Abstract
目的
分析小儿血红蛋白H病(HbH病)血清可溶性转铁蛋白受体(sTfR)水平,探讨其与HbH病贫血程度的关系。
方法
纳入55例HbH病患儿以及30例正常健康儿童(对照组)为研究对象,回顾性分析缺失型、非缺失型HbH病组以及对照组的血液学指标与血清sTfR水平。
结果
55例HbH病中,缺失型39例,非缺失型16例。缺失型与非缺失型HbH组血红蛋白(Hb)、平均红细胞体积(MCV)、平均血红蛋白含量(MCH)均低于对照组(P < 0.05),血清sTfR水平均高于对照组(P < 0.05)。非缺失型HbH病组红细胞(RBC)、Hb水平低于缺失型HbH病组(P < 0.05),而MCV、MCH以及血清sTfR水平高于缺失型HbH病组(P < 0.05)。HbH病患儿血清sTfR水平与RBC、Hb水平呈负相关(r分别为-0.739、-0.667,均P < 0.05);而与MCV、MCH呈正相关(r分别为0.750、0.434,均P < 0.05)。
结论
血清sTfR水平与HbH病患儿贫血程度相关,可能是HbH病治疗的一个靶点。
Keywords: 血红蛋白H病, 可溶性转铁蛋白受体, 贫血, 儿童
Abstract
Objective
To investigate the serum level of soluble transferrin receptor (sTfR) and its association with the degree of anemia in children with hemoglobin H (HbH) disease.
Methods
A total of 55 children with HbH disease were enrolled as the HbH group, and 30 healthy children were enrolled as the control group. The HbH group was further divided into a deletional HbH disease group and a non-deletional HbH disease group. A retrospective analysis was performed for hematological parameters and serum sTfR level in all groups.
Results
Of the 55 children with HbH disease, 39 had deletional HbH disease and 16 had non-deletional HbH disease. Compared with the control group, the deletional and non-deletional HbH disease groups had significantly lower hemoglobin (Hb), mean corpuscular volume (MCV), and mean corpuscular hemoglobin (MCH) and a significantly higher serum level of sTfR. Compared with the deletional HbH disease group, the non-deletional HbH disease group had significantly lower red blood cell count (RBC) and Hb level and significantly higher MCV, MCH, and serum sTfR level. In children with HbH disease, serum sTfR level was negatively correlated with RBC and Hb level (r=-0.739 and -0.667 respectively, P < 0.05) and positively correlated with MCV and MCH (r=0.750 and 0.434 respectively, P < 0.05).
Conclusions
Serum sTfR level is associated the degree of anemia in children with HbH disease, and sTfR may be a target for the treatment of HbH disease.
Keywords: Hemoglobin H disease, Soluble transferrin receptor, Anemia, Child
α地中海贫血(简称“地贫”)是由于α珠蛋白基因突变或缺失导致α珠蛋白合成障碍的一种单基因遗传病,临床上分为静止型、轻型、中间型、重型(Hb Bart's胎儿水肿综合征)四类。中间型α地贫即血红蛋白H病(hemoglobin H disease, HbH病),是由于患者外周血血红蛋白电泳中检测出血红蛋白H带而得名[1],临床表现具有异质性[2],其临床异质性除了与不同类型有关外,有报道认为还可能与一些蛋白表达有关[3]。可溶性转铁蛋白受体(soluble transferrin receptor, sTfR)主要用于缺铁性贫血的检测,近些年来,对sTfR在地贫中的研究逐渐增多[4-6]。Li等[6]研究表明,转铁蛋白受体(TfR)-1表达减少能改善β地贫小鼠的无效造血,逆转铁超载。sTfR在HbH病中的作用机制未见报道。本研究针对sTfR在不同类型HbH病中的水平以及与血液学指标关系的分析,为将来HbH病的机制研究及临床治疗奠定基础,现报告如下。
1. 资料与方法
1.1. 研究对象
回顾性纳入2016年12月至2018年12月我院确诊为HbH病的55例患儿,其中男32例,女23例,相互间无亲缘关系。年龄3个月至14岁,平均年龄3.0岁。选取同一时间段来我院体检的正常健康儿童30例作为对照组,其中男18例,女12例。排除合并β地贫、缺铁性贫血及其他血液性疾病以及3个月内输过血的患儿。本研究经我院医学伦理学委员会批准,批准号为“深儿医伦审[文章] 2019(013)号”。研究对象的监护人知情同意。
1.2. 主要的仪器与试剂
主要的仪器包括:XS-800i全自动五分类血球计数仪(日本Sysmex公司)、DXI800全自动生化分析仪(美国贝克曼公司)、PCR扩增仪和凝胶成像系统(德国耶拿分析仪器股份公司)、电泳仪(美国Bio-Rad公司)、5430小型台式高速离心机(德国Eppendorf公司)、YN-H16恒温杂交仪(深圳亚能公司);主要试剂为全血DNA快速提取试剂盒和珠蛋白生成障碍性贫血基因检测试剂盒(深圳亚能公司)。
1.3. 血液学分析
采用全自动五分类血球计数仪对红细胞(RBC)、血红蛋白(Hb)、平均红细胞体积(MCV)、平均血红蛋白含量(MCH)进行检测。
1.4. 血清sTfR检测
采用全自动生化分析仪,运用化学发光法检测血清sTfR。
1.5. 基因检测
取200 μL EDTA-K2抗凝血标本,按照全血DNA快速提取法及试剂盒说明书操作流程提取基因组DNA。采用Gap-PCR检测缺失型α-地贫,RDB-PCR检测α非缺失型点突变,将疑似HbH病、常规试剂盒未检出的样本送至深圳亚能公司进行基因测序检测。
1.6. 统计学分析
运用SPSS 16.0统计软件对数据进行统计学分析。计量资料以均值±标准差(x±s)表示。三组比较采用单因素方差分析,组间两两比较采用SNK检验。sTfR与血液学数据的相关性分析采用Pearson相关分析法。P < 0.05为差异有统计学意义。
2. 结果
2.1. 地贫基因检测结果
55例HbH病中,缺失型39例,非缺失型16例。缺失型HbH病中以--SEA/-α3.7为主,非缺失型HbH病中以--SEA/αCSα为主,见表 1。
1.
55例HbH病患儿的基因型分布
| 基因型 | n(%) |
| 缺失型 | |
| --SEA/-α3.7 | 25(45) |
| --SEA/-α4.2 | 13(24) |
| --THAI/-α3.7 | 1(2) |
| 非缺失型 | |
| --SEA/αCSα | 11(20) |
| --SEA/αQSα | 1(2) |
| --SEA/αWSα | 1(2) |
| --SEA/αcd30α | 1(2) |
| --SEA/αcd61α | 1(2) |
| --11.1 Kb/αCSα | 1(2) |
2.2. 缺失型、非缺失型HbH病组、对照组三组的血液学分析
缺失型、非缺失型HbH病及对照组三组RBC、Hb、MCV、MCH及sTfR的比较差异均具有统计学意义(P < 0.01),其中缺失组RBC高于对照组,非缺失型组RBC低于对照组,缺失型和非缺失型HbH病组Hb、MCV、MCH均低于对照组,sTfR均高于对照组。缺失型HbH病RBC、Hb均高于非缺失型HbH病组,而MCV、MCH、sTfR均低于非缺失型HbH病组。见表 2。
2.
缺失型、非缺失型HbH病组、对照组三组的血液学分析 (x±s)
| 组别 | 例数 | RBC (×1012/L) |
Hb (g/L) |
MCV (fl) |
MCH (pg) |
sTfR (nmol/L) |
| 注:非缺失型HbH病组中1例--SEA/αWSα未计入统计。a示与对照组比较,P < 0.05;b示与缺失型HbH病组比较,P < 0.05。 | ||||||
| 对照组 | 30 | 4.7±0.3 | 127±9 | 82±4 | 27.4±1.5 | 19.7±2.9 |
| 缺失型HbH病 | 39 | 5.7±0.6a | 89±8a | 52±4a | 15.8±1.2a | 50.9±10.0a |
| 非缺失型HbH病 | 15 | 3.8±1.0a, b | 68±18a, b | 67±8a, b | 17.5±1.7a, b | 118.2±28.2a, b |
| F值 | 52.2 | 184.3 | 298.1 | 610.1 | 259.8 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
2.3. sTfR与血液学指标的相关性分析
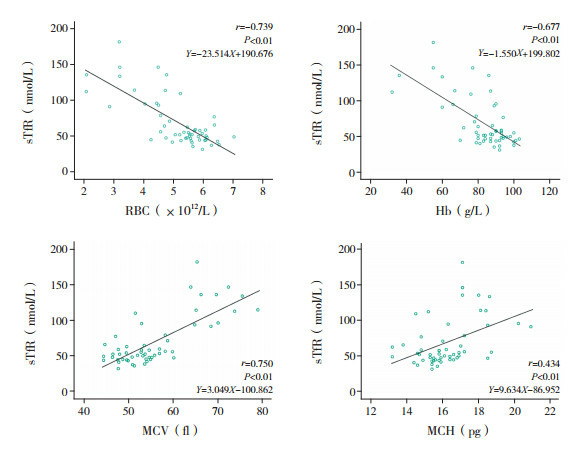
Pearson相关分析显示:HbH病患儿sTfR水平与RBC和Hb水平均呈负相关(分别r=-0.739、-0.667,均P < 0.01),与MCV、MCH均呈正相关(分别r=0.750、0.434,均P < 0.01),见图 1。非缺失型HbH病组中1例--SEA/αWSα未计入统计。
1.
sTfR与相关血液学指标的相关性
sTfR与RBC和Hb水平呈负相关,与MCV、MCH呈正相关。
3. 讨论
α地贫是南方地区最常见的单基因遗传病,其中HbH病是α地贫存活下来的患儿中最严重的一种类型。由于形成HbA(α2β2)的α链生成不足,多余的β链形成HbH(β4),沉积在红细胞膜上造成溶血。HbH病主要分为两种类型:缺失型和非缺失型,还有严重突变的纯合子或双重杂合子也属于HbH病,但是非常少见[7]。在本研究中,缺失型HbH病多于非缺失型HbH病,以--SEA/-α3.7为主,这与广东地区[8]以及本实验室[9]既往报道结果一致。--SEA/αWSα虽然属于非缺失型HbH病,但是它不同于--SEA/αCSα和--SEA/αQSα,血液学指标和血清sTfR都接近正常,所以本研究未将--SEA/αWSα患儿纳入统计分析中。本研究血液学分析显示,非缺失型HbH病的贫血程度比缺失型HbH病严重,这与陈素琴等[10]报道一致。HbH病的异质性除了类型不同外,可能还有一些未知的调控机制。
sTfR是细胞膜TfR经蛋白水解酶作用生成的片段,在血清中能进行检测[11],其含量较少受炎症、慢性疾病等影响,其水平与细胞TfR呈平行关系,因此血清sTfR水平可间接反映总TfR水平。sTfR是铁转运过程中必不可少的膜蛋白,在铁缺乏的情况下,sTfR上调[12]。近年来,国内外有报道表明溶血性贫血患者sTfR水平也增高[13],其机制可能与红细胞无效造血和骨髓增生有关。Li等[6]的研究发现,β地贫红细胞前体过表达TfR1,TfR1表达减少能够降低无效造血,导致持续性铁抑制性红细胞生成,防止全身性铁过载,而外源性的脱铁转铁蛋白可以减少TfR1的表达,为β地贫的治疗提供了一个方向。TfR1在HbH病中的作用机制以及外源性的脱铁转铁蛋白是否可以减少HbH病TfR1的表达,将是我们以后研究的重点。
张力等[5]研究发现,广东地区不同类型地贫患儿sTfR水平升高程度不同,其与临床表现严重程度一致。同时,他们还观察到HbCS-HbH病患儿的贫血程度比缺失型HbH病患儿更严重,其sTfR水平也高于缺失型HbH病患儿。姚红霞等[14]报道也表明HbH病患者sTfR平均水平明显高于正常组。本研究中,不管是缺失型HbH病还是非缺失型HbH病,sTfR水平均高于正常对照组,而非缺失型HbH病组升高更为明显。相关性分析显示,sTfR水平与RBC和Hb呈负相关,也就是说非缺失型HbH病患儿贫血程度比缺失型更严重,sTfR水平更高。
本研究病例类型上更加多样,而且将HbH病分组比较,进一步完善了sTfR在HbH病中的水平分析,提示sTfR可能在HbH病的发病机制中起到了一定的作用,为以后进一步更加深入的机制研究和临床治疗奠定了基础。
Biography
任振敏, 女, 硕士研究生
Funding Statement
深圳市卫生计生系统科研项目(SZFZ2017051)
References
- 1.Farashi S, Najmabadi H. Diagnostic pitfalls of less well recognized HbH disease. Blood Cells Mol Dis. 2015;55(4):387–395. doi: 10.1016/j.bcmd.2015.08.003. [DOI] [PubMed] [Google Scholar]
- 2.Lal A, Goldrich ML, Haines DA, et al. Heterogeneity of hemoglobin H disease in childhood. N Engl J Med. 2011;364(8):710–718. doi: 10.1056/NEJMoa1010174. [DOI] [PubMed] [Google Scholar]
- 3.Surapolchai P, Chuansumrit A, Sirachainan N, et al. A molecular study on the role of alpha-hemoglobin-stabilizing protein in hemoglobin H disease. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=1df458e9efc2cf9153f815d65b57485a. Ann Hematol. 2017;96(3):1005–1014. doi: 10.1007/s00277-017-2978-x. [DOI] [PubMed] [Google Scholar]
- 4.黄 钰君, 伍 绍国, 区 小冰. 不同类型地中海贫血的血清可溶性转铁蛋白受体水平研究. 临床血液学杂志. 2010;23(3):289–292. doi: 10.3969/j.issn.1004-2806.2010.03.011. [DOI] [Google Scholar]
- 5.张 力, 高 秀蓉, 颜 慕霞, et al. 广东地区地中海贫血患儿血清可溶性转铁蛋白受体水平的研究. http://d.old.wanfangdata.com.cn/Periodical/zgsyzdx201506033 中国实验诊断学. 2015;19(6):969–971. [Google Scholar]
- 6.Li H, Choesang T, Bao W, et al. Decreasing TfR1 expression reverses anemia and hepcidin suppression in β-thalassemic mice. Blood. 2017;129(11):1514–1526. doi: 10.1182/blood-2016-09-742387. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zhou JY, Yan JM, Li J, et al. First case of a compound heterozygosity for two nondeletional α-thalassemia mutations, Hb Constant Spring and Hb Quong Sze. Hemoglobin. 2016;40(3):210–212. doi: 10.3109/03630269.2016.1148614. [DOI] [PubMed] [Google Scholar]
- 8.曾 祥兴, 刘 惠敏, 廖 悦余, et al. 广东河源客家人群血红蛋白H病基因型和表现型分析. 国际遗传学杂志. 2017;40(2):79–83. doi: 10.3760/cma.j.issn.1673-4386.2017.02.003. [DOI] [Google Scholar]
- 9.任 振敏, 蔡 德丰, 肖 伟伟, et al. 深圳地区小儿α和β地中海贫血基因类型分析. http://d.old.wanfangdata.com.cn/Periodical/lcjyzz201708012 临床检验杂志. 2017;35(8):605–608. [Google Scholar]
- 10.陈 素琴, 蒋 玮莹, 陈 路明, et al. 中国南方地区血红蛋白H病的基因型与表型的相关性研究. 新医学. 2015;46(5):294–298. doi: 10.3969/g.issn.0253-9802.2015.05.005. [DOI] [Google Scholar]
- 11.Wians FH Jr, Urban JE, Kroft SH, et al. Soluble transferrin receptor (sTfR) concentration quantified using two sTfR kits:analytical and clinical performance characteristics. Clin Chim Acta. 2001;303(1-2):75–81. doi: 10.1016/S0009-8981(00)00376-4. [DOI] [PubMed] [Google Scholar]
- 12.Schranzhofer M, Schifrer M, Cabrera JA, et al. Remodeling the regulation of iron metabolism during erythroid differentiation to ensure efficient heme biosynthesis. Blood. 2006;107(10):4159–4167. doi: 10.1182/blood-2005-05-1809. [DOI] [PubMed] [Google Scholar]
- 13.刘 冯, 莫 东华, 刘 智屏, et al. 可溶性转铁蛋白受体在急性溶血性贫血诊断中的意义. 中国全科医学. 2010;13(14):1528–1530. doi: 10.3969/j.issn.1007-9572.2010.14.012. [DOI] [Google Scholar]
- 14.姚 红霞, 陈 志斌, 丁 毅鹏. 黎族地中海贫血患者血清促红细胞生成素和转铁蛋白受体水平的研究. 中国实验血液学杂志. 2002;10(5):483–484. doi: 10.3969/j.issn.1009-2137.2002.05.025. [DOI] [PubMed] [Google Scholar]


