Abstract
目的
探讨血管活性肠肽(VIP)对哮喘小鼠气道炎症的影响,以及对Th17细胞/调节性T细胞(Treg)失衡的调控作用。
方法
将30只BALB/c小鼠随机分成对照组、哮喘组、VIP组,每组10只。利用卵白蛋白(OVA)致敏和激发制作急性哮喘小鼠模型;对照组致敏和激发阶段均以生理盐水代替OVA;VIP组每次OVA激发前,先以VIP溶液(20 μg/mL)雾化吸入30 min。留取各组小鼠支气管肺泡灌洗液、肺组织等标本。利用苏木精-伊红染色观察肺组织病理变化;ELISA法检测肺泡灌洗液中Th17/Treg相关细胞因子水平;免疫组化及Real-time PCR检测肺组织中Th17细胞特异性转录因子RORγt及Treg特异性转录因子Foxp3表达情况。
结果
病理组织学结果显示VIP组小鼠肺组织气道炎症表现较哮喘组减轻。哮喘组小鼠BALF中IL-17浓度高于对照组(P < 0.01),VIP组IL-17浓度较哮喘组降低(P < 0.01),但仍高于对照组(P < 0.01)。哮喘组BALF中IL-10浓度低于对照组(P < 0.01),VIP组IL-10浓度较哮喘组升高(P < 0.01),但仍低于对照组(P < 0.01)。哮喘组小鼠肺组织RORγt mRNA及蛋白表达高于对照组(P < 0.01),Foxp3 mRNA及蛋白表达低于对照组(P < 0.01);VIP组肺组织RORγt mRNA及蛋白表达水平低于哮喘组(P < 0.01),Foxp3 mRNA及蛋白表达水平高于哮喘组(P < 0.05)。
结论
哮喘小鼠存在Th17/Treg免疫失衡,VIP可通过调控Th17/Treg免疫失衡而改善哮喘小鼠气道炎症。
Keywords: 血管活性肠肽, 哮喘, Th17细胞, 调节性T细胞, 小鼠
Abstract
Objective
To investigate the effects of vasoactive intestinal peptide (VIP) on the airway inflammation and its regulatory effect on Th17/Treg imbalance in asthmatic mice.
Methods
A total of 30 BALB/c mice were equally and randomly divided into three groups:control, asthma, and VIP. An acute asthmatic mouse model was established by sensitization and challenge with ovalbumin (OVA). The control group received normal saline instead of OVA. Before the challenge with OVA, the VIP group was administered VIP (20 μg/mL) by aerosol inhalation for 30 minutes. The bronchoalveolar lavage fluid (BALF) and the lung tissue were collected from mice. The pathological changes in the lung tissue were observed by hematoxylin and eosin staining. The levels of Th17/Treg-related cytokines in BALF were measured by enzyme-linked immunosorbent assay. The expression of retinoid-related orphan receptor gamma t (RORγt) and forkhead box P3 (Foxp3) were measured by real-time fluorescence quantitative PCR and immunohistochemistry.
Results
The histopathological results showed that the VIP group had milder symptoms of airway inflammation than the asthma group. The level of IL-17 in BALF in the asthma group was significantly higher than that in the control group and the VIP group (P < 0.01), but the level of IL-17 in the control group was significantly lower than that in the VIP group (P < 0.01). The level of IL-10 in BALF in the asthma group was significantly lower than that in the control group and the VIP group (P < 0.01, but the level of IL-10 in the VIP group was significantly higher than that in the control group (P < 0.01). The asthma group showed significantly higher expression levels of RORγt mRNA and protein in the lung tissue and significantly lower expression levels of Foxp3 mRNA and protein than the control group (P < 0.01). The VIP group had significantly lower expression levels of RORγt mRNA and protein in the lung tissue and significantly higher expression levels of Foxp3 mRNA and protein than the asthma group (P < 0.05).
Conclusions
The Th17/Treg imbalance may be closely related to the airway inflammation in asthmatic mice. VIP can improve airway inflammation by regulating the Th17/Treg imbalance in asthmatic mice.
Keywords: Vasoactive intestinal peptide, Asthma, Th17 cell, Regulatory T cell, Mice
支气管哮喘(简称哮喘)是一种以慢性气道炎症为特征的异质性疾病[1],其发病机制复杂,迄今为止尚未完全清楚。既往认为Th1/Th2平衡对于哮喘的发生发展具有重要的作用,然而,近些年来研究发现,支气管哮喘的某些临床和实验现象与上述失衡学说不相符合,故并不能简单用Th1/Th2失衡学说来解释。Th17细胞和调节性T细胞(Treg),以及其代表性细胞因子IL-17、IL-10等与哮喘发病存在复杂的相关关系,二者在分化上具有相关性,但在功能上相互拮抗,从而使机体处于一种精细而复杂的相对稳定状态。因此提出了Th17/Treg免疫失衡也是哮喘发病的重要机制之一[2-3]。
非肾上腺素能非胆碱能抑制性神经递质有一氧化氮和血管活性肠肽(vasoactive intestinal peptide, VIP)等,可介导抗炎、扩张支气管及免疫抑制等作用。在呼吸系统中,VIP可舒张肺血管,对抗其他炎症介质所致的气道痉挛,起到扩张支气管的作用[4];在免疫系统中,VIP能够调节免疫系统来发挥内源性的调节作用,即能抑制抗原提呈细胞的促进炎症反应,调节Th1/Th2免疫平衡状态,并促进Treg的分化,抑制Th17细胞功能,在炎症动物模型如胶原诱导的关节炎和自身免疫性脑脊髓炎中都起到明显作用[5-6]。在此基础上,本研究拟在复制急性哮喘小鼠模型,验证Th17细胞/Treg失衡与哮喘气道炎症的关系,并探讨VIP在哮喘气道炎症中的防治前景。
1. 材料与方法
1.1. 实验动物
3~5周龄SPF级BALB/c雄性小鼠30只,体重14~18 g,购于上海斯莱克实验动物有限责任公司,饲养于温州医科大学SPF级实验动物中心。
1.2. 主要实验试剂及仪器
鸡卵白蛋白(OVA,美国Sigma公司),VIP(美国Sigma公司),小鼠IL-17、IL-10 ELISA试剂盒(美国R & D公司),TRIzol(美国Invitrogen公司),RT-PCR逆转录试剂盒(加拿大Fementas公司),SYBR Premix Ex TaqTMⅡ(Perfect Real-Time)定量试剂盒(日本TaKaRa公司),PCR特异性引物由上海基康生物技术有限公司合成,兔抗鼠维甲酸相关孤独核受体γt(retinoid-related orphan receptor gamma t, RORγt)和叉状头/翅膀状螺旋转录因子3(forkhead/winged helix transcription factor, Foxp3)抗体(英国Abcam公司)。Roche Light Cycler 480实时定量PCR仪(瑞士罗氏集团),LKB-2088型超薄切片机(瑞士LKB公司)。
1.3. 动物模型的建立
将30只雄性BALB/c小鼠随机分成对照组、哮喘组、VIP组,每组10只。模型制作参照文献[7-8]方法并稍作改进,具体如下:(1)致敏阶段:哮喘模型于实验开始的第1天和第13天腹腔注射0.1 mL含0.01%OVA的Al(OH)3凝胶致敏,各1次,共2次。(2)激发阶段:于实验第25天开始每天将小鼠置密闭容器中雾化吸入1%OVA生理盐水溶液激发,每次雾化吸入时间约30 min,连续激发8 d。对照组致敏和激发阶段均以生理盐水代替OVA;VIP组每次OVA激发前,先以VIP溶液(20 μg/mL)雾化吸入30 min。
1.4. 标本收集
末次激发后24 h内,取左肺中下肺段组织,固定、脱水、包埋、切片;另一部分肺组织分装后迅速置于液氮中,-80℃保存待检。取PBS缓冲液1 mL分3次缓慢冲洗右肺,收集支气管肺泡灌洗液(BALF),3 000 r/min离心15 min,取上清液,于-80℃冰箱保存待检。
1.5. 病理组织学检查
取肺组织切片行苏木精-伊红染色,光镜下观察小鼠支气管黏膜下和周围肺组织炎性细胞浸润。
1.6. ELISA检测BALF中IL-17、IL-10浓度
实验过程参照试剂盒说明书测定BALF中IL-17、IL-10的水平,用酶标仪在450 nm处测吸光度(OD)值,根据样品的OD值确定其浓度。
1.7. Real-time PCR检测肺组织ROR-γt、Foxp3 mRNA的表达
肺组织用TRIzol试剂提取总RNA,按照逆转录试剂盒说明书操作步骤逆转录为cDNA,之后进行内参β-actin、ROR-γt、Foxp3产物扩增。引物序列:β-actin:正义链5'-GGAGATTACTGCCCTGGCTCCTA-3',反义链5'-GTCGTTCGTCCTCATGCTACTCAG-3';ROR-γt:正义链5'-GAACTTGGGGAACCAGAACAG-3',反义链5'-CTTGGCAAACTCCACCACATA-3';Foxp3:正义链5'-AGTTCCTTCCCAGAGTTCTTCCA-3',反义链5'-GCTCAGGTTGTGGCGGATG-3'。PCR反应体系总体积20 μL,包括SYBR Premix Ex TaqTM(2×)10.0 μL,PCR上游引物(10 μM)0.4 μL,PCR下游引物(10 μM)0.4 μL,cDNA模板2.0 μL,dH2O 7.2 μL。PCR反应条件:95℃预变性30 s;95℃变性10 s,60℃退火20 s,40个循环;溶解曲线95℃ 1 s,40℃ 1 s,70℃ 1 s。应用SYBR GreenⅠ法进行Real-Time PCR反应,每个样本重复3次,反应完成后确认扩增和融解曲线,结果以2-△△Ct法对mRNA水平进行相对定量,其中△△Ct=Ct(样品)-Ct(基准)。
1.8. 免疫组化SP法检测肺组织中ROR-γt、Foxp3蛋白的表达
一抗工作浓度均为1 : 100,按试剂盒说明书操作,光镜下观察,阳性表达结果为细胞胞核或胞浆内出现棕黄色颗粒。每只小鼠肺组织标本随机选取10张切片,每张切片随机选择5个高倍镜视野(×400),应用Image-Pro Plus图像分析软件测定阳性部位的平均吸光度(MOD)值,用以代表阳性部位的蛋白表达水平。
1.9. 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验;两变量的相关比较采用Pearson相关分析法;P < 0.05为差异有统计学意义。
2. 结果
2.1. 各组小鼠急性哮喘发作特点比较
哮喘小鼠经致敏后在雾化激发阶段,表现出兴奋时烦躁不安和安静时少动,弓背,前肢抬起,头面部痉挛,伴呼吸加深加快,反应低下等哮喘急性期表现。对照组无上述表现,VIP组亦出现上述症状,但程度较哮喘组轻。
2.2. 各组小鼠肺组织病理学变化
对照组小鼠肺组织结构完整,支气管、肺泡形态规则,黏膜上皮完整,支气管腔内分泌物少或未见,支气管、肺泡膈及血管周围未见炎性细胞浸润。哮喘组小鼠支气管、肺泡内及血管周围出现较多炎性细胞浸润,黏液腺增生,气道上皮断裂,肺间质和支气管腔内可见炎性细胞渗出和分泌物,部分有黏液栓形成等。VIP组肺组织炎性细胞浸润等病理改变较哮喘组减轻,但未完全消失。见图 1。
1.
各组小鼠的肺组织病理切片
(苏木精-伊红染色,×100)对照组未见气道炎症改变;哮喘组支气管、肺泡内及血管周围出现较多炎性细胞浸润;VIP组炎症改变较哮喘组轻。

2.3. 各组小鼠BALF中IL-17、IL-10浓度的变化
哮喘组小鼠BALF中IL-17浓度高于对照组(P < 0.01),VIP组IL-17浓度较哮喘组降低,(P < 0.01),但仍高于对照组(P < 0.01)。哮喘组BALF中IL-10浓度低于对照组(P < 0.01),VIP组IL-10浓度较哮喘组升高(P < 0.01),但仍低于对照组(P < 0.01)。见表 1。
1.
各组小鼠BALF中IL-17、IL-10水平比较 (x±s,pg/mL)
 |
2.4. 小鼠肺组织中转录因子RORγt和Foxp3 mRNA的变化
哮喘组小鼠肺组织中RORγt mRNA表达较对照组显著增强(P < 0.01);VIP组小鼠肺组织中RORγt mRNA的表达低于哮喘组(P < 0.01),且与对照组比较差异无统计学意义(P > 0.05)。哮喘组小鼠肺组织中Foxp3 mRNA表达显著低于对照组(P < 0.01),VIP组小鼠肺组织Foxp3 mRNA表达较哮喘组升高(P < 0.01),且与对照组比较差异无统计学意义(P > 0.05)。见表 2。
2.
各组小鼠肺组织中RORγt、Foxp3 mRNA的表达比较 (x±s)
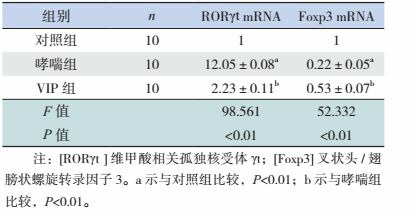 |
2.5. 小鼠肺组织中转录因子RORγt和Foxp3蛋白表达情况
Th17特异性转录因子RORγt表达于细胞胞浆和细胞核内,Treg特异性转录因子Foxp3表达于细胞核内,主要位于肺组织的淋巴细胞、气道周围和肺间质的炎性细胞内。见图 2~3。
2.
各组小鼠肺组织RORγt蛋白表达情况
(免疫组化染色,×200)对照组支气管上皮细胞RORγt蛋白少量表达;哮喘组支气管上皮细胞及周围炎性细胞有大量RORγt蛋白表达;VIP组支气管上皮细胞及周围炎性细胞RORγt蛋白表达较哮喘组明显减少。箭头所示为RORγt蛋白阳性表达。

3.
各组小鼠肺组织Foxp3蛋白表达情况
(免疫组化染色,×200)对照组支气管上皮细胞Foxp3蛋白正常表达;哮喘组支气管上皮细胞及周围炎性细胞Foxp3蛋白表达较对照组减少;VIP组支气管上皮细胞及周围炎性细胞Foxp3蛋白表达较哮喘组明显增加。箭头所示为Foxp3蛋白阳性表达。

哮喘组小鼠肺组织中RORγt蛋白呈强阳性表达,与对照组相比差异有统计学意义(P < 0.01);VIP组RORγt蛋白较哮喘组表达降低,但仍高于对照组(P < 0.01)。哮喘组转录因子Foxp3蛋白表达较对照组降低(P < 0.01);VIP组Foxp3蛋白表达较哮喘组升高,但仍低于对照组(P < 0.05)。见表 3。
3.
各组小鼠肺组织中RORγt、Foxp3蛋白表达比较 (x±s)
 |
2.6. 相关性分析
小鼠肺组织中RORγt/Foxp3蛋白比值与Th17细胞分泌特异性细胞因子IL-17浓度呈正相关(r=0.823,P < 0.01)(图 4);与Treg分泌特异性细胞因子IL-10呈负相关(r=-0.714,P < 0.01)(图 5)。
4.

小鼠肺组织中RORγt/Foxp3蛋白比值与BALF中IL-17浓度相关性分析
5.

小鼠肺组织中RORγt/ Foxp3蛋白比值与BALF中IL-10浓度相关性分析
3. 讨论
哮喘的具体发病机制及病因较为复杂,传统理论认为机体内Th2细胞应答增强为主的Th1/Th2失衡对于哮喘的发生发展具有重要的作用[9]。近年来研究发现哮喘的一些实验和临床病理生理现象并不能归因于经典的Th1/Th2失衡学说。CD4+T淋巴细胞另一亚群—Th17细胞,其分化、成熟受其上游转录因子RORγt基因表达水平的调控[3]。Th17细胞主要以分泌IL-17为特征,参与机体的一系列免疫反应,有研究表明,哮喘动物模型局部气道分泌的IL-17可以促进气道上皮细胞、平滑肌细胞和纤维母细胞的活化,高度表达炎症因子如IL-6、IL-8等,进而促进中性粒细胞趋化和活化,进一步加重气道炎症反应[10-11]。Treg是CD4+T淋巴细胞的重要亚型,分泌抑制性细胞因子如IL-10、TGF-β等多种细胞因子,发挥调节机体的免疫平衡及抗炎等功能。Foxp3是促进Treg分化成熟的上游转录因子,它特异性表达在Treg中,其表达水平在一定程度上可以反映出Treg的数量和功能活性[3]。
本研究发现,哮喘组较对照组肺组织RORγt mRNA表达水平明显升高,伴随着Th17特异性细胞因子IL-17表达增高;而Foxp3 mRNA表达降低,伴随Treg相关因子IL-10的表达下降;且RORγt/Foxp3蛋白比值增高,提示哮喘发生的可能机制与Th17/Treg免疫失衡有关。
VIP是具有生物活性的小分子神经肽,是肺内非肾上腺素能非胆碱能抑制性神经递质,是目前发现最强的内源性支气管扩张剂。有研究结果显示急性哮喘发作或者持续加重时,利用ELISA测定BALF及肺组织中VIP含量显著降低[6]。Szema等[12]报道,VIP基因敲除小鼠吸入胆碱能药物后出现气道高反应性,气道周围及BALF中炎性细胞及炎性因子的浸润增加,通过额外给予VIP的干预能够逆转上述反应。最近越来越多的研究表明VIP还能通过改变Th17细胞和Treg的数量及功能参与免疫调节反应。动物实验证实,在胶原诱发性关节炎和非肥胖糖尿病小鼠模型中,VIP通过改变Th17细胞/Treg的数量及功能起到抗炎及免疫调节作用[5, 13]。最近,日本学者通过VIP衍生物干预OVA致敏哮喘小鼠,结果显示干预组BALF、血清及肺组织炎性细胞浸润明显减少[14]。VIP作为重要的神经递质和内分泌免疫调节肽,具有广泛的生物学功能,被认为是治疗自身免疫疾病和炎症性疾病最具前景的生物制剂之一,因此利用VIP及其衍生物在防治哮喘方面显示出了很大的潜能,另外VIP能否有利于急性哮喘小鼠炎症细胞的局限?是否能逆转哮喘模型的Th17细胞/Treg平衡?目前国内外尚无相关研究报道。本研究通过雾化吸入VIP干预哮喘小鼠,结果显示肺组织气道炎症明显缓解,BALF中Th17细胞因子IL-17较哮喘小鼠明显降低,而Treg细胞因子IL-10水平升高。同时VIP不仅能抑制肺组织RORγt基因的表达,还能提高Foxp3基因表达水平;提示雾化吸入VIP对哮喘小鼠气道炎症具有一定的调节作用,其可能机制是:(1)VIP具有直接扩张哮喘小鼠气道作用;(2)VIP与肺内受体结合,改善小鼠肺内转录因子RORγt和Foxp3基因的表达,逆转初始T细胞向Th17细胞分化,使得Th17细胞分泌炎症因子IL-17减少,Treg分泌特异的抗炎细胞因子IL-10增多,维持哮喘小鼠体内Th17/Treg免疫平衡状态。
综上所述,本研究结果显示Th17/Treg免疫平衡参与哮喘气道炎症损伤过程,其作用机理可能是与特异转录因子RORγt、Foxp3失衡表达有关。另外,急性哮喘小鼠经雾化吸入VIP可通过逆转特异性转录因子RORγt/Foxp3的失衡表达,有效影响Th17/Treg免疫失衡,这可能是VIP改善哮喘小鼠气道炎症的作用机理之一。
Biography
柯莉芹, 女, 硕士, 住院医师
References
- 1.Horak F, Doberer D, Eber E, et al. Diagnosis and management of asthma-Statement on the 2015 GINA Guidelines. Wien Klin Wochenschr. 2016;128(15-16):541–554. doi: 10.1007/s00508-016-1019-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Zhao J, Lloyd CM, Noble A. Th17 responses in chronic allergic airway inflammation abrogate regulatory T-cell-mediated tolerance and contribute to airway remodeling. Mucosal Immunol. 2013;6(2):335–346. doi: 10.1038/mi.2012.76. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Jiang H, Wu X, Zhu H, et al. FOXP3(+)Treg/Th17 cell imbalance in lung tissues of mice with asthma. https://www.researchgate.net/publication/278042048_FOXP3TregTh17_cell_imbalance_in_lung_tissues_of_mice_with_asthma. Int J Clin Exp Med. 2015;8(3):4158–4163. [PMC free article] [PubMed] [Google Scholar]
- 4.Groneberg DA, Springer J, Fischer A. Vasoactive intestinal polypeptide as mediator of asthma. Pulm Pharmacol Ther. 2001;14(5):391–401. doi: 10.1006/pupt.2001.0306. [DOI] [PubMed] [Google Scholar]
- 5.Jimeno R, Gomariz RP, Gutiérrez-Cañas I, et al. New insights into the role of VIP on the ratio of T-cell subsets during the development of autoimmune diabetes. Immunol Cell Biol. 2010;88(7):734–745. doi: 10.1038/icb.2010.29. [DOI] [PubMed] [Google Scholar]
- 6.Olopade CO, Yu J, Abubaker J, et al. Catalytic hydrolysis of VIP in pregnant women with asthma. J Asthma. 2006;43(6):429–432. doi: 10.1080/02770900600710730. [DOI] [PubMed] [Google Scholar]
- 7.聂 颖, 杨 邦坤, 盛 安群, et al. PI3K和Notch信号通路对哮喘小鼠CD4+T淋巴细胞活化及增殖的协同调控作用. 中华医学杂志. 2013;93(44):3532–3536. doi: 10.3760/cma.j.issn.0376-2491.2013.44.012. [DOI] [PubMed] [Google Scholar]
- 8.Lee MY, Seo CS, Lee NH, et al. Anti-asthmatic effect of schizandrin on OVA-induced airway inflammation in a murine asthma model. Int Immunopharmacol. 2010;10(11):1374–1379. doi: 10.1016/j.intimp.2010.07.014. [DOI] [PubMed] [Google Scholar]
- 9.Noval Rivas M, Chatila TA. Regulatory T cells in allergic diseases. J Allergy Clin Immunol. 2016;138(3):639–652. doi: 10.1016/j.jaci.2016.06.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Deng Y, Chen W, Zang N, et al. The antiasthma effect of neonatal BCG vaccination does not depend on the Th17/Th1 but IL-17/IFN-γ balance in a BALB/c mouse asthma model. J Clin Immunol. 2011;31(3):419–429. doi: 10.1007/s10875-010-9503-5. [DOI] [PubMed] [Google Scholar]
- 11.Gasch M, Goroll T, Bauer M, et al. Generation of IL-8 and IL-9 producing CD4+ T cells is affected by Th17 polarizing conditions and AHR ligands. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3945483/ Mediators Inflamm. 2014;2014:182549. doi: 10.1155/2014/182549. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Szema AM, Hamidi SA, Lyubsky S, et al. Mice lacking the VIP gene show airway hyperresponsiveness and airway inflammation, partially reversible by VIP. Am J Physiol Lung Cell Mol Physiol. 2006;291(5):L880–L886. doi: 10.1152/ajplung.00499.2005. [DOI] [PubMed] [Google Scholar]
- 13.Deng S, Xi Y, Wang H, et al. Regulatory effect of vasoactive intestinal peptide on the balance of Treg and Th17 in collagen-induced arthritis. Cell Immunol. 2010;265(2):105–110. doi: 10.1016/j.cellimm.2010.07.010. [DOI] [PubMed] [Google Scholar]
- 14.Onoue S, Matsui T, Kuriyama K, et al. Inhalable sustained-release formulation of long-acting vasoactive intestinal peptide derivative alleviates acute airway inflammation. Peptides. 2012;35(2):182–189. doi: 10.1016/j.peptides.2012.03.021. [DOI] [PubMed] [Google Scholar]


