Abstract
目的
探讨血浆miRNA-497在小儿脓毒症心肌损伤中的表达及其临床意义。
方法
纳入148例脓毒症患儿,依据其是否发生心肌损伤分为心肌损伤组(58例)和非心肌损伤组(90例),比较两组血浆miRNA-497、心肌肌钙蛋白I (cTnI)、肌酸激酶同工酶(CK-MB)、N末端B型钠尿肽前体(NT-proBNP)、降钙素原(PCT)、C-反应蛋白(CRP)水平及左室射血分数(LVEF)的变化。绘制受试者工作特征曲线(ROC),评价血浆miRNA-497、cTnI、CK-MB对心肌损伤的诊断价值。应用Pearson相关分析法分析miRNA-497与cTnI、CK-MB、NT-proBNP、PCT、CRP及LVEF的相关性。
结果
心肌损伤组血浆miRNA-497、cTnI、CK-MB、NT-proBNP、PCT及CRP水平均明显高于非心肌损组(P<0.05)。血浆miRNA-497、cTnI、CK-MB及三项联合诊断心肌损伤的曲线下面积(AUC)分别为0.918、0.931、0.775、0.940。miRNA-497的最佳阈值为2.05时,其诊断心肌损伤的敏感度和特异度较好,分别为90.4%和91.2%。相关分析显示,心肌损伤患儿血浆miRNA-497与cTnI的相关性较好(r=0.728,P<0.01)。
结论
血浆miRNA-497对小儿脓毒症心肌损伤的诊断价值与cTnI相当,有望作为早期诊断心肌损伤的潜在标志物。
Keywords: 脓毒症, 心肌损伤, miRNA-497, 敏感度, 特异度, 儿童
Abstract
Objective
To study the expression of plasma miRNA-497 in children with sepsis-induced myocardial injury and its clinical significance.
Methods
A total of 148 children with sepsis were enrolled.According to the presence or absence of myocardial injury, these children were divided into myocardial injury group (n=58) and non-myocardial injury group (n=90).The two groups were compared in terms of the changes in plasma levels of miRNA-497, cardiac troponin I (cTnI), creatine kinase-MB (CK-MB), N-terminal pro-brain natriuretic peptide (NT-proBNP), procalcitonin (PCT), and C-reactive protein (CRP) and left ventricular ejection fraction (LVEF).The receiver operating characteristic (ROC) curve was plotted to evaluate the value of plasma miRNA-497, cTnI, and CK-MB in the diagnosis of myocardial injury.A Pearson correlation analysis was used to determine the correlation of miRNA-497 with cTnI, CK-MB, NT-proBNP, PCT, CRP, and LVEF.
Results
Compared with the non-myocardial injury group, the myocardial injury group had significantly higher plasma levels of miRNA-497, cTnI, CK-MB, NT-proBNP, PCT, and CRP (P<0.05).Plasma miRNA-497, cTnI, and CK-MB when measured alone or in combination had an area under the ROC curve of 0.918, 0.931, 0.775, and 0.940 respectively.At the optimal cut-off value of 2.05, miRNA-497 had a sensitivity of 90.4% and a specificity of 91.2%.The correlation analysis showed that there was a good correlation between plasma miRNA-497 and cTnI in children with myocardial injury (r=0.728, P<0.01).
Conclusions
Plasma miRNA-497 has a similar value as cTnI in the diagnosis of sepsis-induced myocardial injury in children and may be used as a potential marker for early diagnosis of myocardial injury.
Keywords: Sepsis, Myocardial injury, miRNA-497, Sensitivity, Specificity, Child
近年来,小儿脓毒症的发病率及病死率有升高的趋势,其中并发心肌损伤是导致患儿死亡的主要原因之一[1-2]。部分脓毒症患儿早期心肌损伤症状不明显,如何尽早诊断心肌损伤一直是临床医生面临的难题。目前,心肌损伤的主要诊断指标为心肌肌钙蛋白I(cardiac troponin I, cTnI)、肌酸激酶同工酶(creatine kinase isoenzyme, CK-MB)、N末端B型钠尿肽前体(N terminal B type natriuretic peptide precursors, NT-proBNP)和超声心动图结果,但其均存在一定的局限性。因此,寻找一种早期诊断心肌损伤的新型标志物对指导脓毒症患儿的诊疗具有重要意义。微小核糖核酸(microRNA, miRNA)是一类非编码核苷酸的单链小分子RNA,参与细胞的增殖、分化、凋亡等多种生物过程,并与脓毒症的发生和发展密切相关[3]。近年来的研究表明,miRNA-497在心肌梗死患者中异常表达,有望作为心肌梗死的生物学标志物或治疗靶点[4]。本研究通过检测脓毒症患儿血浆miRNA-497、cTnI、CK-MB、NT-proBNP、降钙素原(procalcitonin, PCT)、C-反应蛋白(c-reactive protein, CRP)水平及左室射血分数(left ventricular ejection fraction, LVEF)的变化,分析miRNA-497与脓毒症患儿心肌损伤的相关性,探讨miRNA-497对小儿脓毒症心肌损伤的诊断价值,为脓毒症患儿心肌损伤的早期诊断及靶向治疗提供依据。
1. 资料与方法
1.1. 研究对象
选取2014年1月至2017年5月海口市妇幼保健院收治的脓毒症患儿148例作为研究对象,其中男96例,女52例,年龄6个月至12岁(平均4.1±1.4岁)。脓毒症的诊断符合2012版脓毒症国际指南诊断标准[5]。下列病例被排除:长期应用激素、免疫抑制剂;原有心脏疾病、血液系统疾病或接受抗凝治疗;伴有严重肝脏、肾脏及恶性肿瘤;病历资料不完整者。
1.2. 病例分组
依据所纳入的脓毒症患儿是否发生心肌损伤分为心肌损伤组(58例)和非心肌损伤组(90例)。心肌损伤组纳入标准为[6]:cTnI水平高于正常(正常值:cTnI<0.15 ng/mL)和/或LVEF<50%。非心肌损伤组纳入标准:cTnI水平和LVEF均正常。
1.3. 标本采集与检测
患儿入院后次日清晨空腹取静脉血5 mL,置于EDTA抗凝管中,3 000 r/min离心5 min分离血浆,向分离的血浆中加入1 mL miRNeasy试剂。按照总miRNA快速提取试剂盒(miRNeasy血浆提取试剂盒)说明书从中提取总miRNA。在ABI 7500型荧光定量PCR仪上进行实时荧光定量聚合酶链反应(RT-PCR)。每个反应体系中荧光信号达到所设定的阈值经历的循环数即为Ct值,以U6为内参照,采用2-△△Ct法计算miRNA-497的相对表达水平,其中△Ct=Ct目的基因-CtU6。使用日立7080系列全自动生化分析仪及SSJ-2-2多功能免疫检测仪进行cTnI、CK-MB、NT-proBNP、PCT及CRP检测。
1.4. 心功能测定
应用荷兰Philips公司的IU22型心脏彩色多普勒超声诊断仪评估LVEF。探头频率2.0~4.0 MHz。参数取自同一心动周期,计算3个心动周期的平均值。操作过程由经验丰富的两位主治医师共同完成。
1.5. 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验。计数资料用例数和百分率(%)表示,组间比较采用卡方检验。两个指标间的相关性评估采用Pearson相关分析。绘制受试者工作特征曲线(ROC),评价各指标对心肌损伤的诊断价值。曲线下面积(area under curve, AUC)的比较采用Z检验。P<0.05为差异有统计学意义。
2. 结果
2.1. 两组临床特征的比较
心肌损伤组的LVEF明显低于非心肌损组,差异有统计学意义(P<0.05)。两组的性别、年龄及感染部位比较差异无统计学意义(P>0.05)。见表 1。
1.
两组临床特征的比较
| 组别 | n | 性别 (男/女, 例) |
年龄 (x±s, 岁) |
感染部位[n(%)] | LVEF (x±s, %) |
|||||
| 肺部感染 | 腹腔感染 | 皮肤软组织感染 | 泌尿系感染 | 颅内感染 | 血源性感染 | |||||
| 注:[LVEF]左室射血分数。 | ||||||||||
| 非心肌损组 | 90 | 56/34 | 4.1±1.4 | 38(42) | 24(27) | 7(8) | 5(6) | 3(3) | 7(8) | 60±11 |
| 心肌损伤组 | 58 | 40/18 | 4.3±1.3 | 28(48) | 18(31) | 3(5) | 1(2) | 6(10) | 8(14) | 46±13 |
| χ2/(t)值 | 0.704 | (0.512) | 0.523 | 0.331 | 0.380 | 1.331 | 3.036 | 1.401 | (8.724) | |
| P值 | 0.402 | 0.541 | 0.470 | 0.565 | 0.538 | 0.249 | 0.081 | 0.237 | < 0.001 | |
2.2. 两组血浆miRNA-497、cTnI、CK-MB、NT-proBNP、PCT及CRP水平的比较
心肌损伤组血浆miRNA-497、cTnI、CK-MB、NT-proBNP、PCT及CRP水平均明显高于非心肌损组,差异有统计学意义(P<0.05),见表 2。
2.
两组血浆miRNA-497、CTnI、CK-MB、NT-proBNP、PCT及CRP水平的比较 (x±s)
| 组别 | n | miRNA-497 | cTnI (ng/mL) |
CK-MB (U/L) |
NT-proBNP (ng/L) |
PCT (μg/L) |
CRP (mg/L) |
| 注:[miRNA-497]微小核糖核酸-497;[cTnI]心肌肌钙蛋白I;[CK-MB]肌酸激酶同工酶;[NT-proBNP] N末端B型钠尿肽前体;[PCT]降钙素原;[CRP] C-反应蛋白。 | |||||||
| 非心肌损组 | 90 | 1.7±0.7 | 0.08±0.02 | 20±9 | 438±85 | 12.2±2.4 | 142±37 |
| 心肌损伤组 | 58 | 4.2±1.1 | 4.15±1.37 | 34±17 | 2 587±119 | 17.8±5.9 | 161±53 |
| t值 | 25.847 | 36.275 | 15.146 | 12.851 | 5.192 | 4.875 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.003 | 0.008 | |
2.3. miRNA-497、cTnI及CK-MB对心肌损伤的诊断价值
miRNA-497、cTnI及CK-MB三项联合诊断心肌损伤的AUC高于CK-MB(Z=4.816,P<0.05),但与miRNA-497和cTnI比较差异无统计学意义(分别Z=1.105、0.912,P>0.05);miRNA-497和cTnI诊断心肌损伤的AUC高于CK-MB(分别Z=4.703、4.519,P<0.05),miRNA-497与cTnI比较差异无统计学意义(Z=0.836,P>0.05)。见表 3。miRNA-497、cTnI及CK-MB的最佳阈值分别取2.05、1.24 ng/mL、25.83 U/L时,其对应的敏感度和特异度为90.4%和91.2%,87.5%和96.8%,61.4%和86.3%,见图 1和表 3。
3.
miRNA-497、cTnI及CK-MB对心肌损伤的诊断价值
| 指标 | 最佳阈值 | AUC(95%CI) | 敏感度 (%) |
特异度 (%) |
阳性预测值 (%) |
阴性预测值 (%) |
阳性似然比 | 阴性似然比 |
| 注:a示与CK-MB比较,P<0.05。[CK-MB]肌酸激酶同工酶;[cTnI]心肌肌钙蛋白I;[miRNA-497]微小核糖核酸-497;[AUC]曲线下面积。 | ||||||||
| CK-MB | 25.83 U/L | 0.775(0.712~0.837) | 61.4 | 86.3 | 89.4 | 58.2 | 4.482 | 0.447 |
| cTnI | 1.24 ng/mL | 0.931(0.872~0.991)a | 87.5 | 96.8 | 93.7 | 90.6 | 27.344 | 0.129 |
| miRNA-497 | 2.05 | 0.918(0.853~0.982)a | 90.4 | 91.2 | 94.5 | 88.0 | 10.273 | 0.105 |
| 三项联合 | - | 0.940(0.875~0.996)a | 97.5 | 88.2 | 92.6 | 93.7 | 8.263 | 0.028 |
1.
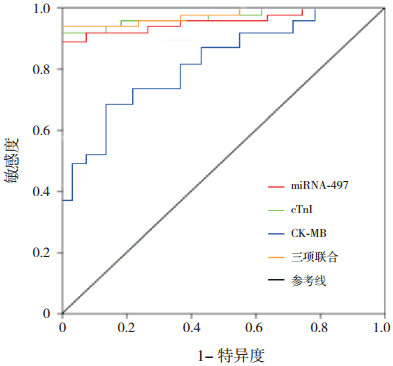
miRNA-497、cTnI及CK-MB诊断心肌损伤的ROC曲线
2.4. miRNA-497与cTnI、CK-MB、NT-proBNP、PCT、CRP及LVEF的相关性
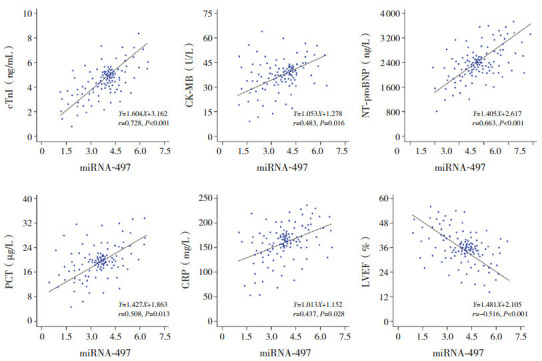
Pearson相关分析显示,脓毒症心肌损伤患儿血浆miRNA-497与cTnI、CK-MB、NT-proBNP、PCT、CRP均呈正相关(分别r=0.728、0.483、0.663、0.508、0.437,均P<0.05),而血浆miRNA-497与LVEF呈负相关(r=-0.516,P<0.01),见图 2。
2.
miRNA-497与cTnI、CK-MB、NT-proBNP、PCT、CRP及LVEF的相关性
[miRNA-497]微小核糖核酸-497;[cTnI]心肌肌钙蛋白I;[CK-MB]肌酸激酶同工酶;[NT-proBNP] N末端B型钠尿肽前体;[PCT]降钙素原;[CRP] C-反应蛋白;[LVEF]左室射血分数。
3. 讨论
miRNA是近年来新发现的一类非编码RNA,具有调控细胞增殖、分化和凋亡等生物学功能。已有研究证实,miRNA参与心肌肥厚、心肌纤维化、心肌梗死、高血压、心律失常等多种心血管疾病的发生发展。Maciejak等[7]研究发现,外周血或血浆中的某些miRNA表达水平在心肌损伤患者中显著升高,有望成为心肌损伤早期诊断的新型标志物。然而,血浆miRNA-497能否作为小儿脓毒症心肌损伤早期诊断的分子标志物,目前尚无定论。本研究显示,心肌损伤组血浆miRNA-497水平明显高于非心肌损组,提示血浆miRNA-497在小儿脓毒症心肌损伤中异常高表达,可能参与心肌损伤的发生发展。Boon等[8]研究表明,miRNA由损伤心肌细胞产生并释放入血,在心肌梗死患者中明显升高,且与心肌损伤程度相关。杨永丽等[9]研究发现,脓毒症合并心肌损伤患者血浆miRNA-499水平显著升高,且和心肌损伤程度呈正相关,可作为脓毒症心肌损伤病情变化的生物学标志物。本研究进一步进行ROC曲线分析,结果显示,血浆miRNA-497诊断小儿脓毒症心肌损伤的效能与cTnI相当,且优于CK-MB。Li等[10]利用6种miRNA(miR-1、miR-134、mi-186、miR-208、miR-223和miR-499)组成一个联合分析系统,发现其对胸痛患者心肌梗死诊断的AUC为0.830(95%CI:0.751~0.910),显著高于肌钙蛋白T [0.768(95%CI:0.672~0.864)]和CK-MB [0.709(95%CI:0.606~0.812)]。D' Alessandra等[11]研究显示,血浆miRNA表达水平在心肌梗死发生后156 min达到峰值,早于传统生物标记物(cTnI和CK-MB),从而提示miRNA的诊断优势可能在心肌损伤后的早期释放。另有研究表明,miRNA鉴别心肌梗死和非心脏疾病的敏感度和特异度明显高于cTnI,推测miRNA可能成为将来诊断心肌损伤程度及预后的重要临床标记物[12]。由此可见,血浆miRNA-497在小儿脓毒症患儿合并心肌损伤的早期诊断中具有较好的应用前景。
cTnI被认为是心肌梗死诊断的金指标,在多种非心脏性疾病中亦可升高,联合CK-MB和NT-proBNP等指标可提高诊断心肌损伤的特异度和灵敏度[13]。PCT及CRP在严重感染及全身炎症反应患者中显著升高,是反映脓毒症患者病情严重程度的可靠指标[14]。LVEF水平可反映左心室功能,其数值与左心功能呈正相关。本研究显示,心肌损伤组cTnI、CK-MB、NT-proBNP、PCT及CRP均升高,LVEF值下降。相关分析显示,心肌损伤患儿血浆miRNA-497与cTnI的相关性最好(r=0.728,P<0.01)。由此,我们推测血浆miRNA-497联合cTnI检测有望提高心肌损伤诊断的准确性。Yang等[15]研究发现,血浆miRNA-1、miRNA-208a及miRNA-499可作为诊断心肌损伤的生物学标志物,能够提供cTnI以外的诊断信息,与cTnI联合应用有助于提高心肌损伤的诊断准确性。另有研究表明,miRNA和心肌损伤其他标志物联合应用检测,其诊断脓毒症患儿合并心肌损伤的价值会更高[16]。
综上所述,本研究表明,血浆miRNA-497诊断脓毒症患儿合并心肌损伤的敏感度和特异度与cTnI相当,有望作为早期诊断小儿脓毒症心肌损伤的潜在标志物。但本研究为单中心的临床研究,其结果尚需大规模、多中心的临床研究证实,从而进一步完善和丰富脓毒症患儿合并心肌损伤的诊疗评估体系。
Biography
吴忠璟, 男, 本科, 主管检验师
WU Zhong-Jing,Email:A522198993@163.com
Funding Statement
海南省医药卫生科研基金项目(16A50275)
References
- 1.de Souza DC, Shieh HH, Barreira ER, et al. Epidemiology of sepsis in children admitted to PICUs in South America. Pediatr Crit Care Med. 2016;17(8):727–734. doi: 10.1097/PCC.0000000000000847. [DOI] [PubMed] [Google Scholar]
- 2.Jayaprakash N, Gajic O, Frank RD, et al. Elevated modified shock index in early sepsis is associated with myocardial dysfunction and mortality. http://www.sciencedirect.com/science/article/pii/S0883944117305683. J Crit Care. 2017;43:30–35. doi: 10.1016/j.jcrc.2017.08.019. [DOI] [PubMed] [Google Scholar]
- 3.Kingsley SMK, Bhat BV. Role of microRNAs in sepsis. Inflamm Res. 2017;66(7):553–569. doi: 10.1007/s00011-017-1031-9. [DOI] [PubMed] [Google Scholar]
- 4.Li Z, Lu J, Luo Y, et al. High association between human circulating microRNA-497 and acute myocardial infarction. http://circgenetics.ahajournals.org/content/3/6/499. Sci World J. 2014:931845. doi: 10.1155/2014/931845. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.高 戈, 冯 喆, 常 志刚, et al. 2012国际严重脓毒症及脓毒性休克诊疗指南. http://guide.medlive.cn/guidelinesub/959 中华危重病急救医学. 2013;25(8):501–505. [Google Scholar]
- 6.Corsten MF, Dennert R, Jochems S, et al. Circulating MicroRNA-208b and MicroRNA-499 reflect myocardial damage in cardiovascular disease. Circ Cardiovasc Genet. 2010;3(6):499–506. doi: 10.1161/CIRCGENETICS.110.957415. [DOI] [PubMed] [Google Scholar]
- 7.Maciejak A, Kiliszek M, Opolski G, et al. miR-22-5p revealed as a potential biomarker involved in the acute phase of myocardial infarction via profiling of circulating microRNAs. Mol Med Rep. 2016;14(3):2867–2875. doi: 10.3892/mmr.2016.5566. [DOI] [PubMed] [Google Scholar]
- 8.Boon RA, Dimmeler S. MicroRNAs in myocardial infarction. Nat Rev Cardiol. 2015;12(3):135–142. doi: 10.1038/nrcardio.2014.207. [DOI] [PubMed] [Google Scholar]
- 9.杨 永丽, 何 静, 肖 志英. 血浆miR-499在脓毒症合并心肌损伤的诊断价值. http://www.cqvip.com/QK/97432A/201503/663988273.html 中山大学学报(医学科学版) 2015;36(2):279–283. [Google Scholar]
- 10.Li C, Fang Z, Jiang T, et al. Serum microRNAs profile from genome-wide serves as a fingerprint for diagnosis of acute myocardial infarction and angina pectoris. BMC Med Genomics. 2013;6:16. doi: 10.1186/1755-8794-6-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.D'Alessandra Y, Devanna P, Limana F, et al. Circulating microRNAs are new and sensitive biomarkers of myocardial infarction. Eur Heart J. 2010;31(22):2765–2773. doi: 10.1093/eurheartj/ehq167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Deddens JC, Colijn JM, Oerlemans MI, et al. Circulating microRNAs as novel biomarkers for the early diagnosis of acute coronary syndrome. J Cardiovasc Transl Res. 2013;6(6):884–898. doi: 10.1007/s12265-013-9493-9. [DOI] [PubMed] [Google Scholar]
- 13.Fan J, Ma J, Xia N, et al. Clinical value of combined detection of CK-MB, MYO, cTnI and plasma NT-proBNP in diagnosis of acute myocardial infarction. https://www.researchgate.net/publication/314783352_Clinical_value_of_combined_detection_of_CK-MB_MYO_cTnl_and_plasma_NT-proBNP_in_Diagnosis_of_acute_myocardial_infarction. Clin Lab. 2017;63(3):427–433. doi: 10.7754/Clin.Lab.2016.160533. [DOI] [PubMed] [Google Scholar]
- 14.Li HX, Liu ZM, Zhao SJ, et al. Measuring both procalcitonin and C-reactive protein for a diagnosis of sepsis in critically ill patients. J Int Med Res. 2014;42(4):1050–1059. doi: 10.1177/0300060514528483. [DOI] [PubMed] [Google Scholar]
- 15.Yang W, Shao J, Bai X, et al. Expression of plasma microRNA-1/21/208a/499 in myocardial ischemic reperfusion injury. Cardiology. 2015;130(4):237–241. doi: 10.1159/000371792. [DOI] [PubMed] [Google Scholar]
- 16.石 苗茜, 苏 菲菲, 李 俊峡, et al. 小儿脓毒症心肌损伤标志物检测的临床应用价值. http://www.cnki.com.cn/Article/CJFDTotal-EBED201412027.htm 中国急救医学. 2016;36(6):486–490. [Google Scholar]


