Zusammenfassung
Die COVID-19-Pandemie ist ein weltweiter Ausbruch von neu aufgetretenen Infektionen mit dem SARS-CoV-2-Virus, von denen weltweit derzeit mehr als 10.670.000 Menschen erkrankt sind bzw. waren. In Deutschland leiden ca. 450.000 Patienten an einer chronisch entzündlichen Darmerkrankung; diese Patienten benötigen in der Regel eine kontinuierliche und kompetente Betreuung. Vor dem Hintergrund eines rasch zunehmenden Wissenszuwachses haben 68 Experten, die die derzeit gültigen Leitlinien der DGVS zum Morbus Crohn und zur Colitis ulcerosa erstellt haben, im Rahmen einer virtuellen Konferenz aktuelle und praxisnahe Empfehlungen formuliert, um die Versorgung von CED-Patienten zu verbessern. Diese adressieren das Infektionsrisiko einschließlich des Risikos für besondere Gruppen, den möglichen Verlauf der Erkrankung und die Konsequenzen für die medikamentöse und die operative Therapie der Grunderkrankung sowie allgemeine Maßnahmen zur Infektionsprävention und adjuvante Präventions- und Therapiemöglichkeiten.
Herausgeber
Federführende Fachgesellschaft
Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankrankheiten (DGVS) T. Brechmann (Bochum), A. Stallmach (Jena), B. Bokemeyer (Minden), K. Aden (Kiel), T. Andus (Stuttgart), R. Atreya (Erlangen), O. Bachmann (Pforzheim), D. Bettenworth (Münster), I. Blumenstein (Frankfurt am Main), U. Böcker (Berlin), J. Büning (Lübeck), A. Dignaß (Frankfurt), R. Ehehalt (Heidelberg), P. Esters (Frankfurt), K. Fellermann (Freudenstadt), M. Götz (Böblingen), W. Häuser (Saarbrücken), F. Hartmann (Frankfurt), U. Helwig (Oldenburg), K. Herrlinger (Hamburg), J. Hoffmann (Ludwigshafen), K. Kannengießer (Lüneburg), J. Klaus (Ulm), W. Kruis (Freimersdorf/Pulheim), T. Kucharzik (Lüneburg), T. Kühbacher (Nürtingen), J. Langhorst (Bamberg), A. Lügering (Münster), C. Maaser (Lüneburg), H. Matthes (Berlin), G. Moog (Kassel), J. Niess (Basel), C. Ott (Regensburg), A. Pace (Neumünster), J. Preiß (Berlin), M. Reinshagen (Braunschweig), C. Schmidt (Fulda), B. Siegmund (Berlin), E. Stange (Stuttgart), J. Stein (Frankfurt), A. Sturm (Berlin), N. Teich (Leipzig), A. Thomann (Mannheim), C. Treese (Berlin), C. Veltkamp (Heidelberg), J. Walldorf (Halle), S. Zeißig (Dresden)
Repräsentativität der Leitliniengruppe/Beteiligte Fachgesellschaften
DGP (Deutsche Gesellschaft für Pathologie)/BDP (Bundesverband Deutscher Pathologen) F. Autschbach (Heilbronn)
DCCV e. V. (Deutsche Morbus Crohn/Colitis ulcerosa Vereinigung) C. Groß (Berlin), S. In der Smitten (Berlin), B. Kaltz (Berlin), I. Kanbach (Berlin)
DGAV (Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie) A. Kroesen (Köln), S. Fichtner-Feigl (Freiburg), M. Kreis (Berlin), P. Kienle (Mannheim), E. Rijcken (Münster)
DGCH (Deutsche Gesellschaft für Chirurgie) A. Kroesen (Köln), S. Fichtner-Feigl (Freiburg), M. Kreis (Berlin)
DGK (Deutsche e. V. Gesellschaft für Koloproktologie) A. Kroesen (Köln), S. Fichtner-Feigl (Freiburg), M. Kreis (Berlin), P. Kienle (Mannheim), E. Rijcken (Münster)
DGEM (Deutsche Gesellschaft für Ernährungsmedizin) J. Ockenga (Bremen)
DGIM (Deutsche Gesellschaft für Innere Medizin) A. Stallmach (Jena)
KN-CED (Kompetenznetz Darmerkrankungen) B. Bokemeyer (Minden)
DRG (Deutsche Röntgengesellschaft) E. Schnoy (Augsburg), A. Schreyer (Brandenburg an der Havel)
GPGE (Gesellschaft für pädiatrische Gastroenterologie und Ernährung) P. Bufler (Berlin), J. Däbritz (Rostock), J. de Laffolie (Gießen), K. Keller (Wiesbaden), S. Koletzko (München)
FACED (Fachangestellte für chronisch entzündliche Darmerkrankungen) P. Hartmann (Minden), J. Zemke (Minden)
Die Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) wurde bei den Leitlinienaktualisierungen Morbus Crohn und Colitis ulcerosa zur Mitarbeit an den Leitlinien eingeladen, konnte das Leitlinienvorhaben aber aufgrund personeller Engpässe nicht unterstützen. Daher wurde die DEGAM bei dem vorliegenden Addendum nicht beteiligt.
Geltungsbereich und Zweck
Die Infektion mit dem neuen SARS-CoV-2-Virus führt zu einem bisher unbekannten Krankheitsbild, das als COVID-19 ( CO rona VI rus D isease-20 19 ) bezeichnet wird und erstmals in der Region Hubei in China beschrieben wurde. Die Infektion entwickelte sich im Januar in China zur Epidemie, wurde am 30.01.2020 durch die WHO zur internationalen Gesundheitsnotlage und schließlich am 11.03.2020 zur Pandemie erklärt 1 . Am 28.01.2020 wurde über die erste Infektion in Deutschland berichtet. Laut der Risikobewertung des Robert Koch-Instituts (RKI) wurde am 26.05.2020 die Gefahr für die Gesundheit der Bevölkerung in Deutschland immer noch als hoch, für besondere Risikogruppen als sehr hoch eingeschätzt. In Deutschland sind etwa 450 000 Einwohner an einer chronisch entzündlichen Darmerkrankung (CED) erkrankt. Für die meisten Patienten beginnt die Erkrankung während der Schulzeit oder der Berufsausbildung und dauert während des gesamten Lebens an. Neben dem persönlichen Leiden verursacht die Erkrankung beträchtliche Kosten für die Gesellschaft. Für Patienten mit Morbus Crohn bzw. Colitis ulcerosa, die insgesamt zu 33–66 % bzw. 11–29 % mit immunsuppressiv wirkenden Medikamenten einschließlich der Biologika behandelt werden 2 3 , aber auch für die in die Behandlung eingebundenen Personen des Gesundheitssystems stellen sich vor dem Hintergrund der COVID-19-Pandemie viele Fragen.
Zielorientierung der Leitlinie
Vor diesem Hintergrund ist es das Ziel der Leitlinie, Empfehlungen auszusprechen und Handlungskorridore zu beschreiben. Dabei soll diese Leitlinie in der hausärztlichen, internistischen, chirurgischen, pädiatrischen und gastroenterologischen Praxis einfach anwendbar sein. Die Behandlung besonders schwerer oder komplizierter Fälle kann durch diese Leitlinie nicht abgebildet werden. Betrachtet werden in der Leitlinie Patienten jeden Alters mit einer CED.
Versorgungsbereich
Ambulant und stationär: hausärztlich, pädiatrisch, internistisch, chirurgisch und gastroenterologisch.
Anwenderzielgruppe/Adressaten
Die Leitlinie richtet sich an alle an der Diagnostik und Therapie von Patienten mit CED beteiligten Berufsgruppen (Internisten, Allgemein- und Viszeralchirurgen, Gastroenterologen, Pathologen, Fachassistenz CED), zudem Betroffene, Angehörige. Sie dient zur Information für Allgemeinmediziner, Kinder- und Jugendmediziner und Leistungserbringer (Krankenkassen, Rentenversicherungsträger).
Zusammensetzung der Leitliniengruppe/Beteiligung von Interessengruppen/methodisches Vorgehen
Die Leitung des Projekts erfolgte durch vier Hauptkoordinatoren (Axel Dignaß, (Frankfurt), Torsten Kucharzik (Lüneburg), Andreas Stallmach (Jena) und Andreas Sturm (Berlin). Zur Erstellung des Addendums der bestehenden Leitlinie zum Morbus Crohn, die sich gegenwärtig in der Aktualisierungsphase befindet, und zur Colitis ulcerosa 4 wurden universitäre und nichtuniversitäre Ärzte, Klinikärzte und niedergelassene Ärzte aus dem Kreis aller Teilnehmer der beiden Leitlinien eingeladen.
Das Leitlinienaddendum enthält insgesamt 23 Empfehlungen. Tab. 2 listet die 10 Kernaussagen auf. Insgesamt basiert das Leitlinienaddendum auf einem Konsensus einer interdisziplinären Expertengruppe. Vorab wurden die Themengebiete der einzelnen Kapitel für die aktuellen und praxisnahen Empfehlungen in einer virtuellen Konferenz formuliert und anschließend in einer ersten Delphirunde von der Leitliniengruppe abgestimmt und durch Autorenteams bearbeitet. Dazu wurde die den Kernaussagen zugrunde liegende Literatur basierend auf der aktuellen Datenlage nach den Richtlinien des Oxford Centre for Evidence-based Medicine – Levels of Evidence bewertet und daraus eine Empfehlungsstärke abgeleitet. 5 Die Kernaussagen wurden den AWMF-Vorgaben entsprechend mit einer Formulierung gemäß ihrer Empfehlungsstärke versehen. Eine starke Empfehlung entspricht in der Formulierung einem „soll“, eine Empfehlung einem „sollte“ und eine offene Empfehlung einem „kann“. Alle Empfehlungen, bis auf die Empfehlung 3.2, wurden in einer zweiten Delphirunde final von der Leitliniengruppe abgestimmt und konsentiert. Die Empfehlung 3.2 wurde aufgrund der Kommentare erneut überarbeitet, abgestimmt und konsentiert. Die Formulierung der Kernaussagen wurden basierend auf diesem Expertenkonsens bei einer Zustimmung von > 95 % aller 68 Experten als starker Konsens, bei 75–95 % als Konsens, bei > 50–75 % als mehrheitliche Zustimmung und bei < 50 % als kein Konsens gewertet (siehe Tab. 1 ).
Tab. 2. Zentrale Empfehlungen des Addendums (hier die 10 wichtigsten Empfehlungen).
| Nr. | Empfehlung | Zustimmungsgrad |
| 1 | In dieser S2k-Leitlinie besteht insgesamt eine nur schwache Evidenz für die Empfehlungen. Handlungsempfehlungen basieren meist auf persönlichen Erfahrungen und Analogieschlüssen zu anderen Krankheitsbildern. Notwendige Entscheidungen zur Anpassung der Therapie (medikamentös oder operativ) sollten somit immer der aktuellen Datenlage angepasst werden. | starker Konsens (98 %) |
| 1.1 | Patienten mit einer CED haben generell kein erhöhtes Risiko für eine Infektion mit SARS-CoV-2. Dennoch sollten Patienten sorgfältig individuelle Schutzmaßnahmen ergreifen. | starker Konsens (95 %) |
| 1.2 | Patienten mit einer CED und einer immunsuppressiven Therapie haben ein erhöhtes Risiko für eine SARS-CoV-2-Infektion und sollten deshalb sorgfältig individuelle Schutzmaßnahmen umsetzen. Der Grad der Risikoerhöhung scheint dabei für einzelne Immunsuppressiva unterschiedlich zu sein. | Konsens (86 %) |
| 1.3 | Patienten mit einer CED und einer SARS-CoV-2-Infektion haben unter bestimmten Bedingungen (Komorbiditäten/Risikofaktoren) ein erhöhtes Risiko für einen schweren Verlauf der COVID-19-Erkrankung. Diese Patienten sollten sorgfältig bezüglich einer raschen Verschlechterung ihrer Erkrankung überwacht werden. | Konsens (93 %) |
| 2.1 | Während der Pandemie sollten Patientenvorstellungen in Einrichtungen des Gesundheitswesens restriktiv erfolgen. CED-Sprechstunden sollten unter Berücksichtigung der Dringlichkeit der Vorstellung und unter Optimierung der Infektionsschutzmaßnahmen wie räumlicher Distanzierung und nach Ausnutzen von Möglichkeiten der Telemedizin fortgeführt werden. | Konsens (86 %) |
| 2.2 | Während der Pandemie sollten sämtliche endoskopischen Untersuchungen unter besonderen Schutzmaßnahmen stattfinden. Das Ausmaß der Schutzmaßnahmen sollte risikoadaptiert erfolgen. | starker Konsens (98 %) |
| 3.1 | Patienten mit einer CED und einer immunsuppressiven Therapie haben generell kein erhöhtes Risiko für einen schweren Verlauf einer SARS-CoV-2-Infektion. Eine immunsuppressive Therapie sollte deshalb bei einer leichten bis moderaten COVID-19-Erkrankung nicht reduziert werden. Eine Ausnahme bilden die länger dauernde Therapie mit systemischen Steroiden insbesondere in Dosierungen größer 20 mg Prednisonäquivalent/Tag. Diese sollte daher möglichst vermieden oder, soweit klinisch vertretbar, reduziert und beendet werden. | Konsens (84 %) |
| 3.2 | Bei Patienten mit schwerer COVID-19-Erkrankung sollte die Therapie mit Thiopurinen, Methotrexat und Tofacitinib pausiert und nach Überwinden der Infektion wieder aufgenommen werden. | Konsens (94 %) |
| 3.4 | Während der SARS-CoV-2-Pandemie sollte eine Biologikatherapie mit zu erwartendem raschem Wirkeintritt gegenüber einer hochdosierten systemischen Steroidtherapie im akuten Schub bevorzugt eingesetzt werden. | Konsens (85 %) |
| 4.3 | Hospitalisierte Patienten mit einer CED und COVID-19-Erkrankung sollten mindestens eine Thromboseprophylaxe erhalten. Bei ambulanten COVID-19-erkrankten CED-Patienten sollte entsprechend ihres individuellen Risikoprofils und ihrer Begleitmedikation die Entscheidung für eine Thromboseprophylaxe großzügig getroffen werden. | starker Konsens (95 %) |
Tab. 1. Einteilung der Konsensstärke.
| Konsens | %-Zustimmung |
| starker Konsens | > 95 |
| Konsens | > 75–95 |
| mehrheitliche Zustimmung | > 50–75 |
| kein Konsens | < 50 |
Da für das Management von CED-Patienten mit COVID-19 keine randomisierten Studien gemäß der Evidenzlevel 1 oder 2 existieren, besteht insgesamt nur eine schwache Evidenz für alle Empfehlungen. Zu fast allen Themenbereichen stehen nur Beobachtungsstudien mit teils kleinen Fallzahlen und naturgemäß kurzen Beobachtungszeiträumen, Fallberichte, Expertenmeinungen oder Erfahrungen mit verwandten viralen Erregern zur Verfügung. Hinzu kommt, dass eine objektive Bewertung kaum zu erheben ist und wesentlich durch die Erfahrungen der Experten beeinflusst wird. Die bislang zu diesen Fragestellungen vorliegenden, meist epidemiologischen Studien hinsichtlich der untersuchten Patientenkollektive und Zielparameter sind sehr uneinheitlich. Vor diesem Hintergrund ist es den Autoren wichtig zu betonen, dass Handlungsempfehlungen meist auf persönlichen Erfahrungen und Analogieschlüssen zu anderen Krankheitsbildern beruhen. Unter Berücksichtigung der zahlreichen Fragen der behandelnden Ärztinnen und Ärzte, aber auch der Sorgen und Ängste der Patienten, die zu ungünstigen Entscheidungen, wie z. B. dem Absetzen der Medikation führen könnten, erscheint dieses Leitlinienaddendum aber gerade deshalb dringend notwendig.
Repräsentativität der Leitliniengruppe/Beteiligung von Patienten
Die Erstellung des Addendums erfolgte unter direkter Mitarbeit mehrerer Vertreter der Deutschen Morbus Crohn/Colitis ulcerosa Vereinigung (DCCV) e. V.
Externe Begutachtung und Verabschiedung
Verabschiedung durch die Vorstände der herausgebenden Fachgesellschaften/Organisationen
Im Anschluss an den Peer-Review-Prozess wurde die vollständige Leitlinie von den Vorständen aller beteiligten Fachgesellschaften begutachtet und konsentiert.
Darüber hinaus stand die Leitlinie für eine Woche als Konsultationsfassung zur Kommentierung auf der DGVS- und der AWMF-Website zur Verfügung. Alle Änderungsvorschläge wurden gesichtet und ggf. eingearbeitet.
Redaktionelle Unabhängigkeit und Finanzierung der Leitlinie
Die Nutzung der CGS-Plattform wurde durch die DGVS finanziert. Eine finanzielle Beteiligung Dritter erfolgte nicht. Alle Mandatsträger und Experten arbeiteten ausschließlich ehrenamtlich.
Darlegung von und Umgang mit Interessenkonflikten
Im Einklang mit dem AWMF-Regelwerk zum Umgang mit Interessenkonflikten haben vor Beginn der Delphirunde alle Teilnehmer Erklärungen auf dem entsprechenden AWMF-Formular abgegeben. Die Interessenkonflikte wurden von den Koordinatoren der Leitlinie und Frau Lynen gesichtet und der Leitliniengruppe vor Beginn der Delphirunde präsentiert. Die Interessenkonflikte wurden zunächst auf thematischen Bezug zur Leitlinie gesichtet und gemäß den AWMF-Kriterien als keine, gering, moderat oder hoch bezüglich der individuellen Empfehlung kategorisiert. Die Mandatsträger der Leitlinie gaben insgesamt eine Vielzahl von potenziellen Interessenkonflikten an. Nach Einschätzung der Leitliniengruppe stellen die interdisziplinäre Besetzung der Leitliniengruppe (einschließlich stimmberechtigter Patientenvertreter) und die selektive Literaturrecherche und deren Bewertung eine wichtige Maßnahme zum Ausgleich dieser potenziellen Interessenkonflikte dar. Mandatsträger mit personenbezogenen Zuwendungen (Zugehörigkeit zu Advisory Boards, Gutachter- und Vortragstätigkeit) wurden daher nach kritischer Bewertung durch die Leitliniengruppe nicht von den Abstimmungen ausgeschlossen, wenn die Art der Zuwendungen nicht einseitig (z. B. Zugehörigkeit zu mehreren Advisory Boards) und die wissenschaftliche Expertise nicht verzichtbar war. Finanzielle Zuwendungen, die ausschließlich wissenschaftlichen Institutionen zugeordnet werden konnten, führten nicht zu einer Stimmenthaltung (Drittmittel, Studienbeteiligung). Mandatsträger, deren Interessenkonflikte nicht vorlagen, oder Mandatsträger mit Eigentümerinteressen (z. B. Patente, Aktienbesitz, Firmenzugehörigkeit) erhielten kein Stimmrecht. Nach Überprüfung aller Interessenkonflikte wurden keine Mandatsträger ausgeschlossen. Die Interessenkonflikte sind im Anhang veröffentlicht.
Verbreitung und Implementierung
Konzept zur Verbreitung und Implementierung
Das Addendum wird in der Zeitschrift für Gastroenterologie, im AWMF-Leitlinienportal (www.awmf.de) und auf der Homepage der DGVS (www.dgvs.de) veröffentlicht. Eine englische Übersetzung soll zur Verfügung gestellt werden. Für die Information von Laien oder Patienten wird auf die Homepage der Deutschen Morbus Crohn/Colitis ulcerosa Vereinigung – DCCV – e. V. ( https://www.dccv.de/betroffene-angehoerige/leben-mit-einer-ced/infektionskrankheitenimpfen/coronavirus/ ) verwiesen.
Gültigkeitsdauer und Aktualisierungsverfahren
Die Gültigkeit des Addendums orientiert sich an der Gültigkeit der S3-Leitlinie Colitis ulcerosa und wird daher auf 3 Jahre geschätzt. Eine Überarbeitung wird durch den Leitlinienbeauftragten der DGVS initiiert werden. Sollte es zwischenzeitlich wichtige Neuerungen in der Therapie der COVID-19-Erkrankung geben, die eine kurzfristige Aktualisierung notwendig erscheinen lassen, entscheiden die Koordinatoren (A. Stallmach, A. Sturm, T. Kucharzik, A. Dignaß) gemeinsam mit der Leitlinienbeauftragten der DGVS (B. Siegmund) über die Notwendigkeit und die evtl. Inhalte einer Aktualisierung. Diese soll dann online im Leitlinienportal der AWMF und auf der Homepage der DGVS veröffentlicht werden.
Der Informationsstand zur SARS-CoV2-Infektion und zu COVID-19 kann sich rasch ändern; täglich erscheinen dazu neue wissenschaftliche Publikationen. Auch die offiziellen Handlungsempfehlungen des Robert Koch-Instituts (RKI: https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/nCoV_node.html ), der Weltgesundheitsorganisation (WHO: https://www.who.int/emergencies/diseases/novel-coronavirus-2019 ) und der DGVS ( https://www.dgvs.de/COVID-19/ ) werden kontinuierlich überarbeitet und sollten im Bedarfsfall in ihrer aktuellen Fassung im Internet eingesehen werden.
Redaktioneller Hinweis
Geschlechtsneutrale Formulierung
Ausschließlich zum Zweck der besseren Lesbarkeit wird auf die geschlechtsspezifische Schreibweise verzichtet. Alle personenbezogenen Bezeichnungen in diesem Dokument sind somit geschlechtsneutral zu verstehen.
Partizipative Entscheidungsfindung
Alle Empfehlungen der Leitlinie sollten im Sinne einer partizipativen Entscheidungsfindung von Arzt und Patient und ggf. den Angehörigen bewertet und ggf. umgesetzt werden.
Einleitung
Die Infektion mit dem neuen SARS-CoV-2-Virus führt zu einem bisher unbekannten Krankheitsbild, das als COVID-19 ( CO rona VI rus D isease-20 19 ) bezeichnet wird und erstmals in der Region Hubei in China beschrieben wurde 6 7 . Die Infektion wurde durch die WHO am 11.03.2020 zur Pandemie erklärt 1 . Das SARS-CoV-2-Virus, das bisher Menschen nicht infizierte, gehört zur großen Gruppe der Coronaviren, die Erkrankungen von einer normalen Erkältung bis zu schweren Krankheitsverläufen verursachen können. Verwandt mit dem SARS-CoV-2-Virus sind die Viren, die das Krankheitsbild des SARS (Schweres Akutes Respiratorisches Syndrom ) und des MERS (Middle East Respiratory Syndrome) verursachen. Trotz der durch die Landesregierungen verordneten Maßnahmen der gesellschaftlichen Ausgangs- und Kontaktsperre und anderer Schutzmaßnahmen stieg die Rate der Patienten mit COVID-19-Erkrankungen kontinuierlich an; in Deutschland erkrankten mehr als 173 000 Menschen, und 7881 Menschen verstarben an der Infektion (Stand 16.05.2020, RKI). 8
Vor allem für Menschen mit CED stellen sich viele Fragen. Hilfreich wären evidenzbasierte Handlungsempfehlungen; aufgrund der zurzeit unzureichenden Datenlage mit meist Registerstudien basieren diese vor allem auf Expertenmeinungen und Analogien zu anderen infektiösen Krankheitsbildern. Kritisch anzumerken ist aber, dass fehlende Evidenzen nicht zwangsläufig durch einen Konsensusprozess zu ersetzen sind. Selbst unter Experten unterliegt eine solche Meinungsbildung kurzlebigen Zeitströmungen, und nicht jede Wissenslücke ist grundsätzlich füllbar. Insgesamt erscheint aber angesichts der Sorgen und Ängste der Patienten, die zu folgereichen Entscheidungen, wie z. B. dem Absetzen der Medikation führen können, und der offenen Fragen bei behandelnden Ärzten diese S2k-Leitlinie dringend notwendig.
Die klinischen Manifestationen des Krankheitsbildes sind unspezifisch und hoch variabel. Sie reichen von asymptomatischen, milden Krankheitsbildern bis hin zu schweren Lungenerkrankungen mit ARDS, Multiorganversagen und Tod. Allgemeingültige Aussagen zum „typischen“ Krankheitsverlauf lassen sich nicht machen. Die kumuliert in China erfassten Patienten (n = 55 924) berichteten am häufigsten über Fieber und Husten. Rund 80 % der Erkrankungen verliefen mild bis moderat. Als „mild“ werden Krankheitsverläufe ohne klinische oder radiologische Zeichen einer Pneumonie bezeichnet, „moderat“ Erkrankte haben eine leichte Pneumonie, die sich nach radiologischen Kriterien auf weniger als die Hälfte der Lunge ausdehnt; die Patienten geben keine Atemnot an und weisen eine Sauerstoffsättigung im Blut von über 93 % auf 9 . Bei 14 % der Patienten verlief die Erkrankung schwer (mit Atemnot, Sauerstoffsättigung unter 94 % oder Lungeninfiltraten in mehr als der Hälfte der Lunge), aber nicht lebensbedrohlich. In 6 % der Fälle war der klinische Verlauf kritisch bis lebensbedrohlich (Lungenversagen, septischer Schock oder multiples Organversagen, ausgedehnte Thrombembolien). In einer Kohorte von 651 Patienten wiesen 74 (11,4 %) gastrointestinale Symptome (Übelkeit, Erbrechen und Diarrhoe) auf, die auch den Symptomen eines akuten Schubs bei bekannter CED entsprechen können 10 . Bei 40 Patienten mit gesicherter CED und begleitender COVID-19-Erkrankung wurden Diarrhoen bei 21 % beschrieben 11 . Daten aus dem weltweiten IO IBD-Register, in dem Mitte Mai 2020 über 1300 Patienten mit bekannter CED und nachgewiesener COVID-Erkrankung dokumentiert werden, beschreiben, dass sich zum Zeitpunkt der COVID-19-Erkrankung 59 % der Patienten in Remission befanden, 18 % wiesen eine milde und 20 % eine moderate Aktivität der Grunderkrankung auf. Die Mehrzahl der Patienten wurde weiter ambulant betreut; tendenziell werden mehr Patienten mit CED und moderater bzw. hoher Krankheitsaktivität bei COVID-19 hospitalisiert (siehe auch Abb. 1 ) 12 :
Abb. 1.
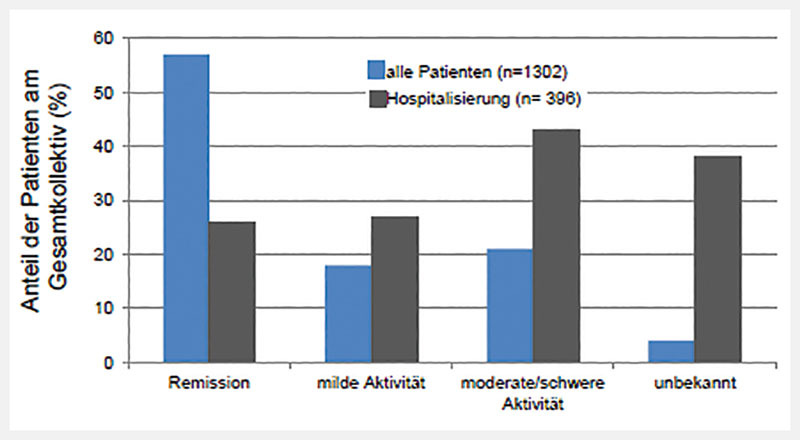
Krankheitsaktivität bei Patienten mit CED und COVID-19-Erkrankung. Der überwiegende Teil der CED Patienten erkrankt an COVID-19 in einer Phase der Remission. Patienten mit moderater bis schwerer CED-Krankheitsaktivität werden häufiger hospitalisiert 12 .
Der Pathomechanismus der gastrointestinalen Symptomatik bei COVID-19-Erkrankung ist unklar. Das SARS-CoV-2-Virus bindet an den ACE2-Rezeptor, der im gesamten Gastrointestinaltrakt, d. h. vom Ösophagus bis um Rektum, exprimiert ist, und dringt so in die Zelle ein. Diese direkten Schäden aufgrund invadierender Viren können so stark ausgeprägt sein, dass sich Patienten mit einer hämorrhagischen Colitis präsentieren 13 . Auch gibt es Patienten, bei denen der Virusnachweis im Rachenabstrich oder Sputum negativ war, die aber einen positiven Virusnachweis im Stuhl hatten 14 . Möglicherweise spielt eine sekundäre Malabsorption aufgrund geschädigter Enterozyten eine Rolle 15 .
Außerhalb von Wuhan/Hubei gibt es Beobachtungen, dass der Anteil milder Verläufe höher als 80 % ist. Naturgemäß hängt die Höhe einer Prozentangabe von der Stichprobengröße und dem Umstand ab, wie Patienten identifiziert wurden (Massenscreening oder symptomorientiertes Vorgehen). In allen Publikationen zeigt sich jedoch eine ähnliche Häufigkeitsverteilung der Symptome 16 17 18 19 (siehe Abb. 2 ).
Abb. 2.
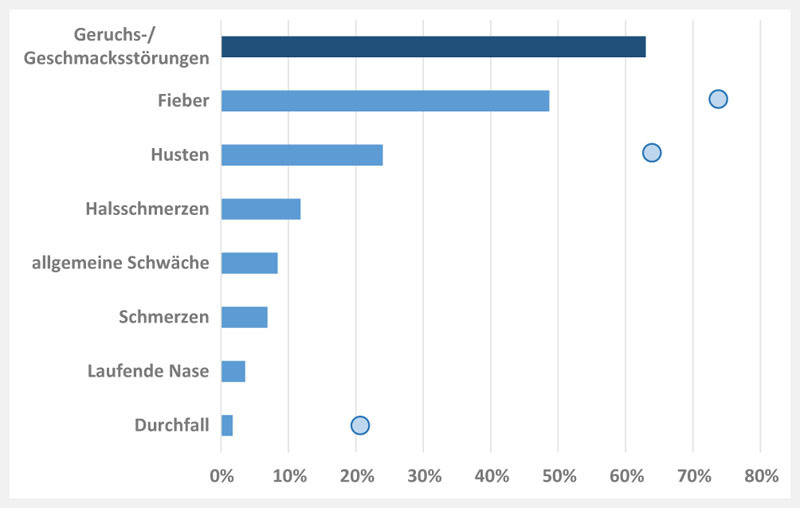
Symptome von Patienten mit COVID-19. (Daten des ECDC, 2020: „The European Surveillance System (TESSy) 20 . Die Angaben zu den Beeinträchtigungen des Geruchs-/Geschmackssinns stammen aus verschiedenen europäischen Studien 21 . Symptome einer Fallserie von CED-Patienten sind als Punkte dargestellt 11 .
Kapitel 1: Risiko für eine COVID-19-Erkrankung bei Patienten mit chronisch entzündlichen Darmerkrankungen
Systematische Befragungen von Patienten mit CED belegen, dass diese sich große Sorgen machen, dass bei ihnen ein erhöhtes Risiko für eine Infektion mit SARS-CoV-2 besteht 22 . Erste epidemiologische Daten zeigen, dass CED-Patienten kein erhöhtes Risiko für eine COVID-19-Erkrankung haben . So wurde aus der IBD Elite Union, dem siebtgrößten CED-Zentrum in China, das mehr als 20 000 Patienten betreut, kein Fall einer COVID-19-Erkrankung bei CED-Patienten beschrieben 23 . In Italien wurde in einer systematisch betreuten Kohorte von 522 Patienten kein Fall identifiziert 24 ; eine größere Kohorte aus Madrid mit 1918 CED-Patienten weist 12 COVID-19-Infektionen aus; dieses entspricht einer Inzidenz von 6,1 COVID-19-Infektionen auf 1000 CED-Patienten bei einer Inzidenz in der Gesamtbevölkerung von 6,6/1000 25 . In einer noch größeren Kohorte aus Nancy (Frankreich) und Mailand (Italien) mit 6000 Patienten wird über eine Inzidenz von 2,5/1000 CED-Patienten bei einer Inzidenz von 1,7/1000 in der Normalbevölkerung berichtet 26 . Die Schwäche aller dieser Untersuchungen ist jedoch, dass nur symptomatische Patienten erfasst wurden und nicht die Gesamtkohorte getestet wurde.
Das selektive Testen von nur symptomatischen Patienten erklärt zumindest partiell, dass der Anteil der Kinder und Jugendlichen an den COVID-19-Erkrankten weltweit sehr niedrig ist. Obwohl Kinder im Allgemeinen anfälliger für Infektionen sind, weisen inzwischen zahlreiche Untersuchungen darauf hin, dass es sich bei der SARS-CoV-19 Infektion anders verhält. Kinder scheinen sich seltener zu infizieren 27 28 und haben im Fall einer Infektion meist einen milden Krankheitsverlauf. Die im Mai im Deutschen Ärzteblatt publizierten Zahlen aus Deutschland geben einen Anteil von 3 % Kinder und Jugendliche aller dem RKI gemeldeten Patienten mit nachgewiesener SARS-CoV-2-Infektion an, obwohl diese Altersklasse 13 % der Gesamtpopulation entspricht. Von 128 stationären pädiatrischen Patienten waren zwei Drittel Säuglinge und Kleinkinder und nur ein Drittel Schulkinder und Jugendliche. Die meisten Patienten waren nicht wegen COVID-19 hospitalisiert, 17 % zeigten keine COVID-typischen Symptome, nur 5 % wurden beatmet und ein Kind verstarb 29 . Ein ähnliches Bild mit Hinweis auf einen leichteren Krankheitsverlauf beim Kind im Vergleich zum Erwachsenen, ergibt sich bei den 1302 im Secure-IBD-Register gemeldeten CED-Patienten mit COVID-19; 61 (4,7 %) waren jünger als 20 Jahre, davon mussten nur vier stationär aufgenommen werden, keiner wurde intensivpflichtig 12 . Die IBD-Arbeitsgruppe der ESPGHAN trug die bisherigen Erfahrungen aus Wuhan in China und Süd-Korea zusammen. Von dort wurde von keinem infizierten Kind mit CED berichtet 30 . Von acht in Europa gemeldeten pädiatrischen CED-Patienten mit COVID-19 hatten alle einen milden Verlauf der Infektion, obwohl alle mit Immunsuppressiva behandelt waren 30 . Zusammenfassend scheinen Kinder und Jugendliche mit CED ein geringes Risiko für einen symptomatischen oder schweren Verlauf einer SARS-CoV-2-Infektion zu haben. Wie häufig Kinder im Fall einer asymptomatischen Infektion Ausgangspunkt einer Infektionskette sind, konnte unter den Bedingungen der letzten Wochen mit Schließung von Kitas, Kindergärten und Schulen nicht untersucht werden. Nach dem jetzigen Wissensstand können Kinder ohne Komorbiditäten für ein erhöhtes Risiko eines schweren COVID-19-Verlaufs am Schulunterricht teilnehmen, wenn dort die empfohlenen Vorsichtsmaßnahmen eingehalten werden können. Ob die Rückkehr von Klein- und Vorschulkindern, die sich nicht an Hygiene- und Abstandsregeln halten, eine deutliche Risikoerhöhung für eine SARS-CoV-2-Infektion für CED-Patienten oder für an CED erkrankte Geschwister oder Eltern darstellt, kann zum Zeitpunkt der Abfassung der Leitlinie nicht eingeschätzt werden. Letztlich wird die Frage des Risikos für eine SARS-CoV-2-Infektion in den verschiedenen Altersklassen unabhängig von Symptomen erst durch große epidemiologische Untersuchungen bei Einsatz hoch sensitiver und spezifischer serologischer Tests beantwortet werden können.
Für die Bewertung des Risikos für eine SARS-CoV-2-Infektion sind aber auch andere virale Infektionen, die über den oberen Respirationstrakt aufgenommen werden, von besonderem Interesse. So ist ein erhöhtes Risiko für Patienten mit CED, an Influenza zu erkranken bzw. aus diesem Grund hospitalisiert zu werden, beschrieben 31 . Weiterhin beschreiben Ko und Mitarbeiter für CED-Patienten im ersten Krankheitsjahr eine Hospitalisierung aufgrund von Infektionen bei 7,9 %; dabei ist mehr als 1/3 durch Infektionen des Respirationstrakts bedingt 32 .
Um das Risiko für eine COVID-19-Erkrankung zu minimieren, sind als wichtigste Maßnahmen hygienische Händedesinfektionen, das Einhalten eines Abstandes (≥ 1,5–2 m) zu anderen Personen, die Eingrenzung sozialer Kontakte und das Verzichten auf Reisen zu nennen. Die konsequente Umsetzung dieser Empfehlungen wird auch durch ein aktuelles Positionspapier der ECCO betont 33 . Aufgrund einer Studie aus China wird spekuliert, dass bei konsequenter Umsetzung der Schutzmaßnahmen CED-Patienten vor einer COVID-19-Erkrankung geschützt werden können 34 . Verschiedene Studien zeigen, dass durch Händewaschen unter Verwendung von Seife (mindestens 15 Sekunden) die Häufigkeit von grippeähnlichen Infektionen signifikant reduziert wird 35 . Eine weitere – allerdings kontrovers diskutierte – Maßnahme ist das Tragen einer Mund-Nasen-Bedeckung (MNB). Das RKI empfiehlt ein generelles Tragen der MNB in bestimmten Situationen im öffentlichen Raum als einen weiteren Baustein, um Risikogruppen zu schützen und den Infektionsdruck und damit die Ausbreitungsgeschwindigkeit von SARS-CoV-2 in der Bevölkerung zu reduzieren. Diese Empfehlung beruht auf einer Neubewertung der zunehmenden Evidenz, dass ein hoher Anteil von Übertragungen bei hoher Viruslast unbemerkt bereits 2–3 Tage vor dem Auftreten von Krankheitssymptomen erfolgen kann. 36 37 . Zu betonen ist, dass der Schutzeffekt nicht auf die Protektion des MNB-Trägers selbst (als eines potenziell gefährdeten Patienten), sondern auf den Schutz des Kollektivs vor dem potenziell infektiösen MNB-Träger abzielt. Von Patienten wird aber auch immer wieder hinterfragt, ob z. B. spezielle filtrierende Halbmasken (sogenannte FFP2-Masken) notwendig oder hilfreich sind, um einen individuellen Schutz zu erreichen. Dazu gibt es keine belastbaren Daten. Wichtig in dem Zusammenhang erscheint aber die Beobachtung, dass bei Krankenhauspersonal, das einen unerkannt an COVID-19 erkrankten Patienten auf der Intensivstation versorgt hatte, innerhalb eines 14-tägigen Nachbeobachtungsintervalls keine Infektionen aufgefallen sind. Dabei wurde in 85 % der potenziellen Infektionsexpositionen lediglich eine chirurgische Mund-Nasen-Maske getragen 38 . Die Verwendung von FFP2-Masken bei CED-Patienten ohne besondere Risikoexposition zum Eigenschutz ist somit nicht nachweisbar indiziert.
Zur tatsächlichen Höhe des Infektionsrisikos fehlen spezifische epidemiologische Daten für Patienten mit CED mit immunsuppressiver Therapie, die eine konkrete Risikoabschätzung für die Infektion mit SARS-CoV-2 möglich machen. Die Zahl der Patienten mit Biologikatherapie bzw. klassischer Immunsuppression in den oben erwähnten Kohorten ist niedrig; teilweise wurde diese mit Beginn der Pandemie abgesetzt; somit sind die Fallzahlen zu niedrig, um verlässliche Aussagen zu machen. Ohne Zweifel ist insgesamt das Risiko für bakterielle und virale Infektionen bei Patienten mit einer immunsuppressiven Therapie bzw. einer Steroidmedikation signifikant erhöht; diese bedingen auch eine erhöhte Mortalität 39 . Epidemiologische Studien aus der Lombardei in Italien zu 1193 Patienten mit Psoriasis und Biologika ergeben ein erhöhtes Risiko für eine Infektion, aber nicht für einen schweren Verlauf im Sinne einer Notwendigkeit für eine intensivmedizinische Betreuung oder Tod (siehe auch Tab. 3 ) 40 .
Tab. 3. Risiko für SARS-CoV-2-Infektionen bei Patienten mit Psoriasis und Biologikatherapie. Angegeben ist das relative Risiko im Vergleich zur Gesamtpopulation 40 .
| Parameter | Risiko | 95 %-Vertrauensintervall | P-Wert |
| Positiver SARS-CoV-2-Test | 3,43 | 2,25–5,73 | < 0,0001 |
| Quarantäne zu Hause | 9,05 | 5,61–14,61 | < 0,0001 |
| Hospitalisierung | 3,59 | 1,49–8,63 | 0,0044 |
| ITS-Aufnahme | 3,41 | 0,21–54,55 | 0,3861 |
| Tod | 0,41 | 0,003–6,59 | 0,5306 |
Seit langer Zeit ist bekannt, dass eine Steroidmedikation, insbesondere in Dosierungen über 20 mg/Tag Prednisolonäquavivalent, das Risiko für opportunistische Infektionen einschließlich Influenzainfektionen und schwerer Pneumonien erhöht und eine signifikant gesteigerte Häufigkeit von Hospitalisierungen und eine erhöhte Mortalität bedingt 41 42 43 44 . In einer großen Fallkontrollstudie mit 140.000 Patienten mit CED war eine Steroidmedikation ein unabhängiger Risikofaktor für eine Influenzainfektion (Odds Ratio, 1.22; 95 %-KI: 1,08–1,38) 31 . Somit muss eine Steroidmedikation, insbesondere in höheren Dosierungen, als ein Risikofaktor für eine COVID-19-Erkrankung angenommen werden.
Auch die Medikation mit Thiopurinen geht mit einer Risikoerhöhung für virale Infektionen einher 45 . Ob das Risiko für Infektionen mit respiratorischen Viren dabei erhöht ist, ist unklar 46 . Im Vergleich zu einer Thiopurin-Monotherapie ist die Anti-TNF-Therapie mit einem niedrigeren Risiko für virale Infektionen (HR: 0,57; 95 %-KI: 0,38–0,87) assoziiert 47 . Für ein insgesamt erhöhtes Risiko für respiratorische Infektionen unter einer Anti-TNF-Monotherapie gibt es keine Hinweise. Allerdings weist die Untersuchung von Kirchgesner et al. ein erhöhtes Risiko für opportunistische virale Infektionen unter einer Anti-TNF-Monotherapie im Vergleich zu nicht exponierten Patienten mit CED auf 47 . Eine COMBO-Therapie aus Anti-TNF-Antikörper plus klassischem Immunsuppressivum (meist Azathioprin/6-Mercaptopurin oder Methotrexat) ist mit einem höheren Risiko für opportunistische Infektionen verbunden als eine Anti-TNF-Monotherapie (Hazard Ratio [HR]: 1,96; 95 %-KI: 1,32–2,91). Dabei sind ältere, multimorbide Patienten besonders gefährdet 48 .
Zurzeit werden verschiedene JAK-Inhibitoren vor dem Hintergrund des Zytokinsturms bei Patienten mit schwerer COVID-19-Erkrankung in klinischen Studien getestet (siehe unten). Wichtig ist aber auch, dass in frühen Phasen viraler Infektionen die Interferon-mediierte Transkription über die JAK-STAT-Signalkaskaden zur Hochregulation von Genen führt, die die Abtötung von Viren in infizierten Zellen vermitteln 49 . Als Konsequenz kann eine JAK-STAT-Blockade zu einer verminderten interferonvermittelten antiviralen Antwort führen. So sind virale Infektionen (einschließlich Herpes Zoster und Herpes simplex) für 10 % der ambulant erworbenen und 5 % der beatmungsassoziierten Pneumonien bei Patienten auf der Intensivstation ursächlich 50 . Vor diesem Hintergrund sollten JAK-Inhibitoren mit Vorsicht eingesetzt werden 51 .
Die Behandlung mit Vedolizumab erhöht das Risiko für Infektion im Respirationstrakt nicht 52 . Auch für Ustekinumab scheint kein erhöhtes Risiko für Infektionen vorzuliegen. So zeigen in einer Übersichtsarbeit zusammengestellte Daten zu Patienten mit Psoriasis-Arthritis 53 bzw. ältere Ergebnisse aus dem PSOLAR-Register insgesamt keine Risikoerhöhung für Ustekinumab im Vergleich zu Basistherapeutika, auch wenn zu der Häufigkeit respiratorischer Infektionen in den Studien nicht dezidiert Stellung genommen wird 53 . Abb. 3 fasst das Risiko für virale Infektionen in Abhängigkeit von einer medikamentösen Therapie schematisch zusammen.
Abb. 3.
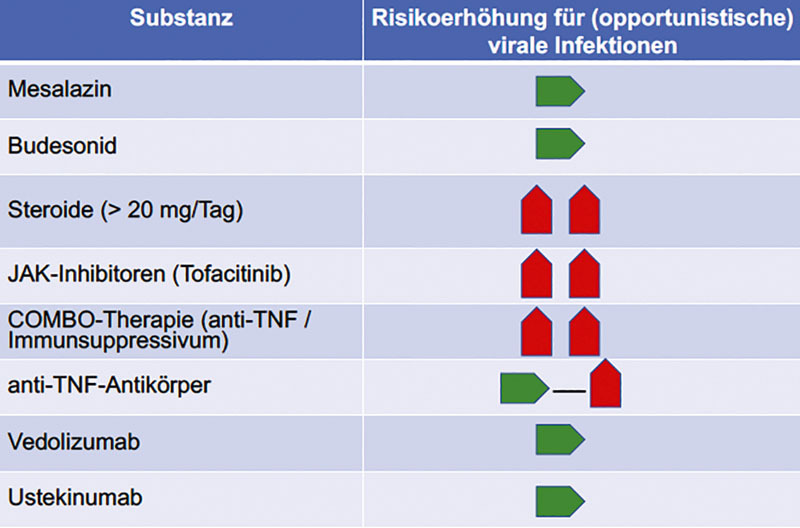
Risikoerhöhungen für virale Infektionen bei Patienten mit CED in Abhängigkeit von der medikamentösen Therapie. Modifiziert nach den Empfehlungen der „International Organization for the Study of Inflammatory Bowel Cisease (IOIBD) 54 .
Im Gegensatz zu vielen anderen Infektionserkrankungen, bei denen vom Auftreten erster Symptome bis zur klinischen Verschlechterung nur wenige Tage und z. T. nur Stunden vergehen, zeichnet sich die COVID-19-Erkrankung durch einen variablen Verlauf mit z. T. langsam zunehmender Krankheitsschwere, z. T. jedoch auch rasch progredienten Verläufen aus. Die mediane Inkubationszeit von der Exposition bis zum Auftreten erster Symptome beträgt 5–6 Tage bei einer Spannbreite von 2 bis 7 Tagen 55 . Die maximale Inkubationszeit wird vom RKI mit 14 Tagen angenommen. Es gibt jedoch Fallberichte von längeren Inkubationszeiten von bis zu 19 oder 24 Tagen. Somit ist bei vielen Patienten mit COVID-19 die Erkrankung zunächst kompensiert, dann kann aber eine rasche Verschlechterung eintreten. Bekanntlich sind Alter und Vorerkrankungen in hohem Maß miteinander assoziiert; es sind bis jetzt jedoch keine Regressionsanalysen publiziert, die den unabhängigen Einfluss der einzelnen Faktoren beschreiben. Folgende Personen sind für schwere Verläufe besonders gefährdet:
ältere Personen (mit stetig steigendem Risiko für schwere Verläufe ab etwa 50–60 Jahren)
Raucher (schwache Evidenz)
ausgeprägte Adipositas/deutliche Kachexie
-
Personen mit Komorbiditäten:
chronische Lungenerkrankungen (z. B. COPD)
koronare Herzerkrankung und/oder arterielle Hypertonie
chronische Lebererkrankungen
Diabetes mellitus
maligne Erkrankungen
Immundefizienz (angeboren oder erworben).
Ohne Zweifel wird bei Patienten mit CED das Risiko für Infektionen bzw. einen schweren Verlauf durch die Medikation beeinflusst („Therapie als Risikofaktor“). Dennoch sind auch die Krankheitsaktivität (OR: 3,35; 95 %-KI: 1,23–9,23) 45 und eine Malnutrition (OR: 6,26; 95 %-KI: 1,20–32,78) 56 57 signifikante nichtpharmakologische Risikofaktoren. In einer kleineren Observationsstudie aus Italien unter Einschluss von 79 Patienten mit CED und COVID-19-Erkrankung zeigte sich, dass das Alter über 65 Jahre und die Krankheitsaktivität mit der Entwicklung einer schweren COVID-19-Pneumonie bzw. dem Versterben assoziiert waren 58 . Vor diesem Hintergrund sind eine gute Einstellung der Grunderkrankung und der Ausgleich von Ernährungsdefiziten anzustreben. Ob Risikopatienten von einer besonderen Überwachung z. B. durch Verwendung von „CORONA-Apps“ profitieren, ist unklar und Gegenstand aktueller Studien.
Es gibt bislang keinen eindeutigen Hinweis darauf, dass sowohl pädiatrische als auch erwachsene Patienten mit einer CED insgesamt eine erhöhte Suszeptibilität für eine COVID-19-Erkrankung haben. Hochwahrscheinlich erhöht eine immunsuppressive Therapie das Risiko für eine Infektion, auch wenn möglicherweise die Erkrankung bei Vorbehandlung mit bestimmten Immunsuppressiva milder verläuft (siehe Empfehlung 1.2). Auch hängt das Infektionsrisiko von der Zahl der Kontakte und der Viruslast ab. Für diese Risikoabschätzung ist auch immer die regionale Zahl der SARS-CoV-2-Infizierten von Bedeutung. In den aktuellen Hochprävalenzregionen wie z. B. den Stadt- und Landkreisen Heinsberg, Traunstein, Greiz, Zollernalbkreis oder Weiden i. d. OPF ist das Risiko für eine Infektion im Rahmen von sozialen Kontakten deutlich höher als in Niedrigprävalenzregionen.
Unter Beachtung der gültigen Hygienevorgaben gibt es insgesamt keinen Grund, dass CED-Patienten ohne immunsuppressive Therapie und ohne weitere Komorbiditäten nicht an Arbeitsplätzen mit einer hohen Zahl an sozialen Kontakten mit Personen ohne besondere Risikokonstellation (z. B. Kunden im Supermarkt, Kinder in KITA und Schule o. Ä.) eingesetzt werden.
Medizinisches Personal hat überdurchschnittlich häufig Kontakt zu COVID-19-Patienten; andererseits besteht bei korrekter Anwendung der Personenschutzausrüstung kein erhöhtes Risiko für eine Infektion 38 . In der aktuellen pandemischen Situation wurden aus China und Italien 9 59 Infektionsraten bei Krankenhausmitarbeitern von bis zu 10 % bzw. 9 % berichtet. Am 10.04.2020 wurden im täglichen Lagebericht des Robert Koch-Instituts (RKI) zur Coronavirus-Erkrankung unter den nach Infektionsschutzgesetz (IfSG) übermittelten COVID-19-Fällen in Deutschland 15 495 Personen gezählt, die in medizinischen Einrichtungen gemäß § 23 Abs. 3 IfSG tätig sind. Zu diesen Einrichtungen zählen z. B. Krankenhäuser, Arztpraxen, Dialyseeinrichtungen, ambulante Pflegedienste und Rettungsdienste 60 . Die Zahl der Personen im Alter von 20 bis 64 Jahren in der Gesamtbevölkerung in Deutschland betrug 2018 48.950.000 61 . 2020 sind 45.130.000 Personen (92,2 %) erwerbstätig gewesen 62 . Davon arbeiten 5.700.000 im Gesundheitswesen. 116 676 Personen im Alter von 20 bis 69 Jahren waren bis zum 27.04.2020 an einer SARS-Cov2-Infektion erkrankt 60 . Nimmt man hier einen Anteil von 92 % Berufstätigen an, ergibt sich eine kalkulierte Zahl von ca. 107.000 Berufstätigen mit COVID-19-Erkrankung. Bei allen Unschärfen, die diese Abschätzung hat, ist somit der Anteil der gemeldet Erkrankten unter dem medizinischen Personal mit 0,27 % numerisch höher als der Anteil bei den Gesamtberufstätigen (0,23 %) (siehe auch Tab. 4 ). Ein Selektionsbias durch vermehrte Testungen medizinischen Personals auch schon bei milder Symptomatik kann dabei als Ursache der höheren Infektionsrate nicht ausgeschlossen werden
Tab. 4. COVID-19-Erkrankungsrisiko medizinischen Personals im Vergleich zu Berufstätigen sowie der Gesamtbevölkerung.
| Personenzahl | gemeldete Infektionen | relativer Anteil [%] | |
| med. Personal | 5 700 000 | 15 495 | 0,27 |
| Berufstätige | 45 130 000 | 107 000 * | 0,23 |
| Gesamtbevölkerung | 83 020 000 | 159 119 | 0,19 |
bezogen auf einen 92 %igen Anteil von Berufstätigen.
Passend dazu eine systematische Untersuchung aus dem Universitätsklinikum Münster bei insgesamt 957 Mitarbeitern insgesamt 52 Mitarbeiter (5,4 %) mit positiven SARS-CoV-2-Abstrichbefunden aus. Davon waren 33 Personen in einem Bereich mit direktem Patientenkontakt eingesetzt. Nach Einführung der Pflicht, einen Mund-Nasen-Schutz zu tragen, konnte in der infektionsepidemiologischen Nachverfolgung keine nosokomiale Person-zu-Person(Mitarbeiter/Patienten)-Übertragung mehr festgestellt werden 57 .
In diesem Zusammenhang ist auch eine Fallkontrollstudie der GETAID mit 482 CED-Patienten, die im Gesundheitssystem arbeiten, von Interesse. Bei einer medianen Nachbeobachtung von 9,3 Jahren traten insgesamt 139 Infektionen (30 CDI, 33 schwere Virusinfektionen, 9 TBC-Fälle, 21 Pneumonien und 46 andere Infektionen) auf. Als Risikofaktoren konnten Steroide (OR: 3,05; 95 %-KI: 2,06–4,52), TNF-Antikörper (OR: 2,93; 95 %-KI: 2,02–4,27) und Immunsuppressiva (OR: 1,98; 95 %-KI: 1,38–2,84) identifiziert werden. Nach dieser Studie haben CED-Patienten, die im Gesundheitssystem arbeiten, generell kein erhöhtes Risiko für Infektionen; Patienten mit einer immunsuppressiven Therapie sind aber besonders gefährdet. Somit erscheint eine Beschränkung der Arbeitsmöglichkeiten für CED-Patienten mit immunsuppressiver Therapie in Bereichen mit einem besonders hohen Infektionsrisiko (wie z. B. COVID-19-Stationen) gerechtfertigt.
In dem am 16. April 2020 vorgestellten SARS-CoV-2-Arbeitsschutzstandard des Bundesministeriums für Arbeit und Soziales 63 ist geregelt, dass Erwerbstätige, die Risikogruppen angehören, besonders geschützt werden müssen. Dazu sollten sich Beschäftigte individuell vom Betriebsarzt auch zu besonderen Gefährdungen wie einer möglichen COVID-19-Erkrankung beraten lassen. Vor dem Hintergrund des aktuellen Arbeitsplatzes hat der Betriebsarzt dem Arbeitgeber geeignete Schutzmaßnahmen vorzuschlagen, wenn die normalen Arbeitsschutzmaßnahmen nicht ausreichen. Gegebenenfalls kann der betroffenen Person auch ein Tätigkeitswechsel empfohlen werden. Dabei verpflichtet das Arbeitsschutzgesetz den Arbeitgeber dazu, die Gefahren für die Sicherheit und Gesundheit seiner Beschäftigten am Arbeitsplatz zu beurteilen (sogenannte Gefährdungsbeurteilung) und daraus Maßnahmen abzuleiten; diese sind ggf. im Rahmen der Pandemieplanung zu erweitern. So kann z. B. ein Tätigkeitswechsel für die Dauer der Pandemie sinnvoll sein.
Kapitel 2: Diagnostik
CED unterliegen einer Schwankung der Entzündungsaktivität und damit verbundenen Komplikationsmöglichkeiten und bedürfen je nach Schweregrad und Therapieeinstellung einer regelmäßigen Kontrolle 64 . Patienten mit akuten Beschwerden müssen weiterhin einen ungehinderten Zugang zu adäquater medizinischer Versorgung haben. Im Speziellen weisen CED-Patienten teils den Bedarf der unverzüglich erforderlichen Diagnostik und Therapie auf, wie z. B. beim Intraanalabszess, Ileus oder Zeichen eines fulminanten Verlaufes 65 . Daher kann generell auf die Versorgung in fachspezifischen Praxen und Zentren nicht verzichtet werden. Zu beachten ist auch, dass Restriktionen im Zugang zu Einrichtungen des Gesundheitssystems nicht zu einer Unterversorgung von CED-Patienten ohne SARS-CoV-2-Infektion führen dürfen.
Die hohe Rate von immunsuppressiven Therapien bei Patienten mit CED und die damit möglicherweise verbundene höhere Anfälligkeit für virale Infektionen 47 müssen zu einer erhöhten Vigilanz im Umgang mit Infektionsschutzmaßnahmen führen. Die Erfahrungen aus Regionen und Ländern mit einer großen Zahl an COVID-19-Patienten zeigen, dass das Risiko der Übertragung in medizinischen Einrichtungen in Zeiten der Pandemie hoch sein kann 9 59 66 .
Zum Schutz der Patienten, aber auch zum Schutz des „Gesundheitswesens“ sollte versucht werden, die Zahl der Besuche von Patienten in Einrichtungen des Gesundheitswesens möglichst gering zu halten 67 . Auf Routinevorstellungen von CED-Patienten in Remission sollte möglichst verzichtet werden. Eine persönliche Vorstellung von Patienten orientiert sich daher an der medizinischen Dringlichkeit, die der behandelnde Arzt mit dem Patienten individuell festlegen muss. Das Nutzen-Risiko-Verhältnis ist bei Kindern und Jugendlichen anders als bei Erwachsenen, und der Verzicht auf persönliche Vorstellungen ist mit einem größeren Risiko für eine unzureichende Behandlung der Grunderkrankung behaftet. Pädiatrische Patienten haben einerseits einen aggressiveren Krankheitsverlauf und in der Pubertät eine schlechte Therapieadhärenz und andererseits ein geringeres SARS-CoV-2-Infektionsrisiko in einer Kinderklinik im Vergleich zur Erwachsenenklink. Die verminderte Zahl an Ambulanzbesuchen erfordert immer alternative Kontaktaufnahmen, um sich über den Erkrankungszustand der Patienten mit CED zu informieren und die Behandlungsqualität nicht zu gefährden. Alternativ zu einer persönlichen Vorstellung, insbesondere bei Patienten in Remission, sollten die Möglichkeiten von Telefon- oder Videosprechstunden vermehrt genutzt werden. Die zunehmenden Möglichkeiten der Telemedizin im Bereich CED können dabei vermehrt zum Einsatz kommen 68 69 .
Bei persönlichen Visiten sei auf die allgemein bekannten Desinfektionsmaßnahmen, Abstandsregelungen, das Tragen von Mund-Nasen-Schutz zum Fremdschutz, aber auch zum Eigenschutz hingewiesen 70 . Weiterhin sollten Patienten grundsätzlich über Infektionsschutzmaßnahmen informiert werden und, wie in allen Hausarztpraxen üblich, vor Betreten der Räumlichkeiten telefonischen Kontakt aufnehmen, wenn Infektionszeichen bestehen oder ein Kontakt zu positiv Getesteten bestanden hat 71 .
Räumliche Veränderungen wie Abstände innerhalb von Wartebereichen und die Distanzierung der Wartezone vom Behandlungsbereich (Parkplatz, Auto, vorgelagerte Flure, Treppenhaus etc.), aber auch die Optimierung der Patientenströme durch Terminverlässlichkeit und Verhinderung von unnötigen Ansammlungen durch Ausschließen von Angehörigen, Zusenden von Rezepten und Formularen können einen Beitrag zur Infektionsprävention leisten.
Auf elektive Endoskopien sollte bei CED-Patienten im Rahmen der Pandemie zum Schutz sowohl der Patienten als auch des medizinischen Personals möglichst verzichtet werden. Die Indikationsstellung zur Endoskopie muss im Rahmen einer individuellen Risiko-Nutzen-Abwägung erfolgen. Regional unterschiedliche Infektionslagen sollten dabei Berücksichtigung finden. Alternativ zu einer invasiven Diagnostik könnten zur Überprüfung der Krankheitsaktivität z. B. die Durchführung von Calprotectin-Bestimmungen im Stuhl 72 73 , eine Ultraschalluntersuchung oder ggf. auch MRT-Untersuchungen genutzt werden. Möglichkeiten zur Calprotectin-Selbstmessung stehen als „Home-testing“-System bereits zur Verfügung 74 . Der Darm-Ultraschall hat sich sowohl bei MC als auch bei der CU zur Bestimmung der Krankheitsaktivität und zur Evaluation von Komplikationen, aber auch zum Krankheitsmonitoring als sehr hilfreich erwiesen 75 76 . Das Infektionsrisiko bei nichtinvasiven Darm-Ultraschalluntersuchungen oder bei MRT-Untersuchungen ist sicherlich geringer als bei endoskopischen Untersuchungen. Dennoch müssen auch dabei die notwendigen Hygienemaßnahmen beachtet werden.
Alle während der Pandemie eingeleiteten restriktiven Maßnahmen, die den Patientenkontakt einschränken, sollten kontinuierlich mit den Zielen der Behandlungsqualität abgeglichen werden. Falls ambulante oder stationäre Vorstellungen in gesundheitlichen Einrichtungen als notwendig erachtet werden, sollten die üblichen Schutzmaßnahmen (z. B. Mund-Nasen-Schutz bei Patienten und Untersuchern) eingehalten werden.
Das Endoskopiepersonal ist über eine mögliche Inhalation von Tröpfchen und Aerosolen, Kontakt über die Konjunktiven sowie über den Stuhl einem erhöhten Risiko einer Infektion mit SARS-CoV-2 ausgesetzt. Eine vermehrte Transmission der Infektion in Krankenhäusern durch infizierte Mitarbeiter wurde beschrieben 77 78 . Endoskopien stellen einen Ort mit besonders hohem Übertragungsrisiko bakterieller und viraler Infektionen dar, sodass die Mitarbeiter dort in besonderer Weise geschützt werden sollten 79 . Während der Endoskopien kommt es zur Aerosolbildung. Aerosole wurden als potenzielle Transmitter von SARS-CoV-2 beschrieben 80 . Darüber hinaus kommt es im Rahmen der COVID-19-Erkrankung bei den meisten Patienten zu einer Ausscheidung von Virus-RNA im Stuhl 37 81 82 83 . Der Rezeptor für SARS-CoV-2, der ACE2-Rezeptor, ist im Gastrointestinaltrakt in hoher Zahl exprimiert, insbesondere im Bereich des terminalen Ileums, in etwas geringerem Ausmaß auch im Kolon 84 . Die Ausscheidung konnte in einer Studie bis zu 21 Tage nachgewiesen werden 37 . Eine Transmission von SARS-CoV-2 über Aerosole, die im Rahmen von Koloskopien auftreten, ist daher nicht auszuschließen, wenngleich bisher kein infektiöses Virus aus dem Stuhl kultiviert werden konnte 37 .
Infektionspräventive Maßnahmen haben sich insbesondere im Bereich der Endoskopie als hochgradig effektiv erwiesen 85 86 . Bedauerlicherweise müssen wir bei allen vorgeschlagenen bzw. notwendigen Maßnahmen beachten, dass es zum Teil limitierte Ressourcen an Schutzausrüstung gibt und die Umsetzung der Empfehlungen daher leider nicht flächendeckend und zu jedem Zeitpunkt gewährleistet werden kann. Zwischenzeitlich wurden verschiedene Leitlinien für Verhaltensmaßnahmen bei Endoskopien in Zeiten der SARS-CoV-2-Pandemie verfasst, u. a. von der ESGE 87 (siehe Tab. 5 ), der AGA 88 und der Asian Pacific Society for Digestive Endoscopy 89 . Eine Risikostratifizierung und ein risikoadaptiertes Vorgehen in Analogie zu den ESGE-Leitlinien erscheinen sinnvoll und pragmatisch 87 . Derzeit variiert die Infektions- und Gefährdungslage in Deutschland von Region zu Region zum Teil erheblich. Zu den Hochrisikogruppen zählen in jedem Fall Personen mit oder ohne Symptome, die innerhalb der letzten 14 Tage Kontakt zu COVID-19-Patienten hatten. Personen, die sich innerhalb der letzten 14 Tage in Regionen mit derzeit starker Verbreitung von SARS-CoV-19-Infektionen oder in einem Umfeld mit einer Ausbruchssituation aufgehalten haben (z. B. in Altenheimen oder Krankenhäusern), zählen ebenfalls zu einer Hochrisikogruppe. Die AGA fordert flächendeckend Schutzmaßnahmen wie bei SARS-CoV-2-positiven Patienten, da im Rahmen einer Pandemie das Risiko überall als gleich hoch einzustufen sei 88 . Dieser Empfehlung können sich die Konsensusteilnehmer in der Mehrheit nicht anschließen, da sich diese Situation nicht mit der in Deutschland regional sehr unterschiedlich vorliegenden Prävalenz der Erkrankung deckt. Ein risikoadaptiertes Vorgehen erscheint daher den meisten Konsensusteilnehmern auch unter Berücksichtigung der zeitweilig limitierten Schutzausrüstung als sinnvoll und ausreichend.
Tab. 5. Risikostratifizierung modifiziert nach den Empfehlungen der ESGE 87 .
| Patienten mit geringem Risiko |
|
| Patienten mit hohem Risiko | Vorliegen von Symptomen, aber
|
Allgemeine Maßnahmen, die bei allen Endoskopien berücksichtigt werden sollten, beinhalten, dass in Zeiten der Pandemie eine enge Indikationsstellung erfolgen sollte. Der Schutz des Personals hat oberste Priorität. Bei jeder endoskopischen Untersuchung sollte geprüft werden, ob es keine alternativen diagnostischen Verfahren gibt. Das Endoskopiepersonal sollte in kleinen Teams möglichst getrennt arbeiten, gemeinsame Treffen bzw. Veranstaltungen innerhalb des Teams sollten vermieden werden. Eine professionelle Hygieneschulung sollte erfolgen, und die eingeleiteten Schutzmaßnahmen sollten von Hygienefachkräften begleitet werden. Die Hygieneschulung sollte u. a. allgemeine Hygienemaßnahmen, Risikofaktoren für COVID-19 und die korrekte An- und Ablage der Schutzkleidungen umfassen. Grundsätzlich sollte Einmalmaterial verwendet werden. Die Endoskopieaufbereitung erfolgt nach den allgemeinen Regeln. Nach jeder endoskopischen Untersuchung erfolgt eine postinterventionelle Flächendesinfektion mit viruziden Substanzen 87 . Generell sollte berücksichtigt werden, dass die erforderlichen Hygienemaßnahmen in der Endoskopie incl. der Verwendung der Schutzausrüstung auch von der aktuellen und regionalen Infektionslage abhängen und nach Rücksprache mit den Hygieneexperten vor Ort auch modifiziert werden können.
Das Risikomanagement vor der Endoskopie umfasst eine Risikostratifizierung, die am Tag der Untersuchung wiederholt werden sollte. Endoskopie- und Aufwachbereiche sollten gemäß der Hoch- und Niedrigrisiko-Stratifizierung getrennt werden. Alle Patienten, die die Endoskopie betreten, sollten Mund-Nasen-Schutz tragen 87 . Eine generelle Testung der Patienten (z. B. Nasen-Rachen-Abstrich) vor Eintritt in die endoskopische Einheit wird von der Mehrheit der Konsensuskonferenzteilnehmer als nicht notwendig angesehen. Personen, die symptomatisch bzgl. einer COVID-19-Infektion sind und die zur Hochrisikogruppe zählen, sollten ggf. vor einer endoskopischen Untersuchung getestet werden. Die Kontrolle der Körpertemperatur des Patienten vor Betreten der Behandlungseinheit, ggf. auch das Ausfüllen eines strukturierten Risikoerfassungsfragebogens, wie er von vielen Kassenärztlichen Vereinigungen angeboten wird, kann sinnvoll sein und wird vom RKI empfohlen.
Das Risikomanagement w ährend der Endoskopie umfasst den Einsatz der persönlichen Schutzausrüstung bei allen endoskopischen Untersuchungen. In Abhängigkeit vom Risikostatus sollte unterschiedliche Schutzausrüstung verwendet werden (siehe Tab. 6 ). Patienten, die auf der Intensivstation liegen, sollten direkt auf dieser Behandlungseinheit endoskopiert werden.
Tab. 6. Risikoabhängige Schutzausrüstung in der Endoskopie 87 .
| Patienten mit geringem Risiko | Mund-Nasen-Schutz Handschuhe Schutzbrille oder Schutzschild wasserfester langärmeliger Einmalkittel |
|
Patienten mit hohem Risiko
Gesicherte COVID-19-Infektion |
FFP2- oder FFP3-Maske
doppelte Handschuhe Haarschutz Schutzbrille oder Schutzschild wasserfester langärmeliger Einmalkittel |
Bezüglich der von der ESGE formulierten Empfehlung zur Durchführung von Endoskopien bei Hochrisikopatienten in „Endoskopie-Räumen mit Unterdruck“ konnte bei den Konsensusteilnehmern keine einheitliche Zustimmung erreicht werden, zumal die Verfügbarkeit dieser Räume limitiert ist. Das Arbeiten in gut ventilierten Räumen erschien den meisten Teilnehmern ausreichend zu sein bzw. eine pragmatische Alternative darzustellen. Alternativ können COVID-19-Patienten auch in Operationssälen (mit Unterdruck) endoskopiert werden.
Einige Fachgesellschaften bzw. Autoren haben sich bereits mit der Frage beschäftigt, wie es nach der Pandemie mit endoskopischen Untersuchungen weitergeht 90 91 92 . In der Regel wird eine risikoadaptierte, stufenweise Rückkehr zum Normalbetrieb („neue Normalität“) favorisiert. Erfahrungen aus der schrittweisen Öffnung der Endoskopien in China und anderen besonders betroffenen Regionen sind sicher hilfreich.
Innerhalb des Behandlungsteams sollte eine gegenseitige Kontrolle bzgl. der Einhaltung von Hygiene- und Schutzregeln erfolgen. Auf eine Verminderung der Aerosolbildung sollte geachtet werden. Dies kann einerseits durch vorsichtiges Entfernen von Zubehör aus dem Arbeitskanal erreicht werden, aber auch durch eine kontinuierliche Absaugung während der Entfernung von Zubehör aus dem Arbeitskanal. Die kontinuierliche Absaugung am Endoskop bei der Entfernung von Zubehör wie Zangen, Schlingen etc. reduziert die Aerosolbildung erheblich und sollte daher grundsätzlich im Rahmen von Endoskopien erfolgen 93 .
Da sich die Erkenntnisse bezüglich des Erkrankungs- und Übertragungsrisikos bei COVID-19-Erkrankung im ständigen Wandel befinden, ist auch bezüglich der endoskopischen Untersuchungen zu erwarten, dass die entsprechenden Empfehlungen neuen Erkenntnissen angepasst werden müssen.
Antikörperdiagnostik
Prinzipiell wäre das Wissen um die Immunantwort bei der CED-Patientenversorgung von großem Interesse: Immunsuppressive Therapien können möglicherweise die Empfänglichkeit für eine virale Infektion erhöhen (siehe Empfehlung 1.2), ein unkontrollierter Entzündungsstatus den Verlauf der SARS-CoV-2 beeinflussen 94 . Das Wissen um eine Immunität der Patienten könnte sowohl den Umgang in den behandelnden Abteilungen als auch die Wahl der Medikation einer Neueinstellung und generelle Verhaltensempfehlungen, etwa bzgl. der Berufsausübung in publikumsreichen Berufen, beeinflussen.
Die momentan in Deutschland angewandte IgA-Testung von Euroimmun lässt nur eingeschränkt einen akuten Infektionsnachweis zu und ist der PCR-Testung in der Akuttestung deutlich unterlegen. Als Verlaufstestung wird dieser Test angeboten, um die beginnende Immunität nachzuweisen 95 . Dazu ist eine Spezifität von 90 % allerdings nicht ausreichend. Kreuzreaktionen mit anderen Coronaviren sind zu häufig. Daher ist dieser Test zum Screening nicht geeignet.
Die IgG-Testung lässt eine Spätphase der Infektion und Beschreibung der Immunität zu. Durch die hochspezifische S1-Domäne des Spike-Proteins erreicht der Test eine hohe Spezifität von 99 % 96 . Weiterhin stellt sich die Frage nach dem Zeitpunkt der Testung; wahrscheinlich ist ein multiples Testen (z. B. bei jeder Kontrollblutentnahme) notwendig, um auch inapparente Verläufe zu sichern 97 .
Kapitel 3: Therapieanpassung
Zum jetzigen Zeitpunkt ist nicht vollständig geklärt, welche Konsequenzen sich für die medikamentöse und operative Therapie bei Patienten mit CED aus der aktuellen Risikokonstellation einer Corona-Pandemie ergeben. Die Evidenz von Empfehlungen stützt sich zurzeit im Wesentlichen auf Erfahrungen bei anderen Viruserkrankungen, etwa einer früheren SARS-Epidemie, MERS-Epidemie, und die Erfahrungen mit Influenzaerkrankungen sowie auf Erkenntnisse aus der aktuellen Corona-Pandemie in China und einem internationalen Register der IOIBD (Secure-IBD) (siehe unten) sowie daraus abgeleitete Expertenempfehlungen der IOIBD 54 ; dieser Umstand sollte klar an Patienten kommuniziert werden. Zudem sind Sorgen und Ängste ernst zu nehmen, und es ist individuell zu entscheiden.
3.1 Medikamentöse Therapie
Ohne Zweifel ist insgesamt das Risiko für Infektionen bei Patienten mit einer immunsuppressiven Therapie bzw. einer Steroidmedikation signifikant erhöht; diese bedingen auch eine erhöhte Mortalität 39 . Im Gegensatz dazu scheint die Behandlung z. B. mit Vedolizumab das Risiko für Infektionen im Respirationstrakt nicht zu erhöhen 52 . Derzeit ist unklar, welche Konsequenzen sich aus dieser Risikokonstellation ergeben. Evidenzbasierte Empfehlungen, die sich aus kontrollierten Studien bzw. Interventionsstudien ergeben, können nicht gegeben werden; dieser Umstand ist klar an Patienten zu kommunizieren. Deren Sorgen und Ängste sind ernst zu nehmen und gemeinsam individuelle Entscheidungen im Sinne des „shared decision making“ zu treffen: Was spricht für ein Aussetzen, was spricht dagegen? Ein Aussetzen der immunsuppressiven Therapie oder eine Reduktion der Dosis bergen das Risiko, dass die Grunderkrankung sich verschlechtert. So wird in der ersten am 13.03.2020 veröffentlichten Einschätzung der ECCO betont, dass ein Absetzen oder eine Dosisreduktion zur Risikoreduktion für eine COVID-19-Erkrankung nicht empfohlen werden 98 . Es ist somit fraglich, ob eine Verlängerung der Infusionsintervalle bei Patienten unter einer Biologikatherapie in stabiler Remission diesen wirklich nützt. Es gibt lediglich Daten zur Möglichkeit der Verlängerung des Infliximab-Infusionsintervalls auf 10 Wochen bei Patienten in stabiler Remission 99 . Die Sinnhaftigkeit dieser Maßnahmen liegt, wenn überhaupt, darin, Kontakte zu Einrichtungen des Gesundheitssystems zu minimieren (siehe dazu auch Empfehlung 3.7). So zeigen kritische Aufarbeitungen aus China, dass bis zu 41 % der COVID-19-Erkrankungen als nosokomiale Infektionen verstanden werden müssen 100 .
Klarer ist die Situation für Empfehlungen, die eine Steroidtherapie betreffen. Die verfügbaren Daten zu diesen Konzepten weisen auf eine erhöhte Mortalität und sekundäre Infektionen bei Influenzapatienten hin, die eine Steroidtherapie erhalten. So wurde eine verzögerte Elimination von SARS-CoV und MERS-CoV bei Überlebenden mit Steroiden beschrieben 101 . Auf der anderen Seite sind aber bei Patienten mit COVID-19-assoziiertem ARDS (Acute Respiratory Distress Syndrome) Steroide protektiv 102 . Im IO IBD-Register haben jedoch Patienten mit einer systemischen Steroidtherapie die höchste Mortalität im Vergleich zu Patienten, die mit anderen Substanzen behandelt wurden (siehe dazu auch Abb. 4 ). Systemisch wirkende Steroidtherapien, insbesondere in Dosierungen über 20 mg/Tag, sollten somit vermieden werden.
Abb. 4.
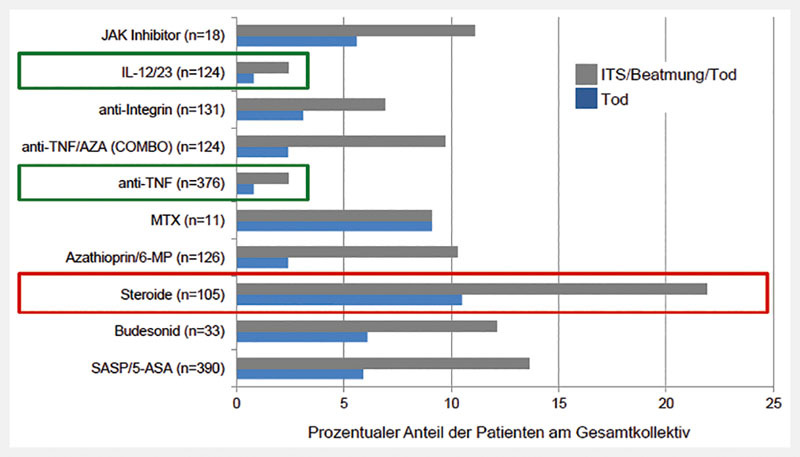
Schwere COVID-19-Erkrankungsverläufe bei CED-Patienten unter verschiedenen Therapeutika (Secure-IBD-Register der IOIBD, letzte Abfrage: 26.05.2020). Dargestellt ist der prozentuale Anteil der Patienten, die verstorben sind bzw. den kombinierten Endpunkt (Aufenthalt auf einer ITS-Station/Beatmungspflicht/Tod) erlitten haben, in Abhängigkeit von der medikamentösen Behandlung. Insgesamt gingen in die Auswertung die Daten von 1302 Patienten ein; dabei ergibt die Summe der zu den einzelnen Medikamenten aufgelisteten Patienten einen höheren Wert, da auch Kombinationstherapien durchgeführt wurden. Auffällig ist die hohe Sterblichkeitsrate bei Patienten, die mit Steroiden (oral/parenteral) behandelt wurden (rotes Rechteck), im Vergleich zu günstigen Verläufen bei Patienten, die mit TNF-Antikörpern bzw. IL12 / IL23-Antikörpern behandelt wurden. Die Gruppe der Patienten, die einen JAK-Inhibitor erhielten, ist mit n = 18 zu klein, um belastbare Aussagen zum Verlauf abzuleiten.
Divergente Einschätzungen ergeben sich zu Medikamenten, die eine Lymphozytopenie bewirken (Azathioprin, 6-Mercaptopurin) bzw. die Signaltransduktion in Lymphozyten hemmen (Calcineurininhibitoren, JAK-Inhibitoren). Eine niedrige Zahl von CD4 + -T-Zellen ist mit verzögerter SARS-CoV-2-Viruselimination und einem schweren Verlauf assoziiert 103 , sodass bei manifester und schwerer Erkrankung ein Stopp der Therapie mit Thiopurinen oder JAK-Inhibitoren begründet sein mag 104 . Die Auswertung der Patientenverläufe von Patienten mit CED und gesicherter SARS-CoV-2-Infektion aus dem IO IBD-Registern zeigt, dass die Komplikationsrate (Aufnahme auf die Intensivstation/Notwendigkeit zur Beatmung/Tod) von der Art der Behandlung der Grunderkrankung abhängt. In diesem Register wurden bis zum 23.06.2020 über 1500 Patienten dokumentiert, sodass eine relevante Datenlage vorliegt.
Bei Medikamenten, die eine Lymphozytopenie bewirken können (Azathioprin, 6-Mercaptopurin, Tofacitinib, Methotrexat), soll im Fall einer SARS-CoV-2-Infektion insbesondere bei schwerer Symptomatik eine Beendigung oder Pausierung der Therapie erwogen werden, wenngleich die lange Halbwertszeit von Thiopurinen und MTX dieser Maßnahme möglicherweise widerspricht. Eine niedrige Zahl an CD4 + -T-Zellen ist jedoch mit verzögerter SARS-CoV-2-Viruselimination und einem schweren Verlauf assoziiert 103 . In einer großen Fallserie mit mehr als 15 000 Patientenjahren (PJ) (4800 PJ mit Thiopurinen, 3000 PJ mit Anti-TNF-Therapie) zeigten sich 31 Fälle schwerer viraler Infektionen (EBV, CMV, VZV und HZV), davon die meisten bei Patienten mit einer Thiopurintherapie 45 , sodass bei manifester COVID-19-Erkrankung ein Stopp der Therapie mit Thiopurinen, Tofacitinib und Methotrexat begründet sein mag 33 104 . Ein erneuter Therapiebeginn wäre nach 2 negativen SARS-CoV-2-PCR-Tests aus dem Nasen-Rachen-Abstrich und Besserung der klinischen Symptomatik der COVID-19-Erkrankung möglich. Für MTX liegen keine spezifischen Daten für eine SARS-CoV-2-Infektion vor. Ein erneuter Therapiebeginn wäre nach 2 negativen SARS-CoV-2-PCR-Tests aus dem Rachenabstrich möglich.
Tofacitinib stellt als JAK-1/-3-Inhibitor im Gegensatz zu JAK-2-Inhibitoren, die möglicherweise den Viruseintritt hemmen und den Th17-vermittelten Zytokinsturm dämpfen 105 , keinen unmittelbaren therapeutischen Ansatz zur Behandlung des Zytokinsturms bei der COVID-19-Erkrankung dar. Die Therapie mit Tofacitinib geht mit gehäuften viralen Infektionen (VZV) einher 106 . In-vitro-Studien zeigen, dass Tofacitinib die Produktion von Interferon- α hemmt 107 , ein Phänomen, das in der ersten Phase der Immunantwort eher ungünstig ist 108 . Aufgrund der kurzen Halbwertszeit sind deshalb ein Absetzen und ggf. der Wiederbeginn nach Ausheilung der COVID-19-Erkrankung sowie nach 2 negativen SARS-CoV-2-PCR-Untersuchungen sinnvoll. Wie oben schon ausgeführt, werden insbesondere JAK-2-Inhibitoren zur Therapie des Hyperinflammationsyndroms bei schwerer COVID-Erkrankung eingesetzt 109 110 ; diese Konzepte sind aber von der Wirkung von Tofacitinib abzugrenzen.
Wie bereits in Leitlinien empfohlen 111 , sollte bei Erreichen einer stabilen Remission über mindestens sechs Monate 112 (klinische Remission CDAI < 150 bei Morbus Crohn oder Mayo Score < 3 bei Colitis ulcerosa mit endoskopischem Subscore 0 oder 1, kein rektaler Blutabgang, fäkales Calprotectin < 250 μg/g Stuhl, zusätzlich CRP normwertig) unter einer kombinierten Therapie mit Azathioprin und Infliximab Azathioprin abgesetzt werden. In den der Cochrane-Metaanalyse 113 zugrunde liegenden Studien 112 114 waren die Rückfallraten nach Umstellung auf eine Infliximab-Monotherapie nicht unterschiedlich (48 % Kombinationstherapie vs. 49 % Monotherapie, RR: 1,02; 95 %-KI: 0,68–1,52). Dennoch konnte für diese Empfehlung nur eine mehrheitliche Zustimmung mit 76 % erreicht werden. Der positive Effekt von Azathioprin auf die Bildung von Autoantikörpern gegen Infliximab, individuelle Besonderheiten in der Vorgeschichte des Patienten (z. B. ein schwerer Verlauf, der nur durch eine COMBO-Therapie in eine Remission überführt werden konnte), wurden als Argumente gegen diese Empfehlung genannt.
Um die möglicherweise risikoreiche hochdosierte systemische Steroidtherapie zu umgehen, bietet sich der Einsatz eines schnell wirksamen Biologikums an. Die Analyse von TNF-Spiegeln bei COVID-19-Patienten zeigte unterschiedliche Ergebnisse: In einer Studie wurden keine erhöhten TNF-Spiegel bei schweren Verläufen gemessen, obwohl andere proinflammatorische Zytokine erhöht waren 115 . In einer weiteren Studie zeigte sich hingegen, dass COVID-19-Patienten auf der Intensivstation höhere TNF-Serumspiegel aufweisen als solche, die auf einer Normalstation behandelt werden konnten. TNF könnte pathogene Effekte bei COVID-19 potenzieren, da es die ACE2-Expression erhöht und eine Lymphozytopenie verstärken kann 116 . Diese Argumente einschließlich einer möglichen Suppression des Zytokinsturms und der rasche Wirkeintritt sprechen für einen Einsatz von Anti-TNF-Medikamenten im Fall eines Schubs bei gleichzeitiger Vermeidung hochdosierter systemischer Steroide. Für Vedolizumab 117 und Ustekinumab konnte bei CED-Patienten keine erhöhte Rate viraler Infektionen beobachtet werden. Es wird spekuliert, dass die Il-23-Blockade durch Ustekinumab bei COVID-19 die pathogene Th17-Antwort im Rahmen eines Zytokinsturms unterdrückt 94 . Wie oben angeführt, weist das IO IBD-Register für Patienten mit einer systemischen Steroidtherapie die höchste Mortalität im Vergleich zu Patienten aus, die mit Biologika behandelt werden.
Die sicherste Therapievariante für SARS-CoV-2-negative Patienten unter einem intravenösen Therapieregime ist die Etablierung eines Non-COVID-19-Infusionsbereichs. In diesem Rahmen können Infusionen unter Berücksichtigung der dafür vorgeschriebenen Hygienemaßnahmen hinreichend sicher durchgeführt werden. Vor Betreten eines solchen Non-COVID-19-Infusionsbereichs ist sicherzustellen, dass bei den Patienten keine Krankheitssymptome vorliegen und ein chirurgischer Mund-Nasen-Schutz gestellt werden kann. Der Abstand zwischen den einzelnen Infusionsplätzen soll 2 m betragen. Die Wartezeit auf die Infusion soll minimal gehalten werden. Die Zubereitung der Infusion kann am Infusionstag nach telefonischem Kontakt mit Sicherstellung der Symptomfreiheit vorbereitet werden und dann rasch verabreicht werden. Eine Infusionsdauer von 60 Minuten bei Infliximab erscheint bei Erwachsenen und Kindern sicher 118 119 120 . Bis zur Zulassung einer s. c. Formulierung für IFX wäre eine Umstellung in der CED-Therapie ein Off-Label-Gebrauch, der nicht zu empfehlen ist.
Es liegen nur begrenzte Daten vor, die eine sichere Verlängerung der Infusionsintervalle unterstützen. So ist eine Verlängerung des Infliximab-Infusionsintervalls auf 10 Wochen bei Patienten in stabiler Remission 99 möglich. Dies gilt nicht für Patienten mit verkürztem Infusionsintervall und/oder erhöhter Dosis pro Infusion. Eine stabile Remission sollte jedoch keinesfalls durch eine weitere Verlängerung der Infusionsintervalle bei SARS-CoV-2-negativen Patienten riskiert werden. Daten aus China und Südkorea bei pädiatrischen CED-Patienten belegen, dass bei Verlängerung des Intervalls zwischen Infliximab-Infusionen aus Sorge vor einer Infektion eine Exazerbation ihrer CED bei 20 % der Patienten auftrat 30 . Möglicherweise ist bei einem Nachweis hochnormaler Infliximab-Talspiegel eine Verlängerung in Ausnahmefällen möglich; dafür wäre die Bestimmung von Talspiegeln vor den Infusionen sinnvoll, um keinen unerwünschten Wirkverlust zu provozieren. Die Steuerung der Therapie mit Vedolizumab mithilfe von Talspiegeln ist in der klinischen Praxis nicht etabliert. In stabiler Remission im 4-Wochen-Intervall können Vedolizumab-Infusionen auf längere Intervalle bis hin zu 8-Wochen-Intervallen ausgedehnt werden. Darüber hinaus wird durch die Marktzulassung ab Juni 2020 eine Umstellung auf eine s. c. Formulierung von Vedolizumab möglich sein 121 .
Sollte die Gabe der o. g. Medikamente in die Phase einer schweren COVID-19-Erkrankung fallen, kann die Applikation um 14 Tage verschoben werden und nach Ausheilung der Erkrankung sowie nach 2 negativen SARS-CoV-2-PCR-Tests wieder aufgenommen werden. Diese Empfehlung trägt den bekanntermaßen teilweise langen Halbwertszeiten keine Rechnung. Die bisherigen Daten der Secure-IBD-Studie ergeben bisher auch keine Hinweise auf ein erhöhtes Risiko eines ungünstigen Verlaufs einer COVID-19-Erkrankung (Intensivbehandlung, Mortalität) unter einer Therapie mit TNF-Antikörpern, Ustekinumab und Vedolizumab. TNF-Antikörper könnten sogar möglicherweise eine Verminderung des pulmonalen Organschadens bewirken 94 . Dieser Effekt wird vermutlich durch ein verringertes „Shedding“ der ACE2-Ektodomäne ausgelöst, das über TNFα-Converting-Enzyme vermittelt wird. Die ACE2-Ektodomänen spielen eine wesentliche Rolle für das Eindringen von SARS-CoV-2 in die Zellen. Da hohe IFN-γ- und TNF-α-Spiegel mit schweren Verläufen einer SARS-CoV-Infektion assoziiert sind, wird eine Blockade von TNF als mögliche Option zur Behandlung dieses Zytokin-Release-Syndroms bei einigen Patienten postuliert 94 .
3.2 Chirurgische Therapie
In vielen Krankenhäusern sind Non-COVID-19-Operationssäle etabliert worden, sodass sich die zunächst vorgeschriebene Reduktion der Operationen auf lebensbedrohliche Situationen bereits deutlich entspannt. Die Indikation zur Operation sollte engmaschig in interdisziplinären Teams besprochen werden. Es sollte insbesondere dann eine Verschiebung der Operation kritisch evaluiert werden, wenn infolge der Verzögerung eine erhöhte Komplikationsrate droht.
Sollte bei isoliertem, kurzstreckigem Befall des terminalen Ileums bei Morbus Crohn eine Budesonid-Therapie nicht ausreichend wirksam sein, ist bei Vorliegen obstruktiver Symptome eine vorübergehende ausschließliche enterale Ernährungstherapie zu erwägen (siehe Empfehlungen zur Ernährung). Bei Kindern und Jugendlichen ist sie in dieser Situation die erste Wahl 122 . Bei der ECCO 2020 wurde die Nachbeobachtungsstudie der Lir!c-Studie vorgestellt. Darin wurde nach 5 Jahren Beobachtungszeitraum ein Vorteil zugunsten einer Resektion des terminalen Ileums im Vergleich zu einer Anti-TNF-Therapie bei Patienten gesehen, die als Vortherapie lediglich Immunmodulatoren erhalten hatten 123 . Die bereits publizierten 4-Jahresdaten hatten diesen Unterschied zunächst nicht gezeigt 124 .
In dieser Situation sollte gemeinsam mit dem Patienten die Option einer Proktokolektomie gegen das Potenzial der in dieser Situation grundsätzlich wirksamen Medikamente (Infliximab, Calcineurininhibitoren als Bridging-Therapie zu Vedolizumab) diskutiert und eine gemeinsame Entscheidung auch unter Berücksichtigung des Infektionsrisikos mit SARS-CoV-2 während des stationären Aufenthalts herbeigeführt werden.
Kapitel 4: Adjuvante Therapie und besondere Fragestellungen
Impfung
Die Impfung gegen Influenza und Pneumokokken schützt nicht vor SARS-CoV-2 selbst, minimiert aber die Gefahr von Doppelinfektionen. Daher ist ein vollständiger Impfschutz nach STIKO-Empfehlungen für alle, aber insbesondere für Risikopersonen wie Senioren und Personen mit schweren Vorerkrankungen wichtig 125 . Das gilt unabhängig von einer aktuellen oder geplanten immunmodulatorischen Therapie von CED-Patienten.
Die Impfung gegen Influenza schützt vor schwer verlaufenden Grippe-Infektionen, z. B. einer Pneumonie, die eine Versorgung der Patienten in einem Krankenhaus oder auf einer Intensivstation erforderlich machen. Die jährliche Impfung ist die wichtigste Präventionsmaßnahme gegen Influenza überhaupt und kann somit auch das Risiko für eine möglicherweise besonders schwer verlaufende Doppelinfektion mit dem Coronavirus reduzieren und die Wahrscheinlichkeit einer stationären Intensivbehandlung senken (RKI) 125 .
Es gibt keine Hinweise darauf, dass die Auseinandersetzung des Immunsystems mit dem SARS-CoV-2 durch eine in zeitlicher Nähe verabreichte Impfung beeinflusst wird. Durch Impfungen wird der Impfling vor Infektionen geschützt, die ihn auch während der Pandemie zusätzlich gefährden oder schädigen können 125 .
Das RKI empfiehlt, dass ausstehende Impfungen sofort durchgeführt werden, wenn ein Patient bereits in der Praxis ist. Insbesondere Patienten, die zu einer Risikogruppe für einen schweren Verlauf von COVID-19 gehören, sollten jedoch zurzeit nicht mit dem öffentlichen Personennahverkehr fahren und nicht in einem Wartezimmer mit weiteren Personen sitzen, um eine Impfung wahrzunehmen. Oberste Priorität hat im Moment die Kontaktreduzierung. Diese schützt nicht nur vor SARS-CoV-2-Infektionen, sondern auch vor der Übertragung anderer Infektionserkrankungen. Es kann daher individuell sinnvoll sein, Impfungen zu verschieben (Empfehlungen der Ständigen Impfkommission) 125 .
Studien
Interventionelle Studien, vor allem Zulassungsstudien stellen, für viele Patienten die einzige verbliebene Behandlungsmöglichkeit dar 126 . Das Ziel der steroidfreien Remission sollte auch in der SARS-CoV-2-Pandemie nicht verlassen werden. Insbesondere die für einige Patienten ansonsten anstehende langfristige und in Zeiten der SARS-CoV-2-Pandemie besonders risikoreiche Steroidtherapie 44 sollte unbedingt vermieden werden und es sollte explizit auch in der Pandemiezeit ein Studieneinschluss erwogen werden.
Der Wirkmechanismus des angewandten Präparats sollte auf Einschränkung der viralen Abwehr geprüft werden und ggfs. eine alternative Therapiemöglichkeit erwogen werden. Weiterhin kann der Wirkmechanismus des zu prüfenden Präparats zu einer Präferenz einer Studie gegenüber konkurrierenden Studien führen. Selbstverständlich sollten Studien unter den üblichen Schutzmaßnahmen durchgeführt werden.
Studien, in die bereits Patienten eingeschlossen worden sind, sollten nicht abgebrochen werden. Die Gründe sind die gleichen wie bei dem Einschluss in eine Studie. Bei Risikopatienten und Patienten in Studien mit einer Prüfsubstanz, die die virale Abwehr stark beeinträchtigt, sollte individuell das Fortsetzen der Studie abgewogen werden.
Nichtinterventionelle Beobachtungsstudien führen definitionsgemäß nicht zu vermehrtem Kontakt des Patienten mit dem Studienzentrum und können daher weiterhin durchgeführt werden. Sollte ein durch SARS-CoV-2 veränderter Verlaufsbeobachtungsmodus erfolgen, soll dieser in der Beobachtungsstudie dokumentiert und der Studienleitung mitgeteilt werden. Sollte der veränderte Verlaufsbeobachtungsmodus das primäre Studienziel beeinflussen, z. B. durch während der SARS-CoV-2-Pandemie erfolgte Telemedizin-Visiten, bei denen keine körperliche Untersuchung in das Studienergebnis einfließt, muss dies von der Studienleitung berücksichtigt werden. Maßnahmen wie Protokolländerungen, neue Fallzahlkalkulation oder Rekrutierungspause sollten dann von der Studienleitung erwogen werden.
Thromboembolische Ereignisse
CED-Patienten haben im akuten Schub ein erhöhtes Risiko für thromboembolische Komplikationen 127 . Sie sollten daher entsprechend u. a. den gültigen DGVS-Leitlinien eine Thromboseprophylaxe erhalten 4 128 129 .
Bei Patienten mit schwerer COVID-19 wurde gehäuft über eine Hyperkoagulopathie mit Nachweis peripherer und zentraler Lungenembolien berichtet. Auch der Nachweis von Antiphospholipid-Antikörpern und multiple Infarkte wurden beschrieben. Dabei finden sich erhöhte D-Dimer-Spiegel, deren Anstieg im Krankheitsverlauf mit einer ungünstigen Krankheitsprognose verbunden ist 130 . Während eines schweren COVID-19-Verlaufs finden sich häufig auch eine aPTT-Verlängerung, ein vermehrter Anfall von Fibrinspaltprodukten und eine schwere Thrombozytopenie, die zu einer lebensbedrohlichen disseminierten intravasalen Koagulopathie (DIC) führen kann 130 131 .
Daher sollte die Indikation zur Einleitung einer pharmakologischen Thromboseprophylaxe mit niedermolekularem Heparin bei stationären COVID-19-Patienten (nicht nur bei CED) umgehend und bei ambulanten CED-Patienten großzügig entsprechend ihrem individuellen Risikoprofil und der Begleitmedikation gestellt werden 132 . Zu welchem Zeitpunkt bei einem schwer an COVID-19 erkrankten Patienten eine therapeutische Antikoagulation indiziert ist, muss im Rahmen des gesamten intensivmedizinischen Zusammenhangs entschieden werden und ist wahrscheinlich unabhängig von einer bestehenden CED.
Ernährung
Eine Mangelernährung verstärkt eine medikamentös und krankheitsbedingt induzierte Immundefizienz 133 . Eine Mangelernährung ist ein unabhängiger Risikofaktor für das Auftreten von Komplikationen der CED und ungünstiger postoperativer Krankheitsverläufe 134 135 . Daher sind die Prävention und die Behandlung der Malnutrition obligatorische Bestandteile der Therapie chronisch entzündlicher Darmerkrankungen (DGVS Leitlinie).
Patienten mit aktiver CED haben im Vergleich zu gesunden Kontrollen eine höhere Prävalenz von Unterernährung. Die Leitlinien der DGVS zur Therapie des M. Crohn und der Colitis ulcerosa empfehlen daher, dass ein weiteres Screening stattfindet, wenn klinische Zeichen oder ein erhöhtes Risiko für eine Unterernährung oder einen Mangel an Nährstoffen vorliegen. Entsprechend des Ernährungszustands oder des Mangels an Mikronährstoffen soll dann ein Ausgleich stattfinden 136 .
Auch wenn die Datenlage unbefriedigend ist, konnten die bisher durchgeführten Untersuchungen zeigen, dass der Ernährungsstatus des Wirts einen unabhängigen Risikofaktor für den Erkrankungsverlauf darstellt 137 . Diese aus der SARS- und der HIV-Infektion bekannten Daten zeigen, dass Patienten mit einem unzureichenden Ernährungszustand eine schlechtere Prognose haben. Wenn auch bisher zu diesem Thema bezüglich COVID-19 und Mangelernährung noch keine eindeutigen Daten vorliegen 138 139 , ist davon auszugehen, dass auch bei dieser Erkrankung ein unzureichender Ernährungszustand oder ein Mangel an Mikronährstoffen mit einem ungünstigeren Krankheitsverlauf verbunden sind.
Footnotes
Interessenkonflikt Siehe Anhang
Contributor Information
Autoren:
Andreas Stallmach, Andreas Sturm, Irina Blumenstein, Ulf Helwig, Sibylle Koletzko, Petra Lynen, Carsten Schmidt, Axel Dignaß, and Torsten Kucharzik
Collaborators::
K. Aden, T. Andus, R. Atreya, F. Autschbach, O. Bachmann, D. Bettenworth, U. Böcker, B. Bokemeyer, T. Brechmann, P. Bufler, J. Büning, J. Däbritz de Laffolie, R. Ehehalt, Ph. Esters, K. Fellermann, St. Fichtner-Feigl, M. Götz, C. Gross, F. Hartmann, P. Hartmann, W. Häuser, K. Herrlinger, J. C. Hoffmann, S. In der Smitten, B. Kaltz, L. Kanbach, K. Kannengießer, K.-M. Keller, P. Kienle, J. Klaus, M. Kreis, A.-J. Kroesen, W. Kruis, T. Kühbacher, J. Langhorst, L. Leifeld, A. Lügering, Ch. Maaser, H. Matthes, G. Moog, J. H. Niess, J. Ockenga, C. Ott, A. Pace, J. Preiß, M. Reinshagen, E. Rijcken, E. Schnoy, A. Schreyer, B. Siegmund, E. F. Stange, J. Stein, N. Teich, A. Thomann, Ch. Treese, C. Veltkamp, J. Walldorf, S. Zeißig, and J. Zemke
Empfehlung 1.
In dieser S2k-Leitlinie besteht insgesamt eine nur schwache Evidenz für die Empfehlungen. Handlungsempfehlungen basieren meist auf persönlichen Erfahrungen, Daten aus publizierten Fallserien und Registern sowie Analogieschlüssen zu anderen Krankheitsbildern. Notwendige Entscheidungen zur Anpassung der Therapie (medikamentös oder operativ) sollten somit immer der aktuellen Datenlage angepasst werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: starker Konsens (98 %)
Empfehlung 1.1.
Patienten mit einer CED haben generell kein erhöhtes Risiko für eine Infektion mit SARS-CoV-2. Dennoch sollten Patienten sorgfältig individuelle Schutzmaßnahmen ergreifen.
Empfehlungsgrad: EL5/Zustimmungsgrad: starker Konsens (95 %)
Empfehlung 1.2.
Patienten mit einer CED und einer immunsuppressiven Therapie haben ein erhöhtes Risiko für eine SARS-CoV-2-Infektion und sollten deshalb sorgfältig individuelle Schutzmaßnahmen umsetzen. Der Grad der Risikoerhöhung scheint dabei für einzelne Immunsuppressiva unterschiedlich zu sein.
Empfehlungsgrad EL5/Zustimmungsgrad: Konsens (86 %)
Empfehlung 1.3.
Patienten mit einer CED und einer SARS-CoV-2-Infektion haben unter bestimmten Bedingungen (Komorbiditäten/Risikofaktoren) ein erhöhtes Risiko für einen schweren Verlauf der COVID-19-Erkrankung. Diese Patienten sollten sorgfältig bezüglich einer raschen Verschlechterung ihrer Erkrankung überwacht werden.
Empfehlungsgrad: EL4/Zustimmungsgrad: Konsens (93 %)
Empfehlung 1.4.
Bei Patienten mit einer CED und einer immunsuppressiven Therapie, die in Berufen mit einer hohen Zahl sozialer Kontakte zu Menschen mit unbekanntem Risiko für eine SARS-CoV-2-Infektion oder gesicherter COVID-19-Erkrankung arbeiten (z. B. Personen, die im Gesundheitssystem arbeiten), kann ein Wechsel des Arbeitsplatzes vorgenommen werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (84 %)
Empfehlung 2.1.
Während der Pandemie sollten Patientenvorstellungen in Einrichtungen des Gesundheitswesens restriktiv erfolgen. CED-Sprechstunden sollten unter Berücksichtigung der Dringlichkeit der Vorstellung und unter Optimierung der Infektionsschutzmaßnahmen wie räumlicher Distanzierung und nach Ausnutzen von Möglichkeiten der Telemedizin fortgeführt werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (86 %)
Empfehlung 2.2.
Während der Pandemie sollten sämtliche endoskopischen Untersuchungen unter besonderen Schutzmaßnahmen stattfinden. Das Ausmaß der Schutzmaßnahmen sollte risikoadaptiert bestimmt werden.
Empfehlungsgrad: EL5/ Zustimmungsgrad: starker Konsens (98 %)
Empfehlung 2.3.
Eine SARS-CoV-2-Antikörpertestung kann ein besseres Patientenmanagement ermöglichen. Die Testung birgt zum jetzigen Zeitpunkt jedoch noch Probleme in der Verfügbarkeit und im sicheren Nachweis einer Immunität.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (86 %)
Empfehlung 3.1.
Patienten mit einer CED und einer immunsuppressiven Therapie haben generell kein erhöhtes Risiko für einen schweren Verlauf einer SARS-CoV-2-Infektion. Eine immunsuppressive Therapie sollte deshalb bei einer leichten bis moderaten COVID-19-Erkrankung nicht reduziert werden. Ausnahmen bilden die längerdauernde Therapie mit systemischen Steroiden insbesondere in Dosierungen größer 20 mg Prednisonäquivalent/Tag. Diese sollte daher möglichst vermieden oder, soweit klinisch vertretbar, reduziert und beendet werden.
Empfehlungsgrad: EL3/Zustimmungsgrad: Konsens (84 %)
Empfehlung 3.2.
Bei Patienten mit schwerer COVID-19-Erkrankung sollte die Therapie mit Thiopurinen, Methotrexat und Tofacitinib pausiert und nach Überwinden der Infektion wieder aufgenommen werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (94 %)
Empfehlung 3.3.
Bei Patienten in stabiler Remission unter kombinierter Anti-TNF-Antikörper-/immunsuppressiver Therapie (Thiopurin, MTX) sollte das Immunsuppressivum abgesetzt werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: mehrheitliche Zustimmung: (73 %)
Empfehlung 3.4.
Während der SARS-CoV-2-Pandemie sollte eine Biologikatherapie mit zu erwartendem raschem Wirkeintritt gegenüber einer hochdosierten systemischen Steroidtherapie im akuten Schub bevorzugt eingesetzt werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (85 %)
Empfehlung 3.5.
Eine Umstellung einer intravenösen Infliximab-Therapie auf ein subkutanes Therapiekonzept mit alternativen Biologika bei Patienten in Remission unter Infliximab sollte nicht erfolgen.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (88 %)
Empfehlung 3.6.
Bei Neueinstellungen einer Biologikatherapie sollte bei gleichwertiger Erfolgsaussicht eine s. c. Formulierung eingesetzt werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (80 %)
Empfehlung 3.7.
Eine Verlängerung der Infusionsintervalle für TNF-Antikörper oder Vedolizumab sollte nicht erfolgen.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (91 %)
Empfehlung 3.8.
Bei Patienten mit nachgewiesener COVID-19-Erkrankung kann die Therapie mit TNF-Antikörpern, Ustekinumab und Vedolizumab im Einzelfall pausiert werden und nach Überwinden der Infektion wieder aufgenommen werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (86 %)
Empfehlung 3.9.
Dringliche und notfallmäßige Operationen sollen in Zeiten der SARS-CoV-2-Pandemie unter adäquaten Schutzmaßnahmen durchgeführt werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: starker Konsens (98 %)
Empfehlung 3.10.
Bei Patienten mit isoliertem, kurzstreckigem Befall des terminalen Ileums bei Morbus Crohn kann eine primäre Resektion vs. eine Steroidstoßtherapie oder eine Biologikatherapie unabhängig von einer möglichen SARS-CoV-2-Infektion zur Remissionsinduktion erwogen werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (84 %)
Empfehlung 3.11.
Bei Patienten mit akuter, schwerer, steroidrefraktärer Colitis ulcerosa soll in der SARS-CoV-1-Pandemie eine frühzeitige Proktokolektomie sorgfältig gegen eine Fortführung der medikamentösen Therapiestrategie abgewogen werden.
Empfehlungsgrad EL5/Zustimmungsgrad: Konsens (78 %)
Empfehlung 4.1.
Nicht immunisierte CED-Patienten sollten zum Schutz vor einer zusätzlichen Atemwegsinfektion gegen Influenza und Pneumokokken geimpft werden.
Empfehlungsgrad: EL 4 /Zustimmungsgrad: starker Konsens (97 %)
Empfehlung 4.2.
Während der SARS-CoV-2-Pandemie sollte der Einschluss in Interventionsstudien nach Alternativtherapien, Schweregrad der Erkrankung und potenzieller Schwächung der viralen Abwehr geprüft werden. In Studien eingeschlossene Patienten können weitergeführt werden. In Einzelfällen kann bei Risikopatienten und gemäß Wirkmechanismus der Studienmedikation mit Einschränkung der viralen Abwehr ein Abbruch erwogen werden. Nichtinterventionelle Beobachtungsstudien führen definitionsgemäß nicht zu vermehrtem Kontakt des Patienten mit dem Studienzentrum. Sollte ein durch SARS-CoV-2 veränderter Verlaufsbeobachtungsmodus erfolgen, sollte dies in der Beobachtungsstudie dokumentiert werden.
Empfehlungsgrad: EL5/Zustimmungsgrad: Konsens (93 %)
Empfehlung 4.3.
Hospitalisierte Patienten mit einer CED und COVID-19-Erkrankung sollten mindestens eine Thromboseprophylaxe erhalten. Bei ambulanten, an COVID-19 erkrankten CED-Patienten sollte entsprechend ihrem individuellen Risikoprofil und ihrer Begleitmedikation die Entscheidung für eine Thromboseprophylaxe großzügig getroffen werden.
Empfehlungsgrad: EL 3/Zustimmungsgrad: starker Konsens (95 %)
Empfehlung 4.4.
Der Ernährungsstatus von CED-Patienten sollte regelmäßig überwacht und Mangelzustände sollten ausgeglichen werden.
Empfehlungsgrad: EL 5/Zustimmungsgrad: starker Konsens (96 %)
Supplement
Literatur
- 1.Ghebreyesus T A.WHO Director-General's opening remarks at the media briefing on COVID-19–11 March 2020In.2020https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020
- 2.Burisch J, Kiudelis G, Kupcinskas L et al. Natural disease course of Crohn’s disease during the first 5 years after diagnosis in a European population-based inception cohort: an Epi-IBD study. Gut. 2018 doi: 10.1136/gutjnl-2017-315568. [DOI] [PubMed] [Google Scholar]
- 3.Burisch J, Katsanos K H, Christodoulou D K.Natural Disease Course of Ulcerative Colitis During the First Five Years of Follow-up in a European Population-based Inception Cohort-An Epi-IBD Study J Crohns Colitis 201913198–208.. doi:10.1093/ecco-jcc/jjy154 [DOI] [PubMed] [Google Scholar]
- 4.Kucharzik T, Dignass A U, Atreya R et al. Updated S3-Guideline Ulcerative Colitis. German Society for Digestive and Metabolic Diseases (DGVS) Z Gastroenterol. 2019;57:162–241. doi: 10.1055/a-0824-0861. [DOI] [PubMed] [Google Scholar]
- 5.Evidence OCfE-bMLo 2020http://www.cebm.net/index.aspx?o=1025, letzter Aufruf: 26.04.2020.
- 6.Novel Coronavirus Pneumonia Emergency Response Epidemiology T [The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China] Zhonghua Liu Xing Bing Xue Za Zhi 202041145–151.. doi:10.3760/cma.j.issn.0254-6450.2020.02.00332064853 [Google Scholar]
- 7.Deng S Q, Peng H J. Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China. J Clin Med. 2020;9 doi: 10.3390/jcm9020575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.RKI 2020https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Fallzahlen.htmlletzter Aufruf am 16.05.2020.
- 9.WHO Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19)In.2020https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- 10.Jin X, Lian J S, Hu J H et al. Epidemiological, clinical and virological characteristics of 74 cases of coronavirus-infected disease 2019 (COVID-19) with gastrointestinal symptoms. Gut. 2020 doi: 10.1136/gutjnl-2020-320926. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Rodriguez-Lago I, Ramirez de la Piscina P, Elorza A et al. Characteristics and prognosis of patients with inflammatory bowel disease during the SARS-CoV-2 pandemic in the Basque Country (Spain) Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.04.043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.IOIBD 2020https://covidibd.org/; letzter Aufruf am 12.05.2020
- 13.Carvalho A, Alqusairi R, Adams A et al. SARS-CoV-2 Gastrointestinal Infection Causing Hemorrhagic Colitis: Implications for Detection and Transmission of COVID-19 Disease. The American journal of gastroenterology. 2020 doi: 10.14309/ajg.0000000000000667. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Chen L, Lou J, Bai Y.COVID-19 Disease With Positive Fecal and Negative Pharyngeal and Sputum Viral Tests The American journal of gastroenterology 2020115790. doi:10.14309/ajg.0000000000000610 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Gu J, Han B, Wang J.COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission Gastroenterology 20201581518–1519.. doi:10.1053/j.gastro.2020.02.054 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Chen N, Zhou M, Dong X.Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study Lancet 2020395507–513.. doi:10.1016/S0140-6736(20)30211-7 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Guan W J, Ni Z Y, Hu Y et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020 doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Wu J, Liu J, Zhao X et al. Clinical Characteristics of Imported Cases of COVID-19 in Jiangsu Province: A Multicenter Descriptive Study. Clin Infect Dis. 2020 doi: 10.1093/cid/ciaa199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Dreher M, Kersten A, Bickenbach J.Charakteristik von 50 hospitalisierten COVID-19-Patienten mit und ohne ARDS Dtsch Arztebl Int 2020117271–278.. doi:10.3238/arztebl.2020.0271 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.ECDC . Coronavirus disease 2019 (COVID-19) in the EU/EEA and the UK- ninth update. 2020.
- 21.RKI 2020https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Steckbrief.htmlletzter Aufruf am 15.05.2020
- 22.Grunert P C, Reuken P A, Stallhofer J IBD in the COVID-19 pandemic – the patients’ perspective. 2020. [DOI] [PMC free article] [PubMed]
- 23.Mao R, Liang J, Shen J.Implications of COVID-19 for patients with pre-existing digestive diseases Lancet Gastroenterol Hepatol 20205426–428.. doi:10.1016/S2468-1253(20)30076-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Norsa L, Indriolo A, Sansotta N et al. Uneventful course in IBD patients during SARS-CoV-2 outbreak in northern Italy. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.03.062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Taxonera C, Sagastagoitia I, Alba C et al. 2019 Novel Coronavirus Disease (COVID-19) in patients with Inflammatory Bowel Diseases. Alimentary pharmacology & therapeutics. 2020 doi: 10.1111/apt.15804. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Allocca M, Fiorino G, Zallot C et al. Incidence and patterns of COVID-19 among inflammatory bowel disease patients from the Nancy and Milan cohorts. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association. 2020 doi: 10.1016/j.cgh.2020.04.071. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Lavezzo E, Franchin E, Ciavarella C et al. Suppression of COVID-19 outbreak in the municipality of Vo, Italy. medRxiv. 2020 doi: 10.1101/2020.04.17.20053157. [DOI] [Google Scholar]
- 28.Gudbjartsson D F, Helgason A, Jonsson H et al. Spread of SARS-CoV-2 in the Icelandic Population. N Engl J Med. 2020 doi: 10.1056/NEJMoa2006100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Armann J PDN, Simon A, Doenhardt M.Hospital admission in children and adolescents with COVID-19 — early results from a national survey conducted by the German Society for Pediatric Infectious Diseases (DGPI) Dtsch Arztebl Int 2020117373–374.. doi:10.3238/arztebl.2020.0373 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Turner D, Huang Y, Martin-de-Carpi J et al. COVID-19 and Paediatric Inflammatory Bowel Diseases: Global Experience and Provisional Guidance (March 2020) from the Paediatric IBD Porto group of ESPGHAN. J Pediatr Gastroenterol Nutr. 2020 doi: 10.1097/mpg.0000000000002729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Tinsley A, Navabi S, Williams E D et al. Increased Risk of Influenza and Influenza-Related Complications Among 140,480 Patients With Inflammatory Bowel Disease. Inflamm Bowel Dis. 2018 doi: 10.1093/ibd/izy243. [DOI] [PubMed] [Google Scholar]
- 32.Ko M K, Ng S C, Mak L Y.Infection-related hospitalizations in the first year after inflammatory bowel disease diagnosis Journal of digestive diseases 201617610–617.. doi:10.1111/1751-2980.12397 [DOI] [PubMed] [Google Scholar]
- 33.Magro F RJ-F, Abeu C, McMahon E.Inflammatory bowel disease management during the COVID-19 outbreak: The 10 do’s and don’ts from the ECCO-COVID TaskforceJ Crohns Colitis2020 [DOI] [PMC free article] [PubMed]
- 34.Pin An M J, Haixia R, Juan S.Protection of 318 Inflammatory Bowel Disease Patients from the Outbreak and Rapid Spread of COVID-19 Infection in Wuhan, China The Lancet 2020. ePub ahead of print 10.2139/ssrn.3543590 [DOI] [Google Scholar]
- 35.Bin Abdulrahman A K, Bin Abdulrahman K A, Almadi M K.Do various personal hygiene habits protect us against influenza-like illness? BMC Public Health 2019191324. doi:10.1186/s12889-019-7726-9 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Cheng H Y, Jian S W, Liu D P et al. Contact Tracing Assessment of COVID-19 Transmission Dynamics in Taiwan and Risk at Different Exposure Periods Before and After Symptom Onset. JAMA internal medicine. 2020 doi: 10.1001/jamainternmed.2020.2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Wölfel R, Corman V M, Guggemos W et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020 doi: 10.1038/s41586-020-2196-x. [DOI] [PubMed] [Google Scholar]
- 38.Ng K, Poon B H, Kiat Puar T H et al. COVID-19 and the Risk to Health Care Workers: A Case Report. Ann Intern Med. 2020 doi: 10.7326/L20-0175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Zabana Y, Rodriguez L, Lobaton T.Relevant Infections in Inflammatory Bowel Disease, and Their Relationship With Immunosuppressive Therapy and Their Effects on Disease Mortality Journal of Crohn’s & colitis 201913828–837.. doi:10.1093/ecco-jcc/jjz013 [DOI] [PubMed] [Google Scholar]
- 40.Damiani G, Pacifico A, Bragazzi N L.Biologics increase the risk of SARS-CoV-2 infection and hospitalization, but not ICU admission and death: Real-life data from a large cohort during red-zone declaration Dermatol Ther 2020e13475. doi:10.1111/dth.13475 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Long M D, Martin C, Sandler R S.Increased risk of pneumonia among patients with inflammatory bowel disease The American journal of gastroenterology 2013108240–248.. doi:10.1038/ajg.2012.406 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Orlicka K, Barnes E, Culver E L.Prevention of infection caused by immunosuppressive drugs in gastroenterology Therapeutic advances in chronic disease 20134167–185.. doi:10.1177/2040622313485275 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Dorrington A M, Selinger C P, Parkes G C et al. The historical role and contemporary use of corticosteroids in inflammatory bowel disease. J Crohns Colitis. 2020 doi: 10.1093/ecco-jcc/jjaa053. [DOI] [PubMed] [Google Scholar]
- 44.Lichtenstein G R, Feagan B G, Cohen R D.Serious infection and mortality in patients with Crohn's disease: more than 5 years of follow-up in the TREAT registry The American journal of gastroenterology 20121071409–1422.. doi:10.1038/ajg.2012.218 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Wisniewski A KJ, Seksik P, Landman C et al. the Saint-Antoine IBD network, Collaborators Saint Antoine IBD Network. Increased incidence of systemic serious viral infections in patients with inflammatory bowel disease associates with active disease and use of thiopurine. United European Gastroenterology Journal. 2020;8(03):303–313. doi: 10.1177/2050640619889763. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Seksik P, Cosnes J, Sokol H.Incidence of benign upper respiratory tract infections, HSV and HPV cutaneous infections in inflammatory bowel disease patients treated with azathioprine Alimentary pharmacology & therapeutics 2009291106–1113.. doi:10.1111/j.1365-2036.2009.03973.x [DOI] [PubMed] [Google Scholar]
- 47.Kirchgesner J, Lemaitre M, Carrat F.Risk of Serious and Opportunistic Infections Associated With Treatment of Inflammatory Bowel Diseases Gastroenterology 2018155337–INF.. doi:10.1053/j.gastro.2018.04.012 [DOI] [PubMed] [Google Scholar]
- 48.Kochar B, Cai W, Cagan A et al. Pre-treatment Frailty Is Independently Associated With Increased Risk of Infections After Immunosuppression in Patients with Inflammatory Bowel Diseases. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.02.032. [DOI] [PubMed] [Google Scholar]
- 49.Fleming S B. Viral Inhibition of the IFN-Induced JAK/STAT Signalling Pathway: Development of Live Attenuated Vaccines by Mutation of Viral-Encoded IFN-Antagonists. Vaccines (Basel) 2016;4 doi: 10.3390/vaccines4030023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Kelesidis T, Mastoris I, Metsini A.How to approach and treat viral infections in ICU patients BMC Infect Dis 201414321. doi:10.1186/1471-2334-14-321 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Favalli E G, Biggioggero M, Maioli G et al. Baricitinib for COVID-19: a suitable treatment? The Lancet Infectious diseases. 2020 doi: 10.1016/S1473-3099(20)30262-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Feagan B G, Bhayat F, Khalid M.Respiratory Tract Infections in Patients With Inflammatory Bowel Disease: Safety Analyses From Vedolizumab Clinical Trials J Crohns Colitis 201812905–919.. doi:10.1093/ecco-jcc/jjy047 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Zabotti A, Goletti D, Lubrano E.The impact of the interleukin 12/23 inhibitor ustekinumab on the risk of infections in patients with psoriatic arthritis Expert Opin Drug Saf 20201969–82.. doi:10.1080/14740338.2020.1703946 [DOI] [PubMed] [Google Scholar]
- 54.Rubin D T, Abreu M T, Rai V et al. Management of Patients with Crohn’s Disease and Ulcerative Colitis During the COVID-19 Pandemic: Results of an International Meeting. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.04.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Linton N M, Kobayashi T, Yang Y et al. Incubation Period and Other Epidemiological Characteristics of 2019 Novel Coronavirus Infections with Right Truncation: A Statistical Analysis of Publicly Available Case Data. J Clin Med. 2020;9 doi: 10.3390/jcm9020538. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Toruner M, Loftus E V, Jr, Harmsen W S et al. Risk factors for opportunistic infections in patients with inflammatory bowel disease. Gastroenterology. 2008;134:929–936. doi: 10.1053/j.gastro.2008.01.012. [DOI] [PubMed] [Google Scholar]
- 57.Tosca J, Garcia N, Pascual I.Clinical assessment of risk factors for infection in inflammatory bowel disease patients Int J Colorectal Dis 202035491–500.. doi:10.1007/s00384-019-03501-0 [DOI] [PubMed] [Google Scholar]
- 58.Bezzio C, Saibeni S, Variola A et al. Outcomes of COVID-19 in 79 patients with IBD in Italy: an IG-IBD study. Gut. 2020 doi: 10.1136/gutjnl-2020-321411. [DOI] [PubMed] [Google Scholar]
- 59.(ISS) ISdS . Sorveglianza Integrata COVID-19 in Italia 2020. 2020. https://wwwepicentroissit/coronavirus/bollettino/Infografica_26marzo%20ITApdf) https://wwwepicentroissit/coronavirus/bollettino/Infografica_26marzo%20ITApdf)
- 60.RKI . Täglicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19). 27.04–AKTUALISIERTER STAND FÜR DEUTSCHLAND. 2020. https://wwwrkide/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/2020-04-27-depdf?__blob=publicationFile https://wwwrkide/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/2020-04-27-depdf?__blob=publicationFile
- 61.Statista 2020https://de.statista.com/statistik/daten/studie/1365/umfrage/bevoelkerung-deutschlands-nach-altersgruppen/letzter Aufruf am 01.05.2020
- 62.Destatis 2020https://www.destatis.de/DE/Presse/Pressemitteilungen/2020/03/PD20_115_132.html;jsessionid=7F326250BEDCBE087ABE219A28DE59F5.internet8712; letzter Aufruf am 01.05.2020
- 63.Soziales BfAu 2020https://www.bmas.de/DE/Presse/Pressemitteilungen/2020/einheitlicher-arbeitsschutz-gegen-coronavirus.html; letzter Aufruf am 01.05.2020
- 64.Colombel J F, D’Haens G, Lee W J.Outcomes and Strategies to Support a Treat-to-target Approach in Inflammatory Bowel Disease: A Systematic Review J Crohns Colitis 202014254–266.. doi:10.1093/ecco-jcc/jjz131 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Strohl M, Gonczi L, Kurt Z.Quality of care in inflammatory bowel diseases: What is the best way to better outcomes? World journal of gastroenterology 2018242363–2372.. doi:10.3748/wjg.v24.i22.2363 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Huang C, Wang Y, Li X.Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China Lancet 2020395497–506.. doi:10.1016/S0140-6736(20)30183-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Occhipinti V, Pastorelli L. Challenges in the Care of IBD Patients During the CoViD-19 Pandemic: Report From a “Red Zone” Area in Northern Italy. Inflamm Bowel Dis. 2020 doi: 10.1093/ibd/izaa084. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.de Jong M J, Boonen A, van der Meulen-de Jong A E et al. Cost-effectiveness of Telemedicine-directed Specialized vs Standard Care for Patients With Inflammatory Bowel Diseases in a Randomized Trial. Clin Gastroenterol Hepatol. 2020 doi: 10.1016/j.cgh.2020.04.038. [DOI] [PubMed] [Google Scholar]
- 69.de Jong M J, van der Meulen-de Jong A E, Romberg-Camps M J.Telemedicine for management of inflammatory bowel disease (myIBDcoach): a pragmatic, multicentre, randomised controlled trial Lancet 2017390959–968.. doi:10.1016/S0140-6736(17)31327-2 [DOI] [PubMed] [Google Scholar]
- 70.RKI 2020https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/nCoV.html; letzter Aufruf am 08.05.2020
- 71.RKI 2020https://www.kvn.de/Information+zum+Coronavirus+%28SARS_CoV2+COVID+19%29-p-6072.html; letzter Aufruf am 01.05.2020
- 72.Heida A, Park K T, van Rheenen P F.Clinical Utility of Fecal Calprotectin Monitoring in Asymptomatic Patients with Inflammatory Bowel Disease: A Systematic Review and Practical Guide Inflamm Bowel Dis 201723894–902.. doi:10.1097/MIB.0000000000001082 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Sipponen T, Kolho K L.Fecal calprotectin in diagnosis and clinical assessment of inflammatory bowel disease Scand J Gastroenterol 20155074–80.. doi:10.3109/00365521.2014.987809 [DOI] [PubMed] [Google Scholar]
- 74.Haisma S M, Galaurchi A, Almahwzi S.Head-to-head comparison of three stool calprotectin tests for home use PLoS One 201914e0214751. doi:10.1371/journal.pone.0214751 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Kucharzik T, Wittig B M, Helwig U.Use of Intestinal Ultrasound to Monitor Crohn’s Disease Activity Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association 201715535–542 e532.. doi:10.1016/j.cgh.2016.10.040 [DOI] [PubMed] [Google Scholar]
- 76.Maaser C, Petersen F, Helwig U et al. Intestinal ultrasound for monitoring therapeutic response in patients with ulcerative colitis: results from the TRUST&UC study. Gut. 2019 doi: 10.1136/gutjnl-2019-319451. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Repici A, Pace F, Gabbiadini R et al. Endoscopy units and the COVID-19 Outbreak: A Multi-Center Experience from Italy. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Repici A, Maselli R, Colombo M et al. Coronavirus (COVID-19) outbreak: what the department of endoscopy should know. Gastrointest Endosc. 2020 doi: 10.1016/j.gie.2020.03.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Johnston E R, Habib-Bein N, Dueker J M.Risk of bacterial exposure to the endoscopist’s face during endoscopy Gastrointest Endosc 201989818–824.. doi:10.1016/j.gie.2018.10.034 [DOI] [PubMed] [Google Scholar]
- 80.van Doremalen N, Bushmaker T, Morris D H.Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1 N Engl J Med 20203821564–1567.. doi:10.1056/NEJMc2004973 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Gu J, Han B, Wang J. COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.02.054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Xiao F, Tang M, Zheng X et al. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.02.055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Song Y, Liu P, Shi X L et al. SARS-CoV-2 induced diarrhoea as onset symptom in patient with COVID-19. Gut. 2020 doi: 10.1136/gutjnl-2020-320891. [DOI] [PubMed] [Google Scholar]
- 84.Hamming I, Timens W, Bulthuis M L.Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis J Pathol 2004203631–637.. doi:10.1002/path.1570 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Prevention. CfDCa. Coronavirus Disease 2019 (COVID-19)Available at (letzter Aufruf am 15.05.2020):2020https://www.cdc.gov/coronavirus/2019-ncov/infection-control/infection-prevention-control-faq.html
- 86.Control. ECfDPa. Infection prevention and control for COVID-19 in healthcare settingsAvailable at (letzter Aufruf am 15.05.2020):2020https://www.ecdc.europa.eu/en/publications-data/infection-prevention-and-control-covid-19-healthcare-settings
- 87.Gralnek I M, Hassan C, Beilenhoff U et al. ESGE and ESGENA Position Statement on gastrointestinal endoscopy and the COVID-19 pandemic. Endoscopy. 2020 doi: 10.1055/a-1155-6229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Sultan S, Lim J K, Altayar O et al. AGA Institute Rapid Recommendations for Gastrointestinal Procedures During the COVID-19 Pandemic. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.03.072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Chiu P WY, Ng S C, Inoue H et al. Practice of endoscopy during COVID-19 pandemic: position statements of the Asian Pacific Society for Digestive Endoscopy (APSDE-COVID statements) Gut. 2020 doi: 10.1136/gutjnl-2020-321185. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Han J, Wang Y, Zhu L et al. Preventing the spread of COVID-19 in digestive endoscopy during the resuming period: meticulous execution of screening procedures. Gastrointest Endosc. 2020 doi: 10.1016/j.gie.2020.03.3855. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Iacucci M, Cannatelli R, Labarile N et al. Endoscopy in inflammatory bowel diseases during the COVID-19 pandemic and post-pandemic period. Lancet Gastroenterol Hepatol. 2020 doi: 10.1016/S2468-1253(20)30119-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Neumann H, Emura F, Bokemeyer B et al. Practical Advice for Management of IBD Patients during the COVID-19 Pandemic: A World Endoscopy Organization Statement. Dig Endosc. 2020 doi: 10.1111/den.13712. [DOI] [PubMed] [Google Scholar]
- 93.Vavricka S R, Tutuian R, Imhof A.Air suctioning during colon biopsy forceps removal reduces bacterial air contamination in the endoscopy suite Endoscopy 201042736–741.. doi:10.1055/s-0030-1255615 [DOI] [PubMed] [Google Scholar]
- 94.Neurath M F. Covid-19 and immunomodulation in IBD. Gut. 2020 doi: 10.1136/gutjnl-2020-321269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Euroimmun 2020https://www.coronavirus-diagnostik.de; letzter Aufruf am 01.05.2020
- 96.Euroimmun https://www.coronavirus-diagnostik.de/documents/Indications/Infections/Coronavirus/YI_2606_I_DE_B.pdf 2020. letzter Aufruf am 01.05.2020
- 97.Streeck Hea . Vorläufiges Ergebnis und Schlussfolgerungen der COVID-19 Case Cluster Study (Gemeinde Gangelt) in land. nrw 942020. 2020:S4. [Google Scholar]
- 98.Taskforce. PDCAobotC-E 2020https://ecco-ibd.eu/images/6_Publication/6_8_Surveys/1st_interview_COVID-19%20ECCOTaskforce_published.pdf; letzter Aufruf am 29.03.2020
- 99.Papamichael K, Karatzas P, Mantzaris G J.De-escalation of Infliximab Maintenance Therapy from 8- to 10-week Dosing Interval Based on Faecal Calprotectin in Patients with Crohn’s Disease J Crohns Colitis 201610371–372.. doi:10.1093/ecco-jcc/jjv206 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Giwa A L, Desai A, Duca A. Novel 2019 coronavirus SARS-CoV-2 (COVID-19): An updated overview for emergency clinicians. Emergency medicine practice. 2020;22:1–28. [PubMed] [Google Scholar]
- 101.Russell C D, Millar J E, Baillie J K.Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury Lancet 2020395473–475.. doi:10.1016/s0140-6736(20)30317-2 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.Wu C, Chen X, Cai Y et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA internal medicine. 2020 doi: 10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Ling Y, Xu S B, Lin Y X.Persistence and clearance of viral RNA in 2019 novel coronavirus disease rehabilitation patients Chinese medical journal 20201331039–1043.. doi:10.1097/cm9.0000000000000774 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Liang-Ru Zhu RM, Gionata Fiorino, Thomas Schneider on behalf of the COVID-19 ECCO Taskforce 2020https://ecco-ibd.eu/images/6_Publication/6_8_Surveys/2nd_Interview_COVID-19_ECCO_Taskforce_published.pdf; letzter Aufruf am 29.03.2020
- 105.Wu D, Yang X O. TH17 responses in cytokine storm of COVID-19: An emerging target of JAK2 inhibitor Fedratinib. J Microbiol Immunol Infect. 2020 doi: 10.1016/j.jmii.2020.03.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106.Winthrop K L, Melmed G Y, Vermeire S.Herpes Zoster Infection in Patients With Ulcerative Colitis Receiving Tofacitinib Inflamm Bowel Dis 2018242258–2265.. doi:10.1093/ibd/izy131 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Boor P PC, de Ruiter P E, Asmawidjaja P S.JAK-inhibitor tofacitinib suppresses interferon alfa production by plasmacytoid dendritic cells and inhibits arthrogenic and antiviral effects of interferon alfa Transl Res 201718867–79.. doi:10.1016/j.trsl.2016.11.006 [DOI] [PubMed] [Google Scholar]
- 108.Jamilloux Y, Henry T, Belot A et al. Should we stimulate or suppress immune responses in COVID-19? Cytokine and anti-cytokine interventions. Autoimmunity reviews. 2020 doi: 10.1016/j.autrev.2020.102567. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 109.Stebbing J, Phelan A, Griffin I.COVID-19: combining antiviral and anti-inflammatory treatments The Lancet Infectious diseases 202020400–402.. doi:10.1016/s1473-3099(20)30132-8 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 110.Spinelli F R, Conti F, Gadina M. HiJAKing SARS-CoV-2? The potential role of JAK inhibitors in the management of COVID-19. Science immunology. 2020;5. doi:10.1126/sciimmunol.abc5367. doi: 10.1126/sciimmunol.abc5367. [DOI] [PubMed] [Google Scholar]
- 111.Torres J, Bonovas S, Doherty G.ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment J Crohns Colitis 2020144–22.. doi:10.1093/ecco-jcc/jjz180 [DOI] [PubMed] [Google Scholar]
- 112.Roblin X, Boschetti G, Williet N.Azathioprine dose reduction in inflammatory bowel disease patients on combination therapy: an open-label, prospective and randomised clinical trial Alimentary pharmacology & therapeutics 201746142–149.. doi:10.1111/apt.14106 [DOI] [PubMed] [Google Scholar]
- 113.Boyapati R K, Torres J, Palmela C.Withdrawal of immunosuppressant or biologic therapy for patients with quiescent Crohn’s disease The Cochrane database of systematic reviews 20185Cd012540. doi:10.1002/14651858.CD012540.pub2 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 114.Van Assche G, Magdelaine-Beuzelin C, D’Haens G.Withdrawal of immunosuppression in Crohn’s disease treated with scheduled infliximab maintenance: a randomized trial Gastroenterology 20081341861–1868.. doi:10.1053/j.gastro.2008.03.004 [DOI] [PubMed] [Google Scholar]
- 115.Chen L, Liu H G, Liu W.[Analysis of clinical features of 29 patients with 2019 novel coronavirus pneumonia] Zhonghua Jie He He Hu Xi Za Zhi 202043203–208.. doi:10.3760/cma.j.issn.1001-0939.2020.03.013 [DOI] [PubMed] [Google Scholar]
- 116.Mehta A K, Gracias D T, Croft M.TNF activity and T cells Cytokine 201810114–18.. doi:10.1016/j.cyto.2016.08.003 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 117.Ng S C, Hilmi I N, Blake A.Low Frequency of Opportunistic Infections in Patients Receiving Vedolizumab in Clinical Trials and Post-Marketing Setting Inflamm Bowel Dis 2018242431–2441.. doi:10.1093/ibd/izy153 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118.Van Assche G, Vermeire S, Noman M.Infliximab administered with shortened infusion times in a specialized IBD infusion unit: a prospective cohort study J Crohns Colitis 20104329–333.. doi:10.1016/j.crohns.2009.12.012 [DOI] [PubMed] [Google Scholar]
- 119.Fukuyo S, Saito K, Yamaoka K.Efficacy and safety of reducing duration of infliximab infusion Modern rheumatology 201424275–280.. doi:10.3109/14397595.2013.843747 [DOI] [PubMed] [Google Scholar]
- 120.El-Matary W, Dykes D MH, Bauman L.Rapid Infliximab Infusion in Children with Inflammatory Bowel Disease: A Multicenter North American Experience Inflamm Bowel Dis 2017232104–2108.. doi:10.1097/mib.0000000000001259 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 121.Sandborn W J, Baert F, Danese S.Efficacy and Safety of Vedolizumab Subcutaneous Formulation in a Randomized Trial of Patients With Ulcerative Colitis Gastroenterology 2020158562–INF.. doi:10.1053/j.gastro.2019.08.027 [DOI] [PubMed] [Google Scholar]
- 122.Ruemmele F M, Veres G, Kolho K L.Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease J Crohns Colitis 201481179–1207.. doi:10.1016/j.crohns.2014.04.005 [DOI] [PubMed] [Google Scholar]
- 123.Stevens T, Haasnoot L DHG, Buskens C et al. Reduced need for surgery and medical therapy after early ileocaecal resection for Crohn’s disease: Long-term follow-up of the LIR!C trial. Journal of Crohn’s and Colitis. 2020;14:S003–S004. [Google Scholar]
- 124.Ponsioen C Y, de Groof E J, Eshuis E J.Laparoscopic ileocaecal resection versus infliximab for terminal ileitis in Crohn’s disease: a randomised controlled, open-label, multicentre trial The lancet Gastroenterology & hepatology 20172785–792.. doi:10.1016/S2468-1253(17)30248-0 [DOI] [PubMed] [Google Scholar]
- 125.RKI Epidemiologisches Bulletin 18 | 2020 30. April 2020letzter Aufruf am 01.05.20202020
- 126.Sachar D B. Placebo-controlled clinical trials in gastroenterology. A position paper of the American College of Gastroenterology. The American journal of gastroenterology. 1984;79:913–917. [PubMed] [Google Scholar]
- 127.Grainge M J, West J, Card T R.Venous thromboembolism during active disease and remission in inflammatory bowel disease: a cohort study Lancet 2010375657–663.. doi:10.1016/s0140-6736(09)61963-2 [DOI] [PubMed] [Google Scholar]
- 128.Preiß J C, Bokemeyer B, Buhr H J.[Updated German clinical practice guideline on “Diagnosis and treatment of Crohn’s disease” 2014] Z Gastroenterol 2014521431–1484.. doi:10.1055/s-0034-1385199 [DOI] [PubMed] [Google Scholar]
- 129.Nguyen G C, Bernstein C N, Bitton A.Consensus statements on the risk, prevention, and treatment of venous thromboembolism in inflammatory bowel disease: Canadian Association of Gastroenterology Gastroenterology 2014146835–INF.. doi:10.1053/j.gastro.2014.01.042 [DOI] [PubMed] [Google Scholar]
- 130.Terpos E, Ntanasis-Stathopoulos I, Elalamy I et al. Hematological findings and complications of COVID-19. American journal of hematology. 2020 doi: 10.1002/ajh.25829. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 131.Llitjos J F, Leclerc M, Chochois C et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. Journal of thrombosis and haemostasis: JTH. 2020 doi: 10.1111/jth.14869. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Kollias A, Kyriakoulis K G, Dimakakos E et al. Thromboembolic risk and anticoagulant therapy in COVID-19 patients: emerging evidence and call for action. British journal of haematology. 2020 doi: 10.1111/bjh.16727. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 133.Balestrieri P, Ribolsi M, Guarino M PL et al. Nutritional Aspects in Inflammatory Bowel Diseases. Nutrients. 2020;12 doi: 10.3390/nu12020372. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 134.Massironi S, Rossi R E, Cavalcoli F A.Nutritional deficiencies in inflammatory bowel disease: therapeutic approaches Clinical nutrition (Edinburgh, Scotland) 201332904–910.. doi:10.1016/j.clnu.2013.03.020 [DOI] [PubMed] [Google Scholar]
- 135.Nguyen G C, Munsell M, Harris M L.Nationwide prevalence and prognostic significance of clinically diagnosable protein-calorie malnutrition in hospitalized inflammatory bowel disease patients Inflamm Bowel Dis 2008141105–1111.. doi:10.1002/ibd.20429 [DOI] [PubMed] [Google Scholar]
- 136.Schreiner P, Martinho-Grueber M, Studerus D et al. Nutrition in Inflammatory Bowel Disease. Digestion. 2020 doi: 10.1159/000505368. [DOI] [PubMed] [Google Scholar]
- 137.Beck M A, Handy J, Levander O A.Host nutritional status: the neglected virulence factor Trends in microbiology 200412417–423.. doi:10.1016/j.tim.2004.07.007 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 138.Calder P C, Carr A C, Gombart A F et al. Optimal Nutritional Status for a Well-Functioning Immune System Is an Important Factor to Protect against Viral Infections. Nutrients. 2020;12 doi: 10.3390/nu12041181. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 139.Gasmi A, Noor S, Tippairote T et al. Individual risk management strategy and potential therapeutic options for the COVID-19 pandemic. Clinical immunology (Orlando, Fla) 2020 doi: 10.1016/j.clim.2020.108409. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.


