Sr. Editor:
Desde el inicio de la pandemia por el nuevo coronavirus 2019, se han reportado múltiples asociaciones clínicas, principalmente de tipo respiratorio; sin embargo, debido a su capacidad neurotrópica y neuroinvasiva, también se han observado diversos síntomas y padecimientos neurológicos, tales como anosmia, disgeusia, cefalea, eventos cerebrovasculares, crisis epilépticas, Guillain-Barré y/o encefalitis, entre otros1, 2, 3.
Presentamos el caso de un paciente con síndrome de encefalopatía posterior reversible (PRES), asociado al síndrome respiratorio agudo grave por coronavirus tipo 2 (SARS-CoV-2).
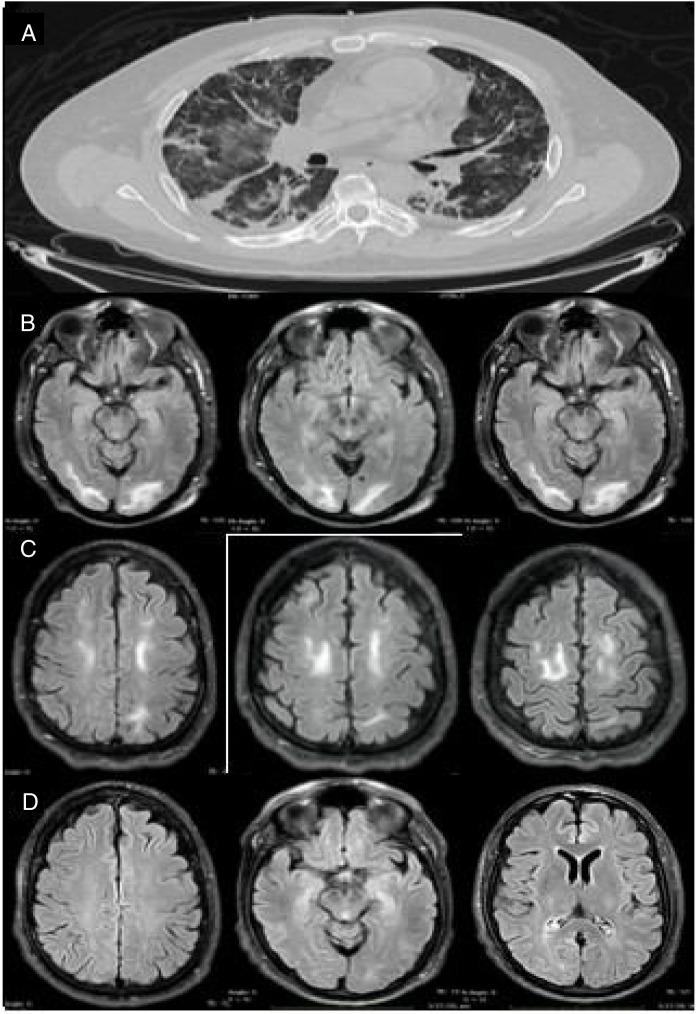
Masculino de 46 años de edad, con historial médico y evolución intrahospitalaria mostrados en la tabla 1 , que inició con mialgias, tos, hiposmia, disgeusia y fiebre 4 días antes de acudir al servicio de urgencias, presentando disnea, temperatura corporal de 39,0° C, presión arterial de 130/70 mmHg, saturación de oxígeno al 85%. En tomografía simple de tórax se observaron múltiples áreas en patrón de vidrio despulido de localización subpleural y en región peribroncovascular, de predominio en lóbulos inferiores y consolidaciones subpleurales (fig. 1 A). Se realizó prueba nasofaríngea por hisopado por transcripción reversa-PCR (RT-PCR), la cual resultó positiva para SARS-CoV-2. Se inició tratamiento con hidroxicloroquina, azitromicina y cefuroxima. Tres días después presentó exacerbación de disnea y descenso de saturación de oxígeno al 60% requiriendo ventilación mecánica invasiva (VMI) e ingresó en la Unidad de Terapia Intensiva; desde el ingreso presentó descontrol hipertensivo con presión arterial media (PAM), 120-130 mmHg de difícil control. Se llevó a cabo la extubación 9 días después (día 22 desde el inicio de los síntomas), con presencia de desorientación, agitación psicomotriz y desconexión con el medio, por lo que se realizó resonancia magnética (RM) con contraste, presentando imágenes hiperintensas subcorticales y en sustancia blanca occipitales y frontales bilaterales en secuencia T2 y FLAIR, hipointensa en T1, sin restricción a la difusión y sin reforzamiento tras el contraste (fig. 1B,C), EEG normal; 48 h posteriores a la extubación, presentó criterios de intubación orotraqueal, requiriendo nuevamente VMI por 7 días. Tras la segunda extubación aún mostraba desorientación, la cual fue mejorando con el paso de los días, sin referir en ningún momento déficit visual, presentando cuadriparesia de predominio en MPI la cual mejoró logrando marcha con apoyo al egreso. Fue egresado el día 34 de estancia intrahospitalaria, sin alteraciones en funciones mentales, persistiendo debilidad de extremidades inferiores. La IRM de control 15 días después de la inicial reportó desaparición de imágenes hiperintensas a nivel frontal y occipital, lo cual es compatible con PRES (fig. 1D).
Tabla 1.
Características del paciente y evolución clínica
| Variable | |||
|---|---|---|---|
| Años | 46 | ||
| Antropométricos | Peso 86 kg, talla 163 cm, IMC 32,40 kg/m2 | ||
| Signos vitales al ingreso | FC 115 lpm, FR 24 rpm, PA 130/70 mmHg, temp. 39° C, saturación de O2 85% | ||
| Antecedentes familiares | Madre: HAS y DM2 | ||
| Antecedentes patológicos | DM2 (desde 2004), HAS (desde 2019) | ||
| Toxicológicos | Alcohol (una vez al mes) / tabaquismo social (una vez por semana) | ||
| Tratamiento crónico prehospitalario | Insulina (glargina + lixisenatida) 22 UI/día, furosemida 40 mg cada 24 h, amlodipino 5 mg cada 24 h, pravastatina 20 mg cada 24 h, Trayenta duo 2,5/850 mg cada 8 h | ||
| Inicio de PRES desde el inicio de los síntomas (días) | 22 | ||
| Presión arterial media (PAM) rango |
69-130 mmHg |
||
| Exámenes de laboratorio |
Ingreso |
Pico |
Egreso |
| Leucocitos (por mm3) | 9,10 | 18,8 | 9,3 |
| Plaquetas (por mm3) | 207.000 | 657.000 | 203.000 |
| Creatinina (mg/dL) | 2,50 | 3,71 | 1,09 |
| PCR (mg/dL) | 20,56 | 20,56 | 1,13 |
| VSG (mm/h) | 101 | 104 | 22 |
| Ferritina (ng/mL) | 435,8 | 1.581 | 643 |
| Dímero-D (ng/mL) | 500,54 | 6.161 | 651 |
Figura 1.
A) Tomografía de tórax en corte axial. Muestra múltiples imágenes en vidrio despulido en ambos pulmones. B) RM en corte axial, que muestra imágenes hiperintensas subcorticales y de la sustancia blanca en lóbulos occipitales. C) RM en corte axial en secuencia T2-FLAIR, con imágenes hiperintensas de la sustancia blanca de forma bilateral en lóbulos frontales. D) Control de RM 15 días después, donde se observa desaparición de las lesiones hiperintensas en lóbulos frontales y occipitales.
El PRES se reconoce como una condición neurológica caracterizada por crisis epilépticas, alteración del estado de consciencia, alteraciones visuales y/o cefalea con neuroimagen típica donde se observa edema vasogénico subcortical reversible en regiones parieto-occipitales principalmente. Se han identificado en el síndrome asociaciones clínicas como descontrol hipertensivo, enfermedad renal o neoplasias, así como factores implicados, entre ellos: encefalopatía hipertensiva, enfermedades infecciosas, mayoritariamente de tipo viral, choque o sepsis, uso de antivirales o inmunosupresores.4
El común denominador de los casos publicados de PRES asociado a SARS-CoV-2 es el descontrol hipertensivo, lesión renal aguda con o sin terapia de reemplazo renal, e infección respiratoria grave que han requerido VMI5, 6, 7. Parte de la fisiopatología del PRES se asociaba a lesión endotelial por isquemia; sin embargo, hasta ahora sigue siendo controversial la fisiopatología con exactitud, sobre todo en el contexto del SARS-CoV-2, sosteniéndose distintas teorías que pretenden incluir de forma integral el espectro fisiopatológico de la infección de base. Incluso se habla del probable efecto directo de los fármacos utilizados, como la hidroxicloroquina, que se ha administrado en la mayoría de los pacientes publicados, y si este constituye un factor independiente para el desarrollo de PRES o simplemente es una observación sin relación directa5. Se sabe que las citocinas inflamatorias juegan un papel importante en la respuesta a las infecciones virales, y el SARS-CoV-2 no es la excepción. Las observaciones in vitro mostraron liberación de quimiocinas y citocinas proinflamatorias producidas en células dendríticas y células epiteliales del tracto respiratorio, principalmente IL-1β, IL-6, IL-4, IL-10 y factor de necrosis tumoral (TNF)8; asimismo, el aumento del factor de crecimiento endotelial vascular (VEGF), aunado a la hipoperfusión tisular, generan daño endotelial y aumentan la permeabilidad vascular. Lo anterior integra la «tormenta de citocinas», una de las explicaciones más aceptadas hasta ahora, y que constituyen actualmente los blancos terapéuticos del SARS-CoV-2. Aún no se sabe si el virus es un factor independiente en el desarrollo de PRES.
Las diversas publicaciones sobre esta entidad permitirán homogeneizar factores de riesgo, evolución y tratamiento, así como el poder establecer la fisiopatología asociada al SARS-CoV-2 y posiblemente establecer biomarcadores pronósticos o de detección temprana de la enfermedad.
Bibliografía
- 1.Asadi-Pooya A.A., Simani L. Central nervous system manifestations of COVID-19: A systematic review. J Neurol Sci. 2020;413:116832. doi: 10.1016/j.jns.2020.116832. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Bridwell R., Long B., Gottlieb M. Neurologic complications of COVID-19. Am J Emerg Med. 2020;38:1549.e3–1549.e7. doi: 10.1016/j.ajem.2020.05.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Wu Y., Xu X., Chen Z., Duan J., Hashimoto K., Yang L. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020;87:18–22. doi: 10.1016/j.bbi.2020.03.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Tetsuka S., Tomoko O. Posterior reversible encephalopathy syndrome: A review with emphasis on neuroimaging characteristics. J Neurol Sci. 2019;404:72–79. doi: 10.1016/j.jns.2019.07.018. [DOI] [PubMed] [Google Scholar]
- 5.Parauda S.C., Gao V., Gewirtz A.N., Parikh N.S., Merkler A.E., Lantos J. Posterior reversible encephalopathy syndrome in patients with COVID-19. J Neurol Sci. 2020;416:117019. doi: 10.1016/j.jns.2020.117019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Kaya Y., Kara S., Akinci C., Kocaman A.S. Transient cortical blindness in COVID-19 pneumonia; a PRES-like syndrome: Case report. J Neurol Sci. 2020;413:116858. doi: 10.1016/j.jns.2020.116858. doi:10.1016/j.jns.2020.116858. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kishfy L., Casasola M., Banankhah P., Parvez A., Jen Jan Y., Shenoy A. Posterior reversible encephalopathy syndrome (PRES) as a neurological association in severe Covid. J Neurol Sci. 2020;414:116943. doi: 10.1016/j.jns.2020.116943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ye Q., Wang B., Mao J. The pathogenesis and treatment of the ‘Cytokine Storm’ in COVID-19. J Infect. 2020;80:607–613. doi: 10.1016/j.jinf.2020.03.037. [DOI] [PMC free article] [PubMed] [Google Scholar]