Abstract
目的
通过普通饲料和高脂饲料喂养大鼠,探讨建立肥胖胰岛素抵抗大鼠模型的适宜条件和时间。
方法
将45只6周龄雄性SD大鼠随机分为普通饲料对照组和高脂饲料组(脂肪供能比为45%), 喂养4周后剔除高脂饲料组肥胖抵抗(obesity resistance,OR)大鼠,肥胖(obese,OB)大鼠继续喂养至12周。分别于4、8、12周末进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),12周末检测胰岛素释放、内脏脂肪、胰腺、肝脏等组织的病理变化。
结果
高脂饲料喂养4周后,高脂饲料组大鼠的体质量比对照组高17.8%(P=0.001),肥胖成模率为67.6%~78.4%,OB大鼠出现糖耐量降低,OGTT 120 min血糖比对照组高27.5%(P<0.001),曲线下面积(area under the curve, AUC)比对照组高8.3%(P=0.037),79.3%的大鼠出现肥胖胰岛素抵抗;喂养8周时,OB大鼠体质量比对照组高30.4%(P<0.001),OGTT 60 min和120 min血糖分别比对照组高35.6%(P<0.001)和36.4%(P<0.001),AUC比对照组高21.7%(P<0.001),100.0%大鼠出现肥胖胰岛素抵抗;喂养12周时,OB大鼠体质量比对照组高36.9%(P<0.001),OGTT 60 min和120 min血糖分别比对照组高24.8%(P=0.001)和34.6%(P<0.001),AUC比对照组高16.1%(P=0.019),93.3%的大鼠出现肥胖胰岛素抵抗。胰岛素释放实验显示,高脂饲料组各时间点血清胰岛素均高于对照组,120 min时胰岛素浓度是对照组的6.3倍(P=0.008),胰岛和肝脏出现病理改变。
结论
使用脂肪供能比为45%的高脂饲料喂养6周龄SD大鼠4周后淘汰OR大鼠,OB大鼠中出现糖耐量异常,8~12周后成模率更高。
Keywords: 胰岛素抵抗, 肥胖症, 膳食, 高脂, 模型, 动物
Abstract
Objective
To investigate the appropriate conditions and duration for establishing a high-fat diet-induced obesity and insulin resistance model in rats.
Methods
Forty-five 6-week-old male Sprague-Dawley (SD) rats were randomly assigned into 2 groups: (1) control group (CON), (2) high-fat diet group (HFD). HFD was fed with a high-fat diet (45% kcal from fat) while CON with chow diet. After four-weeks of high-fat diet feeding, the rats of obesity resistance (OR) were eliminated according to body weight sorting, whereas obese (OB) rats were continued feeding a high-fat diet until 12 weeks. Body weight and food intake were recorded weekly. Glucose tolerance was evaluated by oral glucose tolerance test (OGTT) in 4 weeks, 8 weeks and 12 weeks. At the end of 12 weeks, insulin releasing test and visceral fat mass were measured and HE staining of the liver, adipose tissue and pancreatic tissue were conducted.
Results
After 4 weeks of a high-fat diet, the body weight of HFD was 17.8% higher than that of CON (P=0.001), and the rate of obesity was 67.6%-78.4%. Glucose tolerance of OB rats was impaired with a higher blood glucose concentration at 120 min (P<0.001) and a higher area under the curve (AUC, P=0.037) in OGTT compared with CON. The rate of obesity and insulin-resistance rats was 79.3%. After 8 weeks of feeding, the body weight in OB was 30.4% higher than CON (P<0.001). In OGTT, blood glucose levels at 60 min and 120 min were 35.6% and 36.4% higher than those in CON (both P<0.001), and AUC was 21.7% (P<0.001) higher than that of CON. The rate of obesity and insulin-resistance rats was 100.0%. After 12 weeks of feeding, the body weight in OB was 36.9% higher than that in CON (P<0.001). In OGTT, the blood glucose levels at 60 min and 120 min were 24.8% (P=0.001) and 34.6% (P<0.001) higher than those in CON, and AUC was 16.1% (P=0.019) higher than that of CON. The rate of obesity and insulin-resistance rats was 93.3%. The insulin releasing test showed that serum insulin concentration at each time point (0, 30, 60, 120 min) was higher than that in CON, with a 6.3-times higher than that in CON at 120 min (P=0.008). Pathological changes were observed in islets and liver in the OB rats.
Conclusion
After 4 weeks of a high-fat diet (45% kcal from fat) feeding in six-weeks SD rats, the rats of OR were eliminated. Impaired glucose tolerance was found in OB rats after 4 weeks of feeding, and the rate was higher after 8-12 weeks of high-fat diet feeding.
Keywords: Insulin resistance, Obesity, Diet, high-fat, Models, animal
胰岛素抵抗是肥胖及其相关疾病(如糖尿病、心血管疾病等慢性病)的重要发病基础,表现为外周组织对胰岛素生理作用的反应性降低或敏感性降低,使胰岛素维持血糖稳态的能力下降。目前的胰岛素抵抗动物模型研究有遗传型、基因型和诱导型[1],胰岛素抵抗除了与遗传背景有关外,饮食不合理与运动缺乏与之密切相关。能量摄入过量、活动消耗过少等造成的肥胖是产生胰岛素抵抗的最主要因素。近年来肥胖率的迅速增长表明其主要因素是环境和行为因素(如饮食、运动),而不是基因改变[2],因此,建立与成人肥胖胰岛素抵抗相似的动物模型,对研究相关疾病的病理生理、治疗等具有重要作用。
高脂饮食诱导的肥胖胰岛素抵抗大鼠动物模型在复制人类相关疾病的自然进程、代谢特点方面有显著优势[3],且较为经济,但目前报道的肥胖胰岛素抵抗大鼠模型条件不同,所需时间更是长短不一,2~24周不等[4,5,6,7,8,9,10,11]。本研究旨在探讨建立肥胖胰岛素抵抗大鼠模型的适宜条件和时间。
1. 材料与方法
1.1. 实验动物
选用5周龄Sprague-Dawley(SD)大鼠,雄性,清洁级,体质量150~170 g,共45只(购自北京维通利华有限公司),实验动物生产许可证号SCXK(京)2016-0010,实验动物使用许可证号SYXK(京)2016-0041。本研究通过北京大学生物医学伦理委员会审批(LA2017002)。
1.2. 饲料
普通饲料采用普通大鼠生长繁殖饲料(北京科澳协力饲料有限公司),总能量为3.49 kcal/g;高脂饲料采用脂肪供能比为45%的高脂饲料(D12451,Research Diets,New Brunswick, NJ),总能量为4.7 kcal/g。
1.3. 大鼠饲养条件及周期
适应性喂养1周后,按体质量大小排序采用区组化随机分组的方法将大鼠分为普通对照组(8只)和高脂饲料组(37只)。高脂饲料组给予高脂饲料喂养,自由采食;对照组根据高脂饲料组的进食量高值定量给予普通大鼠生长繁殖饲料。大鼠自由饮水,每笼2只,饲养环境为无特定病原体(specific pathogen free,SPF)环境,恒温恒湿,温度(25±2)℃,湿度55%±10%,12 h光照-黑暗循环,饲养周期为12周。
1.4. 大鼠的筛选
采用两种方法分别判定肥胖(obesity, OB)和肥胖抵抗(obesity resistance,OR)大鼠,方法(1):高脂饲料喂养后体质量高于对照组体质量均值的10%为OB,否则为OR[12];方法(2):高脂喂养后体质量从大到小排序处于上2/3的大鼠为OB,处于下1/3的大鼠为OR[13]。根据上述判定方法,剔除OR大鼠,筛选出OB大鼠。在OB大鼠中根据体质量大小按随机方法选取15只与对照组一起继续喂养至12周。
1.5. 体质量和进食量
每周在固定时间用分度值为0.1 g的秤称量大鼠体质量和进食量各1次,经观察发现撒食量很少,因此计算每天每只大鼠进食量(g)=(给食量-剩食量)/2(每笼两只)。
1.6. 口服葡萄糖耐量试验(oral glucose tolerance testing, OGTT)
在大鼠喂养4、8、12周末时,隔夜禁食16 h后,通过灌胃给予50%(质量分数)葡萄糖溶液2 g/kg(大鼠体质量)。分别于灌胃前(0 min)和灌胃后15、30、60及120 min剪尾采血,用试纸条在血糖仪(ACCU-CHEK Advantage, Roche, DE)上测定血糖(glucose,GLU)。根据梯形公式计算曲线下面积(area under curve, AUC),AUC(min·mmol/L) = 7.5×GLU0 min+15.0×GLU15 min+22.5×GLU30 min+45.0×GLU60 min+30.0×GLU120 min。高脂饲料组的AUC高于对照组AUC均值的大鼠视为胰岛素抵抗大鼠,据此计算成模率。
1.7. 胰岛素释放试验
12周末,大鼠隔夜禁食16 h后通过灌胃给予50%葡萄糖溶液2 g/kg(大鼠体质量)。分别于灌胃前(0 min)和灌胃后30、60及120 min时由内眦取血,2 500 r/min离心15 min分离血清,采用大鼠胰岛素试剂盒(Millipore, EZRMI-13K)检测血清胰岛素浓度。
1.8. 组织病理检查
12周末,腹腔注射戊巴比妥钠麻醉后,股动脉放血处死大鼠。开腹依次取出肝脏、睾周脂肪和胰腺,取同一部位的部分组织放入10%(体积分数)甲醛溶液固定,后续进行石蜡包埋、切片、HE染色观察。采用Image Pro Plus 6.0软件测量脂肪细胞面积、胰岛面积,计数每个样本10个10倍视野内的胰岛数目。脂肪细胞炎性浸润程度评分标准为:0分=无,1分=轻微异常,2分=轻度异常,3分=中度异常,4分=重度异常。肝细胞脂肪变性程度根据非酒精性脂肪性肝病活动度评分(nonalcoholic fatty liver disease active score,NAS)分为4度:F0,<5%肝细胞脂肪变性;F1,5%~30%肝细胞脂肪变性;F2,31%~50%肝细胞脂肪变性;F3,51%~75%肝细胞脂肪变性;F4,>75%肝细胞脂肪变性[14]。所有病理切片由同一位经验丰富的病理科医师在不知实验设计和动物分组情况下进行评分。
1.9. Lee’s指数、内脏脂肪百分比和脏器重量及指数
12周末,腹腔注射戊巴比妥钠麻醉后测量大鼠身长(鼻尖到尾根部),称取终末体质量。股动脉放血处死后,取肾脏周围及睾周脂肪组织、肝脏和肾脏称重。按以下公式计算内脏脂肪百分比、Lee’s指数、肝脏指数和肾脏指数:内脏脂肪百分比=(肾周+睾周)脂肪组织(g)/终体质量(g)×100%,Lee’s指数= ,肝脏指数=肝重(g)/体质量(g)×100%,肾脏指数=肾重(g)/体质量(g)×100%。
1.10. 统计学分析
用SPSS 21.0软件对数据进行统计学分析,符合正态分布的数据以均数±标准差表示,两组间比较采用独立样本t检验,三组间比较采用单因素方差分析,并采用LSD法进行两两比较;不符合正态分布的指标以中位数(P25,P75)表示,两组间比较采用独立样本Mann-Whitney U秩和检验,P<0.05为差异有统计学意义。
2. 结果
2.1. 进食量和体质量变化
高脂饲料组大鼠每日进食量均值为19.8 g/只(17.8~22.5 g/d),随体质量增长进食量无明显变化,对照组根据高脂饲料组进食量高值定量给食,两组平均能量摄入分别为高脂饲料组93.06 kcal/d和对照组78.53 kcal/d(占高脂饲料组的84.4%)。
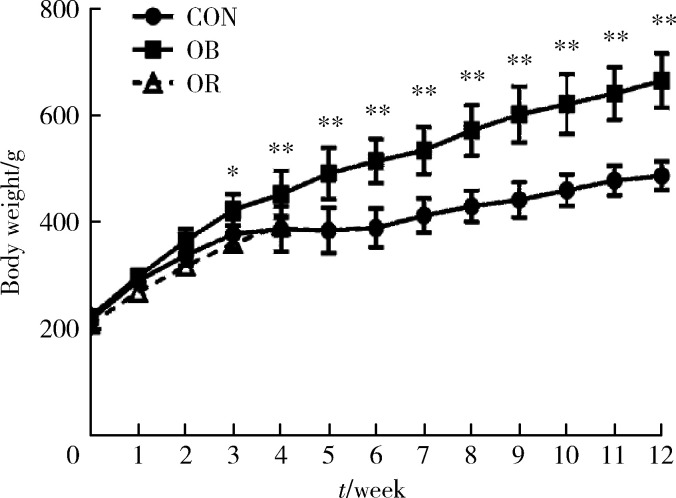
高脂喂养前,高脂饲料组的体质量为(219.0±8.6) g,对照组的体质量为(217.7±9.2) g;高脂饮食3周后,高脂饲料组的体质量均值高于对照组14.5%(t=-2.229,P=0.032),4周后,高于对照组17.8%(t=-3.556, P=0.001)。剔除OR大鼠后,OB大鼠在4、8、12周末的体质量分别高于对照组21.7%、30.4%和36.9%(P<0.001,图1)。
1.
大鼠体质量变化
Changes in body weight of rats
*P<0.05, **P<0.01, OB compared with CON. Only week 1 to week 4 of OR is shown. CON, control; OB, obesity; OR, obesity resis-tance.
2.2. OB与OR
高脂饲料喂养4周,按方法(1)筛选出OR大鼠8只[体质量(394.6±18.3) g],OB大鼠29只[体质量(463.4±32.9) g],OB大鼠体质量高于对照组21.7%(t=5.580, P<0.001),高于OR大鼠17.4%(t=5.220, P<0.001),肥胖成模率为78.4%。按方法(2)筛选出12只OR大鼠[体质量(403.8±20.0) g],OB大鼠25只[体质量(470.0±30.6) g],OB大鼠体质量高于对照组23.4%(t=6.386, P<0.001),高于OR大鼠16.4%(t=6.133, P<0.001),肥胖成模率67.6%。最终选择方法(1)(高于对照组体质量均值10%)筛选出OB大鼠,剔除OR大鼠(图1)。
2.3. 糖耐量变化
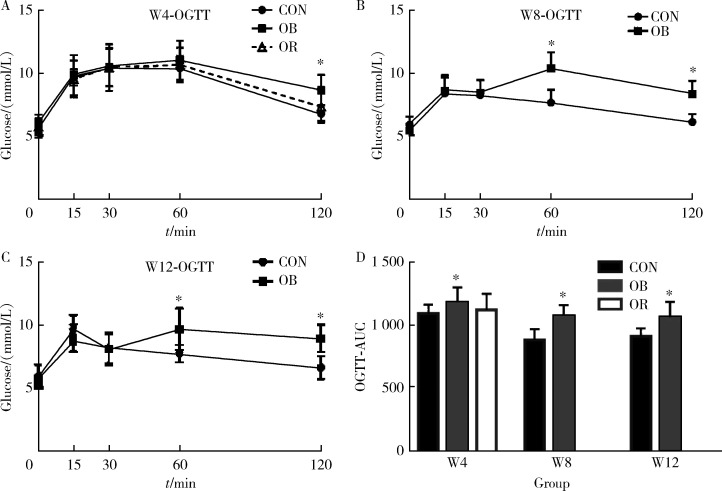
高脂饲料喂养4周后糖耐量出现异常,表现为OB大鼠120 min血糖高于对照组 27.5%(t=-3.849, P<0.001),AUC高于对照组 8.3%(t=-2.155, P=0.037),有胰岛素抵抗表现的比例为79.3%。高脂喂养8周后,OB组60 min、120 min血糖分别高于对照组35.6%(t=6.330, P<0.001)和36.4%(t=6.996, P<0.001),AUC高于对照组21.7%(t=6.225, P<0.001),全部大鼠均出现胰岛素抵抗。高脂喂养12周后,OB组60 min、120 min血糖分别高于对照组24.8%(t=4.088, P=0.001)和34.6%(t=6.212, P<0.001),AUC高于对照组16.1%(t=2.703, P=0.019),出现胰岛素抵抗的比例为93.3%(图2)。
2.
高脂饲料对大鼠OGTT的影响
OGTT of rats with high-fat diet feeding
*P<0.05, OB compared with CON. CON, control; OB, obesity; OR, obesity resistance; OGTT, oral glucose tolerance test; AUC, area under the curve; W4, week 4; W8, week 8; W12, week 12.
高脂喂养4周时,OR大鼠与对照组糖耐量差异无统计学意义,120 min血糖比对照组高 7.9%(t=-0.920, P=0.363),AUC比对照组高 2.5%(t=-0.467, P=0.643),比OB大鼠120 min血糖低18.2%(t=-2.940, P=0.005)。OR大鼠中出现胰岛素抵抗的比例为37.5%(图2A)。
2.4. 空腹血清胰岛素和胰岛素释放变化
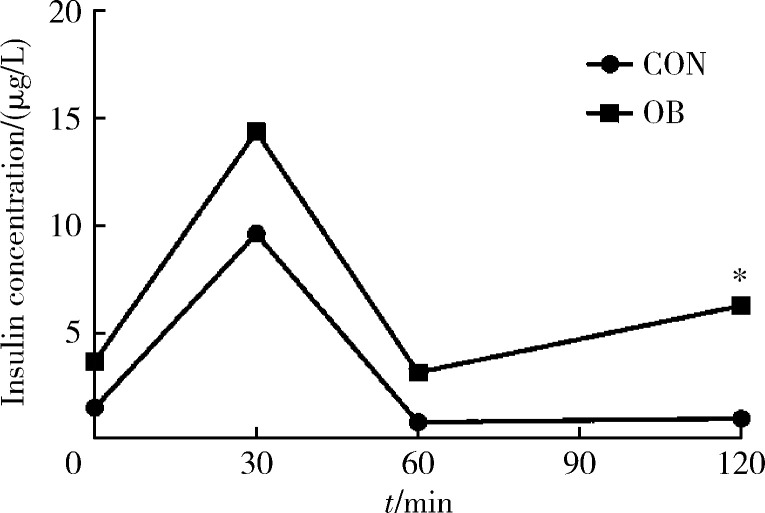
高脂饲料喂养12周后,OB大鼠的血清胰岛素水平升高,口服葡萄糖前(0 min)和口服葡萄糖后30、60、120 min血清胰岛素水平分别高于对照组145.7%、49.5%、276.5%和528.3%。个体来看,100.0%的OB大鼠各个时间点血清胰岛素水平均高于对照组大鼠的血清胰岛素(图3、表1)。
3.
高脂饲料喂养12周后大鼠血清胰岛素释放试验
Insulin releasing test with high-fat diet feeding for 12 weeks in rats
*P<0.05, OB compared with CON. CON, control; OB, obesity.
1.
高脂饮食对大鼠脂肪、肝脏和胰岛组织的病理影响[中位数(P25,P75)]
The pathological changes of high-fat diet on adipose tissue, liver and islets in SD rats [median (P25, P75)]
| Items | CON (n=8) | OB (n=8) |
| *P<0.05, **P<0.01, OB compared with CON. CON, control; OB, obesity. | ||
| Adipocyte area/μm2 | 8 282.6 (6 610.8, 8 715.9) | 14 509.4 (12 534.4, 14 892.9)* |
| Degree of inflammatory infiltration of adipocyte | 0.0 (0.0, 0.8) | 2.0 (1.0, 2.0)** |
| Degree of hepatocyte steatosis | 0.0 (0.0, 0.0) | 1.0 (0.0, 2.8)* |
| Islet area/μm2 | 17 202.7 (5 302.5, 38 872.1) | 151 020.5 (17 262.6, 431 886.1)* |
| Number of islets in ten fields of 10×vision | 14.0 (12.3, 17.5) | 18.0 (14.8, 23.8) |
2.5. 组织病理结果
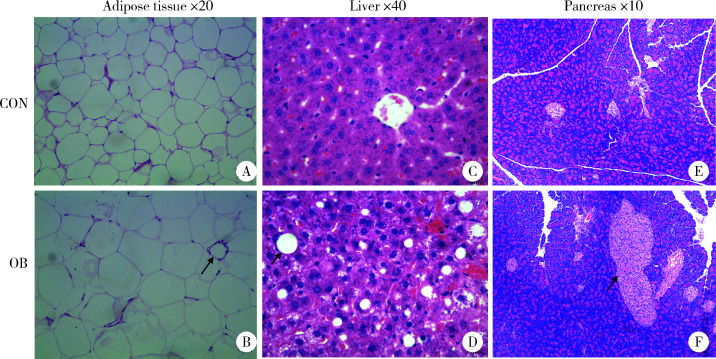
显微镜下显示,与对照组大鼠相比,OB大鼠的脂肪细胞体积明显变大、形态大小不一,8只OB大鼠中有7只大鼠脂肪细胞内可见泡沫细胞浸润;60%的肝细胞出现大小泡混合性脂肪变性,并有50%的大鼠(4/8只)出现少量单核淋巴细胞浸润及点灶状肝细胞坏死;胰腺可见胰岛数目增多、大小不一、形态不规整,并有中等量单核淋巴细胞浸润,毛细血管中度扩张(图4、表1)。
4.
大鼠脏器病理组织切片HE染色
Pathological section and hematoxylin and eosin stain
Arrow in B, infiltration of foam cells in adipocytes; Arrow in D, hepatocyte steatosis; Arrow in F, hyperplasia of pancreatic islet with irregular shape. CON, control; OB, obesity.
2.6. Lee’s指数、内脏脂肪百分比和脏器重量及指数
高脂饲料喂养12周后,OB组大鼠的内脏脂肪比显著增加,高于对照组168%(t=-7889, P<0.001);Lee’s指数高于对照组8%(t=-7.237, P<0.001);肝脏重量比对照组高10%(t=-2.486, P=0.027),肾脏重量与对照组无明显差别;肝脏指数(t=4.565, P=0.001)和肾脏指数(t=0.635, P<0.001)显著低于对照组(表2)。
2.
高脂饮食对大鼠Lee’s指数和脏器重量的影响
The effect of high-fat diet on Lee’s index and organ weight
| Group | n | Body weight/g | Visceral fat weight/g |
Percentage of visceral fat |
Lee’s index | Liver weight/g | Liver index | Kidney weight/g | Kidney index |
| *P<0.05, OB compared with CON. CON, control; OB, obesity. | |||||||||
| CON | 8 | 498.88±29.28 | 16.70±5.65 | 3.32%±0.97% | 26.93±0.50 | 14.63±1.20 | 2.94±0.27 | 3.16±0.29 | 0.63±0.04 |
| OB | 8 | 680.86±64.19* | 61.46±17.66* | 8.90%±1.72%* | 29.20±0.71* | 16.07±1.02* | 2.37±0.20* | 3.41±0.15 | 0.50±0.04* |
3. 讨论
使用脂肪供能比为45%的高脂饲料喂养6周龄SD大鼠4周后肥胖成模率为 78.4%,淘汰OR大鼠后,建立肥胖胰岛素抵抗模型,4周时79.3% 的OB大鼠有胰岛素抵抗表现,8周时100.0%出现肥胖胰岛素抵抗,12周时 93.3% 出现肥胖胰岛素抵抗,100.0%大鼠出现血清胰岛素水平升高。
3.1. 建立肥胖胰岛素抵抗大鼠模型的条件和方法
本研究使用脂肪供能比为45%的高脂饲料喂养6周龄SD大鼠,建立肥胖胰岛素抵抗模型。SD大鼠是常用于诱导肥胖胰岛素抵抗的大鼠,使用高脂饲料喂养很容易在短时间内区分出肥胖易感和肥胖抵抗大鼠[7, 12, 15]。刚离乳大鼠在高脂饮食下的体质量增长较快[16],而中年或老年大鼠的体质量增长较慢,很难出现体质量差异[10]。用于诱导肥胖模型的高脂饲料配方经过了25年的发展变化,已形成更合理的脂肪含量(40%~50%脂肪供能比),在此基础上添加蔗糖对糖代谢可产生更加严重的代谢紊乱[17];45%(D12451)脂肪供能比的高脂饲料比60%(D12492)脂肪供能比的高脂饲料含有更高的蔗糖(高于145%),更适合于建立肥胖和胰岛素抵抗模型[18],且饲料不至于过于松软,适口性更好。
关于OB和OR大鼠的判断方法,目前常用的有普通饲料对照法和高脂饲料喂养后体质量排队剔除法,前者按照高脂饲料喂养组大鼠体质量均值高于对照组10%为OB,否则为OR[12];后者是高脂饲料喂养后将体质量从大到小排序,处于上2/3的大鼠为OB,处于下1/3的大鼠为OR[13]。本研究选用这两种方法判定OB大鼠,结果显示,方法(1)的成模率为78.4%,方法(2)为67.6%,筛选出的OB大鼠体质量均值分别显著高于对照组21.7%和23.4%。两种方法筛选出的OB大鼠体质量结果差异不大,均已经超过对照组均值20%,所以本研究选用成模率高的方法(1),进一步观察肥胖胰岛素抵抗的情况。
本研究发现,高脂饲料喂养4周后 79.3% 的OB大鼠出现糖耐量降低,8~12周时糖耐量受损情况更加明显(93.3%~100.0%的OB大鼠)。12周末胰岛素释放实验结果显示,各点胰岛素浓度均显著升高,120 min时胰岛素浓度达到对照组的 6.3倍,并可见内脏脂肪升高,肝脏脂肪变性和炎性细胞浸润,胰岛增大,发生病理性改变。同时,股动脉取血在全自动生化分析仪上采用酶法检测空腹血浆葡萄糖水平显著升高(数据未列出)。以往研究显示,高脂饲料喂养大鼠2周时首先出现胰岛素水平升高[9],4~8周时糖耐量降低,伴随肥胖和胰岛素敏感指数降低,胰岛素钳夹实验表明葡萄糖灌注率显著降低[10],但空腹血糖一般无明显降低[5]。将造模时间延长至32周或10个月,空腹血糖仅有轻度的升高,且个体差异较大[19]。因此,胰岛素抵抗的发生首先表现为胰岛素水平升高,继而高胰岛素血症更加显著,并出现糖耐量受损,依次出现120 min、60 min血糖值升高,最终可加重为空腹血糖受损。
本研究12周时100.0%的OB大鼠各时间点的血清胰岛素水平均高于对照组大鼠,说明12周时存在高胰岛素血症,而OGTT结果只有93.3%出现肥胖胰岛素抵抗表现。4、8和12周时对照组和OB组的AUC结果有下降趋势,可能是因为OGTT测试时使用血糖仪和试纸快速测血糖的方法存在系统误差。因此,建议将测试方法标准化,如每次测试前校准血糖仪、前后尽量由同一人操作等,确保数据准确一致。本研究中胰岛素释放曲线出现了双峰和120 min时分泌延迟升高,组织病理检查发现胰岛有代偿性增生、体积增大,表明可能出现了胰岛素的代偿性过度释放。
有研究显示,建立肥胖模型需要7~9个月[20]。本研究通过定量给对照组饲料、剔除OR大鼠,4周时建立OB大鼠模型。当OB大鼠的OGTT显示明显的糖耐量下降、胰岛素释放实验显示各时间点胰岛素水平显著升高、个体的AUC-OGTT高于对照组AUC-OGTT均值者,即可判定肥胖胰岛素抵抗模型建立。这一过程并不需要过长的造模周期,4周80%左右出现肥胖胰岛素抵抗,8~12周可建立稳定的胰岛素抵抗模型。
本研究还发现,高脂饲料喂养的OR大鼠4周末也有37.5%出现糖耐量降低,表明高脂饲料本身即可诱发胰岛素抵抗。而OB大鼠更容易产生胰岛素抵抗,肥胖是独立于高脂饲料的一个胰岛素抵抗的显著诱发因素[15]。肥胖是一种低度慢性炎症状态[21],脂肪组织分泌促炎细胞因子,如肿瘤坏死因子α(tumor necrosis factor α, TNFα)、C反应蛋白、白介素-6等,最终诱发慢性炎症[22],因此,脂肪细胞、肝细胞内出现了肥胖引起的炎性浸润。TNFα对胰岛素信号传导有负调节作用,是联系肥胖和胰岛素抵抗的关键[23]。同时,肥胖会使脂肪组织巨噬细胞类型从M2型激活为M1型,导致促炎细胞因子以及活性氧水平升高,诱导胰岛素抵抗[24]。
3.2. 应注意的问题
值得注意的是,因高脂饲料造模时间长,且高脂饲料易导致进食量减少、肠胀气等问题,进而可能引起动物抵抗力下降、易患病。因此,使用高脂饲料建立肥胖胰岛素抵抗模型对饲养环境、动物质量、饲料质量及喂养等条件要求较高,应引起足够的重视。
本研究在造模期间,先后3批大鼠以高脂饮食喂养2~3周时,个别大鼠开始出现轻微气喘,随后陆续出现多只大鼠发病,气喘症状逐渐加重。发病后大鼠进食量下降、体质量减轻,解剖发现肺部出现散在出血点或纤维样实变,组织病理显示支气管周围、肺泡腔内有淋巴细胞和中性粒细胞弥漫浸润,支气管腔内积脓。多数大鼠发病2~4周后症状逐渐好转至消失,体质量和进食量恢复正常,但也有个别大鼠死亡,出现类似症状时应尽快隔离病鼠避免传染。究其原因,应注意在真实的SPF级环境饲养,确保饲养条件合格的基础上严控各项条件。
同样,饲料卫生安全问题应引起重视。本研究第一批动物采用国内著名饲料公司生产的高脂饲料,因镉超标10倍以上,导致70多只大鼠先后死亡。为避免这种问题,购买饲料时应索要饲料质量和卫生检测报告。此外,高脂饲料易氧化变质,应在低温条件下保存,并按需每日给食,保证饲料新鲜。因肥胖大鼠后期体质量较大,尽量单笼饲养或每笼两只,以保证足够的活动空间。
3.3. 局限性和展望
本研究因4周和8周时取血量较少,没有测定胰岛素,为了更充分地判定胰岛素抵抗情况,应测定胰岛素及做胰岛素耐量实验。由于观察时间较短,高脂饲料喂养超过12周后胰岛素抵抗表现如何需要喂养更长时间观察。目前有关建立肥胖胰岛素抵抗模型的研究条件和判断标准纷繁不一,需要有更加系统和全面的研究确立一套建模的标准程序和方法。
Funding Statement
国家重点研发计划项目(2016YFD0400603)
National Key Research and Development Program(2016YFD0400603)
References
- 1.Rees DA, Alcolado JC. Animal models of diabetes mellitus. Diabet Med. 2005;22(4):359–370. doi: 10.1111/j.1464-5491.2005.01499.x. [DOI] [PubMed] [Google Scholar]
- 2.Malik VS, Willett WC, Hu FB. Global obesity: trends, risk factors and policy implications. Nat Rev Endocrinol. 2013;9(1):13–27. doi: 10.1038/nrendo.2012.199. [DOI] [PubMed] [Google Scholar]
- 3.Chen D, Wang MW. Development and application of rodent models for type 2 diabetes. Diabetes Obes Metab. 2005;7(4):307–317. doi: 10.1111/j.1463-1326.2004.00392.x. [DOI] [PubMed] [Google Scholar]
- 4.Panchal SK, Brown L. Rodent models for metabolic syndrome research. J Biomed Biotechnol. 2011;2011:351982. doi: 10.1155/2011/351982. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.张 小华, 张 汝学, 贾 正平, et al. 高脂饮食和地塞米松联合诱导胰岛素抵抗大鼠模型. 中国实验动物学报. 2008;16(5):325–329. [Google Scholar]
- 6.Chen SH, Zhuang XH, Liu YT, et al. Expression and significance of lipin1 and AMPKalpha in hepatic insulin resistance in diet-induced insulin resistance rats. Exp Clin Endocrinol Diabetes. 2012;120(2):84–88. doi: 10.1055/s-0031-1298013. [DOI] [PubMed] [Google Scholar]
- 7.Marques C, Meireles M, Norberto S, et al. High-fat diet-induced obesity rat model: a comparison between Wistar and Sprague-Dawley rat. Adipocyte. 2016;5(1):11–21. doi: 10.1080/21623945.2015.1061723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Davidson EP, Coppey LJ, Dake B, et al. Effect of treatment of Sprague-Dawley rats with AVE7688, enalapril, or candoxatril on diet-induced obesity. J Obes. 2011;2011:686952. doi: 10.1155/2011/686952. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Reed MJ, Meszaros K, Entes LJ, et al. A new rat model of type 2 diabetes: the fat-fed, streptozotocin-treated rat. Metabolism. 2000;49(11):1390–1394. doi: 10.1053/meta.2000.17721. [DOI] [PubMed] [Google Scholar]
- 10.王 智华, 宋 光耀, 刘 晶, et al. 高脂饮食诱发胰岛素抵抗大鼠模型的建立与评价. 现代中西医结合杂志. 2012;21(3):244–245. [Google Scholar]
- 11.Svegliati-Baroni G, Candelaresi C, Saccomanno S, et al. A model of insulin resistance and nonalcoholic steatohepatitis in rats: role of peroxisome proliferator-activated receptor-alpha and n-3 polyunsa-turated fatty acid treatment on liver injury. Am J Pathol. 2006;169(3):846–860. doi: 10.2353/ajpath.2006.050953. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hariri N, Thibault L. High-fat diet-induced obesity in animal models. Nutr Res Rev. 2010;23(2):270–299. doi: 10.1017/S0954422410000168. [DOI] [PubMed] [Google Scholar]
- 13.那 立欣, 赵 丹, 宁 华, et al. 减肥功能实验动物模型的改良. 卫生研究. 2010;39(2):162–164. [PubMed] [Google Scholar]
- 14.Kleiner DE, Brunt EM, van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41(6):1313–1321. doi: 10.1002/hep.20701. [DOI] [PubMed] [Google Scholar]
- 15.Levin BE, Dunn-Meynell AA, Balkan B, et al. Selective breeding for diet-induced obesity and resistance in Sprague-Dawley rats. Am J Physiol. 1997;273(2 Pt 2):R725–R730. doi: 10.1152/ajpregu.1997.273.2.R725. [DOI] [PubMed] [Google Scholar]
- 16.Cheng HS, Ton SH, Phang S, et al. Increased susceptibility of post-weaning rats on high-fat diet to metabolic syndrome. J Adv Res. 2017;8(6):743–752. doi: 10.1016/j.jare.2017.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Giles ED, Jackman MR, Maclean PS. Modeling diet-induced obesity with obesity-prone rats: Implications for studies in females. Front Nutr. 2016;3(3):50. doi: 10.3389/fnut.2016.00050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ghibaudi L, Cook J, Farley C, et al. Fat intake affects adiposity, comorbidity factors, and energy metabolism of sprague-dawley rats. Obes Res. 2002;10(9):956–963. doi: 10.1038/oby.2002.130. [DOI] [PubMed] [Google Scholar]
- 19.Chalkley SM, Hettiarachchi M, Chisholm DJ, et al. Long-term high-fat feeding leads to severe insulin resistance but not diabetes in Wistar rats. Am J Physiol Endocrinol Metab. 2002;282(6):E1231–E1238. doi: 10.1152/ajpendo.00173.2001. [DOI] [PubMed] [Google Scholar]
- 20.Malvi P, Piprode V, Chaube B, et al. High fat diet promotes achievement of peak bone mass in young rats. Biochem Biophys Res Commun. 2014;455(1-2):133–138. doi: 10.1016/j.bbrc.2014.10.131. [DOI] [PubMed] [Google Scholar]
- 21.Lumeng CN, Saltiel AR. Inflammatory links between obesity and metabolic disease. J Clin Invest. 2011;121(6):2111–2117. doi: 10.1172/JCI57132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Karalis KP, Giannogonas P, Kodela E, et al. Mechanisms of obesity and related pathology: Linking immune responses to metabolic stress. FEBS J. 2009;276(20):5747–5754. doi: 10.1111/j.1742-4658.2009.07304.x. [DOI] [PubMed] [Google Scholar]
- 23.Hotamisligil GS. Inflammatory pathways and insulin action. Int J Obes Relat Metab Disord. 2003;27(Suppl 3):S53–55. doi: 10.1038/sj.ijo.0802502. [DOI] [PubMed] [Google Scholar]
- 24.Shapiro H, Lutaty A, Ariel A. Macrophages, meta-inflammation, and immuno-metabolism. Scientific World J. 2011;11(6):2509–2529. doi: 10.1100/2011/397971. [DOI] [PMC free article] [PubMed] [Google Scholar]