Abstract
目的
评价MRI对肾细胞癌下腔静脉瘤栓侵犯下腔静脉壁的诊断价值。
方法
回顾性分析2010—2018年在北京大学第一医院行肾根治性切除术及下腔静脉取栓术的肾细胞癌患者,术前行1.5 T或3.0 T MRI检查的56例患者被纳入本研究。由两位影像科医生测量术前MRI图像瘤栓所在水平肾静脉及下腔静脉最大径、下腔静脉瘤栓的长度,并评判瘤栓是否充满下腔静脉腔达两侧缘、瘤栓边缘是否光滑、瘤栓与下腔静脉壁分界是否清晰、下腔静脉壁正常信号是否改变等征象。基于病理证实下腔静脉壁受累与否将患者分为两组,对临床资料及MRI征象进行单因素分析及多因素回归分析。
结果
56例患者中男性43例、女性13例,平均年龄(55.64±0.43)岁,有17例(30.4%)病理证实下腔静脉壁受累, 大部分为透明细胞癌。下腔静脉壁受累组与非受累组比较,下腔静脉瘤栓的长度更长[(7.91±3.59) cm vs. (5.94±3.57) cm,P=0.049]、瘤栓充满下腔静脉腔(P=0.002)、瘤栓边缘不光滑(P=0.005)、瘤栓与下腔静脉壁分界不清晰(P=0.001)、下腔静脉壁正常信号改变(P<0.001)出现的概率更大,结合这五个指标诊断下腔静脉壁受累的敏感性及特异性为94.12%和79.49%。
结论
MRI可作为评估下腔静脉瘤栓侵犯静脉壁的方法,结合下腔静脉瘤栓的长度及MRI征象可以获得较高的诊断敏感性及特异性。
Keywords: 癌, 肾细胞, 瘤栓, 腔静脉, 下, 磁共振成像
Abstract
Objective
To evaluate the diagnostic performance of MRI for the assessment of inferior vena cava (IVC) wall invasion by IVC thrombus in patients with renal cell carcinoma (RCC).
Methods
We retrospectively collected patients who underwent radical nephrectomy and thrombectomy for RCC between 2010 and 2018 at Peking University First Hospital. All the patients underwent imaging on a 1.5 Tesla or 3.0 Tesla MRI scanner. Fifty-six patients met the inclusion criteria. Preoperative imaging was reviewed by two radiologists blinded to details of the patient’s surgical procedure and histopathology. Two radiologists measured the maximum anterior-posterior diameter and coronal diameters of the IVC and renal vein, and the craniocaudal extent of tumor thrombus, and evaluated the MRI features of IVC thrombus, including occlusion of the IVC lumen,the margin of the tumor thrombus (smooth vs. irregular), contact of the IVC thrombus and IVC wall, and altered signal of the IVC wall. Univariable and multivariable associations of clinical and radiographic features with IVC wall invasion were evaluated by Logistic regression.
Results
Of the 56 patients [male: 43, female: 13, mean age: (55.64±0.43) years], 17 (30.36%) were detected with IVC wall invasion, and most were clear cell carcinoma. Tumor thrombus with IVC wall invasion showed an increase in length of IVC thrombus [(7.91±3.59) cm vs. (5.94±3.57) cm, P=0.049], and more features of complete occlusion of the IVC lumen (P=0.002),irregular margin of the IVC thrombs (P=0.005), contact of the IVC thrombus and IVC wall (P=0.001), and altered signal of the low-intensity vessel wall (P<0.001), with a sensitivity of 94.12% and a specificity of 79.49%.
Conclusion
The present study indicates that MRI could be a means of evaluating RCC with IVC wall invasion, and the combination of tumor thrombus length and subjective impression of IVC wall invasion achieved a high sensitivity and specificity for diagnosis.
Keywords: Carcinoma, renal cell, Thrombus, Vena cava, inferior, Magnetic resonance imaging
肾细胞癌(肾癌)是最常见的肾恶性肿瘤,约占所有恶性肿瘤的4%[1],有10%左右合并下腔静脉瘤栓[2]。肾癌合并下腔静脉瘤栓,如果术前没有发现局部淋巴结或远处转移,肾根治性切除术及彻底切除瘤栓是目前最有效的治疗手段,不合并转移的患者术后5年生存率约30%~70%[3]。
虽然MRI与CT对于肾癌分期的诊断准确性相当,但MRI仍然被认为是评估肾癌静脉瘤栓的标准方法[4,5]。MRI可评估肾癌瘤栓累及范围,采用美国梅奥(Mayo)中心的五级分类法:0级,瘤栓局限在肾静脉内;Ⅰ级,瘤栓侵入下腔静脉,瘤栓顶端距肾静脉开口处≤2 cm;Ⅱ级,瘤栓侵入肝静脉水平以下的下腔静脉内,瘤栓顶端距肾静脉开口>2 cm;Ⅲ级,瘤栓顶端达肝内下腔静脉水平,膈肌以下;Ⅳ级,瘤栓侵入膈肌以上的下腔静脉[6]。同时,MRI还可以帮助预测瘤栓是否侵犯下腔静脉壁。如果瘤栓不累及下腔静脉壁,只需要进行瘤栓取出术;当瘤栓侵犯下腔静脉壁需要进行下腔静脉段切除及下腔静脉血管重建时,手术难度增加,且下腔静脉壁受侵的患者预后不良[4,7-8]。因此,术前除了进行肿瘤分期,下腔静脉瘤栓分级及下腔静脉壁是否受累的评估对于手术方式的制定非常重要。
肾癌瘤栓侵犯下腔静脉壁的影像学研究较少,尤其是MRI相关研究,且样本量都较少。本研究主要是探讨术前MRI预测肾癌瘤栓侵犯下腔静脉壁的效能。
1. 资料与方法
1.1. 患者一般资料
回顾性分析2010—2018年在北京大学第一医院因肾癌行肾根治性切除术及下腔静脉瘤栓取栓术患者,在病案系统“出院诊断”处查询“肾根治性切除术”患者,入组标准为:(1)病案“手术记录“里描述有“下腔静脉瘤栓取出”或“下腔静脉瘤栓切除”的病例;(2)患者术前1个月内在本院行MRI检查评估瘤栓;(3)患者的MRI检查序列完整、图像清晰、扫描范围足够包全下腔静脉瘤栓上界和下界。排除标准:MRI检查前或术前针对肾癌进行新辅助化疗、放疗或者介入治疗者。共收集符合要求的患者56例,记录患者的性别、手术时年龄、手术记录及病理结果。
1.2. MRI技术参数和图像评估
使用机型为1.5 T 或3.0 T的MRI仪器(Discovery 750-w,GE Healthcare或Siemens Healthcare),腹部线圈,扫描序列包括轴位正反相位T1WI、轴位T2压脂、轴位DWI(层厚6 mm,FOV 35~40 cm,矩阵256×256),冠状位T2 fiesta(GE Healthcare)或T2 ture-fisp(Siemens Healthcare)。
其中,43例行含钆对比剂增强检查,包括轴位动态增强、延时增强轴位、冠状位图像。动态增强参数如下:层厚4 mm,FOV 35~40 cm,矩阵256×256,对比剂量0.1 mmol/kg体重。静脉注射对比剂16~20 s后延时扫描,延时冠状位前后范围从下腔静脉腹侧至肾静脉背侧,上下范围从左心房至髂总静脉分叉部。
图像评估使用影像归档和通信系统(Picture Archiving and Communication Systems,PACS)工作站,由两位具有6年以上腹部MRI诊断经验的影像科医生完成,医生评估前不知道手术及病理资料,并且评估顺序随机。两位医生共同读片测量瘤栓所在水平轴位肾静脉最大前后径及冠状位最大上下径、轴位下腔静脉最大前后径及冠状位最大左右径、下腔静脉瘤栓的长度并进行瘤栓Mayo分级。两位医生再分别单独评判瘤栓是否充满下腔静脉腔达两侧缘、瘤栓边缘是否光滑、瘤栓与下腔静脉壁分界是否清晰、下腔静脉壁正常信号是否改变等征象,当两位医生评估征象意见不一致时由第三位高年资医生最终确认。将下腔静脉壁正常信号改变定义为T1WI及T2WI图像下腔静脉壁的正常信号不完整、不连续或出现肿瘤信号。
1.3. 术中评估
术中评估瘤栓与静脉壁粘连情况,共25例因瘤栓取出困难而行下腔静脉段切除,其中病理证实静脉壁为肿瘤细胞浸润者17例。余31例瘤栓均没有发现与静脉壁粘连,取出容易且完整取出。
1.4. 统计学方法
以病理诊断为金标准,将入组患者分为下腔静脉壁受累及不受累两组。对计量评估指标(年龄、下腔静脉瘤栓长度、肾静脉径线、下腔静脉径线)采用Mann-Whitney秩和检验,对计数评估指标(性别、肿瘤病理类型、瘤栓分级、瘤栓是否充满下腔静脉、瘤栓与下腔静脉壁分界是否清晰、瘤栓边缘是否光滑、下腔静脉壁是否出现信号改变)采用单变量χ2检验,将单变量统计分析结果中差异有统计学意义的变量纳入二元Logistic回归,探究对诊断下腔静脉壁受累具有统计学差异的变量。使用SPSS 20.0统计学软件完成,以P<0.05为差异具有统计学意义。
2. 结果
共56例患者,其中男性43例、女性13例,年龄21~74岁,平均年龄(55.64±0.43)岁,43例病理诊断为透明细胞癌,其余病理类型较少,包括乳头状细胞癌8例、嫌色细胞癌2例、透明细胞癌混合乳头状细胞癌1例、透明细胞癌混合嫌色细胞癌1例、集合管癌1例。共17例患者下腔静脉壁受累,瘤栓合并血栓1例。
按下腔静脉瘤栓Mayo分级,Ⅰ级7例、Ⅱ级44例、Ⅲ级4例、Ⅳ级1例。基于瘤栓是否累及下腔静脉壁,将患者分为两组,对临床资料及影像学相关变量进行独立样本分析,结果提示,两组间差异有统计学意义的5个变量为:下腔静脉瘤栓长度、瘤栓与下腔静脉壁分界是否清晰、瘤栓是否充满下腔静脉、瘤栓边缘是否光滑及下腔静脉壁正常信号是否改变,其余变量在两组间差异没有统计学意义(表1和2)。对其中4个分类变量的OR值分析结果提示,当患者存在瘤栓与下腔静脉壁分界不清、瘤栓充满下腔静脉、瘤栓边缘不光滑及下腔静脉壁正常信号改变时,下腔静脉壁受累的风险会增加(表2),其中,下腔静脉壁正常信号改变这个指标的系数最大(34.29)。
1.
比较下腔静脉壁受累组及无受累组的临床资料
Clinical characteristics of the study population (IVC wall invasion group vs. no IVC wall invasion group)
| Items | Invasion (n=17) | No invasion (n=39) | Statistics | P |
| IVC,inferior vena cava. | ||||
| Age/years, x±s | 57.410±10.038 | 54.870±12.612 | 0.535 | 0.593 |
| Gender, n (%) | 1.759 | 0.180 | ||
| Male | 15 (88.235) | 28 (71.795) | ||
| Female | 2 (11.765) | 11 (28.205) | ||
| Pathology type, n (%) | 8.758 | 0.271 | ||
| Clear cell carcinoma | 13 (76.471) | 30 (76.923) | ||
| Papillary carcinoma | 2 (11.765) | 6 (15.385) | ||
| Chromophobe cell carcinoma | 0 | 2 (5.128) | ||
| Clear cell carcinoma mixed with papillary carcinoma | 0 | 1 (2.564) | ||
| Clear cell carcinoma mixed with chromophobe cell carcinoma | 1 (5.882) | 0 | ||
| Collecting duct carcinoma | 1 (5.882) | 0 | ||
| Thrombus level, n (%) | 3.893 | 0.273 | ||
| Ⅰ | 1 (5.882) | 6 (15.385) | ||
| Ⅱ | 13 (76.471) | 31 (79.487) | ||
| Ⅲ | 2 (11.765) | 2 (5.128) | ||
| Ⅳ | 1 (5.882) | 0 | ||
2.
比较下腔静脉壁累组及无受累组MRI特征
MRI features of the study population (IVC wall invasion group vs. no IVC wall invasion group)
| Items | Invasion (n=17) | No invasion (n=39) | Statistics | P | OR | 95%CI |
| IVC,inferior vena cava. | ||||||
| Contact of the IVC thrombus and IVC wall, n (%) | 11.793 | 0.001 | 12.000 | 2.398-60.050 | ||
| No contact | 2 (11.765) | 24 (61.538) | ||||
| Contact | 15 (88.235) | 15 (38.462) | ||||
| Occlusion of the IVC lumen, n (%) | 9.636 | 0.002 | 9.706 | 1.949-48.335 | ||
| Filling | 15 (88.235) | 17 (43.590) | ||||
| No filling | 2 (11.765) | 22 (56.410) | ||||
| Margin of the thrombus, n (%) | 7.806 | 0.005 | 5.804 | 1.585-21.245 | ||
| Smooth | 4 (23.529) | 25 (64.103) | ||||
| Irregular | 13 (76.471) | 14 (35.897) | ||||
| Altered signal of the IVC wall, n (%) | 24.521 | 7.349×10-7 | 34.286 | 6.346-185.237 | ||
| Altered | 15 (88.235) | 7 (17.949) | ||||
| No altered | 2 (11.765) | 32 (82.051) | ||||
| Length of IVC thrombus/cm | 7.906±3.592 | 5.939±3.570 | 1.961 | 0.049 | ||
| Maximal anterior-posterior diameter of renal vein/cm | 1.877±0.549 | 1.744±0.520 | 0.957 | 0.339 | ||
| Maximal superior-inferior diameter of renal vein/cm | 1.953±0.532 | 1.926±0.559 | -0.080 | 0.936 | ||
| Maximal anterior-posterior diameter of IVC/cm | 3.288±0.704 | 2.672±1.300 | 1.837 | 0.066 | ||
| Maximal coronal diameter of IVC/cm | 3.041±0.780 | 2.672±1.300 | 1.641 | 0.101 | ||
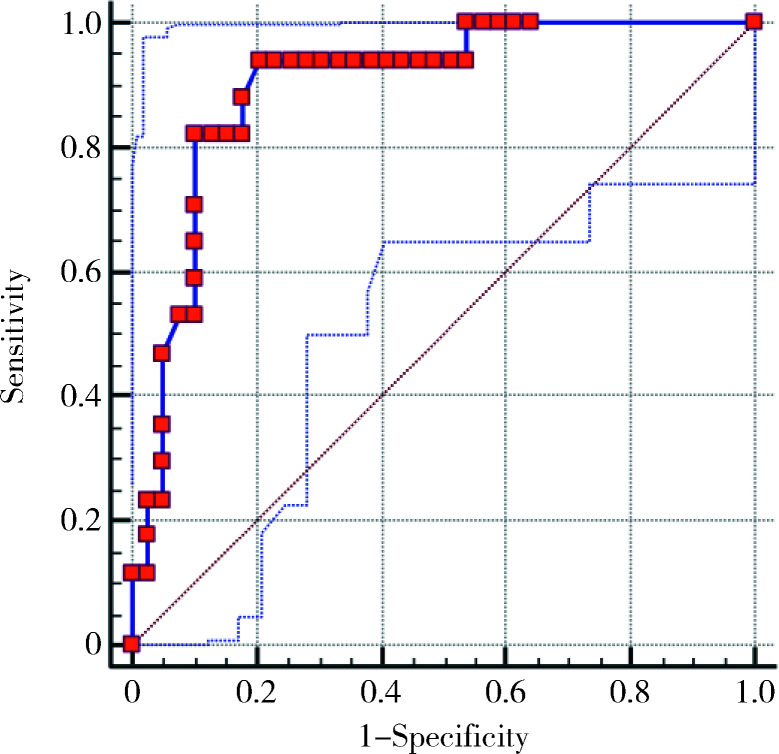
对以上差异具有统计学意义的5个变量进行随机组合,分别构建二元Logistic回归模型预测瘤栓对下腔静脉壁的侵犯,以找出最好的预测模型,结果显示,结合5个变量构建的模型的ROC曲线下面积最大,为0.897(95%CI 0.787~0.962),考虑此组合构建的模型最优。根据此模型绘制ROC曲线(图1),取最大AUC时,下腔静脉壁受累的诊断敏感性及特异性为94.12%和79.49%。
1.
结合5个MRI影像学指标二元Logistic回归ROC曲线
ROC curve based on the binary Logistic regression model
3. 讨论
近年来,研究认为下腔静脉壁受累是影响肾癌合并下腔静脉瘤栓患者预后的独立危险因素[9,10,11]。下腔静脉壁受累取栓困难,有可能要进行下腔静脉段切除及血管重建,手术难度增加。因此,术前评估肾癌瘤栓是否侵犯下腔静脉壁对于手术方式的制定有重要价值。由于MRI对瘤栓及瘤栓侵犯下腔静脉壁的诊断准确率高,中国的《肾癌伴静脉癌栓诊治专家共识》推荐下腔静脉MRI平扫+增强作为癌栓的评估方法之一[12]。
肾癌瘤栓侵犯下腔静脉壁的相关影像学研究国内外都有报道,但是大部分病例数不多,尤其是MRI研究,因此,有学者将行CT或MRI检查的肾癌合并下腔静脉瘤栓的患者都纳入到研究中[13]。既往研究多认为MRI对下腔静脉瘤栓的评估优于CT,例如MRI对下腔静脉瘤栓上缘的显示比CT更清晰[14]。也有研究认为,CT和MRI诊断下腔静脉瘤栓分级的效能相似[5,15-17],但目前尚未见有研究对二者进行系统自身对比研究。本研究只选择术前进行了MRI检查的肾癌合并下腔静脉瘤栓患者作为研究对象,样本量与国内外研究相比病例数较多,且同时结合了临床资料、主观的影像征象、下腔静脉和肾静脉管径定量指标进行综合分析,探讨MRI对下腔静脉瘤栓累及下腔静脉壁的预测。本研究发现,术前MRI结合以下5个影像学表现:下腔静脉瘤栓长度、瘤栓充满下腔静脉腔、瘤栓边缘不光滑、瘤栓与下腔静脉壁分界不清晰及下腔静脉壁正常信号改变,对诊断下腔静脉壁受累具有较好的敏感性及特异性,与既往的研究结果相似。
Adams等[18]研究MRI对肾癌瘤栓侵犯下腔静脉壁的预测,结果表明下腔静脉完全被瘤栓填充以及静脉壁中断破坏这两个指标诊断静脉壁侵犯具有较好的敏感性及特异性。还有一些研究认为,下腔静脉两侧壁均可见肿瘤信号是诊断静脉壁破坏及静脉壁受累的可靠征象[19,20,21]。
此外,下腔静脉管径越粗,静脉壁受侵犯的可能性越高。Alayed等[22]对24例肾癌合并下腔静脉瘤栓患者(11例侵犯下腔静脉壁)的MRI图像进行定量分析,发现有下腔静脉壁侵犯的患者肾静脉及下腔静脉管径更粗,瘤栓长度越长,瘤栓体积更大。Psutka等[13]则认为肾静脉开口处的管径≥24 mm可能提示下腔静脉壁受累。本研究中,下腔静脉壁受累组与未受累组患者的下腔静脉管径差异没有统计学意义。
既往认为MRI征象诊断下腔静脉壁侵犯的特异性高,敏感性为中等[18,20,23]。本研究发现,结合5个影像学征象的诊断敏感性较高,特异性则较既往研究稍低,这可能与本研究将5个影像学征象共同进行相关分析有关。
下腔静脉瘤栓强化或静脉壁增强是鉴别瘤栓与血栓的标准,而且可以更好地诊断下腔静脉壁受累。瘤栓的新生血管可能与下腔静脉壁粘连而造成下腔静脉壁受累;但血栓没有新生血管,不会强化[18,20],若完全为血栓,则认为下腔静脉壁未受累。本研究发现瘤栓强化并不是诊断下腔静脉壁受累的可靠征象,本组共43例患者行MRI增强检查,所有瘤栓均可见强化,其中1例合并血栓,只有16例发现下腔静脉壁受累。
本研究仍存在着一定的局限性。首先,本研究病例数较少,肾癌合并下腔静脉瘤栓并累及下腔静脉壁的发病率本身较低,且大多数患者到本院来就诊时已经在外院进行了比较完善的检查(包括超声、CT及MRI等),诊断较明确,因此,为了减少患者的就医成本,术前较少复查MRI。此外,我院影像中心自2009年9月才启用PACS,限制了本研究的病例收集时间范围,且前几年进行肾癌瘤栓MRI评估检查的病例也较少。因此,我们将进一步收集病例或者进行多中心研究。其二,本研究病例存在偏倚,Ⅱ级瘤栓较多,其他级别的瘤栓较少。第三,本院MRI机型较多,患者不在同一机器扫描,数据也可能存在偏倚。
总之,本研究表明MRI可以用于术前评估肾癌下腔静脉瘤栓是否侵犯下腔静脉壁。瘤栓长度越长、瘤栓充满下腔静脉腔、瘤栓边缘不光滑、瘤栓与下腔静脉壁分界不清晰及下腔静脉壁信号改变可能提示下腔静脉壁受累。
References
- 1.Motzer RJ, Jonasch E, Agarwal N, et al. Kidney cancer, version 2.2017: NCCN Clinical Practice Guidelines in oncology. J Natl Compr Canc Netw. 2017;15(6):804–834. doi: 10.6004/jnccn.2017.0100. [DOI] [PubMed] [Google Scholar]
- 2.Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update. Eur Urol. 2015;67(5):913–924. doi: 10.1016/j.eururo.2015.01.005. [DOI] [PubMed] [Google Scholar]
- 3.Hatcher PA, Anderson EE, Paulson DF, et al. Surgical management and prognosis of renal cell carcinoma invading the vena cava. J Urol. 1991;145(1):20–23. doi: 10.1016/s0022-5347(17)38235-6. [DOI] [PubMed] [Google Scholar]
- 4.Lawindy SM, Kurian T, Kim T, et al. Important surgical consi-derations in the management of renal cell carcinoma (RCC) with inferior vena cava (IVC) tumour thrombus. BJU Int. 2012;110(7):926–939. doi: 10.1111/j.1464-410X.2012.11174.x. [DOI] [PubMed] [Google Scholar]
- 5.Guo HF, Song Y, Na YQ, et al. Value of abdominal ultrasound scan, CT and MRI for diagnosing inferior vena cava tumour thrombus in renal cell carcinoma. Chin Med J (Engl) 2009;122(19):2299–2302. [PubMed] [Google Scholar]
- 6.Neves RJ, Zincke H. Surgical treatment of renal cancer with vena cava extension. Br J Urol. 1987;59(5):390–395. doi: 10.1111/j.1464-410x.1987.tb04832.x. [DOI] [PubMed] [Google Scholar]
- 7.Ciancio G, Livingstone AS, Soloway M. Surgical management of renal cell carcinoma with tumor thrombus in the renal and inferior vena cava: the University of Miami experience in using liver transplantation techniques. Eur Urol. 2007;51(4):988–994. doi: 10.1016/j.eururo.2006.11.055. [DOI] [PubMed] [Google Scholar]
- 8.Kwon TW, Kim H, Moon KM, et al. Surgical treatment of inferior vena cava tumor thrombus in patients with renal cell carcinoma. J Korean Med Sci. 2010;25(1):104–109. doi: 10.3346/jkms.2010.25.1.104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Hatakeyama S, Yoneyama T, Hamano I, et al. Prognostic benefit of surgical management in renal cell carcinoma patients with thrombus extending to the renal vein and inferior vena cava: 17-year experience at a single center. BMC Urol. 2013;(13):47. doi: 10.1186/1471-2490-13-47. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chen X, Li S, Xu Z, et al. Clinical and oncological outcomes in Chinese patients with renal cell carcinoma and venous tumor thrombus extension: single-center experience. World J Surg Oncol. 2015;(13):14. doi: 10.1186/s12957-015-0448-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Whitson JM, Reese AC, Meng MV. Population based analysis of survival in patients with renal cell carcinoma and venous tumor thrombus. Urol Oncol. 2013;31(2):259–263. doi: 10.1016/j.urolonc.2010.11.017. [DOI] [PubMed] [Google Scholar]
- 12.中华医学会泌尿外科学分化中国肾癌联盟, 中国肾癌伴下腔静脉癌栓诊疗写作组. 肾癌伴静脉癌栓诊治专家共识. 中华泌尿外科杂志. 2018;39(12):881–884. [Google Scholar]
- 13.Psutka SP, Boorjian SA, Thompson RH, et al. Clinical and radiographic predictors of the need for inferior vena cava resection du-ring nephrectomy for patients with renal cell carcinoma and caval tumour thrombus. BJU Int. 2015;116(3):388–396. doi: 10.1111/bju.13005. [DOI] [PubMed] [Google Scholar]
- 14.Hallscheidt PJ, Fink C, Haferkamp A, et al. Preoperative staging of renal cell carcinoma with inferior vena cava thrombus using multidetector CT and MRI: prospective study with histopathological correlation. J Comput Assist Tomogr. 2005;29(1):64–68. doi: 10.1097/01.rct.0000146113.56194.6d. [DOI] [PubMed] [Google Scholar]
- 15.Gupta NP, Ansari MS, Khaitan A, et al. Impact of imaging and thrombus level in management of renal cell carcinoma extending to veins. Urol Int. 2004;72(2):129–134. doi: 10.1159/000075966. [DOI] [PubMed] [Google Scholar]
- 16.Cuevas C, Raske M, Bush WH, et al. Imaging primary and se-condary tumor thrombus of the inferior vena cava: multi-detector computed tomography and magnetic resonance imaging. Curr Probl Diagn Radiol. 2006;35(3):90–101. doi: 10.1067/j.cpradiol.2006.02.006. [DOI] [PubMed] [Google Scholar]
- 17.Lawrentschuk N, Gani J, Riordan R, et al. Multidetector computed tomography vs magnetic resonance imaging for defining the upper limit of tumour thrombus in renal cell carcinoma: a study and review. BJU Int. 2005;96(3):291–295. doi: 10.1111/j.1464-410X.2005.05617.x. [DOI] [PubMed] [Google Scholar]
- 18.Adams LC, Ralla B, Bender YY, et al. Renal cell carcinoma with venous extension: prediction of inferior vena cava wall invasion by MRI. Cancer imaging. 2018;18(1):17. doi: 10.1186/s40644-018-0150-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Aslam Sohaib SA, Teh J, et al. Assessment of tumor invasion of the vena caval wall in renal cell carcinoma cases by magnetic resonance imaging. J Urol. 2002;167(3):1271–1275. doi: 10.1097/00005392-200203000-00015. [DOI] [PubMed] [Google Scholar]
- 20.Oto A, Herts BR, Remer EM, et al. Inferior vena cava tumor thrombus in renal cell carcinoma: staging by MR imaging and impact on surgical treatment. AJR Am J Roentgenol. 1998;171(6):1619–1624. doi: 10.2214/ajr.171.6.9843299. [DOI] [PubMed] [Google Scholar]
- 21.Laissy JP, Menegazzo D, Debray MP, et al. Renal carcinoma: diagnosis of venous invasion with Gd-enhanced MR venography. Eur Radiol. 2000;10(7):1138–1143. doi: 10.1007/s003309900296. [DOI] [PubMed] [Google Scholar]
- 22.Alayed A, Krishna Sk, Breau RH, et al. Diagnostic accuracy of MRI for detecting inferior vena cava wall invasion in renal cell carcinoma tumor thrombus using quantitative and subjective analysis. AJR Am J Roentgenol. 2019;212(3):562–569. doi: 10.2214/AJR.18.20209. [DOI] [PubMed] [Google Scholar]
- 23.Myneni L, Hricak H, Carroll PR. Magnetic resonance imaging of renal carcinoma with extension into the vena cava: staging accuracy and recent advances. Br J Urol. 1991;68(6):571–578. doi: 10.1111/j.1464-410x.1991.tb15417.x. [DOI] [PubMed] [Google Scholar]