Abstract
目的
研究生物陶瓷材料(iRoot BP Plus)作为盖髓剂用于乳牙牙髓切断术的临床可操作性和疗效,为临床应用提供参考依据。
方法
选择2016年9月至2017年9月到北京大学口腔医院第三门诊部儿科就诊患者,在乳磨牙的牙髓切断术中使用生物陶瓷材料作为盖髓剂,以治疗时间为观察开始时间,以最后一次拍摄X线片的时间为观察终点时间,对患牙进行定期随访观察1年以上,每次复诊时记录患牙的临床检查和X线片检查情况,将患牙预后归为N、H、P0、PX、PY五类,N为临床和X线均未见异常,H为临床未见异常,X线表现为牙根生理性吸收,P0为临床未见异常,X线出现牙髓钙化、牙根吸收等改变,但暂时无需治疗,PX为临床出现或未出现异常,X线出现根尖周病变,需要根管治疗或拔除,PY为乳牙早失;其中N、H定义为成功,P0、PX、PY定义为失败。
结果
截至2018年9月,共纳入患牙40颗(患者34人),初诊年龄为3.1~8.5岁,平均(4.7±1.2)岁,观察时间12~24个月(中位时间16个月),患牙预后符合N的牙齿34颗,符合H的2颗,符合P0的1颗,符合PX的3颗,符合PY的0颗。使用生物陶瓷材料作为盖髓剂的乳磨牙牙髓切断术12个月成功率95%。
结论
使用生物陶瓷材料作为盖髓剂进行乳牙牙髓切断术取得满意疗效,可以作为盖髓剂用于乳牙牙髓切断术的常规治疗。
Keywords: 牙髓切断术, 生物陶瓷, 乳磨牙
Abstract
Objective
To evaluate the clinical characteristics and effectiveness of bioceramic putty repairment (iroot BP Plus) used as pulp capping agents on pulpotomy in primary molars.
Methods
Forty primary molars were treated by pulpotomy with bioceramic putty repairmen as the pulp capping agents at the Third Clinical Division of Peking University School and Hospital of Stomatology, from September 2016 to September 2017. The children who were followed up over one year were selected as the subjects of this study. The teeth were checked clinically and radiographically during fixed intervals, and classified into one of five outcomes: N,H,P0,PX,PY. N, absence of clinical symptoms, and absence of apical radiolucency; H, absence of clinical symptoms, and nonpathologic radiographic change present; P0, absence of clinical symptoms, and pathologic change present, no need for treatment; PX, present or absence of clinical symptoms, pathologic change present treatment or extract immediately; PY, premature loss of deciduous tooth. Molars classified into N and H were regarded as successful, classified into P0,PX and PY were regarded as failed.
Results
Followed up for 12-24 months (the average follow up time was 16months),thirty four children were finally included, aged from 3.1 years to 8.5 yaers (the average age was 4.3 years), forty primary molars were included. Thirty four primary molars were included into N group, with absence of clinical symptoms, absence of apical radiolucency. Two molars were included into H group with physiological root absorption. One molar was included into P0 group with absence of clinical symptoms butinternal absorption of the root. Three molars were included into PX group, with gingival fistula and apical radiolucency. None was included into PY group. Thirty six teeth got successful treatment, four molars failed. One year success rate of pulpotomy of primary molars using bioceramic putty repairment was 95%.
Conclusion
Current evidence suggests that bioceramic putty repairment as a pulpotomy medicament showed satisfied clinical and radiographic result in pulpotomy of primary molars. Bioceramic putty repairment is an acceptable material when used in pulpotomy of primary molars.
Keywords: Pulpotomy, Bioceramic, Primary molars
乳牙牙髓切断术是乳牙常用的治疗方法,当乳牙龋坏侵犯牙髓的早期,可去除已被感染的冠髓,应用盖髓剂保留未感染根髓,保持根髓于正常的生理状态,有利于继承恒牙萌出。目前,三氧化矿物凝聚体(mineral trioxide aggregate,MTA)被认为是用于乳牙牙髓切断术理想盖髓剂[1],MTA具有良好的封闭性、生物相容性和细胞诱导作用,可以促进乳牙牙髓细胞的增殖分化,诱导钙化桥的形成[2]。近年来,一些新的生物活性材料相继问世,并得到推广应用[3],其中研究证实iRoot BP Plus作为一种生物陶瓷材料,具有与MTA相似的生物学及理化性能,同样具有良好的封闭性[4]、生物相容性[5]、低细胞毒性[6]、抗微生物作用[7]、促进组织再生能力[8],这些特性使其在根尖倒充填、根尖封闭、髓腔穿孔修补、活髓保存治疗等领域得到推广使用,但这些研究多集中于基础研究及恒牙的临床研究,关于生物陶瓷材料用于乳牙牙髓切断术的研究未见报道。本研究旨在观察这种材料作为盖髓剂在乳牙牙髓切断术中的临床疗效,为临床应用提供参考依据。
1. 资料与方法
1.1. 病例选择
纳入标准:(1)在北京大学口腔医院第三门诊部就诊的患儿;(2)患儿乳磨牙深龋洞近髓,去净腐质后露髓、或者在洞底及近髓角处透红,无自发痛史,无叩痛,不松动,周围牙龈未见异常,X线检查龋坏近髓腔,未见根尖周及根分歧异常,未见牙根内外吸收及根管钙化等病理变化,牙根生理吸收不超过1/4;(3)治疗前有X线片,随访时间截止时至少有一张X线片,临床和X线片观察期均不低于12个月;(4)全身健康状况良好,治疗中合作。排除标准:(1) 治疗时牙根吸收>1/4;(2) 治疗后失访,没有拍摄观察期12个月或12个月以上的X线片;(3)治疗中不合作。
1.2. 实验方法
治疗前判断患牙龋坏情况和牙髓状态,拍摄术前X线片,观察牙根发育状态、根尖周状态、恒牙胚发育状态,为术后复查提供参考。
临床治疗操作按照北京大学口腔医院制定的《儿童口腔科诊疗指南与护理常规》[9]进行,所有患牙均在局部麻醉无痛状态下进行,使用橡皮障隔湿系统,患牙在去除腐质后,使用牙髓切断无菌手术包操作,去除牙髓至根管口,生理盐水10 mL冲洗去除牙本质碎屑及牙髓残片,放置生理盐水棉球5 min止血,放置约2 mm厚的生物陶瓷材料,用无菌湿棉球覆盖1 min,用光固化玻璃离子垫底,树脂充填或预成冠修复。
治疗后对患者进行随访观察,以治疗时间为观察开始时间,以最后一次拍摄X线片的时间为观察终点时间,对患牙进行定期随访观察1年以上,随访时间分别为术后每3个月复诊一次,复诊时记录患牙的主诉、临床检查情况,包括充填体完好度、叩痛、松动度、牙龈状态,并在3、6、12、18、24个月时拍摄X线片,检查根尖周有无病变、牙根有无吸收、恒牙胚冠方骨硬板是否完好。
1.3. 疗效评价
参考Casas等[10]和窦桂丽等[11]既往同类研究, 结合临床制定评价指标如下:N:临床表现无异常, 无自发痛、咬合痛等疼痛症状, 无叩痛、病理性松动、牙龈肿胀等体征; X线表现正常, 无牙周膜增宽、根尖周和根分歧病变、根管钙化、牙根内外吸收等病理表现。H:临床表现未见异常;X线检查与同颌同名牙或对颌同名牙相比较, 牙根吸收与生理吸收相关。P0:临床表现未见异常; X线有牙周膜增宽、根管钙化、牙根内外吸收不伴有根周病变等, 但不需要立即治疗, 有待观察。PX:临床表现未见异常, 或临床表现异常, 如疼痛、牙龈肿胀、瘘管、充填体严重缺陷(如充填体折断致根管口暴露等); X线表现为根尖周或根分歧病变、伴或不伴有牙根内外吸收等, 需要进行根管治疗或拔除等。PY:乳牙早失, 继承恒牙未萌或者继承恒牙牙根长度发育不足1/2。N、H为治疗成功,P0、PX、PY为治疗失败。
2. 结果
2016年9月至2017年9月,符合纳入标准的患者34人,男孩15人,女孩19人,初诊年龄为3.1~8.5岁,平均(4.7±1.2)岁,纳入乳磨牙40颗,其中上颌第一乳磨牙9颗,上颌第二乳磨牙6颗,下颌第一乳磨牙11颗,下颌第二乳磨牙14颗;治疗后21颗牙采用预成冠修复,19颗牙采用树脂充填。
观察期截至2018年9月,观察时间为12~24个月(中位时间16个月), 符合N标准的牙齿有34颗(图1);符合H标准的牙齿有2颗,分别在术后12、13个月时脱落,恒牙随之萌出,牙根发育至1/2,未见釉质发育异常,其对侧同名牙(无牙髓根尖周病变)牙根也基本吸收,因此该2颗牙也判断为成功(图2);符合P0标准的牙齿有1颗,患牙在术后4个月开始观察到牙根内吸收,在术后19个月时观察到根管钙化,无临床表现(图3);符合PX标准的牙齿有3颗,分别在术后8、15、22个月时检查发现牙龈瘘管,拍摄根尖片显示有根尖周及根分歧病变,伴有或不伴有牙根的内外吸收(图4), 这3颗患牙中有1颗出现了继发龋坏,1颗出现了再发龋坏,1颗伴有继承恒牙胚先天缺失,其余患牙充填体均完好;符合PY 标准的患牙为0颗;所有患牙术后均未出现牙冠变色。
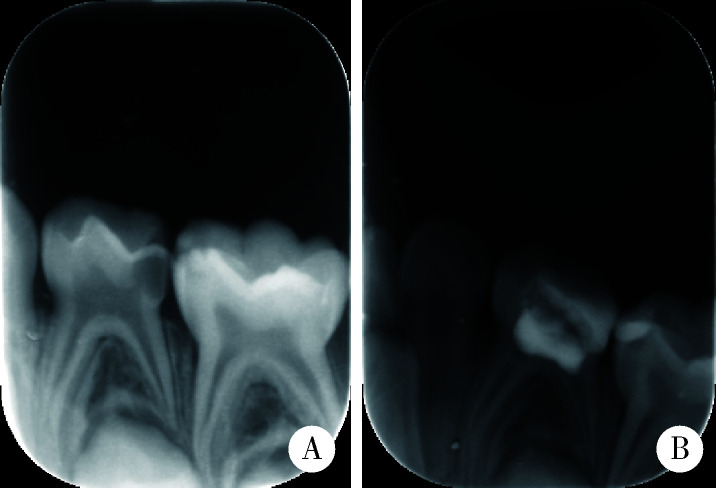
1.
牙髓切断术后1年成功
One year after pulpotomy, no pathological radiographic change could be seen
A,male,5.3-year-old, before treatment;B, 12 months after treatment.
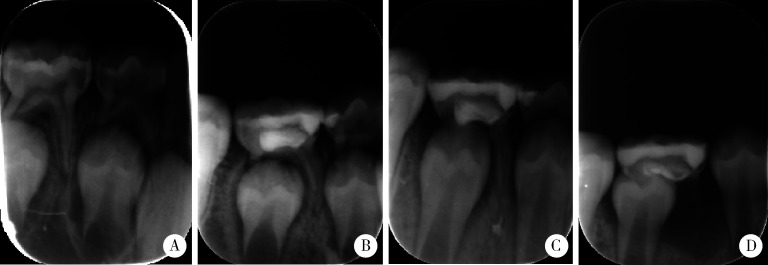
2.
牙髓切断术后13个月牙根生理性吸收
Thirteen months after pulpotomy, the root of the tooth was physiologically absorbed
A,female, 8.5-year-old, before treatment; B, 4 months after treatment; C, 7 months after treatment; D, 13 months after treatment.
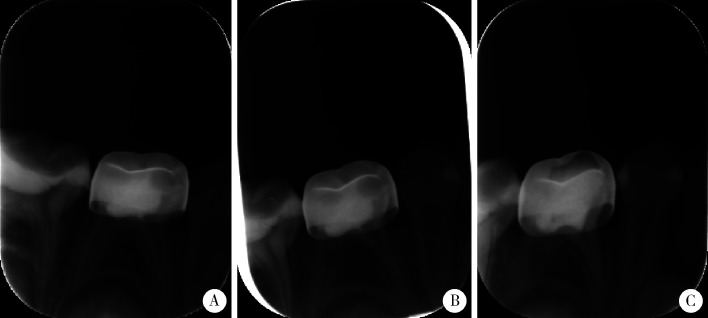
3.
牙髓切断术后牙根内吸收、根管钙化
Endodontic absorption and calcification happened to the canal after pulpotomy
A,female, 3.9-year-old, just after treatment; B, 4 months after treatment, endodontic absorption happened to the distal canal; C, 19 months after treatment, calcification happened to the distal canal.
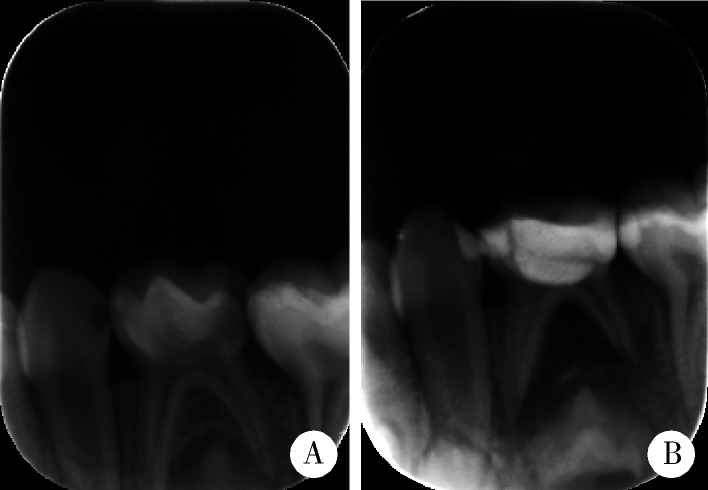
4.
牙髓切断术8个月后失败
Treatment of pulpotomy showed failure after 8 months
A, female, 4.1-year-old, before treatment; B, 8 months after treatment, and pathological radiographic changes could be seen unde the furcation.
本研究中,使用生物陶瓷材料作为盖髓剂进行乳磨牙冠髓切断术,12个月成功率是95%,但随着观察时间延长,失败的患牙增多,成功率下降。
3. 讨论
牙髓切断术是乳磨牙龋齿治疗重要的治疗手段之一,治疗成功的关键在于适应证的选择、无菌操作保证根髓无污染以及盖髓剂的选择[12]。理想的盖髓剂应具有良好的封闭性以隔绝外界刺激,具有良好的生物相容性以保护健康牙髓,具有抗微生物作用,具有促进组织再生能力以诱导牙髓细胞分化形成牙本质桥,具有良好理化性能以方便临床操作,并具有一定抗压强度。传统的盖髓材料不能达到理想的临床效果,甲醛甲酚的细胞毒性较强[13],氢氧化钙制剂中氢氧离子释放过快会造成牙髓细胞胞浆pH值过高,抑制牙髓细胞代谢,造成牙髓弥漫性炎症和牙根内外吸收[14]。MTA问世后,基本能达到盖髓剂的要求,在临床上获得了满意的疗效,国外有研究报道MTA用于乳牙牙髓切断术的成功率为90.9% ~ 95.0%[15,16,17],在北京大学口腔医院的一项回顾研究中,MTA用于乳磨牙牙髓切断术的1、1.5、2年牙齿保存率分别为98.5%、92.9%、90.9%[11],与本研究的结果相近。
但是,MTA材料也有一些局限性,其使用前需要将粉剂与蒸馏水混合使用,难以确保材料的均质性,固化时间长,含三氧化二铋、铁、镁元素易使牙冠变色等,三氧化二铋还可能增加MTA细胞毒性,抑制细胞增殖[18],而生物活性陶瓷材料则是色泽稳定的白色亲水性修复材料,由直径为10~50 nm的均质纳米颗粒组成,主要成分包括硅酸钙、氧化锆、氧化钽、硫酸钙、过磷酸钙增稠剂和填料,是一种膏体,无需调拌,降低了配比调拌技术敏感性,操作方便,缩短了临床时间,以氧化钽、氧化锆代替了三氧化二铋,不造成牙冠变色。
在多项研究中证实了生物陶瓷材料具有与MTA相似或者更优的生物学性能,对牙髓细胞增殖无抑制作用,能够诱导成牙本质分化,在牙髓暴露界面形成钙化桥。Machado等[19]报道生物陶瓷材料对小鼠牙髓干细胞增殖分化的影响与MTA类似,均对牙髓细胞的增殖无抑制作用。Oncel等[20]发现生物陶瓷材料具有比MTA更高的诱导成牙本质分化能力。Zhang等[21]报道在小鼠盖髓术的体内模型中,牙髓与生物陶瓷材料之间形成比MTA组更厚的修复性牙本质。Shi等[22]在比格犬尖牙直接盖髓的实验中发现生物陶瓷材料和MTA均能诱导牙髓暴露界面形成钙化桥,有效修复暴露的牙髓,与MTA不同的是生物陶瓷材料未见牙冠变色的现象。Azimi等[23]通过人前磨牙活髓切断随机对照试验发现两组样本在盖髓处均有牙体硬组织及钙化桥形成。
本研究使用生物陶瓷材料作为盖髓剂进行乳牙活髓切断术取得了较满意的结果,出现临床与X线失败的3例均采用的是树脂修复,而非预成冠修复,其中有2例患儿年龄均在4岁多,咽反射敏感,治疗后未予预成冠修复,分别在治疗后8、15个月时发现牙龈瘘管,同时发现有再发龋坏和继发龋坏,根管治疗中发现再发龋坏牙(牙位为左下第一乳磨牙)龋坏位于近中,继发龋坏牙(牙位为右下第二乳磨牙)龋坏位于充填体边缘,龋坏均至牙本质浅层,开髓后盖髓材料下方已形成钙化桥,质地较致密,疏通困难,疏通后远中根髓处于慢性炎症状态,近中根髓基本完好。另一例失败病例治疗时患儿6岁,牙位为左上第一乳磨牙,在左上第一乳磨牙和第二乳磨牙根方只有一颗恒牙胚,不能确定是第一双尖牙还是第二双尖牙缺失,该牙在治疗后22个月时发现牙龈瘘管,充填体完好,恒牙胚冠方骨硬板连续,该牙治疗失败是否与恒牙胚缺失有关尚不能确认。在既往研究中,Hutcheson等[24]在比较MTA牙髓切断术后树脂修复及预成冠修复的随机对照病例研究中,未发现两组在临床及影像学方面的差异,但发现术后1年树脂修复缺陷发生率高于预成冠修复。在北京大学口腔医院的回顾性研究中,采用金属预成冠修复较树脂修复患牙中位生存时间略长,但二者对患牙结局影响差异无统计学意义[11]。在2016年美国儿童牙医协会《乳牙和年轻恒牙牙髓治疗指南》中指出,如果乳磨牙预计在2年内替换,在剩余牙体组织支持和固位力足够的情况下,牙髓切断术后可以采用树脂修复,否则应用预成冠修复,预成冠能够防止微渗漏的产生,为根髓生存提供良好环境,也减少因充填体缺陷导致的治疗失败,有利于患牙的预后[25]。本实验中,临床失败的均为树脂修复病例,虽然未发现树脂充填修复与预成冠修复的患牙术后失败风险差异有统计学意义,失败后根管治疗中所见也不能证明治疗失败是因树脂修复缺陷引起,但仍然提示我们良好的冠部封闭对于牙髓切断治疗长期预后的重要性。
本研究尚存在不足,研究纳入的患牙数量不多,因为在无临床症状时,监护人不愿意拍摄X线片,导致符合纳入标准的患牙数量有限;研究中临床失败的3颗患牙中有2颗都出现了充填体缺陷,但因为数量较少,不能证明充填体缺陷和治疗失败的相关性;随访时间尚不够长,随着观察期的延长,治疗成功率在显著下降,希望今后能收集更多的病例,并进行更长时间的跟踪随访,为生物陶瓷材料用作乳牙牙髓切断术盖髓剂的预后研究提供更多的证据。
综上所述,本研究证实,生物陶瓷材料可以作为盖髓剂用于乳牙牙髓切断术常规治疗,不会造成牙齿变色,但其远期成功率尚需进一步临床追踪观察。
Footnotes
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
References
- 1.Simancas-Pallares MA, Díaz-Caballero AJ, Luna-Ricardo LM. Mineral trioxide aggregate in primary teeth pulpotomy. A systema-tic literature review. Avances En Odontoestomatología. 2011;27(2):91–98. [Google Scholar]
- 2.王 敏永, 刘 鹤, 李 盛林, et al. 三氧化矿物凝聚体对乳、恒牙牙髓细胞增殖和分化影响的比较. 华西口腔医学杂志. 2015;33(1):75–79. [Google Scholar]
- 3.Shivani U, RuchikaRoongta N, Sangeeta T. Current perspectives of bio-ceramic technology in endodontics: calcium enriched mixture cement, review of its composition, properties and applications. Restor Dent Endod. 2015;40(1):1–13. doi: 10.5395/rde.2015.40.1.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.de Souza ET, Tameirão N, Roter JM, et al. Tridimensional quantitative porosity characterization of three set calcium silicate-based repair cements for endodontic use. Microsc Res Tech. 2013;76(10):1093–1098. doi: 10.1002/jemt.22270. [DOI] [PubMed] [Google Scholar]
- 5.Jiang Y, Zheng Q, Zhou X, et al. A comparative study on root canal repair materials: a cytocompatibility assessment in L929 and MG63 cells. Sci World J. 2014;2014(12):463826. doi: 10.1155/2014/463826. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ciasca M, Aminoshariae A, Jin G, et al. A comparison of the cytotoxicity and proinflammatory cytokine production of EndoSequence root repair material and ProRoot mineral trioxide aggregate in human osteoblast cell culture using reverse-transcriptase polymerase chain reaction. J Endod. 2012;38(4):486–489. doi: 10.1016/j.joen.2011.12.004. [DOI] [PubMed] [Google Scholar]
- 7.Lovato KF, Sedgley CM. Antibacterial activity of EndoSequence root repair material and ProRoot MTA against clinical isolates of enterococcus faecalis. J Endod. 2011;37(11):1542. doi: 10.1016/j.joen.2011.06.022. [DOI] [PubMed] [Google Scholar]
- 8.Shokouhinejad N, Nekoofar MH, Razmi H, et al. Bioactivity of EndoSequence root repair material and bioaggregate. Int Endod J. 2012;45(12):1127. doi: 10.1111/j.1365-2591.2012.02083.x. [DOI] [PubMed] [Google Scholar]
- 9.秦 满. 儿童口腔科诊疗指南与护理常规. Vol. 62 北京: 人民卫生出版社; 2015. [Google Scholar]
- 10.Casas MJ, Layug MA, Kenny DJ, et al. Two-year outcomes of primary molar ferric sulfate pulpotomy and root canal therapy. Pediatr Dent. 2004;26(1):44–48. [PubMed] [Google Scholar]
- 11.窦 桂丽, 吴 南, 赵 双云, et al. 乳磨牙牙髓切断术两年疗效观察及其影响因素回顾性分析. 北京大学学报(医学版) 2018;50(1):170–175. [Google Scholar]
- 12.Stanley HR. Pulp capping: conserving the dental pulp, can it be done? Is it worth it? Oral Surgery Oral Medicine Oral Pathology. 1989;68(5):628–639. doi: 10.1016/0030-4220(89)90252-1. [DOI] [PubMed] [Google Scholar]
- 13.Elmeligy O, Abdalla M, Elbaraway S, et al. Histological evaluation of electrosurgery and formocresolpulpotomy techniques in primary teeth in dogs. J Clin Pediatr Dent. 2001;26(1):81–85. doi: 10.17796/jcpd.26.1.w2243176tj661n8p. [DOI] [PubMed] [Google Scholar]
- 14.Hunter AR, Kirk EE, Robinson DH, et al. A slow release calcium delivery system for the study of reparative dentine formation. Dent Traumatol. 1998;14(3):112–118. doi: 10.1111/j.1600-9657.1998.tb00822.x. [DOI] [PubMed] [Google Scholar]
- 15.Harandi A, Forghani M, Ghoddusi J. Vital pulp therapy with three different pulpotomy agents in immature molars: a case report. Iran Endod J. 2013;8(3):145. [PMC free article] [PubMed] [Google Scholar]
- 16.Subramaniam P, Konde S, Mathew S, et al. Mineral trioxide aggregate as pulp capping agent for primary teeth pulpotomy: 2 year follow up study. J Clin Pediatr Dent. 2009;33(4):311–314. doi: 10.17796/jcpd.33.4.r83r38423x58h38w. [DOI] [PubMed] [Google Scholar]
- 17.Fernández CC, Martínez SS, Jimeno FG, et al. Clinical and radiographic outcomes of the use of four dressing materials in pulpotomized primary molars: a randomized clinical trial with 2-year follow-up. Int J Paediatr Dent. 2013;23(6):400. doi: 10.1111/ipd.12009. [DOI] [PubMed] [Google Scholar]
- 18.Asgary S, Parirokh M, Eghbal MJ, et al. Chemical differences between white and gray mineral trioxide aggregate. J Endod. 2005;31(2):101–103. doi: 10.1097/01.don.0000133156.85164.b2. [DOI] [PubMed] [Google Scholar]
- 19.Machado J, Johnson JD, Paranjpe A. The effects of endosequence root repair material on differentiation of dental pulp cells. J Endod. 2016;42(1):101. doi: 10.1016/j.joen.2015.08.007. [DOI] [PubMed] [Google Scholar]
- 20.Oncel TZ, Torun D, Demirkaya K, et al. Effects of “iRoot BP” and “white mineral trioxide aggregate” on cell viability and the expression of genes associated with mineralization. Int Endod J. 2015;48(10):986–993. doi: 10.1111/iej.12393. [DOI] [PubMed] [Google Scholar]
- 21.Zhang J, Zhu LX, Cheng X, et al. Promotion of dental pulp cell migration and pulp repair by a bioceramic putty involving FGFR-mediated signaling pathways. J Dent Res. 2015;94(6):853–862. doi: 10.1177/0022034515572020. [DOI] [PubMed] [Google Scholar]
- 22.Shi S, Bao ZF, Liu Y, et al. Comparison of in vivo dental pulp responses to capping with iRoot BP plus and mineral trioxide aggregate. Int Endod J. 2016;49(2):154. doi: 10.1111/iej.12439. [DOI] [PubMed] [Google Scholar]
- 23.Azimi S, Fazlyab M, Sadri D, et al. Comparison of pulp response to mineral trioxide aggregate and a bioceramic paste in partial pulpotomy of sound human premolars: a randomized controlled trial. Int Endod J. 2014;47(9):873–881. doi: 10.1111/iej.12231. [DOI] [PubMed] [Google Scholar]
- 24.Hutcheson C, Seale NS, Mcwhorter A, et al. Multi-surface composite vs stainless steel crown restorations after mineral trioxide aggregate pulpotomy: a randomized controlled trial. Pediatr Dent. 2012;34(7):460. [PubMed] [Google Scholar]
- 25.Dentistry AAOP. Guideline on pulp therapy for primary and young permanent teeth. Pediatr Dent. 2004;26(4):115–119. [PubMed] [Google Scholar]