Abstract
目的
旨在建立早期糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)大鼠模型。
方法
26只雄性SD大鼠经过适应性喂养1周后,分为对照组(n=6)和模型组(n=22)。模型组给予D12451高糖高脂饲料(碳水化合物的热量占比35%,脂肪的热量占比45%)喂养6周诱导胰岛素抵抗,对照组给予普通饲料。随后模型组按体质量给予35 mg/kg的链脲佐菌素(streptozocin,STZ)缓冲液腹腔注射诱导胰腺特异性损伤,对照组给予等量的缓冲液,48 h后测定模型组大鼠的随机血糖,大于16.7 mmol/L即认为2型糖尿病(type 2 diabetes mellitus,T2DM)造模成功。评价T2DM大鼠的一般特征,包括体质量、空腹血糖、糖耐量及胰岛素耐量。定期监测其热痛阈的变化,判断早期DPN出现的时间,最后测定大鼠的坐骨神经传导速率。
结果
模型组大鼠经过高糖高脂饮食喂养6周联合STZ腹腔注射后,T2DM造模成功。T2DM组与对照组相比,空腹血糖明显升高(P<0.001),糖耐量及胰岛素耐量均明显受损(分别为P<0.001,P=0.002)。模型建立成功后第17天,T2DM组与对照组相比表现出明显的热痛觉过敏(P=0.004),两组的坐骨神经传导速率差异无统计学意义(P=0.196)。
结论
高糖高脂饮食喂养大鼠6周联合35 mg/kg的STZ腹腔注射可成功诱导T2DM模型,表现为一定程度的胰岛素抵抗与胰岛素缺乏,此模型在第17天左右出现早期DPN,其中小纤维的损害早于大纤维。
Keywords: 糖尿病,2型; 糖尿病神经病变; 大鼠,Sprague-Dawley; 痛阈; 温度觉; 神经传导
Abstract
Objective
To create the early diabetic peripheral neuropathy (DPN) rat model. Me-thods: After one-week adaption, 26 male Sprague-Dawley (SD) rats were divided into two groups, the control group (n=6) and the model group (n=20). High-sucrose/high-fat diet (D12451, 35% of energy from carbohydrate, 45% of energy from fat) was given to the model group for six weeks to induce insulin resistance, meanwhile normal diet was given to the control group. Afterwards, streptozocin (STZ) buffer solution (35 mg/kg bodyweight) was injected into abdomen of the model group to induce specific pancreatic injury, meanwhile an equal amount of buffer solution was given to the control group. Then 48 h later, type 2 diabetes mellitus (T2DM) was supposed to be successfully induced according to the random blood glucose more than 16.7 mmol/L in the model group. Then the basic features of the T2DM rats were evaluated, including body weight, fasting blood glucose (FBG), glucose tolerance (oral glucose tolerance test, OGTT), and insulin tolerance (intraperitoneal insulin tolerance test, IPITT). Subsequently, withdrawal thermal latency (WTL) was measured regularly to determine when the early DPN occurred. Once confirmed, sciatic nerve conduction velocity (NCV) of all the rats was conducted.
Results
The T2DM rats were successfully induced in the model group through high-sucrose/high-fat diet for six weeks along with STZ intraperitoneal injection (35 mg/kg bodyweight). When compared to the control group, the T2DM rats had higher FBG (P<0.001), and the glucose tolerance and insulin tole-rance were both damaged (P<0.001 in OGTT, P=0.002 in IPITT). It was on the 17 th day when the T2DM rats became much more sensitive to heat stimulus compared to the control group (P=0.004). Meanwhile, the sciatic NCV was conducted. There was no significant difference between the early DPN group and the control group (P=0.196).
Conclusion
High-sucrose/high-fat diet for six weeks along with STZ intraperitoneal injection (35 mg/kg bodyweight) could successfully induce T2DM rat model, manifested by a certain extent of insulin resistance and deficiency of insulin secretion. It was about 17 days later when the early DPN emerged. In the early DPN, small fiber neuropathy came out earlier than large fiber neuropathy.
Keywords: Diabetes mellitus, type 2; Diabetic neuropathies; Rats,Sprague-Dawley; Pain threshold; Temperature sense; Neural conduction
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)是糖尿病常见的慢性并发症之一,以多发性周围神经病变最常见,任何周围神经,包括感觉、运动及植物神经均可受累[1]。一般其临床表现隐匿,早期识别困难,患者发病时已出现手足麻木、疼痛、无力等症状,临床上即使综合治疗其预后也不佳。因此,早期识别和治疗DPN至关重要,需要建立合适的动物模型用于研究。本研究以动物模型为基础建立早期DPN模型,为DPN药物治疗相关的研究模型建立参考,期待为未来早期识别临床DPN提供理论基础。
1. 材料与方法
1.1. 主要仪器与试剂
RB-200智能热板仪及BL-420E+生物机能实验系统,均购自成都泰盟软件有限公司。无特殊病原体(specific pathogen free, SPF)级大小鼠维持饲料(脂肪含量≥4%)购自北京科澳协力饲料有限公司。D12451高糖高脂饲料(配方:Research Diets-D12451,碳水化合物的热量占比35%,脂肪的热量占比45%),由北京华阜康生物科技股份有限公司定制。D-(+)-葡萄糖(货号G7528)购自Sigma公司。精蛋白生物合成人胰岛素注射液(诺和灵N)购自诺和诺德(中国)制药有限公司。5%(质量分数)戊巴比妥钠溶液由北京大学第一医院动物实验中心提供。
1.2. 实验动物
6周龄雄性Sprague-Dawley(SD)大鼠26只,购自北京维通利华实验动物科技有限公司,动物合格证号SCXK(京)2012-0001,平均体质量(154±4)g,饲养在北京大学第一医院实验动物中心SPF级动物室。给予大鼠维持饲料或D12451高糖高脂饲料喂养,自由进食、饮水,室温(22±2)℃,湿度55%±10%,光照与黑暗每12小时交替。本研究关于实验动物的所有相关实验处理和操作均经过北京大学第一医院临床研究伦理委员会审核通过。
1.3. 实验动物分组和流程
所有大鼠在适应性喂养1周后,随机分为正常对照组(n=6)和模型组(n=20)。模型组给予D12451高糖高脂饲料喂养6周,诱导胰岛素抵抗;正常对照组给予维持饲料喂养6周。随后,模型组按体质量腹腔注射35 mg/kg的STZ缓冲液(pH 4.1),诱导胰腺特异性损伤;正常对照组腹腔注射等量的缓冲液。评价48 h后模型组大鼠的随机血糖,大于16.7 mmol/L即认为2型糖尿病(type 2 diabetes mellitus, T2DM)大鼠造模成功[2]。造模成功后,糖尿病组继续高糖高脂饮食,正常对照组继续普通饮食。监测正常对照组与糖尿病组大鼠热痛阈的变化,当二者差异有统计学意义时,认为早期DPN模型建立(早期DPN组)。最后测定所有大鼠的坐骨神经传导速率(nerve conduction velocity, NCV)。每周监测体质量、进食量。实验动物分组和处理流程见图1。
1.
实验流程图
1.4. 口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)
大鼠隔夜禁食12 h,饮水不限,适应环境5~10 min后给予40%(质量分数)葡萄糖溶液灌胃,剂量为按体质量2 g/kg,分别于0、30、60、90、120 min用血糖仪测定尾尖血糖[3]。用血糖曲线下面积(area under curve, AUC)评价胰岛β细胞的敏感性。
1.5. 腹腔注射胰岛素耐量试验(intraperitoneal insulin tolerance test, IPITT)
大鼠隔夜禁食12 h,饮水不限,适应环境5~10 min后给予诺和灵N胰岛素溶液(生理盐水配制)腹腔注射,剂量为按体质量0.75 IU/kg,分别于0、30、60、90、120 min用血糖仪测定尾尖血糖[4]。用血糖AUC评价外周组织对胰岛素的反应性。
1.6. 热痛阈的测定
热痛阈反映的是周围神经小纤维的情况,糖尿病大鼠最初表现为热痛觉过敏[5]。本研究使用RB-200智能热板仪,热板加热至恒温55 ℃,让大鼠的足底接触恒温的热板,大鼠受热刺激而产生明显的抬足或舔后足动作作为疼痛的反应指标[6],以产生痛反应所需的时间(潜伏期)为足底热痛阈值,时间超过30 s要及时终止热刺激以免造成组织损伤[7]。每只大鼠重复3~4次,每次间隔15 min,取平均值[8]。每只大鼠在测试室的时间不超过1 h,以免大鼠脱水或对刺激停止反应(图2)。
2.

RB-200智能热板仪实物图
Picture of RB-200 intelligent hot plate
1.7. NCV的测定
NCV反映的是周围神经大纤维的情况,大纤维NCV的减慢是诊断糖尿病患者神经病变的金标准,也用于评估治疗效果[5]。本研究选取坐骨神经为靶点,检测坐骨神经NCV,代表周围神经的传导速率。大鼠腹腔注射5%戊巴比妥钠麻醉,俯卧位固定,术野脱毛,于坐骨神经走行切开皮肤,分离股四头肌肌肉组织至坐骨切迹,显露坐骨神经,用玻璃分针仔细分离双侧坐骨神经,全程注意用液体石蜡油保护坐骨神经,分离动作需轻、细,以免损伤神经。上至坐骨切迹,下至足踝部,充分暴露坐骨神经,分离后立即测定。将电极间距为2 mm的7联排钩状电极连接到BL-420E+生物机能实验系统,以钩状电极轻轻勾住坐骨神经,从近端至远端依次为一对刺激电极(连接刺激输出通道)、第1对参考电极+记录电极(连接1通道)、第2对参考电极+记录电极(连接2通道),见图3。
3.
坐骨神经传导速率测定原理
实验参数设定:模式细电压、方式单刺激、延时5.0、波宽0.05 ms、强度1.0 V、波间隔99。给予电刺激后,记录从坐骨神经近端到远端产生动作电位的潜伏期(Δt),两个记录电极间的距离(Δs)固定,则NCV=记录电极之间的距离/动作电位潜伏期之差,重复电刺激3次取平均值[9]。
1.8. 数据处理与统计分析
实验数据以均数±标准误表示,应用Graph-Pad Prism version 5.0中的非配对t检验,判断两组间差异是否有统计学意义,用梯形法则来分析AUC。P<0.05为差异有统计学意义。
2. 结果
2.1. 糖尿病大鼠的一般特征
高糖高脂饮食喂养1周后,对照组和模型组大鼠体质量差异有统计学意义(t=5.33,P<0.001)。到第6周,高糖高脂喂养的模型组体质量增加,但与对照组相比,差异无统计学意义(t=1.95,P=0.063,图4A)。
4.
糖尿病大鼠的一般特征
The basic characteristics of T2DM rat model
高糖高脂饮食6周联合35 mg/kg的STZ腹腔注射,诱导T2DM大鼠造模成功后,糖尿病组的血糖明显高于对照组(t=18.83,P<0.001,图4B)。比较两组OGTT的血糖AUC,糖尿病组明显大于对照组(t=20.22,P<0.001,图4C、D)。比较两组IPITT的血糖AUC,糖尿病组也明显大于对照组(t=3.94,P=0.002,图4E、F),可以认为糖尿病组大鼠存在胰岛素抵抗。
2.2. 糖尿病大鼠早期周围神经病变的特征
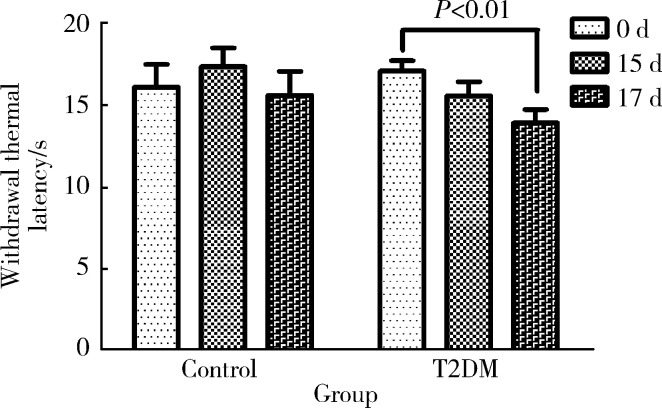
2.2.1 热痛阈 T2DM造模成功后,监测对照组与糖尿病组大鼠的热痛阈,发现从造模后第17天开始,糖尿病组大鼠的热痛阈较造模前明显下降(t=3.07,P=0.004),而对照组大鼠的热痛阈较前无明显变化(t=0.249,P=0.808),糖尿病组大鼠出现早期DPN(图5)。
5.
糖尿病造模成功后热痛阈的变化
Change of withdrawal thermal latency before and after modeling
2.2.2 神经传导速率 分别测定对照组与早期DPN组大鼠的坐骨神经NCV,两组间比较差异无统计学意义(t=1.31,P=0.196,图6)。
6.
早期糖尿病周围神经病变造模成功后两组间坐骨神经传导速率的比较
3. 讨论
本研究结果得出,高糖高脂饮食6周联合 35 mg/kg的STZ腹腔注射可成功诱导T2DM大鼠模型,表现为一定程度的胰岛素抵抗与胰岛素缺乏,T2DM大鼠模型建立成功后第17天出现早期DPN,早期DPN小纤维的损害早于大纤维。
由于1型糖尿病(type 1 diabetes mellitus, T1DM)占人类糖尿病人群的5%~10%,既往大部分临床前研究均以T1DM小鼠作为研究对象,随着研究数据的不断累积,认为T1DM和T2DM小鼠模型的表型大部分相似,包括大神经纤维传导减慢,进行性热感觉减退及表皮纤维的消失[5]。本研究选取大鼠为研究对象,相较于小鼠,测定坐骨神经NCV时更方便,用于后续组织学检测的神经组织也更充足。以T2DM大鼠为基础,监测DPN早期出现的时间,大鼠存在一定程度的胰岛素抵抗与胰岛素缺乏,更贴近于T2DM患者的实际情况。
以往有研究报道了应用不同喂养时间的高糖高脂饮食联合不同剂量的STZ腹腔注射诱导T2DM大鼠的模型[2,8-12]:(1)既往研究中,诱导胰岛素抵抗的饲料多为20%蔗糖、10%猪油(以热量占比计),本研究选取D12451高糖高脂饲料,含有碳水化合物热量占比35%、脂肪热量占比45%,糖脂所占能量比例更高,更好地模拟了T2DM肥胖患者的饮食习惯。(2)既往研究的诱导时间多为4~8周,STZ剂量多为30 mg/kg,本研究以高糖高脂喂养时间越长、大鼠体质量越大、给予STZ剂量越小为原则,在保证造模成功的前提下,设立了不同的高糖高脂饮食诱导时间,对应不同剂量的STZ腹腔注射进行预实验。与既往研究相比,选取高糖高脂饮食6周,可以诱导一定程度的胰岛素抵抗,且时长适中。选取35 mg/kg的STZ诱导胰腺特异性损伤,可以在提高造模成功率的同时,降低造模后死亡率。
针对大鼠DPN表型的评价,包括对大纤维(大直径的有髓Aα、Aβ纤维)及小纤维(直径小于7 μm的有髓Aδ纤维)的评价[13],其中小神经纤维受累更常见[14,15]。大纤维的评价指标包括NCV、轻触缩足阈值的测定及光学显微镜下对纤维形态的观察等,小纤维的评价指标包括热痛阈的测定、肉垫皮肤或角膜的小感觉神经纤维密度的测算等[5],其中常用的评价指标包括热痛阈、机械痛阈及NCV。既往研究多选用热痛阈作为评价DPN的指标[8,16-18],与皮肤组织病理的结果一致,方法可靠且为无创性操作,重复性好、简便易行。本研究以热痛阈作为早期DPN出现的监测指标,早期DPN表现为痛觉过敏,热痛阈检测结果就表现为阈值的减低。本研究中,当表现为明显的热痛觉过敏时,NCV未出现明显受损,与既往研究结果一致[13]。
本研究以T2DM大鼠模型为媒介,确立了早期DPN出现的时间,应用高糖高脂饮食喂养大鼠6周联合35 mg/kg的STZ腹腔注射,诱导了T2DM模型,造模成功后第17天早期DPN出现。我们期待这种造模方法可为DPN药物治疗提供相关研究参考,并为未来更早期识别临床DPN提供理论基础。
References
- 1.Singh R, Kishore L, Kaur N. Diabetic peripheral neuropathy: current perspective and future directions. Pharmacol Res. 2014;80:21–35. doi: 10.1016/j.phrs.2013.12.005. [DOI] [PubMed] [Google Scholar]
- 2.Shi X, Chen Y, Nadeem L, et al. Beneficial effect of TNF-α inhibition on diabetic peripheral neuropathy. J Neuroinflammation. 2013;10:69. doi: 10.1186/1742-2094-10-69. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bai J, Zhu Y, Dong Y. Response of gut microbiota and inflammatory status to bitter melon (Momordica charantia L.) in high fat diet induced obese rats. J Ethnopharmacol. 2016;194:717–726. doi: 10.1016/j.jep.2016.10.043. [DOI] [PubMed] [Google Scholar]
- 4.Ishibashi K, Hara A, Fujitani Y, et al. Beneficial effects of vildagliptin combined with miglitol on glucose tolerance and islet morphology in diet-controlled db/db mice. Biochem Biophys Res Commun. 2013;440(4):570–575. doi: 10.1016/j.bbrc.2013.09.110. [DOI] [PubMed] [Google Scholar]
- 5.Jolivalt CG, Frizzi KE, Guernsey L, et al. Peripheral neuropathy in mouse models of diabetes. Curr Protoc Mouse Biol. 2016;6(3):223–255. doi: 10.1002/cpmo.11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Balter RE, Dykstra LA. Thermal sensitivity as a measure of spontaneous morphine withdrawal in mice. J Pharmacol Toxicol Methods. 2013;67(3):162–168. doi: 10.1016/j.vascn.2013.02.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Shi W, Ding Y, Yu A, et al. BDNF/TRK/KCC2 pathway in nicotine withdrawal-induced hyperalgesia. Transl Neurosci. 2015;6(1):208–213. doi: 10.1515/tnsci-2015-0022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.宋庆芳. 游离脂肪酸与2型糖尿病周围神经病变的关系及其机制探讨 [D]. 石家庄: 河北医科大学, 2010.
- 9.吴庆秋. 枸杞多糖对氧化应激诱导2型糖尿病大鼠周围神经细胞凋亡的保护作用及其机制研究 [D]. 银川: 宁夏医科大学, 2010.
- 10.Ding Y, Dai X, Jiang Y, et al. Functional and morphological effects of grape seed proanthocyanidins on peripheral neuropathy in rats with type 2 diabetes mellitus. Phytother Res. 2014;28(7):1082–1087. doi: 10.1002/ptr.5104. [DOI] [PubMed] [Google Scholar]
- 11.Reed MJ, Meszaros K, Entes LJ, et al. A new rat model of type 2 diabetes: the fat-fed, streptozotocin-treated rat. Metabolism. 2000;49(11):1390–1394. doi: 10.1053/meta.2000.17721. [DOI] [PubMed] [Google Scholar]
- 12.Zhou JY, Zhou SW. Protection of trigonelline on experimental diabetic peripheral neuropathy. Evid Based Complement Alternat Med. 2012;164219 doi: 10.1155/2012/164219. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.邢国平. 糖尿病患者周围神经功能的神经电生理比较研究 [D]. 天津: 天津医科大学, 2009.
- 14.Chéliout-Héraut F, Zrek N, Khemliche H, et al. Exploration of small fibers for testing diabetic neuropathies. Joint Bone Spine. 2005;72(5):412–415. doi: 10.1016/j.jbspin.2004.10.003. [DOI] [PubMed] [Google Scholar]
- 15.Krämer HH, Rolke R, Bickel A, et al. Thermal thresholds predict painfulness of diabetic neuropathies. Diabetes Care. 2004;27(10):2386–2391. doi: 10.2337/diacare.27.10.2386. [DOI] [PubMed] [Google Scholar]
- 16.Hao GM, Liu YG, Wu Y, et al. The protective effect of the active components of ERPC on diabetic peripheral neuropathy in rats. J Ethnopharmacol. 2017;202:162–171. doi: 10.1016/j.jep.2017.03.015. [DOI] [PubMed] [Google Scholar]
- 17.Xu X, Yang X, Zhang P, et al. Effects of exogenous galanin on neuropathic pain state and change of galanin and its receptors in DRG and SDH after sciatic nerve-pinch injury in rat. PLoS One. 2012;7(5):e37621. doi: 10.1371/journal.pone.0037621. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Liao C, Yang M, Zhong W, et al. Association of myelinated primary afferents impairment with mechanical allodynia in diabetic peripheral neuropathy: an experimental study in rats. Oncotarget. 2017;8(38):64157–64169. doi: 10.18632/oncotarget.19359. [DOI] [PMC free article] [PubMed] [Google Scholar]