Abstract
目的
探索趋化因子CXCL10及其受体CXCR3基因在肝细胞癌(hepatocellular carcinoma,HCC)中的表达及其临床意义。
方法
通过挖掘癌症基因组图谱(the cancer genome atlas,TCGA)中HCC数据库和国际肝癌研究所(Liver Cancer Institute,LCI)中乙肝相关肝癌数据库,分析CXCL10基因和CXCR3基因在HCC及癌旁组织中的表达以及与患者术后总生存率的关系;采用实时荧光定量PCR(quantitative real-time PCR,qPCR)方法检测45例乙肝相关HCC患者临床样本中CXCL10基因和CXCR3基因的表达情况,并分析CXCL10和CXCR3基因表达的相关性。
结果
TCGA数据库中CXCL10基因在HCC组织中的表达显著高于癌旁组织(非配对样本:3.379±2.081 vs. 2.213±2.274,P<0.001;配对样本:3.159±2.267 vs. 2.213±2.274,P=0.018),LCI数据库中CXCL10基因在HCC组织中的表达显著高于癌旁组织(7.625±1.683 vs. 7.287±1.328,P=0.009),TCGA和LCI数据库中CXCL10基因高表达HCC患者术后总体生存率高于CXCL10基因低表达患者(P=0.107,P=0.002)。TCGA数据库中CXCR3基因在HCC组织的表达显著高于癌旁组织(非配对样本:-0.906±1.697 vs. -1.978±1.629,P<0.001;配对样本:-1.329±1.732 vs. -1.978±1.629,P=0.037),而LCI数据库中CXCR3基因在乙肝相关HCC组织的表达显著低于癌旁组织(3.989±0.339 vs. 4.074±0.309,P=0.003),但两个数据库中HCC组织CXCR3基因高表达患者的术后总体生存率均显著高于CXCR3基因低表达患者(P=0.004,P=0.014)。TCGA数据库中CXCL10基因与CXCR3基因在HCC和癌旁组织里的表达水平均呈正相关(r=0.584,P<0.001;r=0.776,P<0.001)。临床样本检测结果显示,CXCL10基因在乙肝相关HCC和配对癌旁组织里的表达水平分别为0.479(0.223,1.094)和0.484(0.241,0.846),均显著高于正常肝组织的0.131(0.106,0.159)(P=0.010,P<0.001), CXCR3基因在HCC和配对癌旁组织里的表达水平分别为0.011(0.006,0.019)和0.016(0.011,0.021),也显著高于正常肝组织的0.002(0.001,0.004)(P=0.004,P<0.001), 但CXCL10和CXCR3基因在HCC组织中的表达水平与配对癌旁组织相比差异均无统计学意义(P=1.000,P=0.374)。
结论
CXCL10在不同病因HCC组织中均呈高表达,CXCR3在乙肝相关HCC组织中呈低表达,HCC组织中CXCL10和CXCR3的高表达均利于HCC患者的术后生存。
Keywords: 趋化因子, 趋化因子受体, 肝细胞癌
Abstract
Objective
To explore the expression and clinical significance of chemokine CXCL10 and CXCR3 in hepatocellular carcinoma (HCC).
Methods
The expression and prognostic of CXCL10 and CXCR3 in HCC tumor tissues and non-tumor tissues were analyzed in two different publicly available databases the Cancer Genome Atlas (TCGA) and Liver Cancer Institute (LCI). In addition, quantitative real-time PCR (qPCR) was used to detect the mRNA expression of CXCL10 and CXCR3 in 45 HCC cli-nical samples with HBV infection background. Pearson correlation and Spearman rank correlation were used to determine the correlation between the expression level of CXCL10 and CXCR3 in tumor and non-tumor tissues.
Results
In TCGA database, the expression of CXCL10 in HCC tumor tissues was significantly higher than that in non-tumor tissues (nonpaired samples: 3.379±2.081 vs. 2.213±2.274, P<0.001; paired samples: 3.159±2.267 vs. 2.213±2.274, P=0.018). Similarly in LCI datebase (7.625±1.683 vs. 7.287±1.328, P=0.009). And higher CXCL10 expression was significantly associated with a better prognosis in the patients with HCC both in TCGA and LCI database (P=0.107, P=0.002). In TCGA database, the expression of CXCR3 in HCC tumor tissues was significantly higher than that in non-tumor tissues (nonpaired samples: -0.906±1.697 vs. -1.978±1.629, P<0.001; paired samples: -1.329±1.732 vs. -1.978±1.629, P=0.037), while lower in LCI database (3.989±0.339 vs. 4.074±0.309, P=0.003). In both databases, higher CXCR3 expression was significantly associated with a better prognosis in the HCC patients (P=0.004, P=0.014). Furthermore, in TCGA database, the expression level of CXCL10 and CXCR3 was positively correlated both in HCC tumor tissues and matched non-tumor tissues (r=0.584, P<0.001; r=0.776, P<0.001). The qPCR assay showed that the expression of CXCL10 in HBV-related HCC tumor tissues was significantly higher than those in normal liver tissues [0.479(0.223, 1.094) vs. 0.131(0.106, 0.159), P=0.010], and the expression in HBV-related non-tumor tissues was also significantly higher than those in normal liver tissues [0.484(0.241, 0.846) vs. 0.131(0.106, 0.159), P<0.001]. The same was true as CXCR3 [0.011(0.006, 0.019) vs. 0.002(0.001, 0.004), P=0.004; 0.016(0.011, 0.021) vs. 0.002(0.001, 0.004), P<0.001]. However there was no significant difference of CXCL10 and CXCR3 between tumor tissues and matched non-tumor tissues (P=1.000, P=0.374).
Conclusion
Expression of CXCL10 was up-regulated in HCC tissues, expression of CXCR3 was down-regulated in HBV-related HCC tissues, and the higher expression of both genes was correlated with better overall survival in HCC patients.
Keywords: Chemokine, Chemokine receptor, Hepatocellular carcinoma
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最常见的恶性肿瘤之一,其术后5年肿瘤复发转移率高达40%~70%[1]。HCC的致病因素主要包括慢性乙型肝炎病毒(hepatitis B virus,HBV)感染、慢性丙型肝炎病毒(hepatitis C virus,HCV)感染、食物黄曲霉毒素暴露、嗜酒以及非酒精性脂肪肝等[2]。我国的HCC发生多与慢性HBV感染有关,且大约70%~90%的乙肝相关HCC都有肝硬化背景[3],因此,阐明HCC特别是乙肝相关HCC的致病机制将对我国HCC防治具有重要意义。
趋化因子及其受体在肿瘤发生发展中发挥重要作用,趋化因子CXCL10是由干扰素-γ(interferon-γ, IFN-γ)诱导产生的一类趋化因子,CXCR3是CXCL10基因的唯一受体。近年的研究显示,CXCL10/CXCR3信号通路与炎症和肿瘤发生密切相关[4]。本研究通过对癌症基因组图谱(the cancer genome atlas,TCGA)和来自国际肝癌研究所(Liver Cancer Institute,LCI)数据库的HCC表达数据库挖掘,以及采用实时荧光定量PCR(quantitative real-time PCR,qPCR)方法检测45例乙肝相关HCC组织中CXCL10基因和CXCR3基因剪接异构体B(CXCR3B)的表达,分析CXCL10和CXCR3基因的异常表达与HCC患者预后的相关性,探索CXCL10基因和CXCR3 基因在HCC发生发展中的作用。
1. 资料与方法
1.1. 临床标本
45例原发性HCC患者的癌组织和配对癌旁组织样本取自郑州大学附属肿瘤医院接受肝癌手术切除的患者,HCC诊断标准参照中国2011年《原发性肝细胞癌诊疗规范》[5]。所有HCC患者均为男性,均有慢性HBV感染及肝硬化背景,并经病理学确诊。8例正常肝组织来源于肝血管瘤患者。本研究已获得北京大学生物医学伦理委员会审批(IRB00001052-12088), 所有研究对象均签署知情同意书。
1.2. TCGA和LCI数据库分析
TCGA肝细胞癌基因表达数据下载自美国Broad 研究所基因数据分析中心(http://gdac.broadinstitute.org/),采用FPKM(fragments per kilobase million)法对TCGA转录组测序数据进行标准化,并去除了部分重复检测的病例,最终纳入370例不同病因的HCC组织及50例癌旁组织的数据。
LCI肝细胞癌基因表达数据下载自高通量功能基因组数据GSE14520(http://www.ncbi.nlm.nih.gov/geo),最终纳入204例有随访信息的HCC患者,所有患者均有HBV感染背景。
1.3. 主要试剂及仪器
RNA提取试剂Trizol购自美国Invitrogen公司,逆转录试剂盒购自立陶宛Fermentas公司,实时荧光定量PCR试剂购自美国Super Array Biosciences公司,实时荧光定量PCR仪购自瑞士Roche 公司(Light Cycler 480Ⅱ)。
1.4. 组织RNA提取
将约100 mg的HCC、癌旁或正常肝组织分别置于装有液氮的研钵中,充分研磨至细粉状,移至无RNA酶的1.5 mL EP管中。加入1 mL Trizol试剂,按照说明书提取肝组织的总RNA。用NanoDrop2000测定RNA浓度,分装冻存于-80 ℃冰箱中备用。
1.5. 逆转录和qPCR实验
按照逆转录试剂盒说明书,在20 μL的反应体系内,以5 μg总RNA为模板,用随机引物合成cDNA链。取1 μL逆转录产物用于qPCR实验,PCR扩增条件:95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。PCR反应运行结束后,采用Roche软件分析每孔反应的Ct值,以管家基因C-TBP1的表达为内参照,计算CXCL10基因和CXCR3B基因的相对表达量,qPCR引物见表1。
1.
临床标本qPCR引物
Table 1 qPCR primer sequences for clinical samples
| Gene | Primer sequence | Size/bp |
|---|---|---|
| F, forward primer; R, reverse primer. | ||
| CXCL10 | F: 5'- GTACGCTGTACCTGCATCAGCATTAG-3' R: 5'-CTGGATTCAGACATCTCTTCTCACCC-3' |
189 |
| CXCR3B | F: 5'-ATCACGCAGAAGAATGCGAG-3' R: 5'-TCGGCGTCATTTAGCACTTG-3' |
265 |
| C-TBP1 | F: 5'-TTCACCGTCAAGCAGATGAGAC-3' R: 5'-CTGGCTAAAGCTGAAGGGTTCC-3' |
156 |
1.6. 统计学分析
使用SPSS 22.0及GraphPad Prism 5软件进行统计学分析。正态计量资料采用均数±标准差进行描述,其中配对资料用配对t检验,非配对资料用非配对t检验,相关性分析用Pearson相关;非正态资料采用中位数和上下四分位数[M(P25,P75)]描述,其中配对资料用Wilcoxon配对检验,非配对资料比较用Mann-Whitney U检验,相关性分析用Spearman 秩相关。使用Kaplan-Meier法进行生存分析,Log-rank检验用于比较组间生存差异。r≥0.3即认为具有相关性,多重比较时采用Bonferroni法对P值进行校正,P<0.05即认为差异具有统计学意义。
2. 结果
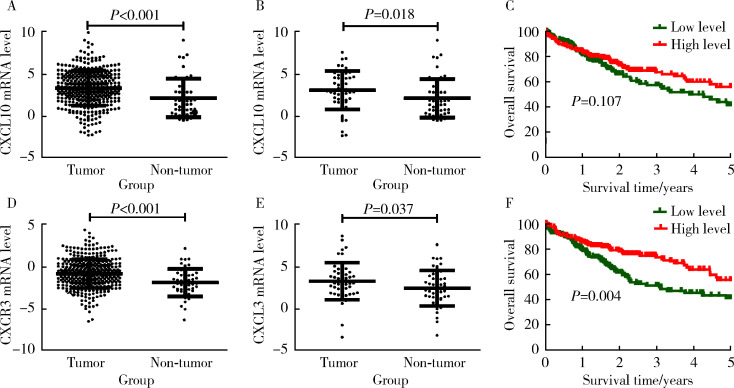
2.1. TCGA数据库中CXCL10和CXCR3基因在HCC样本中的表达及预后
为探索CXCL10及其受体CXCR3基因在HCC组织中的表达情况,我们首先分析TCGA数据库中370例HCC组织和50例癌旁组织中的基因表达,结果显示HCC组织中的CXCL10基因表达水平显著高于癌旁组织(P<0.001,图1A)。在TCGA数据库中,有50例HCC患者同时有HCC和配对癌旁组织的表达数据,分析CXCL10基因在配对HCC及癌旁组织中的表达,结果显示50例HCC组织中CXCL10基因的表达水平显著高于配对癌旁组织(P=0.018,图1B)。进一步采用Kaplan-Meier法分析了CXCL10基因表达水平与HCC患者预后的相关性,结果显示与CXCL10基因低表达(n=185)的HCC患者相比,CXCL10基因高表达(n=185)的HCC患者5年总体生存率升高,但差异无统计学意义(P=0.107,图1C)。
1.
TCGA数据库HCC与癌旁组织中CXCL10基因和CXCR3基因的表达及预后分析
Expression and prognostic of CXCL10 and CXCR3 in HCC tumor tissues and non-tumor tissues in TCGA database
A, the expression of CXCL10 in nonpaired HCC tumor tissues (n=370) and non-tumor tissues (n=50); B, the expression of CXCL10 in paired HCC tumor tissues and non-tumor tissues (n=50); C, the prognostic of CXCL10 in HCC patients; D, the expression of CXCR3 in nonpaired HCC tumor tissues (n=370) and non-tumor tissues (n=50); E, the expression of CXCR3 in paired HCC tumor tissues and non-tumor tissues (n=50); F, the prognostic of CXCR3 in HCC patients. Results were showed as x±s.
我们采用同样的方法也分析了TCGA数据库HCC组织中CXCR3基因的表达,结果表明370例HCC组织中CXCR3基因表达水平显著高于50例癌旁组织(P<0.001,图1D),且CXCR3基因在50例配对HCC组织中的表达亦显著高于癌旁组织(P=0.037,图1E)。Kaplan-Meier分析结果表明CXCR3基因高表达(n=185)的HCC患者5年总体生存率显著高于CXCR3基因低表达(n=185)的HCC患者(P=0.004,图1F)。
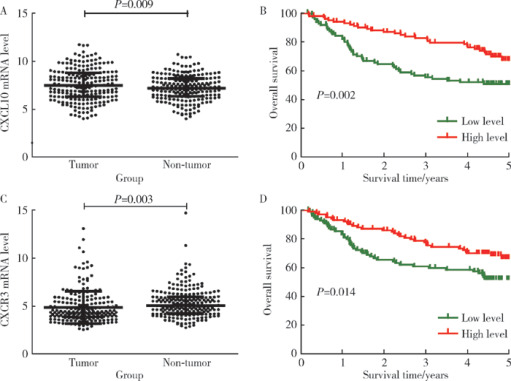
2.2. LCI数据库中CXCL10和CXCR3基因在HCC样本中的表达及预后
我们进一步分析了LCI数据库中CXCL10基因和CXCR3基因在乙肝相关HCC样本中的表达情况,结果表明HCC组织中CXCL10基因表达水平显著高于癌旁组织(P=0.009,图2A)。Kaplan-Meier分析结果显示,CXCL10基因高表达(n=102)HCC患者的5年总体生存率显著高于CXCL10基因低表达(n=102)HCC患者(P=0.002,图2B),但CXCR3基因在HCC组织中的表达显著低于癌旁组织(P=0.003,图2C)。Kaplan-Meier分析结果所示,CXCR3基因高表达(n=102)HCC患者的5年总生存率高于CXCR3基因低表达(n=102)HCC患者(P=0.014,图2D)。
2.
LCI数据库HCC与癌旁组织中CXCL10基因和CXCR3基因的表达及预后分析
The expression and prognostic of CXCL10 and CXCR3 in HCC tumor tissues and non-tumor tissues in LCI database
A, the expression of CXCL10 in HCC tumor tissues and non-tumor tissues (n=204); B, the prognostic of CXCL10 in HCC patients (n=204); C, the expression of CXCR3 in HCC tumor tissues and non-tumor tissues (n=204); D, the prognostic of CXCR3 in HCC patients (n=204). Results were showed as x±s.
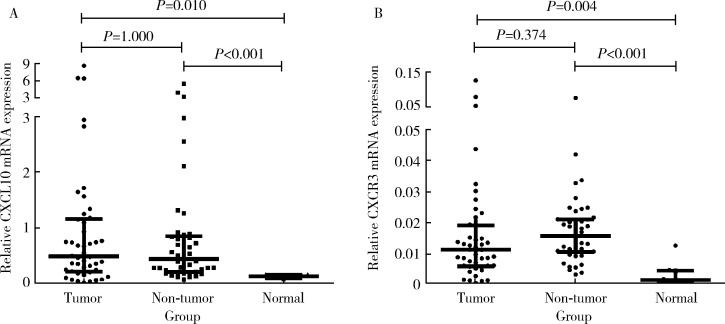
2.3. qPCR方法检测HCC样本中CXCL10和CXCR3基因的表达
为了验证TCGA和LCI数据库的结果,我们采用qPCR方法检测了45例乙肝相关HCC中CXCL10和CXCR3基因的表达水平,并以8例正常肝组织作为对照,结果显示CXCL10基因在乙肝相关HCC和配对癌旁组织里的表达均显著高于正常肝组织(P=0.010,P<0.001),但CXCL10基因表达水平在HCC和配对癌旁组织中的差异无统计学意义(P=1.000,图3A)。同样,CXCR3基因在HCC和配对癌旁组织里的表达水平也显著高于正常肝组织(P=0.004,P<0.001),但其在HCC组织中的表达水平与配对癌旁组织相比差异无统计学意义(P=0.374,图3B)。
3.
qPCR方法检测45例乙肝相关HCC样本中CXCL10和CXCR3基因的表达
mRNA expression of CXCL10 and CXCR3 of 45 HCC clinical samples with HBV infection background detected by qPCR
A, mRNA expression of CXCL10 in HCC (n=45), non-tumor (n=45) and nomal (n=8) tissues; B, mRNA expression of CXCR3 in HCC (n=45), non-tumor (n=45) and normal (n=8) tissues. Results were showed as M (P25,P75).
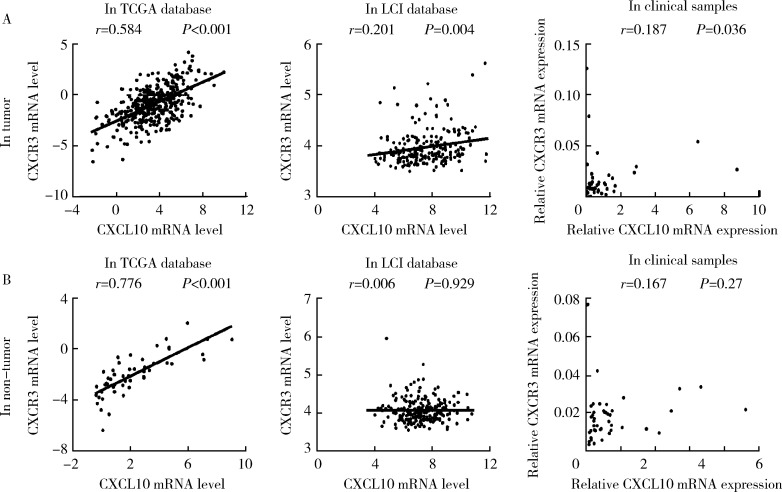
2.4. CXCL10与CXCR3基因表达水平在HCC和癌旁组织中的相关性
我们进一步分析了来自TCGA、LCI数据库以及我们检测的临床样本中CXCL10基因与CXCR3基因表达水平的相关性,结果如图4所示,在HCC组织中,来自TCGA数据库的CXCL10基因与CXCR3基因的表达水平间呈显著正相关,但在LCI数据库以及我们的临床样本中未见明显相关性(图4A),这一现象同样存在于癌旁组织中(图4B)。
4.
CXCL10与CXCR3基因表达水平在HCC和癌旁组织中的相关性分析
Correlation between the expression level of CXCL10 and CXCR3 in tumor and non-tumor tissues
A, correlation between the expression level of CXCL10 and CXCR3 in tumor tissues in TCGA datebase, LCI database and clinical samples; B, correlation between the expression level of CXCL10 and CXCR3 in non-tumor tissues in TCGA datebase, LCI database and clinical samples.
3. 讨论
作为肿瘤细胞赖以生存的场所,肿瘤微环境可直接影响肿瘤细胞的生长、转移及预后[6],因此研究肿瘤微环境的特点及功能可为肿瘤的早期诊断和治疗提供新依据。趋化因子及其受体之间的相互作用是肿瘤微环境的关键环节,在促进肿瘤细胞增殖、招募免疫细胞及重塑细胞外基质等方面发挥重要作用。已有研究表明,CXCL10基因可通过招募表达CXCR3基因的T细胞、B细胞、单核/巨噬细胞和自然杀伤细胞等,参与多种炎症性疾病和肿瘤的发生与发展[7]。CXCL10/CXCR3在胃癌、乳腺癌、肺癌和多发性骨肉瘤组织中呈高表达,且与上述肿瘤的恶性表型密切相关[7],但CXCL10/CXCR3在HCC中的表达及作用鲜见报道。
CXCL10基因主要由成纤维细胞、内皮细胞、肝实质细胞、角化细胞等多种细胞表达。在细胞处于稳态条件下,CXCL10基因呈低表达,但在炎症细胞因子刺激下CXCL10基因表达上调。CXCL10基因的表达主要由IFN-γ诱导,其主要作用是趋化T淋巴细胞、单核细胞、自然杀伤细胞到达炎症部位,发挥抗炎免疫作用。CXCL10基因也是一种血管抑制因子,可招募抗肿瘤T淋巴细胞,发挥潜在的抗肿瘤效应,但肿瘤细胞的自分泌CXCL10信号也能促进肿瘤细胞的增殖、血管生成和转移[7]。Ren等[8]的研究发现,HCC组织中CXCL10基因表达上调,且CXCL10基因高表达与HCC患者的总体生存率呈负相关,但也有研究表明[9,10],HCC组织中CXCL10基因的表达水平与Th1、CD8+T细胞和自然杀伤样T细胞的浸润呈正相关,提示在某些HCC患者中CXCL10基因可能是通过增强抗肿瘤免疫抑制肿瘤的转移和复发,从而利于HCC患者的预后。为了进一步验证组织中CXCL10基因的表达水平与患者预后的关系,我们分析了TCGA和LCI数据库中CXCL10基因的表达情况及其与预后的关系。与Ren等[8]的发现一致,本研究结果显示CXCL10基因在HCC组织中的表达显著高于癌旁组织,但不同的是,CXCL10基因高表达HCC患者的总体生存率显著高于CXCL10基因低表达HCC患者,提示CXCL10基因高表达利于HCC患者的预后。此外,我们也在45例乙肝相关HCC样本中验证了CXCL10基因在HCC组织的高表达,但HCC和癌旁组织中CXCL10基因水平差异无统计学意义,可能与我们所检测癌旁组织均有肝硬化背景有关。
已有研究表明,CXCR3基因在乳腺癌、骨髓瘤、结肠癌等多种肿瘤中异常表达,且与肿瘤的转移和预后相关[9]。Ding等[11]和任颖等[12]的研究表明,HCC组织中CXCR3基因表达水平高于癌旁组织,HCC组织中CXCR3蛋白的阳性率也高于癌旁组织,且CXCR3蛋白阳性患者术后总体生存率低于阴性患者。本研究来自TCGA数据库370例HCC患者的转录组测序数据显示,CXCR3基因在HCC组织中的表达水平显著高于癌旁组织,且CXCR3基因高表达利于HCC患者的预后,但来自LCI数据库乙肝相关肝癌的分析结果与TCGA相反,CXCR3基因在HCC组织中的表达水平低于配对癌旁组织,而CXCR3基因高表达的HCC患者同样预后更好。我们检测了CXCR3基因在45例乙肝相关HCC中的表达,CXCR3基因在HCC组织和癌旁组织中的表达差异不具有统计学意义,但趋势与LCI数据库一致。本研究检测的45例HCC样本和LCI数据库里纳入的204例HCC均有HBV感染背景,TCGA数据库中仅有102例HCC患者有HBV感染,而Ding等[11]和任颖等[12]的研究没有分析HCC患者的慢性乙肝背景,提示不同研究中CXCR3基因表达不一致的原因可能与HCC患者的病因不同有关。与此结果一致的是,CXCL10基因和CXCR3基因表达水平呈正相关的现象仅存在于TCGA数据库,但在LCI数据库和我们检测的样本中这种相关性消失。由于HCC中浸润的淋巴细胞也可以表达CXCR3基因,淋巴细胞浸润程度会影响CXCR3基因mRNA水平的检测。此外,CXCR3基因有3个剪接异构体,分别为CXCR3A、CXCR3B和CXCR3alt。研究表明,不同CXCR3基因亚型的功能及分布不同。CXCR3A激活可诱发细胞的趋化和增殖,而CXCR3B激活则抑制细胞的迁移和增殖,促进凋亡[13]。本研究定量检测的是CXCR3B亚型,其在乙肝相关肝癌中的低表达可能与肿瘤的发生有关,但TCGA、LCI数据库以及另外两项研究中均未注明所检测的CXCR3基因亚型,因此,不同研究中的CXCR3基因表达结果不一致也可能与所检测的亚型不同有关。
综上所述,本研究结果证实CXCL10基因在不同病因的HCC组织中均呈高表达,而CXCR3基因在乙肝相关HCC组织中呈低表达,且CXCL10基因和CXCR3基因的高表达利于HCC患者的术后生存,提示CXCL10基因和CXCR3基因在HCC的发生、发展过程中发挥重要的作用。
(志谢:郑州大学附属肿瘤医院肝胆胰外科张玲教授提供肝组织样本)
(本文编辑:刘淑萍)
Biographies

鲁凤民,北京大学基础医学院病原生物学系及北京大学感染病研究中心教授、学系主任,博士生导师。长期从事病毒性肝炎、肿瘤等相关研究。主持或参加了国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项、国家高技术研究发展计划(863计划)、国家重点基础研究发展计划(973计划)及国家自然科学基金面上项目。担任国务院学位委员会基础医学学组委员、中国医药质量协会转化医学分会主任委员、中国研究型医院分子诊断专业委员会副主任委员、中华医学会医学病毒学分会委员、北京市医学病毒学分会副主任委员、中国微生物学会病毒学工作委员会常委、北京市微生物学会常委等,并担任《中华肝脏病杂志》《中华预防医学杂志》等期刊常务编委或编委。主要学术成就是实验证实了乙型肝炎病毒RNA病毒样颗粒的存在,提出了以血清乙型肝炎病毒RNA的持续消失作为慢性乙肝核苷(酸)类似物抗病毒治疗安全停药和准功能性治愈的概念。在New England Journal of Medicine、Journal of Hepatology、 Cancer Research等SCI杂志发表论文120篇,他引超过3 200次。曾作为参加人两次获得国家科学技术进步奖二等奖。

陈香梅,北京大学基础医学院病原生物学系及北京大学感染病研究中心副教授,博士生导师,主要研究方向为病毒和宿主因素在乙肝疾病进展和肝癌发生中的作用及机制。主要研究工作包括:乙型肝炎病毒整合的致癌新机制、乙型肝炎相关肝癌发生发展的分子机制、影响慢性乙型肝炎疾病进展的宿主遗传易感性等。近五年主持和参加的课题有国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项、国家自然科学基金面上项目、北京市自然科学基金面上项目、北京市科委首都市民培育项目等。现任中华医学会肝病学分会青年委员、中华医学会病毒学分会临床病毒学组委员、北京市医学会肝病学会委员、中国医药质量管理协会转化医学分会副主任委员,《中华肝脏病杂志》《微生物学免疫学进展》等杂志编委。作为第一作者或通信作者在Journal of Hepatology、Oncogene、 Liver International等杂志发表SCI论文20余篇,曾获得国家科学技术进步奖二等奖1次(第8完成人)。
Funding Statement
北京市自然科学基金(7182079)
Supported by Beijing Natural Science Foundation(7182079)
Contributor Information
鲁 凤民 (Feng-min LU), Email: lu.fengmin@hsc.pku.edu.cn.
陈 香梅 (Xiang-mei CHEN), Email: xm_chen6176@bjmu.edu.cn.
References
- 1.Joliat GR, Allemann P, Labgaa I, et al. Treatment and outcomes of recurrent hepatocellular carcinomas. Langenbecks Arch Surg. 2017;402(5):737–744. doi: 10.1007/s00423-017-1582-9. [DOI] [PubMed] [Google Scholar]
- 2.El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemio-logy and molecular carcinogenesis. Gastroenterology. 2007;132(7):2557–2576. doi: 10.1053/j.gastro.2007.04.061. [DOI] [PubMed] [Google Scholar]
- 3.Hong TP, Gow P, Fink M, et al. Novel population-based study finding higher than reported hepatocellular carcinoma incidence suggests an updated approach is needed. Hepatology. 2016;63(4):1205–1212. doi: 10.1002/hep.28267. [DOI] [PubMed] [Google Scholar]
- 4.Elia G, Fallahi P. Hepatocellular carcinoma and CXCR3 chemokines: a narrative review. Clin Ter. 2017;168(1):e37–e41. doi: 10.7417/CT.2017.1980. [DOI] [PubMed] [Google Scholar]
- 5.中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版) 临床肝胆病杂志. 2011;27(11):1141–1159. [Google Scholar]
- 6.Kamil F, Rowe JH. How does the tumor microenvironment play a role in hepatobiliary tumors? J Gastrointest Oncol. 2018;9(1):180–195. doi: 10.21037/jgo.2017.06.09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tokunaga R, Zhang W, Naseem M, et al. CXCL9, CXCL10, CXCL11/CXCR3 axis for immune activation:a target for novel cancer therapy. Cancer Treat Rev. 2018;63:40–47. doi: 10.1016/j.ctrv.2017.11.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ren T, Zhu L, Cheng M. CXCL10 accelerates EMT and metastasis by MMP-2 in hepatocellular carcinoma. Am J Transl Res. 2017;9(6):2824–2837. [PMC free article] [PubMed] [Google Scholar]
- 9.Hirano S, Iwashita Y, Sasaki A, et al. Increased mRNA expression of chemokines in hepatocellular carcinoma with tumor-infiltrating lymphocytes. J Gastroenterol Hepatol. 2007;22(5):690–696. doi: 10.1111/j.1440-1746.2006.04551.x. [DOI] [PubMed] [Google Scholar]
- 10.Chew V, Chen J, Lee D, et al. Chemokine-driven lymphocyte infiltration: an early intratumoural event determining long-term survival in resectable hepatocellular carcinoma. Gut. 2012;61(3):427–438. doi: 10.1136/gutjnl-2011-300509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Ding Q, Xia Y, Ding S, et al. An alternatively spliced variant of CXCR3 mediates the metastasis of CD133 + liver cancer cells induced by CXCL9 . Oncotarget. 2016;7(12):14405–14414. doi: 10.18632/oncotarget.7360. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.任 颖, 阚 云珍, 孔 令非. 靶向沉默CXCR3对肝癌细胞恶性增殖的作用研究. 中华肝脏病杂志. 2018;26(7):508–512. doi: 10.3760/cma.j.issn.1007-3418.2018.07.006. [DOI] [PubMed] [Google Scholar]
- 13.Billottet C, Quemener C, Bikfalvi A. CXCR3, a double-edged sword in tumor progression and angiogenesis. Biochim Biophys Acta. 2013;1836(2):287–295. doi: 10.1016/j.bbcan.2013.08.002. [DOI] [PubMed] [Google Scholar]