Abstract
目的
比较以不同种类气体为工作气体的大气压放电冷等离子体处理氧化锆对氧化锆表面人牙龈成纤维细胞生物学行为的影响。
方法
将20个氧化锆试件随机分为4组:对照组(无处理),氦气大气压介质阻挡放电等离子体处理90 s组(He组),氩气大气压介质阻挡放电等离子体处理90 s组(Ar组),95%氩气+5%氧气大气压介质阻挡放电等离子体处理90 s组(Ar+O2组),每组5个。分组处理后观察氧化锆表面形貌,测定表面粗糙度及润湿性,分析表面元素组成,培养人牙龈成纤维细胞3 h测定细胞在氧化锆表面的初期黏附能力,免疫荧光染色观察细胞黏附初期细胞形态。
结果
等离子体处理后氧化锆表面形貌及粗糙度无明显改变,接触角均显著降低(P<0.05), 其中Ar组及Ar+O2组接触角与He组具有统计学意义(P<0.05)。X射线光电子能谱分析结果显示,等离子体处理后氧化锆表面C/O比分别下降至0.45(He组)、0.36(Ar组)和0.33(Ar+ O2组)。经Ar及Ar+O2混合气体等离子体处理的氧化锆表面人牙龈成纤维细胞黏附初期数量提高,差异具有统计学意义(P<0.05)。相对于对照组,不同等离子体处理后的氧化锆表面成纤维细胞黏附及增殖情况更佳,细胞在黏附初期形态铺展更佳,伸出伪足更多。
结论
不同种类大气压放电冷等离子体处理氧化锆可在不改变材料表面形貌及粗糙度的情况下通过在材料表面引入含氧官能团提高材料表面润湿性;以Ar+O2混合气体为工作气体的大气压放电冷等离子体可显著提高人牙龈成纤维细胞在氧化锆表面的早期黏附能力。
Keywords: 氧化锆, 大气压放电冷等离子体, 成纤维细胞, 牙龈, 人
Abstract
Objective
To evaluate the effect of different cold atmospheric plasma (CAP) treatment on the surface chemical and physical properties of zirconia and adhensive behaviour of human gingival fibroblasts (HGFs) cultured on zirconia disks.
Methods
The zirconia disks were divided into four groups and treated using helium, argon and mixture of argon and oxygen cold atmospheric plasma for 90 s or left untreated. The surface morphology, wettability and chemical elements were analyzed right after treatment. Human gingival fibroblasts were grown from biopsies obtained from a periodontally healthy human subject during periodontal surgery. HGFs were seeded on zirconia disk, and cells density was measured at the time point of 3 hours. Indirect immunofluorescence (IIF) was performed for morphometric examination at the time point of 3 hours.
Results
The crystallographic structure of zirconia was analyzed pre-viously and the results suggested that it fitted the properties of zirconium yttrium oxide. After helium, argon and mixture of argon and oxygen cold atmospheric plasma treatment, the surface morphology and roughness of zirconia disks remained the same. The contact angle of zirconia decreased significantly(P<0.05)after CAP treatment: from 68.38° to 17.90°. After different CAP plasmas treatment, the atomic percentage of carbon on the outermost surface of the three groups decreased, as did the surface C/O ratio. The surface C/O ratio of zirconia decreased from 1.07 to 0.33. Fibroblasts density increased on CAP treated disks, especially the ones treated by mixture of argon and oxygen CAP(P<0.05). Cells of the three CAP plasma treatment groups spread better and had more protrusions, as well as larger surficial areas.
Conclusion
Based on the results of this study after being treated by different kinds of CAP plasmas for 90 s, the surface wettability increased and the elements changed significantly with no changes in the tomography and roughness of the materials. The CAP treatment enhances the adhensive behavior of fibroblasts on zirconia by increasing the oxygen functional groups and promoting the cell density. Wettability of zirconia, an important physicochemical property, has a vital influence on the cell behaviors.
Keywords: Zirconia, Cold atmospheric plasma, Fibroblasts, gingival, human
自20世纪80年代以来,口腔种植临床技术迅速发展成熟,口腔种植修复已经逐渐成为牙列缺损、牙列缺失的首选治疗方案。种植体周围软组织通过牙龈结合上皮、牙龈纤维等附着于种植体颈部结构形成一圈封闭性良好的“袖口”结构,成为一种功能性生物封闭屏障[1],这一结构具有保护种植体在复杂口腔环境中免受细菌及其他致炎因子侵入而保持长期稳定的作用[2]。种植体周围软组织与颈部基台间的结合直接影响种植修复的功能及美学效果,氧化锆凭借良好的机械性能、生物相容性及美学性能作为基台材料在前牙美学区种植修复具有良好的应用前景。研究发现,相较于表面形貌,种植体基台与周围软组织的结合受基台表面润湿性的影响更大[3],因此,对氧化锆基台进行表面改性,特别是通过对氧化锆表面润湿性的改变获得有利于软组织附着的表面特性具有重要意义。
等离子体是一种以自由电子和带电离子为主要成分的物质形态,大气压放电冷等离子体(cold atmospheric plasma, CAP)具有在大气压开放环境中放电且放电温度接近体温的特性,在口腔医学领域已广泛应用于根管治疗、义齿消毒、牙齿美白、材料改性等方面[4]。本课题组既往研究表明,使用大气压放电冷等离子体处理氧化锆后,可在不改变材料表面形貌的情况下,通过增加氧化锆表面润湿性,提高人牙龈成纤维细胞黏附相关基因的表达,从而增加其黏附增殖能力[5]。
本研究拟进一步探究不同大气压放电冷等离子体对氧化锆基台的作用及其对周围软组织结合的影响。
1. 材料与方法
1.1. 氧化锆试件的制备
准备直径为15 mm,厚度为2 mm的市售圆盘状钇稳定性氧化锆试件(Zenostar, Wieland Dental 公司, 德国), 使用表面研磨仪(AutoMet 300. Buehler, Waukegan 公司, 美国)用60 μm金刚砂砂纸(直径25 mm, 振戎融通通信技术有限公司, 北京)表面打磨抛光。
在进行表面处理前,将试件分别在无水乙醇及去离子水中超声荡洗20 min,干燥备用。
1.2. CAP处理氧化锆试件
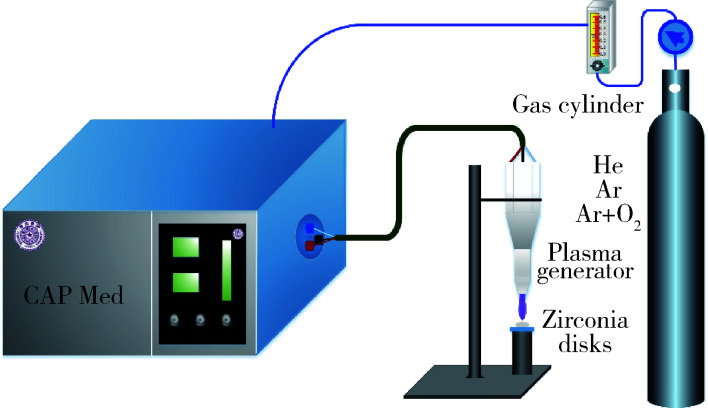
使用清华大学等离子体健康科技研究组与北京振戎融通通信技术有限公司联合研发的等离子体手术刀(图1)处理氧化锆试件。该仪器采用双介质同轴型介质阻挡放电结构,高压电极为直径1 mm的钨针,外面套有内径1 mm、外径2 mm的玻璃管,低压电极则使用铜箔胶带缠绕在外径为8 mm、 内径为6 mm的玻璃管上;工作时两绝缘玻璃管间的空间中充满工作气体,在外加高压交流电场的作用下电离形成等离子体。本实验装置处理仓体积为25.25 cm3,电源驱动频率为26 kHz,放电电压4.64~4.72 kV,放电的功率密度为0.44 W/cm3。由于实验采用开放环境放电,为了避免空气对高浓度工作气体造成混杂,在处理前使用工作气体流吹扫1 min,以尽可能排空处理仓内电极间的空气。
1.
等离子体手术刀示意图
Picture of the CAP Med generator
按照上述处理方式,20个试片共分为4组,每组5片,分组如下,组1:未经大气压放电冷等离子体处理的对照组(C组);组2:氦气大气压放电冷等离子体处理90 s组(He组);组3:氩气大气压放电冷等离子体处理90 s组(Ar组);组4:95%氩气+5%氧气大气压放电冷等离子体处理90 s组(Ar+O2组)。
1.3. 表面形貌的观察
观察4组氧化锆试件肉眼表面形貌,经过表面喷金处理后,使用扫描电镜(S-4800, HITACHI 公司, 日本)在放大2 500倍下分别观察表面纹理和细微结构。
1.4. X射线衍射分析试件成分
使用X射线衍射仪 (D8 advance, Bruker AXS 公司, 德国) 对氧化锆试件表面陶瓷成分及晶体结构进行测量。
1.5. 粗糙度测量
使用粗糙度测量仪(Mitutoyo Surftest 401 Analyzer Series 200, Mitutoyo Corporation 公司,日本)对4组氧化锆试件表面粗糙度进行测量。取样长度0.8 mm,评定长度4.0 mm,测定轮廓算术平均偏差(Ra值),即在取样长度内轮廓偏距绝对值的算术平均值。每个试件按照直径方向随机选取5个测定线段,每组测定3个试件计算Ra平均值。
1.6. 接触角测量
使用接触角测量仪(SL200, Kino Industry 公司, 美国)对4组氧化锆试件表面接触角进行测量。通过静态接触角测量方式,将1 μL去离子水滴在氧化锆试件表面,等待3 s至液滴稳定后用接触角测量仪自带软件进行测量,每次接触角采用左右接触角的平均值作为测定结果。每个试件表面随机选取3个点进行测量,每组3个试件,最后计算每组的平均接触角。
1.7. X射线光电子能谱分析
使用X射线光电子能谱仪(ESCALAB 250, ThermoFisher Scientific 公司,美国)分析表面元素组成,仪器功率225 W(工作电压15 kV,发射电流15 mA)。
1.8. 人牙龈成纤维细胞的体外原代提取及培养
选取于北京大学口腔医院牙周科就诊的牙周健康状况良好的的冠延长手术患者,于术前签署知情同意书。将牙周冠延长术中切除的健康牙龈组织块放入含77%(质量分数)改良杜氏伊戈尔培养基(Dulbecco’s modified eagle medium,DMEM, Gibco BRL公司, 美国)、20%(体积分数)胎牛血清(Gibco BRL公司,美国)及3%(质量分数)双抗(青霉素300 U/mL 链霉素300 mg/L, Sigma公司, 美国)的离心管内,用于提取人牙龈成纤维细胞。本研究经过北京大学口腔医院伦理委员会(PKUSSIRB-2012060)批准。
在直径为60 mm的培养皿中加入含77%DMEM培养基、20%胎牛血清及3%双抗的培养基,将术中获得的牙龈组织块置于培养皿中央,用DMEM培养基冲洗3次,并剪碎为1 mm×1 mm×1 mm 的小块。使用移液管将细碎组织块移入另一直径60 mm的培养皿内,使用吸引器小心吸干组织块周围的培养基。将培养皿置于CO2细胞培养箱(37 ℃, 5%CO2,SERIES Ⅱ, ThermoForma 公司, 美国), 静置2~3 h,待组织块初步贴壁。随后,在培养皿内缓慢加入培养基(77%DMEM培养基,20%胎牛血清及3%双抗),将培养皿转移至细胞培养箱[37 ℃, 5%(体积分数)CO2]中培养,2~3 d换液,待细胞爬满培养皿面积80%进行传代。
1.9. 细胞黏附数量检测
将经不同种类大气压放电冷等离子体处理前后的4组试件浸泡于75%乙醇中30 min,消毒后使用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3遍,用吸引器吸干表面液体,将氧化锆试件置于24孔板中。将生长状态良好的培养至4~7代的牙龈成纤维细胞以1×105每孔的密度接种于试件表面,静置30 min,待细胞贴壁后,每孔加入DMEM培养基(含10%胎牛血清和1%青链霉素混合液)1 mL,将培养皿置于CO2培养箱中培养。培养3 h后从培养箱中取出培养皿,测定细胞的黏附能力。轻轻晃动24孔板并吸去原培养基及未贴壁的细胞,PBS冲洗3遍,将试件取出放出24孔板的新孔中,加入360 μL DMEM培养基及40 μL 细胞增殖-毒性检测(cell counting kit-8,CCK-8)试剂。在培养箱中37 ℃孵育2 h,吹打混匀后将培养基移至96孔板中,每孔100 μL。使用酶标仪(ELX808, BioTek 公司, 美国)波长450 nm,测定光密度值。试验重复3次,每次每组3个平行样。
1.10. 细胞黏附形态检测
使用激光共聚焦显微镜(LSM710, Zeiss 公司, 德国)观察牙龈成纤维细胞在氧化锆试件表面的初期黏附形态。将生长状态良好的培养至4~7代的牙龈成纤维细胞以5×104每孔的密度接种于试件表面,静置30 min,每孔加入DMEM 培养基(含10%胎牛血清和1%青链霉素混合液)1 mL,置于 CO2培养箱中培养3 h,观察牙龈成纤维细胞在氧化锆试件表面的黏附情况。达到培养时间后,PBS冲洗3遍,去除未贴壁细胞,4%(质量分数)甲醛固定50 min,PBS冲洗3遍(每次浸泡5 min)。使用异硫氰酸酯(fluoresceine isothiocyanate, FITC)标记的鬼笔环肽 (Phalloidin,肌动蛋白染色为绿色,Sigma 公司, 美国)进行胞浆染色,使用4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI,细胞核染为蓝色,Roche Basler 公司, 瑞士)进行细胞核染色,使用激光共聚焦显微镜(LSM710, Zeiss 公司,德国)对细胞形态进行观察。
1.11. 统计学分析
氧化锆试件粗糙度、接触角以及细胞黏附数量使用单因素方差分析,并通过LSD方法进行组间两两比较,所有统计结果均由统计软件SPSS 17.0完成,显著性水平设置为α=0.05。
2. 结果
2.1. 试件表面形貌
4组氧化锆试件肉眼观察下对照组表面可见磨光纹路,使用扫描电镜放大2 500倍观察,对照组及经不同大气压放电冷等离子体处理后试件表面形貌未见明显变化(图2)。
2.
扫描电镜观察对照组及经氦气大气压放电冷等离子体处理后氧化锆试件(×2 500)
Surface topography observations of the zirconia disks by SEM (×2 500)
A,control group; B,He group.
2.2. 试件表面粗糙度测量结果
分别测量4组试件表面粗糙度, Ra=(0.05±0.01) μm。对照组与He组、Ar组及Ar+O2组间接触角差异无统计学意义(P>0.05)。
2.3. 试件表面接触角测量结果
对照组氧化锆表面接触角测量结果为 68.38°±5.1°,经以不同气体为工作气体的大气压放电冷等离子体处理后,接触角显著减小至39.73°±3.20°(He组)、24.71°±3.60°(Ar组)、17.90°±2.60°(Ar+O2组), P<0.05。
2.4. X射线衍射分析材料成分
X射线衍射分析结果显示,30.5°处的峰值显示的是四方相氧化锆,是钇稳定性氧化锆的主体,试件晶体成分符合钇稳定性氧化锆。
2.5. X射线光电子能谱分析
经等离子体处理后,3组氧化锆试件表面C百分比含量明显下降,O百分比含量升高,C/O比下降(表1)。
1.
对照组及等离子体处理组C及O元素百分比组成
Atomic percentage of C and O on four surfaces
| Items | C/% | O/% | C/O |
| He group | 23.55 | 52.63 | 0.45 |
| Ar group | 18.72 | 52.47 | 0.36 |
| Ar+O2 group | 17.15 | 52.17 | 0.33 |
| Control | 39.63 | 37.09 | 1.07 |
2.6. 不同处理条件的试件表面对牙龈成纤维细胞黏附增殖的影响
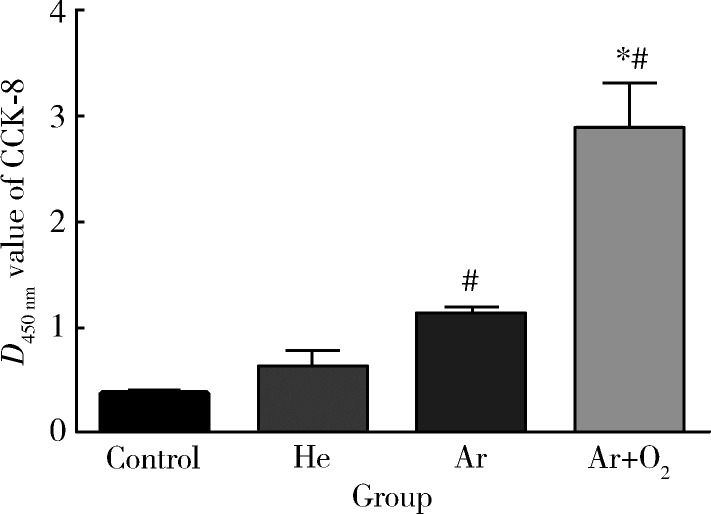
不同种类大气压放电冷等离子体处理后的氧化锆试件表面人牙龈成纤维细胞3 h黏附数量均多于未经等离子体处理的氧化锆试件表面,其中Ar组及Ar+O2组相较于对照组差异具有统计学意义(P<0.05,图3)。在3组CAP处理组中,Ar+O2组较另外两处理组有更多的牙龈成纤维细胞附着(P<0.05)。
3.
对照组及大气压放电冷等离子体处理组氧化锆表面牙龈成纤维细胞定量检测,经不同种类大气压放电冷等离子体处理后氧化锆试件表面人牙龈成纤维细胞3 h黏附数量增长
Quantitative measurements of the HGFs on the control and CAP plasma treatment surfaces, cell attachment after culturing for 3 h
Data are shown as mean ± SD (n = 15). * P < 0.05, vs. Ar group; # P < 0.05, vs. control group. CCK-8, cell counting kit-8.
2.7. 不同处理条件的试件表面对牙龈成纤维细胞形态的影响
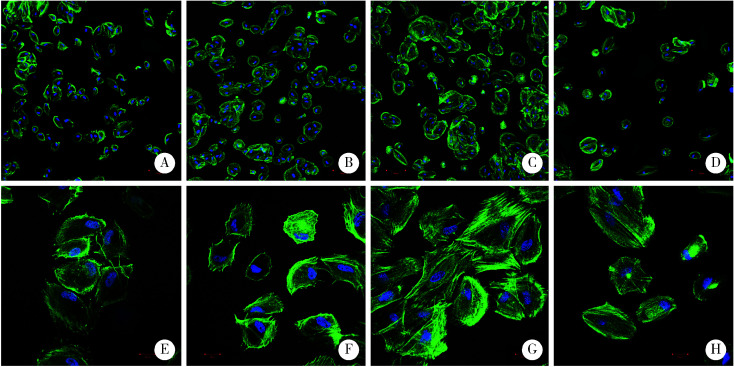
氧化锆试件表面接种牙龈成纤维细胞3 h后可检测到细胞贴壁, 3组经大气压放电冷等离子体处理的氧化锆表面,牙龈成纤维细胞初期黏附后铺展更开,伸出的伪足更多,细胞间连接更多,表面积更大(图4)。
4.
激光共聚焦显微镜观察4组试件表面牙龈成纤维细胞形态
Confocal laser scanning microscopy observations of the human gingival fibroblasts on the control and plasma treatment surfaces
A, E, the helium cold atmospheric plasma treatment for 90 s; B, F, the argon cold atmospheric plasma treatment for 90 s; C, G, the mixture argon and oxygen cold atmospheric plasma treatment for 90 s; D,H, no atmospheric plasma treatment treatment as controls. Cell immunofluorescence staining,A-D, magnification is ×10, E-H, magnification is ×40.
3. 讨论
氧化锆是一种生物相容性良好、机械性能稳定且美观性好的全瓷材料,已经在口腔修复的各个领域有了广泛的应用[6],氧化锆作为基台材料应用于前牙美学区种植修复具有良好的应用前景。
除基台材料类型外,材料表面的理化性质同样影响周围软组织结合[7],粗糙度及润湿性是两个重要的材料表面理化性质。Abrahamsson等[8]的研究显示,基台表面粗糙度对其周围结合上皮及结缔组织的愈合差异无统计学意义。Schwarz等[9,10]的系列研究证实润湿性强的表面更利于基台周围软组织的初期附着,并得出结论,相较于表面形貌,种植体基台与周围软组织的结合受基台表面润湿性的影响更大,因此,改变光滑的氧化锆表面润湿性获得有利于软组织附着的表面特性,对种植体达到良好的功能及美学效果并维持长期稳定具有重要作用。
等离子体是一种以原子、分子、离子、自由基和光子为主要成分的物质形态,广泛存在于宇宙中,被视为物质的第四态,其中大气压放电冷等离子体具有在大气压开放环境中放电且放电温度接近体温的特性,在生物医学领域应用广泛。
本研究的结果显示,以不同气体为工作气体的大气压放电冷等离子体处理的氧化锆表面形貌及粗糙度无改变,接触角显著下降,润湿性提高,与Canullo等[11]的研究结果一致。X射线光电子能谱分析结果显示,经等离子体处理后的氧化锆试件表面,C百分比含量减少,O百分比含量增加,C/O显著下降,表明经大气压放电冷等离子体处理后的氧化锆材料表面含氧元素的官能团显著增加。通过比较以不同气体作为工作气体的大气压放电冷等离子体对氧化锆表面润湿性及元素组成的改性效果,Ar+O2混合气体的改性作用最为显著,氧化锆材料表面经处理后含氧官能团增加最明显。
既往研究显示,氧化锆润湿性及含氧官能团增加可显著增加表面人牙龈成纤维细胞的黏附及增殖能力[12]。Hoshi等[13]发现经紫外线照射的钛基台材料表面粗糙度不变,润湿性显著提高,其表面培养的人牙龈成纤维增殖能力亦显著提高。An等[14]的研究显示人牙龈上皮细胞在经酸蚀处理后润湿性更高的光滑钛表面具有更好的铺展及增殖能力。本课题组既往研究证实He大气压放电冷等离子体可通过增加氧化锆表面润湿性提高人牙龈成纤维细胞的黏附及增殖能力[5]。本研究进一步比较He、Ar、Ar+O2混合气体对氧化锆表面的改性作用以及对人牙龈成纤维黏附能力的影响,以获得更佳的处理条件。研究显示在相同处理条件下,相较于He,Ar等离子体对氧化锆表面的改性作用更为明显,对人牙龈成纤维细胞早期黏附能力的促进作用亦更为显著,这与Canullo等[15]发现的经Ar等离子体处理后的氧化锆表面更有利于成骨细胞早期黏附的结论一致。本研究使用95%Ar+5%O2的混合气体作为工作气体,发现混合气体可在氧化锆表面接支更多的含氧官能团,对人牙龈成纤维细胞的早期黏附作用促进更为明显。
综上所述,大气压放电冷等离子体处理氧化锆可在不改变材料表面形貌及粗糙度的情况下,通过在氧化锆表面接支含氧官能团增加氧化锆表面润湿性,进而促进人牙龈成纤维细胞在氧化锆表面的早期黏附能力。以Ar+O2混合气体作为工作气体的大气压放电冷等离子体可促进人牙龈成纤维细胞在氧化锆表面的黏附,提示材料表面的润湿性及元素组成是影响其表面细胞生物学行为的重要理化性质。本研究为氧化锆基台提供了一种安全、便捷、高效的表面处理方法,为更好地形成氧化锆基台周围软组织袖口封闭提供了新思路,具有重要的理论指导及临床实践意义。
(本文编辑:刘淑萍)
Funding Statement
国家自然科学基金(81801013)
the National Natural Science Foundation of China(81801013)
Contributor Information
李 和平 (He-ping LI), Email: liheping@tsinghua.edu.cn.
谭 建国 (Jian-guo TAN), Email: kqtanjg@bjmu.edu.cn.
References
- 1.Kawahara H, Kawahara D, Hashimoto K, et al. Morphologic stu-dies on the biologic seal of titanium dental implants. Report Ⅰ. In vitro study on the epithelialization mechanism around the dental implant. Int J Oral Maxillofac Implants. 1998;13(4):457–464. [PubMed] [Google Scholar]
- 2.Schwarz F, Derks J, Monje A, et al. Peri-implantitis. J Periodontol. 2018;89(Suppl 1):S267–S290. doi: 10.1002/JPER.16-0350. [DOI] [PubMed] [Google Scholar]
- 3.Kim YS, Shin SY, Moon SK, et al. Surface properties correlated with the human gingival fibroblasts attachment on various materials for implant abutments: a multiple regression analysis. Acta Odontol Scand. 2015;73(1):38–47. doi: 10.3109/00016357.2014.949845. [DOI] [PubMed] [Google Scholar]
- 4.Kim JH, Lee MA, Han GJ, et al. Plasma in dentistry: a review of basic concepts and applications in dentistry. Acta Odontol Scand. 2014;72(1):1–12. doi: 10.3109/00016357.2013.795660. [DOI] [PubMed] [Google Scholar]
- 5.Zheng M, Yang Y, Liu XQ, et al. Enhanced biological behavior of in vitro human gingival fibroblasts on cold plasma-treated zirconia. PLoS One. 2015;10:e0140278. doi: 10.1371/journal.pone.0140278. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Yin L, Nakanishi Y, Alao AR, et al. A review of engineered zirconia surfaces in biomedical applications. Procedia CIRP. 2017;65:284–290. doi: 10.1016/j.procir.2017.04.057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Rigolin MSM, de Avila ED, Basso FG, et al. Effect of different implant abutment surfaces on OBA-09 epithelial cell adhesion. Microsc Res Tech. 2017;80(12):1304–1309. doi: 10.1002/jemt.22941. [DOI] [PubMed] [Google Scholar]
- 8.Abrahamsson I, Zitzmann NU, Berglundh T, et al. The mucosal attachment to titanium implants with different surface characteristics: an experimental study in dogs. J Clin Periodontol. 2002;29(5):448–455. doi: 10.1034/j.1600-051x.2002.290510.x. [DOI] [PubMed] [Google Scholar]
- 9.Schwarz F, Herten M, Sager M, et al. Histological and immunohistochemical analysis of initial and early subepithelial connective tissue attachment at chemically modified and conventional SLA titanium implants. A pilot study in dogs. Clin Oral Investig. 2007;11(3):245–255. doi: 10.1007/s00784-007-0110-7. [DOI] [PubMed] [Google Scholar]
- 10.Schwarz F, Mihatovic I, Becker J, et al. Histological evaluation of different abutments in the posterior maxilla and mandible: an experimental study in humans. J Clin Periodontol. 2013;40(8):807–815. doi: 10.1111/jcpe.12115. [DOI] [PubMed] [Google Scholar]
- 11.Canullo L, Genova T, Wang HL, et al. Plasma of argon increases cell attachment and bacterial decontamination on different implant surfaces. Int J Oral Maxillofac Implants. 2017;32(6):1315–1323. doi: 10.11607/jomi.5777. [DOI] [PubMed] [Google Scholar]
- 12.Yang Y, Zhou J, Liu X, et al. Ultraviolet light-treated zirconia with different roughness affects function of human gingival fibroblasts in vitro: the potential surface modification developed from implant to abutment. J Biomed Mater Res B Appl Biomater. 2015;103(1):116–124. doi: 10.1002/jbm.b.33183. [DOI] [PubMed] [Google Scholar]
- 13.Hoshi N, Negishi H, Okada S, et al. Response of human fibroblasts to implant surface coated with titanium dioxide photocatalytic films. J Prosthodont Res. 2010;54(4):185–191. doi: 10.1016/j.jpor.2010.04.005. [DOI] [PubMed] [Google Scholar]
- 14.An N, Rausch-fan X, Wieland M, et al. Initial attachment, subsequent cell proliferation/viability and gene expression of epithelial cells related to attachment and wound healing in response to dif-ferent titanium surfaces. Dent Mater. 2012;28(12):1207–1214. doi: 10.1016/j.dental.2012.08.007. [DOI] [PubMed] [Google Scholar]
- 15.Canullo L, Genova T, Tallarico M, et al. Plasma of argon affects the earliest biological response of different implant surfaces: an in vitro comparative study. J Dent Res. 2016;95(5):566–573. doi: 10.1177/0022034516629119. [DOI] [PubMed] [Google Scholar]