Abstract
目的
研究真菌次级代谢产物rasfonin对骨肉瘤143B细胞增殖与迁移能力的影响。
方法
以骨肉瘤细胞系143B为模型,利用3-(4,5-二甲基) -5-(3-羧甲基苯环)-2-(4-硫基苯)-2H-四唑盐复合物检测法[3-(4,5-dime-thylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt, MTS]观察rasfonin对细胞活性的影响,以二甲基亚砜(dimethyl sulfoxide,DMSO)组为对照,采用rasfonin (3 μmol/L和6 μmol/L)处理12或24 h,观察143B细胞活性的变化;采用克隆形成实验检测rasfonin对细胞集落形成能力的影响,以DMSO组为对照,采用rasfonin (3 μmol/L)处理1周,对比两组克隆形成数目。划痕实验及侵袭实验检测rasfonin对细胞侵袭迁移能力的影响,以DMSO组为对照,采用rasfonin (3 μmol/L)处理24 h,对比两组的伤痕愈合率及侵袭细胞数。以DMSO组为对照,透射电子显微镜观察rasfonin(3 μmol/L)处理4 h后细胞内自噬体含量的变化。蛋白免疫印迹的方法检测rasfonin对p62蛋白(sequestosome 1)、微管相关蛋白1轻链3融合蛋白(microtubule associated protein 1 light chain 3 fusion protein, LC3)及聚腺苷酸二磷酸核糖转移酶[poly (ADP-ribose) polymerase-1, PARP-1]表达的影响。
结果
在12和24 h,随着rasfonin浓度的升高,骨肉瘤143B细胞的细胞活性均逐渐降低,3组间差异有统计学意义(12 h: F=31.36, P<0.01; 24 h: F=67.07, P<0.01),任意两组间比较差异也均有统计学意义(P<0.01)。3 μmol/L的rasfonin可以显著抑制143B细胞的集落形成能力(P<0.01)。Rasfonin处理后,143B细胞在24 h内的伤痕愈合比率明显低于DMSO对照组(33.91%±0.83% vs. 65.11%±0.94%, P<0.01);同样24 h内穿过覆盖有Matrigel的基底膜的细胞数明显低于DMSO对照组[(21.33±1.45)个vs.(49.33±2.40)个, P<0.01]。Rasfonin处理4 h后骨肉瘤143B细胞中自噬体增多,p62水平降低,LC3-Ⅱ累积,自噬抑制剂氯喹存在条件下LC3-Ⅱ累积更为明显,并且随着rasfonin浓度的提高PARP-1的切割增多。
结论
Rasfonin既可以抑制骨肉瘤143B细胞的增殖迁移,还可以引起细胞的自噬与凋亡,这些结果为rasfonin作为骨肉瘤新的治疗药物提供了初步的实验基础。
Keywords: 骨肉瘤, 增殖, 迁移, 自噬
Abstract
Objective
To investigate the effects of rasfonin,a fungal secondary metabolite, on the proliferation and migration of osteosarcoma 143B cells.
Methods
3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,inner salt (MTS) assay was performed to exa-mine 143B cell viability following treatment of rasfonin. Using dimethyl sulfoxide (DMSO) group as control, cell viability was detected when 143B cells were treated with rasfonin (3 μmol/L and 6 μmol/L) for 12 or 24 hours. The effect of rasfonin on colony forming ability was detected by clone formation assay.143B cells treated with DMSO or rasfonin (3 μmol/L) for one week, and the number of clones formed in the two groups was counted. Wound healing and transwell assay were employed to analyze cell invasion and migration upon rasfonin challenge. The DMSO group was used as control while rasfonin (3 μmol/L) was used for 24 hours. The wound healing rate and the number of invasive cells were compared between the two groups. The intracellular autophagosomes were monitored by transmission electron microscopy when 143B cells were treated with DMSO or rasfonin (3 μmol/L) for 4 hours. The expression of p62, microtubule-associated protein 1 light chain 3 fusion protein (LC3) and poly (ADP-ribose) polymerase-1(PARP-1) in response to rasfonin were detected by immunoblotting assay.
Results
Rasfonin reduced the viability of 143B cells in a dose-dependent manner (12 h: F=31.36, P<0.01; 24 h: F=67.07, P<0.01). Rasfonin (3 μmol/L) completely inhibited the clonal formation of 143B cells (P<0.01). The wound healing result revealed that rasfonin significantly decreased migratory ability of 143B cells (33.91%±0.83% vs. 65.11%±0.94%, P<0.01), whereas its treatment significantly reduced the number of 143B cells penetrating through Matrigel-containing basement membrane (21.33±1.45 vs. 49.33±2.40, P<0.01). Compared with the control group, rasfonin markedly increased the number of autophagic vacuoles. The immunoblotting results revealed that rasfonin increased LC3-Ⅱ accumulation and decreased p62 levels. Choloroquine (CQ), an often used autophagic inhibitor, further accumulated rasfonin-induced LC3-Ⅱ. In addition, rasfonin appeared to cause the cleavage of PARP-1.
Conclusion
Rasfonin induced autophagy and activated caspase-dependent apoptosis in 143B cells concurring with suppressing the proliferation and migration of the cells; these results provide an experimental basis for rasfonin as a potential therapeutic agent for osteosarcoma.
Keywords: Osteosarcoma, Proliferation, Migration, Autophagy
骨肉瘤是起源于间叶组织,以肿瘤细胞直接产生骨或骨样组织为特点的恶性肿瘤,是临床最常见的一种原发性恶性骨肿瘤,70%以上发生于儿童及青少年,恶性程度高,易发生转移,预后极差[1]。目前的治疗方法主要是术前化疗、手术、术后化疗相结合。为了进一步提高诊疗效果,研究者们正积极开发新的靶向治疗药物[2]。Rasfonin是由日本千叶大学和东京大学科学家从真菌的固体发酵提取物中分离出来的新的化合物,可以显著抑制ras依赖的小鼠B细胞系Ba/F3-V12细胞的生存[3];而近年来研究发现,rasfonin在体内外对胰腺癌细胞Panc-1均有抑制作用[4],还可以在肾癌细胞中通过诱导自噬与凋亡发挥抗肿瘤细胞的活性[5]。
细胞凋亡、自噬、程序性坏死是程序性细胞死亡的3种主要方式[6]。细胞凋亡是程序性细胞死亡的主要形式,诱导细胞凋亡的途径主要为死亡受体途径和线粒体途径。细胞自噬是对细胞内损坏或衰老的蛋白质或细胞器进行降解并回收再利用的过程[7]。细胞自噬有助于维持细胞在恶劣环境中的生存,但过度的自噬使细胞内关键蛋白和细胞器消耗过度而导致死亡[8]。程序性坏死则是以细胞器的肿胀、胞膜的破坏为特点。尽管三者经历不同的生理过程,但三者间关系十分密切,在恶劣环境下细胞中还可以出现多种死亡方式共存[9]。
目前rasfonin在骨肉瘤中的作用还未见报道,本研究旨在明确rasfonin对骨肉瘤细胞143B的增殖和迁移是否存在抑制作用,并探讨rasfonin对骨肉瘤细胞凋亡及自噬的影响,希望为rasfonin用于骨肉瘤的治疗提供初步的实验依据。
1. 材料与方法
1.1. 药品和抗体
Rasfonin由中国人民解放军军事医学科学院毒物药物研究所车永胜研究员提供。氯喹(chloroquine diphosphate salt, CQ, C6628)和微管相关蛋白1轻链3融合蛋白(microtubule associated protein 1 light chain 3 fusion protein, LC3)抗体(L7543,1 ∶1 000)购自美国Sigma Aldrich公司,p62(sequestosome 1)抗体(sc-28359,1 ∶1 000)购自美国Santa Cruz公司,聚腺苷酸二磷酸核糖转移酶[poly (ADP-ribose) polymerase-1, PARP-1]抗体(9542,1 ∶1 000)购自美国Cell Signaling Technology公司,Actin抗体(TA-09, 1 ∶2 000)购自北京中杉金桥公司。
1.2. 试剂耗材
DMEM培养基和胎牛血清购自美国GIBCO公司,Transwell侵袭小室购自美国Corning公司,聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)膜及发光液购自美国Millipore公司。
1.3. 细胞培养
骨肉瘤143B细胞采用DMEM培养基[含10%(质量分数)胎牛血清和1%(质量分数)青链霉素双抗],于37 ℃、5% CO2(体积分数)细胞培养箱中进行培养。当细胞密度达到80%左右时,用胰酶消化贴壁细胞,离心后使用新鲜培养基重悬,将细胞分到六孔板内,待细胞生长至60%~70%密度,进行加药处理。
1.4. MTS检测细胞存活率
取对数生长期细胞,每孔5 000~10 000个细胞均匀接种于96孔板中,体积为100 μL,培养过夜后更换不含酚红的DMEM(含10%胎牛血清)培养基。每组设置3个复孔,以二甲基亚砜(dimethyl sulfo-xide, DMSO)为对照,加入指定浓度的rasfonin,继续培养指定的时间。而后每孔加入3-(4,5-二甲基) -5-(3-羧甲基苯环)-2-(4-硫基苯)-2H-四唑盐复合物 [3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt, MTS]和吩嗪硫酸甲酯(phenazine methosulfate,PMS)(20 ∶1)混合溶液20 μL,使用酶标仪(波长492 nm)测定各孔光密度值。
1.5. 克隆形成实验
将143B细胞按照1 000个/盘接种到6 cm培养皿中,加入3 μmol/L的rasfonin处理,每组重复3次。37 ℃、5%CO2细胞培养箱中培养1周。弃培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)洗1次,加入2 mL吉姆萨染液,室温过夜孵育。去除染液,清水洗1次,室温干燥后拍照。
1.6. 划痕实验
将143B细胞接种到6孔板中,当细胞密度达到80%左右时用200 μL枪头划一条直线。PBS洗去脱落细胞,加入新鲜培养基与3 μmol/L的rasfonin,于0、24 h分别拍照。
1.7. 侵袭实验
将143B细胞消化后重悬在不含血清的DMEM培养基中,以1×105个/200 μL的量接种于覆盖有基质胶的Transwell小室的上室中,以DMSO为对照,加入3 μmol/L的rasfonin,下室中加入含10%胎牛血清的DMEM培养基600 μL。37 ℃培养24 h后取出小室,用棉签擦去上室内的细胞,然后使用甲醇固定20 min,结晶紫染色20 min,显微镜下拍照并计数。
1.8. 透射电镜观察
将143B细胞接种于10 cm培养皿中,待细胞密度达到70%左右。换新鲜培养基,按3 μmol/L的浓度加入rasfonin或DMSO处理4 h。然后胰酶消化细胞,4 ℃、1 000×g离心5 min,冷的PBS洗两遍。加入1.5%的戊二醛溶液,4 ℃固定过夜后送检。
1.9. 免疫印迹实验(Western blot)
细胞经药物处理后,用冷PBS洗1遍,加入一定量的细胞裂解液,进行总蛋白的提取。将等量样品经8%或13.5%的十二烷基硫酸钠聚丙烯酰氨凝胶电泳(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,而后将胶内蛋白质电转至PVDF膜上。将PVDF膜用5%脱脂奶粉室温封闭1 h,一抗4 ℃孵育过夜,三羟甲基氨基甲烷缓冲盐水(triethanolamine buffered saline solution tween,TBST)洗膜后用相应二抗室温孵育1 h,经适当漂洗后,化学发光试剂盒显色。
1.10. 统计学分析
实验数据以均数±标准差的方式表示,均数间的比较采用独立t检验,MTS实验结果以单因素方差分析和Student-Newman-Keuls (S-N-K)法两两比较分析,P<0.05 认为差异有统计学意义。
2. 结果
2.1. Rasfonin抑制骨肉瘤143B细胞的增殖
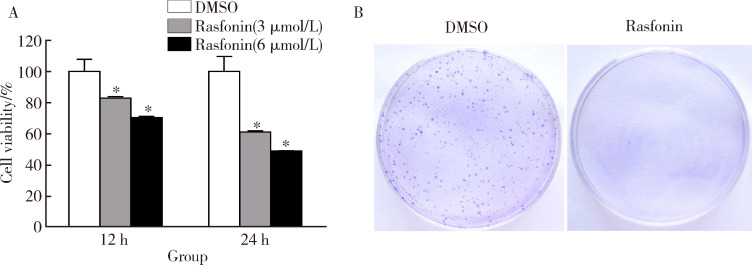
以DMSO为对照,采用不同浓度的rasfonin(3、6 μmol/L)处理143B细胞12 h或24 h。MTS结果显示,随着rasfonin浓度的升高,骨肉瘤143B细胞的细胞活性均逐渐降低,3组间差异有统计学意义(图1A, 12 h: F=31.36, P<0.01; 24 h: F=67.07, P<0.01),之后使用SNK法两两比较发现,任意两组间比较差异也均有统计学意义。克隆形成实验显示,3 μmol/L的rasfonin可以显著抑制143B细胞的集落形成能力(图1B)。
1.
Rasfonin抑制骨肉瘤143B细胞的增殖
Rasfonin inhibits cell viability of 143B cells
A,143B cells were treated with rasfonin (3 μmol/L and 6 μmol/L) for up to 24 h, cell viability was analyzed by 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt (MTS)assay;B,colony growth assays were performed in 143B cells with rasfonin (3 μmol/L).*P<0.01, vs.DMSO group.DMSO, dimethyl sulfoxide.
2.2. Rasfonin抑制骨肉瘤143B细胞的侵袭迁移
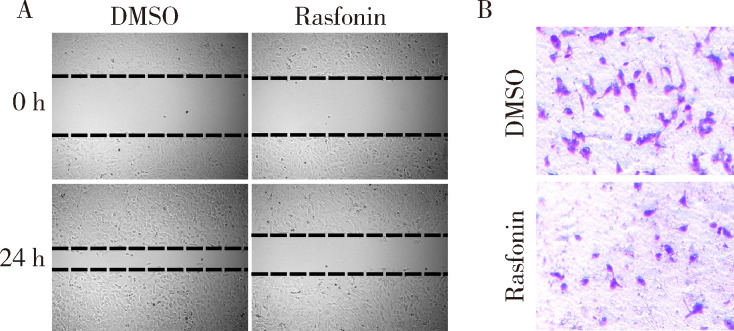
划痕实验表明,在3 μmol/L的rasfonin存在条件下,143B细胞的迁移愈合能力明显减弱,rasfonin处理组的伤痕愈合比率(33.91%±0.83%)明显低于DMSO组(65.11%±0.94%, P<0.01, 图2A)。同样,Transwell结果显示,3 μmol/L的rasfonin使143B细胞的侵袭能力也明显减弱, rasfonin处理组有(21.33±1.45)个细胞穿过覆盖有Matrigel的基底膜,明显低于DMSO组的(49.33±2.40)个(P<0.01,图2B)。
2.
Rasfonin抑制骨肉瘤143B细胞的侵袭迁移
Rasfonin inhibits migratory and invasive abilities of 143B cells
A and B, wound healing assay and transwell assay were performed in143B cells in the present of DMSO or rasfonin (3 μmol/L); B, stained with crystal violet, ×100.DMSO, dimethyl sulfoxide.
2.3. Rasfonin诱导143B细胞的自噬与凋亡
透射电镜观察发现3 μmol/L的rasfonin处理143B细胞4 h后,细胞中自噬体的数量明显增多(图3A)。LC3是自噬的标志蛋白,当自噬发生时,LC3-Ⅰ脂化形成LC3-Ⅱ,而p62是自噬的特异性底物,在自噬体内被降解;而氯喹是自噬晚期的抑制剂,可以抑制LC3-Ⅱ的降解。Rasfonin使143B细胞中p62蛋白表达减少,LC3-Ⅱ的量明显增多(图3B),而且在氯喹存在的情况下rasfonin引起的LC3-Ⅱ继续增多(图3C),这说明rasfonin可以引起143B细胞的自噬。PARP-1是一种脱氧核糖核酸(deoxyribonucleic acid,DNA)修复酶,也是细胞凋亡核心成员半胱天冬酶-3(caspase-3)的切割底物,PARP-1的切割可以作为caspase-3依赖的细胞凋亡的标志。采用rasfonin处理143B细胞,PARP-1的切割随着rasfonin浓度的升高而增强(图3D),说明rasfonin可以诱导143B细胞的凋亡。
3.
Rasfonin增强143B细胞的自噬与凋亡
Rasfonin increases autophagy and apoptosis of 143B cells
A,electron microscopy was performed in 143B cells after exposed to rasfonin (3 μmol/L) for 4 h,×9 900; B and C, following treatment of rasfonin (B: 3 μmol/L and 6 μmol/L, C:3 μmol/L) for 4 h with or without Choloroquine (CQ), 143B cells were lysed and analyzed by immunoblotting using the indicated antibodies.Actin was used as a loading control; D, expression of poly (ADP-ribose) polymerase-1(PARP-1) was analyzed by immunoblotting after treated by rasfoninfor 4 h. Actin was used as a loading control.DMSO, dimethyl sulfoxide; CQ,choloroquine;LC3, microtubule associated protein 1 light chain 3 fusion protein; PARP, poly (ADP-ribose) polymerase.
3. 讨论
新辅助化疗出现以来,骨肉瘤患者的5年生存率已由原来的20%提高到70%,且与过去的截肢手术相比,患者大多可以进行保肢手术,提高了患者术后的生活质量[10]。然而,对于化疗耐药或者发生肺转移的患者,治疗效果依然没有取得很大的进展,预后依然较差,死亡率较高,因此开发新的对骨肉瘤的生长与转移具有抑制作用的治疗药物对骨肉瘤患者具有重要意义。
真菌次级代谢产物rasfonin是一种具有肿瘤抑制活性的化合物,研究表明,rasfonin对胰腺癌细胞Panc-1的增殖、迁移均具有抑制作用,并且使丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的活性显著降低,说明rasfonin有可能通过该通路发挥抗肿瘤作用[4]。在肾癌细胞ACHN中,rasfonin可以抑制细胞活性并诱导其凋亡,对信号通路检测发现,rasfonin导致了蛋白激酶B(protein kinase B,AKT)活性的升高及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)下游核糖体蛋白S6激酶(ribosomal protein S6 kinase beta-1,S6K1) 和真核翻译起始因子-4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1, 4E-BP1)活性的降低[5],还使活性氧簇(reactive oxygen species, ROS) /c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)通路的活性升高[11],表明rasfonin可能通过多种不同的信号通路发挥抗肿瘤作用,这些结果均表明rasfonin具有临床治疗恶性肿瘤的潜在价值。与这些研究相一致的是,本研究发现rasfonin对骨肉瘤细胞也具有显著的抑制效果,它不仅可以降低143B细胞的活性及克隆形成能力,还减弱了细胞的迁移与侵袭能力,并且诱导了caspase依赖的细胞凋亡,下一步可进行体内实验进一步验证rasfonin对骨肉瘤的作用。
过度的自噬可以导致细胞的死亡,自噬是不同于细胞凋亡的第二类程序性细胞死亡[12]。通过药物诱导自噬性死亡对肿瘤的治疗具有积极作用,如替莫唑胺(temozolomide)、姜黄素(curcumin)均可以诱导恶性胶质瘤细胞的自噬性死亡[13,14];舒尼替尼(sunitinib)诱导的肾癌细胞的自噬增强了其对肾癌细胞的杀伤作用[15]。在肾癌细胞中,rasfonin可以诱导细胞的自噬,抑制其自噬可以挽救rasfonin引起的细胞活性降低与凋亡,这表明自噬可能是rasfonin引起细胞死亡的方式之一[5]。本研究表明,rasfonin也可以诱导骨肉瘤细胞的自噬,自噬在rasfonin的抗瘤效果中可能也起到重要作用,这其中的具体机制有待进一步阐明。
综上所述,本实验证明了rasfonin在体外对骨肉瘤细胞143B的抑制作用,rasfonin有望成为一种临床治疗骨肉瘤的新药物。
(志谢:感谢中国人民解放军军事医学科学院毒物药物研究所车永胜研究员对rasfonin的提供)
(本文编辑:刘淑萍)
Funding Statement
国家自然科学基金(81272381)
the National Natural Science Foundation of China(81272381)
References
- 1.Osasan S, Zhang M, Shen F, et al. Osteogenic sarcoma: a 21st century review. Anticancer Res. 2016;36(9):4391–4398. doi: 10.21873/anticanres.10982. [DOI] [PubMed] [Google Scholar]
- 2.Shaikh AB, Li F, Li M, et al. Present advances and future perspectives of molecular targeted therapy for osteosarcoma. Int J Mol Sci. 2016;17(4):506. doi: 10.3390/ijms17040506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Tomikawa T, Shin-Ya K, Furihata K, et al. Rasfonin, a new apoptosis inducer in ras-dependent cells from Talaromyces sp. J Antibiot (Tokyo) 2000;53(8):848–850. doi: 10.7164/antibiotics.53.848. [DOI] [PubMed] [Google Scholar]
- 4.Xiao Z, Li L, Li Y, et al. Rasfonin, a novel 2-pyrone derivative, induces ras-mutated Panc-1 pancreatic tumor cell death in nude mice. Cell Death Dis. 2014;5(5):e1241. doi: 10.1038/cddis.2014.213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lu Q, Yan S, Sun H, et al. Akt inhibition attenuates rasfonin-induced autophagy and apoptosis through the glycolytic pathway in renal cancer cells. Cell Death Dis. 2015;6(12):e2005. doi: 10.1038/cddis.2015.344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ouyang L, Shi Z, Zhao S, et al. Programmed cell death pathways in cancer: a review of apoptosis, autophagy and programmed necrosis. Cell Prolif. 2012;45(6):487–498. doi: 10.1111/j.1365-2184.2012.00845.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Hale AN, Ledbetter DJ, Gawriluk TR, et al. Autophagy: regulation and role in development. Autophagy. 2013;9(7):951–972. doi: 10.4161/auto.24273. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Levine B, Yuan J. Autophagy in cell death: an innocent convict? J Clin Invest. 2005;115(10):2679–2688. doi: 10.1172/JCI26390. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Eisenberg-Lerner A, Bialik S, Simon HU, et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death Differ. 2009;16(7):966–975. doi: 10.1038/cdd.2009.33. [DOI] [PubMed] [Google Scholar]
- 10.燕 太强, 梁 伟民, 郭 卫. 骨肉瘤的诊疗和研究进展. 中华临床医师杂志: 电子版. 2012;(17):4988–4990. [Google Scholar]
- 11.Wang W, Sun H, Che Y, et al. Rasfonin promotes autophagy and apoptosis via upregulation of reactive oxygen species (ros)/jnk pathway. Mycology. 2016;7(2):64. doi: 10.1080/21501203.2016.1170073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Galluzzi L, Vitale I, Abrams JM, et al. Molecular definitions of cell death subroutines: recommendations of the Nomenclature Committee on Cell Death 2012. Cell Death Differ. 2012;19(1):107–120. doi: 10.1038/cdd.2011.96. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kanzawa T, Germano IM, Komata T, et al. Role of autophagy in temozolomide-induced cytotoxicity for malignant glioma cells. Cell Death Differ. 2004;11(4):448–457. doi: 10.1038/sj.cdd.4401359. [DOI] [PubMed] [Google Scholar]
- 14.Shinojima N, Yokoyama T, Kondo Y, et al. Roles of the akt/mtor/p70s6k and erk1/2 signaling pathways in curcumin-induced autophagy. Autophagy. 2007;3(6):635–637. doi: 10.4161/auto.4916. [DOI] [PubMed] [Google Scholar]
- 15.曹 珮, 姜 学军, 席 志军. 舒尼替尼通过抑制 Akt/mTOR 信号通路诱导肾癌细胞自噬. 北京大学学报(医学版) 2016;48(4):584–589. [Google Scholar]