Abstract
目的
探究人类趋化素样因子超家族2(CKLF-like MARVEL transmembrane domain-containing protein 2, CMTM2)在小鼠精子生成过程中的作用。
方法
构建CMTM2基因敲除小鼠模型,利用Northern、RT-PCR及 Western 印迹检测野生型、杂合子及纯合子小鼠的CMTM2表达水平,统计小鼠生育幼崽数量及生育率,采集并分析精子活动度、形态及睾丸组织切片,检验血清睾酮及促卵泡激素(follicle-stimulating hormone, FSH)水平。
结果
CMTM2在小鼠生精中呈现准确的调控式高度表达,基因敲除的成年小鼠和野生型成年小鼠在体重上差异没有统计学意义。纯合子的小鼠睾丸体积及重量小于野生型小鼠睾丸,野生型小鼠与CMTM2敲除小鼠的睾丸长径比较,差异有统计学意义[(11.32±1.21) mm vs. (8.29±1.92) mm, P<0.05],睾丸重量比较,差异有统计学意义[(101.63±2.33) mg vs. (85.22±2.84) mg, P <0.05]。与野生型小鼠相比,杂合子精子数量明显减少,纯合子小鼠精子发生停滞。在精子形态学方面,与野生型小鼠相比,杂合子小鼠有更多圆形精子,而纯合子则因精子发育停滞,多为圆形精子细胞。睾酮和FSH在3组间差异无统计学意义。纯合子雄性小鼠由于精子发生停滞而不育,纯合子小鼠缺失生精上皮层。
结论
CMTM2在生精过程中发挥着不可或缺的作用,其参与精子发生的潜在机制有待于进一步实验研究以证实。
Keywords: 人类趋化素样因子超家族2, 精子, 基因敲除小鼠模型, 精子生成
Abstract
Objective
To investigate whether CKLF-like MARVEL transmembrane domain-containing protein 2 (CMTM2) is involved in spermatogenesis in mice. CMTM2 is highly expressed in testis, and could possibly be a potential spermagogenesis specific gene.
Methods
CMTM2-deficient mouse model was generated. Northern, RT-PCR and Western blotting analysis were performed on total RNA derived from wild-type (WT, CMTM2 +/+) and CMTM2 +/- (heterozygote) and CMTM2 -/-(homozygote) mice to examine the CMTM2 level. The number of litters and the number of pups were counted and pregnancy rates calculated. The motility and morphology of the sperm and the histology of testes were analyzed. Se-rum testosterone and FSH concentrations were also measured. Standard t-tests were used and standard error of means were calculated.
Results
CMTM2 was highly expressed in a finely regulated pattern in the mouse testis during spermatogenesis. The body weight of adult mice with CMTM2 deficiency was not significantly different from that of wild type mice. No obvious anatomical or behavioral abnormalities were observed. The testis of CMTM2 -/- was smaller than that of CMTM2 +/+ mice. The testis diameter in wild mice and CMTM2 null mice were (11.32±1.21) mm vs. (8.29±1.92) mm (P<0.05), and the weights were (101.63±2.33) mg vs. (85.22±2.84) mg (P<0.05), respectively. Female CMTM2 null mice were fertile, indicating that CMTM2 was not required for female gametogenesis. The CMTM2 -/- mice produced virtually no sperm, and CMTM2 +/- mice sperm count showed a significant decline. In terms of sperm morphorlogy study, more round spermatids could be observed in the heterozygote group, compared with the wild type group; while in the homozygote group, a large amount of round spermatids could be observed because of complete arrest of spermiogenesis. The hormone levels were not significantly different. The CMTM2 -/- male mice were sterile due to a late, complete arrest of spermiogenesis. The organized architecture of the seminiferous epithelium of the seminiferous tubules seen in CMTM2 +/+ mice was lost in CMTM2 -/- mice.
Conclusion
This study suggests CMTM2 is not required for embryonic development in the mouse but is essential for spermiogenesis, however, further studies are required for more detailed mechanism study.
Keywords: CMTM2, Sperm, Gene knockout mouse model, Spermiogenesis
尽管男性生殖在人类健康中占有重要地位,但目前对于男性不育的发病机制仍然知之甚少[1]。多种因素可导致男性不育,如先天畸形、环境污染、遗传和内分泌紊乱、感染、炎症和自身免疫疾病[2]。精子发生依赖于大量睾丸特异基因的精确表达,其与精子发生的缺陷和男性不育高度相关[3,4,5]。
人类趋化素样因子超家族2(CKLF-like MARVEL transmembrane domain-containing protein 2, CMTM2)可能和精子发生相关[6],CMTM2是CMTM基因家族中的一员,以前称之为趋化素样因子超家族,该家族基因的编码产物结构特殊,介于趋化因子和4次跨膜蛋白之间[7,8]。有意义的是CMTM家族多数成员在男性睾丸组织中都有较高水平的表达,特别是CMTM2在人睾丸组织中特异性高表达[9],而且CMTM2异常表达和生精缺陷有密切联系,这都提示了CMTM2在精子发生中的重要性[6]。唯支持细胞综合征是一种以人类睾丸生精小管上皮完全缺失为特点的病理学综合征。随着精子形成缺陷的加剧,CMTM2阳性细胞数量和mRNA转录水平明显下降,在唯支持细胞综合征患者的睾丸组织中没有翻译出相应的蛋白产物[6,10],这种相关性提示CMTM2在精子生成中可能起到关键作用。本研究通过建立CMTM2基因敲除小鼠模型,从生殖表型、精子质量、生育能力和睾丸变化等方面观察CMTM2对男性生育能力的影响。
1. 材料与方法
1.1. 实验材料
CMTM2基因敲除小鼠由美国圣路易斯华盛顿大学Kite Brandes医生惠赠。实验用小鼠均为C57BL/6株系。CMTM2基因敲除小鼠饲养在北京大学人民医院SPF级实验动物中心,环境温度控制在(24.0±0.5)℃,相对湿度50%~60%,自由饮食进水,昼夜光照节律。采用大小鼠繁殖饲料(上海斯莱克试验动物有限公司)及灭菌垫料,二者均为SPF级,垫料每周更换2次,饮水为超纯水,每日补充饲料及饮水。饲养笼具及饮水瓶每次更换清洗后均使用84消毒液浸泡,自来水冲洗后高压灭菌处理。
1.2. 实验方法
1.2.1 基因鉴定 分别提取 CMTM2 基因敲除野生型、杂合子及纯合子小鼠睾丸组织总RNA,进行 RT-PCR,扩增目的基因片段并进行Northern blot检测基因表达情况。CMTM2 引物序列由Jackson Laboratory提供,由上海生工生物工程技术服务股份有限公司合成,为干粉状,正义序列为CAAACCCGAGGAAGACAAG,反义序列为GGAACGCACAAGCAATCA,按体积比1 ∶100稀释,等体积混合备用。PCR反应体系为20 μL: 2×DreamTaq Green PCR Master Mix 10 μL,模板DNA 2 μL,引物混合物1 μL,ddH2O 7 μL。采用PCR仪进行扩增,反应条件为预变性 95 ℃ 3 min,变性95 ℃ 30 s,退火60 ℃ 30 s,延伸72 ℃ 45 s,循环40次,72 ℃ 5 min终止反应。琼脂糖凝胶电泳:取PCR扩增产物6 μL,在2%(质量分数)琼脂糖凝胶中以150 V由负极向正极电泳 30 min,于化学发光凝胶成像系统中拍照观察。基因型结果判定:常规突变下游引物扩增产物长度为250 bp左右,为基因敲除(knock out, KO)小鼠;野生型上游常规引物扩增产物长度为747 bp,为WT小鼠;两条电泳条带均存在的为杂合子小鼠。CMTM2 基因敲除纯合子小鼠RNA采用未加入逆转录酶的对照PCR反应。睾丸提取物采用单克隆抗体(Santa Cruz Biotechnology, Santa Cruz, CA, USA)进行Western blot检测。
1.2.2 睾丸组织的表达定位 研究采用8~12周的成年雄性小鼠,氯胺酮(100 mg/kg)和甲苯噻嗪(10 mg/kg)混合后腹腔内注射麻醉。取由剑突到耻骨的腹部正中切口,用解剖显微镜检查腹腔内容物,随后戊巴比妥(100 mg/kg)心腔内注射处死小鼠。小鼠死后立即取睾丸在Bouin氏液中固定,4 μm厚度切片,HE染色后镜下观察。每个睾丸取5个(即每个小鼠取10个)精曲小管计数生精上皮特定细胞数,两个独立的观察者进行细胞计数。
1.2.3 Western blot检测 取CMTM2 基因敲除野生型、杂合子及纯合子小鼠睾丸组织,分别加入预冷的RIPA 裂解液,低温均匀后,4 ℃ 离心 20 min收集上清,BCA蛋白定量法定量蛋白后加入5×蛋白上样缓冲液,95 ℃ 10 min 后进行 SDS-PAGE 凝胶电泳,转移到NC 膜上,用5%(体积分数)BSA 封闭1 h,加兔抗 CMTM2抗体(Cell Signaling Technology, Inc., Beverly, MA, USA)4 ℃ 过夜,TBST洗膜后加 HRP标记羊抗兔IgG抗体(Sigma-Aldrich, MO, USA)室温1 h,ECL化学发光液孵育5 min,于 Image Quant凝胶成像系统仪上显影观察,图像采用Image Quant软件扫描。抗 GAPDH抗体(Sigma-Aldrich MO, USA)为内参。
1.2.4 精子计数、运动参数及形态分析 收集附睾尾的精子加入改良Whitten溶液,5 min后肉眼可见精子充分分散。取少量样本后以体积比1 ∶20改良Whitten溶液稀释,于预热计数腔式载玻片盖片后采用计算机辅助精子计数分析系统进行分析。选取载玻片的5个格子进行分析,记录精子的活动度。两份样本各取少量以体积比1 ∶200蒸馏水固定并采用血细胞计数器计数,随后计算平均精子浓度。收集的精子加入预热的M16溶液中并稀释到105/mL,多聚甲醛固定。取3 μL样本加入12 μL MicroCell 固定槽 (Conception Technologies, San Diego, CA, USA), 用40倍相差显微镜观察。每一基因型至少计数100个精子,包括头部和尾部,使用计算机辅助精子计数(computer aided sperm analysis, CASA)收集精子计数、运动参数与形态分析。
1.2.5 交配实验 3种基因型成年雄性小鼠与两种不同种系(B6和C57BL/6)的野生型成年雌性小鼠合笼交配,一只雄鼠和两只雌鼠合笼交配,而雌鼠每周更换1次。当观察到雌性小鼠的阴道栓后,则马上进行更换。观察到阴道栓且生育仔鼠的雌鼠定义为成功怀孕,计算交配/插入频率,怀孕频率及平均仔鼠数量。
1.2.6 血清睾酮水平的检测 处死小鼠后静脉采血离心分离血清,置-20 ℃冰箱中保存,采用酶联免疫吸附试验(ELISA试剂盒)检测样品血清睾酮及促卵泡激素(follicle-stimulating hormone, FSH)水平。
1.3. 统计学分析
用SPSS11.0软件分析,计量资料以 x±s 表示,对于正态分布数据,两组间比较采用t检验,不适用t检验的数据采用秩和检验,P< 0.05认为有统计学差异。
2. 结果
2.1. CMTM2 基因敲除小鼠模型的建立
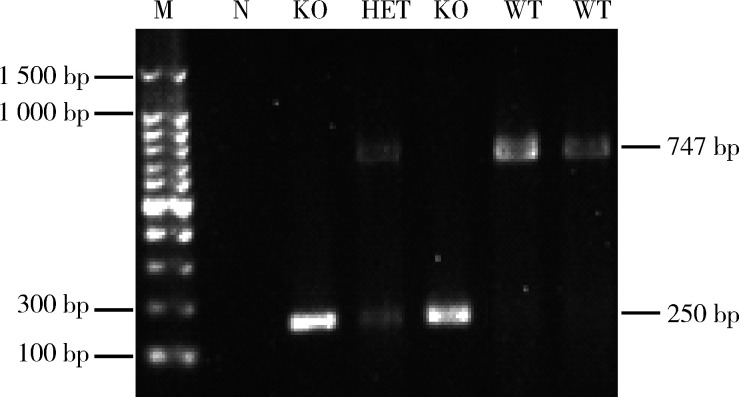
以CMTM2 基因敲除杂合子小鼠进行杂合交配,共产生3种基因型F2后代:36只野生型、38只杂合子及20只纯合子。从F1到F8代共255只小鼠,死亡3只,提示敲除CMTM2并不具有致死性。CMTM2 基因敲除小鼠在成年过程中未出现畸形和异常死亡,从外观及行为上看和正常小鼠并无差异。CMTM2 基因敲除小鼠的体重和野生型小鼠差异无统计学意义。部分小鼠鼠尾基因组DNA扩增产物凝胶电泳结果及Western blot如图1、2所示,N为阴性对照未见电泳条带,仅250 bp左右位置可见条带为CMTM2基因敲除纯合子,仅 747 bp位置可见条带为野生型,250 bp左右和747 bp位置两条条带均可见为CMTM2基因敲除杂合子。实验注意到CMTM2 基因敲除小鼠的睾丸长径[(8.29±1.92) mm vs. (11.32±1.21) mm, P<0.05]及重量[(85.22±2.84)mg vs. (101.63±2.33) mg,P<0.05]小于野生型小鼠(图3),不过,因两组中小鼠体重差异无统计学意义,考虑睾丸长径与重量减少可能与小鼠体重无关(表 1)。
1.
部分小鼠基因型PCR检测结果
Genotype of some mice by PCR method
M, marker (100 bp DNA ladder); N, negative control; KO, homozygote; HET, heterozygote; WT, wild type.
3.
CMTM2基因突变小鼠睾丸体积的比较
Comparison of the testis volume in CMTM2 mutant mice
The testes of CMTM2-/- mice are smaller than those of CMTM2+/+.
1.
3组基因型小鼠的睾丸重量、精子计数、运动参数及形态分析
The comparison of testis weight, sperm count and motion parameters in different groups
| Genotype | Age/weeks | Testes weight/mg | Sperm count /(×107/mL) | Motility/% | Morphology |
| Values are x±s. Sperm counts and motility percentage was calculated by combining sperm from both cauda epididymides of mice.*P<0.001. | |||||
| CMTM2+/+ | 8-12 | 101.63±2.33 | 3.28±0.34 | 86.33±2.98 | Normal |
| CMTM2+/- | 8-12 | 98.87±2.76 | 2.07±0.57 | 33.45±3.67* | Many round sperms |
| CMTM2-/- | 8-12 | 85.22±2.84* | 0* | 0* | 0* |
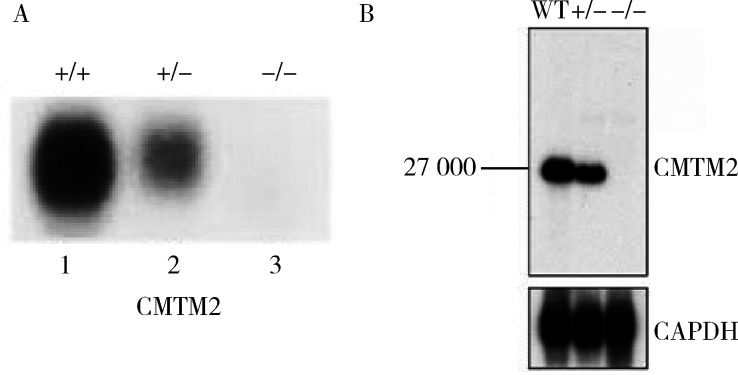
2.
CMTM2基因突变小鼠睾丸特异基因表达的检测
Analysis of testis gene expression in CMTM2 mutant mice
A, northern blot analysis, the RNA from the mice whose genotype is shown above each lane was hybridized with a 32 P-labeled probe to detect the expression of the gene shown below each panel. The CMTM2 gene expression is abolished in CMTM2-/- animals; B, Western blot analysis, testes of CMTM2+/+, CMTM2+/- and CMTM2-/- were tested for CMTM2 protein expression. There was a dramatic reduction in the expression of CMTM2 in mutant mice. GAPDH was used as the loading control.
2.2. 精子计数、运动参数及形态分析
CMTM2基因敲除小鼠与野生型相比,精子计数和活动度差异有统计学意义,杂合子小鼠精子数量显著减少,纯合子小鼠精子发生停滞(表1)。在精子形态学方面,杂合子小鼠有更多圆形精子,而纯合子因精子发育停滞,多为圆形精子细胞。
2.3. 血清激素水平的检测
纯合子小鼠血清睾酮[(11.90±0.52) nmol/L]和FSH水平[(5.33±0.12) IU/L]、杂合子血清睾酮[(12.11±0.55) nmol/L]和FSH水平[(5.39±0.15) IU/L]与野生型血清睾酮[(11.88±0.68) nmol/L]和FSH水平[(5.34±0.19) IU/L],差异均无统计学意义。
2.4. 交配实验
雌性CMTM2基因敲除小鼠有生育能力,表明CMTM2对于雌配子发生不是必需的。相反,CMTM2基因敲除纯合子雄性小鼠则不育。3组基因型雄性小鼠与野生型雌鼠交配的能力组间差异无统计学意义,然而,纯合子组不能使雌性小鼠怀孕,杂合子组的怀孕雌鼠和仔鼠数目也比野生型组减少(表2)。
2.
3组基因型小鼠交配实验结果
The mating experiment in different groups
| Male mice genotype | Female mice | Plugged mice | Pregnant mice | Offspring (M ∶F) | AOA | FCP/% | FC/% |
| M, male; F, female; WT, wild type. Average offspring amount (AOA) was calculated as the total number of offspring divided by the number of females that gave birth to offspring. Frequency of copulatory plug (FCP) was calculated as the ratio of the number of plugged females to total number of females to which males with the same genotype had access. Frequency of conception (FC) was calculated as the ratio of the number of females that gave birth to offspring to total number of females.*P<0.001. | |||||||
|
CMTM2+/+ (n=5) CMTM2+/- (n=5) CMTM2-/-(n=5) |
WT (n=49) WT (n=51) WT (n=50) |
38 34 36 |
31 13 0* |
249 (132 ∶117) 103 (50 ∶53) 0* |
8.0 7.9 0* |
77.6 66.7 72.0 |
63.3 25.5 0* |
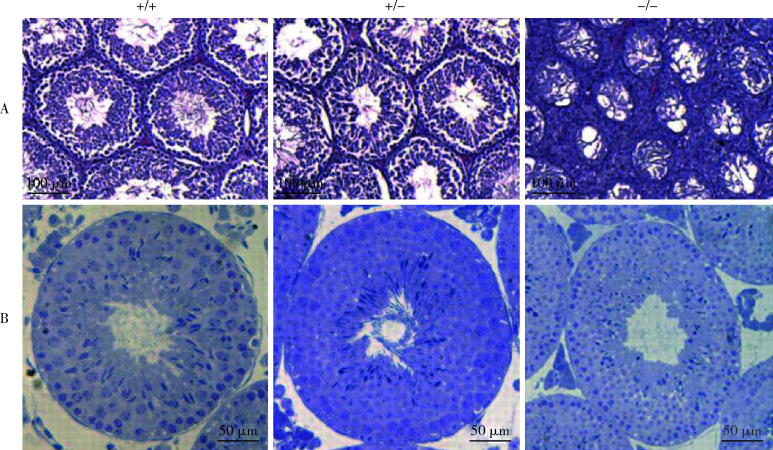
2.5. 睾丸组织的病理变化
野生型小鼠的生精小管中可见完整的生精上皮层结构,杂合子小鼠睾丸中生精上皮可见部分缺失,而纯合子组中未见完整的正常生精上皮结构(图4), 且其管腔生精上皮极度不规则甚至缺失(表3)。
4.
CMTM2基因突变小鼠睾丸组织表达定位
Testis histology in CMTM2 mutant mice
A, histological staining of testis with hematoxylin and eosin (HE), and nearly complete germ cell loss is apparent in CMTM2-/- testis, whereas CMTM2+/+, CMTM2+/- testes look normal; B, spermatogonial depletion CMTM2-/- mice, CMTM2+/- mice look normal in comparison with CMTM2+/+ animals, whereas a progressive germ cell loss is also could be observed.
3.
3组基因型小鼠生精小管上皮中的各类精子细胞数目
The comparison of spermatids in seminiferous tubule in different groups
| Genotype | SG | PSC | SSC | Spermatids | Sperms | Sertoli cells |
| Values are x±s. SG, spermatogonia; PSC, primary spermatocytes; SSC, secondary spermatocytes. *P<0.001. | ||||||
|
CMTM2+/+(n=5) CMTM2+/- (n=5) CMTM2-/- (n=5) |
39.11±2.98 37.73±4.55 14.22±5.01* |
67.92±1.03 63.34±6.01 20.18±8.82* |
2.96±0.73 2.29±0.74 0.00±0.00* |
139.22±7.81 128.18±8.17 30.84±13.89* |
40.84±5.92 29.28±3.44 0.00±0.00* |
9.21±1.29 9.45±1.78 9.01±1.54 |
3. 讨论
既往研究表明,CMTM2参与精子发生,本研究旨在进一步探讨其在CMTM2基因敲除小鼠模型中的作用。本研究提示CMTM2基因缺失与雄性小鼠不育有着密切关系。
CMTM2位于内质网近高尔基体处[9],在减数分裂后期,精子会出现形态改变,并经过高尔基体、基体-轴丝复合体、线粒体、内质网等细胞器的结构修饰[11,12]。此外,CMTM2蛋白序列中含有MARVEL结构域, 而含有MARVEL的蛋白(如 MAL、physins, gyrins and occluding家族等)可能与类固醇合成时胞内物质的转运过程有潜在的关系,如囊泡载体的来源[13]。
交配实验显示,3种基因型雄性小鼠与野生型雌性小鼠交配的能力差异无统计学意义,然而,纯合子小鼠没有产生精子,杂合子小鼠的精子计数和运动能力明显减少从而影响其生育率。在人类,男性不育患者精子的运动能力低,而精子的运动能力是定义正常精液一个至关重要的参数[14]。精子运动能力的降低导致受精的机会减少从而会导致不孕症[15]。基因缺陷者会更容易受到致病因素和生活方式的影响,包括其他遗传疾病、生殖道感染、环境污染及吸烟[16],而这些轻微损伤的累积可能会导致男性不育的发生,除此之外,遗传疾病在精子损伤中也发挥着重要作用[17]。
纯合子小鼠的精子稀少且形态畸形,通常从圆形精子过渡到蝌蚪状精子(即精子变态)时开始出现该畸形。在野生型小鼠,这种转变之前伴随着圆形精子细胞核CMTM2的过表达,同时,CASA揭示了纯合子小鼠和野生型小鼠精子运动参数的差异,不过,有关CMTM2蛋白的生物学功能目前仍知之甚少[18,19]。虽然本研究并未检测关键启动子磷酸腺苷反应元件调节物(cAMP response element binding protein, CREM)基因以及其他睾丸特异基因的表达[20,21],但对精子形成的中止主要发生在精子变态中的可能解释是特定的单倍体基因没有表达,而这些基因的表达通常在圆形精子细胞变态的第5~7步骤开始,且在精子变态整个过程中持续转录mRNA [22,23]。而转录的启动总是伴随着CMTM2表达的高峰,虽然不能排除间接效应,但这表明了mRNA的表达可能由CMTM2直接控制。这些基因的特征尚未完全被阐明,其明确的功能尚不为人知。然而,CMTM2纯合子小鼠精子形成中止表明CMTM2在精子变态成熟过程中发挥着不可或缺的作用。
本研究存在局限性:首先,研究只是针对小鼠CMTM2初期的观察性研究,没有进行基于时间的动态观察;其次,没有进行细胞凋亡研究阐明过度凋亡是否参与精子发生减少;也未使用电子显微镜、原位杂交、免疫荧光显微镜等其他研究方法。本课题组将在后续研究中进一步探索CMTM2参与精子发生的机制。
综上所述,本研究成功地构建CMTM2基因敲除小鼠模型,并证实了CMTM2纯合子小鼠的生殖表型、生育状况和睾丸的变化,因此推测CMTM2可能参与了减数分裂后期精子发生和细胞凋亡,最终导致了不育,具体机制有尚待进一步研究。
(本文编辑:王 蕾)
Funding Statement
国家自然科学基金(81472393); 北京市自然科学基金(7194327)
National Natural Foundation of China(81472393); Beijing Municipal Natural Science Foundation(7194327)
References
- 1.Zhang Y, Xiao F, Lu S, et al. Research trends and perspectives of male infertility: a bibliometric analysis of 20 years of scientific literature. Andrology. 2016;4(6):990–1001. doi: 10.1111/andr.12204. [DOI] [PubMed] [Google Scholar]
- 2.Kumar N, Singh AK. Trends of male factor infertility, an important cause of infertility: a review of literature. J Hum Reprod Sci. 2015;8(4):191–196. doi: 10.4103/0974-1208.170370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Cho C, Willis WD, Goulding EH, et al. Haploinsufficiency of protamine-1 or-2 causes infertility in mice. Nat Genet. 2001;28(1):82–86. doi: 10.1038/ng0501-82. [DOI] [PubMed] [Google Scholar]
- 4.Pan J, Goodheart M, Chuma S, et al. RNF17, a component of the mammalian germ cell nuage, is essential for spermiogenesis. Development. 2005;132(18):4029–4039. doi: 10.1242/dev.02003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yan W. Male infertility caused by spermiogenic defects: lessons from gene knockouts. Mol Cell Endocrinol. 2009;306(1/2):24–32. doi: 10.1016/j.mce.2009.03.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Liu G, Xin ZC, Chen L, et al. Expression and localization of CKLFSF2 in human spermatogenesis. Asian J Androl. 2007;9(2):189–198. doi: 10.1111/j.1745-7262.2007.00249.x. [DOI] [PubMed] [Google Scholar]
- 7.Han W, Ding P, Xu M, et al. Identification of eight genes encoding chemokine-like factor superfamily members 1-8 (CKLFSF1-8) by in silico cloning and experimental validation. Genomics. 2003;81(6):609–617. doi: 10.1016/s0888-7543(03)00095-8. [DOI] [PubMed] [Google Scholar]
- 8.Han W, Lou Y, Tang J, et al. Molecular cloning and characterization of chemokine-like factor 1 (CKLF1), a novel human cytokine with unique structure and potential chemotactic activity. Biochem J. 2001;357(Ptl):127–135. doi: 10.1042/0264-6021:3570127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Shi S, Rui M, Han W, et al. CKLFSF2 is highly expressed in testis and can be secreted into the seminiferous tubules. Int J Biochem Cell Biol. 2005;37(8):1633–1640. doi: 10.1016/j.biocel.2004.04.028. [DOI] [PubMed] [Google Scholar]
- 10.Zhang XD, Yin LL, Zheng Y, et al. Expression of a novel beta adaptin subunit mRNA splice variant in human testes. Asian J Androl. 2005;7(2):179–188. doi: 10.1111/j.1745-7262.2005.00025.x. [DOI] [PubMed] [Google Scholar]
- 11.Noormets K, Kõks S, Kavak A, et al. Male mice with deleted Wolframin (Wfs1) gene have reduced fertility . Reprod Biol Endocrinol. 2009;7:82. doi: 10.1186/1477-7827-7-82. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Ramalho-Santos J, Moreno RD. Targeting and fusion proteins during mammalian spermiogenesis. Biol Res. 2001;34(2):147–152. doi: 10.4067/s0716-97602001000200021. [DOI] [PubMed] [Google Scholar]
- 13.Sánchez-Pulido L, Martín-Belmonte F, Valencia A, et al. MARVEL: a conserved domain involved in membrane apposition events. Trends Biochem Sci. 2002;27(12):599–601. doi: 10.1016/s0968-0004(02)02229-6. [DOI] [PubMed] [Google Scholar]
- 14.Centola GM. Semen assessment. Urol Clin North Am. 2014;41(1):163–167. doi: 10.1016/j.ucl.2013.08.007. [DOI] [PubMed] [Google Scholar]
- 15.Parmegiani L, Cognigni GE, Filicori M. Sperm selection: effect on sperm DNA quality. Adv Exp Med Biol. 2014;791:151–172. doi: 10.1007/978-1-4614-7783-9_10. [DOI] [PubMed] [Google Scholar]
- 16.Skakkebaek NE, Jørgensen N, Main KM, et al. Is human fecundity declining. Int J Androl. 2006;29(1):2–11. doi: 10.1111/j.1365-2605.2005.00573.x. [DOI] [PubMed] [Google Scholar]
- 17.Shamsi MB, Kumar K, Dada R. Genetic and epigenetic factors: Role in male infertility. Indian J Urol. 2011;27(1):110–120. doi: 10.4103/0970-1591.78436. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.刘 振华, 谢 京, 萧 云备, et al. CMTM2改善环磷酰胺致转基因小鼠模型生殖毒性作用并影响StAR蛋白的表达. 中华男科学杂志. 2013;19(3):210–213. [Google Scholar]
- 19.刘 振华, 萧 云备, 张 晓威, et al. CMTM2转基因小鼠的构建及其血清睾酮水平的变化. 中华男科学杂志. 2012;18(6):483–486. [PubMed] [Google Scholar]
- 20.Walker WH, Habener JE. Role of transcription factors CREB and CREM in cAMP-regulated transcription during spermatogenesis. Trends Endocrinol Metab. 1996;7(4):133–138. doi: 10.1016/1043-2760(96)00035-5. [DOI] [PubMed] [Google Scholar]
- 21.Sassone-Corsi P. CREM: a master-switch governing male germ cells differentiation and apoptosis. Semin Cell Dev Biol. 1998;9(4):475–482. doi: 10.1006/scdb.1998.0200. [DOI] [PubMed] [Google Scholar]
- 22.Schmidt EE, Schibler U. High accumulation of components of the RNA polymerase II transcription machinery in rodent spermatids. Development. 1995;121(8):2373–2383. doi: 10.1242/dev.121.8.2373. [DOI] [PubMed] [Google Scholar]
- 23.Kotaja N. MicroRNAs and spermatogenesis. Fertil Steril. 2014;101(6):1552–1562. doi: 10.1016/j.fertnstert.2014.04.025. [DOI] [PubMed] [Google Scholar]