Abstract
目的
探讨二氧化硫(sulfur dioxide,SO2)在肢体缺血再灌注(ischemia/reperfusion,I/R)致急性肺损伤(acute lung injury,ALI)保护作用中对肺泡巨噬细胞(alveolar macrophage,AM)凋亡的影响,为控制炎症反应寻找新的靶点。
方法
分离培养AM,应用肢体缺血再灌注致ALI大鼠血清制备细胞模型,给予外源性SO2,然后检测线粒体膜电位以及线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)开放情况,AM凋亡情况及凋亡相关Bcl-2、Caspase-3分子蛋白表达情况。
结果
与对照组相比,I/R组红、绿荧光的比值下降,吸光度显著降低,AM凋亡率增加到43.81%±2.40%,Caspase-3蛋白表达升高,Bcl-2蛋白表达下降;而与I/R组比较,I/R+SO2组红、绿荧光的比值升高,吸光度增高,AM凋亡率减少37.01%±1.93%,Caspase-3蛋白表达降低,Bcl-2蛋白表达升高。
结论
外源性SO2可通过抑制线粒体途径改善巨噬细胞的凋亡。
Keywords: 二氧化硫, 再灌注损伤, 急性肺损伤, 巨噬细胞, 肺泡
Abstract
Objective
To investigate the effect of sulfur dioxide (SO2) on the apoptosis of alveolar macrophage (AM) in lung protection of limb ischemia/reperfusion (I/R) induced acute lung injury (ALI), and to find a new target for the control of inflammatory response.
Methods
Twenty pathogen-free, adult male Sprague-Dawley (SD) rats (180-230 g) were used in this study. Five rats were to be used for limb ischemia/reperfusion, then plasma was extracted as ischemia/reperfusion serum stimulation. Fifteen rats were to be used for extracting AM by bronchoalveolar lavage. The AM was isolated and cultured, then the cell count was adjusted to 1×10 6/mL, and randomly divided into the following 4 groups (n=6): control group, I/R group, SO2 group, and I/R+SO2 group. The I/R group was given ischemia/reperfusion serum (500 μg/L) to stimulate 6 h; the SO2 group was given an SO2 donor, Na2SO3/NaHSO3 [(0.54 mmol/kg) / (0.18 mmol/kg)]; and the I/R+SO2 group was given the same ischemia/reperfusion serum and Na2SO3/NaHSO3 at the same time. The level of mitochondrial membrane potential, the state of mitochondrial permeability transition pore (mPTP), the rate of AM apoptosis, the expression of Bcl-2 and Caspase-3 proteins were detected by flow cytometry, microplate reader and Western blotting.
Results
Compared with the control group, in the I/R group, the ratio of red to green fluorescence and the absorbance decreased significantly, the percentage of apoptotic cells increased obviously, the apoptotic rate was 43.81%±2.40%, Caspase-3 protein expression increased, Bcl-2 protein expression decreased. While compared with the I/R group, in the I/R+SO2 group, the ratio of red to green fluorescence and the absorbance increased significantly; the apoptotic rate decreased to 37.01%±1.93%, Caspase-3 protein expression decreased, Bcl-2 protein expression increased.
Conclusion
Exo-genous SO2 has the effect of accelerating AM apoptosis by stimulating mPTP to open and mitochondrial membrane potential to decrease; besides, exogenous SO2 could stimulate AM to secrete more anti-inflammatory cytokines and less inflammatory cytokines. In conclusion, exogenous SO2 can reduce macrophage apoptosis by inhibiting mitochondrial pathways.
Keywords: Sulfur dioxide, Reperfusion injury, Acute lung injury, Macrophages, alveolar
尽管关于肢体缺血再灌注(ischemia/reperfusion,I/R)致急性肺损伤(acute lung injury,ALI)的发病机制迄今尚未完全阐明,但现在较为公认的看法是缺血再灌注刺激使机体的炎症反应细胞处于激活状态,继而出现了失控的全身炎症反应[1],此时,由于凋亡和清除的延迟而导致中性粒细胞(polymorphonuclear neutrophil,PMN)在肺部的大量聚集是肺损伤发生的中心环节[2]。
肺泡巨噬细胞(alveolar macrophage,AM)占肺泡常驻细胞的80%,是肺部发挥免疫防御病原微生物的第一道防线,AM不仅具有自噬和清除其他凋亡细胞的功能,还具有分泌能力,其在ALI的发生和发展中起着非常重要的作用。有研究报道,肺损伤大鼠与正常大鼠相比,在用酵母多糖刺激后AM的凋亡率明显增加,使肺内凋亡的PMN不能被及时清除,导致这些细胞继发性坏死,释放其内容物,从而加重组织的损伤[3,4,5]。因而,采取有效措施,通过调节ALI时AM的异常凋亡,适当延长AM的寿命,清除不需要的处于持续激活状态的PMN,并及时清除凋亡的PMN,缩短PMN寿命,以减少在肺内聚集的PMN数量并防止PMN坏死,这对于控制炎症反应的发展和转归至关重要。
二氧化硫(sulfur dioxide,SO2)是全球性的常见大气污染物,对人体健康危害很大。Meng等[6]报道,SO2及其衍生物亚硫酸盐及亚硫酸氢盐作为系统性有毒物质能够影响哺乳动物的多个器官,健康人体内含硫氨基酸(如L-半胱氨酸)代谢也会产生S 。我们前期研究已证明SO2可通过抗炎、抗氧化、抑制PMN聚集等减轻肢体缺血再灌注所导致的急性肺损伤,而且有多个信号通道参与其中[8,9,10]。那么,SO2是否通过改善AM凋亡从而发挥肺保护作用呢?本研究拟通过以下实验进一步探讨SO2在肺保护作用中对AM凋亡的影响,为控制炎症反应寻找新的靶点,为肢体缺血再灌注致ALI研究探索新的途径,也为SO2的进一步深入开发应用提供科学依据。
1. 材料与方法
1.1. 实验动物
健康雄性Sprague-Dawley(SD)大鼠购于北京维通利华生物技术有限公司,许可证号为SCXK(京)2012-0001,所有大鼠质量检测合格,均为无特定病原体(specific pathogen free,SPF)级,8周龄,体重180~230 g,于饲养笼(北京维通利华实验动物技术有限公司)中饲养,饲料、动物垫料由北京朝阳医院实验研究中心提供。饲养室温度 23.6 ℃,湿度35%,昼夜明暗交替时间为12 h/12 h,大鼠24 h均可自由饮水、进食。所有动物实验均由首都医科大学动物伦理委员会审查通过。
1.2. 实验主要药品与试剂
Na2SO3/NaHSO3(分析纯)购于北京康普汇维科技有限公司,Bradford蛋白测定试剂盒、Actin抗体、Bcl-2抗体、Caspase-3抗体、线粒体膜电位检测试剂盒(JC-1)和Annexin V-FITC细胞凋亡检测试剂盒购于上海碧云天公司,辣根过氧化物酶标记山羊抗兔IgG(H+L)购于南京恩晶生物科技有限公司,β-actin抗体购于美国CST公司,大鼠白细胞介素(interleukin,IL)-1β(IL-1β)、IL-10、IL-6和肿瘤坏死因子α(tumor necrosis factor,TNF-α)ELISA试剂盒购于美国Cusabio公司。
1.3. 动物模型
1.3.1 动物模型制备 按照Cohen等[11]报道的方法复制肢体缺血再灌注致ALI动物模型。术前SD大鼠禁食12 h,自由饮水。应用苯巴比妥钠(40 mg/kg,腹腔注射)进行麻醉,麻醉成功后,分离左侧颈外静脉及右侧颈总动脉插管用来补液(乳酸林格液2 mL/h)、给药及采血。用市售统一规格的橡皮止血带绑扎双后肢根部造成肢体缺血,4 h后松开止血带使肢体血流再灌注2 h,并轻揉大腿根部,以利于快速恢复后肢血流再灌注。应用激光多普勒探测血流以保证肢体的缺血和再灌注。
1.3.2 血清刺激物制备 于拟进行细胞实验的前一天,按照上述方法复制肢体缺血再灌注致ALI动物模型。SD大鼠双后肢缺血4 h、再灌注2 h后,麻醉处死大鼠。留取血样并离心(4 000 r/min,10 min, 0~4 ℃), 取血清存储于4 ℃冰箱作为刺激物,并对大鼠肢体缺血再灌注致ALI动物模型进行验证,相关检验指标详见文献[8]和[10]。
1.4. 实验细胞
1.4.1 AM的分离与培养 取雄性SD大鼠,苯巴比妥钠(40 mg/kg)麻醉后固定于鼠板上。颈部使用酒精常规消毒后,剪开颈部皮肤,分离暴露气管,其下穿线;在气管正中剪一T型切口,使用头皮针行气管插管并固定;将约5 mL生理盐水注入肺脏并轻轻按摩,停留数秒后再缓慢回抽获得支气管肺泡灌洗液,重复灌洗10次;将肺泡灌洗液移入50 mL离心管中,300×g离心5 min沉淀细胞。用含10%(体积分数)胎牛血清的RPMI 1640培养液重悬AM,将AM浓度调至1×106/mL左右后,平均接种于6孔培养皿中。在CO2孵育箱37 ℃培养2 h,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗去非贴壁细胞,换新鲜的含10%胎牛血清的RPMI 1640培养液继续培养24 h,台盼蓝吞噬实验显示95%以上的AM具有活力后再进行其他实验干预。手术器械术前高压灭菌,保证无菌操作。
1.4.2 细胞模型建立 抽取肢体缺血再灌注损伤的SD大鼠静脉血,制作血清刺激物,加入AM的培养基中作为刺激因素(500 μg/L),刺激6 h后可进行各项指标检测(6 h后细胞的损伤最明显)。
1.5. 实验分组
将通过支气管肺泡灌洗方法获得的AM随机分为以下4组:对照组、SO2组、肢体I/R血清刺激组(I/R组)、I/R+SO2组。对照组细胞加入与实验组等体积生理盐水;SO2组给以SO2供体Na2SO3/NaHSO3[(0.54 mmol/kg)/(0.18 mmol/kg)];I/R组细胞给予肢体缺血再灌注大鼠血清(500 μg/L)刺激6 h;I/R+SO2组同时给予肢体缺血再灌注大鼠血清(500 μg/L)和SO2供体Na2SO3/NaHSO3[(0.54 mmol/kg)/(0.18 mmol/kg)]刺激6 h。6 h后进行相关检查。
1.6. 检测指标和方法
1.6.1 流式细胞仪检测线粒体膜电位 使用线粒体膜电位检测试剂盒(JC-1)对线粒体膜电位进行检测,按照公司说明操作步骤如下:(1)实验处理后,PBS洗涤细胞2~3次,加入0.25%(质量分数)胰蛋白酶(含0.02%EDTA)消化收集细胞,取约105个细胞,重悬于0.5 mL细胞培养液中。(2)加入0.5 mL JC-1染色工作液,颠倒数次混匀,细胞培养箱中37 ℃孵育20 min。(3)37 ℃孵育结束后,600×g 4 ℃离心4 min,沉淀细胞,弃上清。(4)用JC-1染色缓冲液(1×)洗涤2次:加入1 mL JC-1染色缓冲液(1×)重悬细胞,600×g 4 ℃离心4 min,沉淀细胞,弃上清;再加入1 mL JC-1染色缓冲液(1×)重悬细胞,操作同前。(5)用JC-1染色缓冲液(1×)重悬后,立即进行流式细胞仪检测,以490 nm为激发波长,530 nm为发射波长,不加JC-l的一管为阴性对照,CCCP(一种线粒体电子传递链抑制剂)为阳性对照。
1.6.2 线粒体通透性转换孔开放情况检测 使用差速离心法分离线粒体,根据Javadov等[12]研究报道的方法,通过线粒体肿胀实验来检测线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)的开放。mPTP开放时,线粒体通透性增大,导致线粒体肿胀,吸光度(absorbance,A)明显下降。使用Bradford法对线粒体蛋白含量进行测定,用酶标仪在540 nm波长处测各组初值吸光度A1,加200 mol/mL CaCl2诱导mPTP开放,每隔1 min测量一次数据变化,15 min后达到平衡,记录此时吸光度A2,ΔA=A1-A2。以ΔA表示mPTP开放程度,此数值越大,mPTP开放程度越大。
1.6.3 Annexin V-FITC和PI双标流式细胞仪法检测AM凋亡情况 正常的活细胞中,磷脂酰丝氨酸(phosphotidylserine,PS)位于细胞膜的内侧,但在早期凋亡的细胞中,PS从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin V是一种相对分子质量为3.5×104~3.6×104的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合,故以带有绿色荧光的荧光探针FITC标记的Annexin V,即Annexin V-FITC,可通过流式细胞仪来检测细胞凋亡。碘化丙啶(propidium iodide,PI)是一种核酸染料,它不能透过具有完整细胞膜的正常细胞或早期凋亡的细胞,但可以透过凋亡晚期和坏死细胞的细胞膜而使细胞核红染。因此,将Annexin V-FITC与PI联合使用时,可以将正常细胞(Annexin V-FITC-/PI-)、早期凋亡细胞(Annexin V-FITC+/PI-)、晚期凋亡细胞和坏死细胞(Annexin V-FITC+/PI+)区分开。实验处理后,用4 ℃预冷的PBS洗涤2~3次,保留洗涤后的PBS;加入0.25%胰蛋白酶(含0.02%EDTA)消化收集细胞,与保留洗涤后的PBS混匀,1 000×g离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取约105个重悬后的细胞,1 000×g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,然后加入5 μL Annexin V-FITC,轻轻混匀,再加入10 μL PI染色液,轻轻混匀。室温(20~25 ℃)下避光孵育20 min,加入300 μL PBS,随即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.6.4 Western blotting方法检测AM中Bcl-2、Caspase-3蛋白表达情况 AM培养在6孔板内,每孔加入200 μL预冷的RIPA裂解液,同时加入蛋白酶抑制剂(50×)和蛋白磷酸酶抑制剂(100×)。裂解的同时使用细胞刮收集细胞,并移至1.5 mL离心管中继续裂解约30 min,整个过程都在冰上操作。然后放置在预冷的离心机中,4 ℃下12 000 r/min离心10 min,取上清液,-80 ℃冰箱保存备用。上清液依次进行蛋白定量(Bradford法)、聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭之后,采用兔抗大鼠Ⅰ抗(1 ∶5 000)孵育,4 ℃过夜。洗膜3次,每次10 min,采用5%(体积分数)牛血清白蛋白(bovine serum albumin,BSA)封闭液稀释的山羊抗兔IgG Ⅱ抗(1 ∶3 000)抗体孵育2 h。孵育结束后,再洗膜3次,每次10 min。随后进行化学发光、显影定影和图像分析。
1.7. 统计学方法
所有数据均以均数±标准差表示,应用SPSS 17.0统计软件进行分析。组间比较采用单因素方差分析(方差齐者应用LSD或S-N-K法,方差不齐者应用Dunnett’s T3或Dunnett’s C法),以P<0.05 为差异有统计学意义。
2. 结果
2.1. 线粒体膜电位水平
JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针。当线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,可以产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1以单体形式存在,可以产生绿色荧光。因此,通过荧光颜色的转变可以反映线粒体膜电位的变化。本实验即以红、绿荧光的相对比值来衡量线粒体去极化的比例。实验发现,与对照组相比,I/R组红、绿荧光的比值明显下降(P<0.01);而与I/R组比较,I/R+SO2组红、绿荧光的比值明显升高(P<0.05),说明外源性SO2促进了线粒体膜电位升高(表1)。
1.
SO2对AM线粒体膜电位及mPTP开放情况的影响(n=8)
Effect of exogenous SO2 on mitochondrial membrane potential and mPTP opening of AM (n=8)
| Group | Ratio (Red/Green) | Absorbance |
| I/R, ischemia/reperfusion. All the data are expressed as x±s. *P<0.01 vs. control group; #P<0.05 vs. I/R group. | ||
| Control | 4.94±0.26 | 0.45±0.03 |
| SO2 | 5.00±0.29 | 0.44±0.02 |
| I/R | 1.75±0.24* | 0.24±0.02* |
| I/R+SO2 | 2.12±0.15# | 0.27±0.03# |
2.2. mPTP开放情况
mPTP的开放可以增加线粒体膜对分子的渗透性,引起线粒体肿胀,此时吸光度明显下降。与对照组相比,I/R组线粒体吸光度显著降低(P<0.01);与I/R组相比,I/R+SO2组线粒体吸光度明显增高(P<0.05),说明外源性SO2抑制了mPTP的开放(表1)。
2.3. AM凋亡情况
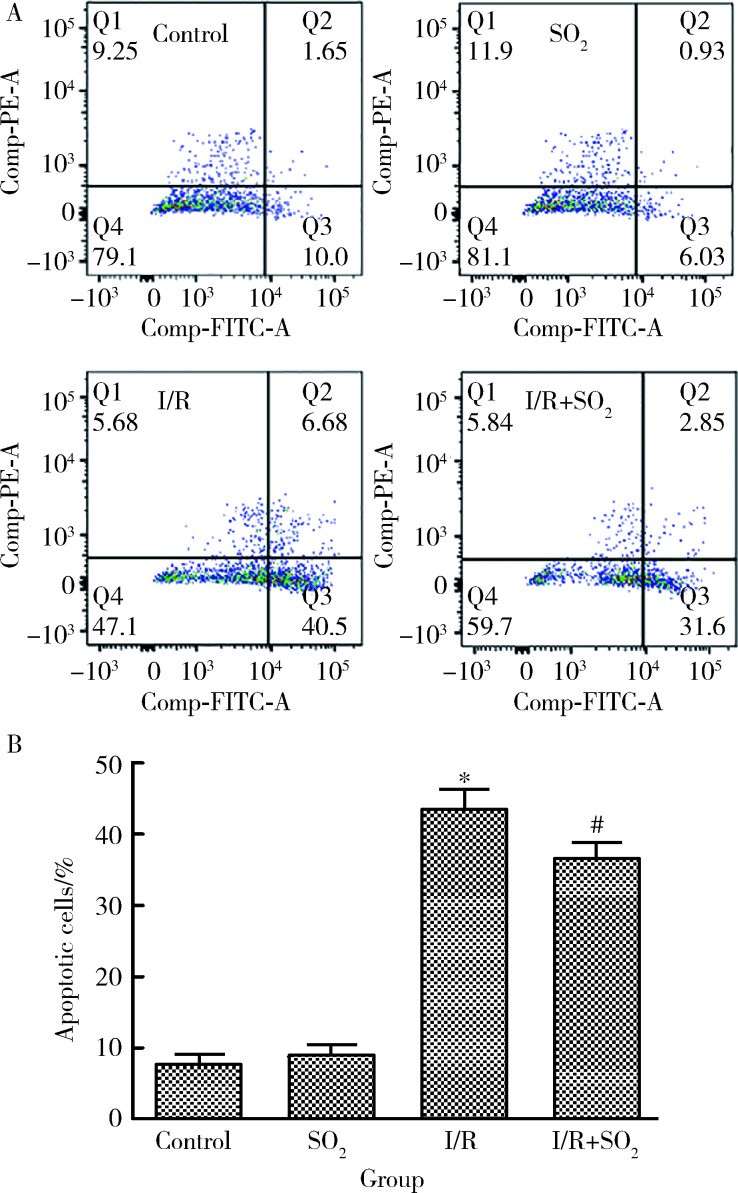
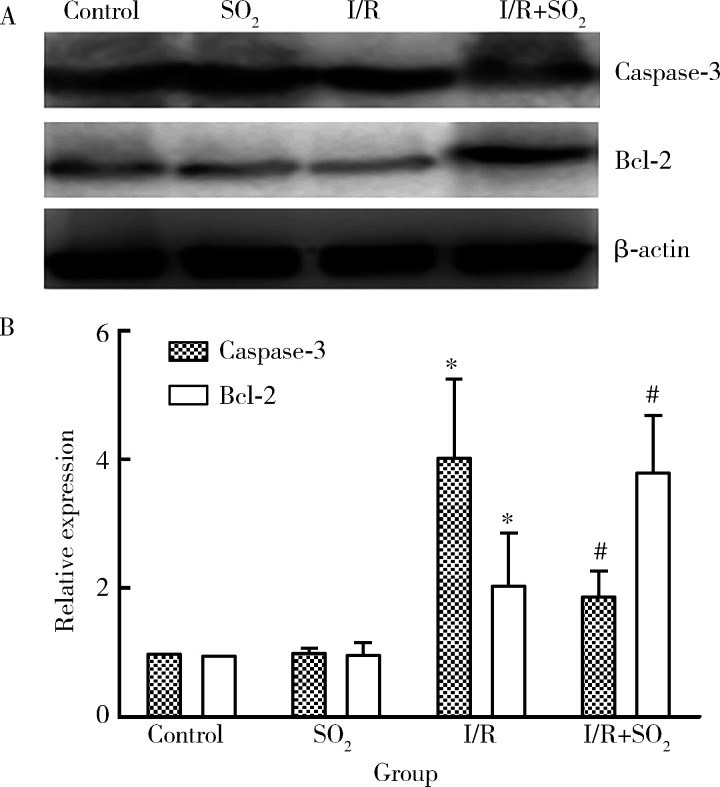
通过Annexin V-FITC和PI双标流式细胞仪法检测,我们发现对照组中可见少量凋亡细胞,凋亡指数为7.94%±1.17%。与对照组相比,I/R组凋亡细胞明显升高,凋亡指数为43.81%±2.40%(P<0.01);与I/R组相比,I/R+SO2组凋亡细胞明显减少,凋亡指数为37.01%±1.93%(P<0.05)(图1)。通过Western blotting方法检测AM中Bcl-2、Caspase-3蛋白表达情况,我们发现与对照组相比,I/R组Caspase-3蛋白表达显著升高,Bcl-2蛋白表达显著下降(P<0.01);与I/R组相比,I/R+SO2组Caspase-3蛋白表达明显降低,Bcl-2蛋白表达明显升高(P<0.05,图2)。
1.
Annexin V-FITC和PI双标流式细胞仪法检测AM凋亡情况
Detection of AM apoptosis by Annexin V-FITC and PI double-label flow cytometry
A, representative flow cytometric dot plots. X-axis, Annexin-V staining; Y-axis, PI staining. Q1, detection error within the permitted range; Q2, late apoptotic cells and necrotic cells; Q3, early apoptotic cells; Q4, normal living cells (The apoptotic cells are Q2+Q3). B, quantitation of apoptotic cells population as shown in figure A. All the results are expressed as x±s (n=8). *P<0.01 vs. control group; #P<0.05 vs. I/R group.
2.
AM中Bcl-2、Caspase-3蛋白表达情况
The expression of Bcl-2 and Caspase-3 proteins of AM in different groups
A, representative bands of Western blots; B, bar graphs show the relative expression of Bcl-2 and Caspase-3 proteins of AM in different groups. All the results are expressed as x±s (n=3). *P<0.01 vs. control group; #P<0.05 vs. I/R group.
3. 讨论
缺血再灌注是临床实践中的重要病理生理过程,由Jennings在1960年首次描述[13]。它参与多种病理过程,不仅有可能加重局部缺血组织的损伤,严重时还会引起全身炎症反应综合征,甚至远隔的多脏器功能障碍,其中肺是最易受累的器官,其特征在于ALI,具有较高的发病率和死亡率[14]。
AM是白细胞的一种,可吞噬和消化细胞碎片、微生物、癌细胞以及其他所有无法与健康细胞结合的蛋白质[15],它们几乎存在于机体所有的组织中[16]。AM约占肺泡常驻细胞的80%,是人体抵御病原体的第一道防线,其在ALI中发挥了非常重要的作用。
SO2虽然是全球性的常见大气污染物,但可由哺乳动物细胞内含硫氨基酸在谷氨酸-草酰乙酸转氨酶(glutamate-oxaloacetate transaminase,GOT)作用下代谢转化产生。我们已经发现,SO2通过抗炎、抗氧化、抑制PMN聚集等对肢体缺血再灌注致ALI起到保护作用[9],此外,我们还发现JAK2/STAT3、PI3K/Akt和p38MAPK信号通路都参与了SO2对肢体缺血再灌注致ALI起保护作用的过程[10]。
但目前尚未见外源性SO2和AM凋亡之间关系的报道,本研究使用SO2供体(Na2SO3/NaHSO3)和由肢体缺血再灌注导致ALI的大鼠血清,刺激通过支气管肺泡灌洗获得的AM,然后检测其凋亡情况,并对Bcl-2、Caspase-3基因表达情况进行检测。结果显示,与对照组相比,I/R组的AM凋亡率增加到43.81%±2.40%;当应用外源性SO2后,AM凋亡率明显减少37.01%±1.93%。Western blotting结果显示,当应用外源性SO2后,抗凋亡基因Bcl-2表达显著增高,而Caspase-3基因表达显著降低,说明外源性SO2通过调控Bcl-2、Caspase-3基因表达抑制了AM的凋亡。
细胞凋亡是发生在多细胞生物体中的程序性细胞死亡过程,是通过细胞因子诱导刺激细胞表面分子,并将信号传递至细胞内,通过激活其自身的内部基因表达形成信号级联反应,诱导细胞死亡的过程。线粒体是细胞生命活动的控制中心,它不仅是细胞呼吸链和氧化磷酸化的中心,而且也是细胞凋亡调控中心。线粒体膜通透性的改变、跨膜电位的降低、细胞色素C的释放等均可导致Caspase级联反应,然后导致细胞凋亡[17]。凋亡早期阶段的显著特征是线粒体活性的破坏,包括线粒体膜电位的改变和线粒体氧化还原电位的改变。膜电位的变化是由于mPTP的打开引起离子及小分子通过造成的,我们发现当应用外源性SO2后,促进了线粒体膜电位的升高,抑制了mPTP的开放。因此,我们推测,外源性SO2通过促进线粒体膜电位升高以及抑制mPTP的开放,减少线粒体损伤,进而抑制AM的凋亡。
迄今为止,关于缺血再灌注致ALI的发病机制仍未完全阐明,但现在较为公认的看法是缺血再灌注刺激使机体的炎症反应细胞处于激活状态,继而出现了失控的全身炎症反应。此时由于PMN凋亡和清除延迟而导致的PMN在肺部大量聚集是肺损伤发生的中心环节[1,2]。AM有自噬和清除其他凋亡细胞的功能,有研究报道,肺损伤大鼠与正常大鼠相比,在用酵母多糖刺激后AM的凋亡率明显增加,使肺内凋亡的PMN不能被及时清除,导致这些细胞继发性坏死,释放其内容物,从而加重组织的损伤[3,4,5]。我们之前的研究发现,SO2通过抑制PMN聚集,对肢体缺血再灌注致ALI起保护作用[9],但其机制不明。通过本课题的研究,我们推测其机制是外源性SO2抑制了AM的凋亡,延长了AM的寿命,进而加速清除了凋亡的PMN,缩短了PMN的寿命,减少了PMN在肺内的聚集。
总之,外源性SO2可通过抑制线粒体途径改善AM的凋亡。
(本文编辑:赵 波)
Funding Statement
国家自然科学基金(81070050); 北京市自然科学基金(7152061)
the National Natural Science Foundation of China(81070050); Beijing Natural Science Foundation(7152061)
References
- 1.Steiger AK, Yang Y, Royzen M, et al. Bio-orthogonal “click-and-release” donation of caged carbonyl sulfide (COS) and hydrogen sulfide (H2S) Chem Commun (Camb) 2017;53(8):1378–1380. doi: 10.1039/c6cc09547j. [DOI] [PubMed] [Google Scholar]
- 2.Steiger AK, Pardue S, Kevil CG, et al. Self-immolative thiocarbamates provide access to triggered H2S donors and analyte replacement fluorescent probes. J Am Chem Soc. 2016;138(23):7256–7259. doi: 10.1021/jacs.6b03780. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Aggarwal NR, D’Alessio FR, Tsushima K, et al. Moderate oxygen augments lipopolysaccharide-induced lung injury in mice. Am J Physiol Lung Cell Mol Physiol. 2010;298(3):L371–L381. doi: 10.1152/ajplung.00308.2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Howard KM. Differential expression of platelet-activating factor acetylhydrolase in lung macrophages. Am J Physiol Lung Cell Mol Physiol. 2009;297(6):L1141–L1150. doi: 10.1152/ajplung.00022.2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Z’Graggen BR, Tornic J, Muller-Edenborn B, et al. Acute lung injury: apoptosis in effector and target cells of the upper and lower airway compartment. Clin Exp Immunol. 2010;161(2):324–331. doi: 10.1111/j.1365-2249.2010.04175.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Meng Z, Liu Y. Cell morphological ultrastructural changes in va-rious organs from mice exposed by inhalation to sulfur dioxide. Inhal Toxicol. 2007;19(6-7):543–551. doi: 10.1080/08958370701271373. [DOI] [PubMed] [Google Scholar]
- 7.Ubuka T, Yuasa S, Ohta J, et al. Formation of sulfate from L-cysteine in rat liver mitochondria. Acta Med Okayama. 1990;44(2):55–64. doi: 10.18926/AMO/30442. [DOI] [PubMed] [Google Scholar]
- 8.赵 彦瑞, 刘 洋, 王 东, et al. PI3KAkt和JAK2STAT3信号转导通路在SO2抗大鼠肢体缺血再灌注致急性肺损伤中的作用. 中华病理生理杂志. 2015;31(11):2076–2082. [Google Scholar]
- 9.Huang XL, Liu Y, Zhou JL, et al. Role of sulfur dioxide in acute lung injury following limb ischemia/reperfusion in rats. J Biochem Mol Toxicol. 2013;27(8):389–397. doi: 10.1002/jbt.21492. [DOI] [PubMed] [Google Scholar]
- 10.Zhao YR, Wang D, Liu Y, et al. The PI3K/Akt, p38MAPK, and JAK2/STAT3 signaling pathways mediate the protection of SO2 against acute lung injury induced by limb ischemia/reperfusion in rats. J Physiol Sci. 2016;66(3):229–239. doi: 10.1007/s12576-015-0418-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Cohen SM, Siddiqi FA, Darakchiev B, et al. Attenuation of acute lung injury caused by hind-limb ischemia-reperfusion injury by butyrolactone anti-inflammatory agent FLl003. J Trauma. 1997;43(2):247–252. doi: 10.1097/00005373-199708000-00007. [DOI] [PubMed] [Google Scholar]
- 12.Javadov S, Choi A, Rajapurohitam V, et al. NHE-1 inhibition-induced cardioprotection against ischaemia/reperfusion is associa-ted with attenuation of the mitochondrial permeability transition. Cardiovasc Res. 2008;77(2):416–424. doi: 10.1093/cvr/cvm039. [DOI] [PubMed] [Google Scholar]
- 13.Kaltenbach JP, Jennings RB. Metabolism of ischemic cardiac muscle. Circ Res. 1960;(8):207–213. doi: 10.1161/01.res.8.1.207. [DOI] [PubMed] [Google Scholar]
- 14.Ward PA. Editorial commentary: New strategies for treatment of humans with acute lung injury/acute respiratory distress syndrome. Clin Infect Dis. 2015;60(4):596–597. doi: 10.1093/cid/ciu892. [DOI] [PubMed] [Google Scholar]
- 15.Tauber AI. Metchnikoff and the phagocytosis theory. Nat Rev Mol Cell Biol. 2003;4(11):897–901. doi: 10.1038/nrm1244. [DOI] [PubMed] [Google Scholar]
- 16.Ovchinnikov. Dmitry A. Macrophages in the embryo and beyond: Much more than just giant phagocytes. Genesis. 2008;46(9):447–462. doi: 10.1002/dvg.20417. [DOI] [PubMed] [Google Scholar]
- 17.Yong Y, Matthew S, Wittwer J, et al. Dichamanetin inhibits cancer cell growth by affecting ROS-related signaling components through mitochondrial-mediated apoptosis. Anticancer Res. 2013;33(12):5349–5355. [PMC free article] [PubMed] [Google Scholar]