Abstract
目的
观察二氢叶酸还原酶基因(dhfr)过表达对乙醇致斑马鱼胚胎心脏和血管发育异常的作用,并初步探讨其机制。
方法
体外转录dhfr mRNA并将其显微注射入斑马鱼受精卵内使dhfr基因过表达,并进行过表达的效率验证。将野生型斑马鱼分为正常对照组、乙醇处理组(400 mmol/L乙醇溶液)、乙醇+dhfr mRNA组(显微注射6 nL dhfr mRNA),观察各组胚胎的整体发育情况。按照上述分组,利用红色荧光蛋白标记心脏的转基因斑马鱼系Tg(cmlc2:mcherry)观察胚胎心房和心室的发育状况;利用荧光显微造影观察野生型斑马鱼胚胎心脏流出道及血管发育情况;通过心率和心室收缩指数评估心功能情况。构建基因探针并通过胚胎整体原位杂交及Real-time PCR法,检测胚胎nkx2.5、tbx1、flk-1的基因表达情况。
结果
与乙醇处理组相比,乙醇+dhfr mRNA组斑马鱼胚胎发育异常百分率明显下降,存活百分率显著上升(P < 0.05);心房、心室、心脏流出道和血管发育的异常表型及心功能情况明显改善。乙醇处理组nkx2.5、tbx1、flk-1 mRNA的表达较对照组下降(P < 0.05);乙醇+dhfr mRNA组nkx2.5、tbx1、flk-1 mRNA的表达较乙醇处理组上调,但仍未达到正常对照组水平(P < 0.05)。
结论
dhfr基因过表达可部分挽救乙醇所致胚胎心脏和血管发育异常,其机制可能与dhfr基因过表达后上调乙醇导致的nkx2.5、tbx1、flk-1水平降低有关。
Keywords: dhfr基因, 乙醇, 心脏, 血管, nkx2.5, tbx1, flk-1, 斑马鱼
Abstract
Objective
To study the effect of dhfr gene overexpression on ethanol-induced abnormal cardiac and vascular development in zebrafish embryos and underlying mechanisms.
Methods
dhfr mRNA was transcribed in vitro and microinjected into zebrafish fertilized eggs to induce the overexpression of dhfr gene, and the efficiency of overexpression was verified. Wild-type zebrafish were divided into a control group, an ethanol group, and an ethanol+dhfr overexpression group (microinjection of 6 nL dhfr mRNA). The embryonic development was observed for each group. The transgenic zebrafish Tg (cmlc2:mcherry) with heart-specific red fluorescence was used to observe atrial and ventricular development. Fluorescence microscopy was performed to observe the development of cardiac outflow tract and blood vessels. Heart rate and ventricular shortening fraction were used to assess cardiac function. Gene probes were constructed, and embryo in situ hybridization and real-time PCR were used to measure the expression of nkx2.5, tbx1, and flk-1 in the embryo.
Results
Compared with the ethanol group, the ethanol+dhfr overexpression group had a significant reduction in the percentage of abnormal embryonic development and a significant increase in the percentage of embryonic survival (P < 0.05), with significant improvements in the abnormalities of the atrium, ventricle, outflow tract, and blood vessels and cardiac function. Compared with the control group, the ethanol group had significant reductions in the expression of nkx2.5, tbx1, and flk-1 (P < 0.05), and compared with the ethanol group, the ethanol+dhfr overexpression group had significant increases in the expression of nkx2.5, tbx1, and flk-1 (P < 0.05), which were still lower than their expression in the control group.
Conclusions
The overexpression of the dhfr gene can partially improve the abnormal development of embryonic heart and blood vessels induced by ethanol, possibly by upregulating the decreased expression of nkx2.5, tbx1, and flk-1 caused by ethanol.
Keywords: dhfr gene, Ethanol, Heart, Vessel, nkx2.5, tbx1, flk-1, Zebrafish
先天性心脏病是胚胎时期心血管系统发育异常所导致的先天性疾病,严重危害儿童生命和健康,其发病率在活产婴儿中约为6‰~8‰。先天性心脏病环境致病因素中的乙醇摄入不容忽视。妇女妊娠期间摄入乙醇过量对胚胎发育有严重影响,可导致胎儿酒精综合征,心血管系统发育异常在胎儿酒精综合征患儿中发生率较高[1]。目前如何挽救妊娠期孕母乙醇摄入所致胚胎发育异常逐渐成为研究热点。
叶酸是一种十分重要的维生素,其可通过转运一碳单位而对嘌呤、嘧啶、核酸、蛋白质的合成及细胞的分裂和生长有重要作用。有研究表明,予以外源性叶酸可以拮抗乙醇对胚胎的致畸作用[2]。在叶酸进入人体内发挥生物学活性作用的通路中,二氢叶酸还原酶(dhfr)对于叶酸发挥生物学作用尤其重要。二氢叶酸还原酶基因(dhfr)功能下调或功能拮抗可致叶酸的生物学活性发挥受到抑制,从而导致胚胎发育异常[3-4],而dhfr基因功能增强可能使体内叶酸利用度增加。目前围绕dhfr基因功能增强后,是否可挽救乙醇所致胚胎心血管发育异常的相关研究甚少。
本研究利用模式生物斑马鱼,观察dhfr基因过表达后对乙醇所致胚胎心脏及血管发育异常的挽救作用,并通过检测心血管发育密切相关因子nkx2.5、tbx1、flk-1的表达水平进行初步挽救机理探讨,期望为由于母亲孕期乙醇摄入过量而导致胎儿先天性心脏病的有效防治提供线索。
1. 材料与方法
1.1. 实验动物
养殖系统从美国Aquatic Habitats公司引进,野生型斑马鱼购自美国Oregon大学。斑马鱼为体外受精,将雌鱼和雄鱼按照1 : 1的比例在交配前置于同一缸中,缸中间有隔板使雌鱼和雄鱼相隔,次日清晨取出隔板后雌鱼与雄鱼交配,收集受精卵进行实验。野生型斑马鱼及红色荧光蛋白标记心脏的Tg(cmlc2:mcherry)斑马鱼的受精卵置于28℃孵化液(60 μg/mL海盐)中孵化,待长出绒毛膜后在胚胎培养液内培育,每天更换胚胎培养液。用于原位杂交的胚胎受精后24 h(24 hours post fertilization, 24 hpf)用0.003%苯硫脲(PTU)处理以防止黑色素的形成。斑马鱼受精卵按照Kimmel等[5]描述对发育阶段分期。实验在野生型斑马鱼及Tg(cmlc2:mcherry)斑马鱼中进行,Tg(cmlc2:mcherry)斑马鱼仅用于进行心房和心室的发育异常表型观察。
1.2. dhfr-GFP mRNA及dhfr mRNA的合成
抽提48 hpf野生型斑马鱼胚胎的总mRNA,经逆转录获得全长cDNA。经PCR扩增dhfr全长cDNA,将扩增的dhfr cDNA及pT7Ts-GFP载体经双酶切后连接,获得含有dhfr全长cDNA的重组pT7Ts-dhfr-GFP质粒;将扩增的dhfr cDNA及pT7Ts载体经双酶切后连接,获得含有dhfr全长cDNA的重组pT7Ts-dhfr质粒;应用美国Ambion公司的mMESSAGE mMACHINE T7试剂盒从重组质粒中体外转录dhfr-GFP mRNA及dhfr mRNA,将它们定量后溶于30%的Danieau溶液中,皆为40 μg/mL,置于-70℃备用。
1.3. 实验分组
(1)将野生型斑马鱼分为正常对照组、溶剂对照组(显微注射6 nL Danieau溶液)、dhfr-GFP mRNA组(显微注射6 nL dhfr-GFP mRNA),进行dhfr过表达的效率验证,并明确显微注射Danieau溶液是否会影响胚胎发育。每组20枚胚胎,实验重复3次。
(2)将野生型斑马鱼分为正常对照组、乙醇处理组、乙醇+ dhfr mRNA组(显微注射6 nL dhfr mRNA),观察dhfr过表达后对乙醇致畸的效应。每组20枚胚胎,实验重复3次。
(3)将Tg(cmlc2:mcherry)斑马鱼分为正常对照组、乙醇处理组、乙醇+ dhfr mRNA组(显微注射6 nL dhfr mRNA),以进行dhfr过表达后对乙醇致心房和心室发育异常的表型观察。每组20枚胚胎,实验重复3次。
1.4. 显微注射
进行显微注射时,在显微镜下挑选发育至1~2个细胞周期(0.5 hpf左右)的斑马鱼受精卵,并将显微注射针刺入斑马鱼受精卵内,利用显微注射仪进行显微注射。显微注射物及容积详见实验分组。显微注射针为1 mm玻璃毛细管经显微注射拉针器拉制而成。
1.5. 乙醇处理
将乙醇溶解于胚胎培养液内(400 mmol/L),在胚胎发育至6 hpf时,将胚胎移入乙醇溶液中;胚胎发育至12 hpf时,将胚胎从乙醇溶液中移入正常胚胎培养液内。为防止由于乙醇挥发而导致乙醇浓度降低,胚胎置于有盖培养皿中进行乙醇处理[6]。
1.6. 胚胎整体发育情况的观察
在显微镜下观察野生型斑马鱼各组胚胎整体发育情况,记录正常对照组、乙醇处理组、乙醇+ dhfr mRNA组胚胎发育异常个体百分率及存活个体百分率。死亡个体也列入发育异常个体计数中。设每组100枚胚胎,实验独立重复3次。
1.7. 心脏及血管发育情况的观察
在Tg(cmlc2:mcherry)斑马鱼胚胎发育至48 hpf时,在红色荧光显微镜下观察各组斑马鱼胚胎(正常对照组、乙醇处理组、乙醇+ dhfr mRNA组)的心房和心室发育形态,设每组20枚胚胎,实验独立重复3次。
在观察胚胎心脏流出道及血管的发育时,在野生型斑马鱼各组胚胎(正常对照组、乙醇处理组、乙醇+ dhfr mRNA组)发育至60 hpf时向各组胚胎心脏内注射3 nL绿色荧光素,在荧光显微镜下观察胚胎心脏流出道及血管的发育情况。设每组20枚胚胎,实验独立重复3次。
分别在胚胎发育至48 hpf和60 hpf时,光学显微镜下统计和计算野生型斑马鱼各组胚胎(正常对照组、乙醇处理组、乙醇+ dhfr mRNA组)的心率及心室收缩指数(ventricular shortening fraction, VSF)以评估心脏功能[4]。心率为在显微镜下记录胚胎每分钟的心跳次数。计算VSF时,在显微镜下进行胚胎心脏录像,根据录像测量胚胎心室舒张期内径和收缩期内径,VSF=(心室舒张期内径-心室收缩期内径)/心室舒张期内径。设每组20枚胚胎,实验独立重复3次。
1.8. 基因探针制备及胚胎整体原位杂交
分别抽提斑马鱼胚胎发育至24、48、60 hpf时的总RNA,经逆转录获得cDNA。采用Primer 3软件设计引物,以逆转录获得的cDNA为模板进行PCR扩增特异性基因序列作为原位杂交的探针片段。将PCR产物切胶回收,克隆入PGEM-T载体中,经测序验证后,获得含有nkx2.5 cDNA片段、tbx1 cDNA片段、flk-1 cDNA片段的质粒,利用内切酶将其线性化后,体外转录反义RNA探针(地高辛标记)。采用构建的反义RNA探针进行胚胎整体原位杂交,检测基因表达情况。
1.9. Real-time PCR
采用Primer 3软件设计用于Real-time PCR实验的引物,由Sangon生物公司合成。nkx2.5引物:F:5'-CTTCTCTCAGGCGCAGGT-3',R:5'-GGATGCTGGACATGCTCGACGGA-3'。tbx1引物:F:5'-GAGACTGTGATCCCGAGGAC-3',R:5'-TCATGATTTGTAGCGAGCCT-3'。flk-1引物:F:5'-CAATGGCAGGATTCACTTTGAG-3',R:5'-TTC-ATAAGGAGCGGATCAATCGTACTCACC-3'。抽提斑马鱼24 hpf、48 hpf及60 hpf的总mRNA,逆转录为cDNA,然后以此cDNA为模板进行Real-time PCR实验,以β-actin为内参对照。实验结果采用ABI 7000荧光定量PCR仪提供的分析软件进行分析。实验独立重复3次。
1.10. 统计学分析
应用SPSS 11.5统计软件对所有数据进行统计学分析。计量资料以均数±标准差(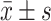 )表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2. 结果
2.1. dhfr过表达的效率验证
在12 hpf时荧光显微镜下观察结果显示,正常及溶剂对照组均未被观察到有GFP绿色荧光表达,dhfr-GFP mRNA组胚胎有较强GFP绿色荧光表达。证实本实验中酶切、连接及体外转录的有效性,说明在同样实验条件下体外可成功转录dhfr mRNA;与正常对照组相比,溶剂对照组胚胎发育正常,说明显微注射Danieau溶液对胚胎发育无干扰作用。见图 1。
1.
12 hpf时dhfr过表达的效率验证(×10)
在荧光显微镜下观察结果显示正常及溶剂对照组胚胎无GFP绿色荧光表达,dhfr-GFP mRNA组胚胎有较强GFP绿色荧光表达。各组胚胎发育正常。

2.2. 各组胚胎发育异常百分率及存活百分率统计分析
胚胎发育至72 hpf时,正常对照组无发育异常个体;与乙醇处理组相比(96.0%±3.5%),乙醇+ dhfr mRNA组发育异常胚胎百分率(48.0%±4.0%)显著下降(t=15.72,P < 0.001)。胚胎发育至受精后第5天(5 days post fertilization, 5 dpf)时,正常对照组全部存活;与乙醇处理组相比(69.0%±2.1%),乙醇+ dhfr mRNA组存活胚胎百分率(84.0%±3.6%)显著上升(t=-6.10,P=0.004)。
2.3. 各组胚胎发育表型观察
光学显微镜下观察显示与正常对照组(图 2A)相比,乙醇处理组胚胎整体发育明显畸形,表现为身体短小、头颅及躯干发育不良、心前区水肿(图 2E)。乙醇+ dhfr mRNA组胚胎整体发育异常情况明显改善(图 2I)。
2.
各组胚胎发育表型观察
A、E、I:光学显微镜下观察48 hpf各组胚胎整体发育情况(×20);B、F、J:利用转基因斑马鱼系Tg(cmlc2:mcherry),在荧光显微镜下观察48 hpf各组胚胎心脏的心房和心室发育情况(v代表心室,a代表心房)(红色荧光,×80);C、G、K:利用荧光显微造影显示60 hpf各组胚胎心脏流出道发育情况(箭头所示为心脏流出道位置)(绿色荧光,×70);D、H、L:利用荧光显微造影显示60 hpf各组胚胎血管发育情况(绿色荧光,×30)。与正常对照组相比,乙醇处理组胚胎整体发育明显畸形;心脏的心房、心室扩大,心房、心室相对位置改变;心脏流出道及血管发育明显畸形,显影不佳。与乙醇处理组相比,乙醇+ dhfr mRNA组胚胎整体发育情况及心房、心室形态明显改善,心脏流出道及血管发育状况好转,显影较清晰。
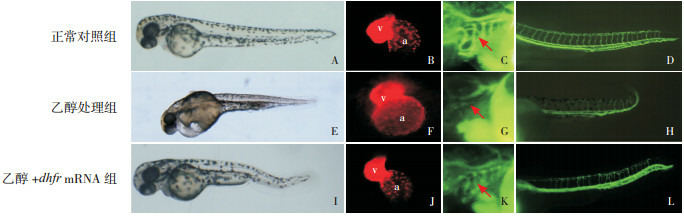
利用心脏被红色荧光蛋白标记的转基因斑马鱼系Tg(cmlc2:mcherry),在红色荧光显微镜下,观察胚胎心房和心室形态。结果显示与正常对照组(图 2B)相比,乙醇处理组胚胎心脏的心房和心室扩大,心房、心室相对位置改变(图 2F);与乙醇处理组相比,乙醇+ dhfr mRNA组胚胎的心房和心室形态及其空间相对位置趋于正常(图 2J)。
通过绿色荧光显微造影,在绿色荧光显微镜下进行观察发现,与正常对照组相比(图 2C、D),乙醇处理组胚胎心脏流出道及血管发育明显畸形,显影不佳(图 2G、H);与乙醇处理组相比,乙醇+ dhfr mRNA组胚胎的心脏流出道和血管发育情况明显改善,有较清晰显影(图 2K、L)。
2.4. 各组胚胎心率和VSF的变化
与正常对照组相比,乙醇处理组胚胎在48 hpf及60 hpf的心率和VSF均显著降低(P < 0.05)。乙醇+ dhfr mRNA组与乙醇处理组相比,在48 hpf及60 hpf的心率和VSF均明显增加(P < 0.05);但仍均低于正常对照组(P < 0.05)。提示dhfr过表达明显改善乙醇干预的斑马鱼胚胎心脏功能状况,但未完全恢复正常。见表 1。
1.
各组心率和VSF的比较(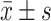 )
)
| 组别 | n | 心率 | VSF | |||
| 48 hpf | 60 hpf | 48 hpf | 60 hpf | |||
| 注:[VSF]心室收缩指数。a示与正常对照组比较,P < 0.05;b示与乙醇处理组比较,P < 0.05。 | ||||||
| 正常对照 | 20 | 166±5 | 205±10 | 25.4±2.8 | 23.6±3.0 | |
| 乙醇处理 | 20 | 102±6a | 132±6a | 14.7±2.0a | 13.6±1.2a | |
| 乙醇+dhfr mRNA | 20 | 128±7a, b | 161±5a, b | 19.7±2.2a, b | 16.6±1.0a, b | |
| F值 | 535.867 | 475.531 | 33.910 | 142.139 | ||
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | ||
2.5. 各组胚胎nkx2.5、tbx1、flk-1 mRNA的表达检测
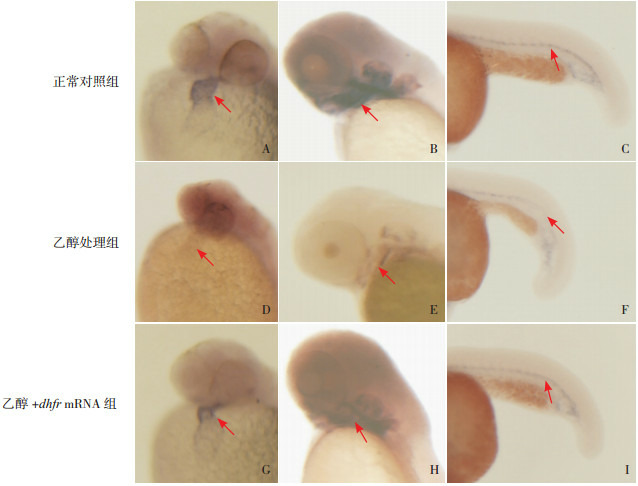
在正常对照组中,48 hpf时nkx2.5在心房和心室,60 hpf时tbx1在心脏流出道,24 hpf时flk-1在血管皆有较强表达(图 3A~C)。与正常对照组相比,乙醇处理组胚胎nkx2.5、tbx1、flk-1的表达下调(图 3D~F);与乙醇处理组相比,乙醇+ dhfr mRNA组胚胎nkx2.5、tbx1、flk-1的表达上调(图 3G~I)。
3.
胚胎整体原位杂交法检测基因表达情况(×60)
A、D、G:nkx2.5在48 hpf各组胚胎心脏的表达情况(箭头所示)。B、E、H:tbx1在60 hpf各组胚胎心脏流出道的表达情况(箭头所示)。C、F、I:flk-1在24 hpf各组胚胎血管的表达情况(箭头所示)。与正常对照组相比,乙醇处理组胚胎nkx2.5、tbx1、flk-1的表达下调;与乙醇处理组相比,乙醇+dhfr mRNA组胚胎nkx2.5、tbx1、flk-1的表达上调。
Real-time PCR结果同样显示,与正常对照组相比,乙醇处理组胚胎nkx2.5、tbx1、flk-1 mRNA的整体相对表达水平下降(P < 0.05)。乙醇+ dhfr mRNA组与乙醇处理组相比,胚胎nkx2.5、tbx1、flk-1 mRNA的整体相对表达水平增加(P < 0.05);但仍低于正常对照组(P < 0.05)。提示dhfr过表达对乙醇干预后上述基因的表达下调情况明显改善,但未完全恢复正常。见表 2。
2.
各组nkx2.5、tbx1、flk-1 mRNA的比较(n=3,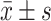 )
)
| 组别 |
nkx2.5 mRNA (48 hpf) |
tbx1 mRNA (60 hpf) |
flk-1 mRNA (24 hpf) |
| 注:a示与对照组比较,P < 0.05;b示与乙醇处理组比较,P < 0.05。 | |||
| 正常对照 | 0.513±0.062 | 0.960±0.053 | 1.063±0.080 |
| 乙醇处理 | 0.203±0.038a | 0.467±0.020a | 0.806±0.047a |
| 乙醇+dhfr mRNA | 0.310±0.026a, b | 0.740±0.043a, b | 0.953±0.035a, b |
| F值 | 37.619 | 107.090 | 15.074 |
| P值 | < 0.001 | < 0.001 | < 0.001 |
3. 讨论
在先天性心脏病较为常见的环境致病因素中,母亲乙醇摄入是导致胎儿心脏发育异常的常见因素。在先天性心脏病的防治策略中,围绕如何对这些导致先天性心脏病发生的常见环境高危因素进行防治研究至关重要。有研究表明,乙醇暴露可导致胚胎发育异常[7-8]。孕期乙醇暴露可影响叶酸代谢,包括减少母体到胎儿的叶酸转移、减少叶酸代谢酶的表达及抑制叶酸代谢酶的活性等,从而导致胚胎发育异常[9]。因此我们提出,是否叶酸代谢通路中的关键酶功能增强后,可挽救乙醇所致胚胎发育异常。叶酸在人体内及其他生物体内发挥生物学活性作用时,首先在叶酸还原酶作用下生成二氢叶酸(DHF),继而DHF在dhfr作用下,由NADPH传递H+生成四氢叶酸(THF),THF是叶酸发挥生物学作用的主要活性物质。THF做为一碳单位的载体转运一碳单位参与体内许多重要的反应。因此,dhfr在叶酸生物学活性发挥的通路中具有至关重要的作用,dhfr基因阻抑可导致胚胎叶酸利用度下降及胚胎发育异常[10-12],而其过表达功能增强后,叶酸在体内的利用度将提高,生物学活性增强。本研究在斑马鱼中开展dhfr基因过表达后对乙醇所致胚胎发育异常的挽救研究,并初步探讨其机制。
斑马鱼与人类基因同源性较高,且其具有繁殖量大、发育周期短、体外受精、受精卵易于获得并透明、进行显微注射操作简单、便于开展基因功能研究等优点,目前已被广泛应用于发育生物学研究。器官特异性荧光的转基因斑马鱼系有助于在荧光显微镜下观察器官发育情况。本研究中应用的Tg(cmlc2:mcherry)斑马鱼的心肌细胞被红色荧光蛋白标记,借助此斑马鱼可对心脏的心房和心室形态发育情况进行清晰的观察。利用pT7Ts载体体外转录目的基因mRNA后将其显微注射入斑马鱼受精卵内,而使目的基因过表达的方法被广泛应用于基因功能研究中[13]。本实验利用pT7Ts-GFP载体体外转录dhfr-GFP mRNA,并将其显微注射入斑马鱼胚胎内,在荧光显微镜下观察到GFP表达,证实dhfr全长cDNA可与pT7Ts-GFP载体成功经双酶切后连接及体外转录的成功和可行性。继而我们采用同样的上述方法,将dhfr全长cDNA插入pT7Ts载体中,体外转录dhfr mRNA用以使斑马鱼dhfr过表达。
在本研究中,通过采用向斑马鱼受精卵显微注射dhfr mRNA的方法进行dhfr过表达,并通过观察和分析乙醇处理组、乙醇+ dhfr mRNA组的心血管发育情况以评估dhfr过表达对乙醇所致胚胎心血管发育异常的挽救作用。显微注射时,设立溶剂对照组,注射的为溶解dhfr mRNA的溶剂,以排除溶剂对胚胎发育的干扰作用。
本研究发现dhfr过表达后可挽救乙醇所致的胚胎发育异常,表现为:胚胎发育异常百分率下降、胚胎存活百分率上升、胚胎整体发育情况改善、心脏形态发育趋于正常、心脏功能(心率、VSF)恢复、血管发育状况好转。进而我们通过检测心房及心室发育关键转录因子nkx2.5、心脏流出道发育关键转录因子tbx1及血管发育关键因子flk-1的表达情况,初步探讨dhfr过表达的挽救机制。
nkx2.5属于NK型同源基因家族中的成员,是胚胎期心脏发育过程中起重要作用的转录因子,参与心脏前体细胞的分化、房室间隔、传导系统及成熟心脏正常功能的维持[14-15]。tbx1属于T盒转录因子家族,其对于心脏流出道发育十分关键[16-17]。flk-1是在血管内皮细胞上特定表达的酪氨酸激酶受体基因,它是血管内皮的重要标志物,对于血管母细胞的发育和整个脉管系统的建立都起着重要作用[18-19]。在基因表达检测方面,通过构建基因探针,采用胚胎整体原位杂交的方法,可探查基因在胚胎特定部位的空间表达情况;Real-time PCR可精准的检测基因在胚胎的整体相对表达水平。我们同时采用上述两种基因表达检测方法进行了基因表达情况检测。结果表明乙醇处理组中,nkx2.5在心房和心室、tbx1在心脏流出道、flk-1在血管的表达皆减弱,且nkx2.5、tbx1、flk-1 mRNA相对表达水平下降。dhfr过表达后,乙醇处理组胚胎上述指标的表达情况均改善。提示dhfr过表达可能通过上调nkx2.5、tbx1、flk-1的表达而挽救乙醇所致胚胎心脏和血管发育异常。另在本研究中,我们还发现,虽然dhfr过表达可挽救乙醇所致的胚胎发育异常及基因表达下调,但与正常对照组相比仍有差异,提示dhfr过表达仅可部分挽救乙醇的致畸作用。
本研究利用模式生物斑马鱼开展dhfr过表达对于乙醇导致胚胎心脏和血管发育异常挽救效应的研究,并进行初步挽救机制探讨。旨在为如何挽救人类乙醇所致胎儿发育异常的相关研究提供依据;并期望能为临床上预防和治疗乙醇暴露所致的先天性发育异常提供线索。
Biographies
孙淑娜, 女, 博士, 副主任医师
Gui Y-H, Email: yhgui@shmu.edu.cn
Funding Statement
上海市科委自然科学基金(19ZR1406300)
References
- 1.Karunamuni G, Gu S, Doughman YQ, et al. Ethanol exposure alters early cardiac function in the looping heart:a mechanism for congenital heart defects? Am J Physiol Heart Circ Physiol. 2014;306(3):H414–H421. doi: 10.1152/ajpheart.00600.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Jiang Q, Lu D, Wang F, et al. Folic acid supplement rescues ethanol-induced developmental defects in the zebrafish embryos. Acta Biochim Biophys Sin (Shanghai) 2020;52(5):536–545. doi: 10.1093/abbs/gmaa030. [DOI] [PubMed] [Google Scholar]
- 3.Sun S, Gui Y, Wang Y, et al. Effects of methotrexate on the developments of heart and vessel in zebrafish. Acta Biochim Biophys Sin (Shanghai) 2009;41(1):86–96. doi: 10.1093/abbs/gmn010. [DOI] [PubMed] [Google Scholar]
- 4.Sun S, Gui Y, Jiang Q, et al. Dihydrofolate reductase is required for the development of heart and outflow tract in zebrafish. Acta Biochim Biophys Sin (Shanghai) 2011;43(12):957–969. doi: 10.1093/abbs/gmr098. [DOI] [PubMed] [Google Scholar]
- 5.Kimmel CB, Ballard WW, Kimmel SR, et al. Stages of embryonic development of the zebrafish. http://europepmc.org/article/MED/8589427. Dev Dyn. 1995;203(3):253–310. doi: 10.1002/aja.1002030302. [DOI] [PubMed] [Google Scholar]
- 6.Qian L, Wang Y, Jiang Q, et al. Ethanol disrupts the formation of hypochord and dorsal aorta during the development of embryonic zebrafish. Sci China C Life Sci. 2005;48(6):608–615. doi: 10.1360/062005-1. [DOI] [PubMed] [Google Scholar]
- 7.Lipinski RJ, Hammond P, O'leary-Moore SK, et al. Ethanol-induced face-brain dysmorphology patterns are correlative and exposure-stage dependent. http://www.ncbi.nlm.nih.gov/pubmed/22937012. PLoS One. 2012;7(8):e3067. doi: 10.1371/journal.pone.0043067. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Muralidharan P, Sarmah S, Zhou FC, et al. Fetal alcohol spectrum disorder (FASD) associated neural defects:complex mechanisms and potential therapeutic targets. https://pubmed.ncbi.nlm.nih.gov/24961433/ Brain Sci. 2013;3(2):964–991. doi: 10.3390/brainsci3020964. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Hutson JR, Stade B, Lehotay DC, et al. Folic acid transport to the human fetus is decreased in pregnancies with chronic alcohol exposure. PLoS One. 2012;7(5):e38057. doi: 10.1371/journal.pone.0038057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.孙 淑娜, 桂 永浩, 蒋 璆, et al. 二氢叶酸还原酶基因在斑马鱼神经系统发育过程中的作用. 中国实验动物学报. 2010;18(2):127–130. doi: 10.3969/j.issn.1005-4847.2010.02.009. [DOI] [Google Scholar]
- 11.孙 淑娜, 桂 永浩, 蒋 璆, et al. 叶酸缺乏对斑马鱼胚胎造血系统影响的初步研究. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yingyxb201001005 营养学报. 2010;32(1):21–25. [Google Scholar]
- 12.孙 淑娜, 桂 永浩, 蒋 璆, et al. 叶酸缺乏对斑马鱼体轴发育的影响. 复旦学报(医学版) 2009;36(6):663–669. doi: 10.3969/j.issn.1672-8467.2009.06.001. [DOI] [Google Scholar]
- 13.孙 淑娜, 桂 永浩, 蒋 缪, et al. 二氢叶酸还原酶基因在斑马鱼咽弓发育过程中作用的研究. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=swhx201002004 生物化学与生物物理进展. 2010;37(2):145–153. [Google Scholar]
- 14.Elliott DA, Solloway MJ, Wise N, et al. A tyrosine-rich domain within homeodomain transcription factor Nkx2-5 is an essential element in the early cardiac transcriptional regulatory machinery. Development. 2006;133(7):1311–1322. doi: 10.1242/dev.02305. [DOI] [PubMed] [Google Scholar]
- 15.Akazawa H, Komuro I. Cardiac transcription factor Csx/Nkx2-5:its role in cardiac development and diseases. Pharmacol Ther. 2005;107(2):252–268. doi: 10.1016/j.pharmthera.2005.03.005. [DOI] [PubMed] [Google Scholar]
- 16.Xu H, Morishima M, Wylie JN, et al. Tbx1 has a dual role in the morphogenesis of the cardiac outflow tract. Development. 2004;131(13):3217–3227. doi: 10.1242/dev.01174. [DOI] [PubMed] [Google Scholar]
- 17.Morishima M, Yanagisawa H, Yanagisawa M, et al. Ece1 and Tbx1 define distinct pathways to aortic arch morphogenesis. https://pubmed.ncbi.nlm.nih.gov/12950083/ Dev Dyn. 2003;228(1):95–104. doi: 10.1002/dvdy.10358. [DOI] [PubMed] [Google Scholar]
- 18.Liang D, Chang JR, Chin AJ, et al. The role of vascular endothelial growth factor (VEGF) in vasculogenesis, angiogenesis, and hematopoiesis in zebrafish development. Mech Dev. 2001;108(1-2):29–43. doi: 10.1016/S0925-4773(01)00468-3. [DOI] [PubMed] [Google Scholar]
- 19.Zhong TP, Childs S, Leu JP, et al. Gridlock signalling pathway fashions the first embryonic artery. Nature. 2001;414(6860):216–220. doi: 10.1038/35102599. [DOI] [PubMed] [Google Scholar]


