Abstract
Objectif de l’étude
Le processus de réalisation de la radiothérapie externe est une chaine d’étapes dans laquelle chacune d’entre elles est réalisée seulement si la précédente a été complétée. Le développement des pratiques d’hypofractionnement ces dernières années a tendance à augmenter la charge de travail des étapes de préparation à une irradiation et à diminuer le nombre de séances par patient. Cette étude rétrospective vise à analyser l’évolution de ces pratiques dans un centre de lutte contre le cancer et d’en apprécier les enjeux organisationnels.
Matériel et méthodes
L’ensemble des données de gestion des dossiers de radiothérapie ont été extraites du système d’information de radiothérapie. Les séances de radiothérapie ont été identifiées par patient et par code CIM (Classification internationale des maladies). Le taux de remplissage des appareils de traitement a été calculé avec les données réelles du département de radiothérapie.
Résultats
De 2015 à 2019, une augmentation du nombre de scanographies (+16 %), du nombre de patients pris en charge (+11,6 %) et du volume d’heures disponibles pour les traitements (+12 %) ont été observées. Aussi, une diminution du nombre total de séances de radiothérapie (−5 %), de la moyenne de séances réalisées par séquence de traitement (−19 %), du taux de remplissage des appareils (−7 %) et de la moyenne de séances réalisées par patients traités des tumeurs malignes des bronches et du poumon (−38 %), des organes digestifs (−37 %), secondaires (−19 %) du sein (−15 %) et de la prostate (−15 %) ont été observées. Le nombre de séances administrées par séquence de traitement entre 2015 et 2019 a diminué significativement pour les patients des classes d’âge [20–69 ans] (p < 0,001) et [> 70 ans] (p < 0,001).
Conclusion
Un paradoxe apparait entre l’augmentation du nombre total de patients pris en charge et la diminution du taux de remplissage des appareils de traitement. Ce transfert de charge de travail a un impact sur la qualité et la sécurité des soins et sur les stratégies d’organisation et d’investissement. Il a également un impact économique lié au modèle de remboursement basé sur la tarification à la séance. Une réorganisation des services de radiothérapie s’avère inéluctable.
Mots clés: Radiothérapie externe, Hypofractionnement, Organisation, Cancer du sein, Cancer de la prostate, Manipulateur en pratique avancée
Abstract
Purpose
External radiotherapy process is a chain of steps in which each of them is carried out only if the previous one has been completed. The development of hypofractionation practices in recent years tends to increase the workload of the stages of preparation for irradiation and to decrease the number of fractions per patient. The purpose of this retrospective study is to analyze the evolution of these practices in a single centre and to assess the organizational issues involved.
Material and methods
All radiation therapy records management data were extracted from the Radiation Therapy Information System. Radiotherapy sessions were identified by patient and by ICD (International Classification of Diseases) code. The filling rate of the treatment equipment was calculated using actual data from the radiotherapy department.
Results
From 2015 to 2019, there was an increase in the number of scans (+16%), the number of patients treated (+11.6%) and the volume of hours available for treatment (+12%). Also, there was a decrease in the total number of fractions (−5%), in the average number of fractions performed per treatment sequence (−19%), in the occupancy rate of the machines (−7%) and in the average number of fractions performed per patient treated for malignant tumours of the bronchi and lung (−38%), digestive organs (−37%), secondary (−19%) breast (−15%) and prostate (−15%). The number of fractions administered per treatment sequence between 2015 and 2019 decreased significantly for patients in age groups [20–69] (P < 0.001) and [> 70] (P < 0.001).
Conclusion
A paradox appears between the increase in the total number of patients treated and the decrease in the loading rate of linacs. This shift of workload has an impact on the quality and safety of care and on the organizational and investment strategies. It also has an economic impact where the model of reimbursement is based on per fraction pricing. A reorganization of radiotherapy services is inevitable.
Keywords: External radiotherapy, Hypofractionated radiotherapy, Organization, Prostate cancer, Breast cancer, Advanced practice radiation therapist
1. Introduction
Ces dernières années, le développement des pratiques d’hypofractionnement en radiothérapie externe questionne le domaine de la qualité et de la sécurité des soins puisque l’administration d’une dose par fraction plus importante augmente les conséquences potentielles en cas de survenue d’un évènement indésirable. En outre, la modification des standards de prise en charge et l’accroissement d’indications de radiothérapie hypofractionnée, notamment pour les tumeurs du sein, de la prostate et du poumon, qui représentent respectivement 25 %, 11 % et 7 % des patients pris en charge par irradiation en France en 2017, implique une diminution significative du nombre de séances de traitement par patient et incite à remodeler l’allocation des ressources humaines et matérielles au sein du processus de prise en charge des patients [1], [2], [3], [4], [5]. L’observatoire national de la radiothérapie a constaté sur la période 2012–2017 une augmentation du nombre de patients et de séances respectivement de 12 % et 6 % [6]. Sur la même période le nombre d’appareils de traitement total en France a progressé de 14 % [7]. L’accessibilité à la radiothérapie pour les patients s’est améliorée ainsi à la fois grâce à l’augmentation du parc d’appareils et à l’intensification des pratiques d’hypofractionnement.
Le besoin d’amélioration de l’accessibilité à la radiothérapie en France est cohérent avec le diagnostic du groupe de travail intitulé Health Economics in Radiation Oncology (HERO) [8]. Sur la base des données 2012 issues de l’observatoire européen du cancer et des sociétés savantes nationales europeennes, HERO a évalué le nombre de traitements de radiothérapie optimal à réaliser par pays, et a indiqué que la France fournissait 77 % du nombre de traitements nécessaires à ses besoins. Le financement actuel de la radiothérapie principalement basé sur la tarification à l’acte (T2A) incite les centres à augmenter leur capacité de production de séances, ce qui incite à améliorer l’offre de radiothérapie mais n’intègre pas encore les changements de pratiques liés à l’hypofractionnement.
Le maintien d'un taux d’activité constant de séances de radiothérapie tenant compte de l’intensification des pratiques d’hypofractionnement nécessite de recruter davantage de patients qu’auparavant, ce qui par conséquent augmente de façon disproportionnelle la charge de travail pour le processus de préparation des traitements de la consultation d’annonce de radiothérapie à la validation de la dosimétrie. En revanche l’augmentation de la part d’hypofractionnement aura des effets bénéfiques sur les listes d’attentes et facilitera l’adéquation entre besoins de la population et offre de soin.
L’analyse des données 2015–2019 du département d’oncologie radiothérapie du centre de lutte contre le cancer (CLCC) Gustave-Roussy est présentée afin de comprendre les enjeux organisationnels actuels.
2. Méthodologie
Les données nécessaires à cette analyse proviennent du système d’information (SIRT) Mosaiq® (Elekta SAS) du département d’oncologie radiothérapie de Gustave-Roussy. Ces données sont les données de gestion quotidienne des dossiers de traitements de radiothérapie. L’extraction de ces données se fait par un ensemble de requêtes paramétrables lancées par un outil de production de rapport SAP® BusinessObject Crystal Reports 2013.
Notamment cet outil a permis l’extraction des données suivantes pour chaque séquence de traitement réalisé :
-
•
code CIM (classification internationale des maladies) ;
-
•
âge du patient ;
-
•
technique employée ;
-
•
machine de traitement ;
-
•
séquence de traitement réalisée ;
-
•
nombre moyen de séances de traitement réalisées ;
-
•
Code de l’acte selon la classification commune des actes médicaux (CCAM).
Une séquence de traitement représente une prescription ou un groupe de prescription (par exemple pour un traitement du sein, une séquence, une prescription de 50 Gy en 25 fractions ou deux prescriptions , 50 Gy en 25 fractions et boost normofractionné de 16 Gy en huit fractions). Les séquences de traitement ont été affectées à une année si la séquence a commencé dans l’année considérée (01/01/20xx–31/12/20xx).
Dans cet article, une séquence de traitement initiée durant l’année considérée a été comptabilisée comme un patient.
Un acte enregistré sous un code CCAM est considéré comme une séance de traitement.
Le nombre de scanographies de radiothérapie réalisées a été obtenu par extraction des actes de scanographie enregistrés sur le système d'information hospitalier de Gustave-Roussy.
Le taux de remplissage a été obtenu à partir des données réelles de Gustave-Roussy comme suit :
-
•
numérateur = nombre d’actes CCAM enregistrés par chaque appareil dans le service pour l’année considérée ;
-
•
dénominateur = nombre d’actes CCAM qui auraient pu être réalisés pour le volume d’heures disponibles en respectant la proportions des types d’actes CCAM enregistrés dans le service pour l’année considérée (par exemple : pour un appareil qui aurait enregistré sur une année une proportion de X% d’actes ZZNL051 avec a = durée de réalisation de l’actes à Gustave-Roussy et Y % d’actes ZZNL063 avec b = durée de réalisation de l’actes à Gustave-Roussy, dix heures de traitement correspondent en nombre d’acte à 10× X %/a + 10× Y %/b).
Le volume d’heures disponibles pour les traitements pour l’année considérée a été obtenu en comptabilisant sur chaque appareil le nombre d’heures dédiées aux traitements, tenant compte de l’amplitude de fonctionnement de chaque appareil, de la programmation des arrêts pour maintenance et contrôle qualité et des pannes survenues.
Les données de répartition par classe d’âge de la moyenne du nombre de séances réalisées par séquence de traitement de 2015 à 2019 sont indépendantes et suivent une distribution non normale. Un test de Wilcoxon–Mann Whitney a donc été réalisé. Une valeur de p < 0,05 a été considérée comme significative (Tableau 2).
Tableau 2.
Répartition par classe d’âge de la moyenne du nombre de séances réalisées par séquence de traitement de 2015 à 2019.
Distribution by age group of the average number of fractions per treatment sequence from 2015 to 2019.
| Classe d’âge | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| 0–19 | 19,20 | 18,45 | 19,20 | 18,28 | 20,37 |
| 20–69 | 21,08 | 19,05 | 17,91 | 17,70 | 16,52 |
| > 70 | 18,55 | 17,19 | 16,22 | 16,65 | 15,17 |
3. Résultats
Entre 2015 et 2019 dans le service de radiothérapie externe de Gustave-Roussy, il a été observé (Fig. 1 ) :
-
•une augmentation :
-
∘du nombre de scanographies de radiothérapie de +16 % ;
-
∘du nombre de patients traités de +11,6 % ;
-
∘du volume d’heures réellement disponibles pour les traitements de +12 % (liée à l’augmentation du parc d’appareil de traitement) ;
-
∘
-
•une diminution :
-
∘du nombre total de séances de radiothérapie réalisées de −5 %,
-
∘de la moyenne de séances réalisées par séquence de traitement de −19 %,
-
∘du taux de remplissage des appareils de −7 %.
-
∘
Fig. 1.
Taux d’évolution du nombre de patients traités, du nombre de scanographies de radiothérapie, du nombre de séances de radiothérapie réalisées, du nombre de séances par patient, du taux de remplissage des appareils de traitement et du volume d’heures disponibles pour les traitements pour l’année considérée de 2015 à 2019 à Gustave-Roussy.
Rate of change in the number of patients treated, the number of radiotherapy scanners, the number of radiotherapy fractions performed, the number of fractions per patient, the filling rate of treatment linac and the volume of hours available for treatment for the year under consideration from 2015 to 2019 at Gustave-Roussy.
La Fig. 2 montre le détail de la diminution de la moyenne de séances réalisées par patients pris en charge pour une tumeur maligne :
-
•
des bronches et du poumon (−38 %) ;
-
•
des organes digestifs (−37 %) ;
-
•
secondaire (−19 %) ;
-
•
du sein (−15 %) ;
-
•
de la prostate (−15 %).
Fig. 2.
Taux d’évolution de la moyenne du nombre de séances de radiothérapie réalisées par patient pour les codes CIM C50 (tumeur maligne, T.M, du sein), C61 (T.M. de la prostate), C15-C26 (T.M. des organes digestifs), C34 (T.M. des bronches et du poumon), C76-C80 (T.M. secondaires) et global (tous les codes CIM) de 2015 à 2019 à Gustave-Roussy.
Rate of change in the average number of radiotherapy fractions per patient for ICD codes C50 (Breast M.T.), C61 (Prostate M.T.), C15-C26 (Digestive Organ M.T.), C34 (Bronchial and Lung M.T.), C76-C80 (Secondary M.T.) and global (all ICD codes) from 2015 to 2019 for Gustave-Roussy.
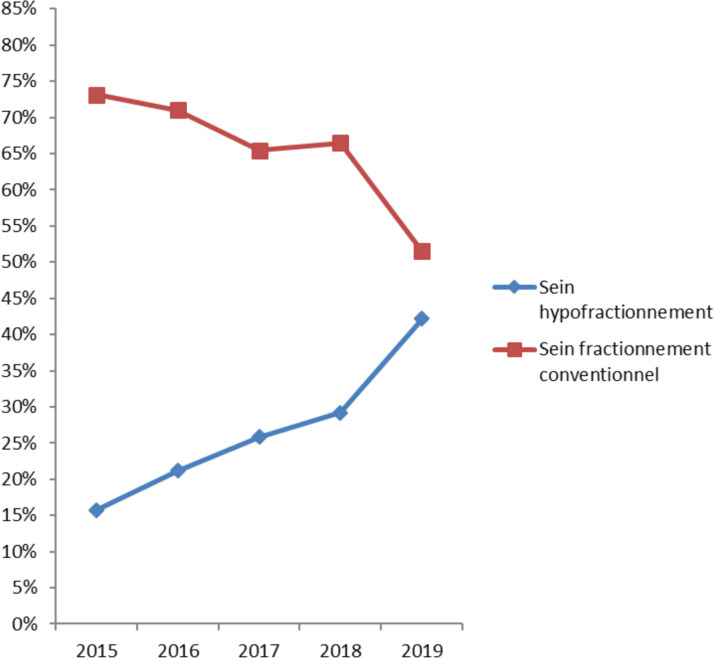
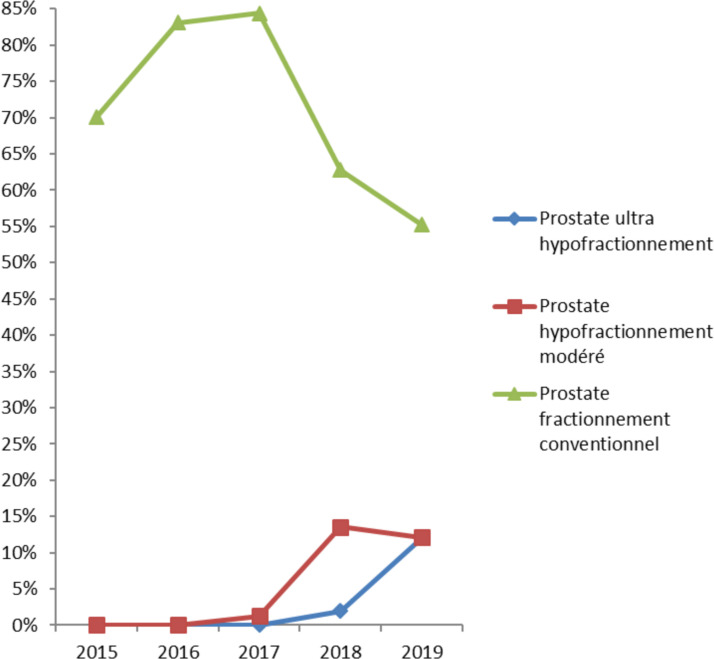
En ce qui concerne les tumeurs malignes du sein et de la prostate, les Fig. 3 et Fig. 4 montrent une baisse progressive de la proportion de patients ayant eu un fractionnement conventionnel. Le schéma ultrahypofractionné (40 Gy en cinq fractions) pour la prostate tendait à augmenter en 2019 par rapport à 2018, année où cette pratique a débuté.
Fig. 3.
Répartition de la proportion des patients pour le code CIM C50 (T.M. du sein) pris en charge selon un schéma hypofractionné (40 Gy en 15 fractions avec ou sans boostsoit de 16 Gy en huit fractions soit de 13,35 Gy en cinq fractions) et un fractionnement conventionnel (50 Gy en 25 fractions avec ou sans boostde 16 Gy en huit fractions ou 50,4 Gy en 28 séances avec 64,4 Gy dans le boost intégré simultané, SIB) de 2015 à 2019 à Gustave-Roussy.
Distribution of the proportion of patients for ICD code C50 (malignant tumour of the breast) treated according to a hypofractionated regimen (40 Gy in 15 fractions with or without a boost of either 16 Gy in 8 fractions or 13.35 Gy in 5 fractions) and a conventional fractionation (50 Gy in 25 fractions with or without a boost of 16 Gy in 8 fractions or 50.4 Gy in 28 fractions with 64.4 Gy on the simultaneous. integrated boost, SIB) from 2015 to 2019 at Gustave-Roussy.
Fig. 4.
Répartition de la proportion des patients pour le code CIM C61 (T.M. de la prostate) pris en charge selon un schéma ultrahypofractionné (40 Gy en 5 fractions), hypofractionné modéré (60 Gy en 20 fractions) et un fractionnement conventionnel (80 Gy en 40 fractions ou 78 Gy en 39 fractions).
bDistribution of the proportion of patients for ICD code C61 (prostate M.T.) treated with ultrahypofractionated (40 Gy in 5 fractions), moderate hypofractionated (60 Gy in 20 fractions) and conventional fractionation (80 Gy in 40 fractions or 78 Gy in 39 fractions).
Le Tableau 1 montre que des patients de plus en plus âgés ont été pris en charge par radiothérapie externe à Gustave-Roussy.
Tableau 1.
Répartition par classe d’âge de la proportion des patientspris en charge à Gustave-Roussy de 2015 à 2019.
Distribution by age group of the proportion of patients treated at Gustave-Roussy from 2015 to 2019.
| Classe d’âge | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| 0–9 | 1,8 % | 1,7 % | 1,7 % | 1,4 % | 1,2 % |
| 10–19 | 1,8 % | 2,0 % | 2,0 % | 1,9 % | 1,9 % |
| 20–29 | 1,6 % | 2,0 % | 1,8 % | 2,4 % | 1,7 % |
| 30–39 | 6,2 % | 6,2 % | 5,2 % | 4,5 % | 5,4 % |
| 40–49 | 13,5 % | 13,5 % | 13,8 % | 12,7 % | 12,2 % |
| 50–59 | 24,7 % | 22,5 % | 24,5 % | 22,9 % | 21,0 % |
| 60–69 | 29,3 % | 29,1 % | 27,8 % | 28,9 % | 26,1 % |
| 70–79 | 16,5 % | 17,0 % | 17,8 % | 19,7 % | 22,0 % |
| 80–89 | 4,3 % | 5,5 % | 5,0 % | 5,4 % | 7,8 % |
| > 90 | 0,3 % | 0,5 % | 0,4 % | 0,3 % | 0,6 % |
Le Tableau 2 montre que la moyenne du nombre de séances administrées par séquence de traitement a diminué progressivement entre 2015 et 2019 pour les patients des classes d’âge 20–69 ans et plus de 70 ans. Pour ces deux classes d’âges, cette diminution est statistiquement significative entre les années 2015 et 2019, avec p < 0,001.
4. Discussion
L’observation des données montre un décalage entre l’augmentation progressive du nombre de scanners de radiothérapie et de patients pris en charge et la diminution du nombre total de séances de traitement (Fig. 1). Cette observation est cohérente avec les données de l’Institut national du cancer (INCa) [4]. La disponibilité des appareils de traitement restait jusqu’à présent la principale source de délai pour la prise en charge des patients, cette cause de délai est réduite grâce à l’intensification des pratiques d’hypofractionnement, qui est particulièrement radicale pour les patients de la classe d’âge 20–69 ans entre 2015 et 2019 (Tableau 2). Le constat est partagé par d’autres centres [9], [10]. Nos résultats ouvrent ici une réflexion plus globale permettant de discuter les enjeux organisationnels liés à l’intensification des pratiques d’hypofractionnement.
L’étape critique des délais de prise en charge en radiothérapie se décale progressivement en amont des postes de traitement, soit en consultation d’annonce de radiothérapie, soit au scanner de radiothérapie, en contourage ou encore en dosimétrie selon la disponibilité des ressources humaines. Les dépenses liées au transport hospitalier sont en augmentation sur la période 2011–2017 selon la Cour des comptes [11], les schémas de traitement hypofractionné en diminuent le coût grâce au plus faible nombre de venues dans le service, notamment pour le cancer du sein [9], [12]. Les résultats récents des essais cliniques de phase 3 FAST-Forward pour le traitement du sein (non-infériorité du schéma délivrant 26 Gy en cinq fractions sur une semaine à celui 40 Gy en 15 fractions sur trois semaines) et de l’HYPO-RT-PC pour la prostate (non-infériorité du schéma délivrant 42,7 Gy en sept fractions sur deux à cinq semaines à celui 78 Gy en 39 fractions sur huit semaines) sont en faveur d’un schéma encore plus hypofractionné [13], [14], [15], [16]. Ils contribuent à un nouveau modèle de radiothérapie où l’étalement dans le temps des traitements est considérablement réduit à l’instar des traitements en conditions stéréotaxiques. La diminution de la durée totale du traitement facilite aussi l’adhésion des patients en particuliers âgés aux traitements notamment pour le sein, ou pour le cancer du poumon non à petites cellules et, en même temps, peut limiter le risque d’infection en diminuant le nombre de déplacements à l’hôpital en particulier dans le contexte de la pandémie coronavirus disease 2019 (covid-19) [15,16]. Cette possible amélioration de l’adhésion au traitement chez les patients âgés est en cohérence avec l’observation d’une augmentation progressive des patients des classes d’âge [70–79 ans] et [80–89 ans] dans notre étude (Tableau 1). En effet, dans cette étude entre 2015 et 2019, la moyenne du nombre de séances réalisées par séquence de traitement pour les patients âgés de 70 ans et plus a significativement diminué (Tableau 2).
Le modèle de remboursement actuel de la radiothérapie ne prend pas en compte les changements induits par l’hypofractionnement. Pour le traitement du sein par exemple, ce constat est partagé par d’autres équipes [10], [12], [17]. Ainsi, le financement des services de radiothérapie français où le remboursement est basé sur le nombre de fractions, tend à diminuer. L’adaptation du modèle de remboursement est en retard sur les pratiques, notamment d’hypofractionnement, au regard du niveau de preuves disponibles dans la littérature [18]. Cela crée une mise en tension financière des unités de radiothérapie dans un contexte d’augmentation du recrutement de patients. Il en résulte une augmentation de la charge de travail aux étapes de préparation du traitement avec, entre autre, une complexification des techniques de traitement liée au progrès techniques, notamment par l’augmentation de la disponibilité d’accélérateurs tels que le CyberKnife®, le Novalis® et la Tomothérapie® [7]. Dans ce contexte, l’implémentation d’un outil de supervision du workflow intégré ou interopérable avec le du système d’information, devient stratégique afin de gérer l’augmentation du flux de patients, la priorité de gestion et l’analyse de l’organisation.
L’augmentation du niveau de risque lié à l’intensification de l’hypofractionnement nécessite d’augmenter la sécurisation des processus de préparation et d’administration des traitements. Les checklists en radiothérapie sont efficaces pour diminuer les évènements indésirables graves [19]. Les checklists sous format informatique sont plus ergonomiques pour les utilisateurs et doivent évoluer avec les pratiques [20]. Dans le service de radiothérapie externe de l’institut Gustave-Roussy depuis 2015, des checklists type « never events » sous format informatique intégrées au dossier du patient ont été adoptées [21], [22]. Ces checklists ont été déployées aux étapes évaluées comme clefs du workflow et font l’objet d’une évaluation ponctuelle par la cellule de retour d’expérience. Elles restent un outil efficace aussi pour sécuriser la radiothérapie hypofractionnée.
Sécuriser et maîtriser les étapes clefs du workflow peut efficacement être réalisé par le développement de solutions innovantes grâce aux différentes applications des big data [23]. La supervision à l’étape de prescription par un modèle statistique permet d’évaluer leur conformité aux recommandations internationales pour chaque prescription établie. L’intelligence artificielle appliquée à la délinéation des régions anatomiques d’intérêt permet potentiellement d’en réduire le temps de réalisation et d’en améliorer la reproductibilité. Dans le département d’oncologie radiothérapie de l’institut Gustave-Roussy, un outil de délinéation automatique basé sur l’intelligence artificielle a été déployé pour la localisation ORL. Ce déploiement vise, entre autre, à réduire le délai de réalisation de la délinéation. La mesure des paramètres de l’appareil de traitement permet d’envisager un système prédictif des pannes pour les anticiper, et programmer des maintenances préventives pour limiter les interruptions de traitement. L’impact des interruptions des traitements hypofractionnés ne relève pas de cette étude et pourrait faire l’objet d’une évaluation. Cela pourrait consolider l’investissement de ressources pour le déploiement d’appareils miroirs et la mise en œuvre de maintenances en horaires décalés.
La diminution du nombre de séances de traitement diminue, in fine, le taux de remplissage des appareils (Fig. 1). L’augmentation de l’hypofractionnement peut permettre l’acquisition d’appareils de haute précision qui demandent un temps de réalisation d’une séance de traitement plus long par rapport à un accélérateur polyvalent sans pour cela entrainer une augmentation du délai de prise en charge des patients. Ce virage des besoins devrait être pris en compte dans l’évaluation du dimensionnement du parc d’appareil et du choix des technologies. À ce titre, l’accélérateur de particules couplé à un système embarqué d’imagerie par résonnance magnétique constitue une illustration de ces changements potentiels [24].
La radiothérapie guidée par l’image (IGRT, i mage- g uided r adiation t herapy) permet de sécuriser l’administration des traitements et est d’autant plus nécessaire pour la radiothérapie hypofractionnée où de fortes doses sont délivrées [9]. La capacité de réaliser des irradiations complexes a été permise par la radiothérapie conformationnelle avec modulation d’intensité (RCMI). Ce gain en complexité d’irradiation nécessite d’augmenter la précision du positionnement du patient et par conséquent la fréquence de l’imagerie réalisée au poste de traitement. À titre d’exemple, la réalisation de cette imagerie de façon quotidienne permet de limiter les toxicités rectales pour le traitement du cancer de la prostate [25]. Le guidage par l’image devient un prérequis incontournable pour la pratique de l’ultrahypofractionnement du cancer de la prostate [14].
Par conséquent, la charge de travail des oncologues-radiothérapeutes augmente au cours des étapes de préparation de chaque séquence de traitement, pour la réalisation des consultations de début et de fin traitement et pour la présence aux postes de traitements lors de la réalisation de chaque séance de traitement de radiothérapie hypofractionnée ayant une dose par fraction supérieure à 8 Gy [26].
Dans ce contexte, le besoin accru de validation de l’imagerie de repositionnement quotidienne liée au développement de la radiothérapie guidée par l’image et de l’imagerie au début de chaque séquence de traitement pourrait donc stratégiquement être pris en charge de manière autonome par le manipulateur en électroradiologie médicale (MERM). Cette autonomie est prévue par la législation en vigueur sous condition de la présence d’un protocole écrit, qualitatif et quantitatif préalablement établi et sous la responsabilité du médecin oncologue-radiothérapeute [27] qui doit donc assurer la supervision de ce processus. En outre, l’Agence internationale de l’energie atomique recommande fortement l’utilisation de protocole pour la gestion de la radiothérapie guidée par l’image par les manipulateurs [28]. À titre d’exemple, le service de radiothérapie externe de l’institut Gustave-Roussy a déployé la validation en temps différée de l’imagerie de « mise en place » pour chaque nouveau patient. Cette validation est réalisée en temps réel par les manipulateurs et révisée sous 2 jours ouvrés par le médecin. Ce processus est basé sur un dispositif de traçage et de supervision intégré au système d’information. La maturité des organisations diffère, il est recommandé d’organiser une formation théorique et pratique des manipulateurs pour la gestion de l’imagerie de repositionnement bidimensionnel et de tomographie conique (CBCT, cone-beam computed tomography) [29], [30], [31], [2]. Il peut être aussi intéressant de noter que la validation des imageries de repositionnement bidimensionnele de basse énergie (kV-kV) ou par tomographie conique de traitement extracrânien (métastase osseuse, foie, poumon) en conditions stéréotaxiques dont la dose par fraction est élevée par les manipulateurs est satisfaisante et est comparable à celles validées par les oncologues radiothérapeutes [32].
La diminution du taux de remplissage des appareils de traitement liée à l’hypofractionnement peut à terme poser aussi la question de l’évolution du besoin en manipulateurs. Bien qu’aujourd’hui en France, l’offre d’emploi des manipulateurs est inférieure à la demande, un questionnement sur les besoins en ressources humaines des services de radiothérapie est partagé par plusieurs auteurs notamment pour prévenir une offre excédentaire dans ce secteur [33]. À court terme, les créneaux libres des appareils de traitement pourraient être consacrés à des activités de recherche clinique, d’enseignement, et de formation continue du personnel y compris la mise en situation de simulation des événements indésirables (tels que des « chambre des erreurs ») [34].
À moyen terme, il est pertinent d’envisager une nouvelle fonction de manipulateur en pratique avancée en radiothérapie (CSRT pour clinical specialist radiation therapist) afin de faire face aux changements induits par la radiothérapie hypofractionnée. L’apport de cette nouvelle fonction a été évalué au Canada de 2007 à 2016 dans dix centres de radiothérapie [35]. Elle permet d’améliorer la qualité des soins dispensés aux patients et de faciliter les progrès de la science et de la pratique de la radiothérapie, tout en augmentant la capacité de prise en charge de patient, l’efficience des différentes étapes du workflow et la satisfaction des patients, des manipulateurs et de l’encadrement. Le manipulateur en pratique avancée en radiothérapie peut également réaliser des tâches qui incombent aujourd’hui aux oncologues-radiothérapeutes afin d’optimiser l’usage des ressources humaines. La fonction d’oncologue radiothérapeute évolue vers la définition de processus et de protocoles tout en assurant leur supervision. La fonction de manipulateur en pratique avancée en radiothérapie peut améliorer l’attractivité du service pour le recrutement de manipulateurs mais reste encore à développer. L’expérience de formation et d’apport du manipulateur en pratique avancée en radiothérapie dédié au parcours des patients palliatifs montre que ces fonctions innovantes manquent encore d’un cadre universitaire pour leur développement [36]. Par ailleurs, le plan cancer 2014–2019 préconise un parcours professionnel de spécialisation pour les manipulateurs d’électroradiologie en tant que dosimétristes ce qui est en cohérence avec le développement des pratiques d’hypofractionnement [37].
5. Conclusion
Le paradoxe montré par l’analyse des données semble s’expliquer par l’intensification des pratiques d’hypofractionnement. Cette tendance sera raisonnablement maintenue voir accrue dans les années à venir.
Cette intensification s’accompagne d’une augmentation de la complexité de gestion des activités inhérentes à l’augmentation du nombre de patients traités. Cette complexité nécessite de consolider la culture qualité des équipes afin de sécuriser les différentes étapes du workflow de radiothérapie.
La diminution du nombre de fractions par patient a un impact financier sur le remboursement qui reste basé sur le nombre de fractions réalisées. Une évolution du modèle de financement de la radiothérapie semble nécessaire et probablement urgente. Cette diminution doit également être aussi prise en compte lors de l’évaluation du dimensionnement et du choix du type de machines dans le renouvellement du parc d’appareil de radiothérapie.
La modification des charges de travail en amont de l’étape d’administration et le besoin accru de précision dans la réalisation des séances d’irradiation impose une réflexion sur le développement du métier du manipulateur ce qui peut apporter une valeur ajoutée aux services d’un point de vue qualité, sécurité, recherche, enseignement, efficience et satisfaction des parties prenantes. Un parcours universitaire spécifique pour la formation par exemple de manipulateur en pratique avancée en radiothérapie en France et une adéquation du cadre règlementaire est à préconiser.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciement
L’outil d’extraction des données a été fourni par M. Rémi Eugène membre de l’équipe Consultance Logiciel pour la société d’Elekta SAS.
Références
- 1.Smith B.D., Bellon J.R., Blitzblau R., Freedman G., Haffty B., Hahn C., et al. Radiation therapy for the whole breast: executive summary of an American Society for Radiation Oncology (ASTRO) evidence-based guideline. Pract Radiat Oncol. 2018;8:145–152. doi: 10.1016/j.prro.2018.01.012. [DOI] [PubMed] [Google Scholar]
- 2.Morgan S.C., Hoffman K., Loblaw D.A., Buyyounouski M.K., Patton C., Barocas D., et al. Hypofractionated radiation therapy for localized prostate cancer: executive summary of an ASTRO, ASCO, and AUA evidence-based guideline. Pract Radiat Oncol. 2018;8:354–360. doi: 10.1016/j.prro.2018.08.002. [DOI] [PubMed] [Google Scholar]
- 3.Videtic G.M.M., Donington J., Giuliani M., Heinzerling J., Karas T.Z., Kelsey C.R., et al. Stereotactic body radiation therapy for early-stage non-small cell lung cancer: executive summary of an ASTRO evidence-based guideline. Pract Radiat Oncol. 2017;7:295–301. doi: 10.1016/j.prro.2017.04.014. [DOI] [PubMed] [Google Scholar]
- 4.Simone C.B., Bogart J.A., Cabrera A.R., Daly M.E., DeNunzio N.J., Detterbeck F., et al. Radiation therapy for small cell lung cancer: an ASTRO clinical practice guideline. Pract Radiat Oncol. 2020:1–16. doi: 10.1016/j.prro.2020.02.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Site de l’Institut National du Cancer, Observatoire National de la radiothérapie, la radiothérapie externe. Consultable sur: http://lesdonnees.e-cancer.fr/Themes/Soins/La-radiotherapie/L-activite-et-les-techniques-de-traitement/La-radiotherapie-externe2#ind6968.(consulté le 28/04/2020).
- 6.Site de l’Institut National du Cancer, Observatoire National de la radiothérapie, les chiffres clefs. Consultable sur: https://www.e-cancer.fr/Professionnels-de-sante/Les-traitements/Radiotherapie/Chiffres-cles-de-la-radiotherapie.(consulté le 28/04/2020).
- 7.Site de l’Institut National du Cancer, Observatoire National de la radiothérapie, Evolution des équipements de radiothérapie depuis 2006. Consultable sur: http://lesdonnees.e-cancer.fr/Themes/Soins/La-radiotherapie/Les-equipements/Evolution-des-equipements-de-radiotherapie-depuis-2006.(consulté le 28/04/2020).
- 8.Borras J.M., Lievens Y., Dunscombe P., Coffey M., Malicki J., Corral J., et al. The optimal utilization proportion of external beam radiotherapy in European countries: An ESTRO-HERO analysis. Radiothe Oncol. 2015;116:38–44. doi: 10.1016/j.radonc.2015.04.018. [DOI] [PubMed] [Google Scholar]
- 9.Hennequin C., Guillerm S., Quero L. Rationale for hypofractionation. Cancer Radiother. 2019;23:500–502. doi: 10.1016/j.canrad.2019.07.156. [DOI] [PubMed] [Google Scholar]
- 10.Dwyer P., Hickey B., Burmeister E., Burmeister B. Hypofractionated whole-breast radiotherapy: impact on departmental waiting times and cost. J Med Imaging Radiat Oncol. 2010;54:229–234. doi: 10.1111/j.1754-9485. [DOI] [PubMed] [Google Scholar]
- 11.Site de la Cour des comptes, Rapport sur l’application des lois de financement de la sécurité sociale, octobre 2019. Consultable sur: https://www.ccomptes.fr/fr/publications/securite-sociale-2019.(Consulté le 29/04/2020).
- 12.Dupin C., Vilotte F., Lagarde P., Petit A., Breton-Callu C. Practice evolution of hypofractionation in breast radiation therapy and medical impact. Cancer Radiother. 2016;20:299–303. doi: 10.1016/j.canrad.2016.04.005. [DOI] [PubMed] [Google Scholar]
- 13.Murray Brunt A., Haviland J.S., Wheatley D.A., Sydenham M.A., Alhasso A., Bloomfield D.J., et al. Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomised, phase 3 trial. Lancet. 2020 doi: 10.1016/S0140-6736(20)30932-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Widmark A., Gunnlaugsson A., Beckman L., Thellenberg-Karlsson C., Hoyer M., Lagerlund M., et al. Ultra-hypofractionated versus conventionally fractionated radiotherapy for prostate cancer: 5-year outcomes of the HYPO-RT-PC randomised, non-inferiority, phase 3 trial. Lancet. 2019;394:385–395. doi: 10.1016/S0140-6736(19)31131-6. [DOI] [PubMed] [Google Scholar]
- 15.Rivin del Campo E., Rivera S. Hypofractionated radiotherapy for breast cancer in elderly patients: current evidence and future perspectives. Cancer Radiother. 2018:635–639. doi: 10.1016/j.canrad.2018.07.127. [DOI] [PubMed] [Google Scholar]
- 16.Shu Z., Dong B., Shi L., Shen W., Hang Q., Wang J. Stereotactic body radiotherapy for elderly patients (≥75 years) with early-stage non-small cell lung cancer. J Cancer Res Clin Oncol. 2020;146(5):1263–1271. doi: 10.1007/s00432-020-03154-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ojerholm E., Freedman G.M., Bekelman J.E. The dollars and sense of hypofractionated breast radiation [Editorial] J Natl Cancer Inst. 2017;109 doi: 10.1093/jnci/djx090. [DOI] [PubMed] [Google Scholar]
- 18.Lievens Y., Defourny N., Corral J., Gasparotto C., Grau C., Borras J.M., et al. How public health services pay for radiotherapy in Europe: an ESTRO–HERO analysis of reimbursement. Lancet Oncol. 2020;21:e42–e54. doi: 10.1016/S1470-2045(19)30794-6. [DOI] [PubMed] [Google Scholar]
- 19.Ford E.C., Terezakis S., Souranis A., Harris K., Gay H., Mutic S. Quality control quantification (QCQ): a tool to measure the value of quality control checks in radiation oncology. Int J Radiat Oncol Biol Phys. 2012;84 doi: 10.1016/j.ijrobp.2012.04.036. e263ee269. [DOI] [PubMed] [Google Scholar]
- 20.Berry S.L., Tierney K.P., Elguindi S., et Mechalakos J.G. Five years’ experience with a customized electronic checklist for radiation therapy planning quality assurance in a multicampus institution. Pract Radiat Oncol. 2018;8:279–286. doi: 10.1016/j.prro.2017.12.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Anon. Agency for Healthcare Research and Quality (US Department of Health and Human Services); Rockville: 2016. Never events. Consultable sur: https://psnet.ahrq.gov/primers/primer/3/never-events. (Consulté le 1er mai 2020) [Google Scholar]
- 22.Brusadin G., Bour M.S., Deutsch E., Kouchit N., Corbin S., et Lefkopoulos D. Implementation of “never events” checklists in a radiotherapy information system. Cancer Radiother. 2017;21:665–669. doi: 10.1016/j.canrad.2017.07. [DOI] [PubMed] [Google Scholar]
- 23.McNutt T.R., Moore K.L., Wu B., Wright J.L. Use of big data for quality assurance in radiation therapy. Seminars Radiat Oncol. 2019;29:326–332. doi: 10.1016/j.semradonc.2019.05.006. [DOI] [PubMed] [Google Scholar]
- 24.Chin S., Eccles C.L., McWilliam A., Chuter R., Walker E., Whitehurst P., et al. Magnetic resonance-guided radiation therapy: A review. J Med ImagRadiat Oncol. 2020;64:163–177. doi: 10.1111/1754-9485.12968. [DOI] [PubMed] [Google Scholar]
- 25.de Crevoisier R., Bayar M.A., Pommier P., Muracciole X., Pêne F., et al. Daily versus weekly prostate cancer image guided radiation therapy: phase 3 multicenter randomized trial. Int J Radiat Oncol Biol Phys. 2018;102:1420–1429. doi: 10.1016/j.ijrobp.2018.07.2006. [DOI] [PubMed] [Google Scholar]
- 26.Site de Légifrance, Arrêté du 12 janvier 2017 fixant le seuil prévu à l’article R. 4351-2-3 du code de la santé publique. Consultable sur: https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000033955876&categorieLien=id.(Consulté le 12/05/2020).
- 27.Site de Légifrance, Décret n(2016-1672 du 5 décembre 2016 relatif aux actes et activités réalisés par les manipulateurs d’électroradiologie médicale. Consultable sur: https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000033537927&categorieLien=id.(Consulté le 03/05/2020).
- 28.IAEA HUMAN HEALTH REPORTS No. 16 (2019): « Introduction of Image Guided Radiotherapy into Clinical Practice. » Consultable sur: https://www-pub.iaea.org/MTCD/Publications/PDF/P1827_web.pdf.(Consulté le 15/05/2020).
- 29.Lauche O., Castan F., de Forges H., Guillaumon C., Gourgou S., Fenoglietto P., et al. Prospective medical analysis of radiation therapist image repositioning during image-guided radiotherapy. Cancer/Radiothérapie. 2018;22:25–30. doi: 10.1016/j.canrad.2017.07.048. [DOI] [PubMed] [Google Scholar]
- 30.Rivin Del Campo E., Brusadin G., Corbin S., Hubert F., Motto D., Deutsch E., et al. Training for RTTs in image verification in breast cancer: from portal imaging to IGRT. Radiother Oncol. 2015;115:VII–VIII. doi: 10.1016/S0167-8140(15)34010-X. [DOI] [Google Scholar]
- 31.Benhaïm C., Loos G., Achard J.L., Berger L., Caillé C., Frédéric-Moreau T., et al. Partial delegation to radiation therapists of the control by cone beam CT of prostate positioning. Cancer Radiother. 2017;21:28–33. doi: 10.1016/j.canrad.2016.07.104. [DOI] [PubMed] [Google Scholar]
- 32.Levin D., Grinfeld G., Greenberg V., Lipsky Y., Zalmanov-Fayerman S., Tova Y., et al. Real time online matching in high dose per fraction treatments: Do radiation therapists perform as well as physicians? Pract Radiat Oncol. 2019;9:e236–e241. doi: 10.1016/j.prro.2018.10.002. [DOI] [PubMed] [Google Scholar]
- 33.Hunter D., Mauldon E., Anderson N. Cost-containment in hypofractionated radiation therapy: a literature review. J Med Radiat Sci. 2018;65:148–157. doi: 10.1002/jmrs.273. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Site de la Haute Autorité de Santé, chambre des erreurs. Consultable sur: https://www.has-sante.fr/upload/docs/application/pdf/2019-02/outil_5_chambre_des_erreurs.pdf.(Consulté le 12/05/2020).
- 35.Harnett N., Bak K., Lockhart E., Ang M., Zychla L., Gutierrez E., et al. The clinical specialist radiation therapist (CSRT): a case study exploring the effectiveness of a new advanced practice role in Canada. J Med Radiat Sci. 2018;65:86–96. doi: 10.1002/jmrs.281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Linden K., Renaud J., Zohr R., Gaudet M., Haddad A., Pantarotto J., et al. Clinical specialist radiation therapist in palliative radiation therapy: report of an orientation, training, and support program. J Med Imaging Radiat Sci. 2019;50:543–550. doi: 10.1016/j.jmir.2019.08.009. [DOI] [PubMed] [Google Scholar]
- 37.Site de l’INCa, plan cancer 2014-2019. Consultable sur: https://www.e-cancer.fr/Plan-cancer/Plan-cancer-2014-2019-priorites-et-objectifs. (Consulté le 12/05/2020).