Zusammenfassung
Die durch SARS‐CoV‐2 verursachte Pandemie COVID‐19 hat weitreichende direkte und indirekte medizinische Folgen. Dazu gehören sowohl der Verlauf als auch die Behandlung vieler Krankheiten. Es wird immer deutlicher, dass Infektionen mit SARS‐CoV‐2 erhebliche immunologische Veränderungen verursachen können, die insbesondere auch pathogenetisch und/oder therapeutisch relevante Faktoren betreffen.
Vor diesem Hintergrund fassen wir hier den aktuellen Wissensstand zur Interaktion von SARS‐CoV‐2/COVID‐19 mit Mediatoren der akuten Phase der Entzündung (TNF, IL‐1, IL‐6), der Typ‐1‐ und Typ‐17‐Immunantwort (IL‐12, IL‐23, IL‐17, IL‐36), Typ‐2‐Immunreaktionen (IL‐4, IL‐13, IL‐5, IL‐31, IgE), B‐Zell‐Immunität, Checkpoint‐Regulatoren (PD‐1, PD‐L1, CTLA4) und Signalwegen, die durch oral applizierte Medikamente moduliert werden (JAK, PDE4, Calcineurin), zusammen. Darüber hinaus diskutieren wir in diesem Zusammenhang die unspezifische Immunmodulation durch Glukokortikosteroide, Methotrexat, Malariamittel, Azathioprin, Dapson, Mycophenolsäure‐Derivate und Fumarsäureester sowie angeborene Immunmechanismen neutrophiler Granulozyten.
Aus diesen neueren Erkenntnissen leiten wir mögliche Implikationen für die therapeutische Modulation der genannten immunologischen Mechanismen im Zusammenhang mit SARS‐CoV‐2/COVID‐19 ab. Obwohl natürlich bei Patienten mit immunologisch vermittelten Krankheiten oder immunmodulierenden Therapien größte Vorsicht geboten ist, scheint es, dass viele Behandlungen auch während der COVID‐19‐Pandemie durchgeführt werden können; einige scheinen COVID‐19 sogar zu lindern.
SARS‐CoV‐2/COVID‐19 und Immunität: Unsere gegenwärtige Sicht in Kürze
Das Coronavirus SARS‐CoV‐2 kann bei infizierten Patienten die Krankheit COVID‐19 verursachen 1, 2. Diese neue Krankheit hält die Welt in vielerlei Hinsicht in Atem, und sie stellt unsere Gesellschaft vor nie dagewesene Herausforderungen 3. Wie die mehr als 35 000 wissenschaftlichen Publikationen zu COVID‐19 in nur sieben Monaten (MedLine‐Zugang 29. Juli 2020) eindrucksvoll belegen, nimmt die Menge der verfügbaren Daten rapide zu.
Das Virus dringt bevorzugt in Makrophagen, Typ‐II‐Pneumozyten, Perizyten und Muskelzellen ein und verursacht so direkte Organschäden, insbesondere bei Patienten mit bereits bestehenden Begleiterkrankungen. Die ersten Symptome von COVID‐19 manifestieren sich in der Regel fünf bis sechs Tage nach der Infektion 4, 5. Die Ausscheidung von Viruspartikeln beginnt zwei bis drei Tage vor dem Auftreten der Symptome, und obwohl das Virus bis zu 37 Tage lang nachgewiesen werden kann, nimmt die Infektiosität etwa zehn Tage nach den ersten Symptomen signifikant ab 4, 6, 7. IgM‐Antikörper gegen SARS‐CoV‐2 entwickeln sich etwa acht bis zwölf Tage nach der Infektion und verschwinden nach etwa zwölf Wochen. Die IgG‐Serokonversion tritt nach etwa 14 Tagen auf, und IgG hält länger als IgM 8, 9, 10. Antikörper gegen SARS‐CoV‐2 sind wahrscheinlich protektiv, da der passive Transfer von Rekonvaleszenten‐Plasma bei schwer betroffenen Patienten mit COVID‐19 den Krankheitsverlauf abschwächen kann 11, 12, 13, 14, 15. Schwere pulmonale Komplikationen bei einigen Patienten können jedoch mit der Entwicklung adaptiver Immunität zusammenhängen 16, 17, 18.
Einerseits spielt die angeborene Immunität eine entscheidende Rolle dabei, ob und wie sich COVID‐19 nach einer Infektion mit SARS‐CoV‐2 entwickelt 8, 17, 19, 20. Zelluläre Komponenten (wie natürliche Killerzellen, γδ‐T‐Zellen und myeloische Zellen) wirken mit humoralen Faktoren (Komplement‐ und Gerinnungssystem, natürliche Antikörper, Zytokine, Chemokine und erregerbindende Glykane) zusammen, um eine antivirale Immunantwort in Gang zu setzen 21, 22, 23. Andererseits können während der Erkrankung und im Falle von Komplikationen tiefgreifende Veränderungen der angeborenen und erworbenen Immunantwort bis hin zu einem unkontrollierten Zytokinsturm auftreten 24. Da Patienten mit immunvermittelten Störungen oder immunmodulatorischen Therapien veränderte Immunfunktionen haben, ist es denkbar, dass sich dies auf den Verlauf der Infektion auswirkt und umgekehrt (Abbildung 1).
Abbildung 1.
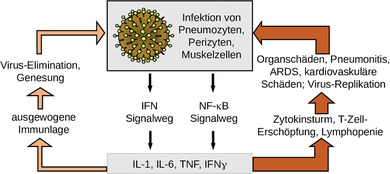
Schematische Darstellung der Immunaktivierung in COVID‐19. SARS‐CoV‐2 greift bevorzugt Pneumozyten, Perizyten und Muskelzellen an. Zahlreiche Mediatoren, zum Beispiel IL‐1, IL‐6 und TNF, werden hauptsächlich über die Interferon‐ und NF‐κB‐Signalwege induziert. Eine ausgewogene Immunantwort führt zur Eliminierung der Viren und zur Heilung (linke Seite). Bei prädisponierten Patienten kann aber auch ein sogenannter Zytokinsturm mit einer unkontrollierten Zunahme proinflammatorischer Mediatoren auftreten. Dies kann zu schweren Organschäden führen (rechte Seite).
Die Forschung über immunologische Regulationswege hat zu vielen selektiv wirkenden Biologika und niedermolekularen Medikamenten geführt, die die Behandlung chronisch entzündlicher Erkrankungen und die Tumortherapie revolutioniert haben. Darüber hinaus greifen auch zahlreiche konventionelle Medikamente in immunologische Prozesse ein, wenn auch meist in einer weniger spezifischen Weise. In dieser Situation ist es durchaus denkbar, dass Infektionen mit SARS‐CoV‐2 relevante immunregulatorische Signalwege und Therapien beeinflussen. Neutrophilie und Lymphopenie sowie erhöhte Serumkonzentrationen zahlreicher Zytokine und Chemokine einschließlich therapeutisch oder pathogenetisch relevanter Mediatoren wurden beschrieben 19, 25, 26. Wir gehen derzeit davon aus, dass viele durch COVID‐19 veränderte immunologische Mediatoren nicht primär an der Virus‐Elimination beteiligt sind 27.
Inzwischen zeichnet sich ein Muster immunologischer Folgen einer Infektion mit SARS‐CoV‐2 ab, das es angebracht erscheinen lässt, einige Krankheiten und deren Behandlungen neu zu überdenken (Abbildung 2). Allerdings ist es nicht ohne weiteres von vornherein vorhersehbar, ob und wie eine Infektion mit SARS‐CoV‐2 mit einer bestimmten Therapie oder einem bestimmten Signalweg interferieren könnte. Manche entzündungshemmenden Therapien dürften bei schweren COVID‐19‐Fällen sogar positive Auswirkungen haben. Erkenntnisse darüber, wie immunologische Mechanismen durch SARS‐CoV‐2 beeinflusst werden, wären daher für das Therapiemanagement relevant (Tabelle 1). Es erscheint uns daher wichtig, wesentliche Aspekte des neugewonnenen Wissens, welche die Pathogenese oder die Therapie berühren, zu skizzieren.
Abbildung 2.
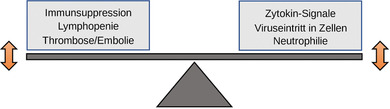
Möglicher Einfluss immunmodulatorischer Therapien auf COVID‐19. Bei COVID‐19‐Patienten, die mit immunmodulierenden Medikamenten behandelt werden, können verschiedene Effekte auftreten. Diese müssen gegeneinander abgewogen werden, da es eine fein abgestimmte Balance zwischen möglichen günstigen und schädlichen Wirkungen gibt. Einige davon sind hier schematisch dargestellt. Beispielsweise könnten Immunmodulatoren die Bildung und Wirkung von Zytokinen, den Eintritt von Viren in Zellen, thromboembolische Ereignisse oder die Lymphozytenfunktionen beeinflussen. Andererseits könnte auch der Verlauf immunvermittelter Krankheiten durch eine Infektion mit SARS‐CoV‐2 verändert werden. Viele Aspekte, wie medikamentöse Therapien das immunologische Gleichgewicht beeinflussen, sind noch nicht bekannt. Dennoch zeichnet sich ab, dass einige spezifische Therapien, wie die Inhibition von IL‐6, die durch COVID‐19 ausgelöste überschießende Immunantwort positiv beeinflussen können. Andererseits könnten Checkpoint‐Inhibitoren synergistisch mit der Immunaktivierung bei COVID‐19 wirken. Weitere Einzelheiten werden im Text erläutert.
Tabelle 1.
Synopse der immunologischen Signalwege und Mechanismen, die potenziell mit einer SARS‐CoV‐2‐Infektion interferieren können. Die Tabelle listet in erster Linie immunologische Mechanismen auf, für die zugelassene Medikamente zur Verfügung stehen
| Modulierbare immunologische Faktoren | Interaktion von COVID‐19 oder SARS‐CoV‐2‐Infektion mit genanntem Signalweg | Ausgewählte zugelassene Medikamente | Potenzielle Beeinflussung der genannten Immunmodulation und SARS‐CoV‐2‐Infektion |
|---|---|---|---|
| TNF | Hochreguliert bei COVID‐19 |
|
Noch keine spezifischen Studien; besserer Verlauf von COVID‐19 bei IBD‐Patienten unter TNF‐Inhibitoren im Vergleich zu Glukokortikoiden |
| IL‐1 | Induziert bei COVID‐19 |
|
Hemmung bessert schwere COVID‐19‐Symptome |
| IL‐6 | Induziert bei COVID‐19, potenziell prognostischer Parameter |
|
Hemmung bessert schwere COVID‐19‐Symptome |
| IL‐12 | Hochreguliert in einer von zwei Studien; kein Zusammenhang mit COVID‐19‐Schweregrad, keine Änderung während Infektion |
|
Noch keine klinischen Daten |
| IL‐23 | Möglicherweise hochreguliert, Transkription vermindert in PBMC |
|
Noch keine klinischen Daten |
| IL‐17 | Erhöhte Serumkonzentration bei COVID‐19; keine Assoziation mit Krankheitsschwere |
|
Noch keine klinischen Daten |
| IL‐4/IL‐13 | Keine signifikante Änderung |
|
Keine Daten, die auf ein erhöhtes Risiko von Patienten mit atopischer Dermatitis für/mit SARS‐CoV‐2‐Infektion hinweisen; Blockierung von Typ‐2‐Zytokinen ohne negativen Ausgang bei einzelnen COVID‐19‐Infektionen |
| IL‐5 | Keine signifikante Änderung |
|
Asthmabehandlung durch IL‐5‐Inhibition und Steroideinsparung möglicherweise von Nutzen bei COVID‐19‐Infektionen |
| IL‐31 | Keine signifikante Änderung |
|
Noch keine klinischen Daten |
| IgE | Keine signifikante Änderung |
|
Noch keine klinischen Daten |
| B‐Zellen/CD20 | Keine Daten berichtet |
|
Kein negativer Effekt der CD20‐Blockade auf Abheilung von COVID‐19 |
| Checkpoint‐Regulatoren | PD‐1‐Expression möglicherweise erhöht bei COVID‐19 |
|
Möglicherweise Synergismus von SARS‐CoV‐2‐Infektion und Immuncheckpoint‐Inhibitoren, keine direkten Daten |
| JAK | COVID‐19‐induzierte Zytokin‐Produktion vermittelt durch JAK‐STAT‐Signalweg |
|
Wahrscheinlich Nutzen von JAK‐Inhibitoren auf COVID‐19‐assoziierte Immunhyperaktivierung |
| PDE4 | Keine Daten berichtet |
|
Keine klinischen Daten |
| Calcineurin, Cyclophiline |
|
Erst wenige Daten, möglicherweise von Nutzen bei COVID‐19 | |
| Pleiotrope (breite oder unspezifische) Immunmodulation oder ‐suppression |
|
Keine generelle Kontraindikation; notwendige Therapien fortsetzen, keine evidenzbasierten Daten bei COVID‐19 |
|
| Angeborene Immunität, Neutrophilen‐Funktionen | Neutrophilie und (wahrscheinlich) NETose bei COVID‐19 |
|
Keine Daten, möglicherweise positiver Effekt auf COVID‐19 |
This article is being made freely available through PubMed Central as part of the COVID-19 public health emergency response. It can be used for unrestricted research re-use and analysis in any form or by any means with acknowledgement of the original source, for the duration of the public health emergency.
SARS‐CoV‐2/COVID‐19 und primäre Mediatoren der akuten Phase (TNF, IL‐1, IL‐6)
Die Infektion mit SARS‐CoV‐2 aktiviert in erster Linie zwei Signalkaskaden der angeborenen Immunität, den Interferon‐ und den NF‐κB‐Signalweg 28. Folglich sind die Serum‐ und Gewebsspiegel von IL‐1, TNF und IL‐6 bei COVID‐19‐Patienten erhöht 19, 29. Tatsächlich scheint das Gleichgewicht proinflammatorischer Zytokine den Krankheitsverlauf zu beeinflussen. IL‐1, IL‐6 und TNF könnten protektiv wirken, da sie die Abtötung virusinfizierter Wirtszellen durch CD8+‐T‐Zellen und Phagozyten erleichtern. Sie fördern auch die Produktion virusspezifischer Antikörper. Übermäßige Konzentrationen dieser Zytokine können jedoch den potenziell lebensbedrohenden „Zytokinsturm“ auslösen 30.
Th1‐Zellen können CD14+CD16+‐Monozyten zur Produktion von IL‐6 und zur Differenzierung in Gewebemakrophagen stimulieren. Dies führt zur Erschöpfung der T‐Zellen und zum Absterben der Gewebezellen 20, 31. Übermäßig hohe IL‐6‐Spiegel begünstigen somit akute Atemnot sowie kardiovaskuläre Schäden 32. Klinisch deuten erhöhte IL‐6‐Spiegel auf schwere Verläufe und Komplikationen von COVID‐19 hin 33, 34. Darüber hinaus führte Tocilizumab (ein humanisierter, gegen den IL‐6‐Rezeptor‐gerichteter Antikörper) bei 20 kritisch kranken Patienten zu einer beeindruckenden Besserung von COVID‐19 35. Innerhalb von fünf Tagen konnte die Sauerstoffgabe reduziert werden, und nach 15 Tagen wurden die Patienten mit verbesserten Lymphozytenzahlen und CRP‐Werten entlassen. Unerwünschte Ereignisse wurden nicht beobachtet. Die Ergebnisse dieser kleinen nichtkontrollierten Studie müssen noch in größeren kontrollierten Studien bestätigt werden. Auf jeden Fall scheint IL‐6, soweit wir wissen, für den Verlauf einer SARS‐CoV‐2‐Infektion von Bedeutung zu sein.
IL‐1α/β ist ein weiteres Angriffsziel, das für Makrophagen‐assoziierte Entzündungen relevant ist. Von neun Patienten mit akuter COVID‐19‐Pneumonie, die mit dem humanen IL‐1‐Rezeptor‐Antagonisten Anakinra behandelt wurden, verbesserten sich alle bis auf einen. Sie waren vom 3. Tag an fieberfrei, die CRP‐Werte fielen ab und die Patienten erreichten ein gutes klinisches Outcome 36. Dies steht im Einklang mit früheren Ergebnissen bei septischen Patienten 37. Studien zur Hemmung von IL‐1 bei Patienten mit COVID‐19 laufen derzeit 38.
Berichte über eine Anti‐TNF‐Behandlung liegen zwar noch nicht vor, aber die ersten klinischen Studien laufen. Allerdings wiesen COVID‐19‐Patienten mit vorbestehender entzündlicher Darmerkrankung (IBD) bessere Behandlungsergebnisse auf, wenn sie statt Kortikosteroiden eine Anti‐TNF‐Therapie erhielten 39.
Es scheint also so zu sein, dass eine spezifische Blockade der inflammatorischen Zytokine IL‐1, IL‐6 und TNF als Teil des Zytokinsturms bei COVID‐19‐Patienten mit Lungenentzündung vorteilhaft ist.
SARS‐CoV‐2/COVID‐19 und Typ‐1/Typ‐17‐Immunität (IL‐12/IL‐23, IL‐17, IL‐36)
Bezüglich T‐Zell‐vermittelter Immunität induziert IL‐12 vorwiegend Th1‐Immunreaktionen, während IL‐23 zur Th17‐Immunität beiträgt 40. Verschiedene Viren, darunter SARS‐CoV‐1, das 2003 eine Pandemie auslöste, können IL‐12 induzieren 41, 42. Der Vergleich von 50 COVID‐19‐Patienten mit acht gesunden Kontrollen ergab einen Anstieg vieler inflammatorischer Zytokine und Chemokine, darunter IL‐12p70 und IL‐12p40. Die Hochregulation war unabhängig von der Schwere der Erkrankung und änderte sich bis zum 15. Tag nicht 26. In einer anderen Studie wurden bei 60 COVID‐19‐Patienten im Vergleich zu vier gesunden Kontrollen keine erhöhten Serumspiegel von IL‐12p70 festgestellt 19. Die Heterogenität der COVID‐19‐Patienten und die geringe Anzahl der Kontrollen limitierten beide Studien.
In einer Transkriptomanalyse war IL‐23 in peripheren mononukleären Blutzellen (PBMC) von COVID‐19‐Patienten tendenziell herunterreguliert 43. Insgesamt führt eine Infektion mit SARS‐CoV‐2 wahrscheinlich zu erhöhten IL‐12‐ und IL‐23‐Serumkonzentrationen.
Th17‐Zellen, Tc17‐Zellen, manche angeborenen Lymphozyten wie ILC3 und natürliche Killer‐T‐Zellen sowie myeloische Zellen sind Quellen von IL‐17 44, 45, 46. IL‐17 trägt zu antiinfektiösen Reaktionen und zur Zytokin‐ und Chemokinproduktion bei, insbesondere in Epithelien, einschließlich der Lunge 47. Der Einbau von IL‐17 in einige große Viren, wie HSV, legt eine Funktion bei antiviraler Immunität nahe, und es wurden virusspezifische IL‐17‐produzierende T‐Zellen nachgewiesen 48. IL‐17 verstärkt jedoch die durch das Respiratory‐Syncytial‐Virus induzierte Produktion neutrophilen‐attrahierender Chemokine, wodurch die Rekrutierung von Neutrophilen in die Lunge erhöht wird 49. Eine Studie mit 41 COVID‐19‐Patienten zeigte eine signifikante Erhöhung der IL‐17‐Serumkonzentration bei Patienten auf der Intensivstation (ICU) im Vergleich zu gesunden Probanden, aber nicht zu Nicht‐ICU‐Patienten 19. Der Vergleich von 123 COVID‐19‐Patienten mit leichten gegenüber schweren Symptomen zeigte keine signifikanten Unterschiede 50. Wie bei IL‐12 und IL‐23 scheint die Serumkonzentration von IL‐17 bei COVID‐19‐Patienten zu steigen, doch muss dies in größeren Studien validiert werden.
Transkriptomanalysen aus bronchoalveolärer Lavageflüssigkeit (BAL) und peripheren mononukleären Blutzellen (PBMC) einer kleinen Zahl von COVID‐19‐Patienten und gesunden Kontrollpersonen identifizierten Komplementaktivierung und humorale Immunreaktionen als sehr stark differenziell regulierte Signalwege 43. Im Gegensatz zu manchen anderen Zytokinen, wurden Moleküle des IL‐36‐Signalwegs nicht unterschiedlich exprimiert. Obwohl diese Daten noch nicht validiert wurden, scheint IL‐36 von COVID‐19 nicht beeinflusst zu werden.
SARS‐CoV‐2/COVID‐19 und Typ‐2‐Immunität (IL‐4, IL‐13, IL‐5, IL‐31, IgE)
Typ‐2‐Zytokine wie IL‐4, IL‐13, IL‐5 und IL‐31 sowie IgE sind bei SARS‐CoV‐2‐Infektionen noch kaum untersucht worden. Theoretisch könnten sie, je nach Infektionsphase, COVID‐19‐assoziierten Entzündungen sogar entgegenwirken. Sie könnten die frühe Immunabwehr, wie bei der atopischen Dermatitis (AD) oder einer Infektion mit Herpesviren, schwächen oder spätere Phasen modulieren. Typ‐2‐Zytokine sind nicht Teil der Hyperinflammation in der Lunge von COVID‐19‐Patienten 30, können aber den Zytokinsturm modulieren, da diese Mediatoren Immunantworten vom Typ 1 und Typ 17 hemmen können 51. Unter den hospitalisierten Patienten mit COVID‐19 gibt es nur wenige Patienten mit einer allergischen Diathese 52. Solange keine verlässlichen Registerdaten vorliegen, könnten uns Daten über zielgerichtete Therapien, ihre Nebenwirkungen und Sicherheitsaspekte bei anderen viralen Infektionen helfen, das mögliche Risiko bei SARS‐CoV‐2‐infizierten Patienten abzuschätzen.
Auch zu SARS‐CoV‐2‐Infektionen bei Patienten mit AD, einer prototypischen IL‐4/IL‐13‐vermittelten Typ‐2‐Krankheit, liegen noch keine Daten vor. Infolge der Typ‐2‐Immundominanz leiden AD‐Patienten häufig an Virusinfektionen 53. Klinische Studien legen nahe, dass Dupilumab die Kontrolle von Atemwegsinfektionen nicht verschlechtert, sondern vielmehr die Kontrolle von Herpesvirusinfektionen verbessert 54. Dementsprechend zeigten zwei italienische Studien, dass AD‐Patienten unter Dupilumab‐Therapie kein erhöhtes Risiko hatten, einer SARS‐CoV‐2‐Infektion zu erliegen 55, 56. Hinsichtlich der IL‐13‐Blockade (Tralokinumab, Lebrikizumab) deuten die wenigen verfügbaren Daten ebenfalls nicht auf eine Beeinflussung der Viruserkrankung hin 57, 58.
Eosinophile sind charakteristisch für Typ‐2‐Erkrankungen; ihre Reduktion durch Hemmung der IL‐5‐Funktion (Mepolizumab, Benralizumab, Reslizumab) bei eosinophilem Asthma führt zur Kontrolle der Erkrankung und hilft, Steroide einzusparen. Es wurde ein positiver Effekt der IL‐5‐Hemmung auf den Verlauf von COVID‐19 bei Patienten mit Asthma postuliert 59. Wie IL‐4 und IL‐13 wurde IL‐5 keine wesentliche Rolle bei COVID‐19 zugeschrieben.
Ein weiteres Typ‐2‐Zytokin, das bei Patienten mit starkem Juckreiz gehemmt werden kann, ist IL‐31. Innerhalb der limitierten Patientenkohorte, die mit Nemolizumab behandelt wurde, gab es kein erhöhtes Risiko für Infektionen der oberen Atemwege, jedoch traten gastrointestinale und muskuloskelettale Nebenwirkungen auf 60. Die Entwicklung eines peripheren Ödems unter Therapie wird bislang nicht gut verstanden 61.
Eine zielgerichtete Therapie von IgE mit Omalizumab bei Asthmapatienten oder Patienten mit chronischer spontaner Urtikaria führte nicht zu einer Zunahme von Infektionen der oberen Atemwege 62. IgE ist unter normalen Bedingungen niedrig oder nicht nachweisbar, und es wird als Reaktion auf eine SARS‐CoV‐2‐Infektion nicht sezerniert.
Wissenschaftliche Evidenz dafür, dass Typ‐2‐Mediatoren bei Patienten mit entsprechenden Erkrankungen wegen der SARS‐CoV‐2‐Pandemie nicht inhibiert werden sollten, liegt nicht vor.
SARS‐CoV‐2/COVID‐19 und B‐Zell‐Immunität
Der Anti‐CD20‐Antikörper Rituximab, der zur Behandlung von Pemphigus vulgaris und B‐Zell‐Lymphomen zugelassen ist, führt zu einer mehrmonatigen Depletion von B‐Lymphozyten und damit zur Abschwächung der humoralen Immunantwort. Rituximab könnte daher für Patienten, die mit SARS‐CoV‐2 infiziert sind, problematisch sein. Andererseits könnte die Produktion hoher Konzentrationen von SARS‐CoV‐Anti‐Spike‐IgG zu einem schwereren Verlauf von COVID‐19 beitragen 63, der bei einer Depletion von B‐Zellen vermieden werden könnte 63. Zwei zuvor mit Rituximab behandelte Patienten, die an Granulomatose mit Polyangiitis leiden, beobachteten eine recht schnelle Abheilung von COVID‐19 64, 65. Da systematische Studien zu B‐Zell‐Depletion bei COVID‐19 nicht verfügbar sind, muss die Anwendung von Rituximab während der Pandemie in jedem einzelnen Fall sehr sorgfältig erwogen werden.
SARS‐CoV‐2/COVID‐19 und Immuncheckpoint‐Regulatoren
Immuncheckpoint‐Regulatoren können konstitutiv exprimiert werden, werden jedoch häufiger durch TCR‐Bindung oder Zytokine induziert 66, 67. Sie regulieren wichtige Gleichgewichte des Immunsystems, deren gezielte Modulation antitumorale Therapien revolutioniert hat 68, 69. Obwohl HIV‐ oder HBV‐Infektionen zu erhöhter und anhaltender PD‐1‐Expression auf T‐Zellen führen 70, scheinen Immuncheckpoint‐Inhibitoren (ICI) bei Patienten mit chronischer Virushepatitis oder HIV‐Infektion sicher und wirksam zu sein 71, 72, 73. Es gibt keine Daten zum Einfluss von COVID‐19 auf die Expression oder Funktion von CTLA‐4, PD‐1 oder PD‐L1. In einer Kohorte von Patienten mit Lungenkrebs wurde kein Zusammenhang zwischen einer früheren Exposition gegenüber einer PD‐1‐Blockade und dem Schweregrad einer SARS‐CoV‐2‐Infektion gefunden 74. Bei einem mit PD‐1‐Inhibitoren behandelten Melanom‐Patienten trat kein besonders schwerer Verlauf von COVID‐19 auf 75.
Eine noch nicht begutachtete retrospektive Analyse von Diao et al. in MedRxiV (Preprintserver) fand eine signifikante Lymphopenie bei 522 chinesischen Patienten mit COVID‐19, was frühere Befunde bei einem einzelnen chinesischen Patienten 76 und in einer griechischen Kohorte 77 bestätigt. In der Studie von Diao et al. war die PD‐1‐Expression durch periphere T‐Zellen bei 14 SARS‐CoV‐2‐infizierten Patienten im Vergleich zu drei gesunden Spendern signifikant höher und schien mit dem Schweregrad der Erkrankung zu korrelieren. Eine im Laufe der Zeit zunehmende PD‐1‐ und TIM‐3‐Expression auf T‐Zellen korrelierte mit dem Schweregrad von COVID‐19 bei drei Patienten. Obwohl diese Daten vorläufig sind, stimmen sie mit der Zunahme von Immuncheckpoint‐Molekülen bei Virusinfektionen überein.
Da Virusinfektionen die Expression von Checkpoint‐Molekülen steigern und ICI – ähnlich wie COVID‐19 – einen Zytokinsturm (Zytokinfreisetzungssyndrom) auslösen können 78, ist es denkbar, dass ICI den Verlauf von COVID‐19 verschlechtern oder umgekehrt COVID‐19 die (erwünschten und unerwünschten) Effekte von ICI verstärken könnte 78, 79. Interessanterweise kann der entweder durch COVID‐19 oder ICI induzierte Zytokinsturm erfolgreich mit Tocilizumab (anti‐IL‐6R) behandelt werden 80, 81. Somit weisen der Wirkmechanismus von ICI und COVID‐19 bemerkenswerte Ähnlichkeiten auf, wobei beide zu einer unerwünschten Immunhyperaktivierung führen.
SARS‐CoV‐2/COVID‐19 und durch orale Medikamente hemmbare Zielmoleküle (JAK, PDE4, Calcineurin)
Patienten, die mit niedermolekularen Inhibitoren immunologischer Signalwege behandelt werden, könnten in der gegenwärtigen Pandemie anfällig sein. Es fehlen jedoch direkte Hinweise darauf, ob sie ein höheres Risiko haben, an SARS‐CoV‐2 zu erkranken, einen schwereren Krankheitsverlauf zu entwickeln oder eine nichtprotektive antivirale Immunantwort hervorzurufen. Es ist auch denkbar, dass einige kleine Moleküle den Zytokinsturm bei COVID‐19‐Patienten abschwächen können.
Da JAK‐Inhibitoren (JAKi) die Signalübertragung vieler Zytokinrezeptoren verhindern, zählen Infektionen zu den häufigen schweren unerwünschten Ereignissen und schwere Herpes‐zoster‐Verläufe sind eine substanzklassenspezifische Nebenwirkung der JAK‐Inhibitoren 82. Tofacitinib (JAK1/3‐Inhibitor), Baricitinib und Upadacitinib (beide JAK1/2‐Inhibitoren) sind derzeit zugelassene Medikamente 83. Die JAK2‐Hemmung scheint das Eindringen von SARS‐CoV‐2 in Zellen zu blockieren und kann so die Infektivität in Lungenzellen verringern 84. Viele Zytokine werden während eines COVID‐19‐assoziierten Zytokinsturms über den JAK‐STAT‐Signalweg freigesetzt 84. Darüber hinaus tragen Th17‐Zellen wahrscheinlich zu diesem Zytokin‐Sturm bei, der zu Gewebeschäden und Lungenödemen führt. Obwohl die JAK‐Hemmung Entzündungsreaktionen abschwächen und die Hämatopoese beeinträchtigen kann, können Therapien mit JAKi unerwünschte Entzündungsreaktionen verringern. Da JAKi das akute Atemnotsyndrom (ARDS) bei COVID‐19‐Patienten lindern könnten, werden derzeit mehrere Phase‐II‐Studien durchgeführt.
Die Immunsuppressiva Cyclosporin A (CsA) und Tacrolimus wirken durch Hemmung der Calcineurinphosphatase recht selektiv auf T‐Zellen. Zu ihrer Wirkung bei COVID‐19‐Patienten liegen keine Daten vor 85. Interessanterweise zeigte CsA in vitro antivirale Aktivität. Es hemmt die Replikation einiger RNA‐Viren, darunter Betacoronaviridae, die Cyclophiline als Chaperone und NFAT‐Signale nutzen. Diese Daten führten zu der Annahme, dass CsA SARS lindern könnte. Es ist unklar, ob die antivirale Aktivität die Verstärkung einer Immunantwort gegen Coronaviren beeinträchtigen und damit die Anfälligkeit für zukünftige Infektionen erhöhen könnte. Diese Immunsuppressiva können wahrscheinlich nur dann bei SARS‐CoV‐2‐infizierten Patienten erfolgreich sein, wenn keine unkontrollierte Virusvermehrung stattfindet. Tacrolimus wird derzeit in einer Phase‐III‐Studie gegen COVID‐19‐Lungenschäden getestet.
Apremilast ist ein PDE4‐Inhibitor, der die zellulären zyklischen AMP‐Spiegel erhöht und dadurch die Produktion inflammatorischer Zytokine in Leukozyten und Epithelzellen kontrolliert. Es führt nicht zu einer offensichtlichen Immunsuppression, und schwere Virusinfektionen sind keine häufigen unerwünschten Ereignisse. Obwohl aktuelle Daten fehlen, könnte Apremilast aufgrund seines insgesamt geringen Risikos einer schweren immunologischen Beeinträchtigung ein vergleichsweise günstiges Risikoprofil bei Patienten mit chronischen Entzündungskrankheiten in der aktuellen COVID19‐Pandemie aufweisen.
SARS‐CoV‐2/COVID‐19 und Malariamittel
Hydroxychloroquin (HCQ) und Chloroquin (CQ) reichern sich in Lysosomen an, wo sie Endozytose, Autophagie und damit die (Auto)Antigenpräsentation durch MHC‐Klasse II hemmen. Sie hemmen auch die Bindung von TLR7 und TLR9 an die entsprechenden Liganden (DNA, RNA), die Typ‐I‐Interferon‐Reaktion, die Zytokin‐ (IL‐1, TNF, IL‐6) und Chemokin‐Synthese (CCL4) und sie regulieren CD40L herunter 86.
Mehrere Studien zeigten die antivirale In‐vitro‐Aktivität von Malariamitteln. Während des SARS‐Ausbruchs 2003, der durch SARS‐CoV‐1 verursacht wurde, wurde CQ als potenzieller Wirkstoff vorgeschlagen 87. Später wurde gezeigt, dass Antimalariamittel auch die Glykosylierung von ACE2, dem zellulären Rezeptor von SARS‐CoV‐1 (und SARS‐CoV‐2), beeinträchtigen und dadurch das Eindringen des Virus in die Zelle hemmen 88. Chloroquin ist in vitro gegen SARS‐CoV‐2 aktiv 89, und es wurde von chinesischen Experten trotz fehlender klinischer Daten für die Behandlung der COVID‐19‐assoziierten Pneumonie empfohlen 90. Eine kleine nichtkontrollierte französische Studie kombinierte HCQ mit Azithromycin und berichtete über eine signifikante Verringerung der Viruslast 91. Eine doppelt verblindete randomisierte Studie aus Brasilien wurde nach der Rekrutierung von 81 der vorgesehenen 440 Patienten wegen schwerer unerwünschter Ereignisse, darunter viele Todesfälle, vorzeitig abgebrochen 92. Eine Beobachtungsstudie mit 1376 COVID‐19‐Patienten zeigte keinen Unterschied zwischen HCQ‐behandelten und unbehandelten Patienten hinsichtlich des primären Endpunkts, Intubationsfreiheit oder Tod 93. Angesichts dieser Daten zog das Leitzentrum seinen Vorschlag zurück, COVID‐19‐Patienten mit HCQ zu behandeln.
Die U.S. Food and Drug Administration hat eine emergency use authorization (EUA) erteilt, um CQ und HCQ für die Behandlung von Erwachsenen und Teenagern zur Verfügung zu stellen, wenn eine Teilnahme an klinischen Studien nicht möglich ist 94, diese Genehmigungen jedoch später widerrufen, da es auf der Grundlage neuerer Daten nun als unwahrscheinlich gilt, dass CQ und HCQ bei der Behandlung von COVID‐19 wirksam sind (https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and.; veröffentlicht am 15. Juni 2020; Zugriff am 21. Juni 2020). Die Europäische Arzneimittel‐Agentur (EMA) empfahl CQ und HCQ im Zusammenhang mit COVID‐19 nur in klinischen Studien oder innerhalb nationaler Notfallverwendungsprogramme 95. Ein kürzlich erschienener Leitartikel über die Verwendung von HCQ gegen COVID‐19 kam zu dem Schluss, dass die gegenwärtige Datenlage „ein gewisses Maß an Skepsis gegenüber den enthusiastischen Behauptungen über Chloroquin hervorrufen und vielleicht dazu dienen sollte(n), die übermäßige Verwendung einzudämmen“ 96.
Es erscheint vernünftig, CQ oder HCQ in zugelassenen oder seit langem etablierten Off‐Label‐Indikationen bei Bedarf fortzusetzen. Obwohl die in der Dermatologie verschriebenen Dosen in der Regel niedriger sind als in COVID‐19‐Studien, sollten Angehörige der Gesundheitsberufe ihre Patienten dennoch sorgfältig auf unerwünschte Ereignisse überwachen und Nebenwirkungen den Zulassungsbehörden melden 86, 97.
SARS‐CoV‐2/COVID‐19 und allgemeine Immunsuppression
Bei Patienten mit immunvermittelten Erkrankungen stellt sich die Frage, ob immunsuppressive Therapien im Zusammenhang mit SARS‐CoV‐2 beibehalten, reduziert oder eingestellt werden sollten. Natürlich gibt es keine allgemeine Antwort, allerdings drei grundsätzliche Überlegungen: Erstens könnte die Immunsuppression die Infektionsabwehr stören und damit nachteilig sein. Zweitens könnte die Immunsuppression die Behandlung durch Unterdrückung der COVID‐19‐assoziierten Immunpathologie unterstützen 30. Drittens könnte ein Absetzen der Behandlung eine Exazerbation der behandelten Grunderkrankung auslösen, was schädlich wäre 98. Es gibt keine Hinweise auf ein erhöhtes Risiko für immunsupprimierte Patienten durch COVID‐19.
COVID‐19 hatte keinen Einfluss auf die Hospitalisierung oder Todesraten von Psoriasis‐Patienten 99, 100. Es gibt jedoch auch keine Evidenz für einen Schutz immunsupprimierter Patienten vor einer COVID‐19‐assoziierten Immunpathologie, wie für Nierentransplantierte berichtet wurde 101. Daher lassen sich die aktuellen Empfehlungen für klassische Immunsuppressiva wie folgt zusammenfassen: i) Bei Patienten ohne SARS‐CoV‐2‐Infektion kann die immunsuppressive Therapie fortgesetzt werden; ii) in milden oder asymptomatischen COVID‐19‐Fällen sollte über die Fortsetzung der Therapie von Fall zu Fall entschieden werden; iii) bei COVID‐19‐Patienten mit schweren Symptomen ist das Absetzen immunsuppressiver Medikamente ratsam; die endgültige Entscheidung sollte jedoch vom behandelnden Arzt und dem Team der Intensivstation getroffen werden.
Glukokortikosteroide: Es gibt keine Evidenz dafür, dass Patienten mit einer SARS‐CoV‐2‐Infektion von Glukokortikosteroiden (GC) profitieren 31, 102. Beispielsweise war bei COVID‐19‐Patienten, die wegen immunvermittelter entzündlicher Erkrankungen hospitalisiert wurden, der Verbrauch oraler GC höher 103. Eine retrospektive Analyse von COVID‐19‐Patienten, die Methylprednisolon erhielten, zeigte kein vorteilhaftes klinisches Ergebnis 101. Insgesamt scheint es, dass systemisch verabreichte GC den Verlauf von COVID‐19 eher negativ beeinflussen. Daher wird eine GC‐Behandlung einer schweren SARS‐CoV‐2‐Infektion nur im Rahmen klinischer Studien 101, 104 oder bei Indikation innerhalb eines notwendigen Therapieschemas empfohlen 105.
Methotrexat: Die Bedeutung von Methotrexat für den klinischen Verlauf von COVID‐19 ist unbekannt. Während eine Fallstudie bei Patienten mit immunvermittelten entzündlichen Erkrankungen ergab, dass diejenigen, die Methotrexat einnahmen, häufiger ins Krankenhaus eingewiesen werden mussten 103, kommt eine systematische Übersicht – die auch Berichte über SARS‐CoV‐1 und MERS enthält – zu dem Schluss, dass es keine definitive Evidenz für eine Kontraindikation von Methotrexat bei Autoimmunerkrankungen gibt 100, 106.
Mycophenolatmofetil (MPM) / Mycophenolsäure (MPA): In vitro zeigte MPA antivirale Aktivität gegen MERS‐CoV und SARS‐CoV‐1 100, 107, 108, war aber in Tierversuchen nachteilig 109. Ein Psoriasis‐Patient erfuhr unter MPM‐Behandlung eine sehr milde Form von COVID‐19, was darauf hindeutet, dass die MPM‐Therapie fortgesetzt werden kann 110.
Azathioprin: Bei Nierentransplantatempfängern, die mit SARS‐CoV‐2 infiziert waren, hatten Patienten, die Azathioprin einnahmen, kein höheres Risiko für eine schwere Erkrankung 98.
Dapson und Colchicin: Beide Wirkstoffe können den Zytokinsturm und die Neutrophilen‐Chemotaxis in der Lunge hemmen 111, 112. Es liegen jedoch keine klinischen Studien vor, die diese Hypothese stützen.
Dimethylfumarat: Es gibt auch Spekulationen über einen potenziellen therapeutischen Nutzen von Dimethylfumarat wegen seiner Fähigkeit, oxidativen Stress abzufangen. Auch hier fehlen Beweise zur Untermauerung dieser Hypothese.
SARS‐CoV‐2/COVID‐19 und Neutrophilen‐vermittelte angeborene Immunität
Neutrophile als Teil des angeborenen Immunsystems können NETs (neutrophil extracellular traps) produzieren 113. Eine übermäßige NETose kann schädlich sein, da NET‐Komponenten zytotoxisch, immunogen und pro‐thrombotisch sind 114, 115. Sie können bei verschiedenen Krankheiten Organe schädigen 38, 116, 117, die auch bei schwerem COVID‐19 betroffen sind. Neutrophile tragen direkt oder indirekt zur Freisetzung von Zytokinen wie IL‐1 oder IL‐6 118 bei und fördern so den COVID‐19‐Zytokinsturm. Aktivierte Neutrophile und NETs könnten also zu COVID‐19 beitragen. Tatsächlich ist Neutrophilie ein Prädiktor für einen schlechteren Verlauf 25, und bei Patienten, die an COVID‐19 starben, wurden schwere neutrophilenreiche Infiltrate festgestellt 38, 119.
Bei Atemwegserkrankungen wie zystischer Fibrose können NETs Schleimverdickung und bakterielle Superinfektionen begünstigen 120. Inhalative DNase I verbessert die Lungenfunktion durch Abbau extrazellulärer DNA 121 und könnte eine einfache, wirksame und sichere Ergänzung zur Therapie von COVID‐19 sein 122.
Darüber hinaus verbinden NETs Immunpathologie und Thrombose. Sie bauen Antithrombin III ab, aktivieren Thrombozyten und den Kontaktweg der Gerinnung. Blutgerinnsel treten bei 20–30 % der Patienten mit COVID‐19 auf 123. Diese Patienten sind nicht nur anfällig für große thromboembolische Ereignisse, sondern auch für mikrovaskuläre Thrombosen in vielen Organen 38, 124. In Tiermodellen löste die systemische DNase‐I‐Behandlung NETs auf und stellte die Organperfusion wieder her 125, was entsprechende Spekulationen in COVID‐19 nährt. Daher könnte eine gezielte Behandlung von Neutrophilen und NETs möglicherweise zu einer Verbesserung von COVID‐19 führen. Zusätzlich zu der oben erwähnten DNAse I wird derzeit eine Reihe weiterer Verbindungen entwickelt, die in Zukunft schädliche Neutrophilen‐Funktionen unterdrücken könnten.
Schlussfolgerungen
Nach unserem derzeitigen Wissensstand gibt es keinen evidenzbasierten Grund, notwendige immunmodulatorische Therapien bei Patienten mit entzündlichen Erkrankungen oder Tumoren während der SARS‐CoV‐2‐Pandemie einzustellen oder nicht zu beginnen. Aber natürlich müssen wir – wie es oft in unsicheren Situationen mit unzureichenden und sich ständig weiterentwickelnder Datenlage der Fall ist – vorsichtig und wachsam sein. Wie das Beispiel der 4‐Aminochinoline zeigt, können sich die Perspektiven schnell ändern. Jedenfalls gibt es keine allgemeine Empfehlung zur Einstellung immunmodulatorischer Therapien. Einige Zytokin‐Inhibitoren oder andere Immunmodulatoren könnten sogar einen positiven Einfluss auf den Verlauf von COVID‐19 haben. Je nach spezifischer Therapie müssen die möglichen Wechselwirkungen mit SARS‐CoV‐2‐induzierten Effekten differenziert betrachtet und oft Einzelfallentscheidungen getroffen werden. Natürlich ist unser Wissen im Fluss, und unsere hier dargestellten Überlegungen basieren auf dem sich derzeit abzeichnenden Muster immunologischer Veränderungen bei COVID‐19. Einige unserer Aussagen sind daher als vorläufig beziehungsweise als Meinungsäußerungen zu betrachten. Wir müssen aufmerksam bleiben, und wir möchten unsere Kollegen ermutigen, ihre Beobachtungen bei Patienten, die mit SARS‐CoV‐2 infiziert sind, kritisch zu bewerten.
Abkürzungen
- COVID‐19
Coronavirus Disease 2019
- CTLA‐4
Cytotoxic T‐Lymphocyte‐Associated Protein 4
- HBV
Hepatitis‐B‐Virus
- HIV
Human Immunodeficiency Virus (Humanes Immundefizienz‐Virus)
- ICI
Immuncheckpoint‐Inhibitor
- Ig
Immunglobulin
- IL
Interleukin
- ILC
Innate Lymphoid Cell (angeborene lymphoide Zelle)
- JAK
Janus‐Kinase
- JAKi
Janus‐Kinase‐Inhibitor
- NET
Neutrophil Extracellular Trap
- NF‐κB
Nuclear Factor Kappa‐Light‐Chain‐Enhancer of Activated B‐Cells
- NFAT
Nuclear Factor of Activated T Cells
- PBMC
Mononukleäre Zelle des peripheren Blutes
- PD‐1
Programmed Cell Death Protein‐1
- PD‐L1
Programmed Cell Death Ligand‐1
- PDE4
Phosphodiesterase 4
- SARS
Severe Acute Respiratory Syndrome (schweres akutes respiratorisches Syndrom)
- SARS‐CoV‐2
Severe Acute Respiratory Syndrome Coronavirus 2
- Tc
Cytotoxic T Cell (zytotoxische T‐Zelle)
- TCR
T Cell Receptor (T‐Zell‐Rezeptor)
- Th
Helper T Cell (Helfer‐T‐Zelle)
- TIM‐3
T‐Cell Immunoglobulin and Mucin‐Domain Containing‐3
- TLR
Toll‐Like Receptor
- TNF
Tumor Necrosis Factor (Tumor‐Nekrosefaktor)
Interessenkonflikt
Keiner.
Literatur
- 1. Zhu N, Zhang D, Wang W et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020; 382(8): 727–33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Zhou P, Yang XL, Wang XG et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020; 579(7798): 270–3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. WHO situation reports . Available from https://www.who.int/docs/default‐source/coronaviruse/situation‐reports/20200520‐covid‐19‐sitrep‐121.pdf?sfvrsn=c4be2ec6_2 [Last accessed May 10, 2020].
- 4. He X, Lau E HY, Wu P et al. Temporal dynamics in viral shedding and transmissibility of COVID‐19. Nat Med 2020; 26(5): 672–5. [DOI] [PubMed] [Google Scholar]
- 5. Linton NM, Kobayashi T, Yang Y et al. Incubation period and other epidemiological characteristics of 2019 novel coronavirus infections with right truncation: a statistical analysis of publicly available case data. J Clin Med 2020; 9: E538. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Zhang J, Litvinova M, Wang W et al. Evolving epidemiology and transmission dynamics of coronavirus disease 2019 outside Hubei province, China: a descriptive and modelling study. Lancet Infect Dis 2020; S1473‐3099(20)30230‐9. doi: 10.1016/S1473-3099(20)30230-9 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Woelfel R, Corman VM, Guggemos W et al. Virological assessment of hospitalized patients with COVID‐2019. Nature 2020; doi: 10.1038/s41586-020-2196-x [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 8. Okba NMA, Müller MA, Li W et al. Severe acute respiratory syndrome coronavirus 2−specific antibody responses in coronavirus disease 2019 patients. Emerg Infect Dis 2020; 26(7): doi: 10.3201/eid2607.200841 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Zhao J, Yuan Q, Wang H et al. Antibody responses to SARS‐CoV 2 in patients of novel coronavirus disease 2019. Clin Infect Dis 2020; ciaa344 DOI: 10.1093/cid/ciaa344 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Guo L, Ren L, Yang S et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID‐19). Clin Infect Dis 2020; ciaa310. doi: 10.1093/cid/ciaa310 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Bloch EM, Shoham S, Casadevall A et al. Deployment of convalescent plasma for the prevention and treatment of COVID‐19. J Clin Invest 2020; 138745. doi: 10.1172/JCI138745 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Casadevall A, Pirofski L. The convalescent sera option for containing COVID‐19. J Clin Invest 2020; 130: 1545–8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Duan K, Liu B, Li C et al. Effectiveness of convalescent plasma therapy in severe COVID‐19 patients. Proc Natl Acad Sci USA 2020; 117(17): 9490–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Shen C, Wang Z, Zhao F et al. Treatment of 5 critically ill patients with COVID‐19 with convalescent plasma. JAMA 2020; 323(16): 1582–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Roback JD, Guarner J. Convalescent plasma to treat COVID‐19: possibilities and challenges. JAMA 2020; doi: 10.1001/jama.2020.4940 [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 16. Walls AC, Xiong X, Park YJ et al. Unexpected receptor functional mimicry elucidates activation of coronavirus fusion. Cell 2019; 176(5): 1026–39. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Matricardi PM, Dal Negro RW, Nisini R. The first, holistic immunological model of COVID‐19: implications for prevention, diagnosis, and public health measures. Pediatric Allergy Immunol 2020; 10.1111/pai.13271. doi: 10.1111/pai.13271 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Wan Y, Shang J, Sun S et al. Molecular mechanism for antibody‐dependent enhancement of coronavirus entry. J Virol 2020; 94(5): e02015–19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Huang C, Wang Y, Li X et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395(10223): 497–506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Zhou F, Yu T, Du R et al. Clinical course and risk factors for mortality of adult inpatients with COVID‐19 in Wuhan, China: A retrospective cohort study. Lancet 2020; 395(10229): 1054–62. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Panda S, Ding JL. Natural antibodies bridge innate and adaptive immunity. J Immunol 2015; 194(1): 13–20. [DOI] [PubMed] [Google Scholar]
- 22. Scorza M, Liguori R, Elce A et al. Biological role of mannose binding lectin: from newborns to centenarians. Clin Chim Acta 2015; 451(Pt1): 78–81. [DOI] [PubMed] [Google Scholar]
- 23. Fung TS, Liu DX. Human coronavirus: host‐pathogen interaction. Annu Rev Microbiol 2019; 73: 529–57. [DOI] [PubMed] [Google Scholar]
- 24. Ye Q, Wang B, Mao J. The pathogenesis and treatment of the “cytokine storm” in COVID‐19. J Infect 2020; 80(6): 607–13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Wang D, Hu B, Hu C et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus‐infected pneumonia in Wuhan, China. JAMA 2020; 323(11): 1061–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Yang Y, Shen C, Li J et al. Plasma IP‐10 and MCP‐3 levels are highly associated with disease severity and predict the progression of COVID‐19. J Allergy Clin Immunol 2020; S0091‐6749(20)30576‐5. doi: 10.1016/j.jaci.2020.04.027 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Schett G, Sticherling M, Neurath MF. COVID‐19: risk for cytokine targeting in chronic inflammatory diseases? Nat Rev Immunol 2020; 20(5): 271–2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Gordon DE, Jang GM, Bouhaddou M et al. A SARS‐CoV‐2 protein interaction map reveals targets for drug repurposing. Nature 2020. doi: 10.1038/s41586-020-2286-9 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Qin C, Zhou L, Hu Z et al. Dysregulation of immune response in patients with COVID‐19 in Wuhan, China. Clin Infect Dis 2020; ciaa248. doi: 10.1093/cid/ciaa248 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Mehta P, McAuley DF, Brown M et al. COVID‐19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395: 1033–4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Felsenstein S, Herbert JA, McNamara PS, Hedrich CM. COVID‐19: Immunology and treatment options. Clin Immunol 2020; 215: 108448. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32. Guzik TJ, Mohiddin SA, Dimarco A et al. COVID‐19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res 2020; cvaa106. doi: 10.1093/cvr/cvaa106 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Liu F, Li L, Xu M et al. Prognostic value of interleukin‐6, C‐reactive protein, and procalcitonin in patients with COVID‐19. J Clin Virol 2020; 127: 104370. doi: 10.1016/j.jcv.2020.104370 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Chen X, Zhao B, Qu Y et al. Detectable serum SARS‐CoV‐2 viral load (RNAaemia) is closely correlated with drastically elevated interleukin 6 (IL‐6) level in critically ill COVID‐19 patients. Clin Infect Dis 2020; ciaa449. doi: 10.1093/cid/ciaa449 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35. Xu X, Han M, Li T et al. Effective treatment of severe COVID‐19 patients with tocilizumab. Proc Natl Acad Sci USA 2020; 117(20): 10970–5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Aouba A, Baldolli A, Geffray L et al. Targeting the inflammatory cascade with anakinra in moderate to severe COVID‐19 pneumonia: case series. Ann Rheum Dis 2020; annrheumdis‐2020‐217706. doi: 10.1136/annrheumdis-2020-217706 [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 37. Shakoory B, Carcillo JA, Chatham WW et al. Interleukin‐1 receptor blockade is associated with reduced mortality in sepsis patients with features of macrophage activation syndrome: reanalysis of a prior phase III trial. Crit Care Med 2016; 44: 275–81. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. Barnes BJ, Adrover JM, Baxter‐Stoltzfus A et al. Targeting potential drivers of COVID‐19: Neutrophil extracellular traps. J Exp Med 2020; 217 (6): e20200652. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Tursi A, Vetrone LM, Papa A. Anti‐TNFα agents in inflammatory bowel disease and course of COVID‐19. Inflamm Bowel Dis 2020; izaa114. doi: 10.1093/ibd/izaa114 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40. Schön MP, Erpenbeck L. The interleukin‐23/interleukin‐17 axis links adaptive and innate immunity in psoriasis. Front Immunol 2018. Jun 15; 9: 1323. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41. Guo Y, Cao W, Zhu Y. Immunoregulatory functions of the IL‐12 family of cytokines in antiviral systems. Viruses 2019; 11(9): 772. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42. Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol 2017; 39(5): 529–39. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43. Xiong Y, Liu Y, Cao L et al. Transcriptomic characteristics of bronchoalveolar lavage fluid and peripheral blood mononuclear cells in COVID‐19 patients. Emerg Microbes Infect 2020; 9(1): 761–70. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44. McGeachy MJ, Cua DJ, Gaffen SL. The IL‐17 family of cytokines in health and disease. Immunity 2019; 50(4): 892–906. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45. Lauffer F, Eyerich K, Boehncke WH et al. Cytokines of the IL‐17 family in psoriasis. J Dtsch Dermatol Ges 2020; DOI: 10.1111/ddg.14124 [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 46. Schön MP. Adaptive and innate immunity in psoriasis and other inflammatory disorders. Front Immunol 2019; 10: 1764. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47. Ryzhakov G, Lai CCL, Blazek K et al. IL‐17 boosts proinflammatory outcome of antiviral response in human cells. J Immunol 2011; 187(10): 5357–62. [DOI] [PubMed] [Google Scholar]
- 48. Veldhoen M. Interleukin 17 is a chief orchestrator of immunity. Nat Immunol 2017; 18(6): 612–21. [DOI] [PubMed] [Google Scholar]
- 49. Stoppelenburg AJ, Salimi V, Hennus M et al. Local IL‐17A potentiates early neutrophil recruitment to the respiratory tract during severe RSV infection. PLoS One. 2013; 8(10): e78461. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50. Wan S, Yi Q, Fan S et al. Relationships among lymphocyte subsets, cytokines, and the pulmonary inflammation index in coronavirus (COVID‐19) infected patients. Br J Haematol 2020; 189(3): 428–37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51. Eyerich K, Eyerich S, Biedermann T. The multi‐modal immune pathogenesis of atopic eczema. Trends Immunol 2015; 36(12), 788–801. [DOI] [PubMed] [Google Scholar]
- 52. Zhang JJ, Dong X, Cao YY et al. Clinical characteristics of 140 patients infected with SARS‐CoV‐2 in Wuhan, China. Allergy 2020; doi: 10.1111/all.14238 [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 53. Koberle M, Biedermann T. Microbiome, atopic eczema and blockade of type 2 immunity. Hautarzt 2018; 69(3), 197–203. [DOI] [PubMed] [Google Scholar]
- 54. Simpson EL, Paller AS, Siegfried EC et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: A Phase 3 Randomized Clinical Trial. JAMA Dermatol 2019; 156(1): 44–56. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55. Carugno A, Raponi F, Locatelli AG et al. No evidence of increased risk for COVID‐19 infection in patients treated with Dupilumab for atopic dermatitis in a high‐epidemic area – Bergamo, Lombardy, Italy. J Eur Acad Dermatol Venereol 2020; doi: 10.1111/jdv.16552 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56. Ferrucci S, Romagnuolo M, Angileri L et al. Safety of dupilumab in severe atopic dermatitis and infection of Covid‐19: two case reports. J Eur Acad Dermatol Venereol 2020; doi: 10.1111/jdv.16527 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57. Guttman‐Yassky E, Blauvelt A, Eichenfield LF et al. Efficacy and safety of lebrikizumab, a high‐affinity interleukin 13 inhibitor, in adults with moderate to severe atopic dermatitis: a phase 2b randomized clinical trial. JAMA Dermatol 2020: 156(4): 411–20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58. Wollenberg A, Howell MD, Guttman‐Yassky E et al. Treatment of atopic dermatitis with tralokinumab, an anti‐IL‐13 mAb. J Allergy Clin Immunol 2019; 143(1), 135–41. [DOI] [PubMed] [Google Scholar]
- 59. Agache I, Beltran J, Akdis C et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. Allergy 2020; 75(5): 1023–42. [DOI] [PubMed] [Google Scholar]
- 60. Ständer S, Yosipovich G, Legat FJ et al. Trial of nemolizumab in moderate‐to‐severe prurigo nodularis. N Engl J Med 2020; 382(8): 706–16. [DOI] [PubMed] [Google Scholar]
- 61. Kabashima K, Furue M, Hanifin JM et al. Nemolizumab in patients with moderate‐to‐severe atopic dermatitis: Randomized, phase II, long‐term extension study. J Allergy Clin Immunol 2018; 142(4): 1121–1130. [DOI] [PubMed] [Google Scholar]
- 62. Saini SS, Bindslev‐Jensen C, Maurer M et al. Efficacy and safety of omalizumab in patients with chronic idiopathic/spontaneous urticaria who remain symptomatic on H1 antihistamines: a randomized, placebo‐controlled study. J Invest Dermatol 2015; 135(1), 67–75. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63. Liu L, Wei Q, Lin Q et al. Anti‐spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS‐CoV infection. JCI Insight 2019; 4(4): e123158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64. Guilpain P, Le Bihan C, Foulongne V et al. Rituximab for granulomatosis with polyangiitis in the pandemic of covid‐19: lessons from a case with severe pneumonia. Ann Rheum Dis 2020; doi: annrheumdis‐2020‐217549 [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 65. Fallet B, Kyburz D, Walker UA. Mild course of Coronavirus disease 2019 and spontaneous severe acute respiratory syndrome coronavirus 2 clearance in a patient with depleted peripheral blood B‐cells due to treatment with rituximab. Arthritis Rheumatol 2020; doi: 10.1002/art.41380 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66. Egen JG, Allison JP. Cytotoxic T lymphocyte antigen‐4 accumulation in the immunological synapse is regulated by TCR signal strength. Immunity 2002;16(1): 23–35. [DOI] [PubMed] [Google Scholar]
- 67. Freeman GJ, Long AJ, Iwai Y et al. Engagement of the PD‐1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000; 192(7): 1027–34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68. Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell 2015; 27(4): 450–61. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69. Kuehn HS, Ouyang W, Lo B et al. Immune dysregulation in human subjects with heterozygous germline mutations in CTLA4. Science 2014; 345(6204): 1623–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70. Schönrich G, Raftery MJ. The PD‐1/PD‐L1 axis and virus infections: a delicate balance. Front Cell Infect Microbiol 2019; 9: 207. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71. Ravi S, Spencer K, Ruisi M et al. Ipilimumab administration for advanced melanoma in patients with pre‐existing Hepatitis B or C infection: a multicenter, retrospective case series. J Immunother Cancer 2014; 2(1): 33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72. Heppt MV, Schlaak M, Eigentler TK et al. Checkpoint blockade for metastatic melanoma and Merkel cell carcinoma in HIV‐positive patients. Ann Oncol 2017; 28(12): 3104–6. [DOI] [PubMed] [Google Scholar]
- 73. Tapia Rico G, Chan MM, Loo KF. The safety and efficacy of immune checkpoint inhibitors in patients with advanced cancers and pre‐existing chronic viral infections (Hepatitis B/C, HIV): A review of the available evidence. Cancer Treat Rev 2020; 86: 102011. [DOI] [PubMed] [Google Scholar]
- 74. Luo J, Egger JV, Preeshagul IR et al. Impact of PD‐1 blockade on severity of COVID‐19 in patients with lung cancers. Cancer Discov 2020; DOI: 10.1158/2159-8290.CD-20-0596 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75. Schmidle P, Biedermann T, Posch C. COVID‐19 in a melanoma patient under treatment with checkpoint‐inhibition. J Eur Acad Dermatol Venereol 2020; doi: 10.1111/JDV.16661 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76. Xu Z, Shi L, Wang Y et al. Pathological findings of COVID‐19 associated with acute respiratory distress syndrome. Lancet Respir Med 2020; 8(4): 420–2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77. Giamarellos‐Bourboulis EJ, Netea MG, Rovina N et al. Complex immune dysregulation in COVID‐19 patients with severe respiratory failure. Cell Host Microbe 2020; S1931‐3128(20)30236‐5. doi: 10.1016/j.chom.2020.04.009 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78. Rotz SJ, Leino D, Szabo S et al. Severe cytokine release syndrome in a patient receiving PD‐1‐directed therapy. Pediatr Blood Cancer 2017; 64(12): 10.1002/pbc.26642. [DOI] [PubMed] [Google Scholar]
- 79. Bersanelli M. Controversies about COVID‐19 and anticancer treatment with immune checkpoint inhibitors. Immunotherapy 2020; 12(5): 269–73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80. Michot JM, Albiges L, Chaput N et al. Tocilizumab, an anti‐IL6 receptor antibody, to treat Covid‐19‐related respiratory failure: a case report. Ann Oncol 2020; doi: 10.1016/j.annonc.2020.03.300 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81. Maude SL, Barrett D, Teachey DT, Grupp SA. Managing cytokine release syndrome associated with novel T cell ‐engaging therapies. Cancer J 2014; 20(2): 119–22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82. Bechman K, Subesinghe S, Norton S et al. A systematic review and meta‐analysis of infection risk with small molecule JAK inhibitors in rheumatoid arthritis. Rheumatology 2019; 58(10): 1755–66. [DOI] [PubMed] [Google Scholar]
- 83. Solimani F, Meier K, Ghoreschi K. Emerging topical and systemic JAK inhibitors in dermatology. Front Immunol 2019; 10: 2847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84. Spinelli FR, Conti F, Gadina M. HiJAKing SARS‐CoV‐2? The potential role of JAK inhibitors in the management of COVID‐19. Sci Immunol 2020; 5(47): eabc5367. [DOI] [PubMed] [Google Scholar]
- 85. Rudnicka L, Goldust M, Glowacka P et al. Cyclosporine therapy during the COVID‐19 pandemic is not a reason for concern. J Am Acad Dermatol 2020: S0190‐9622(20)30775‐1. doi: 10.1016/j.jaad.2020.04.153 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86. Schrezenmeier E, Dorner T. Mechanisms of action of hydroxychloroquine and chloroquine: implications for rheumatology. Nat Rev Rheumatol 2020; 16: 155–66. [DOI] [PubMed] [Google Scholar]
- 87. Savarino A, Boelaert JR, Cassone A et al. Effects of chloroquine on viral infections: an old drug against today's diseases? Lancet Infect Dis 2003; 3: 722–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88. Vincent MJ, Bergeron E, Benjannet S et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virol J 2005; 2: 69. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89. Wang M, Cao R, Zhang L et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019‐nCoV) in vitro. Cell Res 2020; 30: 269–71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90. Gao J, Tian Z, Yang X. Breakthrough: chloroquine phosphate has shown apparent efficacy in treatment of COVID‐19 associated pneumonia in clinical studies. Biosci Trends 2020; 14: 72–3. [DOI] [PubMed] [Google Scholar]
- 91. Gautret P, Lagier JC, Parola P et al. Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial. Int J Antimicrob Agents 2020: 105949. doi: 10.1016/j.ijantimicag.2020.105949 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92. Borba MGS, Val FFA, Sampaio VS et al. Effect of high vs low doses of chloroquine diphosphate as adjunctive therapy for patients hospitalized with severe acute respiratory syndrome coronavirus 2 (SARS‐CoV‐2) infection: a randomized clinical trial. JAMA Netw Open 2020; 3: e208857. [DOI] [PubMed] [Google Scholar]
- 93. Geleris J, Sun Y, Platt J et al. Observational study of hydroxychloroquine in hospitalized patients with Covid‐19. New Engl J Med 2020; doi: 10.1056/NEJMoa2012410 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94. Food and Drug Administration . Available from https://www.fda.gov/media/136784/download [Last accessed May 10, 2020].
- 95. European Medicines Agency . Available from https://www.ema.europa.eu/en/news/covid‐19‐chloroquine‐hydroxychloroquine‐only‐be‐used‐clinical‐trials‐emergency‐use‐programmes [Last accessed May 10, 2020].
- 96. Fihn SD, Perencevich E, Bradley SM. Caution needed on the use of chloroquine and hydroxychloroquine for coronavirus disease 2019. JAMA Netw Open 2020; 3: e209035. [DOI] [PubMed] [Google Scholar]
- 97. Fiehn C, Ness T, Weseloh C et al. Safety management in treatment with antimalarials in rheumatology. Interdisciplinary recommendations on the basis of a systematic literature review. Z Rheumatol 2020; 79(2): 186–94. [DOI] [PubMed] [Google Scholar]
- 98. Pereira MR, Mohan S, Cohen DJ et al. COVID‐19 in solid organ transplant recipients: Initial report from the US epicenter. Am J Transplant 2020; doi: 10.1111/ajt.15941 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99. Gisondi P et al. Risk of hospitalization and death from COVID‐19 infection in patients with chronic plaque psoriasis receiving a biological treatment and renal transplanted recipients in maintenance immunosuppressive treatment. J Am Acad Dermatol 2020; 82(1): 117–22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100. Russell B, Moss C, George G et al. Associations between immune‐suppressive and stimulating drugs and novel COVID‐19‐a systematic review of current evidence. Ecancermedicalscience 2020; 14: 1022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101. Nair V, Jandovitz N, Hirsch JS et al. COVID‐19 in kidney transplant recipients. Am J Transplant 2020; doi: 10.1111/ajt.15967 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019‐nCoV lung injury. Lancet 2020; 395: 473–5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103. Haberman R, Axelrad J, Chen A et al. Covid‐19 in immune‐mediated inflammatory diseases – case series from New York. N Engl J Med 2020; NEJMc2009567. doi: 10.1056/NEJMc2009567 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104. Qin YY, Zhou YH, Lu YQ et al. Effectiveness of glucocorticoid therapy in patients with severe coronavirus disease 2019: protocol of a randomized controlled trial. Chin Med J 2020; 133(9): 1080–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105. Johnson KM, Belfer JJ, Peterson GR et al. Managing COVID‐19 in renal transplant recipients: a review of recent literature and case supporting corticosteroid‐sparing immunosuppression. Pharmacotherapy 2020; doi: 10.1002/phar.2410 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106. Nasiri S, Araghi F, Tabary M et al. A challenging case of psoriasis flare‐up after COVID‐19 infection. J Dermatolog Treat 2020; 1‐2: doi: 10.1080/09546634.2020.1764904 [Online ahead of print]. [DOI] [PubMed] [Google Scholar]
- 107. Cheng KW, Cheng SC, Chen WY et al. Thiopurine analogs and mycophenolic acid synergistically inhibit the papain‐like protease of Middle East respiratory syndrome coronavirus. Antiviral Res 2015; 115, 9–16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108. Hart BJ, Dyall J, Postnikova E et al. Interferon‐beta and mycophenolic acid are potent inhibitors of Middle East respiratory syndrome coronavirus in cell‐based assays. J Gen Virol 2014; 95: 571–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 109. Chan JF, Yao Y, Yeung ML et al. Treatment with lopinavir/ritonavir or interferon‐beta1b improves outcome of MERS‐CoV infection in a nonhuman primate model of common marmoset. J Infect Dis 2015; 212, 1904–13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 110. Balestri R, Rech G, Girardelli CR. Occurrence of SARS‐CoV‐2 during mycophenolate mofetil treatment for pemphigus. J Eur Acad Dermatol Venereol 2020; doi: 10.1111/jdv.16578 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 111. Farouk A, Salman S. Dapsone and doxycycline could be potential treatment modalities for COVID‐19. Med Hypotheses 2020; 140: 109768. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 112. Altschuler EL, Kast RE. Dapsone, colchicine and olanzapine as treatment adjuncts to prevent COVID‐19 associated adult respiratory distress syndrome (ARDS). Med Hypotheses 2020; 141: 109774. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 113. Schönrich G, Raftery MJ. Neutrophil extracellular traps go viral. Front Immunol 2016; 7: 366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 114. Martinod K, Wagner DD. Thrombosis: tangled up in NETs. Blood 2014; 123 (18): 2768–76. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 115. Brill A, Fuchs TA, Savchenko AS et al. Neutrophil extracellular traps promote deep vein thrombosis in mice. J Thromb Haemost 2012; 10 (1): 136–44. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 116. Jorch SK, Kubes P. An emerging role for neutrophil extracellular traps in noninfectious disease. Nat Med 2017; 23 (3): 279–87. [DOI] [PubMed] [Google Scholar]
- 117. Porto BN, Stein RT. Neutrophil extracellular traps in pulmonary diseases: Too Much of a Good Thing? Front Immunol 2016; 7: 311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118. Meher AK, Spinosa M, Davis JP et al. Novel role of IL (interleukin)‐1b in neutrophil extracellular trap formation and abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol 2018; 38 (4): 843–53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 119. Fox SE, Akmatbekov A, Harbert JL et al. Pulmonary and cardiac pathology in Covid‐19: the first autopsy series from New Orleans. medRxiv 2020; doi: 10.1101/2020.04.06.20050575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 120. Manzenreiter R, Kienberger F, Marcos V et al. Ultrastructural characterization of cystic fibrosis sputum using atomic force and scanning electron microscopy. J Cyst Fibros 2012; 11 (2): 84–92. [DOI] [PubMed] [Google Scholar]
- 121. Yang C, Montgomery M. Dornase alfa for cystic fibrosis. Cochrane Database Syst Rev 2018; 9 (9): Cd001127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 122. Earhart AP, Holliday ZM, Hofmann HV, Schrum AG. Consideration of dornase alfa for the treatment of severe COVID‐19 acute respiratory distress syndrome. New Microbes New Infect 2020; 35: 100689. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 123. Klok FA, Kruip M, van der Meer NJM et al. Incidence of thrombotic complications in critically ill ICU patients with COVID‐19. Thromb Res 2020; S0049‐3848(20)30120‐1. doi: 10.1016/j.thromres.2020.04.013 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 124. Magro C, Mulvey JJ, Berlin D et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID‐19 infection: a report of five cases. Transl Res 2020; S1931‐5244(20)30070‐0. doi: 10.1016/j.trsl.2020.04.007 [Online ahead of print]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 125. Cedervall J, Zhang Y, Huang H et al. Neutrophil extracellular traps accumulate in peripheral blood vessels and compromise organ function in tumor‐bearing animals. Cancer Res 2015; 75 (13): 2653. [DOI] [PubMed] [Google Scholar]


