Abstract
Die Leitlinie (AWMF-Register-Nr.: 179-004) „Neurogene Darmfunktionsstörung bei Querschnittlähmung“ der Deutschsprachigen Medizinischen Gesellschaft für Paraplegiologie ist an alle Personen adressiert, die Menschen mit kongenitalen oder erworbenen Querschnittlähmungen mit neurogenen Darmfunktionsstörungen (NDFS) betreuen. Insbesondere werden Ärzte, Pflegende und Therapeuten angesprochen. Die multiprofessionell erstellte Leitlinie (beteiligt waren Neuro-Urologen, Viszeralchirurgen, Gastroenterologen sowie Gesundheits- und Krankenpflegekräfte und Ernährungsberater sowie assoziierte Fachgesellschaften im Review-Verfahren) stellt eine praxisorientierte Unterstützung für die Versorgung von Patienten mit NDFS dar. Es werden Definitionen und aktuelles Wissen zur Diagnostik von NDFS sowie zu dem notwendigen konservativen Darmmanagement vermittelt, um eine kompetente Behandlung von Patienten mit NDFS zu gewährleisten. Dabei wird das Konzept der neurogenen Darmfunktionsstörung sowie deren klinische Auswirkungen beschrieben. Medikamentöse Interventionen und operative Eingriffe werden in Kurzform erläutert und Empfehlungen abgegeben. Das Hauptziel der vorliegenden Leitlinie besteht darin, Komplikationen inklusive der Stuhlinkontinenz und der Obstipation zu verhindern und so die Lebensqualität der Betroffenen positiv zu beeinflussen. Hilfreiche Anhänge, die im Alltag genutzt werden können, runden die Leitlinie ab.
Zusatzmaterial online
Zusätzliche Informationen sowie Selbsterhebungsbögen, Schemata, Tabellen und weitere Abbildungen sind im Anhang der Online-Version dieses Artikels (10.1007/s00053-020-00482-5) enthalten.
Schlüsselwörter: Sekundäre Kontinenz, Stuhlmodulation, Darmmanagement, Obstipation, Inkontinenz
Abstract
The guidelines (AWMF register number: 179-004) on neurogenic bowel dysfunction (NBD) in spinal cord injury of the German-speaking Medical Society for Paraplegiology is addressed to all persons who care for people with congenital or acquired paraplegia with NBD. In particular, doctors, nurses and therapists are addressed. The multiprofessionally developed guidelines (involving neurourologists, visceral surgeons, gastroenterologists, health and nursing staff, nutritionists and associated professional societies in the review process) provides practical support for the care of patients with NBD. Definitions and up to date knowledge on the diagnostics of NBD as well as on the necessary conservative bowel management are conveyed in order to ensure the competent treatment of patients with NBD. The concept of NBD and its clinical implications are described. Drug interventions and surgical procedures are explained in brief and recommendations are given. The main objective of the present guidelines is to prevent complications including fecal incontinence and constipation and thus to positively influence the quality of life of those affected. Helpful appendices, which can be used in everyday life, complete the guidelines.
Keywords: Secondary Continence, Stool modulation, Bowel management, Constipation, Incontinence
Infobox
Federführende Fachgesellschaft
Deutschsprachige Medizinische Gesellschaft für Paraplegiologie e. V. (DMGP)
Leitliniengruppe
Bremer Jörn; Dr.med., Facharzt für Urologie, Leitender Oberarzt Querschnittgelähmtenzentrum, BDH-Klinik Greifswald gGmbH
Frei Isabella; Gesundheits- und Krankenschwester, Balgrist, Zentrum für Paraplegie, Zürich
Henauer Jörg, Dr. med., Facharzt für Allgemein- und Rechtsmedizin Balgrist, Zentrum für Paraplegie, Zürich/CH
Hetzer, Franc H. Prof. Dr. Leitender Arzt und Bereichsleiter allgemeine Chirurgie Viszeralchirurgie FMH, Uznach/CH
König Maike, Krankenschwester, Urotherapeutin, Expertin für neurogene Darmfunktionsstörung, Zentralklinik Bad Berka
Obereisenbuchner Jeannette, Diätassistentin, Med. Ernährungsberaterin, Kliniken Beelitz, Beelitz
Pehl Christian, Prof. Dr. Ärztlicher Direktor, Chefarzt Medizinische Klinik Visliburg
Rafler, Henry, Pflegedirektor, BG Klinikum Bergmannstrost Halle
Storr Martin Prof. Dr. Facharzt für Innere Medizin/Gastroenterologie, Gesundheitszentrum Starnberger See MVZ
Wildisen Alesandro; Dr. med., Viszeralchirurg, Chefarzt, Kantonales Spital Sursee
Präambel
Die vorliegende S2k-Leitlinie wurde federführend durch die Deutschsprachige Gesellschaft für Paraplegiologie e. V. (DMGP) erstellt. Initiiert, koordiniert und erarbeitet wurde die Leitlinie im Wesentlichen durch Mitglieder des Arbeitskreises neurogene Darmfunktionsstörungen der DMGP.
Im multiprofessionellen interdisziplinären Arbeitskreis neurogene Darmfunktionsstörungen arbeiten u. a. DMGP-Mitglieder der Fachrichtungen Paraplegiologie, Proktologie, Viszeralchirurgie, Neuro-Urologie, Gastroenterologie, Gesundheits- und Krankenpflege sowie Pflegewissenschaftler und Diätassistent/medizinische Ernährungsberater. Die DMGP ist eine Fachgesellschaft der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF), eine Sektion der Deutschen Gesellschaft für Orthopädie und Unfallchirurgie (DGOU) und affiliierte Gesellschaft der International Spinal Cord Society (ISCoS).
Die Leitlinie wurde im Konsensus-Verfahren erstellt (Konsensus-Konferenzen und nominaler Gruppenprozess). Sie wurde vollständig im Konsens-Meeting vom 15.09.2018 abgestimmt.
Die Empfehlungen aus den Review-Verfahren wurden am 03.07.2019 in die Leitlinie eingearbeitet. Zu Einzelheiten des Konsensus und Review-Prozesses wird auf den Leitlinienreport verwiesen.
Formulierung der Empfehlungen mit Empfehlungsstärken
Bei allen Empfehlungen ist die Stärke der Empfehlung anhand der Formulierung ersichtlich. Die Formulierungen und Bedeutung der Empfehlungsstärken sind in Tab. 1 dargelegt. In allen Kommentaren wurden die Empfehlungen anhand der zugrunde liegenden Literatur begründet. Evidenzgrade wurden in dieser S2k-Leitlinie nicht vergeben.
| Formulierung | Empfehlungsstärke |
|---|---|
| „Soll“ | Starke Empfehlung |
| „Sollte“ | Empfehlung |
| „Kann“ | Offene Empfehlung |
| „Sollte nicht“ | Negativempfehlung |
| „Soll nicht“ | Starke Negativempfehlung |
In diesem Dokument wird aus Gründen der besseren Lesbarkeit auf die Nennung der männlichen und weiblichen Form verzichtet. Da die Anzahl der männlichen Querschnittgelähmten überwiegt, wird die männliche Bezeichnung gewählt. Selbstverständlich sind hierin beide Geschlechter inbegriffen.
1. Methodik
Es wird auf den Leitlinienreport unter dem Link https://www.awmf.org/uploads/tx_szleitlinien/179-004m_S2k_Neurogene-Darmfunktionsstoerung-Querschnittlaehmung_2019-10.pdf verwiesen, in dem die Zusammensetzung der Leitliniengruppe, die Beteiligung wissenschaftlicher Fachgesellschaften, die Methodik der Leitlinienerstellung und das Review-Verfahren detailliert dargestellt werden.
2. Definitionen
2.1. Darmmanagement
Darmmanagement bezeichnet die Gesamtheit aller Aktivitäten, die dazu dienen, eine regelmäßige, planbare sowie zeitlich begrenzte Darmentleerung mit ausreichender Stuhlmenge sowie adäquater Stuhlkonsistenz zu erreichen, Gesundheit und Wohlbefinden zu erhalten und Komplikationen sowie ungeplante Stuhlentleerungen zu vermeiden. Das Darmmanagement ist ein Prozess, welcher das Assessment, die individuelle Planung und Durchführung der Interventionen unter Berücksichtigung individueller Einflussfaktoren, die Beurteilung des Outcomes sowie die Evaluation beinhaltet.
Ein erfolgreiches Darmmanagement erfordert immer eine multiprofessionelle Zusammenarbeit der verschiedenen Berufsgruppen (interdisziplinäres Team).
Sekundäre Stuhlkontinenz
Da bei neurogenen Darmfunktionsstörungen die willkürliche Steuerung, den Stuhl sicher zu speichern und willkürlich zu entleeren lähmungsbedingt meist nicht mehr vorhanden ist, kann mit einem individuellen Darmmanagement eine sekundäre Stuhlkontinenz erreicht werden.
2.2. Stuhlinkontinenz
Stuhlinkontinenz bezeichnet die eingeschränkte oder fehlende Fähigkeit, den Abgang von Darminhalt (Darmgase [Wind]/Schleim/Faeces) willkürlich zu kontrollieren.
Eine evidenzbasierte, allgemein anerkannte Einteilung der Stuhlinkontinenz existiert nicht. Für die Menschen mit neurogenen Darmfunktionsstörungen eignet sich im klinischen Bereich die Inkontinenz-Skala in Tab. 2. Diese ist bisher allerdings nicht validiert (Konsens: 100 %).
| Inkontinenz-Skala bei Querschnittlähmung | ||
|---|---|---|
| Grad I | Inkontinenz nur für Darmgase (Winde) | Anale Inkontinenz |
| Grad II a | Schleimabgang | Anale Inkontinenz |
| Grad II b | Stuhlschmieren | Stuhlinkontinenz |
| Grad III | Inkontinenz für dünne Stühle (Bristol Stool Scale 5–7; [32]; s. Zusatzmaterial online: Anhang 3.) | Stuhlinkontinenz |
| Grad IV | Inkontinenz für feste Stühle (Bristol Stool Scale 1–4; s. Zusatzmaterial online: Anhang 3.) | Stuhlinkontinenz |
Für wissenschaftliche Fragestellungen sollte ein validierter Score verwendet werden (z. B. Neurogenic Bowel Dysfunction Score [NBD-Score], International Bowel Function Spinal Cord Injury Basic Data Set Vers. 2.1/Extended Data Set Vers. 1.0; [26, 27, 29].
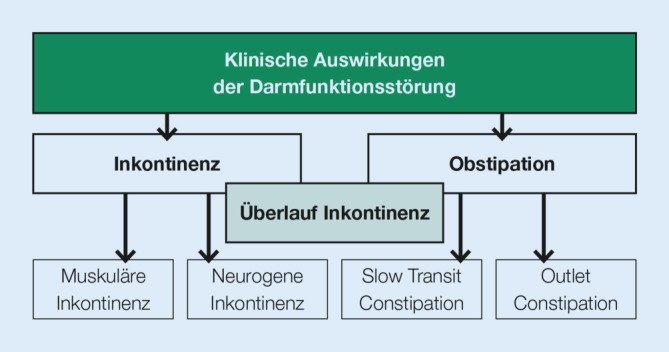
Formen der Stuhlinkontinenz
Neurogene Inkontinenz: Stuhlinkontinenz aufgrund der gestörten Innervation des Kontinenzorgans.
Muskuläre Inkontinenz: Stuhlinkontinenz aufgrund eines Defekts der muskulären Anteile des Kontinenzorgans (Sphincter ani externus und internus).
Konsistenzbedingte Inkontinenz: Stuhlinkontinenz aufgrund unpassender Stuhlkonsistenz (zu flüssig, zu breiig).
Überlaufinkontinenz: Stuhlinkontinenz als Folge einer unzureichenden Entleerung des Mastdarms („fecal impaction“, Stuhlausmauerung, paradoxe Diarrhoe). Eine Stuhlimpaktion kann zu einer Dauerrelaxation des Musculus sphincter ani internus mit der Folge von flüssiger Stuhlausscheidung führen.
Mischformen der Stuhlinkontinenz sind aufgrund einer multikausalen Genese möglich.
2.3. Obstipation
Die Kriterien in Tab. 3 umschreiben die Obstipation bei Querschnittlähmung.
| 1. | Harter Stuhlgang (bei mind. 25 % der Defäkationen) Bristol Stool Scale 1–2 |
| 2. | Manuelle Unterstützung der Entleerung (bei mind. 25 % der Defäkationen) |
| 3. | In der Regel weniger als 3 Stuhlentleerungen pro Woche |
| 4. | Verlängerte Entleerungszeit |
| 5. | Inkomplette Stuhlentleerungen (bei mind. 25 % der Defäkation) |
| 6. | Erfolglose Stuhlentleerungsversuche |
| 7. | Meteorismus mit funktionellen abdominellen oder respiratorischen Störungen |
„Slow transit constipation“
Durch eine verminderte Peristaltik des Darms wird der Stuhl verlangsamt vorwärtsbewegt. Ursache für die „slow transit constipation“ ist eine Störung der Darm-Gehirn-Darm-Achse, da die aktivierenden extrinsischen Einflüsse abhängig von der Lähmungshöhe und Vollständigkeit (inkomplett/komplett) ausfallen. Darüber hinaus finden sich unterschiedliche Lokalisationen der am häufigsten betroffenen Kolonabschnitte in Abhängigkeit von der Lähmungshöhe, zumindest bei kompletten Lähmungsformen: Während bei Tetraplegikern vor allem das Rektosigmoid betroffen ist, liegt der Schwerpunkt bei den Paraplegikern mit Schädigung des oberen motorischen Neurons (UMNL) im Colon ascendens und bei Paraplegikern mit Schädigung des unteren motorischen Neurons (LMNL) im Colon descendens [51].
„Outlet constipation“
Der im Enddarm gespeicherte Stuhl kann nicht entleert werden. Ursachen dafür können sein:
Dyssynergie zwischen Rektum, Beckenboden und/oder analem Sphinkterapparat,
morphologische Veränderungen (z. B. Rektozele, Intussuszeption, Enterozele, Cul-de-Sac-Syndrom, Analstenose),
die Innervationsstörungen des Beckenbodens können zu sekundären topographischen und/oder morphologischen Veränderungen (z. B. Analprolaps) führen.
Mischformen aus „slow transit“ und „outlet constipation“ sind möglich.
3. Pathophysiologie
Der neurogenen Darmfunktionsstörung bei Querschnittlähmung liegt eine Schädigung des Rückenmarks oder der Cauda equina auf unterschiedlichem Niveau zugrunde [22, 36].
Veränderungen der gastrointestinalen Funktionen nach Querschnittlähmung sind in ihrer klinischen Erscheinung abhängig von der Höhe der Läsion, der Vollständigkeit der Verletzung und dem Zeitraum, der seit Eintritt der Querschnittlähmung vergangen ist. Von entscheidender klinischer Bedeutung sind die Veränderungen von Motilität des oberen und unteren Gastrointestinaltrakts sowie die Peristaltik, die Frage, ob die Fähigkeit zur Entleerung des Rektums erhalten bleibt und der anale Verschlussmechanismus funktioniert. Bezogen auf den zeitlichen Ablauf und den klinischen Verlauf können die Veränderungen am Gastrointestinaltrakt nach einer Rückenmarkschädigung in 3 Phasen eingeteilt werden, wobei die Phasen fließend ineinander übergehen [31].
3.1. Phasenverlauf
Akutphase
In der Phase des spinalen Schocks nach einer Rückenmarkschädigung fallen alle spinal gesteuerten Funktionen unterhalb der Läsion unabhängig von der Lähmungshöhe aus. Bei allen Läsionen oberhalb S2 kommt es zunächst zum Ausfall der Peristaltik [11, 17, 41]. Klinisch ist die Folge dieser Darmatonie im Extremfall eine Paralyse. Da die zum Zeitpunkt der Verletzung im Kolon vorhandene Stuhlsäule nicht weitertransportiert wird, kann sie von der mikrobiellen Standort-Flora des Kolons erneut verarbeitet werden. Diese sekundäre Verarbeitung des Darminhaltes durch Bakterien und Hefepilze hat eine Gärung zur Folge, die zur Gasbildung führt. Das klinische Bild kann ein massiver Meteorismus sein, der zum Bild des akuten Abdomens führen kann [17].
Postakute Phase
Nach Abklingen des spinalen Schocks setzt die Peristaltik wieder ein. Die weitere Entwicklung von intestinaler Motilität und Rektumfunktion ist nun von der Höhe und dem Ausmaß der Rückenmarkverletzung abhängig. Sie entscheidet über die Aktivität von Sympathikus und Parasympathikus sowie die Auslösbarkeit der Reflexsteuerung von Kolon und Rektum. Bei Patienten mit einer Rückenmarkschädigung ist die Kolontransitzeit in der Regel verlängert: bei Lähmungsniveau oberhalb Th7 bei ca. 31 % der Patienten, unterhalb Th7 bei 63 %. Sind bei diesen Patienten (unterhalb Th7) die sakralen Reflexe erhalten, ist die Kolontransitzeit in 36 % verlängert, bei fehlenden sakralen Reflexen in 85 % [38, 51].
Langzeitverlauf
Im klinischen Alltag können im Langzeitverlauf schwerwiegende Komplikationen im Sinne von Megakolon, Paralyse und Ileus auftreten. In einer der wenigen Langzeitstudien (über 19 Jahre) nahm die Obstipation zu, während die Stuhlinkontinenz unverändert blieb [37].
3.2. Konzept der neurogenen Darmfunktionsstörung
Pathophysiologische Merkmale der neurogen veränderten Darmfunktion sind sowohl eine gestörte Sensorik und Motilität des Stuhltransports als auch die eingeschränkte bis fehlende reflektorische Steuerung von Darmentleerung und Kontinenz.
Bei der nachfolgenden klassischen Einteilung werden komplette Lähmungen angenommen.
3.2.1. Läsion des unteren motorischen Neurons
Diese Form der neurogenen Darmfunktionsstörung (nDFS) wird auch areflexiver Darm genannt [20]. Ursächlich bei der Querschnittlähmung ist eine Zerstörung der parasympathischen Nervenzellen im Conus medullaris und/oder der in der Cauda equina gebündelten sakralen Nervenwurzeln. Durch die gestörte Verbindung zwischen Kolon und Rückenmark kann es weder zu einer durch das Rückenmark vermittelten reflektorischen Peristaltik noch zu einer Reflexentleerung kommen. Allein der Plexus myentericus sorgt durch segmentale Kolonperistaltik für einen langsamen Transport des Darminhaltes. Vor allem im Bereich des Colon descendens und des Rektosigmoids ist der Transport erheblich verlangsamt [28, 51]. Der M. sphincter ani externus ist denerviert und erschlafft. Durch den Tonusverlust des M. levator ani kommt es zu einem Absinken des Beckenbodens (Descensus perinei) mit einer Veränderung des rektoanalen Winkels. Beides führt zu einem erhöhten Inkontinenzrisiko („passiv leakage“; [7]).
3.2.2. Läsion des oberen motorischen Neurons
Bei dieser Form der nDFS spricht man auch von einem reflexiven Darm [20]. Der reflexive Darm hat seine Ursache in einer Läsion oberhalb des Conus medullaris. Massenbewegungen des Kolons sind weiter möglich. Die Kontraktilität des Kolons ist erhöht. Der Transit ist hauptsächlich im linken Kolon und im Rektosigmoid verlangsamt [51]. Es kann zu einer spastischen Tonuserhöhung der Beckenbodenmuskulatur und des M. sphincter ani externus kommen. Klinisch steht deshalb eine Stuhlentleerungsstörung aufgrund einer funktionellen Auslassbehinderung („outlet constipation“) im Vordergrund.
3.2.3. Gegenüberstellung der Läsionen
In Tab. 4 werden die Störungen und Symptome kompletter Läsionen (AIS Typ A/ASIA Impairment Scale; [24]) des oberen und unteren motorischen Neurons (schematisch) gegenübergestellt. Bei inkompletter Lähmung gelten diese Symptome grundsätzlich auch, allerdings zeigt sich bei diesen Läsionen bei teilweise erhaltener Sensibilität und Motorik eine variable Ausprägung.
| Läsion des oberen motorischen Neurons | Läsion des unteren motorischen Neurons |
|---|---|
| „Upper motor neuron lesion“ (UMNL) | „Lower motor neuron lesion“ (LMNL) |
| „Reflexiver Darm“ | „Areflexiver Darm“ |
| Pathophysiologie | |
| Läsion oberhalb des Conus medullaris, sakrales Reflexzentrum ist intakt | Läsion sakrale Segmente des Conus medullaris und/oder Schädigung der sakralen Nervenwurzeln |
| Klinische Symptome | |
| Stuhltransportstörung | |
| Veränderte perianale Empfindung | |
|
Stuhlentleerungsstörung Obstipation Stuhlinkontinenz (Überlauf- oder Reflexinkontinenz) |
Stuhlentleerungsstörung Stuhlinkontinenz („passiv leakage“) |
| Erhöhter Tonus der Beckenbodenmuskulatur | Erniedrigter Tonus der Beckenbodenmuskulatur |
| Erhöhter Tonus des Sphincter ani externus | Fehlender Tonus des Sphincter ani externus |
| Intakter Bulbocavernosusreflex | Fehlender Bulbocavernosusreflex |
| Intakter Analreflex | Fehlender Analreflex |
| Klinische Konsequenzen | |
| Entleerung durch rektale Stimulation möglich | Entleerung durch rektale Stimulation nicht möglich |
| Angestrebter Stuhlentleerungsrhythmus jeden 2. Tag | Angestrebter Stuhlentleerungsrhythmus täglich |
Erwähnt werden sollte an dieser Stelle eine ebenfalls neuropathophysiologisch orientierte, allerdings nicht so verbreitete Klassifizierung [51] nach weiteren klinisch durchaus relevanten Gesichtspunkten. Diese teilt die nDFS bei komplett Querschnittgelähmten in 3 Gruppen (Tab. 5). Diese Klassifikation erlaubt weiter differenzierte therapeutische Ansätze.
| Lähmungshöhe | Details |
|---|---|
| >Th7 | Keine Bauchpresse |
| <Th7 | Mit erhaltenen sakralen Reflexen |
| <Th7 | Ohne sakrale Reflexe |
3.2.4. Klinische Auswirkungen neurogener Darmfunktionsstörungen
Die klinische Auswirkung einer Querschnittlähmung mit neurogener Darmfunktionsstörung kann sowohl die Inkontinenz als auch die Obstipation sein (Abb. 1).
3.2.5. Komplikationen neurogener Darmfunktionsstörungen
Bei unzureichendem Darmmanagement können neben den bereits erwähnten Leitsymptomen auch die nachfolgenden Probleme auftreten oder verstärkt werden:
4. Diagnostik
4.1. Basisdiagnostik
Anamnese (z. B. Stuhlmenge und -konsistenz, Stuhlfrequenz, Entleerungsdauer, Zeitpunkt der Defäkation, Ernährung, Medikamente, Stuhlinkontinenz, erfolglose Entleerungsversuche)
Stuhlbeobachtung nach Bristol Stool Scale (Zusatzmaterial online: Anhang 3.)
Beurteilung des Abdomens mit Palpation und Auskultation
- Anorektale Untersuchung
- Inspektion der perianalen Region inkl. Beckenbodenbeurteilung zur Beurteilung des Hautzustands und Feststellung von proktologischen Erkrankungen, z. B. Fissuren/Marisken/perianale Thrombosen/Missbildungen
- Prüfung der Sensibilität
- Bei der digital-rektalen Untersuchung wird die perianale und tief anale Sensibilität sowie der Sphinktertonus in Ruhe und nach willkürlicher Kontraktion untersucht, eingeschätzt und dokumentiert (International standards of neurological classification of spinal cord injury [ISNCSCI]); Digital rectal examination scoring system (DRESS-Score; [39])
- Überprüfung des Analreflex, Bulbocavernosusreflex
- Kontrolle der Ampulle
Die Leitlinien-Arbeitsgruppe empfiehlt für den klinischen Alltag den nichtvalidierten nDFS-Selbsterhebungsbogen (Zusatzmaterial online: Anhang 1.). Dieser wurde von der LL-Gruppe entwickelt und konsentiert. Allerdings ist er ein Selbsterhebungsbogen, der im Rahmen der Leitlinien-Erstellung durch Anwender und Patienten erprobt wurde und von den Mitgliedern der Leitlinien-Gruppe in der Praxis genutzt wird. Für wissenschaftliche Zwecke eignet sich der validierte Neurogenic Bowel Dysfunction Score (NBD-Score; Zusatzmaterial online: Anhang 2.) oder der International SCI Bowel Function Basic Data Set Version 2.1 English (https://www.iscos.org.uk/international-sci-bowel-data-sets), der nur in Englisch vorliegt. Die vorliegenden Instrumente müssten validiert und auf Reliabilität in deutscher Sprache überprüft werden. Konsens: 100 %.
Empfehlung
Die Anamnese in Kombination mit der Überprüfung des Analsphinktertonus sollen wesentliche Eckpfeiler der Erstdiagnostik darstellen. (Konsens: 100 %)
Empfehlung
Ein Score kann als Screening zur Einschätzung des Darmmanagement genutzt werden, z. B. der nDFS-Selbsterhebungsbogen oder der NBD-Score (s. Zusatzmaterial online: Anhang 2.) (Konsens:100 %)
4.2. Erweiterte Diagnostik bei neurogenen Darmfunktionsstörungen
Nach klinischem, individuellem Bild erfolgt eine weiterführende Diagnostik:
Stuhlprotokoll
Ernährungs- und Trinkprotokoll
Abdomineller Ultraschall
Abdomen-Übersichtsaufnahme mit/ohne Kontrastmittel
Funktionelle Rektomanometrie
Assessment-gestützte Problemerhebung und Bewertung: Wir empfehlen für den klinischen Alltag die Nutzung des nichtvalidierten nDFS-Selbsterhebungsbogens (Zusatzmaterial online: Anhang 1.) (Konsens: 100 %)
Labor: Hb, HK, Leukozyten, Thrombozyten, Elektrolyte, TSH basal, fT3 und fT4 (Konsens: 100 %)
Stuhldiagnostik nach Verdachtsdiagnose
Proktoskopie/Rektoskopie/Koloskopie
4.3. Weiterführende Diagnostik bei speziellen Fragestellungen
Abdomen-CT
Bestimmung der Kolontransitzeit (CTT)
Kolonkontrasteinlauf/(MR)-Defäkographie
Transanale Endosonographie/Veränderung der Muskulatur
EMG des M. sphincter ani externus und der Puborektalisschlinge (Differenzierung der Innervierung durch S4)
(MR)-Angiographie (Ausschluss „non-occlusiv disease”/Angina abdominalis)
Erweitertes Labor
Weitere konsiliarische Untersuchungen nach individueller Beurteilung: Viszeralchirurg, Proktologe, Neurologe, Gynäkologe, Urologe, Gastroenterologe, Schmerztherapeut
5. Das Darmmanagement
Das übergeordnete Ziel des Darmmanagements ist das Erreichen einer sekundären Kontinenz bei regelmäßiger und ausreichender Darmentleerung innerhalb eines individuell akzeptablen Zeitrahmens. Das Darmmanagement findet in einem zyklischen Prozess statt. Für die Umsetzung des Darmmanagements in der Frühphase (bei Frischverletzten) findet sich im Zusatzmaterial online (Anhang unter 4.) das „Abführschema für Frischverletzte“.
5.1. Phasen des Darmmanagements
Die nachfolgend beschriebenen Phasen des Darmmanagements werden nach einer frisch eingetretenen Querschnittlähmung durchlaufen. Die einzelnen Phasen sind typischerweise mit jeweils spezifischen Zielsetzungen verknüpft (Tab. 6).
| Phasen | Zielsetzung |
|---|---|
| 1 | Erreichen einer ersten Darmentleerung |
| 2 | Erreichen einer regelmäßigen, ausreichenden sowie zeitlich begrenzten Darmentleerung unter Berücksichtigung der individuellen Situation mittels des Assessments |
| 3 | Betroffener und/oder Betreuungsperson erhält Informationen und Instruktionen zum Darmmanagement und übernimmt das Darmmanagement eigenverantwortlich unter Anleitung/Unterstützung der Pflegepersonen |
| 4 | Betroffener beherrscht das Darmmanagement im Rahmen seiner Möglichkeiten (kognitiv/funktionell), sekundäre Stuhlkontinenz, regelmäßige und ausreichende Stuhlentleerung |
| 5 | Anpassung auf die individuellen Lebensumstände zu Hause, lebenslange Nachsorge |
Beim Auftreten von Komplikationen oder bei einer Wiederaufnahme muss nach detaillierter Einschätzung der Problem- und Ressourcensituation das Darmmanagement (re)evaluiert und eventuell individuell angepasst werden.
5.2. Etablierung eines Darmmanagements
Auf der Grundlage der Ersteinschätzung lassen sich Maßnahmen zum Darmmanagement planen:
Festlegen eines Darmentleerungsrhythmus. Die tägliche bzw. zweitägige Darmentleerung ist unter pathophysiologischen Gesichtspunkten anzustreben; sie sollte möglichst immer zur selben Tageszeit durchgeführt werden.
Interventionen zur Darmentleerung, gegebenenfalls inkl. Einsatz von Laxanzien und/oder Hilfsmitteln. Vgl. Überblick Behandlung Stuhlinkontinenz s. Zusatzmaterial online: Anhang 5., Abb. 2 und Überblick Behandlung Obstipation Zusatzmaterial online: Anhang 6., Abb. 3.
Empfehlung
Für die Etablierung des Darmmanagements soll der Darmentleerungsrhythmus, die Entleerungstechnik und der Einsatz von Laxanzien und Hilfsmitteln festgelegt werden. (Konsens: 100 %)
5.2.1. Evaluation des Darmmanagements
Zur Evaluation des Darmmanagements gehören folgende Aspekte:
Entleerungsrhythmus „upper motor neuron läsion“ (UMNL) = 1- bis 2‑tägig/“lower motor neuron läsion“ (LMNL) = 1- bis 2‑mal täglich zur gleichen Tageszeit
Entleerungszeit pro Abführen <1 h
Stuhlmenge adäquat zur Ernährung
- Stuhlkonsistenz
- Typ 3–4 (Bristol Stool Scale) bei UMNL „reflexivem Darm“
- Typ 2–3 (Bristol Stool Scale) bei LMNL „areflexivem Darm“
Vollständige Entleerung der Rektumampulle
Kontinenz
- Erfassung möglicher Komplikationen
- Blähungen
- Schmerzen/Missempfindungen
- Anorektale Komplikationen
- Autonome Dysreflexie
- Rezidivierende Harnwegsinfekte
Empfehlung
Zur Evaluierung des Darmmanagements soll insbesondere die Kontinenz, der Entleerungsrhythmus, die Defäkationszeit und die subjektive Patientenzufriedenheit eingeschätzt werden. (Konsens: 100 %)
5.2.2. Lebenslange Nachsorge
Neurogene Darmfunktionsstörungen können therapiert und mit dem Darmmanagement beherrscht, aber nicht geheilt werden. Aus diesem Grund muss im Rahmen der lebenslangen Nachsorge auf die Darmfunktionsstörung speziell geachtet werden. Neurogene Darmfunktionsstörungen können durch zunehmendes Alter, Komorbiditäten sowie medikamentöse Therapien beeinflusst werden. Daher ist sowohl die Überprüfung der Darmfunktionsstörung als auch das dazugehörige Darmmanagement im Rahmen der lebenslangen Nachsorge essenziell (regelmäßiges Screening, ggf. Assessment als Grundlage der Anpassung des Darmmanagements).
5.3. Überblick zum Darmmanagement
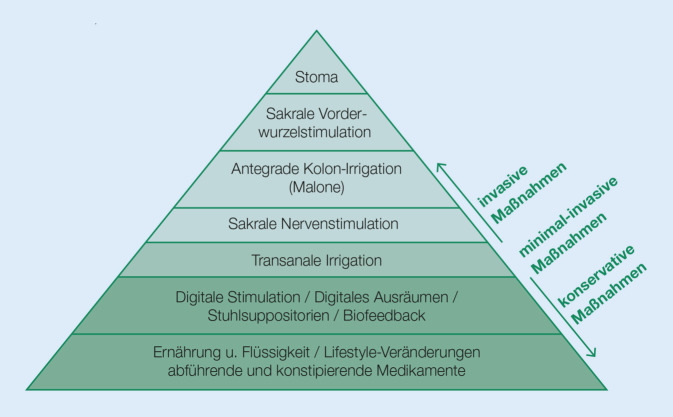
Die sog. Therapie-Pyramide zeigt eine mögliche Therapie-Eskalation bei neurogener Darmfunktionsstörung (Konsens: 71 %), die im internationalen, wissenschaftlichen Schrifttum weit verbreitet ist (Abb. 2).
Tab. 7 zeigt alltagstauglich den möglichen Einsatz von konservativen Interventionen und deren Kombinationen mit einer Steigerung der Invasivität nach dem Abklingen des spinalen Schocks, vereinfachend differenziert nach Läsionstyp. Die vorgestellten Maßnahmen werden individuell und bedarfsweise auch parallel angewendet.
| Läsion des oberen motorischen Neurons („upper motor neuron lesion“) „Reflexiver“ Darm |
Läsion des unteren motorischen Neurons („lower motor neuron lesion”) „Areflexiver“ Darm |
|---|---|
| Ziele | |
| Entleerung täglich bis jeden 2. Tag | Entleerung 1‑ bis 2‑mal täglich |
| Stuhlkonsistenz 3–4 (Bristol Stool Scale) | Stuhlkonsistenz 2–3 (Bristol Stool Scale) |
| Therapie | |
| Ballaststoffreiche Ernährung, adäquate Flüssigkeitsmenge, Bewegung, Entspannung | |
| Gastrokolische Antwort ausnutzen (Abführen nach Mahlzeit) | |
| Kolonmassage | |
| Digitale Stimulation | – |
|
Rektaler Entleerungsreflex positiv: Suppositorium: CO2, Glycerin, Bisacodyl |
– |
| Digitales Ausräumen | |
| Ampullencheck (Ampulle leer?) ca. 10 min nach der letzten Stuhlausscheidung | |
|
Beeinflussen der Stuhlkonsistenz (Stuhlmodulation) Quellmittel und/oder osmotisch wirksame, langzeitverträgliche Laxanzien (Macrogol, Laktulose) | |
| Mikroklistier, Klysma | – |
| Transanale Irrigation | |
Die Anpassung des Darmmanagements orientiert sich am Erfolg (Kontinenz und Entleerungsrhythmus) und wird individuell festgelegt.
6. Konservative Methoden des Darmmanagements
Empfehlungen
Der Algorithmus sollte die Grundlage zur Erarbeitung eines ersten Darmmanagements geben. Die Anpassung des Darmmanagements soll sich am Erfolg (Kontinenz und Entleerungsrhythmus) orientieren und soll individuell festgelegt werden. (Konsens: 100 %)
Die Darmentleerung sollte optimaler Weise nach einer Mahlzeit geplant werden (Gastrokolische Antwort). (Konsens 100 %)
Der Ampullencheck nach der Stuhlentleerung sollte zur Überprüfung der kompletten Entleerung durchgeführt werden. (Konsens: 100 %)
Eine Änderung des Darmmanagements sollte erst nach ausreichender Beobachtung (3–5 Stuhlentleerungen/1 Woche) erfolgen (Ausnahme akute Interventionen). (Konsens: 100 %)
6.1. Aspekte der Ernährung
Der Essrhythmus spielt im Hinblick auf den Abführrhythmus eine wichtige Rolle. Nur bei regelmäßiger Ernährung kann auch ein regelmäßiges Abführen erwartet werden. Die zugeführte Trinkmenge sollte zwischen 1500 und 2000 ml/24 h liegen [1]. Eine ausreichende Ballaststoffzufuhr unterstützt eine geregelte Verdauung. Die D‑A-CH [10] empfiehlt eine Aufnahme von 30 g Ballaststoffen am Tag. Von dieser Empfehlung kann auch für Menschen mit Querschnittlähmung ausgegangen werden. Anpassung der Ballaststoffmenge initial mit 15 g/24 h beginnen und kontinuierlich in gleichmäßigen Schritten auf 25–30 g steigern. Bei einer Zufuhr von 30 g Ballaststoffen am Tag sind 2 Liter energiefreie Trinkflüssigkeit sinnvoll [1, 8].
Empfehlung
Eine regelmäßige Ernährung, ausreichende Flüssigkeitsaufnahme (1500–2000 ml/Tag) und Zufuhr mit Ballaststoffen (bis 30 g/Tag, löslich und unlöslich) sollte Grundlage der Ernährung sein. (Konsensus: 100 %)
6.2. Entleerungstechniken
Die folgenden Maßnahmen sind ohne Wertigkeit in alphabetischer Reihenfolge dargestellt. Kontraindikationen sind zu beachten. Korrekte Ausführungen nach fachlicher Anleitung sind obligat. Für alle rektalen Maßnahmen sind Einweghandschuhe notwendig! Vor der Darmentleerung ist die Blasenentleerung sinnvoll. Die Maßnahmen werden durch den Betroffenen selbst oder eine Pflegeperson durchgeführt (Tab. 8).
| Abdominaldruck erhöhen | Erhöhung des Abdominaldrucks durch Einsatz noch innervierter Bauchmuskulatur. Veränderung der Sitzposition (Oberkörper vorbeugen, Pressen der Arme oder Beine auf den Bauchraum, Knie anziehen, Nutzung einer Bauchbandage oder Husten) |
| Ampullenkontrolle (Ampullencheck) | Digitales Austasten der Rektumampulle zur Feststellung des Füllungszustandes vor und nach der Entleerung |
| Analdehnung | Digitales Aufdehnen des Analkanals zum Lösen der Sphinkterspastik bzw. zum Auslösen des Entleerungsreflexes |
| Anus- und Damm-Beklopfung | Stimulation der Darmentleerung durch Setzen von externen Reizen zur Reflexentleerung |
| Ausräumen – digital | Entleeren der Rektumampulle mit dem Finger durch den Betroffenen selbst oder die Pflegeperson (rechtliche Hinweise siehe Zusatzmaterial online: Anhang 9.) |
| Hebe-Senk-Einlauf Hoher Einlauf Schwenkeinlauf | Instillation von körperwarmem Wasser bzw. konfektionierter Einlauflösung zur retrograden Spülung des Rektums und des linken Kolons |
| Irrigation – transanale | Auslösen des Entleerungsreflexes sowie des rektoanalen Inhibitionsreflexes durch Einbringen einer individuell festgelegten Wassermenge mittels Rektalkatheter (Ballon- oder Konuskatheter). Die Irrigation kann mittels Schwerkraft oder manuellem oder elektrischem Pumpsystem durchgeführt werden. Eine kompetente und mehrfache Einweisung in die Handhabung sowie ein adäquates Troubleshooting sind Voraussetzungen für die erfolgreiche Anwendung [12]. (Checkliste – transanale Irrigation zur Evaluation, ob die transanale Irrigation das geeignete Verfahren zur Darmentleerung ist. [Zusatzmaterial online: siehe Anhang 7.]) |
| Mikroklistier/Klistier | Mikroklistiere/Klistiere sind Fertiglösungen. Mit dem Klistier wird ein chemischer und/oder physikalischer Reiz gesetzt, der dazu führt, dass die Peristaltik angeregt und der im Rektum befindliche Stuhlgang aufgeweicht wird |
| Stimulation – digital | Digitale Stimulation durch kreisende Bewegung mit einem behandschuhten Finger oberhalb des Analsphinkters ca. 15–20 s. Danach 5–10 min zuwarten, ob der Reflex zur Stuhlentleerung ausgelöst werden kann. Kann 2–3 Mal wiederholt werden |
6.3. Physikalische Maßnahmen
Neben der Sitzposition für die Darmentleerung kann jegliche Form von Bewegung einen positiven Effekt auf den Stuhltransport ausüben. Gezielt können die in Tab. 9 aufgeführten physikalischen Maßnahmen unterstützend eingesetzt werden.
| Beckenbodengymnastik/Biofeedback | Bei inkompletter Lähmung: Die wichtigste Voraussetzung für ein erfolgreiches Beckenbodentraining ist die Fähigkeit, den Beckenboden wahrzunehmen und diesen isoliert an- und entspannen zu können. Das Beckenbodentraining wird primär unter Anleitung durchgeführt und kann durch funktionelle Elektrostimulation, ggf. Biofeedback [35], unterstützt werden |
| Kolonmassage | Manuelle oder apparative, analwärts gerichtete Reflexmassage. Sie dient der Anregung der Peristaltik, verringert die Kolontransitzeit und erhöht die Stuhlfrequenz [30] |
| Wärmeapplikationen | Wärme, z. B. in Form von Wickeln (eventuell auch feuchte Wärme), kann Krämpfe und Schmerzen lösen und den Stuhltransport unterstützen. Ätherische Substanzen können dies unterstützen. Cave: Verbrennungsgefahr bei verminderter Sensibilität! |
7. Medikamentöse Therapie
7.1 Rektale Entleerungshilfen (Tab. 10)
| Suppositorien | Das CO2-Suppositorium, welches vor dem Einführen befeuchtet (keine Vaseline!) werden muss, entwickelt ca. 80–100 ml CO2-Gas, das eine Dehnung der Rektumwand bewirkt und somit eine Stimulation der Rezeptoren verursacht. Ein weiterer Effekt ist die Stimulation durch die Gasbläschen an der Darmwand. Die Peristaltik wird dadurch angeregt |
| Bisacodyl wirkt abführend, indem es die Peristaltik des Dickdarms und die Wasser- und Elektrolytansammlung in seinem Lumen stimuliert. Bei Applikation als Suppositorium wird zudem die rektale Wandspannung erhöht, wie es auch physiologisch bei der Defäkation erfolgt [19] | |
| Glycerin (hochkonzentriert) ist hygroskopisch und übt auf die Schleimhaut des Rektums einen milden osmotischen Sekretionsreiz aus und setzt gleichzeitig den Defäkationsmechanismus in Gang | |
| Klistier | Natriumdihydrogenphosphat bewirkt ein osmotisches Druckgefälle, sodass vermehrt Flüssigkeit in das Darmlumen einströmt. Die dadurch bedingte Füllung und Drucksteigerung im Enddarm regt auf physiologische Weise die Darmperistaltik an |
| Sorbitol, Natriumdioctylsulfosuccinat, Docusat-Natrium wirkt stuhlerweichend. Sorbit ist ein osmotisch wirkendes Laxans. Docusat erleichtert in wässriger Sorbit-Lösung das Eindringen von Wasser und Fetten in den Darminhalt sowie die Benetzung der Darmwand | |
| Natriumcitrat, Dodecyl(sulfoacetat), Natriumsalz, Sorbitol-Lösung 70 % setzt das Wasser, das selbst im verhärteten Stuhlballen in gebundener Form reichlich vorhanden ist, frei. Dadurch kommt es zu einer Erweichung des Ballens, der nun leichter entleert werden kann [44] |
Einsatz der rektalen Entleerungshilfen
Der Einsatz der rektalen Laxanzien erfolgt nach einem Stufenplan im Sinne einer Eskalation, jeweils nach Überprüfung der Wirksamkeit (Abb. 3).
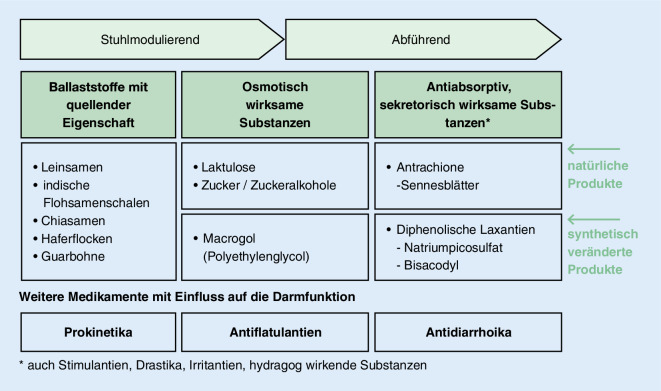
7.2 Orale Laxanzien (Tab. 11)
|
1. Ballaststoffe mit Quelleigenschaft Zunahme des Stuhlvolumens durch intestinale Flüssigkeitsaufnahme, reflektorische Anregung der Darmperistaltik. Da die Wirkung erst nach einigen Tagen eintritt, eignen sich diese Mittel nicht für eine sofortige Stuhlregulation. Zum Beispiel Flohsamenschalen (erfahrungsgemäß beginnen mit einem gestrichenen Teelöffel, kann bei Bedarf nach ca. 8 Tagen gesteigert werden) | |
|
2. Osmotisch aktive Laxanzien a Sog. Stuhlweichmacher, Wasserbindung im Kolon, erhöhen das Stuhlvolumen und bewirken dadurch reflektorisch eine Anregung der Peristaltik. Glaubersalze werden in der Langzeitbehandlung bei neurogenen Darmfunktionsstörungen nicht eingesetzt | |
|
Macrogol (Polyethylenglykol) |
Einsatz angepasst an Stuhlkonsistenz, Beginn mit 1 Btl./d, Dosissteigerung oder -reduktion nach Wirkung; Akute Obstipation: einmalig 5–6 Beutel auf 1–1,5 l über 3–4 h |
| Laktulose |
Einsatz angepasst an Stuhlkonsistenz, Beginn mit 7,5–15 ml Sirup (5–10 g Laktulose) 1‑bis 2‑mal/Tag, Dosisreduktion oder -steigerung nach Wirkung Akute Obstipation: einmalig 60–100 ml |
| 3. Antiabsorptiv-sekretorisch wirksame Substanzen a | |
| Antrachinone | Zum Beispiel der Sennesfrüchte oder Sennesblätter. Kurzfristige Anwendung – 3 Drg. zur Stimulation der Entleerung – ca. 12. h vor Entleerung einnehmen |
| Bisacodyl | 5–10 mg 1/Tag, kurzfristige Anwendung zur Stimulation der Entleerung, ca. 10–12 h vor Entleerung einnehmen |
| Natriumpicosulfat | 10–20 Tropfen 2‑tägig, kurzfristige Anwendung zur Stimulation der Entleerung, ca. 10–12 h vor Entleerung einnehmen |
aNebenwirkungen: Besonders die stark wirkenden stimulierenden Laxanzien – aber auch alle anderen – können bei nicht sachgerechtem Gebrauch durch enterale Verluste von Natrium, Kalium, Kalzium und Wasser zu Störungen des Elektrolythaushaltes führen. „Der intestinale Natriumverlust kann über einen sekundären Hyperaldosteronismus zusätzlich einen renalen Kaliumverlust verursachen. Die Kaliumverluste vermindern die Darmmotilität und verstärken die Obstipation, sodass eine Toleranz (Dosissteigerung) gegenüber dem Laxans entstehen kann“ [3]
Einsatz oraler Laxanzien
Die Verabreichung der oralen Laxanzien bei neurogenen Darmfunktionsstörungen erfolgt in einem Stufenplan von den Quell- und Fasermitteln zu den osmotisch wirksamen Substanzen. Erst wenn diese ausgetestet sind, werden antiabsorptiv, sekretorisch wirksame Substanzen eingesetzt (Abb. 4).
Empfehlungen
Zur Stuhlmodulation und Unterstützung der Darmfunktion sollten orale Laxanzien der Stufe 1 und 2 zur Anwendung kommen. (Konsens: 100 %)
Orale Laxanzien der Stufe 3 sollten bei Querschnittgelähmten mit neurogener Darmfunktionsstörung nur kurzzeitig zum Einsatz kommen. (Konsens: 100 %)
8. Operative Behandlungsmaßnahmen
8.1. Botulinumtoxin-A/externer analer Sphinkter (EAS)
Bei analer Sphinkterspastik mit Problemen bei der Entleerung, beim Einführen von Therapeutika oder beim digitalen Ausräumen, insbesondere wenn diese Vorgänge zur Auslösung einer autonomen Dysreflexie (siehe 9.2.) führen und sich somit Maßnahmen wie z. B. Stretching verbieten, kann nach Ausschöpfung konservativer therapeutischer Maßnahmen die Reduktion des Sphinktertonus auch durch eine Off-label-Therapie mit Botulinumtoxin‑A versucht werden. Hierbei werden von erfahrenen Anwendern einige wenige Einheiten (z. B. 10–40 IE Ona- oder Incobotulinumtoxin) intramuskulär, unter Injektionskontrolle mittels Ultraschall oder EMG, in die 4 Quadranten des M. sphincter ani externus verteilt [23]. Die Injektion sollte bei Tetraplegikern mit Risiko einer autonomen Dysreflexie unter Blutdruckmonitoring erfolgen; Inkontinenz nach zu hoher Dosierung sollte vermieden werden.
Empfehlung
Botulinumtoxin‑A kann bei „outlet constipation“ aufgrund eines spastischen Analsphinkters eingesetzt werden (off-label). (Konsens: 100 %)
8.2. Sakrale Neuromodulation/-stimulation (SNM/SNS)
Nach Ausschöpfung konservativer therapeutischer Maßnahmen kann die sakrale Neuromodulation (SNM) für ein selektives Patientenklientel mit inkompletter Querschnittlähmung in Erwägung gezogen werden [16, 34]. Prädiktoren für den Therapieerfolg sind nicht gesichert, u. a. wird die Dauer vom Zeitpunkt der neurologischen Diagnosestellung bis zur SNM als Faktor diskutiert [34]. Zur Objektivierung der 3‑ bis 4‑wöchigen Testphase ist neben klinischen Parametern auch die Beeinflussung der Lebensqualität zu überprüfen.
Kombiniert mit anderen Behandlungsmethoden (konservatives Darmmanagement) kann die SNM dazu beitragen, multiple Symptome der neurogenen Darmfunktionsstörung (nDFS) zu bessern [6].
Empfehlung
Nach Ausschöpfung konservativer therapeutischer Maßnahmen kann die sakrale Neuromodulation (SNM) für ein ausgewähltes Patientenklientel mit inkompletter Lähmung in Erwägung gezogen werden. (Konsens: 100 %)
8.3. Malone-Stoma
Es handelt sich um ein kontinentes Appendikostoma zur antegraden Spülung des Kolons. In der Literatur werden gute Ergebnisse bei Kindern mit Spina bifida beschrieben [21, 49].
Empfehlung
Ein Malone-Stoma kann als alternative Form der Behandlung einer Obstipation oder zum Erreichen einer sekundären Kontinenz bei Stuhlinkontinenz erwogen werden. (Konsens: 100 %)
8.4. Konus-Deafferentation, sakrale Deafferentation (SDAF nach Sauerwein) und sakrale Vorderwurzelstimulation (SARS nach Brindley)
Bei Auftreten einer relevanten autonomen Dysreflexie im Rahmen des Darmmanagements (z. B. während der digitalen Stimulation und Ausräumung) ist nach Ausschöpfung konservativer Maßnahmen die Deafferentation eine Therapieoption. Bei nDFS kann der Einsatz von Suppositorien, die Notwendigkeit der digitalen Evakuation oder die Applikation von Klysmen unter SARS signifikant gesenkt werden [46]. Die Darmfunktion kann mittels SARS verbessert werden, und die Patientenzufriedenheit mit dieser Therapie ist hoch [50].
Empfehlungen
Bei einer therapieresistenten autonomen Dysreflexie aufgrund des Darmmanagements sollte die Deafferentierung eine Therapieoption sein. (Konsens: 100 %)
Bei Indikation einer Deafferentierung soll der Einsatz der sakralen Vorderwurzelstimulation zur Verbesserung der Darmentleerung erwogen werden. (Konsens: 100 %)
8.5. Kolostoma
Im Langzeitverlauf unterziehen sich ca. 10 % der Querschnittgelähmten einer Stoma-Anlage [37]. Bei diesen ausgewählten Fällen kann durch eine Kolostomie eine erhebliche Verbesserung der Lebensqualität erreicht werden [2]. Mit der Entscheidung zur Anlage eines Stomas sollte bei diesen problematischen Fällen nicht zu lange gezögert werden [9].
Als definitive Lösung sollte in diesen Fällen das Kolon in Form eines endständigen Kolostomas abgeleitet werden [2]. Als passagere Lösung eignet sich auch ein doppelläufiges Kolostoma, z. B. bei Dekubitus und Stuhlinkontinenz (geringer chirurgischer Eingriff und leichtere Rückverlegung).
Die Lage des Stomas soll präoperativ vom Operateur bzw. Stomatherapeuten insbesondere unter Berücksichtigung der Sitzposition im Rollstuhl und der Handfunktion angezeichnet werden, und ein Probetragen eines aufgeklebten Beutels in der geplanten Positionierung wird empfohlen [9].
Empfehlung
Ein definitives Kolostoma sollte bei Versagen sämtlicher konservativer Maßnahmen und therapierefraktärer Obstipation oder Stuhlinkontinenz erwogen werden.
Es soll dann ein endständiges Kolostoma angelegt werden. (Konsens: 100 %)
9. Komplikationen
9.1. Meteorismus
Als Meteorismus wird ein geblähtes Abdomen mit oder ohne Flatulenz (vermehrter Windabgang) bezeichnet. Ursächlich abzugrenzen ist die Aerophagie (Luftschlucken). Blähungen entstehen unter anderem, wenn die Stuhlsäule zu lange im Kolon steht. Die Darmflora beginnt, den Darminhalt nochmals zu verarbeiten, dabei bildet sich durch Gärung Gas, welches den Meteorismus verursacht. Im Weiteren können folgende Faktoren ursächlich sein:
Zunahme des absoluten Volumens des Darminhaltes (u. a. durch Obstipation)
Abnahme des Tonus der Bauchmuskulatur
Nahrungsmittelunverträglichkeiten (z. B. Hülsenfrüchte, Kohl, Lauch, Zwiebeln)
Nahrungsmittelintoleranz oder Malabsorption
Spastischer Analsphinkter
Bei Querschnittlähmung stellt ein Meteorismus ein ernsthaftes klinisches Symptom dar, welches neben körperlichen Symptomen (Abgang von Darmgasen, Appetitlosigkeit, Völlegefühl, Unwohlsein, Bewegungseinschränkungen u. a.) schwerwiegende Komplikationen wie respiratorische Insuffizienz, Darmparalyse bis zum Ileus oder eine autonome Dysreflexie auslösen kann.
Empfehlung
Bei störendem Meteorismus sollen vor der Symptombehandlung die Ursachen evaluiert werden. (Konsens: 100 %)
Antiflatulantien
Gegen störenden Meteorismus können Antiflatulantien (Carminativa) auf natürlicher oder synthetischer Basis in Kombination mit Kolonmassage und/oder Bauchlage eingesetzt werden. Natürliche Produkte sind ätherische Öle wie z. B. Anis, Fenchel, Kümmel, Koriander, Pfefferminzblätter, Kamillenblüten etc. Sie wirken spasmolytisch auf die glatte Darmmuskulatur und gärungshemmend auf den Darminhalt. Zu den synthetischen Produkten gehören Dimeticon und Simeticon. Es handelt sich um langkettige organische Siliciumverbindungen, die im Magen-Darm-Kanal rein physikalisch die Oberflächenspannung von eingeschlossenen Gasblasen herabsetzen und diese dadurch auflösen.
9.2. Autonome Dysreflexie
Eine autonome Dysreflexie (AD) stellt ein potenziell lebensbedrohliches Syndrom dar, das bei einer Rückenmarkschädigung oberhalb Th6 (selten auch bei tieferen Lähmungen) auftreten kann [8, 33]. Bei kompletten Lähmungsformen ist die Gefahr deutlich größer (Häufigkeit: 91 %, bei inkompletter Lähmung: 27 %) und steigt mit zunehmender Lähmungsdauer [25]. Bedrohlich kann vor allem ein anfallsweiser Blutdruckanstieg (im Sinne einer hypertensiven Krise) mit konsekutiver Bradykardie sein. Eine autonome Dysreflexie kann sich u. a. durch klopfende Kopfschmerzen, vermehrtes Schwitzen, „Flush“ und Gänsehaut bemerkbar machen.
Auslöser einer durch den Darm getriggerten autonomen Dysregulation sind: Dehnungen des Darms/Rektums, Manipulationen wie digitales Ausräumen und rektales Einführen von Suppositorien oder die transanale Irrigation [13]. Die Dehnung des Darms ist nach der Dehnung der Harnblase der zweithäufigste auslösende Faktor [47].
Bei der transanalen Irrigation treten Symptome einer AD seltener und in geringer Ausprägung als bei der digitalen Ausräumung [13] auf. Die Instillation von lidocainhaltigem Gleitgel kann das Auftreten einer AD auch bei der digitalen Ausräumung verhindern [15].
Empfehlung
Bei bekanntem Risiko für eine autonome Dysreflexie sollen auslösende Trigger im Rahmen des Darmmanagements möglichst vermieden werden. (Konsens: 100 %)
9.3. Blutabgänge
Gelegentlich berichten Patienten über Blutabgänge im Zusammenhang mit der Darmentleerung. Dabei handelt es sich oft um Verletzungen der Rektumschleimhaut oder der Hämorrhoidalpolster, welche durch Manipulationen beim Ausräumen oder Irrigieren entstehen.
Vermieden werden Verletzungen durch den Gebrauch von ausreichend Gleitmittel, Handschuhen und einem sanften Vorgehen.
Empfehlung
Bei wiederholten Blutabgängen müssen andere Blutungsursachen wie Tumoren oder entzündliche Darmerkrankungen ausgeschlossen werden. (Konsens: 100 %)
9.4. „Fecal impaction“/paradoxe Diarrhoe
Eine spezielle Situation besteht bei der sog. „fecal impaction“. Wiederholte unvollständige Darmentleerungen führen zu einem fortschreitenden Aufstau der Stuhlmassen im Kolon bis hin zur Entwicklung eines Koprolithen (Kotstein) vor allem im Rektum.
Diese Stuhlmassen werden durch das Mikrobiom des Dickdarms erneut verarbeitet. Es resultiert ein Gärungsprozess, der zu einer Verflüssigung des Stuhls aboral führt und gleichzeitig den Gasdruck über der Stuhlsäule erhöht. Gleichzeitig triggert der Koprolith den rektoanalen Inhibitionsreflex (RAIR), wodurch der M. sphincter ani internus relaxiert wird. Ausgeschieden wird entweder dünnflüssiger, übelriechender Stuhl und/oder es kommt zu explosionsartigen Entleerungen, wenn sich genügend Druck aufgebaut hat.
Ohne Kenntnisse der Ursachen wird dies fälschlicherweise als banaler Durchfall interpretiert und eventuell mit Loperamid (verlangsamt Darmbewegung) behandelt, wodurch die Obstipation schließlich noch verschärft wird. Der Nachweis eines Koprolithen erfolgt durch digitale Austastung, Sonographie oder radiologisch (Abdomen-Leeraufnahme). Gelegentlich sichert ein Kontrastmittel-Einlauf die Diagnose. Eine Computertomographie ist meist entbehrlich (außer zum Ausschluss eines ursächlich stenosierenden Tumors).
9.5. Spezifische Diarrhoe-bedingte Risiken
Diarrhoe (nahrungsmittel-, antibiotika- oder infektionsbedingt) und damit einhergehende Inkontinenzereignisse bedeuten ein Gefährdungspotenzial für die Haut und den Harntrakt. Die Therapie ist zunächst immer symptomatisch, eindickend, absorbierend, in den seltensten Fällen kausal.
Neben der ursächlichen Therapie kann eine kurzzeitige Behandlung der Diarrhoe z. B. mit Loperamid erwogen werden.
Aufgrund des häufigen Antibiotikaeinsatzes bei Querschnittgelähmten kann es zu einer Antibiotika-assoziierten Diarrhoe, z. B. durch Clostridium difficile, kommen.
9.6. Lokale Komplikationen
Perianalvenenthrombosen und Analfissuren stellen akute, je nach Lähmung auch schmerzhafte Veränderungen dar, wobei die Fissur chronifizieren kann.
Im Langzeitverlauf kann sich sowohl ein Hämorrhoidalleiden entwickeln als auch ein Anal- oder Rektumschleimhautprolaps auftreten. Die Therapie erfolgt nach proktologischen Grundsätzen.
10. Hilfsmittel (Situation in Deutschland)
Zur Unterstützung des Darmmanagements stehen zahlreiche Hilfsmittel zur Verfügung.
Die Anleitung des Betroffenen oder einer Hilfsperson in die selbstständige Anwendung oder Durchführung muss grundsätzlich vor dem Einsatz von Hilfsmitteln sichergestellt sein (Tab. 12).
| Analtampona | Indikation: Stuhlinkontinenz bei schlaffem Analsphinkter |
| Duschrollstuhla | Ziel: physiologische Entleerungsposition und Reduktion von Transfers |
| Fäkalkollektora |
Indikation: Stuhlinkontinenz und Immobilität Prinzip = Stoma-Beutel |
| Fuß-Hockera | Zur Unterstützung der Sitzposition und Optimierung des anorektalen Winkels |
| Irrigationssysteme transanala | Siehe unter 6.2 |
| Stuhldauerableitungssysteme | Indikation: Stuhlinkontinenz, Immobilität, Wundschutz bei Dekubitus. Neben der Stuhlausleitung sind Darmspülung und/oder Medikamentengabe möglich |
| Toilettenpapiergreifhilfea | Einsatz bei eingeschränkter Handfunktion oder ungenügender Sitzstabilität |
| Toilettensitzauflagea | Abpolsterung des Toilettensitzes (Dekubitusprophylaxe) |
| Toilettensitzerhöhunga |
Erleichterung – Transfer Rollstuhl-Toilette-Rollstuhl Erleichterung – Zugang zum Analbereich bei Patienten mit frischen Frakturen im Lenden‑/Beckenbereich, welche keine Sitzposition in einem 90°-Winkel einnehmen dürfen |
| Zäpfchen-Steckhilfe |
Anwendung bei eingeschränkter Handfunktion Cave: Verletzungen im Analbereich |
aSind im Hilfsmittelverzeichnis [18] gelistet
Empfehlung
Die Kostenübernahme der Hilfsmittel soll vorab mit dem zuständigen Kostenträger geklärt werden. (Konsens: 100 %)
Caption Electronic Supplementary Material
Abkürzungen
- AWMF
Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften
- CT
Computertomographie
- ISCoS
International Spinal Cord Society
- LMNL
Lower motor neuron lesion
- MR
Magnetresonanz
- NBD
Neurogenic bowel dysfunction
- nDFS
Neurogene Darmfunktionsstörungen
- OTC
Over the counter
- RAIR
Rektoanaler Inhibitionsreflex
- SADF
Sakrale Deafferentation
- SARS
Sakrale Stimulation der Vorderwurzel
- SNM
Sakrale Neuromodulation
- UMNL
Upper motor neuron lesion
- WHO
World Health Organization
Einhaltung ethischer Richtlinien
Interessenkonflikt
Die Erstellung dieser Leitlinie wurde von der Manfred-Sauer-Stiftung, Lobbach, unterstützt, welche für das Sitzungszimmer und Verpflegung im Rahmen der Konsensus-Konferenzen sowie die grafische Gestaltung und den Druck der Broschüre aufkam. Die Autoren V. Geng, R. Böthig, A. Hildesheim, I. Kurze und E.D. Leder haben erklärt, dass bei ihnen gemäß den AWMF Kriterien keine Interessenkonflikte vorliegen. Erklärungen über Interessenkonflikte aller Arbeitsgruppen-Mitglieder können im Leitlinienreport unter dem Link https://www.awmf.org/uploads/tx_szleitlinien/179-004m_S2k_Neurogene-Darmfunktionsstoerung-Querschnittlaehmung_2019-10.pdf eingesehen werden.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
E.D. Leder ist vor der Veröffentlichung dieses Beitrags verstorben.
Literatur
- 1.ADA American Dieticians Association . Spinal cord injury nutrition evidence based guidelines. 2010. [Google Scholar]
- 2.Branagan G, Tromans A, Finnis D. Effect of stoma formation on bowel care and quality of life in patients with spinal cord injury. Spinal Cord. 2003;41:680–683. doi: 10.1038/sj.sc.3101529. [DOI] [PubMed] [Google Scholar]
- 3.Brune K, Lemmer B. Pharmakotherapie. Berlin, Heidelberg, New York: Springer; 2010. [Google Scholar]
- 4.Cameron AP, Rodriguez GM, Gursky A, He C, Clemens JQ, Stoffel JT. The severity of bowel dysfunction in patients with neurogenic bladder. J Urol. 2015;194(5):1336–1341. doi: 10.1016/j.juro.2015.04.100. [DOI] [PubMed] [Google Scholar]
- 5.Carlson M, Vigen C, Rubayi S, Blanche E, Blanchard J, Atkins M, Bates-Jensen B, Garber S, Pyatak E, Diaz J, Florindez L, Hay J, Mallinson T, Unger J, Azen S, Scott M, Cogan Clark AF. Lifestyle intervention for adults with spinal cord injury: results of the USC–RLANRC pressure ulcer prevention study 2017. J Spinal Cord Med. 2019;42(1):2–19. doi: 10.1080/10790268.2017.1313931. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chen G, Liao L. Sacral neuromodulation for neurogenic bladder and bowel dysfunction with multiple symptoms secondary to spinal cord disease. Spinal Cord. 2014;53(3):204–208. doi: 10.1038/sc.2014.157. [DOI] [PubMed] [Google Scholar]
- 7.Chung EA, Emmanuel AV. Gastrointestinal symptoms related to autonomic dysfunction following spinal cord injury. Prog Brain Res. 2006;152:317–333. doi: 10.1016/S0079-6123(05)52021-1. [DOI] [PubMed] [Google Scholar]
- 8.Coggrave M, Norton C, Wilson-Barnett J. Management of neurogenic bowel dysfunction in the community after spinal cord injury: a postal survey in the United Kingdom. Spinal Cord. 2009;47(4):323–330. doi: 10.1038/sc.2008.137. [DOI] [PubMed] [Google Scholar]
- 9.Coggrave M, Ingram RM, Gardner BP, Norton CS. The impact of stoma for bowel management after spinal cord injury. Spinal Cord. 2012;50:848–852. doi: 10.1038/sc.2012.66. [DOI] [PubMed] [Google Scholar]
- 10.D-A-CH Deutsche Gesellschaft für Ernährung (DGE) Österreichische Gesellschaft für Ernährung (ÖGE) Schweizerische Gesellschaft für Ernährung (SGE) Referenzwerte für die Nährstoffzufuhr. 2 2016. [Google Scholar]
- 11.Dietz V. Pathophysiologie, Klinik und Therapie von Blasenfunktionen, Bewegung und Vegetativum. Stuttgart: Kohlhammer; 1996. [Google Scholar]
- 12.Emmanuel AV, Krogh K, Bazzocchi G, et al. Consensus review of best practice of transanal irrigation in adults. Spinal Cord. 2013;51:732–738. doi: 10.1038/sc.2013.86. [DOI] [PubMed] [Google Scholar]
- 13.Faaborg PM, Christensen P, Krassioukov A, Laurberg S, Frandsen E, Krogh K. Autonomic dysreflexia during bowel evacuation procedures and bladder filling in subjects with spinal cord injury. Spinal Cord. 2014;52(6):494–498. doi: 10.1038/sc.2014.45. [DOI] [PubMed] [Google Scholar]
- 14.Faaborg PM, Finnerup NB, Christensen P, Krogh K. Abdominal pain: a comparison between neurogenic bowel dysfunction and chronic idiopathic constipation. Gastroenterol Res Pract. 2013 doi: 10.1155/2013/365037. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Furusawa K, Sugiyama H, Tokuhiro A, Takahashi M, Nakamura T, Tajima F. Topical anesthesia blunts the pressor response induced by bowel manipulation in subjects with cervical spinal cord injury. Spinal Cord. 2009;47(2):144–148. doi: 10.1038/sc.2008.86. [DOI] [PubMed] [Google Scholar]
- 16.Gstaltner K, Rosen H, Hufgard J, Mark R, Schrei K. Sacral nerve stimulation as an option for the treatment of faecal incontinence in patients suffering from cauda equina syndrome. Spinal Cord. 2008;46:644–647. doi: 10.1038/sc.2008.6. [DOI] [PubMed] [Google Scholar]
- 17.Gerner HJ. Rückenmarkschädigung Erstversorgung, Behandlungsstrategie, Rehabilitation. Berlin: Blackwell; 1992. p. 102. [Google Scholar]
- 18.GKV Spitzenverband (2019) Hilfsmittelverzeichnis Produktgruppe 10 Krankenpflegeartikel. https://hilfsmittel.gkv-spitzenverband.de/produktgruppeAnzeigen_input.action?gruppeId=19. Zugegriffen: 6. Febr. 2019
- 19.Gosselink MJ, Hop WC, Schouten WR. Rectal tone in response to bisacodyl in women with obstructed defecation. Int J Colorectal Dis. 2000;15(5–6):297–302. doi: 10.1007/s003840000259. [DOI] [PubMed] [Google Scholar]
- 20.Hanak M, Scott A. Spinal cord injury, an illustrated guide for health care professionals. Berlin, Heidelberg, New York: Springer; 1993. [Google Scholar]
- 21.Imai K, Shiroyanagi Y, Kim WJ, Ichiroku T, Yamazaki Y. Satisfaction after the Malone antegrade continence enema procedure in patients with spina bifida. Spinal Cord. 2014;52:54–57. doi: 10.1038/sc.2013.111. [DOI] [PubMed] [Google Scholar]
- 22.Abrams P, Cardozo L, Wagg A, Wein A, editors. Incontinence. 6. Bristol: ICI-ICS; 2017. p. 361. [Google Scholar]
- 23.Jost W. Bildatlas der Botulinumtoxin-Injektion: Dosierung/Lokalisation/Anwendung. Marburg: KVM; 2007. [Google Scholar]
- 24.Kirshblum SC, Burns S, Biering-Sorensen F, Donovan W, Graves E, Jha A, Johansen M, Jones L, Krassi-oukov A, Mulcahey MJ, Schmidt-Read M, Waring W. International standards for neurological classification of spinal cord injury (Revised 2011) J Spinal Cord Med. 2011;34(6):535–546. doi: 10.1179/204577211X13207446293695. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Krassioukov A, Eng JJ, Claxton G, Sakakibara BM, Shum S. Neurogenic bowel management after spinal cord injury: a systematic review of the evidence. Spinal Cord. 2010;48(10):718–733. doi: 10.1038/sc.2010.14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Krogh K, Christensen P, Sabroe S, Laurberg S. Neurogenic bowel dysfunction score. Spinal Cord. 2006;44(10):625–631. doi: 10.1038/sj.sc.3101887. [DOI] [PubMed] [Google Scholar]
- 27.Krogh K, Perkash I, Stiens SA, Biering-Sørensen F. International bowel function basic spinal cord injury data set. Spinal Cord. 2009;47(1):93–94. doi: 10.1038/sc.2008.102. [DOI] [PubMed] [Google Scholar]
- 28.Krogh K. Colorectal function in spinal cord injury: symptoms and pathophysiology. 2004. [Google Scholar]
- 29.Krogh K et al (2017) The International Spinal Cord Injury Bowel Function Basic Data Set (Version 2.1) include minor adjustments to the International Spinal Cord Injury Bowel Function Basic Data Set (Version 2.0). https://www.iscos.org.uk/international-sci-bowel-data-sets. Zugegriffen: 17. Juli 2019
- 30.Lämås K, Lindholm L, Stenlund H, Engström B, Jacobsson C. Effects of abdominal massage in management of constipation—A randomized controlled trial. Int J Nurs Stud. 2009;46(6):759–767. doi: 10.1016/j.ijnurstu.2009.01.007. [DOI] [PubMed] [Google Scholar]
- 31.Leder D, Geng V. Physiologie und Pathophysiologie des Gastrointestinaltrakts. Ernährung und Verdauung. In: Zäch GA, Koch HG, editors. Paraplegie – Ganzheitliche Rehabilitation. Basel: Karger; 2006. [Google Scholar]
- 32.Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. 1997;32(9):920–924. doi: 10.3109/00365529709011203. [DOI] [PubMed] [Google Scholar]
- 33.Liu CW, Huang CC, Chen CH, Yang YH, Chen TW, Huang MH. Prediction of severe neurogenic bowel dysfunction in persons with spinal cord injury. Spinal Cord. 2010;48(7):554–559. doi: 10.1038/sc.2009.181. [DOI] [PubMed] [Google Scholar]
- 34.Lombardi G, Del Popolo G, Cecconi F, Surrenti E, Macchiarella A. Clinical outcome of sacral neuromodulation in incomplete spinal cord-injured patients suffering from neurogenic bowel dysfunctions. Spinal Cord. 2010;48(2):154–159. doi: 10.1038/sc.2009.101. [DOI] [PubMed] [Google Scholar]
- 35.Mazor Y, Jones M, Andrews A, Kellow JW, Malcolm A. Anorectal biofeedback for neurogenic bowel dysfunction in incomplete spinal cord injury. Spinal Cord. 2016;54(12):1132–1138. doi: 10.1038/sc.2016.67. [DOI] [PubMed] [Google Scholar]
- 36.Mehnert U. Chapter 24: Management of bladder, bowel, and sexual dysfunction. In: Dietz V, Ward N, editors. Oxford textbook of neurorehabilitation. 2015. pp. 283–287. [Google Scholar]
- 37.Nielsen SD, Faaborg PM, Finnerup NB, Christensen P, Krogh K. Ageing with neurogenic bowel dysfunction. Spinal Cord. 2017;55:769–773. doi: 10.1038/sc.2017.22. [DOI] [PubMed] [Google Scholar]
- 38.Nino-Murcia M, Stone JM, Chang PJ. Colonic transit in spinal cord injured patients. Invest Radiol. 1990;25:109–112. doi: 10.1097/00004424-199002000-00002. [DOI] [PubMed] [Google Scholar]
- 39.Orkin BA, Sinykin SB, Lloyd PC. The digital rectal examination scoring system (DRESS) Dis Colon Rectum. 2010;53(12):1656–1660. doi: 10.1007/DCR.0b013e3181f23c85. [DOI] [PubMed] [Google Scholar]
- 40.Ozisler Z, Koklu K, Ozel S, Unsal-Delialioglu S. Outcomes of bowel program in spinal cord injury pa-tients with neurogenic bowel dysfunction. Neural Regen Res. 2015;10(7):1153–1158. doi: 10.4103/1673-5374.160112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Paeslack V. Internistische Störungen beim Paraplegiker. Stuttgart: Thieme; 1965. [Google Scholar]
- 42.Park HJ, Noh SE, Kim GD, Joo MC. Plain abdominal radiograph as an evaluation method of bowel dysfunction in patients with spinal cord injury. Ann Rehabil Med. 2013;37(4):547–555. doi: 10.5535/arm.2013.37.4.547. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Partida E, Mironets E, Hou S, Tom VJV. Cardiovascular dysfunction following spinal cord injury. Neural Regen Res. 2016;11(2):189–194. doi: 10.4103/1673-5374.177707. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Pharmavista (2017) Homepage. www.pharmavista.ch. Zugegriffen: 17. Nov. 2017
- 45.Rabchevsky A, Kitzman P. Latest approaches for the treatment of spasticity and autonomic dysreflexia in chronic spinal cord injury. Neurotherapeutics. 2017;8(2):274–282. doi: 10.1007/s13311-011-0025-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Rasmussen MM, Kutzenberger J, Krogh K, Zepke F, Bodin C, Domurath B, Christensen P. Sacral anterior root stimulation improves bowel function in subjects with spinal cord injury. Spinal Cord. 2015;53(4):297–301. doi: 10.1038/sc.2015.2. [DOI] [PubMed] [Google Scholar]
- 47.SCIRE Community Team Scire-Spinal cord injury research evidence. https://scireproject.com/community/topic/autonomic-dysreflexia/. Zugegriffen: 10. Okt. 2017 (Reviewed by: Krassioukov A, Eng J)
- 48.Scott D, Papa MZ, Sareli M, Velano A, Ben-Ari GY, Koller M. Management of hemorrhoidal disease in patients with chronic spinal cord injury. Tech Coloproctol. 2002;6(1):19–22. doi: 10.1007/s101510200003. [DOI] [PubMed] [Google Scholar]
- 49.Smith PH, Decter RM. Antegrade continence enema procedure: impact on quality of life in patients with spinal cord injury. Spinal Cord. 2015;53:213–215. doi: 10.1038/sc.2014.223. [DOI] [PubMed] [Google Scholar]
- 50.Vallès M, Rodríguez A, Borau A, Mearin F. Effect of sacral anterior root stimulator on bowel dysfunction in patients with spinal cord injury. Dis Colon Rectum. 2009;52(5):986–992. doi: 10.1007/DCR.0b013e31819ed459. [DOI] [PubMed] [Google Scholar]
- 51.Vallès M, Vidal J, Clavé P, Mearin F. Bowel dysfunction in patients with motor complete spinal cord injury: clinical, neurological, and pathophysiological associations. Am J Gastroenterol. 2006;101(10):2290–2299. doi: 10.1111/j.1572-0241.2006.00729.x. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.