Sr. Editor:
En diciembre de 2019, se informó por primera vez de una serie de casos de síndrome respiratorio agudo grave (SARS) en Wuhan (China). Se aisló un nuevo coronavirus y se lo denominó SARS-CoV-21. El 1 de abril de 2020, la Organización Mundial de la Salud declaró pandemia mundial2 la enfermedad causada por el SARS-CoV-2, conocida como enfermedad coronavírica de 2019 (COVID-19).
Aunque la principal manifestación clínica de este nuevo virus tiene lugar en el sistema respiratorio, también pueden afectarse otros órganos como el corazón. Hay varios mecanismos por medio de los cuales el SARS-CoV-2 podría causar daño miocárdico. La presencia de receptores de la enzima de conversión de la angiotensina 2 (que este virus utiliza para invadir el neumocito) en los cardiomiocitos podría estar relacionada con la aparición de miocarditis, que puede causar disfunción sistólica e insuficiencia cardiaca (IC)3. Otro mecanismo de daño cardiaco podría ser la gran actividad inflamatoria. La COVID-19 precipita una tormenta de citocinas con aumento de la concentración de interleucinas (principalmente IL-2, IL-7 e IL-10) y otras citocinas proinflamatorias, tales como el factor estimulador de colonias de granulocitos y el factor de necrosis tumoral, entre otros mediadores de la respuesta sistémica y la respuesta inflamatoria local. Esta tormenta proinflamatoria puede reducir el flujo a las arterias coronarias, así como desestabilizar las placas de ateroesclerosis coronaria, en relación con el estado de hipercoagulabilidad que precipita la trombosis microvascular causante del daño miocárdico y el consiguiente aumento de troponinas (Tn)4, 5.
En situaciones de hipoxemia o hipotensión prolongada, también puede tener lugar un infarto agudo de miocardio de tipo 2. Por último, la miocardiopatía causada por estrés o las taquicardias debidas a descarga adrenérgica, tanto endógena como exógena, son otras formas de daño miocárdico relacionadas con este virus6.
Este estudio se realizó para evaluar el impacto en la mortalidad, la IC y la combinación de ambas con elevación de la TnI en la COVID-19 de pacientes con y sin cardiopatía previa, determinada por antecedentes de cardiopatía isquémica, al menos valvulopatía moderada o disfunción del ventrículo izquierdo (fracción de eyección del ventrículo izquierdo < 40%).
Entre el 10 de marzo y el 6 de abril del 2020, se incluyó a todos los pacientes de nuestra área de salud con infección por SARS-CoV-2 confirmada que ingresaron en el hospital (n = 245). De estos, 33 (14,1%) requirieron cuidados intensivos. Se registró un total de 27 defunciones (11%), y 35 pacientes (14,3%) sufrieron IC. Un total de 42 pacientes sufrieron cardiopatía (17,1%) y, de estos, 15 tenían aumentadas las Tn (el 35,7 frente al 13,3% de los pacientes sin cardiopatía).
La tabla 1 resume las características iniciales de los pacientes con COVID-19 y compara las cohortes con valores normales y elevados de TnI, así como los resultados del análisis univariante para ver la relación existente entre la mortalidad y la IC en todos los pacientes hospitalizados.
Tabla 1.
Características basales de la población total y por subgrupos, y variables relacionadas con la mortalidad y la insuficiencia cardiaca
| Características basales de la población total y por subgrupos | ||||
|---|---|---|---|---|
| Población total n = 245 (100%) |
Concentración de troponina aumentada n = 42; (17,1%) |
Concentración de troponina normal n = 203; (82,9%) |
p | |
|
Cuadro clínico | ||||
| Días con síntomas |
6,6 ± 4,8 |
5,4 ± 4,6 |
6,8 ± 4,8 |
0,077 |
| Fiebre |
198 (80,8) |
31 (73,8) |
167 (82,3) |
0,205 |
| SaO2 < 95% |
134 (54,7) |
30 (71,4) |
104 (51,2) |
0,017 |
|
Características demográficas | ||||
| Edad (años) |
67,6 ± 15,7 |
77,2 ± 10,8 |
65,6 ± 15,9 |
< 0,001 |
| Mujeres |
99 (40,4) |
12 (28,6) |
87 (42,9) |
0,086 |
| Obesidad |
27 (11,0) |
7 (16,7) |
20 (9,9) |
0,199 |
| Trabajador sanitario |
12 (4,9) |
1 (2,4) |
11 (5,4) |
0,406 |
| Residencia de ancianos |
8 (3,3) |
3 (7,1) |
5 (2,5) |
0,120 |
| Demencia |
10 (4,1) |
5 (11,9) |
5 (2,5) |
0,005 |
| Dependencia |
27 (11,0) |
12 (28,6) |
15 (7,4) |
< 0,001 |
|
Factores de riesgo cardiovascular | ||||
| Fumador en el momento del estudio |
7 (2,9) |
0 |
7 (3,4) |
0,222 |
| Hipertensión |
117 (47,8) |
27 (64,3) |
90 (44,3) |
0,018 |
| Diabetes mellitus |
61 (24,9) |
20 (47,6) |
41 (20,2) |
< 0,001 |
| Dislipemia |
114 (46,5) |
25 (59,5) |
89 (43,8) |
0,064 |
| Arteriopatía periférica |
20 (8,2) |
12 (28,6) |
8 (3,9) |
< 0,001 |
|
Cardiopatía | ||||
| Cardiopatía isquémica |
24 (9,8) |
9 (21,4) |
15 (7,4) |
0,005 |
| Disfunción del ventrículo izquierdo |
13 (5,3) |
8 (19,0) |
5 (2,5) |
< 0,001 |
| Valvulopatía |
12 (4,9) |
2 (4,8) |
10 (4,9) |
0,964 |
| Fibrilación auricular |
15 (6,1) |
7 (16,7) |
8 (3,9) |
0,002 |
|
Arteriopatía pulmonar | ||||
| Afección pulmonar |
48 (19,6) |
7 (16,7) |
41 (20,2) |
0,600 |
| EPOC/asma |
31 (12,7) |
7 (16,7) |
24 (11,9) |
0,390 |
| SAHOS |
12 (4,9) |
0 |
12 (5,9) |
0,106 |
|
Otras comorbilidades | ||||
| Insuficiencia renal, TFGe < 30 ml/min |
14 (5,7) |
9 (21,4) |
5 (2,5) |
< 0,001 |
| Ictus/AIT |
13 (5,3) |
7 (16,7) |
6 (3,0) |
< 0,001 |
| Neoplasia |
5 (2,0) |
4 (9,5) |
1 (2,0) |
0,864 |
| Hipotiroidismo |
10 (4,1) |
2 (4,8) |
8 (3,9) |
0,807 |
| Enfermedad autoinmunitaria |
15 (6,1) |
2 (4,8) |
13 (6,4) |
0,686 |
|
Análisis (solo de los pacientes ingresados) | ||||
| pO2 < 60 mmHg |
176 (71,7) |
36 (85,7) |
140 (68,7) |
0,027 |
| pO2 < 45 mmHg |
16 (6,3) |
7 (16,7) |
9 (4,1) |
0,002 |
| Hemoglobina (g/dl) |
13,2 ± 1,9 |
12,3 ± 2,6 |
13,4 ± 1,7 |
0,015 |
| Leucocitos (103/μl) |
65 ± 3,4 |
8,0 ± 4,7 |
6,2 ± 3,1 |
0,021 |
| Linfocitos (103/μl) |
0,9 ± 0,8 |
0,7 ± 1,2 |
0,9 ± 0,7 |
0,099 |
| Plaquetas (103/μl) |
201,1 ± 98,3 |
187,1 ± 108,9 |
201,9 ± 96,4 |
0,771 |
| Creatinina (mg/dl) |
1,2 ± 0,9 |
1,8 ± 1,5 |
1,0 ± 0,7 |
0,002 |
| Dímero D (ng/ml) |
2.779,8 ± 10.370,3 |
4.351,5 ± 6.419,8 |
2.460,6 ± 10.985,6 |
0,294 |
| Ferritina (ng/ml) |
926,2 ± 998,4 |
1.291,8 ± 1.407,2 |
856,8 ± 888,6 |
0,090 |
| Proteína C reactiva (mg/dl) |
12,2 ± 13,5 |
15,5 ± 11,7 |
11,5 ± 13,7 |
0,083 |
| Interleucina 6 (pg/ml) |
113,1 ± 408,0 |
355.0 ± 942,1 |
71,3 ± 186,1 |
0,117 |
|
Tratamientos previos | ||||
| Tratamiento antiagregante plaquetario |
36 (14,7) |
14 (33,3) |
22 (10,8) |
< 0,001 |
| Anticoagulación |
27 (11,0) |
12 (28,6) |
15 (7,4) |
< 0,001 |
| Bloqueadores beta |
37 (15,1) |
14 (33,3) |
23 (11,3) |
< 0,001 |
| IECA/ARA-II |
81 (33,1) |
20 (47,6) |
61 (30,0) |
0,028 |
| Corticoides | 20 (8,2) | 4 (9,5) | 16 (7,9) | 0,724 |
| Variables asociadas a la mortalidad y a la insuficiencia cardiaca | ||||||
|---|---|---|---|---|---|---|
|
Variables |
Mortalidad |
Insuficiencia cardiaca |
||||
| OR | IC95% | p | OR | IC95% | p | |
| Días con síntomas, por cada día |
0,91 |
0,83-1,02 |
0,096 |
1,06 |
0,99-1,13 |
0,081 |
| Fiebre |
0,81 |
0,31-2,14 |
0,671 |
0,77 |
0,32-1,82 |
0,552 |
| SaO2 < 95% |
4,16 |
1,52-11,39 |
0,005 |
4,83 |
1,93-12,12 |
0,001 |
| Edad, por cada año |
1,11 |
1,06-1,16 |
< 0,001 |
1,02 |
0,99-1,04 |
0,196 |
| Sexo femenino |
0,30 |
0,11-0,82 |
0,019 |
0,98 |
0,47-2,04 |
0,958 |
| Obesidad |
2,02 |
0,70-5,88 |
0,195 |
1,05 |
0,34-3,24 |
0,934 |
| Trabajador sanitario |
— |
— |
— |
0,53 |
0,07-4,26 |
0,552 |
| Residencia de ancianos |
5,32 |
1,20-23,68 |
0,028 |
0,85 |
0,10-7,15 |
0,883 |
| Demencia |
3,77 |
0,91-15,54 |
0,067 |
— |
— |
— |
| Dependencia |
3,46 |
1,31-9,19 |
0,013 |
0,45 |
0,10-1,98 |
0,291 |
| Fumador en el momento del estudio |
— |
— |
— |
1,00 |
0,12-8,57 |
1,000 |
| Hipertensión |
1,20 |
0,54-2,68 |
0,652 |
1,04 |
0,51-2,13 |
0,917 |
| Diabetes mellitus |
8,14 |
3,42-19,37 |
< 0,001 |
1,99 |
0,94-4,25 |
0,073 |
| Dislipemia |
1,50 |
0,67-3,36 |
0,321 |
1,89 |
0,91-3,91 |
0,088 |
| Arteriopatía periférica |
7,23 |
2,63-19,86 |
< 0,001 |
2,90 |
1,03-8,14 |
0,044 |
| Cardiopatía isquémica |
4,14 |
1,53-11,17 |
0,005 |
2,21 |
0,81-6,02 |
0,122 |
| Disfunción del ventrículo izquierdo |
5,97 |
1,80-18,82 |
0,004 |
4,21 |
1,29-13,71 |
0,017 |
| Valvulopatía |
4,57 |
1,28-16,34 |
0,020 |
3,53 |
0,93-11,47 |
0,066 |
| Fibrilación auricular |
4,73 |
1,48-15,08 |
0,009 |
3.33 |
1,07-10,42 |
0,038 |
| Afección pulmonar |
2,29 |
0,96-5,49 |
0,062 |
1,52 |
0,66-3,50 |
0,327 |
| EPOC/asma |
2,21 |
0,81-5,99 |
0,120 |
1,94 |
0,76-4,91 |
0,164 |
| SAHOS |
2,90 |
0,73-11,46 |
0,128 |
1,21 |
0,25-5,78 |
0,809 |
| TFGe < 30 ml/min |
7,50 |
2,38-23,68 |
0,001 |
1,70 |
0,45-6,41 |
0,436 |
| Ictus/AIT (previo) |
4,04 |
1,15-14,15 |
0,029 |
0,49 |
0,06-3,85 |
0,494 |
| Cáncer (previo) |
2,06 |
0,22-19,11 |
0,526 |
4,18 |
0,67-25,98 |
0,125 |
| Hipotiroidismo |
0,89 |
0,11-7,34 |
0,916 |
2,72 |
0,67-11,06 |
0,162 |
| Enfermedad autoinmunitaria |
— |
— |
— |
2,33 |
0,70-7,79 |
0,168 |
| pO2 < 60 mmHg |
3,34 |
0,97-14,52 |
0,056 |
2,09 |
0,83-5,29 |
0,120 |
| pO2 < 45 mmHg |
0,56 |
0,07-4,47 |
0,586 |
11,31 |
3,72-34,34 |
< 0,001 |
| Hemoglobina (g/dl) |
0,69 |
0,56-0,84 |
< 0,001 |
0,92 |
0,76-1,11 |
0,366 |
| Leucocitos, cada 1.000 |
1,23 |
1,11-1,36 |
< 0,001 |
1,11 |
1,01-1,21 |
0,027 |
| Linfocitos, cada 100 |
0,90 |
0,51-1,61 |
0,728 |
0,09 |
0,03-0,31 |
< 0,001 |
| Plaquetas, cada 100.000 |
1,20 |
0,84-1,72 |
0,315 |
1,19 |
0,85-1,65 |
0,307 |
| Creatinina, cada 1 g/dl |
1,64 |
1,14-2,34 |
0,007 |
1,51 |
1,08-2,10 |
0,016 |
| Dímero D, cada 100 unidades |
1,01 |
1,00-1,01 |
0,049 |
1,00 |
0,99-1,00 |
0,770 |
| Ferritina, cada 100 unidades |
1,02 |
0,98-1,06 |
0,473 |
1,05 |
1,02-1,09 |
0,002 |
| PCR, cada unidad |
1,02 |
0,99-1,05 |
0,068 |
1,05 |
1,02-1,08 |
0,003 |
| Interleucina 6, cada unidad |
1,00 |
1,00-1,01 |
0,358 |
1,01 |
1,00-1,01 |
0,018 |
| Tratamiento antiagregante plaquetario |
1,37 |
0,48-3,89 |
0,553 |
0,96 |
0,34-2,67 |
0,941 |
| Anticoagulación |
10,83 |
4,30-27,24 |
< 0,001 |
5,56 |
2,31-13,56 |
< 0,001 |
| IECA/ARA-II |
1,22 |
0,53-2,79 |
0,642 |
1,23 |
0,59-2,60 |
0,580 |
| Bloqueadores beta |
5,08 |
2,13-12,12 |
< 0,001 |
2,71 |
1,17-6,26 |
0,020 |
| Corticoides | 0,40 | 0,05-3,13 | 0,385 | 1,06 | 0,30-3,84 | 0,924 |
AIT: accidente isquémico transitorio; ARA-II: antagonistas del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidores de la enzima de conversión de la angiotensina; PCR: proteína C reactiva; pO2: presión parcial de oxígeno; SAHOS: síndrome de apneas/hipopneas obstructivas del sueño; SaO2: saturación arterial de oxígeno; TFGe: tasa de filtrado glomerular estimada.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Los análisis multivariantes se ajustaron para las variables con un valor de p < 0,05 en el análisis univariante:
• Ajuste de la mortalidad por edad, sexo, SaO2 < 95%, residencia de ancianos, dependencia, diabetes mellitus, arteriopatía periférica, cardiopatía, fibrilación auricular, ictus previo, enfermedad renal crónica, hemoglobina, leucocitos, creatinina, dímero D, anticoagulación y bloqueadores beta.
• Ajuste de la insuficiencia cardiaca por SaO2 < 95%, arteriopatía periférica, disfunción ventricular, fibrilación auricular, hipercapnia, leucocitos, linfocitos, creatinina, ferritina, PCR, interleucina 6, anticoagulación y bloqueadores beta.
• Ajuste del resultado combinado de muerte e insuficiencia cardiaca por edad, sexo, SaO2 < 95%, residencia de ancianos, dependencia, diabetes mellitus, arteriopatía periférica, cardiopatía, fibrilación auricular, ictus previo/AIT, hipercapnia, hemoglobina, leucocitos, linfocitos, creatinina, dímero D, ferritina, PCR, IL-6, anticoagulación y bloqueadores beta.
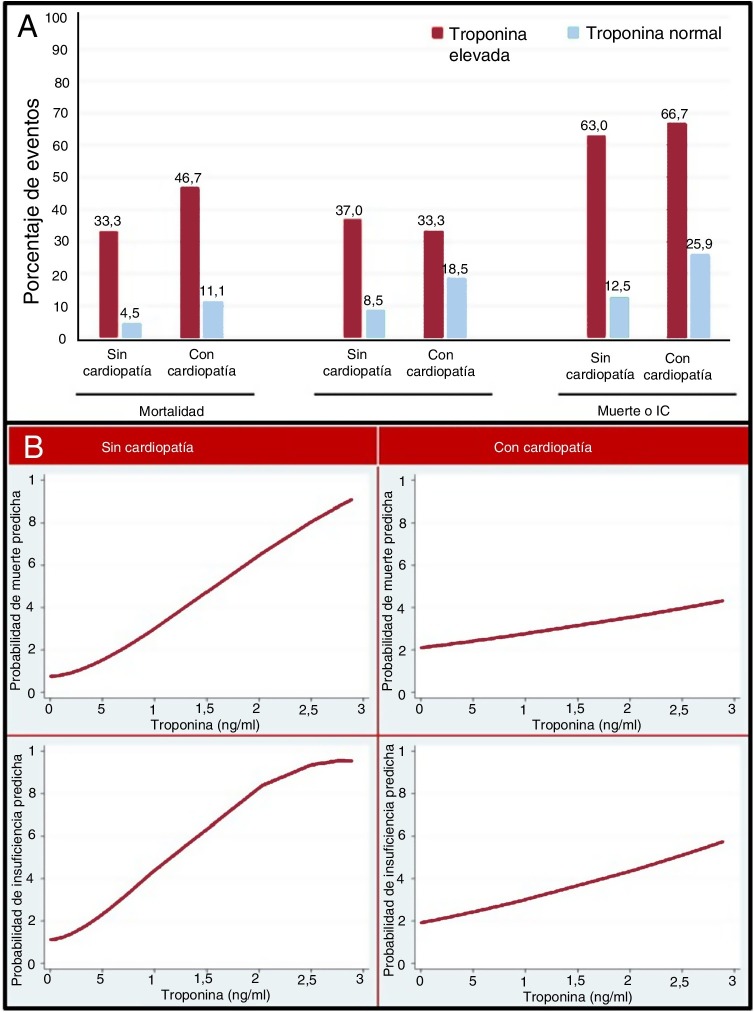
La figura 1A representa las complicaciones clínicas observadas en pacientes con TnI elevada o normal, en función de la presencia previa de cardiopatía. En todos los grupos, la elevación de la TnI sirvió para identificar a un grupo de pacientes con un peor pronóstico, pero la frecuencia de eventos en los pacientes con la TnI elevada, comparados con aquellos con la TnI normal, fue mayor en los pacientes sin cardiopatía alguna.
Figura 1.
A: eventos en pacientes con concentraciones de troponina normal o alta en función de si padecen una cardiopatía o no. B: relación entre la troponina y la probabilidad predicha de muerte o IC según la presencia o ausencia de cardiopatía. IC: insuficiencia cardiaca.
En los análisis ajustados y sin ajustar sobre la relación entre la TnI y las complicaciones observadas durante la hospitalización, la elevación de la TnI se relacionó con mayor mortalidad (odds ratio [OR] = 334; intervalo de confianza del 95% [IC95%], 4,91-2.285,10; p = 0,025), pero no con un mayor riesgo de sufrir IC (OR = 3,12; IC95%, 0,72-13,63; p = 0,130). El resultado combinado de mortalidad e IC fue más frecuente en el grupo con la TnI elevada (OR = 5,58; IC95%, 1,24-25-12; p = 0,025).
En el análisis multivariante sobre la relación entre la TnI y las complicaciones clínicas en pacientes con y sin cardiopatías previas, la elevación de TnI se relacionó con mayor mortalidad (OR = 4,93; IC95%, 1,24-19,52; p = 0,023), IC (OR = 4,28; IC95%, 1,30-14,07; p = 0,017) y el resultado combinado de mortalidad o IC (OR = 7,09; IC95%, 2,28-22,03; p = 0,001) en pacientes sin cardiopatía, pero no en aquellos con cardiopatía previa (p = 0,561, p = 0,337 y p = 0,992 respectivamente).
La figura 1B explica la relación entre la TnI y la probabilidad predicha de mortalidad o IC. A medida que la Tn aumentaba, tenía lugar un aumento del riesgo de resultados adversos. Esta relación era más sólida en los pacientes sin cardiopatía previa.
La elevación de Tn en los pacientes sin cardiopatía podría indicar una infección más grave y disnea, lo que determinaría el pronóstico de la COVID-19. En cambio, en los pacientes sin cardiopatía previa, la elevación de Tn no solo puede estar relacionada con el proceso infeccioso, sino también con la enfermedad causante, de manera que por sí sola no identifica la gravedad de la COVID-19.
Estas observaciones podrían tener implicaciones clínicas de interés. La elevación de Tn permite la identificación fácil y rápida de un grupo de pacientes con un peor pronóstico. Esta capacidad predictiva del riesgo de muerte o IC fue particularmente significativa en los pacientes sin cardiopatía previa. Según estos resultados, la determinación de la TnI de los pacientes hospitalizados por COVID-19 debería incluirse de manera sistemática.
Bibliografía
- 1.Li Q., Guan X., Wu P. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia. N Engl J Med. 2020;382:1199–1207. doi: 10.1056/NEJMoa2001316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.World Health Organization. WHO announces COVID-19 outbreak a pandemic. 2020. Disponible en: https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020. Accessed 20 Jul 2020.
- 3.Guo T., Fan Y., Chen M. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19) JAMA Cardiol. 2020;5:1–8. doi: 10.1001/jamacardio.2020.1017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Huang C., Wang Y., Li X. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bikdeli B., Madhavan M.V., Jiménez D. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-Up: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75:2950–2973. doi: 10.1016/j.jacc.2020.04.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chapman A.R., Bularga A., Mills N.L. High-Sensitivity Cardiac Troponin Can Be an Ally in the Fight Against COVID-19. Circulation. 2020;141:1733–1735. doi: 10.1161/CIRCULATIONAHA.120.047008. [DOI] [PubMed] [Google Scholar]