Abstract
Introducción y objetivos
A pesar de los avances en el tratamiento del infarto agudo de miocardio (IAM), este sigue presentando un pronóstico desfavorable. Hay poca evidencia acerca de la evolución de los pacientes con IAM y la enfermedad por coronavirus 2019 (COVID-19). El objetivo del estudio es describir la presentación clínica, las complicaciones y los factores predictores de mortalidad hospitalaria en pacientes con IAM durante el brote de COVID-19 en España.
Métodos
Se realizó un estudio de cohortes, prospectivo y multicéntrico de todos los pacientes consecutivos con IAM en tratamiento invasivo durante el brote de COVID-19 (15 de marzo a 15 de abril de 2020). Se compararon las características clínicas de los pacientes positivos para COVID-19 con las de los negativos, y se evaluó el efecto de la COVID-19 en la mortalidad mediante emparejamiento por puntuación de propensión y regresión logística.
Resultados
Se incluyó a 187 pacientes con IAM: 111 con elevación del segmento ST y 76 sin elevación. De ellos, 32 (17%) resultaron positivos para COVID-19. Las puntuaciones GRACE y Killip-Kimball y varios marcadores inflamatorios resultaron significativamente mayores en los pacientes con COVID-19. La mortalidad total y cardiovascular fueron significativamente mayores en los pacientes con COVID-19 (el 25 frente al 3,8%; p < 0,001; y el 15,2 frente al 1,8%; p = 0,001). La puntuación GRACE > 140 (OR = 23,45; IC95%, 2,52-62,51; p = 0,005) y la COVID-19 (OR = 6,61; IC95%, 1,82-24,43; p = 0,02) resultaron factores independientes de mortalidad hospitalaria.
Conclusiones
Durante el brote epidémico, la puntuación GRACE elevada y la COVID-19 fueron los factores independientes de mortalidad hospitalaria en los pacientes con IAM.
Palabras clave: COVID-19, Infarto de miocardio, Síndrome coronario agudo, Mortalidad
Abreviaturas: COVID-19, enfermedad coronavírica de 2019; IAM, infarto agudo de miocardio; IAMCEST, infarto agudo de miocardio con elevación del segmento ST; IAMSEST, infarto agudo de miocardio sin elevación del segmento ST; SDRA, síndrome de dificultad respiratoria aguda
Abstract
Introduction and objectives
Despite advances in treatment, patients with acute myocardial infarction (AMI) still exhibit unfavorable short- and long-term prognoses. In addition, there is scant evidence about the clinical outcomes of patients with AMI and coronavirus disease 2019 (COVID-19). The objective of this study was to describe the clinical presentation, complications, and risk factors for mortality in patients admitted for AMI during the COVID-19 pandemic.
Methods
This prospective, multicenter, cohort study included all consecutive patients with AMI who underwent coronary angiography in a 30-day period corresponding chronologically with the COVID-19 outbreak (March 15 to April 15, 2020). Clinical presentations and outcomes were compared between COVID-19 and non-COVID-19 patients. The effect of COVID-19 on mortality was assessed by propensity score matching and with a multivariate logistic regression model.
Results
In total, 187 patients were admitted for AMI, 111 with ST-segment elevation AMI and 76 with non-ST-segment elevation AMI. Of these, 32 (17%) were diagnosed with COVID-19. GRACE score, Killip-Kimball classification, and several inflammatory markers were significantly higher in COVID-19-positive patients. Total and cardiovascular mortality were also significantly higher in COVID-19-positive patients (25% vs 3.8% [P < .001] and 15.2% vs 1.8% [P = .001], respectively). GRACE score > 140 (OR, 23.45; 95%CI, 2.52–62.51; P = .005) and COVID-19 (OR, 6.61; 95%CI, 1.82-24.43; P = .02) were independent predictors of in-hospital death.
Conclusions
During this pandemic, a high GRACE score and COVID-19 were independent risk factors associated with higher in-hospital mortality.
Full English text available from:www.revespcardiol.org/en
Keywords: COVID-19, Myocardial infarction, Acute coronary syndrome, Mortality
INTRODUCCIÓN
A pesar del uso generalizado de técnicas de reperfusión y la mejora de los tratamientos médicos complementarios, los pacientes con infarto agudo de miocardio (IAM) todavía presentan un riesgo considerable de eventos cardiovasculares y mortalidad1, 2. Por ello se han establecido varios factores de riesgo y se han elaborado varias puntuaciones para predecir una evolución adversa a corto y a largo plazo3, 4, 5.
Desde el mortífero brote epidémico de la enfermedad por coronavirus de 2019 (COVID-19) a principios de 2020, se han notificado varios tipos de afección cardiovascular, como síndrome coronario agudo, miocarditis, miocardiopatía de tako-tsubo, parada cardiaca y tromboembolia pulmonar6, 7, 8, 9. Entre los posibles mecanismos podrían citarse los siguientes: toxicidad directa por la interiorización del virus en el miocito a través de los receptores de membrana de la enzima de conversión de la angiotensina II, desajuste entre la oferta y la demanda de oxígeno en el marco de la sepsis y un proceso mediado por la hipoxemia causada por el síndrome de dificultad respiratoria aguda (SDRA)10. Todos estos factores, además de causar lesiones miocárdicas, también podrían sentar las bases para la desestabilización de la placa coronaria, la aterotrombosis y el IAM.
Además, es importante hacer hincapié en la actual falta de conocimiento sobre la presentación clínica, el tratamiento, la evolución y la mortalidad hospitalaria de los pacientes con COVID-19 que sufren un IAM. Además, no está claro que la COVID-19 sea un factor independiente pronóstico de mortalidad en el contexto del IAM. En consecuencia, se comparó la mortalidad y las complicaciones hospitalarias en una serie de pacientes con IAM con y sin COVID-19 a quienes se realizó una angiografía coronaria durante el brote epidémico y se investigó si la COVID-19 es un factor independiente pronóstico de mortalidad hospitalaria en los pacientes con IAM durante la pandemia.
MÉTODOS
Diseño y población del estudio
Este estudio de cohortes observacional, prospectivo y multicéntrico se basa en los datos obtenidos de los 7 hospitales españoles de nivel terciario con capacidad para realizar una intervención coronaria percutánea (ICP) in situ en servicio permanente (Registro RECOVID-SCA). Este registro incluyó a todos los pacientes consecutivos con IAM con (IAMCEST) y sin elevación del segmento ST (IAMSEST) a quienes se practicó una coronariografía del 15 de marzo al 15 de abril de 2020. Este periodo se corresponde cronológicamente con el pico de la COVID-19 en España. El estudio se realizó conforme a la Declaración de Helsinki de 1964 y sus posteriores modificaciones, y fue aprobado por el Comité de Ética del hospital encargado de coordinar el registro. Un comité independiente de criterios de valoración clínicos y académicos llevó a cabo una adjudicación a ciegas de los episodios.
Recopilación de datos y definiciones
Se registraron los datos personales, los antecedentes cardiovasculares y los factores de riesgo: sexo, índice de masa corporal, hipertensión, diabetes mellitus, dislipemia, insuficiencia renal crónica con aclaramiento de creatinina < 30 ml/min, tabaquismo (actual o anterior), enfermedad pulmonar obstructiva crónica, insuficiencia cardiaca (fracción de eyección conservada y reducida), coronariopatía anterior, accidente cerebrovascular o accidente isquémico transitorio, cualquier patrón de fibrilación auricular11, cáncer y tratamiento anticoagulante crónico.
Se clasificó a los pacientes según el diagnóstico inicial de IAMCEST o IAMSEST. Se diagnosticó IAMCEST a los pacientes con características clínicas de isquemia miocárdica y electrocardiograma con elevación del segmento ST en al menos 2 derivaciones contiguas12. Mientras tanto, el diagnóstico de IAMSEST requería que hubiera angina junto con aumento de un biomarcador cardiaco por encima del percentil 99 del límite superior de referencia13. Se excluyó a los pacientes a quienes finalmente se diagnosticó miocarditis o miocardiopatía de tako-tsubo. Asimismo, se clasificó a los pacientes en función de la positividad para la COVID-19. Este diagnóstico se estableció en cada centro según las directrices de la Organización Mundial de la Salud14. De cada paciente se realizó una prueba de reacción en cadena de la polimerasa mediante fluorescencia en tiempo real para detectar el ácido nucleico positivo del SARS-CoV-2 en frotis de garganta o en muestras del tracto respiratorio inferior.
Se registraron las manifestaciones clínicas, los hallazgos electrocardiográficos y ecocardiográficos, las puntuaciones de Killip-Kimball y GRACE y los resultados de las siguientes pruebas analíticas: troponina cardiaca, creatincinasa, fracción aminoterminal del propéptido natriurético cerebral, péptido natriurético cerebral, proteína C reactiva, dímero D, ferritina, hemograma completo y función hepática. Cada centro midió la troponina cardiaca I o T mediante pruebas de alta sensibilidad con diferentes límites superiores de referencia. Para estandarizar estos resultados, se utilizó la razón del valor de troponina observado dividido entre los puntos de corte del percentil 99 del límite superior de referencia de cada centro, como se había hecho anteriormente15.
Se evaluaron los siguientes hallazgos relacionados con la intervención quirúrgica: acceso vascular, número de vasos coronarios con estenosis grave (> 70%), vaso culpable, características angiográficas (caracterización del trombo según el sistema de clasificación del grupo de estudio Thrombolysis in Myocardial Infarction [TIMI] y el grado del flujo TIMI antes y después de la intervención quirúrgica)16, 17, número de stents y aspiración del trombo durante la ICP.
Se consideraron los siguientes eventos adversos hospitalarios: hemorragia según la escala Bleeding Academic Research Consortium (BARC)18, SDRA que requirió intubación traqueal, accidente cerebrovascular, tromboembolia arterial sistémica, reinfarto de miocardio, uso de asistencia circulatoria mecánica, arritmias ventriculares sostenidas, muerte total y muerte de origen cardiovascular. Se definió reinfarto como la elevación del segmento ST ≥ 1 mm recidivante o la aparición de nuevas ondas Q patognomónicas en al menos 2 derivaciones contiguas, especialmente en concomitancia con síntomas isquémicos y elevación de la troponina (aumento > 20% del valor de troponina en la segunda muestra)19. El SDRA se definió como una afección aguda caracterizada por infiltrados pulmonares bilaterales e hipoxemia grave (relación entre la presión parcial de oxígeno en la sangre arterial del paciente [PaO2] y la fracción de oxígeno en el aire inspirado [FiO2]) en ausencia de signos de edema pulmonar cardiogénico20. Como muertes cardiovasculares se incluyeron las muertes por IAM, muerte súbita cardiaca, insuficiencia cardiaca, accidente cerebrovascular, hemorragia cardiovascular o intervención cardiovascular21. La embolia abarca la embolia sistémica y el accidente cerebrovascular, y excluye la tromboembolia venosa.
Análisis estadísticos
Se compararon las variables basales y los resultados clínicos durante el ingreso entre los pacientes con y sin COVID-19 mediante la prueba de la χ2 o la prueba exacta de Fisher (si el valor esperado en cada casilla era < 5) para las variables categóricas y la prueba de la t de Student o de la U de Mann-Whitney (si el supuesto de normalidad era significativo [p < 0,05 en la prueba de Shapiro-Wilk]) para las variables continuas, según correspondiera. No se necesitó imputar datos perdidos. En todas las pruebas, los valores de p de todos los resultados fueron bilaterales; se consideró que un valor < 0,05 indicaba significación estadística. Los intervalos de confianza se definieron al 95% (IC95%). Se utilizó un modelo de regresión logística multivariante para identificar factores independientes de muerte hospitalaria mediante el método «adelante condicional». Se excluyó de este análisis a los pacientes con IAM de tipo 2 por su fisiopatología, distinta que la del IAM de tipo 1. Las variables con p < 0,05 en el análisis univariante se incorporaron al análisis multivariante. La puntuación GRACE > 140 y la fracción de eyección del ventrículo izquierdo < 30% se analizaron como variables categóricas. Los resultados se comunican como odds ratio (OR) con sus IC95%. La prueba de Hosmer-Lemeshow y la R2 de Nagelkerke a partir del modelo de regresión se utilizaron como indicadores de la bondad de ajuste de cada modelo de riesgo y para evaluar su capacidad de calibración.
Además, debido a la naturaleza observacional del estudio, hubo algunas diferencias entre las características basales de los pacientes de los 2 grupos. Como consecuencia de estas diferencias, se realizó un análisis por puntuación de propensión con modelos potenciados generalizados, con la COVID-19 como variable dependiente y las características basales descritas en la tabla 1 como covariables. Se realizó un análisis ponderado por puntuación de propensión para determinar el efecto de la COVID-19 en la mortalidad.
Tabla 1.
Covariables en el análisis por puntuación de propensión con la COVID-19 como variable dependiente
| Sin ajuste |
Ajuste por puntuación de propensión |
|||||
|---|---|---|---|---|---|---|
| COVID-19 | Sin COVID-19 | DE | COVID-19 | Sin COVID-19 | DE | |
| Edad |
66,16 |
64,64 |
0,13 |
66,16 |
65,87 |
0,03 |
| Sexo |
0,90 |
0,79 |
0,37 |
0,90 |
0,86 |
0,13 |
| HT |
0,68 |
0,59 |
0,18 |
0,68 |
0,63 |
0,09 |
| DM |
0,29 |
0,29 |
0,00 |
0,29 |
0,29 |
0,00 |
| DL |
0,58 |
0,50 |
0,15 |
0,58 |
0,51 |
0,15 |
| ACV |
0,06 |
0,04 |
0,10 |
0,06 |
0,06 |
0,01 |
| ERC |
0,03 |
0,02 |
0,07 |
0,03 |
0,04 |
−0,04 |
| EPOC |
0,13 |
0,06 |
0,20 |
0,13 |
0,06 |
0,20 |
| IC |
0,03 |
0,03 |
−0,01 |
0,03 |
0,06 |
−0,15 |
| Coronariopatía |
0,13 |
0,15 |
−0,06 |
0,13 |
0,19 |
−0,17 |
| Cáncer |
0,00 |
0,05 |
ND |
0,00 |
0,04 |
ND |
| Killip |
1,52 |
1,19 |
0,33 |
1,52 |
1,39 |
0,13 |
| GRACE | 129,79 | 116,07 | 0,35 | 129,79 | 124,91 | 0,12 |
ACV: accidente cerebrovascular; COVID-19: enfermedad por coronavirus de 2019; DE: desviación estándar; DL: dislipemia; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; GRACE: Global Registry of Acute Coronary Disease; HT: hipertensión; IC: insuficiencia cardiaca; ND: no disponible.
Los análisis se realizaron con la versión 25 del paquete de software IBM SPSS Statistics para Mac (IBM Corp., Estados Unidos) y la versión 3.6.3 de R statistics (R Foundation for Statistical Computing, Austria).
RESULTADOS
Características basales de los pacientes
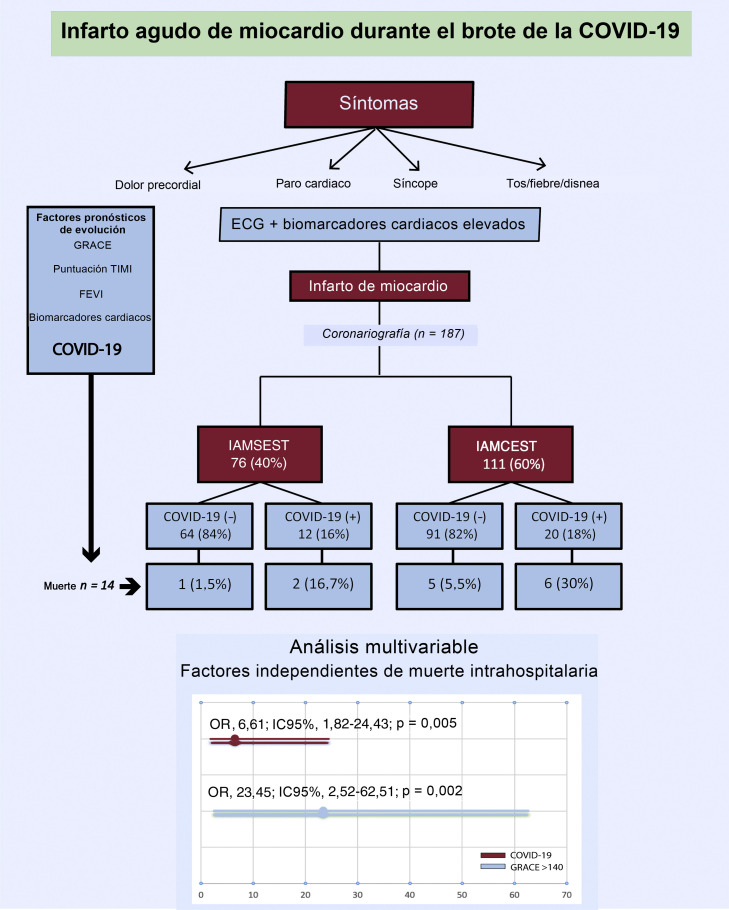
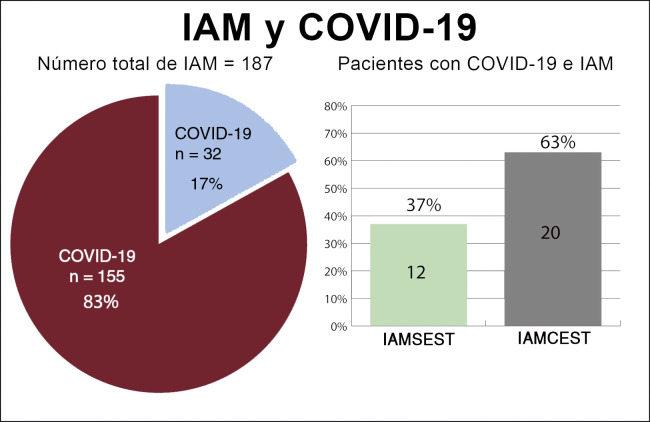
Entre el 15 de marzo y el 15 de abril de 2020, se diagnosticó IAM a 193 pacientes. Se excluyó a 6 pacientes: 3 diagnosticados de miocarditis, que en 1 de ellos fue fulminante y produjo 1 muerte, y 3 diagnosticados de miocardiopatía de tako-tsubo. Se incluyó en el estudio a un total de 187 pacientes, 76 con IAMSEST (40%) y 111 con IAMCEST (60%) (figura 1 ). La media de edad en el momento del ingreso fue 65 ± 13 años y 34 pacientes (18%) eran mujeres. De todos los pacientes, 32 (17%) dieron positivo en las pruebas de la COVID-19: 12 (37%) tenían IAMSEST y 20 (63%), IAMCEST (figura 2 ). A 10 pacientes sin síntomas infecciosos no se les realizó la prueba de reacción en cadena de la polimerasa mediante fluorescencia en tiempo real para detectar el SARS-CoV-2 y se los consideró negativos para la COVID-19 (8 con IAMCEST y 2 con IAMSEST). Ninguno de los pacientes tuvo eventos adversos. No hubo diferencias estadísticamente significativas en las características iniciales entre los pacientes diagnosticados de COVID-19 y sin este diagnóstico (tabla 2 ).
Figura 1.
Infarto agudo de miocardio durante el brote epidémico de la COVID-19. COVID-19: enfermedad por coronavirus de 2019; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; GRACE: Global Registry of Acute Coronary Events; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IC95%: intervalo de confianza del 95%; OR: odds ratio; TIMI: Thrombolysis in Myocardial Infarction.
Figura 2.
Distribución de pacientes en función del diagnóstico inicial. COVID-19: enfermedad por coronavirus de 2019; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST.
Tabla 2.
Características clínicas, analíticas, intervenciones y evolución de los pacientes con IAM durante el brote epidémico de la COVID-19
| Variables | Negativo para la COVID-19 (n = 155) | Positivo para la COVID-19 (n = 32) | Total | p |
|---|---|---|---|---|
| Características clínicas y datos personales | ||||
| Edad (años) | 65 ± 13 | 66 ± 11 | 65 ± 13,1 | 0,679 |
| Mujeres | 31 (20,0) | 3 (9,4) | 34 (18,2) | 0,156 |
| IMC | 27,1 ± 4,7 | 28,4 ± 4,0 | 27,3 ± 4,6 | 0,207 |
| Hipertensión | 93 (60,0) | 22 (68,8) | 115 (61,5) | 0,354 |
| Dislipemia | 79 (51,0) | 19 (59,3) | 98 (52,4) | 0,386 |
| Diabetes mellitus | 43 (27,8) | 10 (31,3) | 53 (28,3) | 0,688 |
| TFGe < 30 ml/min/m2 | 3 (1,9) | 1 (3,1) | 4 (2,1) | 0,531 |
| Fumador | ||||
| Activo | 55 (35,5) | 7 (21,9) | 62 (33,2) | 0,327 |
| Exfumador | 26 (17,8) | 7 (21,9) | 33 (17,6) | |
| EPOC | 10 (6,5) | 5 (15,6) | 15 (8,0) | 0,082 |
| Fibrilación auricular | 14 (9,0) | 0 | 14 (7,5) | 0,133 |
| Coronariopatía previa | 26 (16,8) | 5 (15,6) | 31 (16,6) | 0,874 |
| IC previa | 5 (3,2) | 2 (6,3) | 7 (3,7) | 0,343 |
| ACV previo | 6 (3,9) | 2 (6,3) | 8 (4,2) | 0,627 |
| Cáncer activo | 7 (4,5) | 1 (3,1) | 8 (4,2) | > 0,99 |
| Anticoagulantes orales | 14 (9,0) | 0 | 14 (7,5) | 0,133 |
| Presentación clínica y pruebas complementarias | ||||
| Tos/fiebre | 2 (1,3) | 6 (18,8) | 8 (4,2) | |
| Dolor precordial | 147 (94,9) | 25 (78,1) | 172 (91,8) | 0,001 |
| Parada cardiaca | 3 (1,9) | 1 (3,1) | 4 (2,1) | |
| IC aguda | 2 (1,3) | 0 | 2 (1,1) | |
| Síncope | 1 (0,6) | 0 | 1 (0,5) | |
| ECG | ||||
| Normal | 39 (25,2) | 5 (15,6) | 44 (23,5) | |
| Depresión del segmento ST | 23 (14,8) | 7 (21,9) | 30 (16,0) | 0,477 |
| Elevación del segmento ST | 89 (57,4) | 20 (62,5) | 109 (58,3) | |
| Nuevo BRIHH | 4 (2,6) | 0 | 4 (2,1) | |
| Ácido acetilsalicílico | 153 (98,7) | 32 (100) | 185 (98,9) | 0,518 |
| Inhibidores del P2Y12 | ||||
| Ninguno | 8 (5,2) | 1 (3,1) | 9 (4,9) | |
| Clopidogrel | 41 (26,5) | 8 (25,0) | 49 (26,2) | 0,001 |
| Ticagrelor | 94 (60,6) | 12 (37,5) | 106 (56,7) | |
| Prasugrel | 12 (7,7) | 11 (34,4) | 23 (12,3) | |
| Puntuaciones | ||||
| Killip-Kimball | ||||
| I | 139 (89,7) | 23 (71,9) | 162 (86,6) | 0,016 |
| II | 9 (5,8) | 3 (9,4) | 12 (6,4) | |
| III | 2 (1,3) | 3 (9,4) | 5 (2,7) | 0,041 |
| IV | 5 (3,2) | 3 (9,4) | 8 (4,3) | |
| GRACE | 116,3 ± 30 | 129,8 ± 39 | 118,4 ± 32 | |
| FEVI (%) | 50 ± 12 | 50 ± 11 | 50 ± 12 | 0,954 |
| Datos analíticos | ||||
| Tnc en el momento del ingreso (×LSR) | 5,17 [0,83-48,74] | 7,81 [0,45-146,35] | 5,21 [0,80-51,22] | 0,483 |
| CK al ingreso (U/l) | 267 [86-928] | 291 [99-620] | 273 [89-898] | 0,491 |
| Valor máximo de NT-proBNP (pg/ml) | 906 [319-3793] | 3.744 [640-12.768] | 1.207 [323-4.074] | 0,062 |
| Valor máximo de BNP (pg/ml) | 340 [29-867] | 385 [245-1.314] | 364 [44-863] | ,618 |
| PCR al ingreso (mg/l) | 1,87 [0,60-6,66] | 10,65 [2,72-34,27] | 2,60 [0,66-10,36] | < 0,001 |
| Valor máximo de PCR (mg/l) | 4,60 [0,99-20,60] | 39,40 [9,40-151,55] | 6,60 [1,20-30,10] | < 0,001 |
| Leucocitos al ingreso (células/ml) | 10.705 [8.355-13.870] | 9.200 [7.700-14.270] | 10.600 [8.225-13.880] | 0,560 |
| Linfocitos al ingreso (células/ml) | 1.690 [1.100-2.315] | 1.100 [800-1.690] | 1.600 [1.015-2.187] | < 0,001 |
| Hb al ingreso (g/dl) | 14,5 [13,2-15,7] | 14,4 [12,3-15,7] | 14,5 [13,0-15,7] | 0,722 |
| Plaquetas (valor más bajo) (×103 células/ml) | 207,5 [171,0-251,7] | 199,0 [166,0-244,0] | 204,0 [170,0-251,0] | 0,404 |
| Valor máximo de dímero D (ng/ml) | 317 [116-633] | 1.109 [523-1.585] | 550 [290-1.344] | < 0,001 |
| Valor máximo de ferritina (ng/ml) | 286 [107-393] | 1239 [518-1851] | 342 [173-1.055] | < 0,001 |
| AST (U/l) | 82 [27-160] | 98 [59-166] | 86 [32-162] | 0,880 |
| ALT (U/l) | 32 [22-48] | 69 [38-109] | 33 [24-67] | 0,561 |
| Hallazgos de la coronariografía e ICP | ||||
| Acceso | ||||
| Radial | 145 (93,5) | 29 (93,5) | 174 (93,5) | |
| Femoral | 8 (5,2) | 2 (6,5) | 10 (5,4) | 0,776 |
| Cubital | 1 (0,6) | 0 | 1 (0,5) | |
| Braquial | 1 (0,6) | 0 | 1 (0,5) | |
| Extensión de la coronariopatía | ||||
| Sin lesiones | 6 (3,9) | 1 (3,2) | 7 (3,7) | |
| Enfermedad de 1 vaso | 93 (60) | 14 (45,2) | 107 (57,5) | 0,368 |
| Enfermedad de 2 vasos | 37 (23,9) | 10 (32,2) | 47 (25,3) | |
| Enfermedad de 3 vasos | 19 (12,2) | 6 (19,4) | 25 (13,5) | |
| Vaso culpable | ||||
| Sin lesiones | 1 (0,7) | 1 (3,2) | 2 (1,1) | |
| TCPI | 2 (1,4) | 2 (6,4) | 4 (2,2) | 0,255 |
| ACDA | 72 (48,3) | 13 (41,9) | 85 (47,2) | |
| ACC | 29 (19,5) | 5 (16,2) | 34 (18,9) | |
| ACD | 40 (26,8) | 10 (32,2) | 50 (27,8) | |
| > 1 vaso | 5 (3,3) | 0 | 5 (2,8) | |
| Grado TIMI del trombo* | ||||
| 0 | 8 (5,7) | 4 (13,3) | 12 (7) | |
| 1 | 54 (38,3) | 7 (23,3) | 61 (35,7) | 0,089 |
| 2 | 24 (17) | 4 (13,3) | 28 (16,4) | |
| 3 | 16 (11,3) | 1 (3,3) | 17 (10) | |
| 4 | 20 (14,2) | 5 (16,6) | 25 (14,5) | |
| 5 | 19 (13,5) | 9 (30) | 28 (16,4) | |
| Aspiración del trombo* | 24 (15,9) | 8 (26,7) | 32 (17,7) | 0,189 |
| Número de stents | 1,30 ± 0,94 | 1,33 ± 0,88 | 1,31 ± 0,93 | 0,868 |
| Diámetro del stent | 3,24 ± 1,16 | 3,26 ± 0,60 | 3,24 ± 1,08 | 0,942 |
| Longitud total con stent | 24 [18-38] | 30 [19-49] | 26 [18-40] | 0,128 |
| Flujo TIMI final* | ||||
| 0 | 1 (0,7) | 3 (9,7) | 4 (2,2) | |
| 1 | 2 (1,4) | 1 (3,2) | 3 (1,6) | 0,016 |
| 2 | 14 (9,3) | 4 (12,9) | 18 (9,8) | |
| 3 | 135 (88,8) | 23 (74,2) | 158 (86,3) | |
×LSR: multiplicado por el límite superior de referencia; ACC: arteria coronaria circunfleja; ACD: arteria coronaria derecha; ACDA: arteria coronaria descendente anterior; ACV: accidente cerebrovascular; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; BNP: péptido natriurético cerebral; BRIHH: bloqueo de la rama izquierda del haz de His; CK: creatincinasa total; COVID-19: enfermedad por coronavirus de 2019; ECG: electrocardiograma; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; GRACE: Global Registry of Acute Coronary Events; Hb: hemoglobina; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PCR, proteína C reactiva; TCPI: tronco coronario principal izquierdo; TFGe: tasa de filtrado glomerular estimada; TIMI: Thrombolysis in Myocardial Infarction; Tnc: troponina cardiaca.
Los valores más-menos son medias ± desviación estándar con un intervalo de confianza del 95%. Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Solo válido para IAMCEST.
Entre los pacientes sin COVID-19 predominaba el dolor precordial, mientras que los pacientes con la enfermedad presentaban sobre todo síntomas respiratorios, como fiebre y tos. Las puntuaciones de Killip-Kimball III/IV y GRACE fueron significativamente más altas en los pacientes con COVID-19. No hubo diferencias significativas en la fracción de eyección del ventrículo izquierdo entre los 2 grupos. Los pacientes con COVID-19 tenían valores de proteína C reactiva más altos al ingreso y concentraciones máximas durante la hospitalización, menos linfocitos al ingreso y mayores concentraciones máximas de ferritina, dímero D y alanina aminotransferasa. No hubo diferencias significativas entre los 2 grupos en los valores de troponina cardiaca al ingreso y el valor máximo alcanzado durante la hospitalización. En cuanto al tratamiento antiagregante plaquetario, para la mayoría de los pacientes con COVID-19 fue prasugrel. La estancia hospitalaria fue considerablemente más corta entre los pacientes sin COVID-19 que entre aquellos con COVID-19 (4,3 ± 2,9 frente a 7,6 ± 6,3 días; p < 0,01).
Coronariografía e intervenciones coronarias percutáneas
De los 187 pacientes sometidos a coronariografía, finalmente se diagnosticó IAM de tipo 2 con coronariopatías no obstructivas a 7 (3,7%); solo 1 paciente (3,2%) resultó positivo en las pruebas de COVID-19, mientras que 6 (3,8%) resultaron negativos. No hubo diferencias en cuanto a mortalidad o eventos cardiovasculares adversos mayores entre los pacientes con IAM de tipo 1 y con IAM de tipo 2.
Se realizó ICP primaria a 106 de los 111 pacientes con IAMCEST. La demora desde el inicio de los síntomas hasta el cruce de la guía en los pacientes con IAMCEST fue equivalente entre aquellos con COVID-19 y sin COVID-19: mediana, 240 [intervalo intercuartílico, 157-315] frente a 241 [99-420] min (p = 0,80). No hubo indicios de una mayor cantidad de trombos medidos por la puntuación TIMI de trombos o una mayor tasa de trombectomía en ninguno de los grupos.
La incidencia de coronariopatía multivaso fue parecida en los 2 grupos. No hubo diferencias importantes respecto al tratamiento de los vasos no culpables durante el ingreso, con tasas del 21% de los pacientes con COVID-19 y el 23% de los pacientes sin COVID-19 (p = 0,20). Tampoco se hallaron diferencias en las características anatómicas del vaso culpable o el número de stents implantados. Las complicaciones relacionadas con la intervención también fueron semejantes en los 2 grupos.
Resultados y eventos adversos
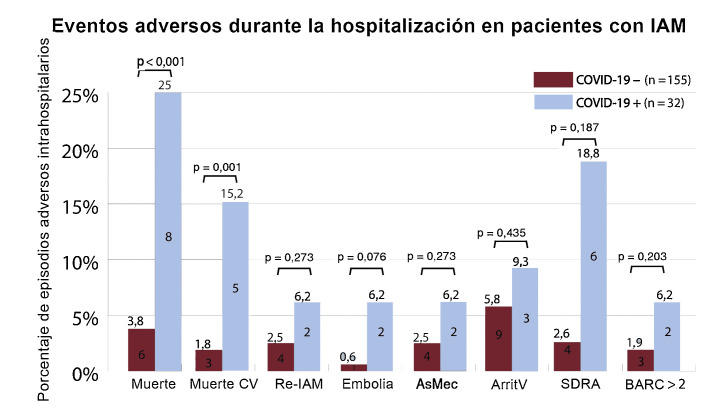
Hubo 14 muertes hospitalarias (7,5%; IC95%, 4%-11%). La mortalidad total (8 [25%] frente a 6 [3,8%]; p < 0,001) y la muerte de origen cardiovascular (5 [15,2%] frente a 3 [1,8%]; p = 0,001) fueron significativamente mayores en el grupo con COVID-19 que en el grupo sin COVID-19 (figura 3 ). No se encontraron diferencias considerables en los demás eventos adversos. Los pacientes con COVID-19 además de IAM y neumonía bilateral que necesitaron ventilación mecánica a causa del SDRA sufrieron mayor mortalidad que los pacientes sin SDRA (el 83 frente al 12%; p = 0,002).
Figura 3.
Asociación de la COVID-19 con eventos adversos en pacientes ingresados por IAM. ArritV: arritmias ventriculares, AsMec: asistencia circulatoria mecánica; BARC: Bleeding Academic Research Consortium; COVID-19: enfermedad por coronavirus de 2019; CV: cardiovascular; Embolia: accidente cerebrovascular o embolia arterial sistémica; IAM: infarto agudo de miocardio; Re-IAM: reinfarto de miocardio; SDRA: síndrome de dificultad respiratoria aguda.
Las causas de muerte de los pacientes con COVID-19 fueron: SDRA, 5 pacientes; shock cardiogénico tras embolización distal del trombo de una lesión de la coronaria principal izquierda, 2; rotura cardiaca como complicación mecánica de un IAMCEST, 1. En cambio, las causas de muerte de los pacientes sin COVID-19 fueron 2 en shock cardiogénico, 1 posible trombosis del stent (definida según el Academic Research Consortium), 1 accidente cerebrovascular cerebeloso, 1 encefalopatía hipóxica después de una larga parada cardiaca extrahospitalaria y 1 hepatitis fulminante.
Factores de riesgo de mortalidad hospitalaria
El análisis de regresión logística univariante de los potenciales factores de riesgo de mortalidad total se muestra en la tabla 1 del material adicional. Los factores de riesgo de mortalidad hospitalaria fueron la edad, una puntuación de Killip-Kimball > 2, una puntuación GRACE > 140, un flujo TIMI < 3 tras la ICP, calcificación coronaria grave, una fracción de eyección del ventrículo izquierdo < 30%, proteína C reactiva, creatincinasa total, dímero D, aspartato aminotransferasa, ferritina, BARC > 2, SDRA y COVID-19. Cuando todas estas variables se incorporaron a un modelo de regresión logística condicional multivariante, solo la COVID-19 (OR = 6,61; IC95%, 1,82-24,43; p = 0,02) y la puntuación GRACE > 140 (OR = 23,45; IC95%; 2,52-62,51; p = 0,005) continuaron siendo factores independientes de muerte hospitalaria (Hosmer-Lemeshow, p = 0,65; R2 de Nagelkerke = 0,54) (figura 1). Tras el emparejamiento por puntuación de propensión, se logró una comparabilidad satisfactoria mediante una disminución de las diferencias estandarizadas a menos del 20% de todas las covariables (tabla 2). En el análisis ajustado por puntuación de propensión, la mortalidad fue significativamente mayor en el grupo de pacientes con COVID-19 (el 25,8 frente al 18,0%; p = 0,045).
DISCUSIÓN
Hasta donde sabemos, este es el primer estudio que analiza el impacto de la COVID-19 en el pronóstico de los pacientes con IAM durante el brote epidémico. El principal hallazgo es que, agregado a la consolidada puntuación GRACE, la COVID-19 es un factor independiente relacionado con la mortalidad hospitalaria de los pacientes con IAM. Se han elaborado muchos modelos de pronóstico multivariables en poblaciones de pacientes con IAMCEST5, 22, 23, 24 e IAMSEST25, 26, pero ninguno durante la pandemia de COVID-19.
El gran registro mundial de observación multinacional de eventos coronarios agudos (Global Registry of Acute Coronary Events [GRACE]) también ha demostrado una excelente capacidad para evaluar el riesgo de muerte hospitalaria27. El hallazgo más notable de este estudio es que la COVID-19 se asocia de manera independiente con una mayor mortalidad hospitalaria de los pacientes con IAM. Si se analizan las posibles causas de este resultado, la primera diferencia es que los pacientes con COVID-19 presentaban con mayor frecuencia síntomas atípicos, especialmente los que indican una infección respiratoria, como fiebre y tos. El retraso en el diagnóstico puede haber implicado un retraso en el tratamiento, lo que inevitablemente empeoraría la evolución. Otro aspecto que puede retrasar el diagnóstico de IAM por su presentación atípica es el sexo femenino. Al igual que en los pacientes con COVID-19, el IAM en mujeres también tiene una presentación atípica (las mujeres presentan síntomas distintos del dolor precordial típico, como astenia y disnea) y se asocia con un pronóstico peor28, 29. Las concentraciones del reactante de fase aguda, la proteína C reactiva, fueron más altas en los pacientes con COVID-19. Esta proteína refleja la inflamación sistémica y vascular, y puede predecir futuros eventos cardiovasculares. La proteína C reactiva elevada es un factor pronóstico de evolución adversa en pacientes con IAM y ayuda a identificar a los que pueden correr el riesgo de sufrir complicaciones cardiovasculares26. La ateroesclerosis es un proceso inflamatorio y los marcadores plasmáticos de inflamación son una posible herramienta para predecir eventos coronarios. El análisis de Chew et al.30 mostró que la proteína C reactiva predijo el riesgo de muerte o infarto de miocardio a 30 días en pacientes sometidos a ICP. Se encontró que la proteína C reactiva se asociaba de manera independiente con recidiva de eventos cardiovasculares y muerte a medio y largo plazo31, 32. Se ha propuesto que la proteína C reactiva no solo puede ser un marcador de inflamación generalizada, sino que también participa directa y activamente tanto en la aterogénesis como en la rotura de la placa de ateroma33, 34, 35. Por lo tanto, la COVID-19 puede predisponer a los pacientes a la enfermedad trombótica, tanto en la circulación venosa como en la arterial, a causa de una inflamación excesiva, activación plaquetaria, disfunción endotelial y estasis36.
Falta información sobre el pronóstico del IAM en pacientes con COVID-19. La serie reciente de Bangalore et al.37 mostró que a la mitad de los pacientes se les realizó coronariografía y que una tercera parte de esos pacientes tenían una coronariopatía no obstructiva. En nuestro estudio de pacientes con IAM tratados con coronariografía, el porcentaje de infarto de miocardio con arterias coronarias no obstructivas fue semejante. La lesión miocárdica en pacientes con COVID-19 podría ser multifactorial e incluir rotura de placa coronaria y microtrombos, tormenta de citocinas, espasmo coronario, lesión endotelial y miocarditis o miocardiopatía de tako-tsubo. Si se tiene en cuenta que más de 2/3 pacientes con COVID-19 e IAM en nuestra serie fallecieron por SDRA o miocarditis fulminante, la evolución de estos pacientes está determinada por la gravedad de la neumonía por COVID-19 y la lesión miocárdica directa, y la trombosis coronaria es más un espectador que un actor en el proceso de la enfermedad.
Nuestros pacientes con COVID-19 fueron tratados según las guías de práctica clínica; se practicó una ICP primaria a todos los pacientes con IAMCEST y se aplicó una estrategia terapéutica invasiva precoz a todos los pacientes con IAMSEST.
Limitaciones
Hay varias limitaciones que tener en cuenta a la hora de interpretar nuestro estudio. Primero, este fue un estudio observacional y no aleatorizado, y como tal los resultados pueden haber estado influidos por factores de confusión identificados y no identificados. En segundo lugar, el número de pacientes estudiados con IAM y COVID-19 es pequeño, lo que podría limitar el número de factores pronósticos independientes identificados y la consistencia de los resultados. Finalmente, se incluyeron todas las variables mediante la consulta de historias clínicas posiblemente incompletas. A pesar de estas limitaciones, la significación estadística fue suficiente para extraer conclusiones provisionales.
CONCLUSIONES
Este estudio muestra que los pacientes ingresados por IAM con COVID-19 presentan puntuaciones de riesgo más altas, inflamación sistémica y mayor mortalidad hospitalaria. Además, la COVID-19 es un factor de riesgo independiente de mortalidad hospitalaria, semejante a una puntuación GRACE elevada.
¿QUÉ SE SABE DEL TEMA?
-
–
Hay poca evidencia sobre la evolución clínica de los pacientes con IAM y COVID-19. Hasta donde sabemos, no se ha publicado ninguna serie que compare a pacientes de IAM con y sin COVID-19.
-
–
También se desconocen los factores de riesgo de mortalidad de los pacientes con IAM durante el brote epidémico de la COVID-19.
¿QUÉ APORTA DE NUEVO?
-
–
En pacientes diagnosticados de IAM durante el brote epidémico de la COVID-19, esta fue un factor pronóstico independiente de mortalidad hospitalaria, además de factores consolidados como una puntuación GRACE elevada.
-
–
La evolución de estos pacientes está determinada por la gravedad de la enfermedad por COVID-19 y la lesión miocárdica directa. Mientras tanto, la trombosis coronaria es más un espectador que un actor en el pronóstico de la enfermedad.
CONFLICTO DE INTERESES
A. Sánchez-Recalde es editor asociado de Revista Española de Cardiología. Se ha seguido el procedimiento editorial de la Revista para garantizar un trato imparcial al original.
Agradecimientos
Agradecemos al Dr. Juan Manuel Monteagudo su ayuda en la revisión metodológica de este original.
Footnotes
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2020.07.023
Appendix B. Material suplementario
Bibliografía
- 1.Piironen M., Ukkola O., Huikuri H. Trends in long-term prognosis after acute coronary syndrome. Eur J Prev Cardiol. 2017;24:274–280. doi: 10.1177/2047487316679522. [DOI] [PubMed] [Google Scholar]
- 2.Tobbia P., Brodie B.R., Witzenbichler B. Adverse event rates following primary PCI for STEMI at US and non-US hospitals: three-year analysis from the HORIZONS-AMI trial. EuroIntervention. 2013;8:1134–1142. doi: 10.4244/EIJV8I10A176. [DOI] [PubMed] [Google Scholar]
- 3.Eagle K.A., Lim M.J., Dabbous O.H. A validated prediction model for all forms of acute coronary syndrome: estimating the risk of 6-month postdischarge death in an international registry. JAMA. 2004;291:2727–2733. doi: 10.1001/jama.291.22.2727. [DOI] [PubMed] [Google Scholar]
- 4.Chapman A.R., Hesse K., Andrews J. High-sensitivity cardiac troponin I and clinical risk scores in patients with suspected acute coronary syndrome. Circulation. 2018;138:1654–1665. doi: 10.1161/CIRCULATIONAHA.118.036426. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Antman E.M., Cohen M., Bernink P.J. The TIMI risk score for unstable angina/non-ST elevation MI: a method for prognostication and therapeutic decision making. JAMA. 2000;284:835–842. doi: 10.1001/jama.284.7.835. [DOI] [PubMed] [Google Scholar]
- 6.Sulemane S., Baltabaeva A., Barron A.J., Chester R., Rahman-Haley S. Acute pulmonary embolism in conjunction with intramural right ventricular thrombus in a SARS-CoV-2-positive patient. Eur Heart J Cardiovasc Imaging. 2020 doi: 10.1093/ehjci/jeaa115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Meyer P., Degrauwe S., Delden C.V., Ghadri J.R., Templin C. Typical takotsubo syndrome triggered by SARS-CoV-2 infection. Eur Heart J. 2020;41:1860. doi: 10.1093/eurheartj/ehaa306. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Siddamreddy S., Thotakura R., Dandu V., Kanuru S., Meegada S. Corona virus disease 2019 (COVID-19) presenting as acute ST elevation myocardial infarction. Cureus. 2020;12:e7782. doi: 10.7759/cureus.7782. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Sánchez-Recalde A., Solano-López J., Miguelena-Hycka J., Martín-Pinacho J.J., Sanmartín M., Zamorano J.L. COVID-19 and cardiogenic shock. Different cardiovascular presentations with high mortality. Rev Esp Cardiol. 2020;73:669–672. doi: 10.1016/j.rec.2020.04.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kang Y., Chen T., Mui D. Cardiovascular manifestations and treatment considerations in COVID-19. Heart. 2020;106:1132–1141. doi: 10.1136/heartjnl-2020-317056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Kirchhof P., Benussi S., Kotecha D., ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS Eur Heart J. 2016;37:2893–2962. doi: 10.1093/eurheartj/ehw210. [DOI] [PubMed] [Google Scholar]
- 12.Ibanez B., James S., Agewall S. ESC Scientific Document Group. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC) Eur Heart J. 2018;39:119–177. doi: 10.1093/eurheartj/ehx393. [DOI] [PubMed] [Google Scholar]
- 13.Roffi M., Patrono C., Collet J.P., ESC Scientific Document Group. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC) Eur Heart J. 2016;37:267–315. doi: 10.1093/eurheartj/ehv320. [DOI] [PubMed] [Google Scholar]
- 14.World Health Organization. Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected: interim guidance. March 13, 2020. Disponible en: https://www.who.int/docs/default-source/coronaviruse/clinical-management-of-novel-cov.pdf. Consultado 10 May 2020.
- 15.Kaura A., Panoulas V., Glampson B. Association of troponin level and age with mortality in 250 000 patients: cohort study across five UK acute care centres. BMJ. 2019;367:l6055. doi: 10.1136/bmj.l6055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Gibson C.M., de Lemos J.A., Murphy S.A. Combination therapy with abciximab reduces angiographically evident thrombus in acute myocardial infarction: a TIMI 14 substudy. Circulation. 2001;103:2550–2554. doi: 10.1161/01.cir.103.21.2550. [DOI] [PubMed] [Google Scholar]
- 17.TIMI Study Group. The Thrombolysis in Myocardial Infarction (TIMI) trial. Phase I findings. N Engl J Med. 1985;312:932-936. [DOI] [PubMed]
- 18.Mehran R., Rao S.V., Bhatt D.L. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium. Circulation. 2011;123:2736–2747. doi: 10.1161/CIRCULATIONAHA.110.009449. [DOI] [PubMed] [Google Scholar]
- 19.Thygesen K., Alpert J.S., Jaffe A.S., ESC Scientific Document Group. Fourth universal definition of myocardial infarction (2018) Eur Heart J. 2019;40:237–269. doi: 10.1093/eurheartj/ehy462. [DOI] [PubMed] [Google Scholar]
- 20.Ranieri V.M., Rubenfeld G.D., Thompson B.T. ARDS Definition Task Force. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307:2526–2533. doi: 10.1001/jama.2012.5669. [DOI] [PubMed] [Google Scholar]
- 21.Hicks K.A., Mahaffey K.W., Mehran R. 2017 cardiovascular and stroke endpoint definitions for clinical trials. Circulation. 2018;137:961–972. doi: 10.1161/CIRCULATIONAHA.117.033502. [DOI] [PubMed] [Google Scholar]
- 22.Subirana I., Fernández Avilés F., Elosua R., Lidón R.-M., García-Dorado D., Marrugat J. Interhospital variability in acute coronary syndrome management in the ATHOS Study. Rev Esp Cardiol. 2019;72:691–693. doi: 10.1016/j.rec.2018.09.016. [DOI] [PubMed] [Google Scholar]
- 23.Morrow D.A., Antman E.M., Charlesworth A. TIMI risk score for ST-elevation myocardial infarction: a convenient, bedside, clinical score for risk assessment at presentation: an intravenous nPA for treatment of infarction myocardium early II trial substudy. Circulation. 2000;102:2031–2037. doi: 10.1161/01.cir.102.17.2031. [DOI] [PubMed] [Google Scholar]
- 24.Morrow D.A., Antman E.M., Giugliano R.P. A simple risk index for rapid initial triage of patients with ST-elevation myocardial infarction: an InTIME II substudy. Lancet. 2001;358:1571–1575. doi: 10.1016/S0140-6736(01)06649-1. [DOI] [PubMed] [Google Scholar]
- 25.Boersma E., Pieper K.S., Steyerberg E.W. the PURSUIT investigators. Predictors of outcome in patients with acute coronary syndromes without persistent ST-segment elevation. Results from an international trial of 9461 patients. Circulation. 2000;101:2557–2567. doi: 10.1161/01.cir.101.22.2557. [DOI] [PubMed] [Google Scholar]
- 26.Gheorghiade M., Sopko G., de Luca L. Navigating the crossroads of coronary artery disease and heart failure. Circulation. 2006;114:1202–1213. doi: 10.1161/CIRCULATIONAHA.106.623199. [DOI] [PubMed] [Google Scholar]
- 27.Mehilli J., Presbitero P. Coronary artery disease and acute coronary syndrome in women. Heart. 2020;106:487–492. doi: 10.1136/heartjnl-2019-315555. [DOI] [PubMed] [Google Scholar]
- 28.Sheikh A.S., Yahya S., Sheikh N.S., Sheikh A.A. C-reactive protein as a predictor of adverse outcome in patients with acute coronary syndrome. Heart Views. 2012;13:7–12. doi: 10.4103/1995-705X.96660. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Araújo C., Laszcynska O., Viana M. Quality of care and 30-day mortality of women and men with acute myocardial infarction. Rev Esp Cardiol. 2019;72:543–552. doi: 10.1016/j.rec.2018.05.012. [DOI] [PubMed] [Google Scholar]
- 30.Chew D.P., Bhatt D.L., Robbins M.A. Incremental prognostic value of elevated baseline C-reactive protein among established markers of risk in percutaneous coronary intervention. Circulation. 2001;104:992–997. doi: 10.1161/hc3401.095074. [DOI] [PubMed] [Google Scholar]
- 31.Heeschen C., Hamm C.W., Bruemmer J., Simoons M.L. Predictive value of C-reactive protein and troponin T in patients with unstable angina: a comparative analysis. CAPTURE Investigators. Chimeric c7E3 AntiPlatelet Therapy in Unstable angina REfractory to standard treatment trial. J Am Coll Cardiol. 2000;35:1535–1542. doi: 10.1016/s0735-1097(00)00581-7. [DOI] [PubMed] [Google Scholar]
- 32.Lindahl B., Toss H., Siegbahn A., Venge P., Wallentin L., Markers of myocardial damage and inflammation in relation to long-term mortality in unstable coronary artery disease. FRISC Study Group. Fragmin during Instability in Coronary Artery Disease N Engl J Med. 2000;343:1139–1147. doi: 10.1056/NEJM200010193431602. [DOI] [PubMed] [Google Scholar]
- 33.Biasucci L.M., Liuzzo G., Grillo R.L. Elevated levels of C-reactive protein at discharge in patients with unstable angina predict recurrent instability. Circulation. 1999;99:855–860. doi: 10.1161/01.cir.99.7.855. [DOI] [PubMed] [Google Scholar]
- 34.de Winter R.J., Bholasingh R., Lijmer J.G. Independent prognostic value of C-reactive protein and troponin I in patients with unstable angina or non-Q-wave myocardial infarction. Cardiovasc Res. 1999;42:240–245. doi: 10.1016/s0008-6363(99)00018-8. [DOI] [PubMed] [Google Scholar]
- 35.Kuller L.H., Tracy R.P., Shaten J., Meilahn E.N. Relation of C-reactive protein and coronary heart disease in the MRFIT nested case-control study. Multiple Risk Factor Intervention Trial. Am J Epidemiol. 1996;144:537–547. doi: 10.1093/oxfordjournals.aje.a008963. [DOI] [PubMed] [Google Scholar]
- 36.Bikdeli B., Madhavan M.V., Jimenez D. COVID-19 and thrombotic or thromboembolic disease: implications for prevention, antithrombotic therapy, and follow-up. J Am Coll Cardiol. 2020;75:2950–2973. doi: 10.1016/j.jacc.2020.04.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Bangalore S., Sharma A., Slotwiner A. ST-segment elevation in patients with Covid-19 - A case series. N Engl J Med. 2020;382:2478–2480. doi: 10.1056/NEJMc2009020. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.