Abstract
Pädiatrische Palliativversorgung richtet sich an Kinder, Jugendliche und junge Erwachsene mit lebensbedrohlichen und lebenslimitierenden Erkrankungen sowie deren Familien. Im Fokus steht die Verbesserung der Lebensqualität. Oft beginnt pädiatrische Palliativversorgung bereits mit der Diagnosestellung. Sie beschränkt sich nicht auf eine Begleitung am Lebensende. Die allgemeine Palliativversorgung wird von niedergelassenen Kinder- und Jugendärzten, Kinderkrankenpflegediensten sowie den Kinderkliniken in Deutschland geleistet. Wichtige tertiäre Versorgungselemente sind die spezialisierte ambulante Palliativversorgung, die seit dem Jahre 2007 eine Kassenleistung darstellt, die Kinderpalliativstationen in Datteln und München sowie Entlastungsangebote in stationären Kinderhospizen. Die Patienten sind oft verbal nicht mitteilungsfähig. Symptombeurteilung und -kontrolle sind eine Herausforderung für die oft multidisziplinären Teams. Viele Medikamente sind für die Indikation, die Altersgruppe oder den verwendeten Applikationsweg nicht zugelassen. Schmerzen, Atemnot, Spastik und Ernährungsstörungen sind die häufigsten Symptome. Nicht selten werden starke Opioide eingesetzt – auch bei nicht-onkologischen Patienten.
Was ist pädiatrische Palliativmedizin?
Im Zentrum pädiatrischer Palliativmedizin stehen Kinder und Jugendliche mit einer lebensbedrohlichen (LBE) bzw. lebenslimitierenden (LLE) Erkrankung sowie deren Angehörige.
Lebensbedrohliche Erkrankungen (LBE) sind Erkrankungen, für die eine kurative Therapie besteht, die aber nur bei einem Teil der Patienten erfolgreich verläuft. Lebenslimitierende Erkrankungen (LLE) sind Erkrankungen, die im Kindes- oder Jugendalter beginnen und mutmaßlich vor dem 40. Lebensjahr zum Tode führen.
Prinzipiell lassen sich 4 Patientengruppen der pädiatrischen Palliativversorgung unterscheiden:
Patienten mit einer lebensbedrohlichen Erkrankung und unklaren Heilungschancen. Während der Phase eines unklaren Therapieerfolgs oder bei Therapieversagen kann eine palliative Versorgung erforderlich sein. Beispiel: Krebs, irreversibles Organversagen von Nieren, Herz, Leber.
Patienten, die dank intensiver Therapie ein aktives Leben führen und deren Krankheitsverlauf verzögert wird, die jedoch eine verkürzte Lebenserwartung haben. Beispiel: Zystische Fibrose, Muskeldystrophie Duchenne.
Patienten mit einer fortschreitenden Erkrankung, die ausschließlich palliativ behandelt werden kann. Beispiel: Zeroid-Lipofuszinose, Mukopolysaccharidose.
Patienten mit einer schweren neurologischen Behinderung, die selbst nicht progredient verläuft, jedoch meist zu Komplikationen mit häufiger Erkrankung und vorzeitigem Tod führt. Beispiel: schwere Mehrfachbehinderung, z. B. bei Zustand nach peripartaler Asphyxie.
Daraus folgt, dass sich pädiatrische Palliativmedizin nicht auf Maßnahmen am Lebensende beschränkt. Vielmehr geht es um die multiprofessionelle Begleitung von jungen Patienten und deren Angehörige ab der Diagnosestellung, möglicherweise bis ins Erwachsenenalter hinein.
Ethische Aspekte der pädiatrischen Palliativmedizin
Die Entscheidung, bei einem unheilbar kranken Kind auf lebenserhaltende Maßnahmen zu verzichten, fällt schwer und ist oft das Ergebnis einer langen Auseinandersetzung mit der Frage, welche Maßnahmen im Sinne des Kindes sein mögen. Pädiater lehnen die gezielte Beendigung des Lebens eines Kindes durch die Gabe einer letalen Medikamentendosis ab. Wenn jedoch eine Therapie, die Leid mindert, zu einer Lebensverkürzung führen kann, wird dies akzeptiert. Entscheidend ist, dass sich die Behandlungsintention auf das Wohl des Kindes richtet und nicht auf die Beendigung dessen Lebens. Umso wichtiger ist es, die Frage nach der Beendigung lebenserhaltender Maßnahmen in einem Entscheidungsprozess im Team, ggf. auch unter Einbeziehung eines klinischen Ethikkomitees zu klären.
Aktive und passive Sterbehilfe
Definition
Aktive Sterbehilfe (Euthanasie) bezeichnet das gezielte, aktive Eingreifen des Arztes auf ausdrücklichen Wunsch des Patienten hin mit dem Ziel, dessen Leben möglichst rasch zu beenden – ihn also zu töten. Aktive Sterbehilfe, also Tötung auf Verlangen, ist in Deutschland verboten und strafbar (§ 216 StGB).
Passive Sterbehilfe bezeichnet die ärztliche Entscheidung, bei der Behandlung eines sterbenden, nicht einwilligungsfähigen Patienten auf Maßnahmen zu verzichten, die den Sterbeprozess hinauszögern. Ziel ist, es dem schwerkranken Patienten zu ermöglichen, an seiner Erkrankung zu sterben.
Somit ist der Begriff „passive Sterbehilfe“ eine missverständliche Formulierung für „Sterbenlassen“. Ethische Grundlage der passiven Sterbehilfe ist der Respekt vor dem Patienten – seinem Leben und seinem Sterben.
Doch selbst, wenn aus juristischer Sicht die Beendigung einer lebensverlängernden Maßnahme vertretbar ist, stellt deren konkrete Umsetzung für Kinder- und Jugendärzte eine große Herausforderung dar.
Der besondere Fall
Ein 12-jähriger Junge befindet sich im Endstadium einer SSPE (subakut sklerosierende Panenzephalitis), einer fortschreitenden Erkrankung des Gehirns ohne Heilungsaussichten. Er ist seit einem Jahr bettlägerig, seit Monaten bewusstlos, eine Kommunikation ist nicht mehr möglich. Die Ernährung erfolgt über eine PEG. Bei Fortsetzung der Ernährung würde der Patient noch längere Zeit leben. Die Eltern erleben den Zustand ihres Kindes als unerträglich leidvoll und wünschen die Beendigung der Ernährung.
Was denken Sie – handelt es sich um aktive oder passive Sterbehilfe? Wie würden Sie vorgehen?
Kommentar: Der Abbruch lebensverlängernder Maßnahmen, also auch der künstlichen Ernährung, gilt bei einer Erkrankung, die einen irreversiblen Verlauf angenommen hat, als passive Sterbehilfe und ist aus juristischer Sicht zulässig. Dies gilt auch, wenn – wie in diesem Fall – der Tod nicht unmittelbar bevorsteht. Doch auch eine eindeutige Rechtslage ersetzt nicht den Entscheidungsprozess zu der Frage, welches Vorgehen am ehesten im Sinne des 12-jährigen Patienten sein mag.
Entscheidungsgrundlagen für „end-of-life decisions“
Es gibt Situationen, in denen sich die Frage stellt, was höher zu werten ist – das Recht auf Leben oder das Recht, würdig zu sterben. Die Beantwortung dieser Frage ist eine der größten Herausforderungen für Kinder- und Jugendärzte. Als Entscheidungshilfe in dieser ethisch komplexen Situation führen wir eine Auswahl an Richtlinien an, die auf die Arbeitsgruppe der Züricher Medizinethikerin Ruth Baumann-Hölzle sowie die Arbeitsgruppe „Ethik“ der Confederation of the European Specialists of Paediatrics (CESP) zurückgeht.
Demnach ist die Beendigung lebensverlängernder Maßnahmen vertretbar, wenn das Kind durch diese Maßnahmen unerträglich belastet wird oder die Lebensverlängerung erfolgt, ohne dass unerträgliches Leiden deutlich vermindert werden kann.
Situationen, in denen Kinderärzte verpflichtet sind zu prüfen, ob die Fortsetzung von lebensverlängernden Maßnahmen sinnvoll ist, treten ein, wenn
der Tod trotz optimaler Therapie unvermeidbar ist und das Kind großes Leid erlebt,
das Kind nur durch intensivmedizinische Maßnahmen überleben kann, was jedoch zur Verlängerung von unerträglichem Leid führt,
das Kind zwar eine Zeitlang ohne intensivmedizinische Maßnahmen überleben könnte, aber trotz adäquater Maßnahmen zur Symptomkontrolle unerträglich leidet.
Eindeutige Vorgaben, wann eine Behandlung eingestellt werden sollte, gibt es nicht. Folgende Richtlinien können als Entscheidungshilfe dienen:
Wünscht das Kind eine Fortsetzung der lebensverlängernden Maßnahmen, ist dies zu respektieren.
Unterschiedliche Faktoren wie Zeitdruck, finanzielle oder materielle Gründe oder auch körperliche oder geistige Behinderung des Patienten dürfen die Entscheidungsfindung nicht beeinflussen.
Die Nichteinleitung von lebensverlängernden Maßnahmen oder deren Beendigung sind ethisch gleichwertig.
In Zweifelsfällen kann – nach ausführlicher Prüfung der Diagnose, Prognose und therapeutischen Optionen durch die behandelnden Ärzte – die Beurteilung durch einen zweiten Gutachter oder die Zusammenarbeit mit einem klinischen Ethikkomitee hilfreich sein. Auch wenn der behandelnde Arzt die Verantwortung für die Entscheidung selbst trägt, sollte er die Entscheidung gemeinsam mit dem Kind, dessen Eltern oder Erziehungsberechtigten und dem Behandlungsteam treffen. Wichtig ist, dass jede Entscheidung zur Beendigung oder Nichteinleitung von lebensverlängernden Maßnahmen ausführlich und vollständig für den Fall einer Überprüfung dokumentiert wird.
Wurde entschieden, dass auf lebensverlängernde Maßnahmen verzichtet wird, sollten umgehend Maßnahmen der Palliativversorgung eingeführt oder intensiviert werden, um die bestmögliche Lebensqualität zu erreichen. Während des Sterbens und nach dem Tod sollte das Behandlungsteam eine Trauerbegleitung für die Familie, also auch die Geschwister sicherstellen und auch später für weitere Gespräche zur Verfügung stehen.
Patientenverfügungen
Bei fortgeschrittenen oder leidvollen lebenslimitierenden Erkrankungen ist es oft nicht im besten Interesse des Patienten, im Falle einer akuten Verschlechterung auf alle intensivmedizinischen Möglichkeiten wie Reanimation oder Intubation zurückzugreifen. Diese Maßnahmen sollten dann unterbleiben. Bei der Gewichtung von kurativen und palliativen Therapieelementen von Kindern mit lebenslimitierenden Erkrankungen sind die Wünsche des betroffenen Kindes und seiner Eltern unbedingt zu berücksichtigen.
Als Orientierungshilfe für eine solche Situation wurde das Formblatt „EVN-Order“ von G. Rellensmann und C. Hasan entwickelt und 2008 von den Teilnehmern des Bundesarbeitskreises Pädiatrische Palliativmedizin (BAPP) zur Verwendung in der Pädiatrie empfohlen (Abb. 33.1). Dort wird dokumentiert, welche therapeutischen Maßnahmen bei einer akuten Verschlechterung oder lebensbedrohlichen Situation aus Sicht des Patienten oder der Sorgeberechtigten angemessen sind, z. B. „Intubation ja/nein“, „Kardiopulmonale Reanimation ja/nein“ usw.

Für die behandelnden Ärzte ist die EVN-Order eine wichtige Hilfe, da in Notfallsituationen oft nicht die erforderliche Zeit bleibt, um zu klären, welches Vorgehen am ehesten im Sinne des Patienten ist. Dies gilt in besonderem Maße für den Notarzt in der ambulanten Versorgung, der mit der Situation des Patienten nicht vertraut ist. Für den Patienten und seine Angehörigen stellt die vorsorgliche Erörterung des therapeutischen Vorgehens in Notfallsituationen eine Möglichkeit dar, das Lebensende vorzubereiten und einen würdigen Abschied und Tod zu ermöglichen.
Kommunikation
Emotionen
Der Tod eines Kindes ist für die Betroffenen eine große Belastung, die starke Gefühle auslöst. Menschen, die professionell mit Sterbenden und ihren Angehörigen arbeiten, sind regelmäßig mit Trauer, Hilflosigkeit, Wut sowie Bewältigungsstrategien wie Ambivalenz und Verdrängung konfrontiert. Voraussetzung für jede Form der Kommunikation ist, dass sich Ärzte wie Therapeuten bewusst mit diesen Gefühlen auseinandersetzen.
Eltern wollen einerseits ihr Kind vor Leid bewahren und einen möglicherweise leidvollen Sterbeprozess nicht verlängern. Andererseits wollen sie ihr geliebtes Kind auf keinen Fall verlieren. Diese scheinbar widersprüchlichen Positionen können eine lähmende Entscheidungsunfähigkeit zur Folge haben. Eine Möglichkeit des Umgangs mit Ambivalenz ist, in Gesprächen beiden Positionen Ausdruck zu verleihen und nicht zu versuchen, die Ambivalenz aufzulösen: „Auf der einen Seite wünschen wir uns alle, dass ihr Kind noch lange und gut lebt. Auf der anderen Seite wissen wir aber leider, dass …“
In jedem Falle ist es eine Grundvoraussetzung für die Arbeit mit Sterbenden und ihren Angehörigen, sich mit den dabei aufkommenden Gefühlen auseinanderzusetzen – beispielsweise im Rahmen einer Supervision.
Kommunikation mit dem Sterbenden
Ein Teil der palliativ behandelten Patienten ist bis zum Lebensende bei vollem Bewusstsein und kann sich mit seinen Angehörigen austauschen. Diese Patienten verleihen ihrem Wunsch nach Kommunikation je nach Alter und Entwicklungsstand auf sehr unterschiedliche Weise Ausdruck und verwenden dabei eigene Metaphern, die meist von ihren Todeskonzepten geprägt sind. Die Kenntnis der entwicklungsabhängigen Todesvorstellungen von Kindern kann zum Verständnis hilfreich sein.
Wenn Eltern ihrem Kind verschweigen wollen, dass es lebensbedrohlich erkrankt ist, andererseits die behandelnden Ärzte und Krankenschwestern eine offene Kommunikation mit dem Kind wünschen, kann dies zu Konflikten führen. Die Eltern versuchen, ihr Kind zu schonen und Belastendes von ihm fernzuhalten. Die Erfahrung zeigt jedoch, dass Kinder meist ahnen, wenn ihr Leben bedroht ist. Von häufigen, wiederkehrenden, teils schmerzhaften Untersuchungen oder therapeutischen Eingriffen, von sterbenden Kindern mit einem ähnlichen Krankheitsbild ziehen sie Rückschlüsse auf ihren eigenen Zustand. Auch haben sie oftmals ein feines Gespür für das, was in ihren Eltern vorgeht. Die Mitteilung der „Wahrheit“ des in greifbare Nähe gerückten Todes ist für diese Kinder und Jugendlichen „keine Wahrheit im eigentlichen Sinne, sondern die Bestätigung dessen, was sie ohnehin wissen oder zumindest ahnen“.
Sterbende Kinder fragen sich: Tut Sterben weh? Wann werde ich sterben? Werde ich allein sein, wenn ich sterbe? Was kommt danach? Auch wenn es auf diese Fragen keine eindeutigen Antworten gibt, kann man den Kindern einen Teil ihrer Ängste nehmen, indem man ihnen neben einer effizienten Schmerztherapie zusichert, dass sie während des Sterbens nicht alleine sein werden.
Nicht immer aber sind Gespräche mit dem Kind möglich. So leiden viele Kinder der pädiatrischen Palliativversorgung an einer schweren Beeinträchtigung ihrer kognitiven Funktionen. Doch auch bei diesen Kindern sind Interaktionsmöglichkeiten vorhanden, sie reagieren meist deutlich auf die Anwesenheit vertrauter Menschen, auf basale Stimulation, Musik und die emotionale Stimmung im Raum. Aus diesem Grunde sollten bei diesen Kindern potenziell belastende Gespräche mit den Eltern (z. B. über die Patientenverfügung) möglichst in einem anderen Raum stattfinden. Manche Eltern erleben es als hilfreich, ihrem Kind im Verlauf mit einfachen Worten den Stand ihrer Entscheidung mitzuteilen: „Wir haben beschlossen, dass du gehen darfst, wenn es soweit ist. Und wir werden dafür sorgen, dass du keine Schmerzen hast und dass immer jemand in deiner Nähe ist.“ Auch wenn unklar ist, wie viel das Kind davon versteht, kann diese Mitteilung für die Eltern eine wichtige Form der Vorbereitung auf das Lebensende ihres Kindes darstellen.
Kommunikation mit den Eltern
Das Wissen um die schwere Erkrankung des eigenen Kindes ist ein für die Eltern sehr leidvoller Prozess. Zusätzlich führen die kontinuierlichen Versorgungsaufgaben nicht selten zu körperlich-seelischer Erschöpfung (Burn-out oder chronisches Erschöpfungssyndrom). Teilweise haben Eltern unrealistische Vorstellungen bezüglich der Heilungschancen ihres Kindes. Ein behutsames Hinführen auf die Möglichkeit des Sterbens ist die Voraussetzung für eine hilfreiche, auch auf die Bedürfnisse der Eltern abgestimmte palliative Therapie.
Die Beziehung des Kindes zu seinen Eltern ist existenziell wichtig. Daher sollten bei der Gewichtung kurativer und palliativer Therapieelemente die Ansichten der Eltern Berücksichtigung finden. Teilen Eltern und Behandelnde unterschiedliche Ansichten über den zu beschreitenden Weg, kann dies zu Spannungen führen, die das Kind wahrnimmt, die es verunsichern und somit über vermehrte Anspannung und Stress beispielsweise zu vermehrten Schmerzen führen können.
Ein Loyalitätskonflikt des Kindes zwischen Eltern und Ärzten ist nach Möglichkeit zu vermeiden.
Kommunikation mit den Geschwistern
Viele Geschwister von Kindern mit einer lebenslimitierenden Erkrankung sind im Vergleich zu ihren Altersgenossen ängstlicher und leiden vermehrt unter Schuldgefühlen, aggressiven oder regressiven Verhaltensmustern, Schulproblemen, Schlafstörungen, Essstörungen oder Kopfschmerzen. Andererseits zeigen Geschwister auch eine positive Entwicklung in Form von einer gesteigerten Wertschätzung für das eigene Leben und ihre Familie, erhöhter Empathie und Sensibilität für andere sowie einem gestärkten Selbstbewusstsein mit beschleunigter Persönlichkeitsentwicklung. Eine offene Kommunikation in der Familie über die mit der Erkrankung verbundenen Aspekte ermöglicht den Geschwistern ein realistisches Verständnis der Erkrankung.
Professionelle Geschwisterarbeit in Form von Gruppentreffen und gemeinsamen Aktivitäten kann das Risiko körperlicher und seelischer Erkrankungen verringern.
Schmerztherapie
„Total Pain“
Fast alle Kinder leiden am Lebensende unter Schmerzen. Voraussetzung einer adäquaten Schmerztherapie ist das Wissen um bio-psycho-soziale Faktoren bei der Entstehung von Schmerzen. Der „biologische“, offensichtliche Befund erklärt häufig nicht das Ausmaß der subjektiv empfundenen Schmerzen. Neben biologischen Faktoren, wie genetischer Disposition bezüglich der Schmerzempfindlichkeit, entscheiden auch psychosoziale Faktoren wie Angst oder Aufmerksamkeit auf den Schmerz über das Ausmaß der subjektiven Beeinträchtigung.
Physische, psychische, soziale und spirituelle Faktoren beeinflussen die Entstehung von Schmerzen. Kann mit einer medikamentösen Schmerztherapie kein zufriedenstellender Erfolg erzielt werden, ist zu prüfen, ob eine der anderen Schmerzdimensionen nicht ausreichend beachtet wurde.
Hinsichtlich der psychischen Dimension kann der Schmerz eine Botschaft enthalten wie „Wie stark müssen meine Schmerzen werden, bis ihr mir die Wahrheit sagt?“; „Bleib bei mir, ich will nicht alleine sein“; „Ich habe solche Angst vor dem Tod“; „Meine ganze Verzweiflung schreie ich heraus, wenn du meinen Verband wechselst“.
Die multiprofessionelle Arbeit mit Psychologen und Seelsorgern stellt hier einen wesentlichen Ansatz dar, um auch soziale Faktoren wie der elterlichen Belastung, die sich auf das kranke Kind übertragen kann, gerecht zu werden.
Schmerzerfassung
Idealerweise erfolgt die Einschätzung der Schmerzen durch das Kind oder den Jugendlichen selbst. Für eine möglichst genaue Einschätzung von Schmerzen eignet sich bei Kindern ab Schulalter die numerische Ratingskala (NRS), ein Zahlenstrahl von 0 bis 10. Mit den Worten „Zeige mir bitte, wie stark deine Schmerzen sind – Null bedeutet keine Schmerzen, 10 bedeutet stärkste Schmerzen“ kann eine Schmerzeinschätzung erfolgen, mit deren Hilfe auch der weitere Therapieerfolg besser nachvollziehbar ist. Bei jüngeren Kindern kann eine Skala mit 6 Gesichtern angewendet werden, wobei die Gesichter von links nach rechts mit 0, 2, 4, 6, 8 oder 10 Punkten gleichgesetzt werden können. Auch hier sollte in einer kindgemäßen Sprache nach Schmerzen und nicht nach der Gefühlslage wie „glücklich“ oder „traurig“ gefragt werden (Abb. 33.2).
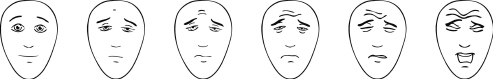
Wenn das betroffene Kind nicht in der Lage ist, sich selbst einzuschätzen bzw. die Mitarbeit verweigert, sollten Fremdeinschätzungsskalen verwendet werden. Auch hier eignet sich die numerische Ratingskala, bei schwer mehrfach behinderten Patienten kann das Paediatric Pain Profile eingesetzt werden. Dabei handelt es sich um eine Liste mit 20 Verhaltensweisen wie „war fröhlich“ oder „weinte/jammerte/stöhnte“, die über einen gewissen Zeitraum beobachtet und je nach Auftreten mit einem Punktwert angegeben werden (auf Englisch auch im Internet unter www.ppprofile.org.uk; eine deutsche Übersetzung gibt es von Zernikow, 2015).
Medikamentöse Schmerztherapie
Grundregeln
Die Schmerztherapie sollte gemäß WHO-Stufenschema erfolgen (Abschn. 33.3.4). Dabei sollten Opioide, wenn erforderlich, frühzeitig zum Einsatz kommen.
Die Kombination von Opioid und Nichtopioid hat sich bei bestimmten Schmerzsyndromen (z. B. Knochenschmerzen) bewährt.
Die orale Applikationsform ist zu bevorzugen, auch stärkste Schmerzen können ausreichend oral behandelt werden.
Die Verabreichung von Analgetika erfolgt regelmäßig nach der Uhr sowie zusätzlich bei Schmerzspitzen nach Bedarf.
Obstipation ist die häufigste Nebenwirkung einer Opioidanalgesie, sie muss prophylaktisch mit stuhlregulierenden Maßnahmen behandelt werden. Weitere mögliche Nebenwirkungen sollten dem Arzt bewusst sein, um rechtzeitig darauf reagieren zu können.
Die Dokumentation der Effektivität der Therapie im Verlauf (z. B. durch wiederholte Selbst- oder Fremdeinschätzung der Schmerzen) sowie von Nebenwirkungen ist fester Bestandteil einer hochwertigen Schmerztherapie.
Wenn unter Einhaltung dieser Grundregeln keine ausreichende Besserung eintritt, sollte ein Schmerztherapeut oder Palliativmediziner hinzugezogen werden.
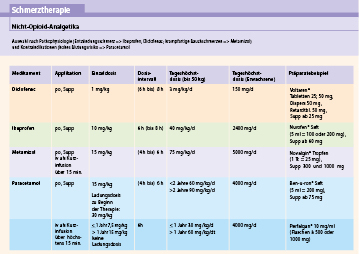
Abb. 33.3 und Abb. 33.4 zeigen die Medikation mit Nicht-Opioid- und Opioidanalgetika.


WHO-Stufenschema
Das WHO-Stufenschema (Abb. 33.5) unterscheidet zwischen hochpotenten und niedrigpotenten Opioiden. Einige niedrigpotente Opioide wie Tramadol sind einerseits nicht BTM-pflichtig, was die Verordnung und Handhabung im klinischen Alltag deutlich erleichtert. Andererseits haben alle niedrigpotenten Opioide einen Ceiling-Effekt: Ab einer Schwellendosis führt die Dosissteigerung zu keiner weiteren Zunahme der analgetischen Wirkung. Demgegenüber sind hochpotente Opioide zwar BTM-pflichtig, es existiert für sie jedoch keine Maximaldosis, solange die Dosissteigerung auch mit einer Steigerung der analgetischen Wirkung einhergeht. Nur die Nebenwirkungen entscheiden somit, welche Dosis für den Patienten noch vertretbar ist.

Die Errechnung der Dosis erfolgt bei Kindern stets auf einer mg/kgKG-Basis bis hin zu einer maximalen Starteinzeldosis (Beispiel: „orales unretardiertes Morphin 0,2 mg/kgKG (maximal 5 mg) alle 4 h“).
WHO-Stufe 1
Klassische Nicht-Opioid-Analgetika der pädiatrischen Palliativmedizin sind Paracetamol, Ibuprofen und Metamizol (Abb. 33.3 und Abb. 33.5).
Paracetamol
Paracetamol (PCM) ist das am meisten eingesetzte Nicht-Opioid-Analgetikum in der Pädiatrie. Der genaue Wirkmechanismus ist bisher ungeklärt. Aufgrund des geringen Effekts auf die periphere Cyclooxygenase (COX) löst es keine klinisch relevante Thrombozytenaggregation oder gastrointestinale Mukosaschäden aus. Bei oraler oder rektaler Applikation sollte bei erstmaliger Gabe eine „loading dose“ (Sättigungsdosis) appliziert werden, d. h. einmalig die doppelte Dosis. Wegen der besonders in palliativen Situationen eingeschränkten Entgiftungskapazität der Leber und der potenziell lebertoxischen Wirkung von PCM (PCM-Überdosierungen sind der häufigste Grund für ein Leberversagen bei Kindern) sollten bei einer Langzeittherapie über 72 h regelmäßig Leberwerte wie S-GOT (syn. AST, ASAT), S-GPT (syn. ALT, ALAT) und die Gerinnung kontrolliert werden.
Ibuprofen
Ibuprofen zählt zur Gruppe der nichtsteroidalen Antirheumatika (NSAR). Es wirkt mittels Hemmung der Cyclooxygenase analgetisch sowie hemmend auf die Thrombozytenaggregation. Sein Einsatz sollte nur dann erfolgen, wenn eine ausreichende Thrombozytenfunktion vorausgesetzt werden kann. NSAR sind gut verträglich, ihre antientzündliche Wirkkomponente ist bei bestimmten Schmerzerkrankungen von Vorteil. Im Rahmen einer Dehydratation, welche in der terminalen Phase bei palliativen Patienten häufig ist, kann die Gabe von NSAR ein Nierenversagen auslösen. Bei Langzeiteinnahme ist eine Schädigung der gastrointestinalen Mukosa nicht selten und kann zu Ulzera und Verdauungsschwierigkeiten führen. Die diesbezüglich prophylaktische Gabe von Omeprazol ist gängige Praxis, ihre Wirksamkeit bislang jedoch für das Kindesalter nicht ausreichend untersucht.
Metamizol
Innerhalb der Gruppe der Nicht-Opioid-Analgetika hat Metamizol den größten analgetischen Effekt. Wegen seiner spasmolytischen Wirkung eignet es sich besonders zur Behandlung von abdominellen Schmerzen. Metamizol wird häufig auch in Kombination mit Opioiden eingesetzt, um die erforderliche Opioiddosis und die damit verbundenen unerwünschten Wirkungen, v. a. die Obstipation, zu verringern, obgleich dieser Effekt bislang wissenschaftlich nicht belegt ist.
International umstritten ist Metamizol aufgrund des sehr geringen Risikos einer Agranulozytose. Tritt unter Metamizol ein septisches Krankheitsbild auf, sollte das Vorliegen einer Neutropenie geprüft und Metamizol im Zweifelsfall abgesetzt werden. Unter dieser Maßnahme kommt es üblicherweise zu einer Normalisierung der Granulozytenzahl. Weitere Nebenwirkungen sind Überempfindlichkeitsreaktionen sowie ein Blutdruckabfall, letzterer v. a. bei zu rascher i.v.-Gabe, weshalb Metamizol nur bei stabilem Kreislaufverhältnissen und i.v. nur als Kurz- oder Dauerinfusion verabreicht werden sollte.
WHO-Stufe 2
Auf der 2. Stufe des WHO-Schemas kommen niedrigpotente Opioide zur Behandlung mittelstarker Schmerzen ohne Progredienz zum Einsatz. Ist jedoch davon auszugehen, dass die zu behandelnden Schmerzen stark sind, bzw. dass sie an Intensität rasch zunehmen werden, kann direkt mit der Gabe von Opioiden der Stufe 3 begonnen werden (Abb. 33.4 und Abb. 33.5).
Tramadol
Tramadol kann sowohl oral als auch i.v. verabreicht werden. Nebenwirkungen wie Übelkeit, Erbrechen und Atemdepression sind in der Pädiatrie selten, zumal ab einer Dosierung über 10 mg/kgKG/Tag meist ein Wechsel auf Morphin erfolgt. Tramadol wird durch das Enzym CYP2D6 in seinen pharmakologisch aktiven Metaboliten O-Desmethyltramadol umgewandelt. Je nach Enzymaktivität kann es zu erheblichen interindividuellen Unterschieden in der Wirksamkeit von Tramadol kommen.
Tilidin
Tilidin ist als Kombipräparat mit Naloxon nur als orales Medikament erhältlich. Die Beigabe von Naloxon verhindert einerseits die missbräuchliche i.v.-Verwendung, andererseits werden unerwünschte Nebenwirkungen wie Obstipation seltener beobachtet. Die Autoren setzen häufig Tilidin/Naloxon bei schwerstmehrfachbehinderten Patienten ein. Zahlreiche Fallberichte belegen gute Erfahrungen damit.
WHO-Stufe 3
Hochpotente Opioide können neben einer analgetischen Wirkung auch eine Hyperalgesie hervorrufen. Die klinisch beobachtbare Wirkung ist dann der Nettoeffekt zwischen analgetischer und hyperalgetischer Wirkung. Beim Einsatz extrem hoher Morphindosen kann der hyperalgetische Effekt überwiegen, der Patient klagt bei Dosissteigerung über mehr Schmerzen und Berührungsempfindlichkeit. In einem solchen Falle sollte das Opioid gewechselt werden.
Obwohl zahlreiche starke Opioide im klinischen Alltag zum Einsatz kommen, beschränkt sich die weitere Darstellung auf Morphin und Fentanyl, wir verweisen auf die entsprechende Fachliteratur zum Thema pädiatrische Schmerztherapie.
Eindosieren und Absetzen von Opioiden
Die aktuellen Dosisempfehlungen zum Beginn einer Opioidtherapie finden sich in Abb. 33.4. Ausgehend von der Startdosis sollte der Patient nach einem festen Zeitplan, z. B. alle 6 oder 8 h sein Opioid erhalten. Bei Säuglingen unter 6 Monaten und Kindern mit einem Zerebralschaden sollte nur 1/3–¼ der empfohlenen Startdosis verabreicht werden. Zusätzlich zur Startdosis wird eine Bedarfsmedikation angesetzt, die 1⁄6 bis ein Zehntel der Tagesdosis beträgt. Sie muss konstant an den steigenden Tagesbedarf angepasst werden.
Häufig tritt zu Beginn einer Opioidtherapie vermehrte Müdigkeit, seltener auch Übelkeit auf, diese Symptome sind innerhalb weniger Tage rückläufig. Bei korrekter Vorgehensweise und oraler Applikation ist keine atemdepressive Wirkung zu erwarten. Mit Beginn der Opioidtherapie sollten vorbeugend stuhlregulierende Maßnahmen erfolgen.
Wird ein Opioid ca. 5 Tage lang eingenommen, wird die Opioidmenge bei Therapieende über 3–4 Tage schrittweise ausgeschlichen. Bei einer längeren Anwendungsdauer reduziert man anfangs die Dosis um 20–40% in 24 h, später um 10–20% in 24 h. Treten Entzugssymptome auf, wird eine weitere Reduktion zunächst ausgesetzt. Zur Therapie von Entzugssymptomen ist eine zusätzliche Opioidgabe weitaus besser geeignet als die Gabe eines Benzodiazepins. Die Opioidentwöhnung kann mehrere Wochen dauern, in bestimmten Fällen kann Clonidin die Entwöhnung erleichtern.
Morphin
Morphin wird als Standardanalgetikum zur Behandlung starker Schmerzen eingesetzt. Es existiert keine obere Dosisgrenze, die erforderliche Dosis sollte ausgehend von einer Startdosis vorsichtig eintitriert werden. Bei oraler Applikation variiert die Absorption teils erheblich, die Bioverfügbarkeit beträgt im Durchschnitt etwa 1/3 der verabreichten Dosis. Entsprechend sollte für einen äquianalgetischen Effekt bei einem Wechsel zur i.v.-Applikation nur 1/3 der oralen Dosis gegeben werden. Der maximale Wirkspiegel wird bei Erwachsenen nach einer Stunde erreicht. Da Morphin und seine Metabolite renal eliminiert werden, kann es bei Niereninsuffizienz vermehrt zu epileptischen Anfällen, Myoklonie und Unruhe bzw. Atemdepression kommen.
Um einen konstanten Plasmaspiegel von Morphin zu erreichen, empfiehlt sich die 2- bis 3-mal tägliche Gabe von Retardpräparaten. Die kleinste erhältliche Retardtablette enthält 10 mg Morphin, sie sollte nicht mechanisch zerteilt werden, da es sonst zu einem Verlust der Retardierung kommt. Bei einem Körpergewicht unter 20 kg oder bei Schwierigkeiten in der Verabreichung von Tabletten empfiehlt sich die Gabe von Morphinretardgranulat. Dieses kann in Wasser gelöst, dann in sehr kleinen Dosierungen verabreicht und auch über dünne Magen- bzw. PEG-Sonden appliziert werden. Für Schmerzspitzen stehen unretardierte Präparate wie Morphintropfen oder -suppositorien zur Verfügung.
Fentanyl
Fentanyl kann i.v., transdermal, transbukkal, sublingual sowie intranasal eingesetzt werden. In der Palliativversorgung krebskranker Kinder kommt häufig das transdermale System zum Einsatz. Dieses sollte jedoch nur eingesetzt werden, wenn eine stabile Opioiddosis über mehrere Tage verabreicht wurde und eine Therapiedauer von einigen Wochen antizipiert wird. Für Durchbruchschmerzen kommt zunehmend Fentanyl als bukkale, sublinguale oder nasale Applikationsform zum Einsatz. Studien zu Kindern in der Palliativsituation fehlen.
Nebenwirkungen von Opioiden
Die wichtigsten Nebenwirkungen von Opioiden bei Kindern und Jugendlichen sind Obstipation, Übelkeit, Erbrechen, Juckreiz und Müdigkeit. Zur Minimierung dieser Beschwerden sollten die Optionen Dosisreduktion, symptomatische Therapie des Schmerzauslösers, Wechsel des Opioids sowie Wechsel des Applikationswegs geprüft werden. Zur Vermeidung von Obstipation sollte eine prophylaktische Stuhlregulation erfolgen (z. B. Macrogol). Übelkeit und Erbrechen treten meist nur in der ersten Woche auf, manche Kinder profitieren von Dimenhydrinat-Kaugummi (10 mg oder 20 mg). Juckreiz kann bei stabiler Schmerzsituation mit einer passageren Dosisreduktion reduziert werden, teilweise ist Clemastin hilfreich. Andernfalls ist ein Opioidwechsel, z. B. auf Hydromorphon, erforderlich. Müdigkeit ist eine häufige Nebenwirkung zu Beginn der Morphintherapie, bei einer Niereninsuffizienz sollte eine Opioidrotation auf Buprenorphin erfolgen.
Seltene Nebenwirkungen sind Harnverhalt, Halluzinationen und Myoklonien. Eine Atemdepression ist bei oraler Therapie mit retardiertem Morphin und adäquater Dosierung nicht zu befürchten.
Adjuvanzien
Adjuvanzien sind eine heterogene Gruppe von Substanzen, die nicht als klassische Analgetika gelten, auch wenn sie bestimmte Schmerzen reduzieren oder Nebenwirkungen der Schmerztherapie verringern können (Koanalgetika http://www.deutsches-kinderschmerzzentrum.de/fileadmin/media/PDF-Dateien/Schmerzkarte_web.pdf). Zu den adjuvanten Schmerzmitteln zählen u. a. trizyklische Antidepressiva, Sedativa, Hypnotika, Neuroleptika, Antikonvulsiva und Glukokortikosteroide. Ihr Einsatz in der pädiatrischen Palliativmedizin erfolgt nur in Ausnahmefällen, z. B. bei neuropathischen Schmerzen.
Patientenkontrollierte Analgesie (PCA)
Ist im Rahmen einer Schmerztherapie die längerfristige i.v.-Applikation von Opioiden erforderlich, kann der Einsatz einer PCA-Pumpe von Vorteil sein. Damit kann sich der Patient – zusätzlich zu einer basalen Infusion – bei Bedarf Schmerzmittelboli verabreichen. Kinder ab 7 Jahren verstehen das Prinzip der PCA-Pumpe rasch.
Symptomkontrolle in der Lebensendphase
Schmerzen, Dyspnoe, Verhaltensänderungen, Nicht-essen-Wollen und verändertes Aussehen – das sind laut Elternbefragung die leidvollsten Symptome in den letzten Lebenstagen von Kindern mit Krebs. Psychische Symptome wie Angst vor dem Alleinsein, Traurigkeit und Sprachlosigkeit werden jedoch oft nicht ausreichend wahrgenommen.
Die Linderung leidvoller Symptome am Lebensende stellt eine wichtige Aufgabe pädiatrischer Palliativmedizin dar. Die folgende Darstellung beschränkt sich auf das Symptom Dyspnoe.
Dyspnoe
Etwa jedes zweite Kind der pädiatrischen Palliativversorgung leidet am Lebensende unter Atemnot. Zahlreiche Symptome wie zähes Sekret, eine Infektion, eine obstruktiven Bronchitis, eine Flüssigkeitsüberladung, ein Pleuraerguss u. a. können Atemnot auslösen und sind in der Regel gut behandelbar. Kann das Vorliegen einer solchen Ursache ausgeschlossen werden, hat sich die Gabe von Opioiden bewährt sowie eine optimierte Lagerung im Bett, Physiotherapie bzw. Atemtherapie und Maßnahmen zur Reduktion von Angst. Mittel der zweiten Wahl sind Benzodiazepine und schwache Neuroleptika. Sauerstoff sollte nur bei nachgewiesener Hypoxie zum Einsatz kommen, Steroide bei pulmonaler Obstruktion oder Tumorbegleitödemen, die einen Bronchus verlegen. Auch ein Ventilator, der Luft ins Gesicht bläst, konnte bei vielen Kindern eine Linderung der Atemnot bewirken.
Das Lebensende unserer jungen Patienten ist häufig von Leid und Trauer geprägt. Dennoch erleben wir gerade in dieser Abschiedsphase zuweilen ein überraschend großes Spektrum des Lebens: tiefste Trauer und Verzweiflung, ansteckende Freude, ruhige Klarheit, Momente intensiver Begegnung. Den Patienten und seine Familie in diesem weiten Spektrum zu begleiten ist ein wichtiger Teil pädiatrischer Palliativmedizin.






