Abstract
Die angemessene Deckung der Ernährungserfordernisse von Kindern und Jugendlichen ist von zentraler Bedeutung für Wachstum und Entwicklung, die kurz- und langfristige Gesundheit sowie die Leistungsfähigkeit (Koletzko et al. 2011, 2005a). Grundvoraussetzung für die normale Funktion des Organismus ist die Gewährleistung des metabolischen Bedarfs an Wasser, Energie sowie Makro- und Mikronährstoffen. Der Zufuhrbedarf eines Nährstoffs lässt sich definieren als „die Menge und chemische Form eines Nährstoffes, welche systemisch benötigt wird, um eine normale Gesundheit und Entwicklung zu ermöglichen, ohne den Stoffwechsel eines anderen Nährstoffes zu beeinträchtigen. Der entsprechende Nährstoffbedarf ist die Zufuhrmenge, welche ausreicht, um den physiologischen Bedarf zu decken. Idealerweise sollte dies ohne extreme homöostatische Prozesse oder ausgeprägte Verarmung bzw. Überschüsse der Körperdepots erreicht werden“ (ESPGHAN Committee on Nutrition 1997).
Einschätzung des kindlichen Nährstoffbedarfs
Die angemessene Deckung der Ernährungserfordernisse von Kindern und Jugendlichen ist von zentraler Bedeutung für Wachstum und Entwicklung, die kurz- und langfristige Gesundheit sowie die Leistungsfähigkeit (Koletzko et al. 2011, 2005a). Grundvoraussetzung für die normale Funktion des Organismus ist die Gewährleistung des metabolischen Bedarfs an Wasser, Energie sowie Makro- und Mikronährstoffen. Der Zufuhrbedarf eines Nährstoffs lässt sich definieren als „die Menge und chemische Form eines Nährstoffes, welche systemisch benötigt wird, um eine normale Gesundheit und Entwicklung zu ermöglichen, ohne den Stoffwechsel eines anderen Nährstoffes zu beeinträchtigen. Der entsprechende Nährstoffbedarf ist die Zufuhrmenge, welche ausreicht, um den physiologischen Bedarf zu decken. Idealerweise sollte dies ohne extreme homöostatische Prozesse oder ausgeprägte Verarmung bzw. Überschüsse der Körperdepots erreicht werden“ (ESPGHAN Committee on Nutrition 1997).
Bei der Definition von Referenzwerten des Nährstoffbedarfs für Populationen von gesunden Kindern und Jugendlichen müssen einige Besonderheiten berücksichtigt werden. Im Gegensatz zum erwachsenen Organismus muss die Nährstoffzufuhr beim Kind und beim Jugendlichen nicht nur den Erhaltungsbedarf für Grundumsatz, obligate Verluste und körperliche Aktivität decken; Kinder haben zusätzlich einen hohen und spezifischen Substratbedarf für das Wachstum. Besonders hoch ist dieser zusätzliche Bedarf während der raschen Gewichtszunahme im Säuglingsalter sowie während der Phasen des Wachstumsspurts im Vorschulalter und in der Pubertät. Im Gegensatz zu ihrem hohen Bedarf haben Kinder aber eine nur begrenzte Kapazität zur Kompensation einer unausgewogenen Substratzufuhr, vor allem aufgrund geringerer körpereigener Depots an Nährstoffen. Im frühen Lebensalter können zudem unreife gastrointestinale und hepatische Funktionen sowie eine eingeschränkte renale Konzentrationsfähigkeit die Homöostasefähigkeit weiter einschränken. Von zusätzlicher Bedeutung ist die lange Lebenserwartung der Kinder mit schon dadurch resultierender höherer Wahrscheinlichkeit langzeitiger Auswirkungen von Menge und Qualität der Ernährung auf das spätere Wohlbefinden und die langfristige Gesundheit wie z. B. das Risiko für kardiovaskuläre Krankheiten im höheren Lebensalter (Koletzko 2000; Koletzko et al. 2005a).
Im Laufe des vergangenen Jahrzehnts hat eine große Zahl von Studien belegt, dass die Ernährung während sensitiver Phasen des frühkindlichen Wachstums und der Organentwicklung permanent programmierende Wirkungen auf spätere Organstrukturen und -funktionen und damit auch auf das Krankheitsrisiko hat.
Im Gegensatz zur großen Relevanz einer angemessenen Nährstoffzufuhr im frühen Lebensalter steht die sehr begrenzte wissenschaftliche Datenbasis, auf deren Grundlage Schlussfolgerungen über die bedarfsgerechte Nährstoffzufuhr im Kindesalter gezogen werden können. Die vorhandenen Daten zum Nährstoffbedarf von Kindern und Jugendlichen sind äußerst lückenhaft, so dass eine konsequent evidenzbasierte Erstellung von Referenzwerten für die Zufuhr der meisten Nährstoffe für die verschiedenen pädiatrischen Altersgruppen nicht möglich ist. Aufgrund dieser Kenntnislücken werden Schätzwerte für eine angemessene Nährstoffzufuhr für Kinder und Jugendliche oftmals aus Werten für Erwachsene und ggf. für Säuglinge extrapoliert, meist auf der Grundlage durchschnittlicher altersbezogener Daten des Körpergewichts, der Körperoberfläche oder des metabolischen Körpergewichts (Atkinson u. Koletzko 2006; The Scientific Committee for Food 1993). Ein analoges Vorgehen der linearen Extrapolation wird ebenfalls häufig verwandt, um für Kinder Obergrenzen für die unbedenkliche Nährstoffzufuhr („upper safe levels of nutrient intake“) festzulegen, also obere Zufuhrmengen, bei denen nachteilige Wirkungen nicht angenommenen werden müssen (The Scientific Committee for Food 2003b). Auch hier wird eine solche Extrapolation deshalb vorgenommen, weil für die meisten Nährstoffe die Datenbasis viel zu begrenzt ist, um auf der Basis gesicherter wissenschaftlicher Evidenz eine direkte Ableitung von Obergrenzen der unbedenklichen Nährstoffzufuhr für die einzelnen pädiatrischen Altersgruppen abzuleiten.
Allerdings besteht kein Grund für die Annahme, dass lineare Extrapolationen allein auf der Basis des Körpergewichts oder der Körperoberfläche adäquate altersbezogene Referenzwerte oder Obergrenzen der unbedenklichen Nährstoffzufuhr erzielen können (Atkinson u. Koletzko 2007). Erhebliche Bedenken zu diesem unzulänglichen Vorgehen wurden durch den Wissenschaftlichen Lebensmittelausschuss der Europäischen Kommission im Hinblick auf die Festlegung von Obergrenzen formuliert:
Das Komitee weiß um die Grenzen der verfügbaren Methoden und des vom Komitee gewählten Vorgehens bei der Extrapolation tolerabler Obergrenzen der Nährstoffzufuhr für Kinder aus den für adulte Populationen etablierten Werten auf der Grundlage ausschließlich des Körpergewichts oder der Körperoberfläche. Für einige Nährstoffe folgerte das Komitee, dass eine Extrapolation auf der Basis des Körpergewichts oder der Körperoberfläche zu Obergrenzen für Kinder führen würde, welche mit dem bekannten Nährstoffbedarf unvereinbar wären, und gab entsprechend für Kinder keine Empfehlungen für Obergrenzen ab. Physiologische Unterschiede zwischen Erwachsenen und Kindern besonders im jüngeren Alter sind sowohl quantitativer als auch qualitativer Natur. Bestehende Unterschiede in der Substratabsorption, -verstoffwechselung, Gewebedeposition während des Wachstums sowie renaler und anderweitiger Exkretion, welche Obergrenzen der unbedenklichen Nährstoffzufuhr beeinflussen, stehen nicht immer in engem Zusammenhang mit der Körpergröße. Das Komitee empfiehlt, dass dieses Problem untersucht wird um festzulegen, ob Verbesserungen in der gewählten Vorgehensweise bzw. weitere Forschung notwendig sind. (The Scientific Committee for Food 2003a) «
Zur Etablierung besserer wissenschaftlicher Grundlagen über die physiologischen Nährstoffbedürfnisse bei Kindern und Jugendlichen sind weitere systematische wissenschaftliche Untersuchungen dringend erforderlich. Die Voraussetzungen für erfolgreiche Fortschritte sind heute günstig, weil methodische Fortschritte zur Entwicklung wenig invasiver und nichtinvasiver Untersuchungsverfahren geführt haben, die ethische Studien zu vielen offenen Fragen bei Kindern ermöglichen.
Trotz der erheblichen Defizite der wissenschaftlichen Datenbasis sind Expertenkommissionen in vielen Ländern und Regionen immer wieder aufgefordert, Referenzwerte für die angemessene Nährstoffzufuhr für Populationen von Kindern und Adoleszenten und auch Referenzwerte für die Nährstoffkennzeichnung auf Lebensmitteln für Kinder zu etablieren (Atkinson u. Koletzko 2006; Deutsche Gesellschaft für Ernährung et al. 2001; Institute of Medicine of the National Academies 2003; The Scientific Committee for Food 1993, 2003b). Es verwundert nicht, dass die publizierten Zahlen für die angemessene Zufuhr der einzelnen Nährstoffe zwischen unterschiedlichen Institutionen z. T. ganz erheblich differieren (Koletzko u. Hermoso 2008). Dies beruht nicht allein auf unterschiedlichen subjektiven Bewertungen, die an die Stelle fehlender präziser Daten treten müssen, sondern auch auf Unterschieden der zugrunde liegenden Konzepte über die Ableitung von Referenzwerten. Überwiegend geht man von der Annahme einer annähernden Normalverteilung des Nährstoffbedarfs in der Population aus und bestimmt Referenzwerte für Populationen als diejenige Nährstoffzufuhr, die den Bedarf bei fast allen Individuen der Population (etwa 97 %) decken kann (◘ Abb. 25.1). Zur Verwirrung tragen jedoch die von verschiedenen Expertengruppen benutzten unterschiedlichen Definitionen und Begriffe bei. So werden für vergleichbare Konzepte parallel die Begriffe „nutrient intake values“, „population reference intakes“, Referenzwerte für die Nährstoffzufuhr („reference values for nutrient intakes“) und „dietary reference intakes“ benutzt.
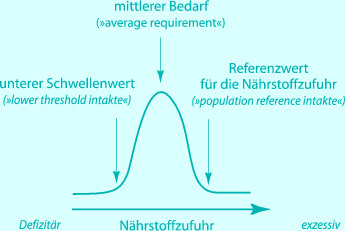
Die bestehenden unterschiedlichen Begriffe und Zahlenwerte fördern Missverständnisse bei der Anwendung von Referenzwerten, z. B. zum Vergleich und zur Bewertung von Ernährungs- und Verzehrserhebungen, zur Erstellung von Richtlinien über eine angemessene Zusammensetzung der Ernährung und von Mahlzeiten in der Gemeinschaftsverpflegung sowie für Entscheidungen über Strategien zur Optimierung und Supplementation. Häufig gibt es Fehlinterpretationen des Stellenwerts und der Bedeutung von Referenzwerten sowie der zugrunde liegenden Annahmen und statistischen Konzepte. Beispielsweise gehen viele Angehörige von Gesundheitsberufen und Ernährungsfachkräfte von der Einschätzung aus, Referenzwerte würden eine zuverlässige Basis für von ihnen abgegebene spezifische Empfehlungen zur Ernährungsweise einzelner Kinder und Jugendlicher darstellen. Referenzwerte werden auch als Grundlage für die Definition von Werten zur Deklaration des Nährstoffgehalts in Lebensmitteln herangezogen. In der Vergangenheit hielt man die mittleren Bedarfswerte für Populationen (◘ Abb. 25.1) für eine angemessene Basis für die Produktdeklaration (The Scientific Commitee for Food 1993). Dagegen ist heute allgemeiner Konsens, die populationsbezogenen Referenzwerte für die Nährstoffzufuhr als Grundlage heranzuziehen, d. h. diejenigen Nährstoffzufuhrmengen, welche den Bedarf nahezu aller Individuen in einer Population decken sollten (◘ Abb. 25.1; The Scientific Commitee for Food 2003b).
Dabei ist wichtig zu bedenken, dass beim einzelnen Kind eine Nährstoffzufuhr unterhalb der alters- und ggf. gewichtsbezogenen Referenzwerte durchaus bedarfsdeckend sein kann. Andererseits können chronische Erkrankungen mit Veränderungen z. B. von Nährstoffresorption, -utilisation, und -metabolisierung beim betroffenen Kind u. U. zu einem deutlich höheren Nährstoffbedarf führen als aus den Referenzwerten abzuleiten ist. Die etablierten Referenzwerte für die Nährstoffzufuhr (◘ Tab. 25.1) können deshalb nur als Orientierung gelten, die für das einzelne Kind ggf. angepasst werden müssen.
| Energie und Nährstoffe | Alter | |||||||
|---|---|---|---|---|---|---|---|---|
| 0–3 Monate | 4–11 Monate | 1–3 Jahre | 4–6 Jahre | 7–9 Jahre | 10–12 Jahre | 13–14 Jahre | 15–18 Jahre | |
| Energie (kcal/kg KG/Tag), m/w | 110 | 95 | 100 | 90 | 75 | 60/55 | 55/45 | 45/40 |
| Protein (g/kg KG/Tag), m/w | 2,0–2,2 | 1,2–1,6 | 1,2 | 1,1 | 1,0 | 1,0 | 1,0 | 0,9/0,8 |
| Fett (% des täglichen Energiebedarfs) | 45–50 | 35–40 | 30–35 | 30–35 | 30–35 | 30–35 | 30–35 | 30–35 |
| Essenzielle Fettsäuren (% des täglichen Energiebedarfs) | 4,5 | 3,8 | 3,5 | 3,5 | 3,5 | 3,5 | 3,5 | 3,5 |
| Kalzium (mg/Tag) | 500 | 500 | 600 | 700 | 800 | 900 | 1000 | 1200 |
| Magnesium (mg/Tag), m/w | 40 | 60 | 80 | 120 | 170 | 230/250 | 310 | 400/350 |
| Eisen (mg/Tag), m/w | 6 | 8 | 8 | 8 | 10 | 12/15 | 12/15 | 12/15 |
| Jod (μg/Tag), m/w | 50 | 80 | 100 | 120 | 140 | 180 | 200 | 200 |
| Zink (mg/Tag) | 5 | 5 | 7 | 10 | 11 | 12 | 15/12 | 15/12 |
| Vitamin A (mg Retinoläquivalent/Tag) | 0,5 | 0,6 | 0,6 | 0,7 | 0,8 | 0,9 | 1,1/1,0 | 1,1/0,9 |
| Vitamin D (μg/Tag) | 10 | 10 | 20 | 20 | 20 | 20 | 20 | 20 |
| Vitamin K (μg/Tag), m/w | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 70/60 |
| Thiamin (mg/Tag), m/w | 0,3 | 0,4 | 0,7 | 1,0 | 1,1 | 1,2 | 1,4/1,2 | 1,6/1,3 |
| Riboflavin (mg/Tag), m/w | 0,3 | 0,5 | 0,8 | 1,1 | 1,2 | 1,4/1,3 | 1,5/1,4 | 1,8/1,7 |
| Niacin (mg Niacinäquivalent/Tag), m/w | 5 | 6 | 9 | 12 | 13 | 15/14 | 17/15 | 20/16 |
| Vitamin B6 (mg/Tag) | 0,3 | 0,6 | 0,9 | 1,2 | 1,4 | 1,6/1,5 | 1,8/1,6 | 2,1/1,8 |
| Folat (Vitamin B9; μg Gesamtfolat/Tag) | 80 | 80 | 120 | 160 | 200 | 240 | 300 | 300–400 |
| Vitamin B12 (μg/Tag) | 0,5 | 0,8 | 1,0 | 1,5 | 1,8 | 2,0 | 3,0 | 3,0 |
| Vitamin C (mg/Tag) | 40 | 50 | 55 | 60 | 65 | 70 | 75 | 75 |
Beachte: Der Bedarf beim individuellen Kind kann u. U. erheblich von diesen Richtwerten abweichen.
m männlich; w weiblich.
Proteine
Die angemessene Zufuhrmenge und -qualität an Nahrungsproteinen sind von entscheidender Bedeutung für Körperwachstum und -funktionen. Eine angemessene Proteinzufuhr deckt den Bedarf aller essenziellen, konditionell essenziellen und für den effektiven Proteinstoffwechsel notwendigen Aminosäuren.
Mit der Nahrung zugeführte Aminosäuren
-
Essenzielle Aminosäuren:
- Isoleucin
- Leucin
- Lysin
- Methionin
- Phenylalanin
- Threonin
- Tryptophan
- Valin
-
Für Früh- und Neugeborene konditionell essenzielle Aminosäuren:
- Histidin
- Tyrosin
- Zystin
-
Nichtessenzielle, aber für eine optimale Metabolisierung von Nahrungsprotein benötigte Aminosäuren:
- Alanin
- Arginin
- Glycin
- Glutaminsäure
- Prolin
-
Nichtessenzielle Aminosäuren:
- Asparaginsäure
- Aspartat
- Glutamin
- Serin
Die biologische Wertigkeit oder nutritionelle Qualität von Nahrungsproteinen hängt in erster Linie davon ab, ob sie alle für die endogene Proteinsynthese benötigten Aminosäuren im erforderlichen Mengenverhältnis bereitstellen. Da die nichtessenziellen Aminosäuren im Organismus aus anderen stickstoffhaltigen Verbindungen gebildet werden können, hängt die Proteinqualität von Gehalt und Muster der enthaltenen essenziellen Aminosäuren ab. Traditionell bestimmt man die biologische Wertigkeit unterschiedlicher Proteine tierexperimentell durch die mit einer bestimmten Proteinzufuhr erzielte Gewichtszunahme („protein efficiency ratio“). Beim Menschen, auch bei Säuglingen und Kindern, lässt sich die biologische Wertigkeit unterschiedlicher Proteine (z. B. der für Säuglingsnahrungen eingesetzten Proteine oder Proteinhydrolysate) durch Bilanzuntersuchungen ermitteln, bei denen über einen definierten Zeitraum (z. B. 72 h) unter gleichbleibenden Ernährungs- und Stoffwechselbedingungen die Eiweißzufuhr sowie die Stickstoffausscheidung mit dem Stuhl und dem Urin gemessen werden. Die Stickstoffretention (oder Stickstoffbilanz) pro Gramm zugeführtes Protein fällt dabei umso positiver aus, je günstiger die Zusammensetzung biologisch verfügbarer Aminosäuren ist.
Die biologische Wertigkeit von Nahrungsproteinen für den Menschen ist im Allgemeinen umso höher, je ähnlicher ihr Aminosäurenmuster der Zusammensetzung des menschlichen Körpereiweißes ist. Besonders hochwertig ist das resorbierbare Protein der menschlichen Muttermilch. Tierisches Protein wie z. B. in Milch oder Fleisch haben eine deutlich höhere biologische Qualität als pflanzliche Proteine. Bei Kombination verschiedener Eiweißquellen in der Ernährung wird die Wertigkeit der Gesamtproteinzufuhr jedoch deutlich erhöht. Beispielsweise haben alle Getreide einen niedrigen Gehalt an Lysin, oft auch an Tryptophan (Mais) oder Threonin (Reis), während sie relativ zum Bedarf zu hohe Anteile anderer Aminosäuren wie Leucin aufweisen. Durch die Kombination mit nur kleinen Mengen tierischen Proteins (z. B. Ei, Fleisch oder Milch) wird eine ausreichende Lysin- und Tryptophanzufuhr erreicht, um die biologische Wertigkeit der Eiweißzufuhr insgesamt deutlich zu verbessern. Auch Leguminosen wie Bohnen und Linsen sind gute Lysinquellen und führen bei gemeinsamem Verzehr mit Getreide zu einer verbesserten Eiweißverwertung.
Für Säuglingsnahrungen wird ein Gehalt an verwertbaren essenziellen Aminosäuren gefordert, der mindestens dem mittleren Gehalt in menschlicher Muttermilch entspricht (Koletzko et al. 2005b). Der Gehalt verwertbarer Aminosäuren kann durch Herstellungsbedingungen von Säuglingsnahrungen und anderen Lebensmitteln, wie z. B. eine Hitzebehandlung, vermindert werden. Hitzeeinwirkung in Gegenwart reduzierender Zucker bei alkalischem pH-Wert fördert die Maillard-Reaktion mit ausgeprägter Verminderung der Lysinverfügbarkeit und Bildung von Polymeren mit brauner Färbung. Auch die Hydrolyse von Proteinen, z. B. zur Herstellung von hypoallergenen Nahrungen, kann je nach Herstellungsbedingungen zu einer unterschiedlichen Minderung der Proteinqualität führen.
Die Referenzwerte für die Nahrungszufuhr (◘ Tab. 25.1) beziehen sich auf Eiweiße mit hoher biologischer Wertigkeit. Der Eiweißgehalt von Nahrungsmitteln wird überwiegend durch die Multiplikation des gemessenen Gesamtstickstoffgehalts mit einem Umrechnungsfaktor von 6,25 berechnet, der auf dem in den meisten Nahrungsproteinen gefundenen Stickstoffgehalt von 16 % beruht.
Eine unzureichende Proteinzufuhr führt zu einer negativen Stickstoffbilanz sowie im Wachstumsalter zu Gedeihstörung, gestörter Proteinsynthese mit Hypoalbuminämie, Ödemneigung, Muskelatrophie und verminderten Konzentrationen von Funktionsproteinen. Dies hat vielfältige Folgen wie z. B. eine erhöhte Infektneigung. Eine überhöhte Proteinzufuhr geht mit einem Anstieg der Harnstoffstickstoffkonzentration und der renalen Molenlast einher. Insbesondere bei jungen Säuglingen mit begrenzter Kapazität zur Urinkonzentration kann ein Wasserdefizit resultieren. Langfristig sind nachteilige Effekte auf die Nierenfunktion zu befürchten.
Kohlenhydrate
Verdaubare Kohlenhydrate sind ein wichtiger Kalorienträger (etwa 4 kcal/g), die in der kindlichen Ernährung meist 40–50 % der zugeführten Energie ausmachen.
Die quantitativ wichtigsten digestiblen Kohlenhydrate in der menschlichen Nahrung – alle mit der grundlegenden chemischen Struktur (CH2O)n – sind:
pflanzliche Stärken,
Glykogen aus tierischen Produkten,
Disaccharide: Saccharose (Kochzucker), Laktose (Milchzucker) und in geringem Maße Maltose (Malzzucker),
Monosaccharide: Fruktose (Fruchtzucker) und Glukose (Traubenzucker)
Mit der Nahrung aufgenommene Stärke (Poly-, Oligo- und Disaccharide) müssen im Gastrointestinaltrakt gespalten werden, bevor sie über die Enterozyten absorbierbar sind. Die Spaltung der Disaccharide in Monosaccharide erfolgt durch spezifische Hydrolasen (Saccharase, Isomaltase, Laktase, Maltase), die im Bürstensaum der Enterozyten im Dünndarm gebunden sind. Nach aktivem Transport der Monosaccharide durch die Enterozyten gelangen die Monosaccharide über die Pfortader in die Leber, wo sie metabolisiert werden.
Störungen der Digestion oder Absorption verursachen osmotische Durchfälle mit sauren Gärungsstühlen. Stuhl ist normalerweise isoosmolar. Unverdauter Zucker im Dickdarm erhöht die osmotische Last, und der Organismus versucht, durch Einstrom von Wasser die Osmolarität wieder auszugleichen. Grob kann damit gerechnet werden, dass jedes Gramm unverdauter Zucker etwa 32 ml Wasser nach sich zieht und damit der Stuhl erheblich in seiner Konsistenz vermindert wird. Gelangen nur geringe Mengen unverdauter Kohlenhydrate in den Dickdarm, werden diese durch die Darmflora metabolisiert. Dabei entstehen verschiedene kurzkettige Fettsäuren, die z. T. wieder resorbiert oder von der Dickdarmschleimhaut metabolisiert werden. Verschiedene Gase (Wasserstoff, Kohlendioxid und Methan) entstehen bei der Verstoffwechselung der Zucker durch die Darmflora. Sie können Bauchschmerzen, Meteorismus und Flatulenz verursachen. Die osmotischen Durchfälle sind besonders ausgeprägt bei Säuglingen, die wegen ihres kurzen Darms mit entsprechend schnellem Transit wenig kompensieren können.
Osmotische Durchfälle können bei Säuglingen rasch zu einer gefährlichen hypertonen Dehydratation und langfristig zu einer Gedeihstörung führen.
Während die Resorption von Glukose und Galaktose bei Gesunden schnell und effektiv erfolgt, geht die Absorption von Fruktose sehr viel langsamer vor sich und unterliegt einer Sättigungskinetik. So verursacht z. B. die Gabe von 15 ml Apfelsaft/kg KG bei den meisten Kindern Durchfall, während eine Menge von 10 ml/kg KG meist noch gut toleriert wird. Bei alleiniger Gabe von Fruktose wird die Absorptionskapazität schneller überschritten, als wenn Fruktose gleichzeitig mit Glukose oder Stärke oder in Form von Saccharose verabreicht wird. Bei der Fruktosemalabsorption handelt es sich selten um einen defekten Transportmechanismus, sondern häufiger um eine individuell niedrige Transportkapazität, die besonders im Kleinkindalter Ursachen von rezidivierenden Durchfällen ( Toddler-Diarrhö), Blähungen und in seltenen Fällen einer Gedeihstörung sein kann. Die autosomal-rezessiv erbliche heriditäre Fruktoseintoleranz führt nach Beginn der Nahrungszufuhr von Fruktose, Saccharose oder Sorbitol, also nach dem Abstillen und der Gabe von Säuglingsnahrungen mit Saccharose (Kochzucker) oder von Beikost mit Saccharose oder Fruktose, zu gastrointestinalen und hepatischen Störungen sowie zu Hypoglykämien (▶ 10.1007/978-3-642-24710-1_6#Sec1; Koletzko u. Koletzko 2006).
Kohlenhydrate sind kein im strengen Sinne unverzichtbarer oder essenzieller Nahrungsbestandteil, denn Energie kann auch aus Aminosäuren und Fetten bereitgestellt und Glukose aus glukoplastischen Aminosäuren gebildet werden. Praktisch ist eine Kohlenhydratzufuhr für eine ausgewogene und gesundheitsförderliche Ernährungsweise jedoch unverzichtbar (Bier et al 1999). Die empfehlenswerte minimale Zufuhr an Nahrungskohlenhydraten lässt sich orientierend aus dem Glukoseverbrauch des zentralen Nervensystems ableiten, welche im Säuglings- und Kleinkindalter besonders hoch ist. Aus epidemiologischen Befunden wird die Empfehlung abgeleitet, ab dem Kleinkindalter eine Gesamtzufuhr an Kohlenhydraten von mindestens 50 % der Energiezufuhr anzustreben, mit bevorzugtem Verzehr von stärkehaltigen und ballaststoffreichen Nahrungsmitteln, um zu einer Vorbeugung von Übergewicht und kardiovaskulären Risiken beizutragen. Gleichzeitig wird eine niedrige Zufuhr von Zuckern (Mono- und Disaccharide) von nicht mehr als etwa 10 % der Energieaufnahme empfohlen, nicht zuletzt da ein hoher Verzehr zuckerreicher Lebensmittel oft die Zufuhr von essenziellen Nährstoffen vermindert.
Nichtverdauliche Kohlenhydrate oder Ballaststoffe sind wichtige Bestandteile der Nahrung, deren mangelnde Zufuhr als ein Risikofaktor in der Pathogenese verschiedener Erkrankungen angesehen wird, darunter Obstipation, Syndrom des irritablen Darms, Dickdarmdivertikulose und Kolonkarzinom. Eine hohe Zufuhr einiger (aber nicht aller) Ballaststoffe wurde mit einer verminderten Prävalenz von Hypercholesterinämie, Diabetes mellitus und koronarer Herzerkrankung in Verbindung gebracht.
Nicht oder schwer verdauliche Kohlenhydrate ( Ballaststoffe) sind eine sehr heterogene Gruppe unterschiedlicher löslicher und nichtlöslicher Substanzen (◘ Abb. 25.2), so dass eine klare Definition nicht einfach ist (ESPGHAN Committee on Nutrition 2003). Gemeinsam ist den nicht oder schwer verdaulichen Kohlenhydraten, dass sie nach Übergang in das Kolon durch bakterielle Fermentation unter Bildung kurzkettiger Fettsäuren abgebaut werden, wobei Acetat, Propionat, Butyrat und Laktat sowie Gase wie Wasserstoff, Kohlendioxid und Methan gebildet werden. Die freigesetzten kurzkettigen Fettsäuren werden von der Kolonmukosa und einigen anderen Geweben als Energieträger genutzt. Man schätzt den hieraus resultierenden biologischen Brennwert nichtverdaulicher Kohlenhydrate auf mindestens 2 kcal/g. Kurzkettige Fettsäuren fördern im Kolon Natrium- und Wasserresorption, intestinale Motilität und epitheliales Wachstum (ESPGHAN Committee on Nutrition 2003).
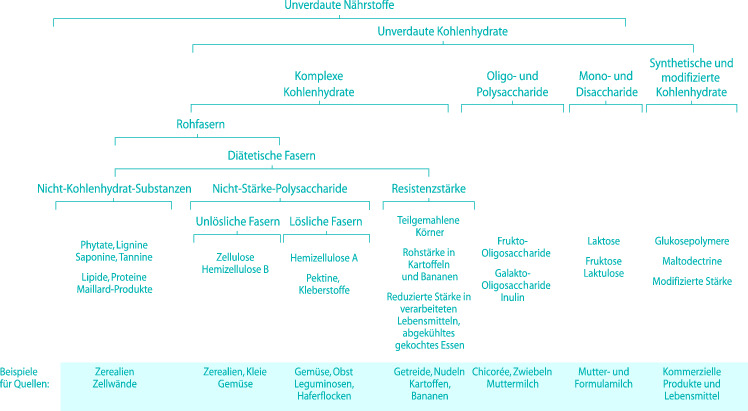
In der Kindernahrung stammt die Hauptmenge an verzehrten nichtverdaulichen Kohlenhydraten aus Getreideprodukten, Leguminosen und Gemüse, ein kleinerer Anteil aus Obst und Fruchtsäften sowie aus Zusätzen in verarbeiteten Nahrungsmitteln wie Dickungsmitteln, Stabilisatoren und Fettersatzstoffen. Vollkornmehle (Ausmahlungsgrad von mindestens 98 %) und daraus hergestellte Nahrungsmittel enthalten die äußeren Schichten des Getreidekorns, die eine ausgezeichnete Quelle nichtdigestibler Kohlenhydrate darstellen. Dagegen sind hellere Mehle mit einem Ausmahlungsgrad von nur 50–80 % und die aus ihnen hergestellten Lebensmittel viel ärmer an Ballaststoffen. Der Verzehr von Vollkornprodukten, die eine ausgezeichnete Ballaststoffquelle darstellen, sollte deshalb auch bei Kindern gefördert werden.
In jüngerer Zeit werden nichtverdauliche Kohlenhydrate als Präbiotika zahlreichen Lebensmitteln zugesetzt, insbesondere Milchprodukten und Getränken, aber auch Säuglingsnahrungen und Beikostprodukten. Unter Präbiotika versteht man nichtverdauliche Nahrungsmittelbestandteile, die nach dem Verzehr im Kolon selektiv das Wachstum und/oder die Aktivität einer oder weniger Bakterienstämme fördern und hierdurch die Gesundheit des Konsumenten fördern (ESPGHAN Committee on Nutrition 2004).
Die optimale Zufuhrmenge an nichtdigestiblen Kohlenhydraten lässt sich derzeit nicht genau definieren, aber pragmatisch wurde für Kinder eine Ballaststoffzufuhr in Gramm entsprechend dem Lebensalter in Jahren plus 5 empfohlen (d. h. mit 5 Jahren 10 g/Tag, mit 10 Jahren 15 g/Tag). Allgemeine Zufuhrempfehlungen für Kohlenhydrate sind ◘ Tab. 25.2 zu entnehmen.
| Altersstufe | Glukoseverbrauch des ZNS (mg/kg KG/min) | Mindestzufuhr an Kohlenhydraten (g/kg KG/Tag) | Typisches Körpergewicht (kg) | Angemessene Mindestzufuhr an Kohlenhydraten (g/Tag) |
|---|---|---|---|---|
| Neugeborene | 8,0 | 11,5 | 3,5 | 40 |
| 1 Jahr | 7,0 | 10,1 | 10 | 10 |
| 5 Jahre | 4,7 | 6,8 | 20 | 135 |
| Jugendliche | 1,9 | 2,7 | 60 | 160 |
| Erwachsene | 1,0 | 1,4 | 70 | 100 |
Lipide
Lipide haben mit 9 kcal/g einen 2,3-fach höheren Energiegehalt als Kohlenhydrate und Proteine und machen bei vielen europäischen Kindern den Hauptteil der Energiezufuhr mit der Nahrung aus. Zudem dienen sie als der quantitativ wichtigste Energiespeicher des menschlichen Organismus. Entsprechend wirken sich Zufuhr, Digestion, Absorption und metabolische Utilisation von Lipiden direkt auf Wachstum, Körperzusammensetzung, Gesundheit und Wohlbefinden aus. Menge und qualitative Zusammensetzung der Nahrungsfette haben Auswirkungen auf zahlreiche biologische Funktionen wie z. B. Immunfunktion, Lipoproteinstoffwechsel und kardiovaskuläre Gesundheit.
Zusammensetzung
Der quantitativ überwiegende Teil der Nahrungsfette wird von Fettsäuren beigetragen, insbesondere in Triacylglycerolen (Triglyceriden), aber auch in anderen veresterten Lipiden wie z. B. Di- und Monoacylglycerole, Phospholipide, Cholesterinester und Phytosterinester. Nach ihrer Kettenlänge werden kurzkettige (<8 Kohlenstoffatome), mittelkettige (8–11 Kohlenstoffatome), intermediärkettige (12–15 Kohlenstoffatome) und langkettige (≥16 Kohlenstoffatome) Fettsäuren unterschieden. Doppelbindungen bestimmen zudem die Eigenschaften von Fettsäuren durch ihre Zahl (gesättigt: ohne Doppelbindung; einfach oder mehrfach ungesättigt), Position (z. B. Doppelbindungen in Omega-3- und Omgea-6-Position bei den essenziellen Fettsäuren) und Konfiguration (cis- oder trans-Fettsäuren).
Mittelkettige Triacylglycerole (MCT) werden zur Behandlung unterschiedlicher Formen der Fettmalassimilation eingesetzt, weil sie stärker wasserlöslich sind als die in der Nahrung überwiegenden langkettigen Triacylglycerole (LCT) und rascher durch Lipasen gespalten werden. Allerdings ist aufgrund der kürzeren Kettenlängen der enthaltenen Fettsäuren der Energiegehalt von MCT pro Gramm um etwa 16 % geringer als derjenige von LCT. Darüber hinaus haben die sehr rasch oxidierten MCT einen höheren thermogenetischen, also wärmeproduzierenden Effekt. In Studien mit Frühgeborenen zeigte der Ersatz von LCT durch MCT in der Nahrung zwar eine Erhöhung der prozentualen Fettresorption, aber keinen Vorteil für Energieaufnahme und Wachstum. Ein therapeutischer Vorteil des Einsatzes von MCT-Ölen ist jedoch bei schweren Formen der Fettmalabsorption zu erwarten, z. B. bei Kindern mit schwerer Cholestase.
Säuglinge und Kleinkinder brauchen durch ihr rasches Wachstum vergleichsweise große Mengen an essenziellen, mehrfach ungesättigten Fettsäuren („polyunsaturated fatty acids“), die unverzichtbare Bestandteile der Strukturlipide in allen biologischen Membranen sind. Die Verfügbarkeit dieser Fettsäuren während des prä- und postnatalen Wachstumsspurts des Gehirns war in vielen Studien mit der funktionellen Entwicklung des Nervengewebes verbunden. Einige langkettige Polyenfettsäuren wirken sich auch auf immunologische Funktionen aus und können die pro- und antiinflammatorische Balance beeinflussen.
Energiebilanz
Aufgrund der hohen Energiedichte von Fetten weist eine Ernährung mit hohem Fettgehalt in der Regel eine höhere Energiedichte (kcal/100 g) auf als fettärmere Diäten. Zusätzlich kann eine hohe Fettzufuhr die Körperfettdeposition fördern. Die Speicherung von Nahrungsfetten als Körperfett ist leicht und mit nur geringem Energieaufwand entsprechend etwa 1–4 % der zugeführten Fettmenge möglich. Nahrungskohlenhydrate können als Substrat für die Synthese im Körper deponierter Fette dienen, aber die Aktivität der endogenen De-novo-Lipogenese ist beim Menschen begrenzt. Darüber hinaus ist die Bildung von Fett aus Kohlenhydraten energetisch aufwendig und verbraucht etwa ein Viertel der mit den Kohlenhydraten zugeführten Energie.
Praktisch ergeben sich aus diesen physiologischen Bedingungen wichtige Vorteile fettreicher Diäten für Kinder mit Gedeihstörung und Untergewicht. Fett transportiert auch Geschmack und Aroma und trägt zu einem angenehmen Mundgefühl bei, so dass eine gewisse Menge an Fett in der Nahrung den Nahrungsverzehr zusätzlich fördern kann.
Andererseits ist ein hoher Fettgehalt der Nahrung ein wichtiger Risikofaktor für die Entwicklung von Adipositas. Auch bei Kindern und Jugendlichen ist eine fettreiche Ernährungsweise mit höherem Körpergewicht, höherem Körperfettgehalt und höherer Prävalenz von Präadipositas und Adipositas assoziiert. In der Nahrung deutscher Schulkinder machen Fette im Durchschnitt einen hohen Anteil von etwa 40 % der insgesamt aufgenommenen Kalorien aus. Diese hohe Fettmenge kommt nicht nur durch die sichtbaren Nahrungsfette (z. B. Butter, Margarine, Öl), sondern ganz wesentlich auch durch auf den ersten Blick nicht sichtbare, sog. versteckte Fette zustande (z. B. in Salami, Leberwurst, fetten Käsesorten). Damit liegt der Fettverzehr oft sehr deutlich über dem empfohlenen Fettgehalt in der Nahrung von Vorschul- und Schulkindern von etwa 30–35 % der Kalorienzufuhr.
Vitamine und Spurenelemente
Vitamine sind für die Erhaltung der Gesundheit und der physiologischen Funktionen erforderlich, aber im Stoffwechsel nicht oder aber nicht in ausreichender Menge synthetisierte Verbindungen. Vitamine stellen daher essenzielle bzw. konditionell essenzielle Substrate dar, die regelmäßig zugeführt werden müssen.
Wasserlösliche Vitamine dienen vor allem als Kofaktoren biochemischer Reaktionen. Sie werden im Körper nur in begrenztem Umfang gespeichert und bei überschüssiger Zufuhr mit dem Urin ausgeschieden. Eine erhöhte Aufnahme ruft in aller Regel keine krankhaften Veränderungen hervor. Dennoch ist die längerfristige Gabe sehr hoch dosierter Präparate wasserlöslicher Vitamine bei Gesunden nicht zu empfehlen, da unerwünschte Wirkungen, z. B. auf Stoffwechselvorgänge, diskutiert werden und ein Nutzen nicht erkennbar ist.
Die lipidlöslichen Vitamine A, D, E und K werden bei exzessiver Zufuhr im Organismus gespeichert und können im Fall der Vitamine A und D zu Hypervitaminosen führen. Referenzwerte für die tägliche Vitaminzufuhr sind in ◘ Tab. 25.1 und ◘ Tab. 25.3 dargestellt. Auch bei gesunden, abwechslungsreich ernährten Kindern und Jugendlichen in Deutschland wird die erwünschte Vitaminzufuhr nicht immer erreicht, insbesondere die Zufuhr von Folaten und Vitamin D liegt sehr häufig unterhalb der als wünschenswert angesehenen Bereiche (Ernährungskommission 2011; Hermoso et al. 2011). Deshalb wird auch für Deutschland die Folsäuresupplementierung von Grundnahrungsmitteln wie z. B. Mehl, Brot und Backwaren sowie von Speisesalz für wünschenswert gehalten.
| Vitamine | Dosierung bei Fettmalabsorption | Dosierung bei schwerer Cholestase | Plasmakontrollen |
|---|---|---|---|
| Vitamin A | 5000 IE/Tag | 5000–12.000 IE/Tag | Vitamin-A-Spiegel (Norm: 300–500 μg/l), RBP |
| Vitamin D | 500 IE Vitamin D3/Tag | 5–7 μg 25-Hydroxy-Vitamin D/kg KG/Tag | 25-Hydroxy-Vitamin-D-Spiegel (Norm: 25–30 μg/l) |
| Vitamin E | 5–10 IE/kg KG/Tag | 150–400 IE/kg KG/Tag | Vitamin-E-Spiegel (>5 mg/l), Vitamin E/Cholesterin (>1 mg/g) |
| Vitamin K | Einmal 5 mg/Woche | 5–15 mg/Tag | Quick-Wert, Konzentrationen Vitamin-K-abhängiger Gerinnungsfaktoren |
RBP Konzentration des retinolbindenden Proteins.
Spurenelemente wie Eisen, Zink und Jod (◘ Tab. 25.1) finden sich in menschlichen Geweben zwar nur in geringen, aber zwischen einzelnen Individuen vergleichbar hohen Konzentrationen. Sie haben überwiegend Funktionen als Kofaktoren von Proteinen und Enzymen, und ihr Entzug führt reproduzierbar zu Mangelerscheinungen.
Eisen dient zur Sauerstoff- und Elektronenübertragung in Hämoglobin, Myoglobin und vielen Enzymen. Während des raschen Körperwachstums in den ersten beiden Lebensjahren und in der Pubertät sowie bei starken Blutverlusten (z. B. starke Menstruation, chronische Darmblutungen) reicht die Eisenzufuhr mit der Nahrung oft nicht zur Deckung des Bedarfs aus. Eisen findet sich in nahezu vergleichbar hohen Konzentrationen in Fleischwaren und in vielen pflanzlichen Nahrungsmitteln wie dunklen Gemüsesorten, jedoch ist die Resorption im proximalen Dünndarm aus Fleisch deutlich besser. Pflanzliche Nahrungsmittel enthalten zahlreiche Liganden, welche die Eisenresorption hemmen, so dass aus pflanzlicher Nahrung kaum mehr als 5 % des Eisens resorbiert werden. Im Gegensatz dazu liegt die Aufnahme von Hämeisen aus Fleisch, welche nicht wesentlich durch Chelate der Nahrung behindert wird, bei >20 %.
Menschliche Milch enthält etwa 0,2–0,3 mg Eisen/l, das im Mittel zu etwa 20 % absorbiert wird, d. h. ein mit täglich 750 ml Muttermilch voll gestilltes Kind absorbiert etwa 0,03–0,05 mg Eisen pro Tag. Der Eisenbedarf für das Wachstum ist höher und wird bis etwa gegen Ende des ersten Lebenshalbjahres zusätzlich durch die Utilisation der bei der Geburt angelegten Eisenspeicher gedeckt. Spätestens ab dem 7. Lebensmonat benötigt ein Säugling eine zusätzliche Eisenquelle. Die zugefütterte Beikost soll ausreichende Mengen gut resorbierbaren Eisens enthalten, günstig ist die Fütterung von Beikost mit Fleisch 2- bis 3-mal wöchentlich. Säuglingsmilchnahrungen enthielten in der Vergangenheit deutlich höhere Eisenkonzentrationen als Muttermilch. Diese höheren Eisenkonzentrationen wurden unter der Annahme einer wesentlich schlechteren Eisenresorption gewählt, wie sie in vor mehr als 2 Jahrzehnten durchgeführten Studien berichtet wurden. Diese Studien weisen jedoch erhebliche methodische Probleme auf und untersuchten z. T. die Eisenresorption nicht aus modernen Säuglingsnahrungen, sondern aus häuslichen Kuhmilchzubereitungen. Jüngere Studien zeigen dagegen eine Eisenresorption sowohl aus Muttermilch als auch aus Säuglingsnahrungen von etwa 15–20 %, d. h. es besteht kein erheblicher Unterschied in der Bioverfügbarkeit. Aktuelle klinische Studien bei Säuglingen belegen zudem, dass die Fütterung mit Säuglingsnahrungen mit einem Eisengehalt zwischen 0,3 und 1,9 mg/100 kcal nicht zu Unterschieden in der Häufigkeit des Auftretens einer Eisenmangelanämie führt (Koletzko et al. 2005b). Aktuell wird deshalb für Säuglingsnahrungen ein Eisengehalt von 0,3–1,3 mg/100 kcal empfohlen (Koletzko et al. 2005b).
Etwa 70 % des im Körper enthaltenen Zinks finden sich in Knochen, Haut und Haaren. Zink wirkt als Bestandteil oder Kofaktor zahlreicher Enzyme, Hormone und Rezeptoren sowie bei der Insulinspeicherung und der Regulation von Immunfunktionen. Zink wird mit vielen pflanzlichen (Vollkorngetreide) und vor allem tierischen Nahrungsmitteln (Fleisch, Ei, Milch, Käse) in relativ hohen Konzentrationen zugeführt, aber auch hier ist die Absorption aus tierischen Nahrungsmitteln deutlich besser als z. B. aus Getreideprodukten. Die Zinkversorgung ist nicht leicht einzuschätzen, da die Messung der Zinkkonzentration im Serum die Versorgung nicht sehr zuverlässig reflektiert.
Jod wird aus der Nahrung fast vollständig absorbiert und zu einem hohen Anteil in die Schilddrüse aufgenommen, wo es in die Schilddrüsenhormone inkorporiert wird. Deutschland gehört zu den Jodmangelgebieten mit einer über die natürliche Ernährung unzureichenden Versorgung, so dass die konsequente Verwendung von jodangereichertem Speisesalz und mit solchem Salz hergestellten Nahrungsmitteln (z. B. Brot und Backwaren) unbedingt sinnvoll ist.
Literatur
- Atkinson SA, Koletzko B. Determining life stage groups and extrapolating nutrient intake values. Food Nutr Bull. 2007;28(I):61–71. doi: 10.1177/15648265070281S107. [DOI] [PubMed] [Google Scholar]
- Bier DM, Brosnan JT, Flatt JP, et al. Report of the IDECG Working Group on lower and upper limits of carbohydrate and fat intake. International Dietary Energy Consultative Group. Eur J Clin Nutr. 1999;53(1):177–178. doi: 10.1038/sj.ejcn.1600759. [DOI] [PubMed] [Google Scholar]
- Deutsche Gesellschaft für Ernährung. Österreichische Gesellschaft für Ernährung. Schweizerische Gesellschaft für Ernährungsforschung . Referenzwerte für die Nährstoffzufuhr. Frankfurt/Main: Umschau Braus; 2001. [Google Scholar]
- Ernährungskommssion der Deutschen Gesellschaft für Kinder- und Jugendmedizin. Böhles HJ, Fusch C, Genzel-Boroviczény O, et al. Vitamin D-Versorgung im Säuglings-, Kinder- und Jugendalter. Monatsschr Kinderheilk. 2011;159:766–774. doi: 10.1007/s00112-011-2483-6. [DOI] [Google Scholar]
- ESPGHAN Committee on Nutrition: . Aggett P, Haschke F, Bresson J, et al. Recommended Dietary Allowances (RDAs), Recommended Dietary Intakes (RDIs), Recommended Nutrient Intakes (RNIs), and Population Reference Intakes (PRIs) are not „Recommended Intakes“. J Pediatr Gastroenterol Nutr. 1997;25:236–241. doi: 10.1097/00005176-199708000-00022. [DOI] [PubMed] [Google Scholar]
- ESPGHAN Committee on Nutrition: . Aggett P, Axelsson I, Agostoni C, et al. Non-digestible carbohydrates in the diets of infants and young children. A commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2003;36:329–337. doi: 10.1097/00005176-200303000-00006. [DOI] [PubMed] [Google Scholar]
- ESPGHAN Committee on Nutrition: . Agostoni C, Goulet O, Axelsson I, et al. Prebiotic oligosaccharides in dietetic products for infants. A commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2004;39:465–473. doi: 10.1097/00005176-200411000-00003. [DOI] [PubMed] [Google Scholar]
- Hermoso M, Vollhardt Bergmann K, Koletzko B. Critical micronutrients in pregnancy, lactation, and infancy: considerations on vitamin D, folic acid, and iron, and priorities for future research. Ann Nutr Metab. 2011;59:5–9. doi: 10.1159/000332062. [DOI] [PubMed] [Google Scholar]
- Institute of Medicine of the National Academies . Dietary reference intakes for energy, carbohydrate, fibre, fat, fatty acids, cholesterol, protein, and amino acids. Washington: The National Academies Press; 2003. pp. 1–936. [Google Scholar]
- Koletzko B. Langzeiteffekte der Substratzufuhr im frühen Kindesalter. Akt Onkol. 2000;17:29–48. [Google Scholar]
- Koletzko B, Hermoso M, et al. Reference nutrient intakes for infants, children and adolescents. In: Koletzko B, Cooper P, Garza C, et al., editors. Children’s nutrition – a practical reference guide. Basel: Karger; 2008. pp. 285–292. [Google Scholar]
- Koletzko B, Toschke AM, von Kries R. Herausforderungen bei der Charakterisierung und der Verbesserung der Ernährungssituation im Kindes- und Jugendalter. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz. 2004;47:227–234. doi: 10.1007/s00103-003-0797-9. [DOI] [PubMed] [Google Scholar]
- Koletzko B, Akerblom H, Dodds PF, Ashwell M, editors. Early nutrition and its later consequences: New opportunities. New York: Springer; 2005. pp. 10–19. [Google Scholar]
- Koletzko B, Baker S, Cleghorn G, et al. Global standard for the composition of infant formula. Recommendations of an ESPGHAN coordinated International Expert Group. J Pediatr Gastroenterol Nutr. 2005;41:584–599. doi: 10.1097/01.mpg.0000187817.38836.42. [DOI] [PubMed] [Google Scholar]
- Koletzko B, Symonds ME, Olsen SF, The Early Nutrition Programming project and The Early Nutrition Academy Programming research: where are we and where do we go from here? Am J Clin Nutr. 2011;94(6 ):2036S–2043S. doi: 10.3945/ajcn.111.018903. [DOI] [PubMed] [Google Scholar]
- Koletzko S, Koletzko B. Wenn Zucker krank machen – Maldigestion und metabolische Unverträglichkeiten. Akt Ernährungsmed. 2006;31(1):68–75. doi: 10.1055/s-2005-915400. [DOI] [Google Scholar]
- The Scientific Committee for Food . Nutrient and energy intakes for the European Community (Opinion expressed on 11 December 1992). Reports of the Scientific Committee for Food, 31st series. Luxembourg: Office for Official Publications of the European Communities; 1993. pp. 1–248. [Google Scholar]
- The Scientific Committee for Food (2003a) Minutes’ statement of the Scientific Committee on Food addressing the limitations of extrapolating tolerable upper intake levels of nutrients for children (expressed on 4 April 2003). SCF/CS/NUT/IF/65 Final. Annex XIV, Minutes of the 137th Plenary Meeting of The Scientific Committee on Food held on 2/3/4 April 2003 in Brussels. SCF/CS/PLEN/MINS 137: 14; http://ec.europa.eu.int/comm/food/fs/sc/scf/out198_en.pdf. Zugegriffen 04 Juni 2012
- The Scientific Committee for Food (2003b) Opinion of the Scientific Committee for Food on the revision of reference values for nutrition labeling (expressed on March 5). SCF/CS/NUT/GEN 18; http://ec.europa.eu.int/comm/food/fs/sc/scf/out171_en.pdf. Zugegriffen 04 Juni 2012


