Abstract
Die rasante Entwicklung der Molekularbiologie und eine inzwischen beachtliche Fülle an Daten aus klinischen Studien haben in der vergangenen Dekade eine neue solide wissenschaftliche Basis für den Einsatz probiotischer Bakterien, speziell von Laktobazillen und Bifidobakterien ergeben. Entgegen manchen Postulierungen existiert jedoch ganz offenkundig sowohl in experimentellen als auch in klinischen Studien eine strenge Stammspezifik von Funktionen und Wirkungen dieser Spezies probiotischer Bakterien. Eine wissenschaftliche Rationale für die Nutzung von Laktobazillen und Bifidobakterien als Probiotika ist bisher nur für vergleichsweise wenige Stämme nachgewiesen worden. Dies gilt für lebende und hitzebehandelte Bakterien gleichermaßen, ob mit oder ohne Mitverwendung ihres Kulturüberstands in den Studienansätzen.
Probiotika
Grundlagen der intestinalen Mikroökologie
Die rasante Entwicklung der Molekularbiologie und eine inzwischen beachtliche Fülle an Daten aus klinischen Studien haben in der vergangenen Dekade eine neue solide wissenschaftliche Basis für den Einsatz probiotischer Bakterien, speziell von Laktobazillen und Bifidobakterien ergeben. Entgegen manchen Postulierungen existiert jedoch ganz offenkundig sowohl in experimentellen als auch in klinischen Studien eine strenge Stammspezifik von Funktionen und Wirkungen dieser Spezies probiotischer Bakterien. Eine wissenschaftliche Rationale für die Nutzung von Laktobazillen und Bifidobakterien als Probiotika ist bisher nur für vergleichsweise wenige Stämme nachgewiesen worden. Dies gilt für lebende und hitzebehandelte Bakterien gleichermaßen, ob mit oder ohne Mitverwendung ihres Kulturüberstands in den Studienansätzen.
Die Ursprünge der heutigen Probiotikaforschung gehen auf den Nobelpreisträger E. Metschnikoff zurück, der 1908 den in fermentierten Milchprodukten enthaltenen Mikroorganismen eine lebensverlängernde Wirkung zusprach. Im Jahre 1965 führten Lilley und Stillwell den Terminus technicus „probiotic“ quasi als Antonym für „antibiotic“ ein. Fuller definierte Probiotika 1989 als lebende mikrobielle Nahrungszusätze mit nutzbringenden Effekten für den Wirtsorganismus durch Verbesserung seiner intestinalen mikrobiellen Balance. Diese Definition ist jüngst durch eine gemeinsame Expertenkonsultation von FAO (Food and Agriculture Organization) und WHO im Wesentlichen bestätigt worden.
Im Gastroenteron des Menschen, ganz überwiegend im Kolon, besteht eine Symbiose des Makroorganismus mit über 500 Bakterienarten. Die im menschlichen Gastrointestinaltrakt kolonisierenden Bakterien repräsentieren ein heterogenes mikrobielles Ökosystem aus etwa 1014 überwiegend (zu etwa 99 %) obligat anaeroben Bakterien, von denen bis dato nur 20–40 % kultiviert und/oder charakterisiert werden konnten. Die vorherrschenden Spezies und ihre quantitativen Veränderungen in unterschiedlichen Lebensabschnitten sind in ◘ Tab. 30.1 dargestellt.
| Bakteriengattung | 1. Lebenswoche | 6.–12. Lebenswoche | Erwachsenen- alter |
||
|---|---|---|---|---|---|
| Ausschließliches Stillen | Gabe von Formelnahrung | Ausschließliches Stillen | Gabe von Formelnahrung | ||
| Bifidobakterien | 8,3 | 8,0 | 9,1 | 9,1 | 10,2 |
| Laktobazillen | 7,9 | 6,6 | 7,3 | 7,9 | 9,6 |
| Bacteroides spp. | 7,1 | 7,8 | 8,3 | 8,4 | 11,3 |
| Clostridien | 6,1 | 6,1 | 5,6 | 6,5 | 9,8 |
| Koliforme Bakterien | 8,6 | 8,3 | 9,2 | 9,1 | 8,6 |
| Streptokokken | 6,5 | 8,0 | 7,1 | 8,9 | 8,9 |
Die postnatale bakterielle Besiedlung des normalerweise sterilen Darms Neugeborener beginnt in den ersten Lebenstagen, wobei die Flora der Geburtswege, des Darms und der Haut der Mutter bei einer normalen Geburt die dominierenden Bakterienquellen darstellen. Unter den Bedingungen der Muttermilchernährung entwickelt sich im Darm gesunder Säuglinge eine vergleichsweise stabile Flora mit Dominanz von Bifidobakterien (◘ Abb. 30.1, ◘ Abb. 30.2).

Im Säuglingsdarm dominierende, vorwiegend anaerobe Bakteriengattungen und -spezies
Fakultativ anaerobe Bakterien:
Escherichia coli
-
Staphylokokken:
- Staphylococcus aureus
- Staphylococcus epidermidis
-
Streptokokken:
- Streptococcus faecalis
- Streptococcus faecium
Enterobacter cloacae
Klebsiella pneumoniae
Proteus mirabilis
Citrobacter freundii
Pseudomonas aeruginosa
Obligat anaerobe Bakterien:
-
Bifidobakterien:
- Bifidobacterium breve
- Bifidobacterium longum
- Bifidobacterium adolescentis
- Bifidobacterium bifidum
- Bifidobacterium infantis
-
Bacteroides spp. :
- Bacteroides fragilis
- Bacteroides distansonis
- Bacteroides vulgatus
- Bacteroides ovatus
- Bacteroides theatiotaomicron
- Bacteroides uniformis
-
Clostridien :
- Clostridium perfringens
- Clostridium difficile
- Clostridium butyricum
- Clostridium tertium
- Clostridium paraputrificum
-
Laktobazillen :
- Lactobacillus acidophilus
- Lactobacillus fermentum
- Lactobacillus salivarius
- Lactobacillus plantarum
-
Eubacterium spp. :
- Eubacterium aerofaciens
- Eubacterium lentum
- Eubacterium rectale
Veillonellae parvula
Peptococcus saccharolyticus
-
Peptostreptokokken :
- Peptostreptococcus productus
- Peptostreptococcus anaerobius
Durch Nahrungs- und andere exogene Einflüsse (medizinische Interventionen, Antibiotikabehandlungen und andere) können Aufbau und Bestand eines natürlichen mikrobiellen Ökosystems im Darm nachhaltig beeinflusst werden.
Probiotika und ihre Eigenschaften
Hinsichtlich ihrer für den Wirtsorganismus nutzbringenden Eigenschaften und der potenziellen Anwendung als Probiotika wurden Laktobazillen und Bifidobakterien am intensivsten untersucht. Im Mittelpunkt tierexperimenteller Studien standen vor allem antimikrobielle Wirkmechanismen von Probiotika als Teil des gastrointestinalen Abwehrökosystems des Wirtsorganismus. Für die hierzu notwendige Differenzierung zwischen kommensalen und enterovirulenten Mikroorganismen scheinen auf Mukosaebene sog. pathogenassoziierte und auf Ebene der endogenen Bakterienspezies sog. mikrobenassoziierte Molekularstrukturen zu fungieren. Unter klinischen Gesichtspunkten sind antimikrobielle Funktionen von Probiotika interessant, da mikrobiell ausgelöste und/oder unterhaltene Inflammationen die Majorität gastrointestinal ablaufender pathologischer Prozesse und Krankheiten darstellen.
Unspezifische antimikrobielle Mechanismen
Die bislang beschriebenen antimikrobiellen Mechanismen von Probiotika sind zwar heterogen und zumindest z. T. hypothetisch. Dennoch konnten in den vergangenen Jahren zunächst nur vermutete antimikrobielle Wirkungen in Studien verifiziert werden: Während die Produktion von H2O2 durch Lactobacillus spp. einen wichtigen unspezifischen Abwehrmechanismus in den Geburtswegen repräsentiert, trifft dies für die Produktion kurzkettiger Fettsäuren (Essigsäure, Milchsäure, Buttersäure) aus Laktose und Oligosacchariden für das Enteron zu. Die Folge ist eine signifikante luminale pH-Wert-Absenkung, ein offenkundig dominierender (unspezifischer) Wettbewerbsfaktor von Probiotika in der Auseinandersetzung mit anderen intestinal kolonisierenden Mikroorganismen. So konnte kürzlich gezeigt werden, dass die Wirkstoffe eines zellfreien Kulturüberstandes von Lactobacillus casei subsp. rhamnosus in der Lage sind, das Wachstum folgender humanpathogener Bakterien zu inhibieren: enterotoxische und enteropathogene Escherichia coli (ETEC und EPEC), Klebsiella pneumoniae, Shigella flexneri, Salmonella typhimurium, Enterobacter cloacae, Pseudomonas aeruginosa, Enterococcus faecalis, Clostridium difficile.
Entwicklung und Modulation des angeborenen Immunsystems
Experimentelle Daten aus Grundlagenstudien lassen den Schluss zu, dass Entwicklung und Funktion des innaten mukosalen und systemischen Immunsystems durch die intestinale Mikrobiota ganz entscheidend geprägt werden.
Neben der Synthese sog. Biosurfactants durch Probiotika sind es insbesondere die immunmodulatorischen Funktionen von Probiotika, die eine große Bedeutung für die Entwicklung des menschlichen Immunsystems haben. Dabei scheinen folgende Prozesse entscheidend zu sein: Probiotika bewirken ein sog. Priming immunologischer Abwehrmechanismen. Jüngste Forschungen konzentrieren sich auf die Wechselbeziehungen zwischen der wirtseigenen Immunantwort und verschiedenen Komponenten des autochthonen intestinalen Mikrosystems, insbesondere Laktobazillen und Bifidobakterien. Es werden derzeit bidirektionale Kommunikationsprozesse zwischen dem lymphoepithelialen System der Mukosa und der Mikroflora durch chemische Botenstoffe (Zytokine, Wachstumsfaktoren, Gewebehormone, Metaboliten des Arachidonsäurestoffwechsels) postuliert, deren Störung nachweisbar mit einer verminderten mukosalen Abwehrfunktion und der Induktion inflammatorischer Prozesse einhergeht. Auch diese Prozesse sind streng spezies- bzw. stammspezifisch; ein entsprechender, wissenschaftlich anerkannter und reproduzierbarer Nachweis ist eine Conditio sine qua non.
Für die Erklärung der Auslösung und Unterhaltung einer zwischen der Mikroflora und dem mukosalen Abwehrsystem „abgestimmten“ Immunantwort werden derzeit folgende Modelle diskutiert:
Die Kolonisation des Gastroenterons mit kommensalen Bakterien in der frühen Neonatalperiode aktiviert in einem selbstinduzierenden Prozess bakterielle Sensoren mit subsequenter Aktivierung angeborener mukosaler Immunfunktionen. Dieser Prozess ist temporär und wird vom Wachstum des Wirts stark beeinflusst: „Self-non-self-Modell“ – propagiert von dem Mikrobiologen F. M. Burnet –, das die Aktivierung antigenspezifischer, als „non-self“ erkannter Immunzellen („single cells“) postuliert.
Das Janeway-Modell setzt für die Immunantwort die Stimulation antigenpräsentierender Zellen voraus, die pathogene und kommensale Mikroorganismen über spezielle Molekülstrukturen (pathogenassoziierte Molekularstrukturen, s. oben) erkennen und damit zwischen „infectious non-self“ und „non-infectious self“ differenzieren können.
Die Präsenz der kommensalen Mikrobiota begünstigt die Schutzfunktion der intestinalen Mukosabarriere gegenüber potenziellen pathogenen Bakterien, stimuliert die Anzahl aktivierter T-Zellen in den mesenterialen Lymphknoten und fördert die Expansion systemischer B-Zellen – auf diese Weise wird neben der zellulären auch die Entwicklung der humoralen Immunität gestützt.
Der Kolonisationsprozess der kommensalen Mikrobiota führt letztlich zu einem Switch vom fetalen Th2- zum Th1/Th17-Status, was einer Invasion potenziell pathogener Mikroorganismen vorbeugt: Danger-Modell von Matzinger, welches eine sog. Überwacherfunktion durch antigenpräsentierende und dendritische Zellen postuliert, welche nicht nur zwischen fremd und nichtfremd unterscheiden können, sondern mit Hilfe spezieller Rezeptoren („Toll-like receptors“) bereits auf Gefahrensignale („danger signals“) reagieren, die von untergehenden Wirtszellen generiert werden.
Hohe Validität für das Verständnis antimikrobieller Wirkungen probiotischer Bakterien kommen Ergebnissen aus sorgfältig geplanten experimentellen Studien mit definierten Laktobazillen- und Bifidobakterienstämmen zu, in denen gegen gastrointestinale mikrobielle Pathogene gerichtete Eigenschaften und Funktionen nachgewiesen wurden:
Ädhäsion: Das Anhaften von Probiotika an Enterozyten und/oder Mukus ist stammspezifisch und schließt aktive (z. B. Sekretion proteaseresistenter Adhäsionsmoleküle) und passive Prozesse (elektrostatische Interaktionen, autoaggregative und hydrophobische sterische Kräfte, Lipoteichoinsäure, Lektinanhängsel etc.) ein.
Interferenz/Inhibition: Einige Laktobazillusstämme und Bifidobakterien können offensichtlich dosisabhängig die Adhärenz pathogener Bakterien (ETEC, EPEC und andere) an die Bürstensaummembran inhibieren, und gut definierte Laktobazillen- und Bifidobakterienstämme konkurrieren mit pathogenen Bakterien um Bindungsstellen an der Mukosa und inhibieren deren Invasion in die Schleimhaut. Da Laktobazillen und Bifidobakterien keine vergleichbaren adhäsiven Oberflächenstrukturen besitzen wie pathogene Bakterien, wird postuliert, dass sie sterische Veränderungen an Enterozytenrezeptoren induzieren, welche die Adhärenz von pathogenen Mikroorganismen verhindern.
Persistenz im Intestinum: In Untersuchungen mit gnotobiotischen Mäusen wurde die Kolonisation verschiedener Laktobazillen und Bifidobakterien in Jejunum und Ileum der Tiere belegt. Der aus dem Stuhl von Säuglingen isolierte Stamm Bifidobacterium adolescentis konnte bis zu 5 Tage nach letztmaliger gastraler Applikation in den Fäzes von Mäusen nachgewiesen werden.
Interaktionen mit Peyer-Plaques: Die Peyer-Plaques sind in initiale Prozesse der mukosalen Immunantwort involviert. Versuche unter Nutzung von Laktobazillen als Vektoren für Vakzine konnten zeigen, dass diese intensiv mit den Peyer-Plaques interagieren.
Antagonistische Wirkungen gegen definierte enterovirulente Mikroorganismen
Vor allem tierexperimentell, aber auch in einigen klinischen Studien konnten in den vergangenen Jahren antagonistische Wirkungen definierter probiotischer Stämme gegen einzelne enterovirulente Mikroorganismen nachgewiesen werden. Zu betonen ist auch hier eine strenge Stammspezifik der heterogenen Wirkungsweisen (◘ Tab. 30.2).
| Probiotische Bakterienstämme | Enterovirulente Pathogene | Gegen Pathogene gerichtete antagonistische Wirkprinzipien | Nachweismethoden/Tiermodelle |
|---|---|---|---|
| Lactobacillus salivarius |
– Helicobacter pylori – Salmonella enteritidis |
– Massive Milchsäureproduktion – Reduktion der Kolonisation |
– Gnotobiotische Mäuse – Leghorn-Hühner |
| Lactobacillus acidophilus LB |
– Helicobacter felis – Salomnella enterica |
– Reduktion der Ureaseaktivität von Helicobacter felis – Reduktion kolonisationsfähiger Salmonellen im Stuhl |
– Konventionelles Mausmodell – C3H/He/oujco-Mäuse |
| Lactobacillus rhamnosus HN001 |
– Salmonella enterica Serovar Typhimurium – Escherichia coli O 157 |
– Induktion und Verstärkung der Immunantwort mit signifikant höheren mukosalen und systemischen Anti-Salmonella-Antikörper-Titern und gesteigerte Ex-vivo-Phagozytosekapazität – Gesteigerte intestinale Anti-Escherichia-coli-IgA-Antwort und Phagozytoseleistung |
– BALB/c-Mäuse – Konventionelles Mausmodell |
| Lactobacillus casei Shirota und Lactobacillus casei DN-114001 |
– Shiga-Toxin produzierende Escherichia coli – Listeria monocytogenes – Rotaviren |
– Steigerung der lokalen Immunantwort – Makrophagenmigration in das retikuloendotheliale System – Steigerung der zellvermittelten Immunität – Signifikant schnellere Regeneration von Mukosaläsionen |
– Kaninchen – Wistar-Ratten – Konventionelles Mausmodell |
| Bifidobacterium spp. | – Salmonella enterica | – Optimierung der Mukosabarriere | – C3H/He/oujco-Mäuse |
| Bifidobacterium lactis HN019 |
– Salmonella enterica – Escherichia coli – Rotaviren |
– Steigerung der IgA-Antikörper-Antwort – Erhöhung der Phagozytenzahl in Blut und Peritoneum – Steigerung von Phagozytose und T-Lymphozyten-Antwort – Erhöhung des Antikörper-Titers – Reduktion der fäkalen Viruskonzentration |
– BALB/c-Mäuse – Rhesus-Rotavirus-infizierte Mäuse |
| Bifidobacterium breve Yakult und Bifidobacterium breve YIT4064 |
– Salmonella enterica Serovar Typhimurium – Rotaviren |
– Reduktion der Kolonisation und der extraintestinalen Translokation des Pathogens – Erhöhung der Anti-Rotavirus-IgA-Spiegel in Fäzes, Brustdrüse und Darmmukosa |
– Antibiotikainduziertes murines Infektionsmodell – Jungmäuse |
| Bifidobacterium longum | – Escherichia coli C 25 | – Inhibition der transmuralen Translokation des Pathogens | – Antibiotikadekontaminierte, speziell pathogenfreie und keimfreie Mäuse |
Probiotika in der Pädiatrie
Gastroenteritis
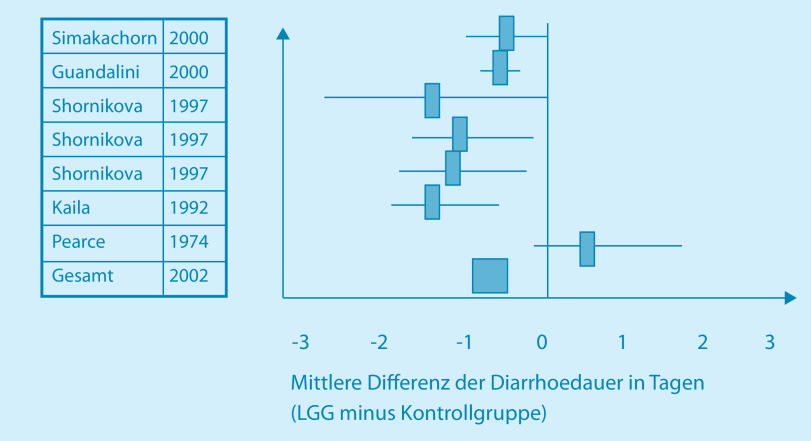
Die durch experimentelle bzw. Grundlagenuntersuchungen gewonnenen Erkenntnisse über klinisch nutzbare Eigenschaften und Wirkungen von Probiotika schlechthin sind in Studien erst ansatzweise bestätigt bzw. validiert worden. Dies gilt auch für kindergastroenterologische Fragestellungen. Wissenschaftlicher Konsens besteht hier bislang bezüglich der reproduzierbaren signifikanten Wirkung definierter Probiotika gegen virale Erreger infektiöser Diarrhöen im Säuglings- und Kindesalter. Im Jahre 2002 konnten Niel et al. im Rahmen einer Metaanalyse einschlägiger Studien zeigen, dass die Applikation von Lactobacillus GG bei Gastroenteritis einen signifikant krankheitsverkürzenden Effekt hat (◘ Abb. 30.3).
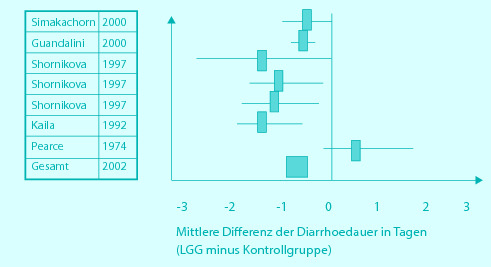
Auch bezüglich der antiviralen Wirksamkeit gelten eine strenge Stammspezifik und Dosisabhängigkeit (höhere Wirksamkeit bei Dosen von >1010 bis 1011 koloniebildenden Einheiten).
Diarrhöen durch enteroinvasive Bakterien scheinen durch Probiotika nicht signifikant beeinflusst zu werden. Über gastrointestinale Infektionen, invasive Infektionen bei Neugeborenen und Allergieprävention hinaus sind Probiotika bei Kindern mit Laktoseunverträglichkeit , Reizdarmsyndrom und chronisch-entzündlichen Darmerkrankungen angewandt worden.
Nekrotisierende Enterokolitis
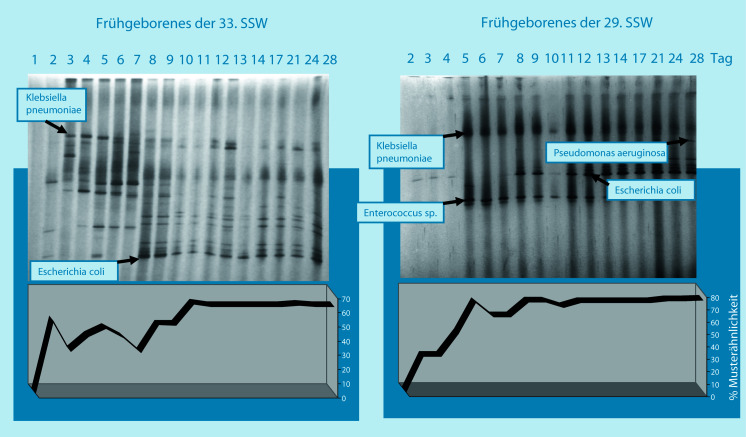
Auf diesem Gebiet ist in den letzten Jahren eine solide wissenschaftliche Evidenz durch Multicenterstudien erarbeitet worden, von der Frühgeborene heute profitieren. Bei sehr unreifen Frühgeborenen wird der intrauterine Schutz des Feten vor Umwelteinflüssen durch die Geburt abrupt unterbrochen; ein immunologisch inkompetentes Individuum wird z. T. aggressiven Umwelteinflüssen ausgesetzt. Die postnatale Antigenstimulation wird durch bakterielle Antigene aus dem perinatalen Umfeld nachteilig beeinflusst. Während bei eutrophen, früh an die Brust angelegten Neugeborenen vor allem Bifidobakterien (◘ Abb. 30.2) und Laktobazillen die Primärbesiedlung des Gastroenterons dominieren, müssen sich Frühgeborene mit Erregern der Hospitalflora auseinandersetzen. Das Gastroenteron als größte Kontaktfläche mit der Außenwelt wird daher ganz wesentlich und vergleichsweise früh bzw. sogar primär mit pathogenen bzw. potenziell pathogenen Erregern besiedelt (◘ Abb. 30.4, ◘ Abb. 30.5).
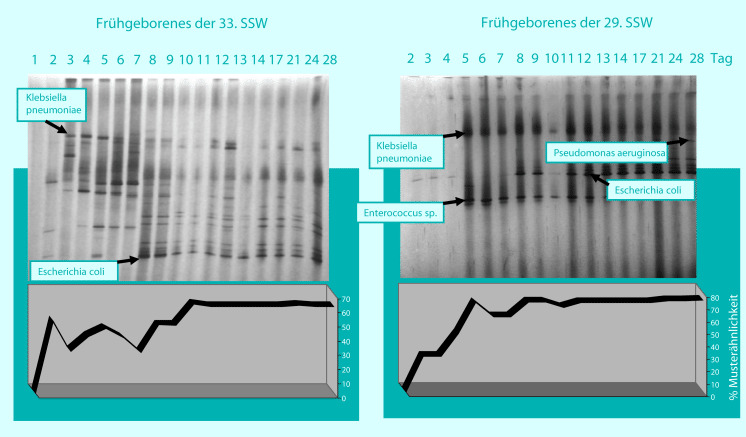
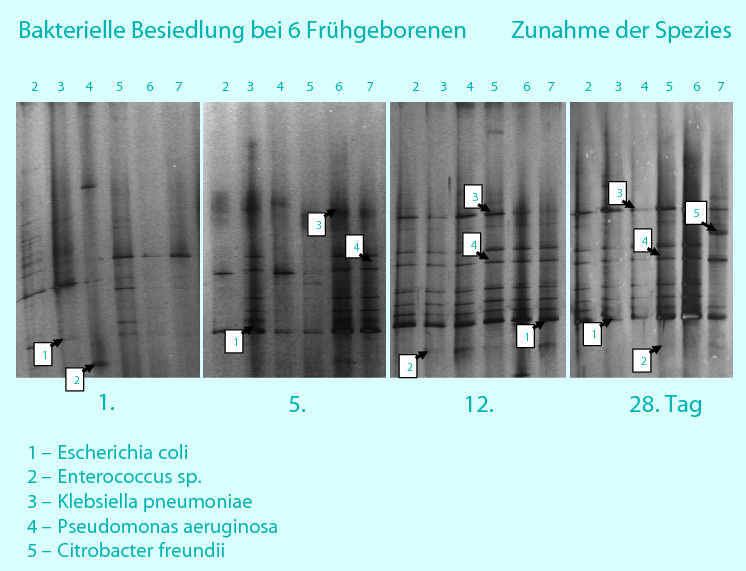
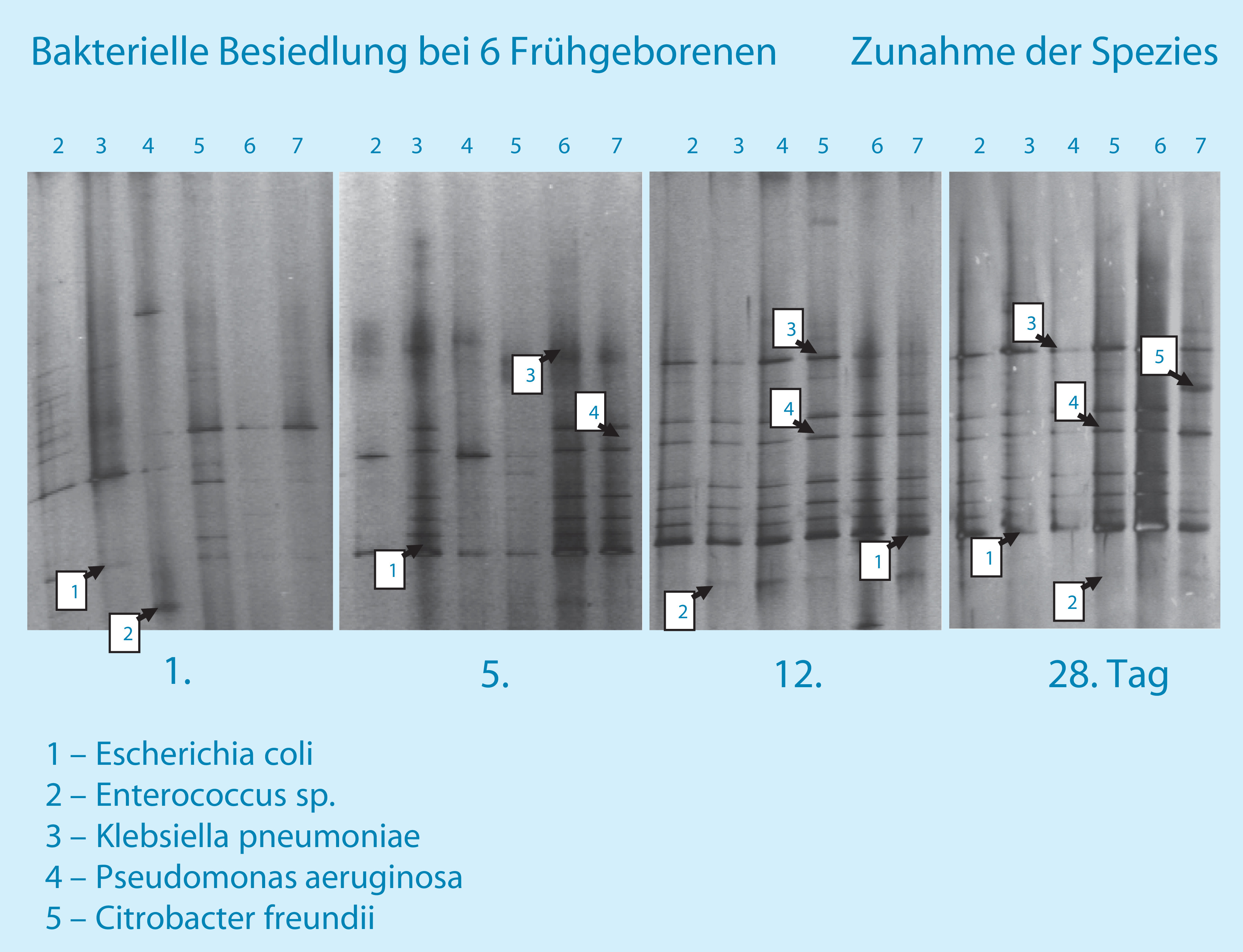
Diese Situation mit einem hohen Risiko für vom Gastroenteron ihren Ursprung nehmenden Entzündungsprozessen bis hin zur nekrotisierenden Enterokolitis (NEC) als schwerwiegendste Darmentzündung (◘ Abb. 30.4) steht derzeit im Fokus der Probiotikaforschung mit dem Ziel der Reduktion der Morbidität und Mortalität Frühgeborener durch Prävention der vom Gastroenteron ausgehenden Entzündungsprozesse.
Zielführendes Kriterium ist hierbei besonders die Abwendung des NEC-Risikos oder seine Schweregradminderung durch Probiotika. In aktuellen Metaanalysen gingen die Daten einer Reihe von doppelblind randomisierten und placebokontrollierten Studien ein, die in den letzten 10 Jahren hierzu durchgeführt wurden. Die in Metaanlysen bekannten Schwächen, insbesondere die fehlende Vergleichbarkeit der eingesetzten Probiotika sowie ihrer Dosis, Anwendungsdauer u. a. können nicht darüber hinwegtäuschen, dass Probiotika heute signifikante Wirkungen zur Minimierung von Risiko und Schweregrad einer NEC haben. Exemplarisch sei eine randomisierte und kontrollierte Multicenterstudie von Lin et al. (2008) erläutert. Insgesamt 434 Frühgeborene (Gestationsalter <34 Wochen oder Geburtsgewicht <1500 g) erhielten Probiotika oder Placebo. Den Probanden der Probiotikagruppe (n = 217) wurden zweimal täglich je 109 Kolonie bildende Einheiten (KbE) Lactobacillus acidophilus und Bifidobacterium bifidum über insgesamt 6 Wochen appliziert. In der Placebogruppe (n = 217) erfolgte keine Intervention durch Probiotika, jedoch ein identischer enteraler Nahrungsaufbau mit Muttermilch bzw. mit einem Muttermilch-Formelmilch-Gemisch, unmittelbar nachdem die Kinder 1 ml/kg KG destilliertes Wasser tolerierten. Die Ergebnisse der Interventionsstudie sind in ◘ Tab. 30.3 dargestellt.
| NEC-Stadium/Outcome | Verumgruppe (n = 217) |
Placebogruppe (n = 217) |
Signifikanz (p) |
|---|---|---|---|
| Tod oder NEC | 4 | 20 | 0,002 |
| NEC, Stadium 2 | 2 | 9 | 0,27 |
| NEC, Stadium 3 | 2 | 5 | 0,13 |
| NEC ≥ Stadium 2 | 4 | 14 | 0,02 |
| Tod infolge NEC | 2 | 3 | 0,98 |
| Tod unabhängig von einer NEC | 0 | 6 | 0,04 |
Chronisch-entzündliche Darmerkrankungen
Für eine Involvierung der intestinalen Mikroflora in die ätiopathogenetisch weitgehend unklaren chronisch-entzündlichen Darmerkrankungen sprechen folgende Überlegungen:
Chronisch-entzündliche Darmerkrankungen sind am stärksten in den besonders dicht mit Mikroorganismen besiedelten Darmabschnitten ausgeprägt.
Experimentell keimfreie Tiere entwickeln keine chronisch-entzündlichen Darmerkrankungen.
Patienten mit M. Crohn profitieren von einer operativ notwendig gewordenen Ableitung des Darminhalts; umgekehrt führt eine Rückverlagerung eines Anus praeterminalis zur Aktivierung von Entzündungsprozessen.
Antibiotika mildern bei einigen Verläufen die klinische Symptomatik.
Probiotika haben wahrscheinlich entzündungshemmende Wirkungen.
Von Kruis et al. (2004) wurden erstmals positive Effekte von Escherichia coli Nissle 1917 (EcN) zur Remissionserhaltung der Colitis ulcerosa bei Erwachsenen dokumentiert. Ein ähnlicher Effekt konnte auch bei Kindern nachgewiesen werden. In einer Studie von Henker et al. (2008) wurden 34 Patienten mit Colitis ulcerosa im Alter von 11–18 Jahren erfasst; 24 erhielten das Probiotikum (EcN), 10 Patienten bekamen Mesalazin (5-Aminosalicylsäure, 5-ASA) in einer Dosis von 1,5 g pro Tag. Der Studienzeitraum betrug ein Jahr. In der EcN-Gruppe hatten 6 der 24 Patienten (25 %) einen Rückfall; in der Mesalazin-Gruppe 3 von 10 (ca. 30 %).
Huynh et al. publizierten 2009 die Ergebnisse einer offenen Pilotstudie zur Remissionsinduktion bei milder bis moderater Colitis ulcerosa bei 18 Kindern im Alter von 3–17 Jahren durch Applikation von VSL#3 , einer probiotischen Präparation aus verschiedenen Laktobazillusstämmen (L. casei, L. plantarum, L. acidophilus, L. delbruecki), 3 Bifidobakterienstämmen (B. longum, B. breve, B. infantis) und Streptococcus thermophilus. Die Patienten erhielten je nach Alter 2 Tagesdosen (½ bis max. 2 ½ Sachets mit je 4,5-mal 1011 lyophilisierten lebensfähigen Bakterien) für einen Zeitraum von 8 Wochen. Die Entzündungsaktivität der Colitis ulcerosa wurde durch endoskopische und einschlägige Laborparameter dokumentiert. Es konnten die Daten von 13 Probanden ausgewertet werden, bei 5 erfolgte wegen ausbleibender Besserung ein Studienabbruch. Als Endergebnis stellte sich bei 10 Probanden (56 %) eine Remission ein und bei den verbleibenden 3 eine Verbesserung der Symptomatik.
Von höherer Aussagekraft ist eine ebenfalls 2009 publizierte randomisierte, placebokontrollierte Studie von Miele et al. (2009) zur Induktion einer Remission und Remissionserhaltung einer neu diagnostizierten Colitis ulcerosa bei 29 Kindern im mittleren Alter von 9,8 Jahren mit VSL#3. Alle Patienten erhielten eine Standardtherapie zur Remissionsinduktion mit Steroiden und 5-ASA. Die 5-ASA-Therapie wurde zur Remissionserhaltung bis zum Endpunkt der Studie nach einem Jahr fortgeführt. Die Probanden der Interventionsgruppe erhielten zusätzlich VSL#3 vom ersten Behandlungstag bis zum Studienende in einer altersgruppenstratifizierten (4 definierte Altersgruppen) Dosierung von 0,45- bis 1,8-mal 109 Bakterien/Tag. Die wesentlichen Ergebnisse sind in ◘ Tab. 30.4 dargestellt.
| Studienkriterium | Steroide/5-ASA plus VSL#3 (n = 14) | Steroide/5-ASA plus Placebo (n = 15) | Signifikanzniveau |
|---|---|---|---|
| Erreichte Remission | 13 (92,8 %) | 4 (36,4 %) | p<0,001 |
| Rezidiv nach einem Jahr | 3 von 14 (21,4 %) | 11 von 15 (73,3 %) | p = 0,014 |
| Endoskopischer Score | p = 0,05 | ||
| – nach 6 Monaten | ↓↓↓ | ↓↓ | |
| – nach 12 Monaten | ↓↓↓ | ↓ | |
| Histologischer Score | p = 0,01 | ||
| – nach 6 Monaten | ↓↓ | ↓ | |
| – nach 12 Monaten | ↓ | → |
↓↓↓ starker Rückgang; ↓↓ mittlerer Rückgang; ↓ leichter Rückgang; → keine Veränderung.
Beide Studien mit kleinen Probandenzahlen zeigen eine klinische Wirksamkeit der applizierten Probiotikumpräparation – hier in Form von VSL#3 – bei der Einleitung und insbesondere Erhaltung der Remission einer neu diagnostizierten Colitis ulcerosa bei Kindern.
In neueren Studien wurde ferner die Wirksamkeit von VSL#3 zur Prävention und Behandlung einer Pouchitis nach ileoanaler Anastomose mit Pouch-Anlage belegt. Bei 40 Patienten mit Pouchitis zeigte eine placebokontrollierte Studie, dass Rezidive einer Pouchitis bei 100 % der mit Placebo, jedoch nur bei 15 % der mit VSL#3 behandelten Patienten auftraten.
Weitere Indikationen
Placebokontrollierte bzw. randomisierte klinische Studien über die Anwendung von Probiotika bei Kindern zur Prävention und Therapie der infektiösen Gastroenteritis sowie der nekrotisierenden Enterokolitis und von chronisch-entzündlichen Darmerkrankrungen hinaus sind – je nach Fragestellung – nicht oder nur in sehr begrenztem Umfang vorhanden. Aus diesem Grund ist es derzeit verfrüht, allgemein gültige Empfehlungen zum Einsatz von Probiotika bei verschiedenen Krankheiten und Funktionsstörungen (z. B. Reizdarmsyndrom) zu geben. In ◘ Tab. 30.5 sind neben der Gastroenteritis einige weitere Anwendungen von Probiotika bei Kindern aufgelistet, für die Daten aus Studien zumindest in begrenztem Umfang publiziert wurden.
| Krankheit/Funktionsstörung | Applizierte Probiotika |
|---|---|
|
– Darminfektionen – Darmentzündungen – Akute virale Gastroenteritis – Akute bakterielle Gastroenteritis – Antibiotikaassoziierte Diarrhö – Reisediarrhö |
– Laktobazillen – Bifidobakterien – Escherichia coli Nissle – Streptococcus thermophilus – Saccharomyces boulardii |
| Infektionen der oberen Atemwege (Otitis media, Tonsillitis) | Streptokokken, Laktobazillen |
| Neugeborenensepsis, nekrotisierende Enterokolitis | Bifidobakterien, Laktobazillen |
| Neurodermitis, Allergien (Prävention und Therapie) | Laktobazillen |
| Chronisch-entzündliche Darmerkrankungen, Pouchitis | Laktobazillen, Escherichia coli Nissle 1917, VSL#3 (Mischung aus verschiedenen Milchsäurebakterien) |
| Reizdarmsyndrom („irritable bowel syndrome“) | Laktobazillen, VSL#3 |
| Chronische Bauchschmerzen | Lactobacillus plantarum |
| Laktoseintoleranz, Laktasemangel | Bifidobakterien, Lactobacillus bulgaricus, Streptococcus thermophilus |
| Vaginitis (durch Candida spp.) | Lactobacillus acidophilus |
| Karies | Laktobazillen |
Präbiotika
Präbiotische Oligosaccharide wie Inulin und Frukto- (FOS) bzw. Galaktooligosaccharide (GOS) werden seit einigen Jahren mit Fokus auf ihre unterstützende Wirkung zur Etablierung einer probiotischen, vor allem einer Bifidusflora untersucht. Neuerdings wird diskutiert, ob FOS und insbesondere GOS nicht sogar eigene immunmodulierende Funktionen innewohnen. FOS und insbesondere GOS finden sich in großer Zahl und Heterogenität in humaner, nicht jedoch in boviner Milch und daher auch nicht in herkömmlichen Säuglingsmilchnahrungen. Sie könnten daher eine interessante Innovation in der Säuglingsernährung mit dem Ziel der Etablierung bzw. Unterhaltung einer stabilen Bifidusflora darstellen. Ein wesentliches funktionelles Charakteristikum humaner Milcholigosaccharide (HMO) ist ihre Unverdaubarkeit durch humane Enzymsysteme: Mehr als 90 % der GOS verbleiben demzufolge im fäkal ausgeschiedenen Chymus und wirken während der Darmpassage wahrscheinlich lokal antiinflammatorisch. Neuere Studien bei eutrophen Neugeborenen und Frühgeborenen haben allerdings gezeigt, dass ein kleiner Anteil der GOS (etwa 1 %) im Urin nachweisbar ist. Es liegt daher die Vermutung nahe, dass diese Präbiotika nicht nur lokale, sondern auch systemische antientzündliche Wirkungen ausüben.
In den letzten Jahren wurden klinische Studien mit Säuglingsmilchnahrungen unter Zusatz von FOS und GOS mit der Zielstellung durchgeführt, die „bifidogene“ Wirkung humaner Milch zu imitieren. Vergleiche zwischen den in Säuglingsmilchnahrungen eingesetzten GOS und humanen Milcholigosacchariden zeigen deutliche qualitative und quantitative Unterschiede, nicht zuletzt gemessen am Gehalt von N-Acetylneuraminsäure (NANA), die sich zwar in humanen Milcholigosacchariden, nicht jedoch in GOS boviner Herkunft findet. In jüngster Zeit erfolgen darüber hinaus Versuche, die Stimulation und Aufrechterhaltung der Kolonisation probiotischer Bakterien durch die simultane Supplementation von Milchsäure- bzw. Bifidobakterien zu optimieren (synbiotische Säuglingsmilchnahrung). Die derzeit verfügbaren Daten lassen hierzu noch keine abschließende Beurteilung zu.
Literatur
- Deshpande G, Rao S, Patole S, Bulsara M. Updated meta-analysis of probiotics for preventing necrotizing enterocolitis in preterm neonates. Pediatrics. 2010;125:921–930. doi: 10.1542/peds.2009-1301. [DOI] [PubMed] [Google Scholar]
- Dimmitt RA, Staley EM, Chuang G, et al. Role of postnatal acquisition of the intestinal microbiom in the early development of immune function. J Pediatr Gastroenterol Nutr. 2010;51:262–273. doi: 10.1097/MPG.0b013e3181e1a114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- FAO/WHO (2001) Joint FAO/WHO expert consultation on evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. http://www.who.int/foodsafety/publications/fs_management/en/probiotics.pdf. Zugegriffen: 19.07.21012
- Gionchetti P, Rizzello F, Venturi A, et al. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology. 2000;119:305–309. doi: 10.1053/gast.2000.9370. [DOI] [PubMed] [Google Scholar]
- Goossens D, Jonkers D, Stobberingh E, et al. Probiotics in gastroenterology: indications and future perspectives. Scand J Gastroenterol. 2003;239:15–23. doi: 10.1080/00855920310002645. [DOI] [PubMed] [Google Scholar]
- Henker J, Müller S, Laass MW, et al. Probiotic Escherichia coli Nissle 1917 (EcN) for successful remission maintenance of ulcerative colitis in children and adolescents: an open-label pilot study. Z Gastroenterol. 2008;46:874–875. doi: 10.1055/s-2008-1027463. [DOI] [PubMed] [Google Scholar]
- Henker J, Huynh HQ, de Bruyn J, et al. Probiotic preparation (VSL#3) induces remission in children with mild to moderate acute ulcerative colitis: a pilot study. Inflamm Bowel Dis. 2009;15:760–768. doi: 10.1002/ibd.20816. [DOI] [PubMed] [Google Scholar]
- Köhler H, McGormic BA, Walker WA. Bacterial-enterocyte crosstalk: cellular mechanisms in health and disease. J Pediatr Gastroenterol Nutr. 2003;36:175–185. doi: 10.1097/00005176-200302000-00005. [DOI] [PubMed] [Google Scholar]
- Kruis W, Fric P, Pokrotnieks J. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut. 2004;53:1617–1623. doi: 10.1136/gut.2003.037747. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kukkonen K, Savilahti E, Haahtela T, et al. Long-term safety and impact on infection rates of postnatal probiotic and prebiotic (symbiotic) treatment: randomized, double-blind, placebo-controlled trial. Pediatrics. 2008;122:8–12. doi: 10.1542/peds.2007-1192. [DOI] [PubMed] [Google Scholar]
- Lin HC, Hsu CH, Chen HL, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight preterm infants: a multicenter, randomized, controlled trial. Pediatrics. 2008;122:693–700. doi: 10.1542/peds.2007-3007. [DOI] [PubMed] [Google Scholar]
- Marteau P, Seksik P, Jian R. Probiotics and intestinal health effects: a clinical perspective. Br J Nutr. 2002;88(1):51–57. doi: 10.1079/BJN2002629. [DOI] [PubMed] [Google Scholar]
- Miele E, Pascarella F, Gianetti E, et al. Effect of a probiotic preparation (VSL#3) on induction and maintenance of remission in children with ulcerative colitis. Am J Gastroenterol. 2009;104:437–443. doi: 10.1038/ajg.2008.118. [DOI] [PubMed] [Google Scholar]
- Mohan R, Koebnick C, Schildt J, et al. Effects of Bifidobacterium lactis Bb12 supplementation on intestinal microbiota of preterm infants: a double-blind, placebo-controlled, randomized study. J Clin Microbiol. 2006;44:4025–4031. doi: 10.1128/JCM.00767-06. [DOI] [PMC free article] [PubMed] [Google Scholar]
- van Niel CW, Feudtner C, Garrison MM. Lactobacillus therapy for acute infectious diarrhea in children: a meta-analysis. Pediatrics. 2002;109:678–684. doi: 10.1542/peds.109.4.678. [DOI] [PubMed] [Google Scholar]
- Otte J-M, Cario E, Podolsky DK. Mechanisms of cross hyporesponsiveness to Toll-like receptor bacterial ligands in intestinal epithelial cells. Gastroenterology. 2004;126:1054–1070. doi: 10.1053/j.gastro.2004.01.007. [DOI] [PubMed] [Google Scholar]
- Radke M. Probiotika in der Kindergastroenterologie. Mschr Kinderheilk. 2010;158:570–582. doi: 10.1007/s00112-009-2156-x. [DOI] [Google Scholar]
- Reid G, Jass J, Sebulky MT, McGormick JK. Potential use of probiotics in clinical practice. Clin Microbiol Rev. 2003;16:658–672. doi: 10.1128/CMR.16.4.658-672.2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Rembacken BJ, Snelling AM, Hawkey PM, Chalmers DM, Axon AT. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet. 1999;354:635–639. doi: 10.1016/S0140-6736(98)06343-0. [DOI] [PubMed] [Google Scholar]
- Schmelzle H, Wirth S, Skopnik H, et al. Randomized double-blind study of the nutritional efficacy and bifidogenicity of a new infant formula containing partially hydrolyzed protein, a high β-palmitic acid level, and nondigestible oligosaccharids. J Ped Gastroenterol Nutr. 2003;36:343–351. doi: 10.1097/00005176-200303000-00008. [DOI] [PubMed] [Google Scholar]
- Schwiertz A, Gruhl B, Löbnitz M, et al. Development of the intestinal bacterial composition in hospitalized preterm infants in comparison with breast-fed, full-term infants. Pediatr Res. 2003;54:393–399. doi: 10.1203/01.PDR.0000078274.74607.7A. [DOI] [PubMed] [Google Scholar]
- Servin AL. Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS Microbiol Rev. 2004;28:405–440. doi: 10.1016/j.femsre.2004.01.003. [DOI] [PubMed] [Google Scholar]
- Thomas DW, Greer FR, Committee on Nutrition, Section on Gastroenterology, Hepatology, and Nutrition Clinical report – probiotics and prebiotics in pediatrics. Pediatrics. 2010;126:1217–1231. doi: 10.1542/peds.2010-2548. [DOI] [PubMed] [Google Scholar]
- Veereman-Wauters G, Staelens S, van de Broek H, et al. Physiological and bifidogenic effects of prebiotic supplementation in infant formulae. J Pediatr Gastroenterol Nutr. 2011;52:763–771. doi: 10.1097/MPG.0b013e3182139f39. [DOI] [PubMed] [Google Scholar]