Abstract
In der sinusoidalen Membran beginnt die Gallebildung. Rezeptoren und Transporter erleichtern die Aufnahme und den Eintritt von Gallensäuren, Bilirubin, Fettsäuren und anderen Gallekomponenten in die Leberzelle. Diese enthält Rezeptoren für Glykoproteine, Asialoglykoprotein, Immunglobulin A (Ig A), vasoaktives intestinales Peptid (VIP), Insulin, Glukagon und „epidermal growth factor“ (EGF). Ein primär aktiver Transport erfolgt durch die Na+-K+-ATPase, die einen Ionengradienten an der Zellmembran aufbaut und innerhalb der Zelle ein negatives elektrisches Potenzial erzeugt (wodurch die Diffusion erleichtert wird). Dieser Ionengradient ermöglicht die Arbeit anderer Carrier gegen das Konzentrationsgefälle, z. B. von NTCP (Natrium-Taurocholsäure-Kotransport-Polypeptid), das auch für zahlreiche Medikamente, Östrogene und zyklische Oligopeptide spezifisch ist. Transporter für organische Anionen (OATP1) und anorganische Ionen wurden ebenfalls nachgewiesen.
Literatur
Literatur zu Abschn. 14.1
- Anderson JM. Leaky junctions and cholestasis: a tight correlation. Gastroenterol. 1996;110:1662–1665. doi: 10.1053/gast.1996.v110.agast961662. [DOI] [PubMed] [Google Scholar]
- Anderson JM, Van Itallie CN. Tight junctions and the molecular basis for regulation of paracellular permeability. Am J Physiol. 1995;269:G467–G475. doi: 10.1152/ajpgi.1995.269.4.G467. [DOI] [PubMed] [Google Scholar]
- Chen HL, Liu YJ, et al. Developmental expression of canalicular transporter genes in human liver. J Hepatol. 2005;43:472–477. doi: 10.1016/j.jhep.2005.02.030. [DOI] [PubMed] [Google Scholar]
- Desmet VJ. Modulation of the liver in cholestasis. J Gastroenterol Hepatol. 1992;7:313–323. doi: 10.1111/j.1440-1746.1992.tb00988.x. [DOI] [PubMed] [Google Scholar]
- LaRusso NF. Morphology, physiology, and biochemistry of biliary epithelia. Toxicol Pathol. 1996;24:84–89. doi: 10.1177/019262339602400112. [DOI] [PubMed] [Google Scholar]
- MacSween RNM, Ishak KG, Burt AD, et al., editors. Pathology of the liver. London: Churchill Livingstone; 2002. [Google Scholar]
- Masyuk TV, Huang BQ, Ward CJ, et al. Defects in cholangiocyte fibrocystin expression and ciliary structure in the PCK rat. Gastroenterology. 2003;125:1303–1310. doi: 10.1016/j.gastro.2003.09.001. [DOI] [PubMed] [Google Scholar]
- Muller M, Jansen PL. The secretory function of the liver: new aspects of hepatobiliary transport. J Hepatol. 1998;28:344–354. doi: 10.1016/0168-8278(88)80024-2. [DOI] [PubMed] [Google Scholar]
- Phillips MJ, Suchy FJ. Mechanisms and morphology of cholestasis. In: Suchy FJ, Sokol RJ, Balistreri WF, editors. Liver disease in children. Philadelphia: Lippincott Williams & Wilkins; 2001. pp. 22–37. [Google Scholar]
- Shneider BL. Genetic cholestasis syndromes. J Pediatr Gastroenterol Nutr. 1999;28:124–131. doi: 10.1097/00005176-199902000-00005. [DOI] [PubMed] [Google Scholar]
- Strazzabosco M. New insights into cholangiocyte physiology. J Hepatol. 1997;27:945–952. doi: 10.1016/S0168-8278(97)80338-8. [DOI] [PubMed] [Google Scholar]
- Suchy FJ. Functional development of the liver. In: Suchy J, Sokol RJ, Balistreri WF, editors. Liver disease in children. 3. Cambridge: Cambridge University Press; 2007. pp. 4–27. [Google Scholar]
- Trauner M, Arrese M, Soroka CJ. The rat canalicular conjugate export pump (MRP2) is down-regulated in intrahepatic and obstructive cholestasis. Gastroenterology. 1997;113:255–264. doi: 10.1016/S0016-5085(97)70103-3. [DOI] [PubMed] [Google Scholar]
- Zakim D, Boyer TD. Hepatology. A textbook of liver disease. Philadelphia: Saunders; 2003. [Google Scholar]
Literatur zu Abschn. 14.2
- Desmet VJ. Cholangiopathies: past, present, and future. Semin Liver Dis. 1987;7:67–76. doi: 10.1055/s-2008-1040566. [DOI] [PubMed] [Google Scholar]
- Desmet VJ. Congenital diseases of the intrahepatic bile ducts: variations on the theme „ductal plate malformation“. Hepatology. 1992;16:1069–1083. doi: 10.1002/hep.1840160434. [DOI] [PubMed] [Google Scholar]
- Desmet V, Roskams TA. Cholestatic syndromes of infancy and childhood. In: Zakim D, Boyer TD, editors. Hepatology. A textbook of liver disease. Philadelphia: Saunders; 2003. pp. 1481–1536. [Google Scholar]
- Desmet VJ, Van Eyken P. Embryology, malformations and malpositions of the liver. In: Haubrich W, Schaffner F, Berk JE, editors. Bockus gastroenterology. Philadelphia: Saunders; 1995. pp. 51–61. [Google Scholar]
- Mowat AP. Liver disorders in childhood. Oxford: Butterworth-Heinemann; 1994. [Google Scholar]
- Schweizer P, Müller G. Gallengangsatresie. Stuttgart: Hippokrates; 1990. [Google Scholar]
- Suchy J, Sokol RJ, Balistreri WF. Liver disease in children. 3. Cambridge: Cambridge University Press; 2007. [Google Scholar]
Literatur zu Abschn. 14.3
- Andres JM. Hepatocyte injury and giant cell transformation. In: Suchy FJ, editor. Liver disease in children. St Louis: Mosby-Year Book; 1994. pp. 166–172. [Google Scholar]
- Mowat AP. Liver disorders in childhood. Oxford: Butterworth-Heinemann; 1994. [Google Scholar]
- Oledzka-Slotwinska H, Desmet V. Morphologic and cytochemical study on neonatal liver „giant“ cell transformation. Exp Mol Pathol. 1969;10:162–175. doi: 10.1016/0014-4800(69)90037-9. [DOI] [PubMed] [Google Scholar]
- Roschlau G. Leberbiopsie im Kindesalter. Jena: Fischer; 1978. [Google Scholar]
- Scheuer PJ. Liver biopsy interpretation. London: Baillière & Tindall; 1973. [Google Scholar]
- Schlesinger L, Musson RA, Johnson RB. Functional and biochemical studies of multinucleated giant cells derived from the culture of human monocytes. J Exp Med. 1984;159:1289–1294. doi: 10.1084/jem.159.4.1289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Thaler H. Leberkrankheiten. Berlin Heidelberg New York: Springer; 1982. [Google Scholar]
- Zakim D, Boyer TD. Hepatology. A textbook of liver disease. Philadelphia: Saunders; 2003. [Google Scholar]
Literatur zu Abschn. 14.4
- Beath S. Nutritional support in liver disease. Arch Dis Childhood. 1993;69:545–549. doi: 10.1136/adc.69.5.545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ferenci P. Successful long term treatment of portal systemic encephalopathy by the benzodiazepine antagonist flumazenil. Gastroenterology. 1989;96:240–243. doi: 10.1016/0016-5085(89)90787-7. [DOI] [PubMed] [Google Scholar]
- Friedman S. Cellular sources of collagen and regulation collagen production in liver. Semin Liver Dis. 1990;10:20. doi: 10.1055/s-2008-1040454. [DOI] [PubMed] [Google Scholar]
- Hardy S, Kleinman R. Cirrhosis and chronic liver failure. In: Suchy F, Sokol R, Balistreri W, editors. Liver disease in children. Philadelphia: Lippincott Williams & Wilkins; 2001. pp. 89–127. [Google Scholar]
- Hasper D. New insights into the management of hepato-renal syndrome. Liver Intern. 2011;31(3):27–30. doi: 10.1111/j.1478-3231.2011.02586.x. [DOI] [PubMed] [Google Scholar]
- Marx M. Interventional stent implantation in a child with patent ductus venosus and pulmonary hypertension. Eur J Pediatr. 2001;160:501–504. doi: 10.1007/s004310100770. [DOI] [PubMed] [Google Scholar]
- Montgomery D, Maher J. Hepatic fibrosis and cirrhosis. In: Zakim D, Boyer T, editors. Hepatology. A textbook of liver disease. Philadelphia: Saunders; 2003. pp. 395–416. [Google Scholar]
- Nakayama H. Stimulation of DNA synthesis in adult rat heptocytes in primary culture by sera from patients with fulminant hepatic failure. Biomed Res. 1985;6:231–237. [Google Scholar]
- Reeves H, Friedman S. Activation of hepatic stellate cells – a key issue in liver fibrosis. Frontiers Biosci. 2002;7:808–826. doi: 10.2741/reeves. [DOI] [PubMed] [Google Scholar]
- Rockey C. Hepatic fibrosis and cirrhosis. In: Zakim D, Boyers T, editors. Hepatology. Philadelphia: Saunders; 2006. pp. 87–109. [Google Scholar]
- Salerno F. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut. 2007;56:1310–1318. doi: 10.1136/gut.2006.107789. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Santamaria F. Noninvasive investigation of hepatopumonary syndrome in children and adolescents with chronic cholestasis. Pediatr Pulmonol. 2002;33:374–379. doi: 10.1002/ppul.10088. [DOI] [PubMed] [Google Scholar]
- Shepherd R. Complication and management of chronic liver disease. In: Kelly D, editor. Diseases of the liver and biliary system in children. Oxford: Blackwell; 2004. pp. 259–281. [Google Scholar]
- Todd R. Current concepts in the pathophysiology and management of hepatic encephalopathy. Gastroenteology Hepatology. 2011;7:222–233. [PMC free article] [PubMed] [Google Scholar]
- Yousef N. Hepatorenal syndrome: diagnosis and effect of Terlipressin therapy in 4 pediatric patients. JPGN. 2010;51:100–102. doi: 10.1097/MPG.0b013e3181d60e73. [DOI] [PubMed] [Google Scholar]
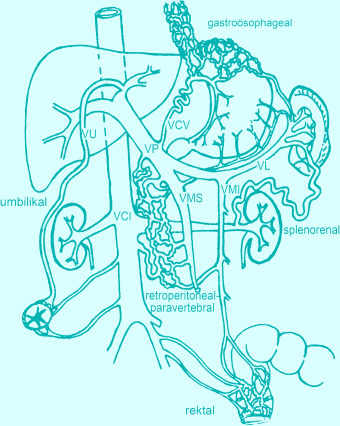
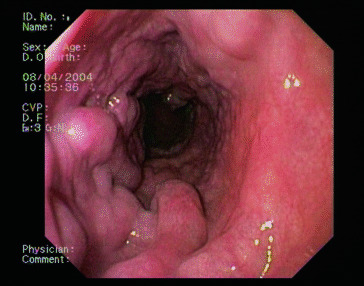
Literatur zu Abschn. 14.5
- Ahuja V, Marwaha N, Chawla Y, Dilawari JB. Coagulation abnormalities in idiopathic portal venous thrombosis. J Gastroenterol Hepatol. 1999;14:1210–1211. doi: 10.1046/j.1440-1746.1999.02030.x. [DOI] [PubMed] [Google Scholar]
- D‘Amico G, Pagliaro L, Bosch J. The treatment of portal hypertension: a meta-analytic review. Hepatology. 1995;22:332–354. doi: 10.1002/hep.1840220145. [DOI] [PubMed] [Google Scholar]
- De Franchis R. Evolving consensus in portal hypertension report of the Baveno IV consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 2005;43:167–176. doi: 10.1016/j.jhep.2005.05.009. [DOI] [PubMed] [Google Scholar]
- De Giacomo C, Tomasi G, Gatti C, Rosa G, Maggiore G. Ultrasonographic prediction of the presence and severity of esophageal varices in children. J Pediatr Gastroenterol Nutr. 1989;9:431–435. doi: 10.1097/00005176-198911000-00006. [DOI] [PubMed] [Google Scholar]
- Dilawari JB, Bambery P, Chawla Y, et al. Hepatic outflow obstruction (Budd-Chiari syndrome). Experience with 177 patients and a review of the literature. Medicine (Baltimore) 1994;73:21–36. doi: 10.1097/00005792-199401000-00003. [DOI] [PubMed] [Google Scholar]
- Gana JC, Turner D, Mieli-Vergani G, et al. A clinical prediction rule and platelet count predict esophageal varices incChildren. Gastroenterology. 2011;141:2009–2016. doi: 10.1053/j.gastro.2011.08.049. [DOI] [PubMed] [Google Scholar]
- Hall RJ, Lilly JR, Stiegmann GV. Endoscopic esophageal varix ligation: technique and preliminary results in children. J Pediatr Surg. 1988;23:1222–1223. doi: 10.1016/S0022-3468(88)80349-X. [DOI] [PubMed] [Google Scholar]
- Herve P, Lebrec D, Brenot F, et al. Pulmonary vascular disorders in portal hypertension. Eur Respir J. 1998;11:1153–1166. doi: 10.1183/09031936.98.11051153. [DOI] [PubMed] [Google Scholar]
- Ho H, Zuckerman MJ, Wassem C. A prospective controlled study of the risk of bacteremia in emergency sclerotherapy of esophageal varices. Gastroenterology. 1991;101:1642–1648. doi: 10.1016/0016-5085(91)90403-8. [DOI] [PubMed] [Google Scholar]
- Infante-Rivard C, Esnaola S, Villeneuve JP. Role of endoscopic variceal sclerotherapy in the long-term management of variceal bleeding: a meta-analysis. Gastroenterology. 1989;96:1087–1092. doi: 10.1016/0016-5085(89)91627-2. [DOI] [PubMed] [Google Scholar]
- Inon AE, D’Agostino D. Portal hypertension secondary to congenital arterioportal fistula. J Pediatr Gastroenterol Nutr. 1987;6:471–473. doi: 10.1097/00005176-198705000-00027. [DOI] [PubMed] [Google Scholar]
- Johnson SP, Leyendecker JR, Joseph FB, et al. Transjugular portosystemic shunts in pediatric patients awaiting liver transplantation. Transplantation. 1996;62:1178–1181. doi: 10.1097/00007890-199610270-00027. [DOI] [PubMed] [Google Scholar]
- Patriquin H, Lafortune M, Burns PN, Dauzat M. Duplex Doppler examination in portal hypertension: technique and anatomy. AJR Am J Roentgenol. 1987;149:71–76. doi: 10.2214/ajr.149.1.71. [DOI] [PubMed] [Google Scholar]
- Sauerbruch T, Schiedermaier P. Medikamentöse Behandlung der intestinalen Blutung bei portaler Hypertension. Dtsch Med Wochenschr. 1998;123:633–636. doi: 10.1055/s-2007-1024031. [DOI] [PubMed] [Google Scholar]
- Shashidhar H, Langhans N, Grand RJ. Propranolol in prevention of portal hypertensive hemorrhage in children: a pilot study. J Pediatr Gastroenterol Nutr. 1999;29:12–17. doi: 10.1097/00005176-199907000-00007. [DOI] [PubMed] [Google Scholar]
- Shneider B, Emre S, Groszmann R, et al. Expert pediatric opinion on the report of the Baveno IV consensus workshop on methodology of diagnosis and therapy in portal hypertension. Pediatric Transplantation. 2006;10:893–907. doi: 10.1111/j.1399-3046.2006.00597.x. [DOI] [PubMed] [Google Scholar]
- Shneider BJ. Portal Hypertension. In: Suchy FJ, Sokol RJ, Balistreri WF, editors. Liver disease in children. Philadelphia: Lippincott Williams & Wilkins; 2001. pp. 129–151. [Google Scholar]
- Spence RA, Johnston GW, Odling-Smee GW, Rodgers HW. Bleeding oesophageal varices with long term follow up. Arch Dis Child. 1984;59:336–340. doi: 10.1136/adc.59.4.336. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Stiegmann GV, Goff JS, Michaletz-Onody PA, et al. Endoscopic sclerotherapy as compared with endoscopic ligation for bleeding esophageal varices. N Engl J Med. 1992;326:1527–1532. doi: 10.1056/NEJM199206043262304. [DOI] [PubMed] [Google Scholar]
- Subramanyam BR, Balthazar EJ, Madamba MR, et al. Sonography of portosystemic venous collaterals in portal hypertension. Radiology. 1983;146:161–166. doi: 10.1148/radiology.146.1.6849040. [DOI] [PubMed] [Google Scholar]
- Terblanche J, Burroughs AK, Hobbs KE. Controversies in the management of bleeding esophageal varices. N Engl J Med. 1989;2(320):1469–1475. doi: 10.1056/NEJM198906013202207. [DOI] [PubMed] [Google Scholar]
- de Ville Goyet J, Alberti D, Clapuyt P, et al. Direct bypassing of extrahepatic portal venous obstruction in children: a new technique for combined hepatic portal revascularization and treatment of extrahepatic portal hypertension. J Pediatr Surg. 1998;33:597–601. doi: 10.1016/S0022-3468(98)90324-4. [DOI] [PubMed] [Google Scholar]