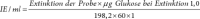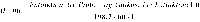Abstract
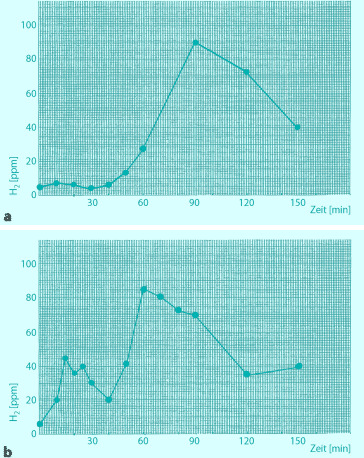
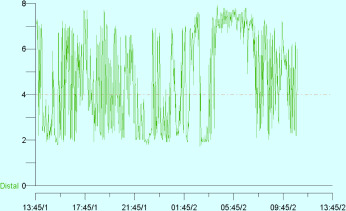
Zur Analyse abgeatmeter Gase muss endexspiratorische Luft gewonnen werden, ohne Vermischung mit frühexspiratorischer Luft (sonst Korrektur mit Messung des CO2-Partialdrucks, s. unten). Ältere Kinder blasen nach Anhalten der Atmung über 15 s durch tiefe Ausatmung über einen Strohhalm endexspiratorische Luft in ein Glasröhrchen, das dann luftdicht verschlossen wird (Vacutainer), oder über ein Mundstück oder eine Maske direkt in ein H2-Messgerät oder in Beutel. Bei Säuglingen und Kleinkindern kann mit einer Maske oder einer Sonde, die bis zum nasopharyngealen Übergang vorgeschoben wird, mit einer Spritze atemsynchron exspiratorische Luft abgesaugt und in Vacutainer oder direkt in das Messgerät eingegeben werden. In Vacutainern sind Proben über mehr als 30 Tage stabil und können auch zur Analyse verschickt werden.
Literatur
Literatur zu Abschn. 3.1
- Braden B, Lembcke B, Caspary WF. Nichtinvasive Funktionsdiagnostik aus der Atemluft mit 13C-Atemtests. Dtsch Ärztebl. 2003;100:A3376–A3381. [Google Scholar]
- Corazza GR, Menozzi MG, Strocchi A, et al. The diagnosis of small bowel bacterial overgrowth. Gastroenterol. 1990;98:302–309. doi: 10.1016/0016-5085(90)90818-l. [DOI] [PubMed] [Google Scholar]
- Jones HF, Burt E, Dowling K, et al. Effect of age on fructose malabsorption in children presenting with gastrointestinal symptoms. J Pediatr Gastroenterol Nutr. 2011;52(5):581–584. doi: 10.1097/MPG.0b013e3181fd1315. [DOI] [PubMed] [Google Scholar]
- Hauser B, De Schlepper J, Caveliers V, et al. Variability of the 13 C-acetate breath test for gastric emptying of liquids in healthy children. J Pediatr Gatroenterol Nutr. 2006;42:392–397. doi: 10.1097/01.mpg.0000215306.40546.17. [DOI] [PubMed] [Google Scholar]
- Hauser B, De Schlepper J, Salvatore S, Salvatoni A, Vandenplas Y. Variability of the 13 C-octanoic acid breath test for gastric emptying of solids in healthy children. Aliment Pharmacol Therapeutics. 2006;23:1315–1319. doi: 10.1111/j.1365-2036.2006.02892.x. [DOI] [PubMed] [Google Scholar]
- Kindermann A, Demmelmeier H, Koletzko B, et al. Influence of age on 13C-urea breath test results in children. J Pediatr Gastroenterol Nutr. 2000;30:85–91. doi: 10.1097/00005176-200001000-00023. [DOI] [PubMed] [Google Scholar]
- Kyaw MH, Mayberry JF. Fructose malabsorption: true condition or a variance from normality. J Clin Gastroenterol. 2011;45(1):16–21. doi: 10.1097/MCG.0b013e3181eed6bf. [DOI] [PubMed] [Google Scholar]
- Lebenthal E, Rossi TM, Nord KS, Branski D. Recurrent abdominal pain and lactose absorption in children. Pediatrics. 1981;67:828–832. [PubMed] [Google Scholar]
- Romagnuolo J, Schiller D, Bailey RJ. Using breath tests wisely in a gastroenterology practice: an evidence-based review of indications and pitfalls in interpretation. Am J Gastroenterol. 2002;97:1113–1126. doi: 10.1111/j.1572-0241.2002.05664.x. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.2
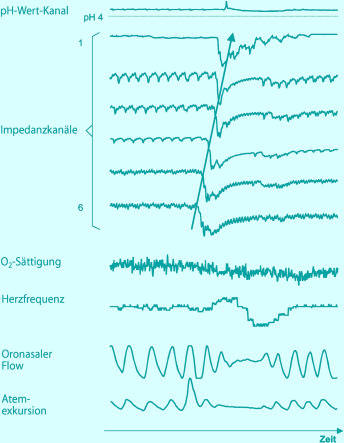
- Pilic D, Fröhlich T, Nöh F, et al. Detection of gastroesophageal reflux in children using combined multichannel intraluminal impedance and pH measurement: data from the German Pediatric Impedance Group. J Pediatr. 2011;158:650–654. doi: 10.1016/j.jpeds.2010.09.033. [DOI] [PubMed] [Google Scholar]
- Rommel N, Omari T. Abnormal pharyngoesophageal function in infants and young children: diagnosis with high-resolution manometry. J Pediatr Gastroenterol Nutr. 2011;52(1):29–30. doi: 10.1097/MPG.0b013e318213a4b8. [DOI] [PubMed] [Google Scholar]
- Vandenplas Y, et al. Esophageal pH and impedance measurement. In: Kleinmann R, Sanderson IR, Goulet O, et al., editors. Walkers pediatric gastrointestinal disease. 5. Hamilton: Decker; 2008. [Google Scholar]
- Vandenplas Y, Rudolph CD, Di Lorenzo C, et al. Pediatric gastroesophageal reflux clinical practice guidelines: joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN) J Pediatr Gastroenterol Nutr. 2009;49:498–547. doi: 10.1097/MPG.0b013e31819de871. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.3
- Caspary WF, Kist M, Stein J, editors. Infektiologie des Gastrointestinaltraktes. Berlin: Springer; 2006. [Google Scholar]
- CDC Diagnosis and management of foodborne illnesses. MMWR. 2004;53:RR04. [PubMed] [Google Scholar]
- Chen CC, Chang CJ, Lin TY, et al. Usefulness of fecal lactoferrin in predicting and monitoring the clinical severity of infectious diarrhea. World J Gastroenterol. 2011;17:4218–4224. doi: 10.3748/wjg.v17.i37.4218. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Clarke SC, Haigh RD, Freestone PPE, Williams PH. Virulence of enteropathogenic Escherichia coli, a global pathogen. Clin Microbiol Rev. 2003;16:365–378. doi: 10.1128/CMR.16.3.365-378.2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Desselberger U, van den Wolleswinkel Bosch J, Mrukowicz J, et al. Rotavirus types in Europe and their significance for vaccination. Pediatr Infect Dis J. 2006;25(1):30–41. doi: 10.1097/01.inf.0000195787.99199.4a. [DOI] [PubMed] [Google Scholar]
- Essers B, Burnens AP, Lanfrancini FM, et al. Acute community-acquired diarrhea requiring hospital admissions in Swiss children. Clin Infect Dis. 2000;30:192–196. doi: 10.1086/313901. [DOI] [PubMed] [Google Scholar]
- Friedrich AW, Zhang W, Bielaszewska M, et al. Prevalence, virulence profiles, and clinical significance of Shiga toxin-negative variants of enterohemorrhagic Escherichia coli O157 infection in humans. Clin Infect Dis. 2007;45:39–45. doi: 10.1086/518573. [DOI] [PubMed] [Google Scholar]
- Gill CJ, Lau J, Gorbach SL, Hamer DH. Diagnostic accuracy of stool assays for inflammatory bacterial gastroenteritis in developed and resource-poor countries. Clin Infect Dis. 2003;37:365–375. doi: 10.1086/375896. [DOI] [PubMed] [Google Scholar]
- Kist M. MiQ 9. Qualitätsstandards in der mikrobiologisch-infektiologischen Diagnostik: Infektionen des Darms. München: Urban & Fischer; 2000. [Google Scholar]
- Klein EJ, Boster DR, Stapp JR, et al. Diarrhea etiology in a children’s hospital emergency department: a prospective cohort study. Clin Infect Dis. 2006;43:807–813. doi: 10.1086/507335. [DOI] [PubMed] [Google Scholar]
- Lankisch PG, Mahlke R, Lübbers H, Lembcke B, Rösch W. Leitsymptom Diarrhö. Dtsch Ärztebl. 2006;103:A261–A268. [Google Scholar]
- Mercado EH, Ochoa TJ, Ecker L, et al. Fecal leukocytes in children infected with diarrheagenic Escherichia coli. J Clin Microbiol. 2011;49:1376–1381. doi: 10.1128/JCM.02199-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Oleson B, Neimann J, Böttiger B, et al. Etiology of diarrhea in young children in Denmark: a case-control study. J Clin Microbiol. 2005;43:3636–3641. doi: 10.1128/JCM.43.8.3636-3641.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Koch Institut, editor. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2010. Berlin: Robert Koch Institut; 2011. [Google Scholar]
- Robert Koch Institut (2011b) Abschließende Darstellung und Bewertung der epidemiologischen Erkenntnisse im EHEC O104:H4 Ausbruch Deutschland 2011. Robert Koch Institut, Berlin. http://www.rki.de/cln_116/nn_205760/DE/Content/InfAZ/E/EHEC/EHEC-Abschlussbericht,templateId=raw,property=publicationFile.pdf/EHEC-Abschlussbericht.pdf. Zugegriffen: 25. Februar 2012 t
- Servin AL. Pathogenesis of Afa/Dr diffusely adhering Escherichia coli. Clin Microbiol Rev. 2005;18:264–292. doi: 10.1128/CMR.18.2.264-292.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Thielman NM, Guerrant RL. Acute infectious diarrhea. N Engl J Med. 2004;350:38–47. doi: 10.1056/NEJMcp031534. [DOI] [PubMed] [Google Scholar]
- Vernacchio L, Vezina RM, Mitchell AA, et al. Diarrhea in American infants and young children in the community setting. Incidence, clinical presentation and microbiology. Pediatr Infect Dis J. 2006;25:2–7. doi: 10.1097/01.inf.0000195623.57945.87. [DOI] [PubMed] [Google Scholar]
- Wilson ME. Clostridium difficile and childhood diarrhea: cause, consequence, or confounder. Clin Infect Dis. 2006;43:814–816. doi: 10.1086/507342. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.4
- Castro-Rodríguez JA, Salazar-Lindo E, León-Barúa R. Differentiation of osmotic and secretory diarrhoea by stool carbohydrate and osmolar gap measurements. Arch Dis Child. 1997;77:201–205. doi: 10.1136/adc.77.3.201. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Fine KD, Schiller LR. AGA technical review on the evaluation and management of chronic diarrhea. Gastroenterology. 1999;116:1464–1486. doi: 10.1016/S0016-5085(99)70513-5. [DOI] [PubMed] [Google Scholar]
- Guittet L, Bouvier V, Mariotte N, et al. Comparison of a guaiac-based and an immunochemical fecal occult blood test in screening for colorectal cancer in a general average-risk population. Gut. 2007;56:210–214. doi: 10.1136/gut.2006.101428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Lundberg JO, Hellström PM, Fagerhol MK, Weitzberg E, Roseth AG. Technology insight: calprotectin, lactoferrin and nitric oxide as novel markers of inflammatory bowel disease. Nat Clin Pract Gastroenterol Hepatol. 2005;2:96–102. doi: 10.1038/ncpgasthep0094. [DOI] [PubMed] [Google Scholar]
- Mao R, Xiao YL, Gao X et al. (2012) Fecal calprotectin in predicting relapse of inflammatory bowel diseases: a meta-analysis of prospective studies. Inflam Bowel Dis. doi: 10.1002/ibd.22861 [DOI] [PubMed]
- Tibble JA, Bjarnason I. Non-invasive investigation of inflammatory bowel disease. World J Gastroenterol. 2001;7:460–465. doi: 10.3748/wjg.v7.i4.460. [DOI] [PMC free article] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.6
- Czaja AJ, Norman GL. Autoantibodies in the diagnosis and management of liver disease. J Clin Gastroenterol. 2003;37:315–329. doi: 10.1097/00004836-200310000-00011. [DOI] [PubMed] [Google Scholar]
- Hill ID, Dirks MH, Liptak GS, et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2005;40:1–19. doi: 10.1097/00005176-200501000-00001. [DOI] [PubMed] [Google Scholar]
- Reumaux D, Sendid B, Poulain D, et al. Serological markers in inflammatory bowel diseases. Best Pract Res Clin Gastroenterol. 2003;17:19–35. doi: 10.1053/bega.2002.0347. [DOI] [PubMed] [Google Scholar]
- Roggenbuck D, Hausdorf G, Martinez-Gamboa L, et al. Identification of GP2, the major zymogen granule membrane glycoprotein, as the autoantigen of pancreatic antibodies in Crohn's disease. Gut. 2009;58:1620–1628. doi: 10.1136/gut.2008.162495. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn 3.7
- Afdhal NH, Nunes D. Evaluation of liver fibrosis: a concise review. Am J Gastroenterol. 2004;99:1160–1174. doi: 10.1111/j.1572-0241.2004.30110.x. [DOI] [PubMed] [Google Scholar]
- Batres LA, Maller ES. Laboratory assessment of liver function and injury in children. In: Suchy FJ, Sokol RJ, Balistreri WF, editors. Liver disease in children. Philadelphia: Lippincott Williams & Wilkins; 2001. pp. 155–169. [Google Scholar]
- Becker M. Krankheiten der Leber: Entwicklung und Funktion. In: Lentze MJ, Schaub J, Schulte FJ, Spranger J, editors. Pädiatrie: Grundlagen und Praxis. Berlin: Springer; 2003. pp. 940–947. [Google Scholar]
- Schneider ARJ, Caspary WF, Stein J. 13C-basierte Atemtests in der Leberfunktionsdiagnostik. Z Gastroenterol. 2004;42:269–275. doi: 10.1055/s-2004-812833. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.8
- Bjarnason I, MacPherson A, Hollander D. Intestinal permeability: an overview. Gastroenterology. 1995;108:1566–1581. doi: 10.1016/0016-5085(95)90708-4. [DOI] [PubMed] [Google Scholar]
- Craig RM, Ehrenpreis ED. D-xylose testing. J Clin Gastroenterol. 1999;29:143–150. doi: 10.1097/00004836-199909000-00008. [DOI] [PubMed] [Google Scholar]
- Fine KD, Schiller LR. AGA technical review on the evaluation and management of chronic diarrhea. Gastroenterology. 1999;116:1464–1486. doi: 10.1016/S0016-5085(99)70513-5. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.9
- Chowdhury RS, Forsmark CE. Pancreatic function testing. Aliment Pharmacol Ther. 2003;17:733–750. doi: 10.1046/j.1365-2036.2003.01495.x. [DOI] [PubMed] [Google Scholar]
- Löser C, Möllgaard A, Fölsch UR. Faecal elastase 1: a novel, highly sensitive, and specific tubeless pancreatic function test. Gut. 1996;39:580–586. doi: 10.1136/gut.39.4.580. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Siegmund E, Löhr JM, Schuff-Werner P. The diagnostic validity of non-invasive pancreatic function tests - a meta-analysis. Z Gastroenterol. 2004;42:1117–1128. doi: 10.1055/s-2004-813604. [DOI] [PubMed] [Google Scholar]
Literatur zu Abschn. 3.10
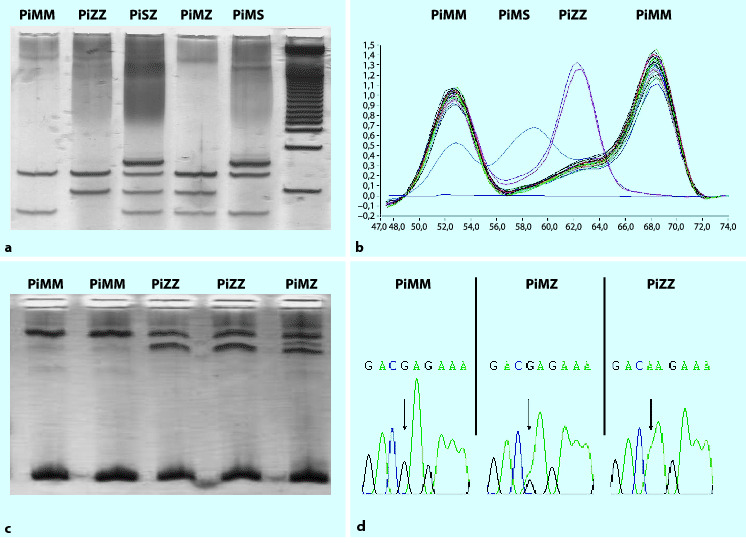
- Dequeker E, Cassiman JJ. Evaluation of CFTR gene mutation testing methods in 136 diagnostic laboratories: report of a large European external quality assessment. Eur J Hum Genet. 1998;6:165–175. doi: 10.1038/sj.ejhg.5200195. [DOI] [PubMed] [Google Scholar]
- Mullis KB, Faloona FA. Specific synthesis of DNA in vitro via a polymerase-catalyzed chain reaction. Methods Enzymol. 1987;155:335–350. doi: 10.1016/0076-6879(87)55023-6. [DOI] [PubMed] [Google Scholar]
- Orita M, Iwahana H, Kanazawa H, Hayashi K, Sekiya T. Detection of polymorphisms of human DNA by gel electrophoresis as single-strand conformation polymorphisms. Proc Natl Acad Sci USA. 1989;86:2766–2770. doi: 10.1073/pnas.86.8.2766. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Sanger F, Nicklen S, Coulson AR. DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci USA. 1977;74:5463–5467. doi: 10.1073/pnas.74.12.5463. [DOI] [PMC free article] [PubMed] [Google Scholar]