Zusammenfassung
Einleitung Die Stadt Jena, Thüringen, führte nach exponentiellem Anstieg der SARS-CoV-2 Infektionen bundesweit erstmalig eine Pflicht zur Bedeckung von Mund und Nase ein. Durch Screening einer unselektierten Kohorte von Schwangeren sollte eine Schätzung der SARS-CoV-2 Periodenprävalenz erfolgen. Von Interesse war die Frage nach der Dunkelziffer.
Methoden Bei stationärer Aufnahme erfolgte ein Screening sowie eine Antikörperbestimmungen auf SARS-CoV-2, mittels spezifischer Real-Time-PCR und Bestimmung spezifischer SARS-CoV-2 IgG im Serum mittels ELISA. Die Schätzung der SARS-CoV2 Periodenprävalenz erfolgte nach der exakten Methode von Clopper und Pearson, der Gruppenvergleich mit Fischers exaktem Test.
Ergebnisse Vom 06.04. bis 13.05.2020 wurden 234 Schwangere stationär aufgenommen. 225 (96,2%) durchgeführte SARS-CoV2 PCR verblieben negativ. Bei einer (0,6%) von 180 (76,9%) erfolgten Antikörperbestimmungen wurden spezifische IgG-Antikörper detektiert. Die Intervallschätzung der Periodenprävalenz ergibt damit ein 95%-Konfidenzintervall zwischen 0–1,7%. Für 96 Haushalten mit Kindern ergibt sich eine Periodenprävalenz von 0–3,8%, die sich nicht von der für 76 Haushalte ohne Kinder von 0–4,8% unterscheidet (p=1,00).
Diskussion Erstmalig wird die SARS-CoV-2 Periodenprävalenz einer unselektierten Stichprobe Schwangerer in Deutschland erfasst. Es ergab sich kein Hinweis für eine befürchtet hohe Dunkelziffer asymptomatischer Schwangerer für unbemerkte SARS-CoV-2 Infektionen mittels Antikörpernachweis. Die messbare Serokonversionsrate lag bei unter 1% (0,6%).
Schlüsselwörter: SARS-CoV-2, Periodenprävalenz, Schwangerschaft, Screening, Antikörpertest
Abstract
Introduction Following an exponential increase in SARS-CoV-2 infections, the city of Jena, Thuringia, was the first in Germany to introduce mandatory mouth and nose coverings. An estimation of the SARS-CoV-2 period prevalence was achieved by screening an unselected cohort of pregnant women. Of interest was the number of unreported cases.
Methods Upon admission to hospital, patients were screened for SARS-CoV-2 by a specific real-time PCR and antibodies determined by a specific SARS-CoV-2 IgG in serum by ELISA. The SARS-CoV-2 period prevalence was estimated using the Clopper–Pearson exact method, the group comparison with Fischerʼs exact test.
Results From 6 April to 13 May 2020, 234 pregnant women were admitted to the Department of Obstetrics. A total of 225 (96.2%) SARS-CoV-2 PCRs were carried out and all remained negative. Specific IgG antibodies were detected in one (0.6%) of 180 (76.9%) antibody tests performed. The interval estimate of the period prevalence thus results in a 95% confidence interval between 0–1.7%. For 96 households with children, the period prevalence is 0–3.8%, which does not differ from the 0–4.8% for 76 households without children (p=1.00).
Discussion This is the first report on the SARS-CoV-2 period prevalence of an unselected sample of pregnant women in Germany. Antibody testing showed no evidence of the feared high number of unreported asymptomatic SARS-CoV-2 infections. The seroconversion rate was below 1% (0.6%).
Key words: SARS-CoV-2, period prevalence, pregnancy, screening, antibody testing
Einleitung
Die Infektion mit dem erstmalig am 07.01.2020 isolierten 1 2 Coronavirus SARS-CoV-2 ist eine hochkontagiöse Tröpfcheninfektion, die sich von Mensch zu Mensch 3 überträgt und sich binnen weniger Monate global bis zur Pandemie ausbreitete. Deutschlandweit wurden krisenausgerichtete Maßnahmen zur Prävention der Infektionsausbreitung ergriffen. Hierbei waren neben zeitlichen auch deutliche regionale Unterschiede zu beobachten. Insbesondere im Gesundheitssystem wurden in Vorbereitung auf ein Massenaufkommen von intensivtherapiepflichtigen COVID-19 Patienten weitreichende Maßnahmen veranlasst, die zu einer radikalen Reduktion der elektiven Patientenversorgung in den Kliniken führte. Innerhalb des Gesundheitssystem kommt dabei der Geburtsmedizin eine Sonderposition zu, da die Versorgung Schwangerer und Gebärender grundsätzlich nicht elektiv sein kann und die Versorgung hier in fast unverändertem Umfang aufrechterhalten werden musste und wurde. Die Zusammensetzung des Kollektivs an Schwangeren und damit der Patientinnen in der Geburtsmedizin wurde daher durch die Maßnahmen zur Epidemie-Eingrenzung nicht beeinflusst. Schwangere stellen grundsätzlich eine unselektierte Stichprobe der ortsansässigen weiblichen Bevölkerung in der Altersgruppe zwischen 15 und 45 Jahren dar.
Die Stadt Jena musste im März 2020 einen exponentiellen Anstieg der SARS-CoV2 Infektionen verzeichnen ( Abb. 1 ) und galt als Hotspot des Infektionsgeschehens innerhalb Thüringens, wobei die meisten Infektionen in der Altersgruppe zwischen 15 und 34 Jahren auftraten ( Abb. 2 ).
Abb. 1.
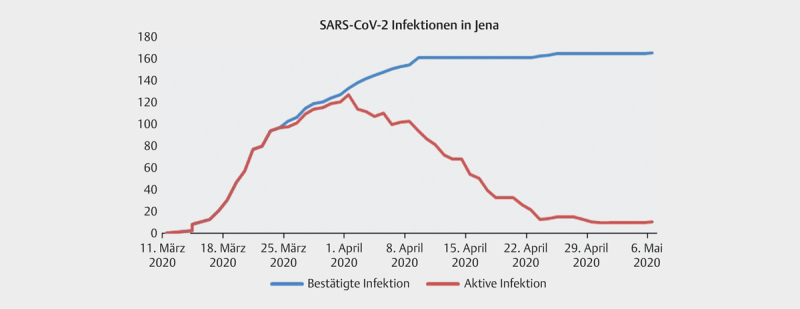
Fallzahlentwicklung SARS-CoV2-Infektion in Jena/Thüringen 15 Stand 11.05.2020.
Abb. 2.
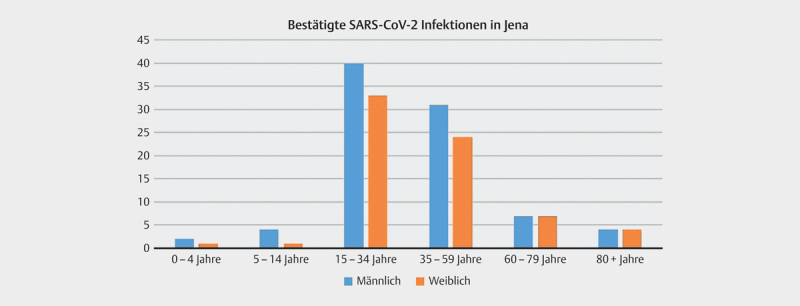
Bestätigte SARS-CoV2-Infektion nach Altersgruppen in Jena/Thüringen 15 Stand: 11.05.2020.
Parallel zu den deutschlandweiten Containmentmaßnahmen, wie der Schulschließung am 16.03.2020 wurden in Jena frühzeitig und konsequent weiterführende Maßnahmen ergriffen. So erließ die Stadt bereits am 10.03.2020 eine weitergehende Quarantäneverfügung für Rückkehrer aus Risikogebieten, und führte am 31.03.2020 als erste Stadt in Deutschland eine Pflicht zur Bedeckung von Mund und Nase ein.
Das Universitätsklinikum ist das Krankenhaus der Regelversorgung für die Stadt Jena und gleichzeitig überregionaler Maximalversorger mit Perinatalzentrum Level 1. Es stellt damit die zentrale Anlaufstelle für Schwangere und Gebärende innerhalb der Region dar. Das Universitätsklinikum führte am 06.04.2020 ein generelles PCR-Screening auf SARS-CoV-2 im Rachenabstrich bei allen stationär aufgenommen Patientinnen und Patienten ein. Seit dem 06.04.2020 wurden daher auch alle Patientinnen der Klinik für Geburtsmedizin des Universitätsklinikums Jena bei stationärer Aufnahme einem Screening auf SARS-CoV-2 unterzogen. Zusätzlich führten wir bei den Schwangeren eine Antikörperbestimmung gegen SARS-CoV-2 im Serum durch.
Die vorliegende Arbeit berichtet neben den Screening-Ergebnissen einer unselektierten Stichprobe schwangerer Frauen Schätzungen der Periodenprävalenz von SARS-CoV-2 Infektionen in der regionalen Bevölkerung. Gleichzeitig soll dabei der Einfluss von im Haushalt lebenden Kindern, die zum Zeitpunkt der Erfassung ganztags zu Hause betreut wurden, auf die Prävalenz der SARS-CoV-2 Infektionen berücksichtigt werden.
Material und Methodik
Vom 06.04.2020 bis 13.05.2020 wurden alle in der Klinik für Geburtsmedizin des Universitätsklinikums Jena stationär behandelten Patientinnen einem Screening auf SARS-CoV-2 unterzogen. Das Screening erfolgte mittels PCR-Testung aus Rachenspülwasser.
Der Direktnachweis von SARS-CoV-2 RNA im Untersuchungsmaterial erfolgte mit einer spezifischen Real-Time-PCR (TIBMOLBIOL, Berlin, Deutschland), bei der eine konservierte Region im E-Gen des Virus amplifiziert wurde. Die Antikörperbestimmung aus dem Serum für spezifisches SARS-CoV-2 IgG wurde mit einem qualitativen ELISA-System (Epitope Diagnostics, San Diego, USA) durchgeführt. Als Antigene werden laut Hersteller rekombinante Nukleokapsid-Strukturen als auch das Spike-Proteine verwendet.
Vorliegende Informationen zu den im Haushalt der Schwangeren betreuten Kindern wurden erfragt und gingen in die deskriptive statistische Auswertung ein. Auf Basis der Ergebnisse der PCR-Screening-Untersuchung und für die Subgruppe der Schwangeren mit Antikörpertest wurden exakte 95% Konfidenzintervalle für die Periodenprävalenz nach der Methode von Clopper und Pearson 4 kalkuliert. Für den Gruppenvergleich von Periodenprävalenzen verwendeten wir Fischers exakten Test und berichten zweiseitige exakte p-Werte; auf die Angabe von Effektschätzern des Gruppenvergleichs wurde verzichtet, da im Screening (ohne Antikörpertest) kein positives Testergebnis beobachtet wurde. Die Berechnungen erfolgen in R (Version 3.6.1).
Ergebnisse
Im Zeitraum vom 06.04.2020 bis 13.05.2020 wurden in der Klinik für Geburtsmedizin 234 Schwangere (Alter median 31 Jahre; min. 15, max. 45 Jahre) stationär betreut. Keine der Patientinnen hatte zur Aufnahme Symptome einer Covid-19 Erkrankung. Alle Patientinnen wurden aufgrund geburtshilflicher Indikationen betreut. Bei 225 (96,2%) wurde ein Screening auf SARS-CoV-2 RNA, bei 180 (76,9%) dieser Frauen zusätzlich ein Antikörpertest durchgeführt. Bei allen untersuchten Patientinnen kam es nicht zu einem Virusnachweis. Bei einer Patientin konnte ein positiver Antikörpertiter nachgewiesen werden (0,6%).
Informationen zu betreuten Kindern lagen zu 172 (95,6%) Frauen vor. Von diesen gaben 96 (55,8 %) an, eigene Kinder im Haushalt betreut zu haben. Insgesamt wurden 189 eigene Kinder und zusätzlich mindestens 36 weitere Kinder seit dem Tag der Schul- und Kindertagesstättenschließung ganztags betreut ( Abb. 3 ). Im Fall der IgG-positiv getesteten Schwangeren betrifft dies ihr eigenes 6-jähriges Kind.
Abb. 3.
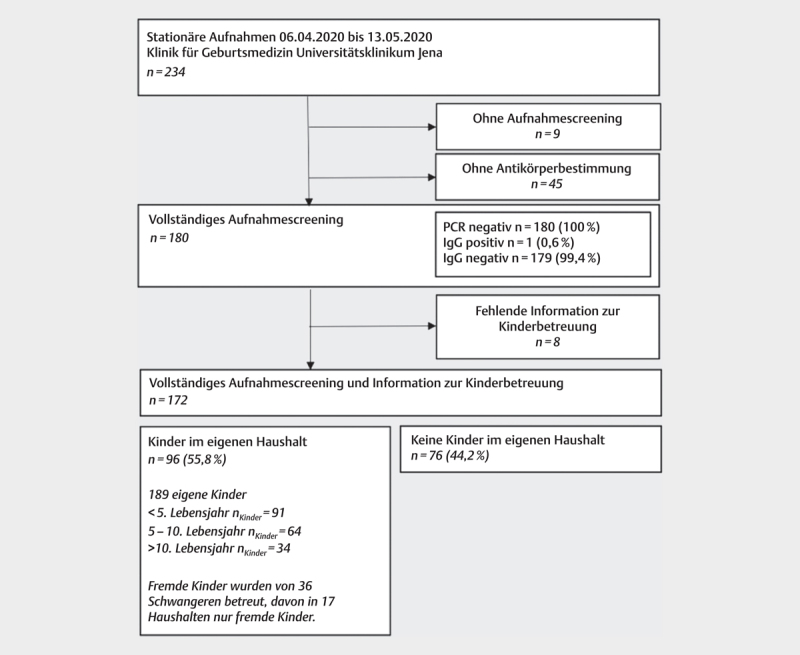
Zusammensetzung der Stichprobe.
Für 225 PCR-negativ getestete Schwangere ergibt sich für die Intervallschätzung der Periodenprävalenz ein 95%-Konfidenzintervall zwischen 0–1,7%. Aufgeteilt nach der Information zur Betreuung eigener Kinder im Haushalt ergibt die Schätzung der Periodenprävalenz einen Wert zwischen 0–3,8% für die 96 Haushalte mit eigenen Kindern und zwischen 0–4,8% für die 76 Haushalte ohne eigene Kinder im Haushalt. Es ergeben sich somit auch keine Hinweise auf Unterschiede zwischen diesen beiden Gruppen (p=1,0). Für den Antikörpertest ergab sich für die 180 Schwangeren, bei denen ein Test durchgeführt wurde, eine Punktschätzung der Periodenprävalenz von 0,6% mit einem 95%-Konfidenzintervall zwischen 0,01–3,1%.
Diskussion
Die vorliegende Arbeit beschreibt erstmalig für Deutschland die SARS-CoV-2 Prävalenz einer unselektierten Stichprobe schwangerer Frauen und der von ihnen betreuten Kinder bei zunächst exponentiell ansteigenden Infektionszahlen und daraufhin frühzeitig umgesetzten Containmentmaßnahmen.
Die klinische Manifestation der Infektion mit SARS-CoV-2 stellt sich variabel mit z. T. auch asymptomatischen Verläufen dar 5 . Aktuelle Screening-Untersuchungen schwangerer Frauen bei Hospitalisation in Regionen mit hohen Infektionsraten konnten einen relevanten Anteil SARS-CoV-2-positiver asymptomatischer Patientinnen von 6,2% (London) bis 32,6% (New York) nachweisen 6 7 8 .
Der Beginn des konsekutiven Screenings von Patientinnen bei stationärer Aufnahme in der Klinik für Geburtsmedizin und damit der Beginn des Rekrutierungszeitraumes der vorliegenden Stichprobe liegt eine Woche nach Inkrafttreten der Verfügung zur Bedeckung von Mund und Nase in Jena. Unsere prospektive Untersuchung fand im „steady state“ des lokalen Infektionsgeschehens statt ( Abb. 1 ). Die beschriebene Stichprobe gehört dabei der Altersgruppe mit der höchstens Fallzahl in Jena an ( Abb. 2 ).
Nahezu alle COVID-19 Infizierten weisen binnen 10–20 Tagen nach Symptombeginn ein positives IgG auf 9 . Dieser indirekte SARS-CoV-2 Nachweis ist v. a. für Patientinnen ohne oder mit milden Symptomen und später Vorstellung (mehr als 2 Wochen nach Symptombeginn) von Bedeutung, wenn die PCR zum Virusnachweis bereits wieder negativ ist. ELISA-basierte Antikörpertests weisen dabei eine Spezifität von >95% für die Diagnose von COVID-19 auf 9 . Limitiert wird die Interpretation der Antikörpertestung bisher durch die noch unklare zeitliche Dynamik der Serokonversion nach Infektion mit SARS-CoV-2 9 10 und das Ausmaß einer damit potentiell einhergehenden Immunität 11 . Der singuläre Nachweis von Antikörpern gegen SARS-CoV-2 in der untersuchten Kohorte zeigt, dass es während des exponentiellen Anstieges des Infektionsgeschehens zur Ausbildung einer messbaren, jedoch äußerst geringen Serokonversionsrate in dieser Bevölkerungsgruppe kam.
Seit der pandemiebedingten Schließung der Kindertageseinrichtungen und Schulen fungierten Schwangere Frauen, die bedingt durch Beschäftigungsverbot oder Mutterschutz zu Hause waren, als Betreuungsperson im häuslichen Umfeld. Bemerkenswerter Weise wurden, selbst in dieser Ausnahmesituation, im Rahmen der Solidargemeinschaften von jeder fünften Schwangeren auch haushaltsfremde Kinder mitbetreut. Insgesamt wurden in den Haushalten der getesteten Frauen 225 Kinder betreut.
Kinder aller Altersklassen können an COVID-19 erkranken. Klinische Verläufe sind in der Regel unspezifisch und milder als bei Erwachsenen 12 . Asymptomatische Verläufe werden mit ca. 15 % angegeben. Auch bei milder Symptomatik ist generell eine hohe Viruskonzentration in den Atemwegen nachweisbar 13 . Auch unter Berücksichtigung einer Inkubationszeit von durchschnittlich fünf Tagen (1–14 Tagen) und einer vermuteten Infektiosität von 1–2 Tagen vor bis ca. acht Tage nach Erkrankungsbeginn bei Kindern wird ein zumindest theoretisch hohes Übertragungspotential diskutiert, ist jedoch in seiner Bedeutung nicht abschließend geklärt 13 14 . Bei der hohen Kontagiösität des Virus kann jedoch davon ausgegangen werden, dass auch die Kinder der hier getesteten Schwangeren keine SARS-CoV-2 Infektion durchgemacht hatten. Dies ist umso bemerkenswerter, weil in Jena nahezu alle Kinder ab dem Alter von einem Jahr Ganztagseinrichtungen besuchen. Auch für die Partner der Schwangeren oder andere im Haushalt lebende Personen kann entsprechend vermutet werden, dass keine SARS-CoV-2 Infektion vorlag.
Unsere lokale, unselektierte Stichprobe liefert daher keine Hinweise auf eine befürchtet hohe Dunkelziffer an SARS-CoV-2 Infektionen in der asymptomatischen Bevölkerung, auch nicht in der Altersgruppe mit der höchsten erwarteten Prävalenz, zumindest in einer Region mit geringer Inzidenz.
Footnotes
Interessenkonflikt Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
Fazit für die Praxis.
Anhand des Screenings einer unselektierten Stichprobe schwangerer Frauen kann die Periodenprävalenz mit einem 95%-Konfidenzintervall zwischen 0–1,7% für Jena berechnet werden.
Eine befürchtete hohe Dunkelziffer SARS-CoV-2 Positiver konnte bei asymptomatischen Schwangeren nicht gezeigt werden, obwohl die Altersgruppe mit der höchsten erwarteten Prävalenz untersucht wurde.
Möglicherweise kann diese Beobachtung als Erfolg des frühen und konsequenten Handelns in Jena – Thüringen interpretiert werden.
Literatur
- 1.Phelan A L, Katz R, Gostin L O. The Novel Coronavirus Originating in Wuhan, China: Challenges for Global Health Governance. JAMA. 2020 doi: 10.1001/jama.2020.1097. [DOI] [PubMed] [Google Scholar]
- 2.Coronaviridae Study Group of the International Committee on Taxonomy of VThe species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2 Nat Microbiol 20205536–544. 10.1038/s41564-020-0695-z [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Wu Z, McGoogan J M. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72314 Cases From the Chinese Center for Disease Control and Prevention. JAMA. 2020 doi: 10.1001/jama.2020.2648. [DOI] [PubMed] [Google Scholar]
- 4.Clopper C J, Pearson E S.The Use of Confidence or Fiducial Limits Illustrated in the Case of the Binomial Biometrika 193426404–413.doi: 10.2307/2331986 [Google Scholar]
- 5.Kluge S, Janssens U, Welte T et al. Recommendations for critically ill patients with COVID-19. Med Klin Intensivmed Notfmed. 2020;115:175–177. doi: 10.1007/s00063-020-00674-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Sutton D, Fuchs K, D'Alton M et al. Universal Screening for SARS-CoV-2 in Women Admitted for Delivery. N Engl J Med. 2020 doi: 10.1056/NEJMc2009316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Khalil A, Hill R, Ladhani S et al. SARS-CoV-2 in pregnancy: symptomatic pregnant women are only the tip of the iceberg. Am J Obstet Gynecol. 2020 doi: 10.1016/j.ajog.2020.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Breslin N, Baptiste C, Gyamfi-Bannerman C et al. COVID-19 infection among asymptomatic and symptomatic pregnant women: Two weeks of confirmed presentations to an affiliated pair of New York City hospitals. Am J Obstet Gynecol MFM. 2020 doi: 10.1016/j.ajogmf.2020.100118. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Sethuraman N, Jeremiah S S, Ryo A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 2020 doi: 10.1001/jama.2020.8259. [DOI] [PubMed] [Google Scholar]
- 10.Jin Y, Wang M, Zuo Z et al. Diagnostic value and dynamic variance of serum antibody in coronavirus disease 2019. Int J Infect Dis. 2020;94:49–52. doi: 10.1016/j.ijid.2020.03.065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Hall M A, Studdert D M. Privileges and Immunity Certification During the COVID-19 Pandemic. JAMA. 2020 doi: 10.1001/jama.2020.7712. [DOI] [PubMed] [Google Scholar]
- 12.Dong X C, Li J M, Bai J Y et al. Epidemiological characteristics of confirmed COVID-19 cases in Tianjin. Zhonghua Liu Xing Bing Xue Za Zhi. 2020;41:638–642. doi: 10.3760/cma.j.cn112338-20200221-00146. [DOI] [PubMed] [Google Scholar]
- 13.Ryu S, Chun B C.Korean Society of Epidemiology -nCo VTFT. An interim review of the epidemiological characteristics of 2019 novel coronavirus Epidemiol Health 202042e2020006doi: 10.4178/epih.e2020006 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Park J Y, Han M S, Park K U et al. First Pediatric Case of Coronavirus Disease 2019 in Korea. J Korean Med Sci. 2020;35:e124. doi: 10.3346/jkms.2020.35.e124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Jena. corona_erkrankungen_jena.csv. In2020


