Abstract
Contexte et objectif
L’enzyme de conversion de l’angiotensine (ACE) de type 2 est le récepteur du virus SARS-CoV-2 sur les pneumocytes. L’expression de l’ACE-2 est modulée par les inhibiteurs de l’enzyme de conversion (IEC) et les antagonistes des récepteurs à l’angiotensine II (ARA2) largement utilisés en cardiologie. Ceci a interrogé sur d’éventuels liens entre ces traitements et la vulnérabilité aux pneumopathies liées au COVID-19 ou leur sévérité. L’objectif de la présente étude était d’analyser l’association entre un traitement par IEC/ARA2 et les formes graves de COVID-19.
Méthodes
Nous avons suivi prospectivement 433 patients consécutifs hospitalisés pour COVID-19 confirmée par PCR ou hautement suspectée sur les données cliniques, biologiques, radiologiques et inclus dans l’étude COVHYP. La survie et les formes graves de COVID-19 (décès, réanimation, ou hospitalisation > 30 jours) ont été comparées chez les patients recevant ou non des IEC/ARA2. Le taux de suivi hospitalier a été de 100 %, et à un mois ou plus de 96,5 %.
Résultats
L’âge moyen des patients était de 64 ± 17 ans, 40 % étaient des femmes. Au suivi moyen de 78 ± 50 jours, 136 (31 %) ont eu une forme grave de COVID-19 (64 décès, 73 séjour en réanimation et 49 hospitalisations >30 jours). L’hypertension (55,1 % vs 36,7 % ; p < 0,001) et la présence d’un traitement antihypertenseur étaient associés aux formes graves ainsi qu’à la mortalité globale. L’association univariée entre le traitement par IEC/ARA2 et les formes graves (Odds Ratio 1,74 IC95 % [1,14–2,64] ; p = 0,01) n’a pas été confirmée après ajustement sur l’âge, le sexe et l’hypertension (OR ajusté 1,13 [0,59–2,15] ; p = 0,72). Le diabète, l’hypothyroïdie étaient associés aux formes graves, l’antécédent d’asthme aux formes non graves.
Conclusion
Le traitement par IEC/ARA2 n’est pas associé aux formes graves, à la mortalité hospitalière, ni à la mortalité à 1 ou 2 mois des patients hospitalisés pour COVID-19, après ajustement sur les facteurs de confusion. A contrario, les antagonistes du système rénine-angiotensine-aldostérone, principalement les ARA2, ne semblent pas avoir d’effet protecteur sur les pneumopathies graves de la COVID-19.
Keywords: COVID-19, Inhibiteurs de l’enzyme de conversion, Antagoniste des récepteurs à l’Angiotensine II, Système Rénine-Angiotensine-Aldostérone, Hypertension
Abstract
Background and aim
Angiotensin converting enzyme (ACE) type 2 is the receptor of SARSCoV-2 for cell entry into lung cells. Because ACE-2 may be modulated by ACE inhibitors (ACEIs) and angiotensin II receptor blockers (ARBs), there are concern that patients treated with ACEIs and ARBs are at higher risk for COVID-19 infection or severity. This study sought to analyse the association of severe forms of COVID-19 and mortality with hypertension and a previous treatment with ACEI and ARB.
Methods
Prospective follow-up of 433 consecutive patients hospitalised for COVID-19 pneumonia confirmed by PCR or highly probable on clinical, biological, and radiological findings, and included in the COVHYP study. Mortality and severe COVID-19 (criteria: death, intensive care unit, or hospitalisation > 30 days) were compared in patients receiving or not ACEIs and ARBs. Follow-up was 100% at hospital discharge, and 96.5% at > 1 month.
Results
Age was 63.6 ± 18.7 years, and 40%) were female. At follow-up (mean 78 ± 50 days), 136 (31%) patients had severity criteria (death, 64 ; intensive care unit, 73; hospital stay > 30 days, 49). Hypertension (55.1% vs 36.7%, P < 0.001) and antihypertensive treatment were associated with severe COVID-19 and mortality. The association between ACEI/ARB treatment and COVID-19 severity criteria found in univariate analysis (Odds Ratio 1.74, 95%CI [1.14–2.64], P = 0.01) was not confirmed when adjusted on age, gender, and hypertension (adjusted OR1.13 [0.59–2.15], P = 0.72). Diabetes and hypothyroidism were associated with severe COVID-19, whereas history of asthma was not.
Conclusion
This study suggests that previous treatment with ACEI and ARB is not associated with hospital mortality, 1- and 2-month mortality, and severity criteria in patients hospitalised for COVID-19. No protective effect of ACEIs and ARBs on severe pneumonia related to COVID-19 was demonstrated.
Keywords: COVID-19, Angiotensin-Converting Enzyme Inhibitors, Angiotensin II Receptor Blockers, Renin-Angiotensin System, Hypertension
1. Introduction
L’infection actuelle à coronarivus 2019 (COVID-19), due au “Severe Acute Respiratory Syndrome CoronaVirus-2” (SARS-CoV-2), a été déclarée pandémie mondiale par l’Organisation mondiale de la Santé le 1er mars 2020, et reste un défi pour l’ensemble de la communauté scientifique et médicale. Les liens entre COVID-19, le système rénine angiotensine aldostérone (SRAA) et ses inhibiteurs ont fait l’objet de débats animés en mars-avril 2020. Le SARS-CoV-2 utilise l’enzyme de convention de l’angiotensine (ACE) de type 2 comme récepteur cellulaire pour son entrée dans les cellules cibles [1], [2]. L’ACE-2 est par ailleurs une enzyme clé du SRAA, et il a été démontré que l’expression de l’ACE-2 est modulée par les inhibiteurs de l’ACE (IEC) et les antagonistes des récepteurs à l’angiotensine II (ARA2) [3], [4]. L’ACE-2 est susceptible d’avoir des effets protecteurs contre les lésions pulmonaires induites par différents agents pathogènes, viraux ou non, parce qu’elle dégrade l’angiotensine II en angiotensine-(1-7) [5]. Les effets de l’inhibition du SRAA sur l’expression de l’ACE-2 sont complexes, et finalement peu étudiés chez l’homme [8], [9]. Il n’a pas été démontré d’effets significatifs d’un traitement antérieur par IEC ou ARA2 sur la vulnérabilité au COVID-19 dans la population générale [10], [11], [12], [13], bien qu’il existe quelques éléments suspects chez les patients hospitalisés [10], [14].
Une fois les patients infectés, il existe des arguments théoriques pour un éventuel effet protecteurs des antagonistes du SRAA, du moins les ARA2. En effet, il a été démontré que les ARA2 protègent contre les lésions pulmonaires induites dans différents modèles animaux de syndrome de détresse respiratoire aiguë (SDRA) d’origine infectieuse ou non [5], [15], [16], [17]. Chez l’homme atteint de COVID-19, deux premières méta-analyses, avec de nombreuses études chinoises initiales, ont montré une tendance à la réduction de la mortalité chez les patients COVID-19 hypertendus [18] ou non [19], mais avec une hétérogénéité. Une revue plus récente de 13 études rétrospectives et une étude cas-témoins, pas toutes publiées, montre une tendance à l’absence de différence entre les patients ayant ou non reçu des IEC/ARA2 pour la survenue de formes sévères [20].
L’étude « COVID-19 et hypertension » (COVHYP) avait pour but, d’une part d’analyser rétrospectivement les éventuelles associations entre l’hypertension artérielle, les traitements antihypertenseurs, essentiellement IEC et ARA2 et le risque de COVID-19, et d’autre part d’étudier prospectivement les liens entre les inhibiteurs du SRAA et la sévérité de la pneumopathie de la COVID-19. Les résultats de la première partie de l’étude ont été soumis à publication [14]. Nous présentons ici les résultats de la seconde partie, avec suivi prospectif d’une cohorte de patients consécutifs hospitalisés pour COVID-19.
2. Méthodes
2.1. Description de l’étude COVHYP
L’étude COVID-19 et hypertension (COVHYP) a été planifiée prospectivement en mars 2020, au début de l’épidémie de COVID-19 dans la région d’Ile de France. Elle comportait deux phases, une phase rétrospective destinée à analyser les liens entre l’infection pulmonaire à SARS-Cov-2 et un antécédent d’hypertension artérielle et un traitement par IEC ou ARA2, par la comparaison de deux séries de patients atteints ou non de la COVID-19, et une partie prospective récoltant les données de suivi des patients COVID-19 et destinée à analyser les liens entre la sévérité de l’atteinte liée au COVID-19, l’hypertension et les traitements du SRAA. L’étude COVHYP a été enregistrée en mars 2020 sur le site clinicaltrial.gov (NCT04374695). Elle a été conduite selon les principes de la déclaration d’Helsinki, son protocole a été approuvé par le comité de protection des personnes Ouest VI (CPP 1296 HPS3 ; Numéro 2020-A01516-33). Les patients ou leur représentant légal ont reçu une information et ont pu exprimer leur non-opposition.
2.2. Population d’étude
Tous les patients consécutifs consultant au service d’accueil des urgences du Centre Hospitalier de Versailles (CHV) entre le 10 mars et le 15 avril 2020 pour suspicion de COVID-19 et dont l’état clinique a nécessité l’hospitalisation dans une unité de court séjour (24–72 h) dite “Pré COVID-19” ont été évalués pour inclusion dans l’étude. Les 3 unités « Pré COVID » mises en place dans les services d’urgence, de cardiologie et de diabétologie avaient pour objectif d’admettre les patients suspects de COVID-19 nécessitant une prise en charge hospitalière en attendant le résultat de la recherche d’ARN viral dans le prélèvement naso-pharyngé et leur orientation vers, soit un service dédié au COVID-19, soit une unité d’hospitalisation « non-COVID », soit un retour à domicile. Les critères d’hospitalisation des patients suspects de COVID-19 étaient, conformément aux recommandations officielles en vigueur, la présence d’au moins un critère de sévérité (fréquence respiratoire > 22/min, SpO2 en air ambiant < 90 %, pression artérielle systolique < 90 mmHg, altération de la conscience, aggravation rapide de l’état général ou déshydratation chez la personne âgée) ou bien d’un antécédent médical considéré à haut risque pour la COVID-19 (liste en matériel supplémentaire).
Les patients ont été inclus s’ils remplissaient les critères suivants :
-
•
âge ≥ 18 ans ;
-
•
présentation clinique évocatrice de pneumopathie COVID-19, au minimum : fièvre > 38 °C ou syndrome pseudo grippal (asthénie intense, myalgies, frissons, courbatures) associé à une toux ou une dyspnée ou la nécessité d’une oxygénothérapie (SpO2 ≤ 90 %) ;
-
•
réalisation d’un test par « reverse transcriptase–polymerase chain reaction » (RT-PCR) de la présence d’acide ribonucléique viral du SARS-CoV-2 dans un prélèvement nasopharyngé ou d’expectoration.
Les critères d’exclusion étaient l’absence de signes cliniques de COVID-19, l’absence de test RT-PCR, un âge < 18 ans, un statut de prisonnier ou détenu, et le refus de participer.
La confirmation de la présence du SARS-Cov-2 était définie comme un résultat positif de RT-PCR dans les secrétions nasopharyngées ou pulmonaires, en accord avec le Centre National de Référence des virus respiratoires et les recommandations de l’OMS [21]. Le cas échéant, une seconde RT-PCR était réalisée dans les prélèvements de crachats ou d’aspiration bronchique, lorsque la probabilité clinico-radiologique de COVID-19 était élevée et que la première PCR nasopharyngée était négative. La quasi-totalité des patients a eu une radiographie thoracique ou un scanner thoracique aux urgences. Les traitements antihypertenseurs ou cardiaques ont été poursuivis lors de l’hospitalisation.
2.3. Définition des groupes et des formes graves de COVID-19
Deux groupes de patients, avec ou sans COVID-19 ont été définis en fonction des résultats de la RT-PCR pour le SARS-CoV-2, l’imagerie pulmonaire et la présentation clinique et biologique. Pour la présente étude prospective, seuls les patients avec COVID-19 confirmée par PCR ou hautement probable sur les données radiologiques, cliniques et biologiques malgré une PCR négative, ont été inclus.
Le critère principal d’évaluation était la survenue d’une forme grave de COVID-19 pendant la durée totale du suivi, définie par la survenue d’un décès et/ou la nécessité d’un séjour en réanimation ou unité de soins continus, et/ou une durée d’hospitalisation initiale en soins aigus liée au COVID-19 ≥ 30 jours. Les critères secondaires étaient les composantes du critère principal, ainsi que le statut clinique à un mois. Les traitements antihypertenseurs, IEC, ARA2, ont été poursuivis normalement à l’admission et, sauf raison médicale contraire (hypotension, choc), pendant toute la durée du séjour.
2.4. Collection des données
Les données cliniques, radiologiques et biologiques ont été enregistrées à partir du dossier médical. Les données enregistrées ont été les suivantes : âge, sexe, symptômes initiaux, délai entre les premiers symptômes évocateurs de COVID-19 et l’admission, résultats de la radiographie ou du scanner thoracique, résultats de la ou des RT-PCR, antécédents d’hypertension, traitement au long cours pour l’hypertension, l’insuffisance cardiaque ou la cardiopathie ischémique, en particulier les inhibiteurs du SRAA (IEC, ARA2, inhibiteurs des récepteurs aux minéralocorticoïdes). Les comorbidités suivantes ont été relevées : asthme, maladie pulmonaire chronique obstructive, autres maladies pulmonaires chroniques, syndrome d’apnée du sommeil, obésité, diabète, maladies cardiaques chroniques (détail dans Tableau 2), cancer, hypothyroïdie, allergies, et immunodépression.
Tableau 2.
Association des comorbidités et des formes graves de COVID-19.
| Tous patients | Forme grave de COVID-19 |
Valeur de P | ||
|---|---|---|---|---|
| Oui |
Non |
|||
| N = 433 | N = 136 | N = 297 | ||
| Hypertension (%) | 184 (42,5) | 75 (55,1) | 109 (36,7) | < 0,001 |
| Cardiopathie chronique (%) | 96 (22,2) | 40 (29,4) | 56 (18,9) | 0,02 |
| Insuffisance coronaire (%) | 31 (7,1) | 12 (8,8) | 19 (6,4) | 0,37 |
| Myocardiopathie dilatée (%) | 3 (0,7) | 1 (0,7) | 2 (0,7) | 0,68 |
| Myocardiopathie hypertrophique (%) | 2 (0,5) | 1 (0,7) | 1 (0,3) | 0,53 |
| Valvulopathie (%) | 15 (3,4) | 6 (4,4) | 9 (3,0) | 0,47 |
| Troubles du rythme (%) | 44 (10,2) | 17 (12,5) | 27 (9,8) | 0,27 |
| Insuffisance cardiaque congestive (%) | 10 (2,3) | 5 (3,7) | 5 (1,7) | 0,26 |
| Inhibiteurs du SRAA et autres antihypertenseurs | ||||
| IEC | 55 (12,7) | 23 (16,9) | 32 (10,8) | 0,08 |
| ARA2 | 90 (20,8) | 34 (25,0) | 56 (18,9) | 0,15 |
| IEC ou ARA2 | 145 (33,5) | 57 (41,9) | 88 (29,6) | 0,02 |
| Anti- aldostérone | 5 (1,2) | 2 (1,5) | 3 (1,0) | 0,50 |
| Tous inhibiteurs du SRAA | 148 (33,9) | 58 (42,6) | 89 (30,1) | < 0,01 |
| Autres antihypertenseursa | 33 (7,6) | 15 (11,0) | 18 (6,1) | 0,07 |
| Asthme (%) | 37 (8,5) | 4 (2,9) | 33 (11,1) | < 0,01 |
| Maladie pulmonaire chroniques (%) | 30 (6,9) | 10 (7,4) | 20 (6,7) | 0,81 |
| BPCO (%) | 24 (5,5) | 6 (4,4) | 18 (6,1) | – |
| MPCR et autres (%) | 6 (1,4) | 4 (2,9) | 2 (0,6) | – |
| Syndrome d’apnée du sommeil (%) | 18 (4,2) | 6 (4,4) | 12 (4,0) | 0,85 |
| Diabète sucré | 76 (17,6) | 33 (24,3) | 43 (14,5) | 0,013 |
| Type 1 (%) | 1 (0,2) | 0 (0,0) | 1 (0,3) | – |
| Type 2, oral traitement (%) | 59 (13,6) | 27 (19,9) | 32 (10,8) | – |
| Type 2, insuline (%) | 16 (3,7) | 6 (4,4) | 10 (3,4) | – |
| Obésité (IMC > 30 kg/m2) (%) | 57 (13,2) | 23 (16,9) | 34 (11,4) | 0,12 |
| Antécédent personnel de cancer (%) | 62 (14,3) | 25 (18,4) | 37 (12,5) | 0,11 |
| Immunosuppression (%) | 28 (6,5) | 7 (5,1) | 21 (7,1) | 0,45 |
| Allergie (%) | 51 (11,8) | 14 (10,3) | 37 (12,5) | 0,52 |
| Hypothyroïdie (%) | 43 (9,9) | 21 (15,4) | 22 (7,4) | < 0,01 |
IEC : inhibiteur de l’enzyme de conversion; ARA2 : antagoniste des récepteurs à l’angiotensine II; SRAA : système rénine angiotensine aldostérone; BPCO : bronchopneumopathie chronique obstructive; MPCR : maladie pulmonaire chronique restrictive; IMC indice de masse corporelle.
Autres antihypertenseurs : bétabloquants, inhibiteurs calciques, diurétiques, centraux.
Le suivi a été réalisé par le recueil de l’ensemble des comptes rendus d’hospitalisation, le contact téléphonique des patients ou de la personne de confiance, et le cas échéant du médecin traitant au moins un mois après le début de l’hospitalisation.
2.5. Analyse statistique
Les variables continues sont présentées par la moyenne ± l’écart type ou la médiane et les quartiles, selon leur distribution, et ont été comparées entre les groups par analyse de variance ou test non paramétrique U de Mann–Whitney. Les données catégorielles sont présentées par les effectifs et les pourcentages, et ont été comparées par le test du χ2 ou le test exact de Fischer. Les comparaisons multivariées entre groupes ont été réalisées par régression logistique multivariée, avec ajustement sur l’âge, le sexe, l’obésité (indice de masse corporelle > 30 kg/m2), l’hypertension et les antécédents de cardiopathie.
Les analyses de survie ont été réalisées par la méthode de Kaplan-Meier, les comparaisons entre groupes ont été réalisées par test du Log Rank en univarié, ou par modèle de Cox pour les analyses multivariées. Une valeur de P < 0,05 a été considérée comme significative. Les analyses ont été réalisées à l’aide des logiciels SPSS® version 19.0 software (SPSS Inc., Chicago, IL) et R version i386 3.6.2.
3. Résultats
3.1. Caractéristiques de base des patients
Pendant la période d’étude 763 patients consécutifs ont été hospitalisés dans une des 3 unités de court séjour “Pré COVID-19” du CHV, 79 ont été exclus (liste des causes d’exclusion en matériel supplémentaire), et 684 ont été inclus dans l’étude COVHYP. Le diagnostic de COVID-19 a été retenu chez 433 patients, confirmé par RT-PCR chez 394 (91 %) ou hautement probable sur les critères cliniques, biologiques et scannographiques chez 39 (9 %), La présente étude porte sur le suivi de ces 433 patients COVID-19, dont les caractéristiques de base, démographie, symptômes initiaux, recours à l’imagerie pulmonaire, figurent dans le Tableau 1 .
Tableau 1.
Caractéristiques de base à l’admission et critères de formes graves de COVID-19.
| Tous Patients |
Forme grave de COVID-19 |
|||
|---|---|---|---|---|
| N = 433 | Oui N = 136 | Non N = 297 | Valeur de P | |
| Âge | 63,9 ± 17,1 | 70,5 ± 14,9 | 60,9 ± 17,2 | < 0,001 |
| Âge > = 65 ans | 215 (49,6) | 88 (64,7) | 127 (42,7) | < 0,001 |
| Âge > = 80 ans | 93 (21,5) | 44 (32,3) | 49 (16,5) | < 0,001 |
| Femmes (%) | 174 (40,2) | 54 (39,7) | 120 (40,4) | 0,89 |
| Critères de sévérité | ||||
| Décès (%) | 64 (14,8) | 64 (14,8) | 0 (0,0) | – |
| Réanimation ou USC (%) | 73 (16,9) | 73 (16,9) | 0 (0,0) | – |
| Hospitalisation > 30 jours (%) | 49 (11,3) | 49 (11,3) | 0 (0,0) | – |
| Symptômes initiaux | ||||
| Fièvre ou syndrôme grippal (%) | 431 (99,5) | 134 (98,5) | 297 (100,0)) | 0,10 |
| Toux (%) | 299 (69,1) | 80 (58,8) | 219 (73,7) | < 0,01 |
| Dyspnée (%) | 327 (75,5) | 118 (86,8) | 209 (70,4) | < 0,001 |
| Dl thoraciques/palpitations (%) | 55 (12,7) | 11 (8,1) | 44 (14,8) | 0,06 |
| Symptômes ORL (%) | 84 (19,4) | 19 (14,0) | 65 (21,9) | 0,06 |
| Symptômes digestifs (%) | 123 (28,4) | 31 (22,8) | 92 (31,0) | 0,08 |
| Symptômes neurologiques (%) | 77 (17,8) | 24 (17,6) | 53 (17,8) | 0,96 |
| SpO2 ≤ 96 % (%) | 378 (87,3) | 130 (95,7) | 248 (83,6 | < 0,001 |
| Délai symptômes-admission (jours) | ||||
| Moyenne ± SD | 7,6 ± 4,0 | 6,8 ± 3,8 | 7,9 ± 4,1 | – |
| Médiane [quartiles] | 7,0 [5,0–10,0] | 7,0 [4,0–9,0] | 7,0 [5,0–10,0] | |
| Scanner thoracique | ||||
| Réalisé (%) | 319 (73,7) | 79 (58,1) | 240 (80,8) | < 0,001 |
| Diagnostic de COVID-19 (%) | ||||
| Certain ou très probable | 283/319 (88,7) | 68/79 (86,1) | 215/240 (89,6) | 0,42 |
| Possible | 24/319 (7,5) | 6/79 (7,6) | 18/240 (7,5) | |
| Pas de signe de COVID-19 | 12/319 (3,8) | 5/79 (6,3) | 7/240 (2,9) | |
| Extension des lésions suspectes de COVID-19 (%) | ||||
| < 10 % | 54/307 (17,6) | 7/74 (9,5) | 47/233 (20,2) | < 0,001 |
| 10–24 % | 130/307 (42.3) | 23/74 (31,1) | 107/233 (45,9) | |
| 25–50 % | 94/307 (30,6) | 27/74 (36,5) | 67/233 (28,8) | |
| > 50 % | 29/307 (9,4) | 17/74 (23,0) | 12/233 (5,2) | |
USC unité de soins continus. SpO2: saturation périphérique en oxygène; Dl : douleur. Symptômes ORL : congestion nasale, rhinorrhée, agueusie, anosmie; nasal congestion, rhinorrhée, odynodysphagie. Symptômes digestifs : douleurs abdominales, nausées, vomissements, perte d’appétit. Symptômes neurologiques : céphalée sévère, modification brutale du comportement, convulsions, troubles de conscience, syncope.
3.2. Suivi clinique
Les données du suivi hospitalier ont été obtenues pour la totalité des patients, et celles du suivi à un mois ou plus chez 414 patients (95,6 %). La durée moyenne du suivi après l’admission a été de 78 ± 50 jours (médiane [quartiles] 64 [39–133] jours, maximale 157 jours).
Un séjour en réanimation a été nécessaire pour 73 patients (17 %), et 63 (15 %) ont nécessité un séjour en SSR. La durée moyenne d’hospitalisation en soins aigus a été de 14 ± 14 jours (médiane 9 jours [5–16]), et la durée totale d’hospitalisation incluant les soins de suite et de réadaptation (SSR) a été de 17 ± 20 jours (médiane 10 jours [5–20]). Les patients transférés l’ont été dans 22 centres hospitaliers de proximité, 12 publics et 10 privés, et 7 patients hospitalisés en réanimation au CHV ont été transférés secondairement hors Île de France (Centres hospitalier universitaires de Rouen et de Rennes).
3.3. Évènements à 30 jours
À 30 jours, 56 patients (14 %) étaient décédés (1 à domicile en EPADH et 55 lors du séjour hospitalier dont 9 en réanimation, 45 en médecine ou gériatrie, considérés comme non réanimatoires, et 1 en SSR), 53 (13 %) étaient encore hospitalisés (14 en réanimation, 12 en médecine aiguë et 27 en SSR) et 299 (73 %) avaient pu regagner leur domicile. La probabilité actuarielle de survie à J30 n’était pas significativement différente selon l’existence ou non d’une hypertension artérielle, d’un traitement antihypertenseur, ou d’un traitement inhibiteur du SRAA (Fig. 1 ).
Fig. 1.
Courbes de survie des patients hospitalisés pour COVID-19, selon la présence ou d’un antécédent d’hypertension artérielle, d’un traitement antihypertenseur, d’un traitement par inhibiteurs du système rénine angiotensine (SRAA), et d’un traitement par antagonistes des récepteurs de type1 à l’angiotensine II (ARA2).
3.4. Mortalité globale et facteurs pronostiques
À l’issue de la période totale de suivi (médiane 2 mois), 64 patients étaient décédés : 11 en réanimation (17 %) et 45 en service de médecine aigue (délai médian admission-décès 9 jours), 2 en SSR, 3 à domicile (2 en EPADH), et 3 à l’occasion d’une réhospitalisation sans lien direct avec la COVID-19 (accident vasculaire cérébral, cancer métastasé, déshydratation sévère). La Fig. 1 montre les courbes de survie en fonction d’un antécédent d’hypertension, d’un traitement antérieur antihypertenseur, d’un traitement antérieur par inhibiteur du SRAA et par ARA2. L’hypertension (p = 0,04) et la présence d’un traitement antihypertenseur (p = 0,02) étaient associés à une mortalité légèrement supérieure, mais aucune différence significative de mortalité n’a été observée entre les patients recevant ou non des inhibiteurs du SRAA ou des ARA2. En analyse multivariée (modèle de Cox), les seuls facteurs indépendamment associés aux décès étaient l’âge (p < 0,0001), la dyspnée et la désaturation à l’arrivée (p < 0,05) et la nécessité de la réanimation (p = 0,018).
3.5. Formes graves de COVID et traitement par IEC ou ARA2
Les formes graves de COVID-19, critère composite associant les décès (n = 64), les séjours en réanimation (n = 73) et les hospitalisations de plus de 30 jours (n = 49), ont concerné au total 136 (31 %) patients, certains cumulant plusieurs critères. Outre un plus grand âge, la toux, la dyspnée et la SaO2 < 96 % étaient associés aux formes graves (Tableau 1). Le scanner thoracique a moins souvent été réalisé en urgence dans les formes graves, soit qu’il n’était pas réalisable devant l’aggravation rapide, la nécessité d’intubation ou de transfert en réanimation, soit que la simple radiographie de thorax était suffisante au diagnostic de pneumopathie aigue. Par contre, lorsque le scanner a été réalisé, l’extension des lésions était plus importante dans les formes graves, près de 60 % des patients ayant des lésions étendues ou sévères (Tableau 1).
Le Tableau 2 montre les fréquences des comorbidités dans les formes graves ou non de COVID-19. En analyse univariée, un antécédent de diabète, d’hypothyroïdie, une hypertension artérielle et un traitement par inhibiteur du SRAA étaient significativement plus fréquents dans les formes graves, au contraire de l’asthme, plus rare chez les patients ayant une forme grave de COVID-19 (Tableau 2).
Cependant, l’association entre traitement par IEC ou ARA2 et formes graves de COVID-19 n’a pas été confirmée après ajustement sur l’âge, le sexe, et l’hypertension artérielle (OR ajusté 1,13 [0,59–2,15], p = 0,72), ni les associations entre les inhibiteurs du SRAA et chaque critère secondaire constitutif du critère principal (mortalité, réanimation, hospitalisation > 30 jours) (Tableau 3 ).
Tableau 3.
Risques relatifs de décès ou formes graves de COVID-19 associés aux traitements inhibiteurs du SRAA.
| N (%) |
Modèle non ajusté |
Modèle Ajustéb |
||||
|---|---|---|---|---|---|---|
| Traitement par IEC/ARA2 | Pas d’EC/ARA2 | Odds Ratio [IC 95 %] | Valeur de p | Odds Ratio [IC 95 %] | Valeur de p | |
| Critère principal | ||||||
| Forme grave de COVID-19a | 58/147 (39,5) | 78/286 (27,3) | 1,74 [1,14–2,64] | 0,01 | 1,13 [0,59–2,15] | 0,72 |
| Critères secondaires | ||||||
| Mortalité toutes causes | 26/147 (17,7) | 38/286 (13,3) | 1,40 [0,82–2,41] | 0,22 | 1,18 [0,51–2,72] | 0,71 |
| Séjour en réanimation | 32/147 (21,8) | 41/286 (14,3) | 1,66 [10–2,77][1,00–2,77] | 0,05 | 0,77 [0,34–1,73] | 0,53 |
| Hospitalisation > 30 jours | 14/147 (16,3) | 25/286 (8,7) | 2,04 [1,12–3,71] | 0,02 | 1,12 [0,46–71] | 0,80 |
IEC : inhibiteur de l’enzyme conversion de l’angiotensine r; ARA2 : antagoniste des récepteurs de type 1 à l’angiotensine II ; IC 95 % : intervalle de confiance à 95 %.
Composite de décès, séjour en réanimation ou séjour hospitalier > 30 jours en soins aigus.
Ajustement sur âge, sexe, et hypertension artérielle.
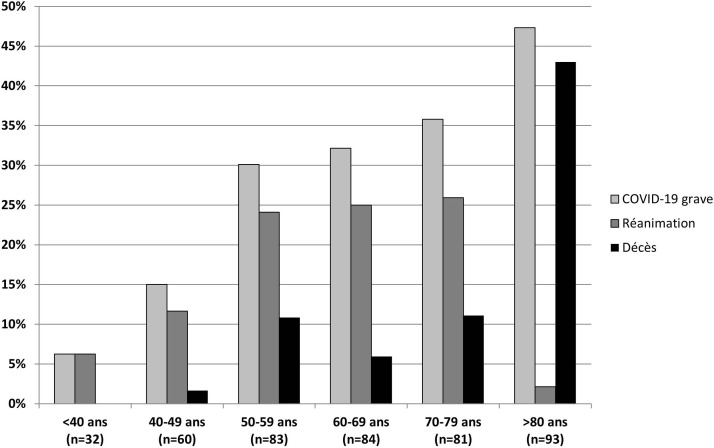
Les fréquences des formes graves, des séjours en réanimation et des décès en fonction des classes d’âge sont représentées dans la Fig. 2 . Si la fréquence des formes graves est proportionnelle à l’âge, on remarque qu’il en va différemment pour les hospitalisations en réanimation, limitées chez les patients de plus de 80 ans, et pour la mortalité, qui est nulle chez les patients de moins de 40 ans, maximale chez les plus âgés, mais atteint 11 % dans la tranche des 50–59 ans.
Fig. 2.
Fréquence des décès, séjours en réanimation et formes graves de COVID-19 selon les classes d’âge.
3.6. Retour à domicile et évolution fonctionnelle.
Après retour à domicile, seuls 12 % des patients ont été réhospitalisés (42/351), sans lien avec la COVID-19 dans 78 % des cas, en lien avec une aggravation de signes respiratoires, la persistance de fièvre ou de symptômes liés à l’infection initiale chez 8 patients (2 % du total) et pour une embolie pulmonaire chez un patient. Aucun patient sorti à domicile ou en SSR n’a nécessité ensuite de séjour en réanimation. À 2 mois de suivi, et en excluant les patients encore en SSR, les patients suivis pour maladie chroniques sévère (cancer, hémodialyse) ou réhospitalisés, 66 % des patients disent avoir totalement récupéré et 34 % décrivent des symptômes résiduels jugés invalidants : dyspnée d’effort (19 %), asthénie (26 %) parfois intense, dépression ou angoisse (5 %), troubles du sommeil défaut d’attention ou troubles de mémoire chez des sujets jeunes (3 %), limitant assez souvent la reprise d’une activité professionnelle ou avec répercussion sur les capacités professionnelles. On note enfin une altération résiduelle du goût ou de l’odorat (2 %) et une chute de cheveux (3 %), surtout mentionné par les femmes.
4. Discussion
Les résultats de cette étude observationnelle prospective confirment que l’hypertension artérielle ou la prise d’un traitement antihypertenseur sont associé à la mortalité et aux formes graves chez les patients atteints de COVID-19 nécessitant une hospitalisation initiale. L’association observée avant ajustement entre les traitements par inhibiteurs du SRAA et la survenue de formes graves de COVID-19 ne reste pas significative après ajustement sur des covariables telles que l’âge, le sexe et l’hypertension. Il n’y a donc pas d’argument, sur les données de cette étude, pour un rôle délétère des IEC ou ARA2 dans la pneumopathie COVID-19 nécessitant une hospitalisation initiale. À l’inverse, aucun rôle protecteur de la prise antérieure de ces traitements n’a pu être mis en évidence, que ce soit sur la mortalité, les séjours en réanimation, et les séjours prolongés.
Plusieurs études portant sur les relations entre traitements par IEC/ARA2 et la sévérité de la COVID-19 ou la mortalité ont déjà été publiées. Certaines étaient limitées aux patients hypertendus [22], [23], [24], [25] d’autres incluaient un ensemble de patients testés positifs pour la COVID-19, dont une proportion significative, entre 20 et 35 %, étaient hypertendus [12], [13]. Toutes ces études montrent que l’hypertension est associée aux formes graves de COVID-19 et à une augmentation de la mortalité totale, comme dans notre étude, ce qui induit un facteur de confusion pour identifier l’effet propre des IEC/ARA2, largement prescrits en cas d’hypertension. Une courte méta-analyse [18] ne retrouvait pas d’association entre les traitements par IEC/ARA2 et les formes graves de COVID-19 (odds ratio 0,71 [IC95 % 0,46–1,08]) et montrait une réduction de la mortalité chez les COVID-19 hypertendus qui recevaient des IEC/ARA2 par rapport à ceux qui n’en recevaient pas (odds ratio 0,57 [0,38–0,84] ; p = 0,004). Il faut remarquer que pour l’analyse des formes graves, 5 des 6 études incluses dans la méta-analyse étaient chinoises et portaient sur de très petits effectifs, que les critères de sévérité (en particulier les critères pour une admission en réanimation) pouvaient varier. Pour l’analyse de mortalité, les 6 études incluses étaient chinoises, la seule étude non chinoise et de taille plus importante de la méta-analyse ne comportant pas de données de mortalité (Reynolds et al, USA [12]).
Une étude européenne plus récente, danoise, rétrospective, basée sur des données populationnelles, a retrouvé des résultats proches de notre étude. Il existait une différence significative à 30 jours de la mortalité (18,1 % vs 7,3 %) et d’un critère composite décès et formes graves de COVID-19 (31,9 % vs 14,2 %) entre les patients COVID-19 qui recevaient des IEC/ARA2 (n = 895) et ceux qui n’en recevaient pas (n = 3585), mais les associations n’étaient plus significatives après ajustement sur l’âge, le sexe et les antécédents médicaux [13]. Une étude texane publiée en « preprint » donc sans évaluation par un comité de lecture lors de la rédaction de cet article, n’a également pas montré d’augmentation de la mortalité hospitalière chez 8000 hypertendus hospitalisés pour COVID-19 (risques relatifs de 0,97 [0,81–1,16] ; pour les IEC et de 1,15 [0,95–1,38] pour les ARA2) [25].
À notre connaissance il n’y a pas de données françaises publiées, mais une expérience francilienne réalisée à la même période que notre étude sur 263 patients COVID-19 a montré l’absence de différence dans la mortalité à 30 jours et les critères de sévérité tels que le séjour en réanimation, l’intubation/ventilation assistée [26].
Au total, il n’y a pas d’effet démontré chez l’homme d’un effet protecteur des IEC/ARA2 sur les formes graves de COVID-19. Cela est un peu décevant, car il existait des arguments expérimentaux pour espérer un bénéfice des IEC/ARA2 sur les atteintes pulmonaires sévères. La délétion du gène de l’ACE-2 aggrave le SDRA expérimental [1], tandis que l’angiotensine[1], [2], [3], [4], [5], [6], [7], produite de l’ECA-2, et le blocage des récepteurs de type 1 de l’angiotensine II l’améliorent [4]. L’effet protecteur du blocage des récepteurs 1 de l’angiotensine II par les ARA2 sur les SDRA provoqués par des agents infectieux, dont des coronavirus, a été démontré expérimentalement chez l’animal [15], [16], [17]. Les IEC et les ARA2 activent l’ECA-2 dans des modèles animaux [3], [5], mais il n’y a pas d’évidence pour une action activatrice de l’ECA-2 tissulaire en tant que récepteur transmembranaire dans le poumon humain [27]. De plus, il a été démontré que les IEC et les ARA2 n’agissent de façon similaire, au moins expérimentalement, sur la balance entre les deux systèmes opposés que sont le SRAA classique et le système ECA-2/angiotensine(1-7)/récepteur MAS [4], [6], [8].
A contrario, il n’y a aucun argument pour un effet délétères des IEC et ARA2 chez les patients atteints de COVID-19, comme cela avait été craint. Les effets des IEC/ARA2 paraissent neutres, que les patients soient hypertendus ou pas, que la forme clinique soit modérée et ne nécessite pas d’hospitalisation, cas de la majorité des patients inclus dans les études populationnelle [10], [11], [12], [13], [25], ou que la pneumopathie COVID-19 nécessite une hospitalisation, comme dans notre étude ou les premières études chinoises.
Plusieurs essais randomisés portant sur l’utilisation des IEC ou des ARA2 lors de la COVID-19 sont en cours. Les résultats de l’étude BRACE-CORONA [NCT04364893] [28], qui a randomisé la poursuite versus l’interruption des IEC/ARA2 chez 659 patients hypertendus déjà traités, hospitalisés pour COVID-19, n’a pas montré de différence sur la mortalité à 30 jours ni sur le nombre de jours en vie hors de l’hôpital entre la sortie le 30e jour (présentation le 1er septembre 2020 au congrès de l’European Society of Cardiology).
Tant que les résultats d’études confirmatoires ne sont pas disponibles, et compte tenu des risques à arrêter brutalement les inhibiteurs du SRAA chez les patients qui en ont besoin, il convient de respecter les recommandations des sociétés savantes de ne pas interrompre les IEC/ARA2 chez les patients atteints de COVID-19 [29].
Le dernier point intéressant de cette étude, non prévu initialement, est la fréquence élevée de symptômes persistants spontanément déclarés lors du suivi médian de 2 mois, en réponse à la question ouverte « avez-vous tout récupéré ? ». Plus d’un tiers des patients revenus à domicile a déclaré des symptômes jugés invalidants, essentiellement une asthénie, une dyspnée mais aussi des troubles de concentration et du sommeil chez des sujets jeunes. La plupart de ces troubles semblent régresser progressivement après un mois. Les symptômes persistants après COVID-19 ont été encore peu étudiés de façon systématique [30], et vont faire l’objet d’études spécifiques en France (étude CoCoLate).
4.1. Limitations
Si le suivi hospitalier a été complet, 19 patients (3,6 %) ont été perdus de vue pour le suivi ultérieur. Cependant, le risque de sous-estimation de la mortalité à moyen terme est probablement faible ou nul, dans la mesure ou la plupart des perdus de vue sont des patients jeunes, soit sans suivi médical ni médecin traitant, soit d’origine étrangère en voyage en Ile de France lors de la survenue de l’épidémie, soit réfugiés (afghans, africains hébergés à plusieurs par chambre dans un centre d’accueil proche du CHV). Le second biais est le risque de diagnostic par excès de la COVID-19, en particulier chez les patients dont la RT-PCR était négative. En cas de discordance entre une ou plusieurs RT-PCR négative(s) et un tableau clinique, biologique, et surtout scannographique très en faveur de la COVID-19, le diagnostic était établi par un collège de cliniciens et radiologues dans le cadre de la prise en charge courante, indépendamment et en amont de l’étude. Cela a été le cas pour 9 % des patients inclus, correspondant à un taux de faux négatifs de la RT-PCR très inférieur aux 30 % rapportés dans la série chinoise de Wuhan [31]. De plus, la confirmation du diagnostic a pu être faite a posteriori chez certains patients dont la sérologie COVID-19 était annoncée positive lors du suivi téléphonique. L’autre biais concerne la sélection des patients. Contrairement aux études réalisées dans des larges populations testées positives pour la COVID-19 et dont seule une minorité (de l’ordre de 10 à 20 %) étaient hospitalisée, les patients de cette série ont tous été hospitalisés, ce qui constitue déjà un critère de gravité de la maladie.
5. Conclusion
Cette étude a montré que, chez des patients hospitalisés pour COVID-19, l’augmentation des formes graves de COVID-19 ou de la mortalité hospitalière, à un mois et moyen-terme (médiane 2 mois) associée au traitement par IEC/ARA2, observée en analyse univariée, ne persistait pas après ajustement sur l’âge, le sexe, et l’hypertension artérielle. Il n’y a pas d’évidence pour un effet protecteur des IEC/ARA2 pour les pneumopathies graves de la COVID-19. Les résultats de cette étude rejoignent ceux de la majorité des autres études publiées en faveur de l’absence d’effet délétère des IEC ou ARA2 chez les patients atteints de COVID-19.
Financement
Ce travail a été financé par le Centre Hospitalier de Versailles.
Déclaration de liens d’intérêts
Le Dr. Georges déclare avoir reçu des financements (conférences) de AstraZeneca France, Sanofi-Aventis, Amgen, and Merck Sharpe and Dohme, sans lien avec le présent article. Les autres auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements
Nous remercions les Dr Reza Azarian, pneumologue, Véronique Bosca, urgentiste, Xavier de Malherbe, François Mignon, Pénélope Labauge, radiologues, les médecins urgentistes, réanimateurs, infectiologues, et l’ensemble du personnel médical et paramédical du Centre Hospitalier de Versailles.
Footnotes
Matériel complémentaire
Le matériel complémentaire accompagnant la version en ligne de cet article est disponible sur http://www.sciencedirect.com et https://doi.org/10.1016/j.ancard.2020.09.030.
supplément en ligne. Matériel complémentaire
Références
- 1.Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med. 2005;11:875–879. doi: 10.1038/nm1267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Hoffmann M., Kleine-Weber H., Schroeder S., Krüger N., Herrler T. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181:271–280. doi: 10.1016/j.cell.2020.02.052. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Ishiyama Y., Gallagher P.E., Averill D.B., Tallant E.A., Brosnihan K.B., Ferrario C.M. Upregulation of angiotensin-converting enzyme 2 after myocardial infarction by blockade of angiotensin II receptors. Hypertension. 2004;43:970–976. doi: 10.1161/01.HYP.0000124667.34652.1a. [DOI] [PubMed] [Google Scholar]
- 4.Ferrario C.M., Jessup J., Chappell M.C., Averill D.B., Brosnihan K.B., Tallant E.A. Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation. 2005;111:2605–2610. doi: 10.1161/CIRCULATIONAHA.104.510461. [DOI] [PubMed] [Google Scholar]
- 5.Imai Y., Kuba K., Rao S., Huan Y., Guo F., Guan B. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 2005;436:112–116. doi: 10.1038/nature03712. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Kreutz R., Algharably E.A.E., Azizi M., Dobrowolski P., Guzik T., Januszewicz A. Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc Res. 2020;116:1688–1699. doi: 10.1093/cvr/cvaa097. pii: cvaa097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Murray E., Tomaszewski M., Guzik T.J. Binding of SARS-CoV-2 and Angiotensin-Converting Enzyme 2: Clinical implications. Cardiovasc Res. 2020 doi: 10.1093/cvr/cvaa096. pii: cvaa096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Burrell L.M., Risvanis J., Kubota E., Dean R.G., MacDonald P.S., Lu S. Myocardial infarction increases ACE2 expression in rat and humans. Eur Heart J. 2005;26:369–375. doi: 10.1093/eurheartj/ehi114. [DOI] [PubMed] [Google Scholar]
- 9.Sama I.E., Ravera A., Santema B.T., van Goor H., Ter Maaten J.M., Cleland J.G.F. Circulating plasma concentrations of angiotensin-converting enzyme 2 in men and women with heart failure and effects of renin-angiotensin-aldosterone inhibitors. Eur Heart J. 2020;41:1810–1817. doi: 10.1093/eurheartj/ehaa373. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Mehta N., Kalra A., Nowacki A.S., Anjewierden S., Han Z., Bhat P. Association of use of angiotensin-converting enzyme inhibitors and angiotensin ii receptor blockers with testing positive for Coronavirus Disease 2019 (COVID-19) JAMA Cardiol. 2020;5:1020–1026. doi: 10.1001/jamacardio.2020.1855. (accédé le 30/08/2020) [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mancia G., Rea F., Ludergnani M., Apolone G., Corrao G. Renin-angiotensin-aldosterone system blockers and the risk of Covid-19. N Engl J Med. 2020;382:2431–2440. doi: 10.1056/NEJMoa2006923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Reynolds H.R., Adhikari S., Pulgarin C., Troxel A.B., Iturrate E., Johnson S.B. Renin-angiotensin-aldosterone system inhibitors and risk of Covid-19. N Engl J Med. 2020;382:2441–2448. doi: 10.1056/NEJMoa2008975. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Fosbøl E.L., Butt J.H., Østergaard L., Andersson C., Selmer C., Kragholm K. Association of angiotensin-converting enzyme inhibitor or angiotensin receptor blocker use with COVID-19 diagnosis and mortality. JAMA. 2020;324:168–177. doi: 10.1001/jama.2020.11301. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Georges J.L., Gilles F., Cochet H., Bertrand A., De Tournemire M., Monguillon M. Positive association of Angiotensin II receptor blockers, not angiotensin-converting enzyme inhibitors, with an increased vulnerability to SARS-CoV-2 infection in patients hospitalized for suspected COVID-19 pneumonia. PlosOne 2020, en révision. Preprint medRxiv. 2020 doi: 10.1101/2020.08.30.2018245110.1101/2020.08.30.20182451. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Wösten-Van Asperen R.M., Lutter R., Specht P.A., Moll G.N., Van Woensel J.B., Van Der Loos C.M. Acute respiratory distress syndrome leads to reduced ratio of ACE/ACE2 activities and is prevented by angiotensin-(1-7) or an angiotensin II receptor antagonist. J Pathol. 2011;225:618–627. doi: 10.1002/path.2987. [DOI] [PubMed] [Google Scholar]
- 16.Kaparianos A., Argyropoulou E. Local renin-angiotensin II systems, angiotensin-converting enzyme and its homologue ACE2: their potential role in the pathogenesis of chronic obstructive pulmonary diseases, pulmonary hypertension and acute respiratory distress Syndrome. Current Medicinal Chemistry. 2011;18:3506–3515. doi: 10.2174/092986711796642562. [DOI] [PubMed] [Google Scholar]
- 17.Meng Y., Yu C.H., Li W., Li T., Luo W., Huang S. Angiotensin-converting enzyme 2/angiotensin-(1-7)/mas axis protects against lung fibrosis by inhibiting the MAPK/NF-κB pathway. Am J Respir Cell Mol Biol. 2014;50:723–736. doi: 10.1165/rcmb.2012-0451OC. [DOI] [PubMed] [Google Scholar]
- 18.Guo X., Zhu Y., Hong Y. Decreased mortality of COVID-19 with renin-angiotensin-aldosterone system inhibitors therapy in patients with hypertension: a meta-analysis. Hypertension. 2020;76:e13–e14. doi: 10.1161/HYPERTENSIONAHA.120.15572. [DOI] [PubMed] [Google Scholar]
- 19.Gao C., Cai Y., Zhang K., Zhou L., Zhang Y., Zhang X. Association of hypertension and antihypertensive treatment with COVID-19 mortality: a retrospective observational study. Eur Heart J. 2020;41:2058–2066. doi: 10.1093/eurheartj/ehaa433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Mackey K; King VJ, Gurley S, Kiefer M, Liederbauer E, Vela K, et al. Risks and Impact of Angiotensin-Converting Enzyme Inhibitors or Angiotensin-Receptor Blockers on SARS-CoV-2 Infection in Adults. A Living Systematic Review. Ann Intern Med. doi:10.7326/M20-1515.(accédé le 30/08/2020). [DOI] [PMC free article] [PubMed]
- 21.WH.O . World Health Organization; 2020. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected: interim guidance, 25 January 2020. https://apps.who.int/iris/handle/10665/330854. License: CC BY-NC-SA 3.0 IGO. [Google Scholar]
- 22.Meng J., Xiao G., Zhang J., He X., Ou M., Bi J. Renin-angiotensin system inhibitors improve the clinical outcomes of COVID-19 patients with hypertension. Emerg Microbes Infect. 2020;9:757–760. doi: 10.1080/22221751.2020.1746200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Zhang P., Zhu L., Cai J., Lei F., Qin J.J., Xie J. Association of inpatient use of angiotensin converting enzyme inhibitors and angiotensin II receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. Circ Res. 2020;126:1671–1681. doi: 10.1161/CIRCRESAHA.120.317134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Li J., Wang X., Chen J., Zhang H., Deng A. Association of renin-angiotensin system inhibitors with severity or risk of death in patients with hypertension hospitalized for Coronavirus Disease 2019 (COVID-19) infection in Wuhan, China. JAMA Cardiol. 2020;5:1–6. doi: 10.1001/jamacardio.2020.1624. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Khera R., Clark C., Lu Y., Guo Y., Ren S., Truax B. Association of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers with the risk of hospitalization and death in hypertensive patients with Coronavirus Disease-19. medRxiv. 2020 doi: 10.1101/2020.05.17.20104943. Preprint (accédé le 30/08/2020) 2020.05.17.20104943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Saib A., Nguyen L.S., Amara W., Feki A., Nallet O. Impact du traitement par IEC/ARA2 chez les patients hospitalisés pour Covid-19: une étude de cohorte. Ann Cardiol Angeiol. 2020;69(5) In press. [Google Scholar]
- 27.Ferrario C.M. ACE2: more of Ang-(1-7) or less Ang II? Curr Opin Nephrol Hypertens. 2011;20:1–6. doi: 10.1097/MNH.0b013e3283406f57. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Lopes R.D., Macedo A.V.S., Melo de Barros E., Silva P.G., Moll-Bernardes R.J., Feldman A. Continuing versus suspending angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: impact on adverse outcomes in hospitalized patients with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)--The BRACE CORONA Trial. Am Heart J. 2020;226:49–59. doi: 10.1016/j.ahj.2020.05.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.De Simone G, Chair, ESC Council on Hypertension; On b*lf of the Nucleus Members. Position Statement of the ESC Council on Hypertension on ACE-Inhibitors and Angiotensin Receptor Blockers. https://www.escardio.org/Councils/Council-on-Hypertension-(CHT)/News/position-statement-of-the-esc-council-on-hypertension-on-ace-inhibitors-and-ang.(accessed 19/05/2020).
- 30.Carfì A., Bernabei R., Landi F. Gemelli against COVID-19 post-acute care study group. Persistent symptoms in patients after acute COVID-19. JAMA. 2020;324:603–605. doi: 10.1001/jama.2020.12603. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Ai T., Yang Z., Hou H., Zhan C., Chen C., Lv W. Correlation of chest CT and RT-PCR testing in Coronavirus Disease 2019 (COVID-19) in China: a report of 1014 cases. Radiology. 2020;296:E32–E40. doi: 10.1148/radiol.2020200642. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.