Abstract
目的
总结ABVD方案治疗儿童和青少年局限期(Ⅰ/Ⅱ期)霍奇金淋巴瘤(HL)的治疗效果和预后,探讨低危组患者化疗达完全缓解(CR)后可否不放疗。
方法
回顾性分析2004–2016年在中山大学肿瘤防治中心接受ABVD方案单纯化疗或联合低剂量侵犯野放疗治疗的85例儿童和青少年局限期HL患者的临床资料。
结果
85例儿童和青少年局限期HL患者的中位年龄12(3~18)岁,男66例,女19例,Ⅰ期5例,Ⅱ期80例,低危组56例,中危组29例。中位随访72(8~196)个月,复发12例,发生第二肿瘤2例,死亡2例。全组5年无事件生存(EFS)率为(85.6±3.8)%,5年总生存(OS)率100%。低危组5年EFS率和OS率分别为(89.1±4.2)%和100%,中危组5年EFS率和OS率分别为(79.3±7.5)%和100%。低危组化疗后达CR者共39例,其中15例化疗后接受放疗,单纯化疗组和化疗联合放疗组5年EFS率分别为(87.0±7.0)%和100%(P=0.506),OS率均为100%。
结论
ABVD方案治疗儿童和青少年局限期HL患者OS率较高,与发达国家相当,低危组化疗后达CR者放疗无获益,鉴于放疗远期不良反应,应根据危险度分层和治疗反应调整治疗强度。
Keywords: 霍奇金淋巴瘤, 局限期, 化疗, 放疗, 儿童和青少年
Abstract
Objective
To summarize the efficiency and long-term outcomes of limited-stage Hodgkin lymphoma in children and adolescents with ABVD therapy and determined whether omitting radiotherapy for a low-risk patient enabled the achievement of complete response (CR) after chemotherapy.
Methods
We retrospectively analyzed data from 13 y (2004–2016) from patients aged ≤18 y with limited-stage HL admitted to the Sun Yat-sen University Cancer Center. Patients received treatment with ABVD chemotherapy alone or ABVD chemotherapy followed by low-dose involved field radiotherapy.
Results
Total 85 subjects were eligible for study inclusion; the median age was 12 (3–18) y; 66 (77.6%) were men, 80 (94.1%) had stage-II disease, 56 (65.9%) were at low-risk, and the median follow-up duration was 72 (8–196) months; 12 relapsed, 2 had secondary neoplasm, and 2 died. The 5-year event free survival (EFS) was (85.6±3.8) %, and the overall survival (OS) was 100%. The 5-year EFS and OS was (89.1±4.2) % and 100%, respectively, for the low-risk cohort and (79.3±7.5) % and 100%, respectively for the intermediate-risk cohort. Among the 39 low-risk patients who achieved CR after chemotherapy, 15 received treatment with chemotherapy followed by LD-IFRT. In the exploratory subset analysis, the low-risk cohort who achieved CR after chemotherapy, the 5-year EFS for comparing ABVD alone with chemotherapy followed by LD-IFRT was (87.0±7.0) % versus 100% (P=0.506), and the OS was 100% for both the groups.
Conclusion
Our retrospective analysis showed excellent survival of limited-stage HL patients with ABVD therapy. For patients who achieving CR after chemotherapy with low-risk HL, received chemotherapy followed by LD-IFRT does not improve 5-year OS and EFS. The use of risk- and response-based stratification may facilitate the development of effective and less toxic protocols.
Keywords: Hodgkin lymphoma, Limited stage, Chemotherapy, Radiation, Children and adolescents
淋巴瘤分为非霍奇金淋巴瘤和霍奇金淋巴瘤(HL),HL对放化疗敏感,多采用放化疗联合治疗。发达国家儿童和青少年HL的5年总生存(OS)率超过90%[1]。随着儿童和青少年HL患者生存期延长,长期随访发现治疗相关不良反应特别是放疗相关的远期不良反应增加[2]–[3]。因此,国外研究者开展了一系列临床试验探索能否在治愈HL的基础上减轻治疗强度[4]–[5]。目前国内儿科多采用COPP或ABV方案、ABVE-PC等方案±放疗治疗儿童局限期HL,这些化疗方案的治疗强度较大,化疗药物中包含的甲基苄肼、环磷酰胺及依托泊苷可能导致生殖器官受损及第二肿瘤。而国内外局限期预后良好的成人HL公认的一线治疗策略是ABVD方案(阿霉素+博来霉素+长春花碱+氮烯咪胺)化疗4个疗程联合放疗(21 Gy),12年OS率可达94%,无事件生存(EFS)率为85%[6]。儿童HL患者采用ABVD方案的研究报道较少,本研究回顾性分析中山大学肿瘤防治中心采用单纯ABVD方案(其中长春新碱取代长春花碱)化疗或联合放疗治疗儿童和青少年局限期HL的治疗效果及预后,同时比较化疗后完全缓解(CR)患者放疗与不放疗的EFS和OS有无差异,探讨ABVD方案±放疗在儿童局限期HL中的应用价值,为进一步优化局限期HL的治疗方案提供临床依据。
病例与方法
1.病例:收集中山大学肿瘤防治中心2004年2月至2016年12月收治的有完整随访资料的18岁以下初治HL患者的临床资料,全部患者均经组织病理形态及免疫组化检查确诊,本研究经中山大学肿瘤防治中心伦理委员会批准。
2.临床分期和危险度分层:采用Ann Arbor分期系统进行临床分期。B症状定义为:不明原因体重下降>10%(诊断前6个月内);不明原因发热,体温超过38 °C;反复夜间盗汗。纵隔巨大肿块定义:CT显示纵隔肿块直径≥10 cm或胸片显示肿块大于胸廓内径的1/3。外周巨大肿块定义:单个或多个互相融合的淋巴结肿块直径>6 cm。危险度分层标准:低危组:ⅠA期或ⅡA期且不伴巨大肿块;中危组:除外低危组的Ⅰ期、Ⅱ期,ⅢA期;高危组:ⅢB期,Ⅳ期。
3.治疗方案:采用标准的ABVD方案化疗,鉴于长春花碱国内无药,采用长春新碱取代。吡柔比星25 mg/m2,静脉推注,第1、15天;博来霉素10 mg/m2,肌肉注射,第1、15天;长春新碱1.5 mg/m2,静脉推注,第1、15天;氮烯咪胺375 mg/m2,静脉滴注,第1、15天;4周为1个周期。有巨大肿块或化疗后疗效达部分缓解(PR)的患者接受放疗,2010年前化疗后疗效达CR的部分患者也接受放疗,2010年后化疗后达CR的大部分患者不再接受放疗。放疗采用低剂量侵犯野放疗(LD-IFRT),放疗总剂量为15~25 Gy/9-12F。复发后挽救方案根据既往治疗及复发情况行COPP、BEACOPP等方案化疗,放疗,缓解后行自体造血干细胞移植(auto-HSCT)或应用免疫检查点抑制剂PD-1单抗等。
4.疗效及不良反应评价:治疗期间每2个疗程评价1次疗效,治疗结束后第1年每3个月全面评估1次,第2年每6个月全面评估1次,第3年起每年全面评估1次。疗效评估标准:CR:无临床、影像学或其他疾病证据;PR:可测量病灶最大垂直直径乘积缩小>50%,但未达到CR标准;疾病稳定(SD):未达到PR但未出现进展,无新病灶;疾病进展(PD):可测量病灶增大>25%或出现新病灶。疗效评估多以CT或MRI为主,2008年之后部分患者采用PET-CT。治疗的不良反应根据美国国立癌症研究所常见不良反应评价标准(CTCAE)4. 0版进行评价。
5.随访:门诊或电话随访,中位随访72(8~196)个月,随访至2020年3月,随访率98.8%。OS期定义为从开始治疗至因任何原因死亡或末次随访的时间,EFS期定义为从开始治疗至疾病进展、复发、发生第二肿瘤或死亡的时间。
6.统计学处理:采用SPSS 25.0软件对数据进行统计学分析。分类资料组间比较采用χ2检验或Fisher精确检验,以Kaplan-Meier法计算OS期、EFS期,率的比较采用Log-rank检验。P<0.05为差异有统计学意义。
结果
1.临床特点:本研究纳入85例儿童和青少年局限期(Ⅰ/Ⅱ期)HL患者,男66例(77.%),女19例(22.4%)。中位年龄12(3~18)岁,14岁以下儿童52例(61.2%),15~18岁青少年33例(38.8%)。以颈部包块起病者最为常见,其他首发症状有腋窝、腮腺、前纵隔包块或发热。有B症状者19例(22.4%),有巨大肿块者14例(16.5%)。Ⅰ期病例5例(5.9%),Ⅱ期病例80例(94.1%)。低危组56例(65.9%),中危组29例(34.1%)。混合细胞型23例(27.1%),结节硬化型36例(42.4%),淋巴细胞丰富型17例(20%),淋巴细胞消减型2例(2.4%),结节性淋巴细胞为主型7例(8.2%)。儿童患者中混合细胞型占36.5%,青少年患者中结节硬化型占66.7%。46例(54.1%)患者接受放疗。化疗组与化疗联合放疗组局限期HL患者的临床特点比较见表1。
表1. 化疗组与化疗联合放疗组局限期霍奇金淋巴瘤患者的临床特点比较[例(%)].
| 化疗组(39例) | 化疗联合放疗组(46例) | χ2值 | P值 | |
| 性别 | 0.141 | 0.708 | ||
| 男 | 31(79.5) | 35(76.1) | ||
| 女 | 8(20.5) | 11(23.9) | ||
| 年龄段 | 20.516 | <0.001 | ||
| 儿童 | 34(87.2) | 18(39.1) | ||
| 青少年 | 5(12.8) | 28(60.9) | ||
| 亚型 | 12.331 | 0.009 | ||
| 混合细胞型 | 14(35.9) | 9(19.6) | ||
| 结节硬化型 | 10(25.6) | 26(56.5) | ||
| 淋巴细胞丰富型 | 12(30.8) | 5(10.9) | ||
| 淋巴细胞消减型 | 0(0) | 2(4.3) | ||
| 结节性淋巴细胞为主型 | 3(7.7) | 4(8.7) | ||
| 分期 | 0.540 | 0.463 | ||
| Ⅰ | 1(2.6) | 4(8.7) | ||
| Ⅱ | 38(97.4) | 42(91.3) | ||
| B症状 | 0.449 | 0.503 | ||
| 无 | 29(74.4) | 37(80.4) | ||
| 有 | 10(25.6) | 9(19.6) | ||
| 巨大肿块 | 14.210 | <0.001 | ||
| 无 | 39(100.0) | 32(69.6) | ||
| 有 | 0(0) | 14(30.4) | ||
| 危险度 | 2.304 | 0.129 | ||
| 低危 | 29(74.4) | 27(58.7) | ||
| 中危 | 10(25.6) | 19(41.3) |
2.疗效评估:低危组患者中,单纯化疗组29例,平均化疗4.95个疗程,24例达CR,其中有3例复发;5例达PR,5例PR患者未行PET-CT及残留灶活检病理检查协助评估疗效,其中有2例复发。化疗联合放疗组27例,平均化疗4.93个疗程,化疗结束后共15例达CR,无复发;12例达PR,其中1例复发。中危组患者中,单纯化疗组10例,平均化疗5.15个疗程,10例患者均达CR,其中2例复发。化疗联合放疗组19例,平均化疗5.76个疗程,化疗结束后12例达CR,其中1例复发;7例达PR,其中3例复发。
3.生存随访:中位随访时间72(8~196)个月,低危组6例复发,中危组6例复发。复发患者的挽救治疗情况见表2,目前低危组全部存活,中危组有2例(2.4%)生存5年后死亡,另外4例存活。
表2. 12例儿童和青少年局限期霍奇金淋巴瘤患者复发后治疗情况.
| 例号 | 危险度分层 | 复发次数 | 挽救治疗 | 结局 |
| 1 | 中危 | 3 | 化疗+放疗+自体移植 | 死亡 |
| 2 | 低危 | 2 | 化疗 | 存活 |
| 3 | 低危 | 1 | 化疗+自体移植 | 存活 |
| 4 | 低危 | 2 | 化疗+放疗+自体移植 | 存活 |
| 5 | 中危 | 4 | 化疗+放疗+自体移植 | 死亡 |
| 6 | 中危 | 1 | 化疗+放疗 | 存活 |
| 7 | 低危 | 1 | 化疗+放疗 | 存活 |
| 8 | 中危 | 1 | 化疗+放疗+PD-1单抗+SGN-35 | 存活 |
| 9 | 中危 | 1 | 化疗+放疗 | 存活 |
| 10 | 中危 | 1 | 化疗+放疗 | 存活 |
| 11 | 低危 | 1 | 化疗+放疗+自体移植 | 存活 |
| 12 | 低危 | 2 | 化疗+放疗+自体移植 | 存活 |
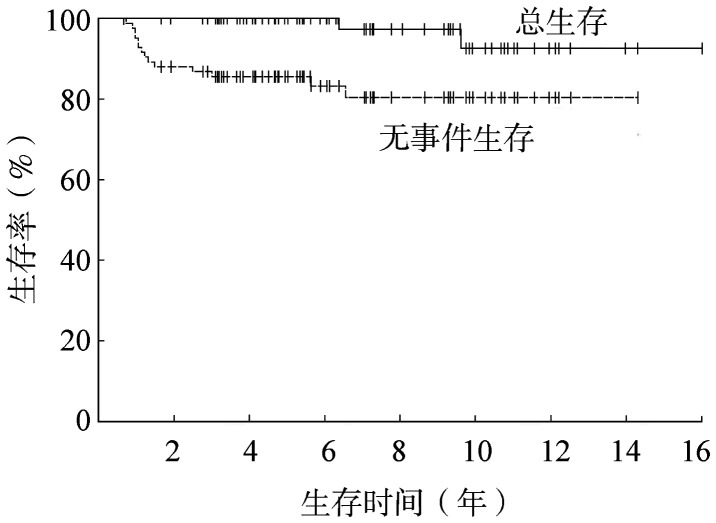
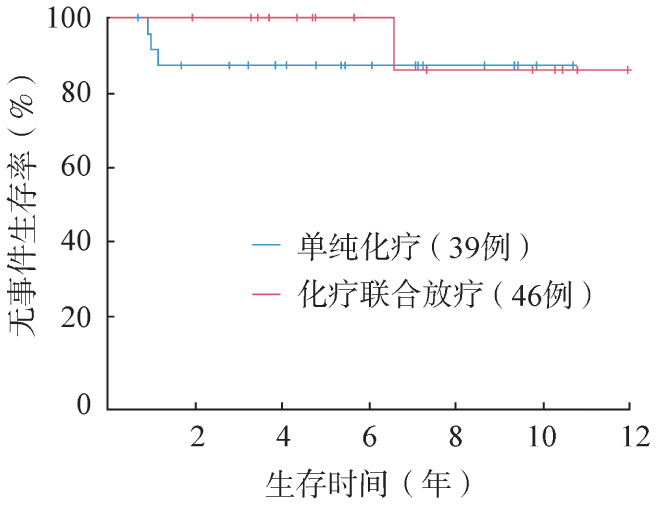
全部患者5年EFS率和OS率分别为(85.6±3.8)%和100%(图1),其中低危组5年EFS率和OS率分别为(89.1±4.2)%和100%。低危组中,单纯化疗组和化疗联合放疗组5年EFS率分别为(82.1±7.2)%和(96.3±3.6)%(P=0.398),5年OS率均为100%。单纯化疗组和化疗联合放疗组化疗结束后达CR患者的5年EFS率分别为(87±7)%和100%(P=0.506)(图2)。单纯化疗组和化疗联合放疗组化疗结束后未达CR患者的5年EFS率分别为(60.0±21.9)%和(91.7±8.0)%。中危组5年EFS率和OS率分别为(79.3±7.5)%和100%,其中单纯化疗组和化疗联合放疗组5年EFS率分别为(80.0±12.6)%和(78.9±9.4)%(P=0.973),5年OS率均为100%。
图1. 85例儿童和青少年局限期霍奇金淋巴瘤患者的总生存和无事件生存曲线.
图2. 化疗组与化疗联合放疗组化疗结束后达完全缓解的局限期霍奇金淋巴瘤患者的无事件生存曲线.
4.不良反应:患者均可耐受化疗和放疗的不良反应,所有患者均出现2~4级血液学不良反应,主要为粒细胞减少,其次为血小板减少,少数患者出现非血液学不良反应如恶心和呕吐,无明显的肝肾功能损害。至随访截止,未出现心脏及肺部不良反应,2例(2.4%)患者出现第二肿瘤,均为低危组且接受过放疗。1例为诊断HL后1年余出现枕部小包块,行手术切除后病理活检诊断为婴儿型纤维肉瘤,术后定期随访无复发,存活至今。1例为诊断HL后6年余出现颈部、腋窝、纵隔、腹膜后等部位淋巴结肿大,行腋窝淋巴结穿刺活检,病理诊断为弥漫大B细胞淋巴瘤,行化疗及auto-HSCT后缓解,定期随访无复发,存活至今。
讨论
HL占儿童肿瘤的6%,是一种可治愈的肿瘤,根据组织病理学分为两类:经典型HL(cHL)和结节性淋巴细胞为主型HL(NLPHL)。其中cHL又分为4个亚型,分别为混合细胞型、结节硬化型、淋巴细胞丰富型及淋巴细胞消减型。在美国,混合细胞型多见于14岁以下儿童,15岁以上的青少年和年轻成人HL则以结节硬化型最为常见[7]。本研究中,14岁以下患者以混合细胞型为主,占36.5%;15~18岁患者则以结节硬化型为主,占66.7%,与国外报道的结果较一致[8]。淋巴细胞消减型HL是一种少见的组织学亚型,儿童罕见,多为晚期病变,本研究中有2例淋巴细胞消减型HL患者,均为青少年。本研究中,儿童和青少年局限期HL的发病率男性明显高于女性,同国外报道基本一致[9]。Ⅰ期HL少见,仅占5.9%,明显低于国外Ⅰ期所占比例[9],提示国内患者可能就诊时间较国外晚。大部分(77.6%)患者就诊时无B症状,同国外报道一致[9]。单纯化疗组儿童所占比例高,最常见的病理类型为混合细胞型。化疗联合放疗组青少年所占比例高,最常见的病理类型为结节硬化型,提示结节硬化型患者化疗疗效较混合细胞型差,部分患者需要放疗。
HL的治疗经历了单纯放疗或化疗到放化疗联合治疗的过程。MOPP(氮芥+长春新碱+甲基苄肼+泼尼松)方案是早年用于治疗儿童和青少年HL患者的化疗方案,但其治疗相关不良反应如继发白血病、不育等促进了新型联合化疗方案的研发[10]。为减少烷化剂对青少年儿童产生远期不良反应,本中心采用ABVD方案化疗,此方案不含环磷酰胺和依托泊苷,1个疗程化疗2次(每2周1次),方案相对简单,疗效好,不良反应低,低危患者生存率高。国外一项回顾性研究采用3~6个疗程ABVD方案化疗,单独或联合放疗治疗儿童和青少年局限期(Ⅰ期和Ⅱ期)HL患者,5年的EFS率和OS率分别为93.9%和97.2%[11]。加拿大的一项研究采用ABVD方案±放疗(21 Gy)治疗儿童、青少年和年轻成人HL患者,研究显示,儿童和青少年低危HL患者的5年EFS率超过90%,OS率达100%,提示ABVD方案疗效好,不良反应少[12],目前4个疗程ABVD方案±放疗(21 Gy)被美国国家癌症研究所(NCI)推荐为儿童低危HL一线治疗方案之一。本中心采用4~6个疗程ABVD方案化疗,单独或联合LD-IFRT治疗85例儿童和青少年局限期HL患者,方案采用长春新碱取代标准方案中的长春花碱,生存率未受影响,5年EFS率和OS率分别为(85.6±3.8)%和100%,与发达国家相当[13]–[14]。儿童和青少年局限期HL患者OS率超过90%,大部分患者可长期生存,远期疗效可。ABVD方案治疗相关不良反应包括药物剂量相关的阿霉素和博来霉素导致的心脏和肺的不良反应[2],[15],至随访结束,本研究暂未发现合并心脏或肺不良反应的患者,仍需继续随访。
截至随访结束,本研究组有2例患者出现第二肿瘤,均接受过放疗。放疗可以增加第二肿瘤的发生风险,在儿童中更为显著[16],多项研究表明原发肿瘤放疗时的放射野内或其附近常出现第二肿瘤[17]–[18]。放疗诱发第二肿瘤的风险随时间延长而增加,国外研究表明,一些与第二肿瘤发生及发展相关的遗传易感基因对射线更敏感[19]–[20],此两例患者并未行相关基因或转录组检测,且发生第二肿瘤的影响因素众多,故此两例患者发生第二肿瘤与放疗是否有关尚不明确。HL对放疗敏感,随着儿童和青少年患者生存期的延长,放疗相关远期不良反应第二肿瘤随之显现[2],如何在减少远期不良反应和治愈HL之间达到平衡成为研究重点[3]。美国儿童癌症协作组开展的随机对照研究CCG5942纳入初治化疗后获得CR的患者,对比接受或不接受放疗者的疗效。研究显示化疗联合放疗组10年EFS率(91.2%)高于单纯化疗组(82.9%),差异有统计学意义(P=0.004),而两者10年OS率(97.1%对95.9%)的差异无统计学意义(P=0.500)。提示放疗可以降低复发率,改善EFS,但由于HL的挽救治疗有效率高,OS无改善[21]。美国另一个HL协作组Stanford-St Jude-Dana Farber开展的HOD99研究纳入88例2个疗程VAMP方案化疗后评估为CR的低危(Ⅰ期和Ⅱ期,<3个淋巴结受累,无B症状,无纵隔巨大肿块,无结外受侵)患者,发现单纯化疗组的2年EFS率与化疗联合放疗组相比差异无统计学意义(89.4%对92.5%,P=0.610),提示早期化疗反应良好的低危患者可以不放疗[22]。在欧洲,德国儿童肿瘤协会HL协作组开展的GPOH-HD-2002研究将患儿分为低危组(ⅠA/B,ⅡA期)、中危组(ⅠEA/B,ⅡEA,ⅡB,ⅢA期)、高危组(ⅡEB,ⅢEA/B,ⅢB,ⅣA/B期),其中低危(ⅠA/B,ⅡA期)患者OEPA/OPPA方案化疗结束后评估为CR者不接受放疗或接受侵犯野放疗,发现化疗联合放疗组的5年EFS率与单纯化疗组相比差异无统计学意义(91.7%对93.2%,P=0.740)[23]。虽然以上各研究的治疗方案、危险度分层及疗效评估时间点不完全一致,但均表明对于某些预后良好、化疗敏感的低危HL患者,化疗达CR后可不放疗。
本研究组对比了本中心儿童和青少年低危组单纯化疗和化疗联合放疗的研究结果,发现对于低危组中化疗结束后达CR患者,化疗联合放疗组5年EFS率与单纯化疗组相比差异无统计学意义(P=0.506),两组5年OS率均为100%,提示低危组患者化疗后达CR行放疗并不能改善EFS率和OS率。但对于低危组化疗结束后未达CR患者,发现化疗联合放疗组的EFS率高于单纯化疗组[(91.7±8.0)%对(60.0±21.9)%],但由于单纯化疗组病例数太少,未作统计学比较。加拿大-德国霍奇金淋巴瘤研究组将HD10(接受2个疗程ABVD方案化疗联合20 Gy放疗)、HD11(接受4个疗程ABVD方案化疗联合30 Gy放疗)和HD6(单纯接受4~6个疗程ABVD方案化疗)3个数据库的低危(Ⅰ期和Ⅱ期,无巨大肿块,无B症状)患者进行比较,发现化疗联合放疗能够改善早期化疗未能达CR患者的无进展生存,但化疗联合放疗组和单独化疗组的OS相当[13],结论与本研究一致。本研究中危组中,化疗联合放疗亦不能改善EFS,但由于本研究收集的病例仅为Ⅰ/Ⅱ期中危患者,未包括其他分期的中危患者,且病例数太少,有待增加中危病例进一步探讨。
本研究组采用ABVD方案治疗儿童和青少年局限期HL患者,时间跨度大且为回顾性分析,结果可能在一定程度上存在偏倚。鉴于放疗的远期不良反应,随着PET-CT的临床应用,本中心目前正在进行根据早期疗效调整化疗和放疗的相关前瞻性临床研究。
总之,本研究中ABVD方案治疗儿童和青少年局限期HL的OS较好,与发达国家相当。低危组化疗后达CR的患者放疗无获益,鉴于放疗远期不良反应,应根据危险度分层和治疗反应调整治疗强度。
References
- 1.Kelly KM, Hodgson D, Appel B, et al. Children's Oncology Group's 2013 blueprint for research: Hodgkin lymphoma[J] Pediatr Blood Cancer. 2013;60(6):972–978. doi: 10.1002/pbc.24423. [DOI] [PubMed] [Google Scholar]
- 2.Castellino SM, Geiger AM, Mertens AC, et al. Morbidity and mortality in long-term survivors of Hodgkin lymphoma: a report from the Childhood Cancer Survivor Study[J] Blood. 2011;117(6):1806–1816. doi: 10.1182/blood-2010-04-278796. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Donaldson SS. Finding the balance in pediatric Hodgkin's lymphoma[J] J Clin Oncol. 2012;30(26):3158–3159. doi: 10.1200/JCO.2012.42.6890. [DOI] [PubMed] [Google Scholar]
- 4.Mauz-Körholz C, Metzger ML, Kelly KM, et al. Pediatric Hodgkin Lymphoma[J] J Clin Oncol. 2015;33(27):2975–2985. doi: 10.1200/JCO.2014.59.4853. [DOI] [PubMed] [Google Scholar]
- 5.Tebbi CK, Mendenhall NP, London WB, et al. Response-dependent and reduced treatment in lower risk Hodgkin lymphoma in children and adolescents, results of P9426: a report from the Children's Oncology Group[J] Pediatr Blood Cancer. 2012;59(7):1259–1265. doi: 10.1002/pbc.24279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Meyer RM, Gospodarowicz MK, Connors JM, et al. ABVD alone versus radiation-based therapy in limited-stage Hodgkin's lymphoma[J] N Engl J Med. 2012;366(5):399–408. doi: 10.1056/NEJMoa1111961. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Punnett A, Tsang RW, Hodgson DC. Hodgkin lymphoma across the age spectrum: epidemiology, therapy, and late effects[J] Semin Radiat Oncol. 2010;20(1):30–44. doi: 10.1016/j.semradonc.2009.09.006. [DOI] [PubMed] [Google Scholar]
- 8.Bazzeh F, Rihani R, Howard S, et al. Comparing adult and pediatric Hodgkin lymphoma in the Surveillance, Epidemiology and End Results Program, 1988-2005: an analysis of 21 734 cases[J] Leuk Lymphoma. 2010;51(12):2198–2207. doi: 10.3109/10428194.2010.525724. [DOI] [PubMed] [Google Scholar]
- 9.Bhethanabhotla S, Bakhshi S. Presence of risk factors does not affect outcome in early stage pediatric Hodgkin lymphoma treated with ABVD[J] Ann Hematol. 2017;96(3):521–522. doi: 10.1007/s00277-016-2880-y. [DOI] [PubMed] [Google Scholar]
- 10.Hunger SP, Link MP, Donaldson SS. ABVD/MOPP and low-dose involved-field radiotherapy in pediatric Hodgkin's disease: the Stanford experience[J] J Clin Oncol. 1994;12(10):2160–2166. doi: 10.1200/JCO.1994.12.10.2160. [DOI] [PubMed] [Google Scholar]
- 11.Jain S, Kapoor G, Bajpai R. ABVD-Based Therapy for Hodgkin Lymphoma in Children and Adolescents: Lessons Learnt in a Tertiary Care Oncology Center in a Developing Country[J] Pediatr Blood Cancer. 2016;63(6):1024–1030. doi: 10.1002/pbc.25935. [DOI] [PubMed] [Google Scholar]
- 12.Marr KC, Connors JM, Savage KJ, et al. ABVD chemotherapy with reduced radiation therapy rates in children, adolescents and young adults with all stages of Hodgkin lymphoma[J] Ann Oncol. 2017;28(4):849–854. doi: 10.1093/annonc/mdx005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Hay AE, Klimm B, Chen BE, et al. An individual patient-data comparison of combined modality therapy and ABVD alone for patients with limited-stage Hodgkin lymphoma[J] Ann Oncol. 2013;24(12):3065–3069. doi: 10.1093/annonc/mdt389. [DOI] [PubMed] [Google Scholar]
- 14.Jhawar SR, Rivera-Núñez Z, Drachtman R, et al. Association of Combined Modality Therapy vs Chemotherapy Alone With Overall Survival in Early-Stage Pediatric Hodgkin Lymphoma[J] JAMA Oncol. 2019;5(5):689–695. doi: 10.1001/jamaoncol.2018.5911. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.van Nimwegen FA, Schaapveld M, Janus CP, et al. Cardiovascular disease after Hodgkin lymphoma treatment: 40-year disease risk[J] JAMA Intern Med. 2015;175(6):1007–1017. doi: 10.1001/jamainternmed.2015.1180. [DOI] [PubMed] [Google Scholar]
- 16.Olsen JH, Möller T, Anderson H, et al. Lifelong cancer incidence in 47,697 patients treated for childhood cancer in the Nordic countries[J] J Natl Cancer Inst. 2009;101(11):806–813. doi: 10.1093/jnci/djp104. [DOI] [PubMed] [Google Scholar]
- 17.Reulen RC, Frobisher C, Winter DL, et al. Long-term risks of subsequent primary neoplasms among survivors of childhood cancer[J] JAMA. 2011;305(22):2311–2319. doi: 10.1001/jama.2011.747. [DOI] [PubMed] [Google Scholar]
- 18.Howell R. Second Primary Cancers and Cardiovascular Disease after Radiation Therapy. NCRP Report No. 170[J] Med Phys. 2012;39(12):7729–7731. doi: 10.1118/1.4765651. [DOI] [PubMed] [Google Scholar]
- 19.Varszegi D, Duga B, Melegh BI, et al. Hodgkin disease therapy induced second malignancy susceptibility 6q21 functional variants in roma and hungarian population samples[J] Pathol Oncol Res. 2014;20(3):529–533. doi: 10.1007/s12253-013-9724-z. [DOI] [PubMed] [Google Scholar]
- 20.Morton LM, Sampson JN, Armstrong GT, et al. Abstract 2691: Genome-wide association study identifies two susceptibility loci that modify radiation-related risk for breast cancer after childhood cancer: A report from the Childhood Cancer Survivor Study and St. Jude Lifetime Cohort[J] Cancer Res. 2016;76(14 Supplement):2691. doi: 10.1158/1538-7445.AM2016-2691. [DOI] [Google Scholar]
- 21.Wolden SL, Chen L, Kelly KM, et al. Long-term results of CCG 5942: a randomized comparison of chemotherapy with and without radiotherapy for children with Hodgkin's lymphoma--a report from the Children's Oncology Group[J] J Clin Oncol. 2012;30(26):3174–3180. doi: 10.1200/JCO.2011.41.1819. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Metzger ML, Weinstein HJ, Hudson MM, et al. Association between radiotherapy vs no radiotherapy based on early response to VAMP chemotherapy and survival among children with favorable-risk Hodgkin lymphoma[J] JAMA. 2012;307(24):2609–2616. doi: 10.1001/jama.2012.5847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Mauz-Körholz C, Hasenclever D, Dörffel W, et al. Procarbazine-free OEPA-COPDAC chemotherapy in boys and standard OPPA-COPP in girls have comparable effectiveness in pediatric Hodgkin's lymphoma: the GPOH-HD-2002 study[J] J Clin Oncol. 2010;28(23):3680–3686. doi: 10.1200/JCO.2009.26.9381. [DOI] [PubMed] [Google Scholar]