Abstract
Der Herzmuskel ist quergestreift und verfügt über eine Automatie, d. h. er kann spontan – ohne Einwirkung von Substanzen oder Nerven – ein Aktionspotenzial bilden und sich kontrahieren. Das Aktionspotenzial entsteht im Sinusknoten und breitet sich über dem gesamten Herzen aus. Die beiden Ventrikel des Herzens werfen einen Teil ihres Blutes in der sog. Ejektionsphase in die beiden Teilkreisläufe (Lunge und Körperkreislauf) aus. In der Erschlaffungsphase werden sie über die Vorhöfe wieder gefüllt. Der Blutstrom wird durch die Herzklappen gerichtet und ein Rückstrom hierdurch verhindert. Die Herzfunktion wird über den Frank-Starling-Mechanismus und eine Reflexkontrolle durch das autonome Nervensystem gesteuert. Nach dem Frank-Starling-Mechanismus gilt: Je größer der venöse Rückstrom, desto höher das Schlagvolumen und umgekehrt. Vagale Stimulation führt zur Bradykardie, sympathoadrenerge Stimulation zur Tachykardie. Die elektrische Aktivität des Herzens lässt sich als EKG ableiten und beurteilen. Der arterielle Blutdruck wird vom linken Ventrikel erzeugt; er ist die treibende Kraft für die Blutströmung im Körperkreislauf (Hochdrucksystem). Der dem Blutfluss entgegen gerichtete Widerstand wird als totaler peripherer Gefäßwiderstand bezeichnet. 84% des gesamten Blutes befinden sich im systemischen Kreislauf, der Rest im Lungenkreislauf (Niederdrucksystem). Das Herzzeitvolumen ist die entscheidende Größe für die Durchblutung der Organe. Seine Höhe hängt von der Stoffwechselaktivität des Körpers ab.
Der Herzmuskel ist quergestreift und verfügt über eine Automatie, d. h. er kann spontan – ohne Einwirkung von Substanzen oder Nerven – ein Aktionspotenzial bilden und sich kontrahieren. Das Aktionspotenzial entsteht im Sinusknoten und breitet sich über dem gesamten Herzen aus. Die beiden Ventrikel des Herzens werfen einen Teil ihres Blutes in der sog. Ejektionsphase in die beiden Teilkreisläufe (Lunge und Körperkreislauf) aus. In der Erschlaffungsphase werden sie über die Vorhöfe wieder gefüllt. Der Blutstrom wird durch die Herzklappen gerichtet und ein Rückstrom hierdurch verhindert. Die Herzfunktion wird über den Frank-Starling-Mechanismus und eine Reflexkontrolle durch das autonome Nervensystem gesteuert. Nach dem Frank-Starling-Mechanismus gilt: Je größer der venöse Rückstrom, desto höher das Schlagvolumen und umgekehrt. Vagale Stimulation führt zur Bradykardie, sympathoadrenerge Stimulation zur Tachykardie. Die elektrische Aktivität des Herzens lässt sich als EKG ableiten und beurteilen. Der arterielle Blutdruck wird vom linken Ventrikel erzeugt; er ist die treibende Kraft für die Blutströmung im Körperkreislauf (Hochdrucksystem). Der dem Blutfluss entgegen gerichtete Widerstand wird als totaler peripherer Gefäßwiderstand bezeichnet. 84% des gesamten Blutes befinden sich im systemischen Kreislauf, der Rest im Lungenkreislauf (Niederdrucksystem). Das Herzzeitvolumen ist die entscheidende Größe für die Durchblutung der Organe. Seine Höhe hängt von der Stoffwechselaktivität des Körpers ab.
Funktion des Herzens
Das Herz als Pumpe
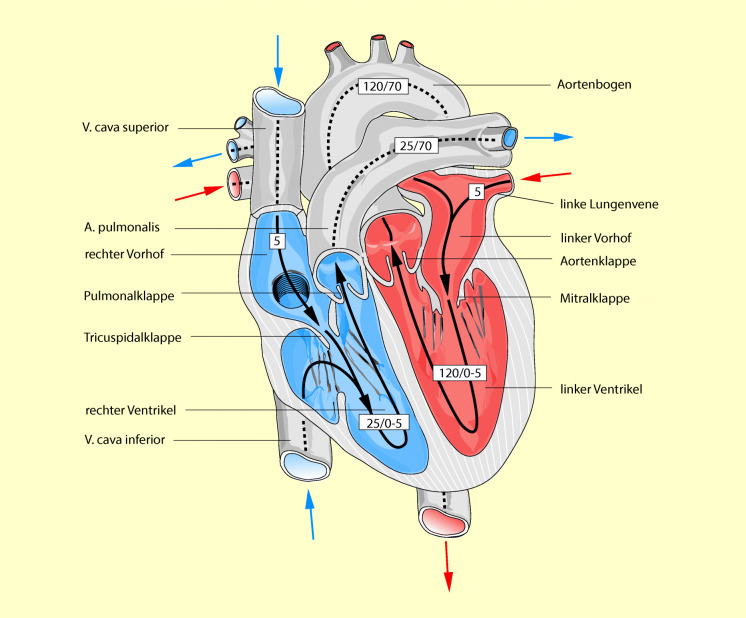
Das Herz ist eine Pumpe, die aus vier Kammern besteht: zwei Vorhöfen und zwei Ventrikeln. Über die Vorhöfe werden die beiden Ventrikel mit Blut gefüllt. Anschließend entleeren sich beide Ventrikel in die ihnen zugehörigen Kreisläufe: der rechte Ventrikel über die A. pulmonalis in den Lungenkreislauf und der linke Ventrikel über die Aorta in den Körperkreislauf.
Physiologie des Herzmuskels
Der Herzmuskel ist aus folgenden Geweben aufgebaut: Vorhofmuskulatur, Kammermuskulatur und spezielles Erregungsbildungs- und Leitungssystem. Vorhof- und Kammermuskulatur werden auch als Arbeitsmuskulatur bezeichnet.
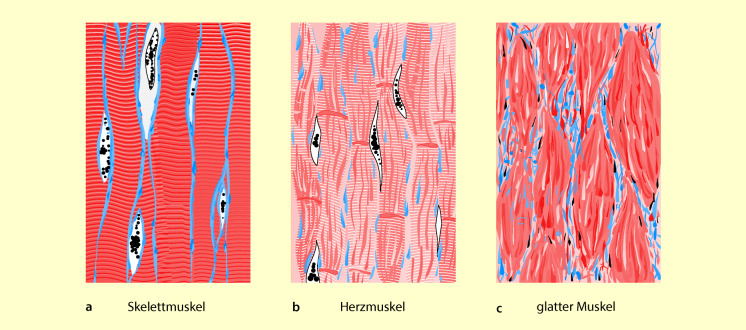
Der Herzmuskel ist, wie der Skelettmuskel, quergestreift, bildet jedoch nicht, wie dieser, ein morphologisches Netzwerk. Vielmehr sind alle Muskelfasern jeweils durch Membranen voneinander getrennt (Abb. 47.1). Die Muskelfasern bestehen aus vielen hintereinandergeschalteten Herzmuskelzellen, die nur durch dünne Membranen voneinander getrennt sind. Da die Erregung sich leicht von Muskelzelle zu Muskelzelle ausbreiten kann, verhält sich das Herzmuskelgewebe, zumindest funktionell, wie ein Netzwerk.
Herzmuskeln unterscheiden sich noch in anderer Hinsicht von quergestreiften Muskeln: sie besitzen eine Automatie, d. h. sie können spontan, ohne humorale (stoffliche) oder nervale Einflüsse, ein Aktionspotenzial bilden und sich rhythmisch kontrahieren.
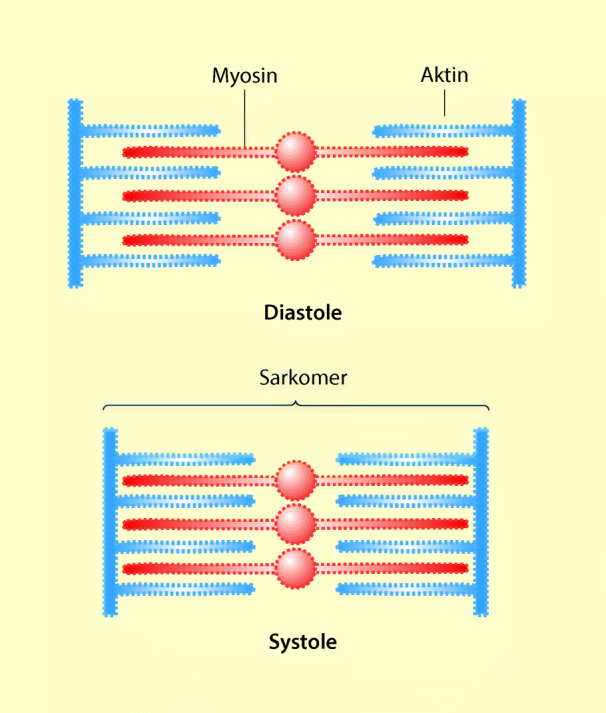
Wie andere Muskeln auch, sind die Herzmuskelzellen aus unzähligen kontraktilen Elementen aufgebaut, den Aktin- und Myosinfilamenten. Diese Filamente überlappen sich. Bei der Kontraktion des Herzmuskels gleiten die Aktin- und Myosinfilamente ineinander: Der Muskel verkürzt sich. Anschließend kehren die Filamente in ihre Ausgangslage zurück: der Muskel erschlafft (Abb. 47.2). Die Kontraktion kann nur unter Vermittlung von Kalziumionen ablaufen, außerdem wird dafür Energie benötigt.
Jeder Kontraktion geht ein Aktionspotenzial voran. Ohne Aktionspotenzial keine Kontraktion! Das Aktionspotenzial (Definition: 10.1007/978-3-662-50444-4_2) entsteht normalerweise im Sinusknoten des rechten Vorhofs. Es breitet sich innerhalb sehr kurzer Zeit über dem gesamten Herzen aus und setzt Kalziumionen frei. Unter dem Einfluss der Kalziumionen kontrahiert sich einige Millisekunden später der Herzmuskel.
Herzzyklus
Die Zeit vom Ende einer Kontraktion des Herzmuskels bis zum Ende der nächsten Kontraktion wird als Herzzyklus bezeichnet. Dieser Zyklus wird jeweils durch ein spontanes Aktionspotenzial aus dem Sinusknoten ausgelöst. Der Herzzyklus besteht aus einer Erschlaffungsphase, der Diastole, und einer Kontraktionsphase, der Systole.
Funktion der Vorhöfe
Die Pumpleistung der beiden Vorhöfe ist gering. Normalerweise fließt das venöse Blut kontinuierlich in die Vorhöfe. Während der Kammerdiastole strömen etwa 70% des Vorhofblutes bereits in die Kammern, bevor die Vorhöfe sich kontrahieren. Nur 30% des Blutes werden durch eine aktive Kontraktion der Vorhöfe in die Ventrikel befördert. Darum kann unter Ruhebedingungen das Herz auf die aktive Kontraktion der Vorhöfe verzichten. Bei Belastung oder bestimmten Herzfehlern (z. B. Mitralstenose) ist jedoch die Vorhofkontraktion ein wesentlicher Beitrag zur Füllung der Kammern. Während des Herzzyklus verändert sich die Druckkurve der Vorhöfe in charakteristischer Weise: Es treten a-, c- und v-Wellen auf:
a-Wellen: sie entstehen durch die Vorhofkontraktion; im rechten Vorhof steigt der Druck hierbei auf 4–6 mmHg an, im linken Vorhof hingegen auf 7–8 mmHg,
c-Welle: sie tritt auf, wenn die Ventrikel sich kontrahieren,
v-Welle: sie entsteht am Ende der Ventrikelkontraktion.
Funktion der Ventrikel
Während der Systole werfen die Ventrikel ihr Blut in die zugehörigen Kreisläufe aus. Gleichzeitig sammeln sich große Mengen Blut in den durch die geschlossenen Klappen von den Ventrikeln getrennten Vorhöfen an. Darum kann sofort nach Erschlaffung der Ventrikel Blut aus den Vorhöfen in die Ventrikel einströmen. Diese Phase wird als rasche Füllungsphase bezeichnet; sie dauert etwa 1/3 der Diastole. Im zweiten Drittel strömt nur eine geringe Blutmenge über die Vorhöfe in die Ventrikel und im letzten Drittel fließen die restlichen 30% durch die Vorhofkontraktion in die Kammern.
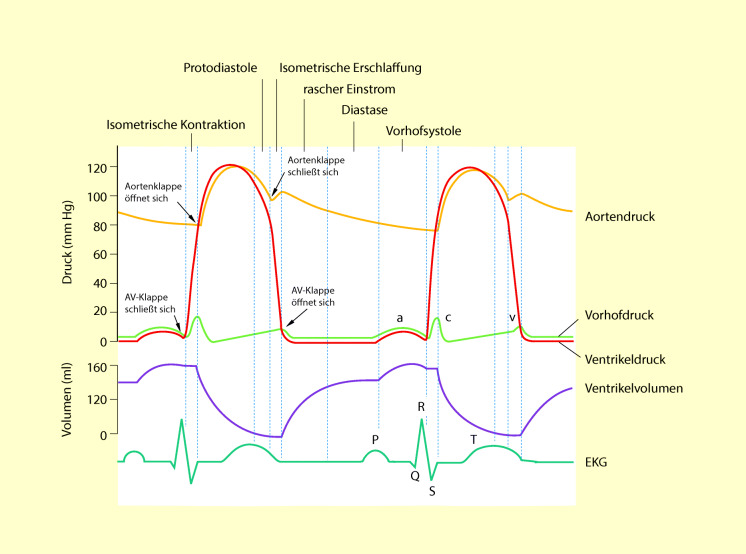
Bei der Ventrikelsystole können verschiedene Phasen unterscheiden werden (Abb. 47.3):
isometrische Kontraktion,
Auswurfphase,
Protodiastole.
Isometrische Kontraktion
Die Ventrikel kontrahieren sich; unmittelbar nach Beginn der Kontraktion steigt der Druck im Ventrikel steil an; die AV-Klappen (Trikuspidalis, Mitralis) schließen sich. In dieser Phase wird kein Blut ausgeworfen.
Auswurfphase (Ejektionsphase)
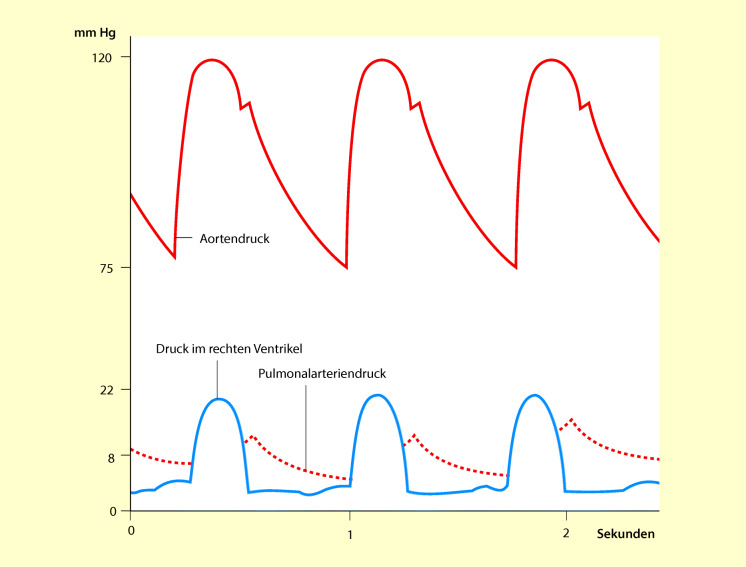
Sobald der Druck im linken Ventrikel den Aortendruck (ca. 80 mmHg) und der Druck im rechten Ventrikel den Pulmonalarteriendruck (ca. 8 mmHg) geringfügig überschreiten, öffnen sich die Aorten- und die Pulmonalisklappe und das Blut wird ausgeworfen, davon 60% bereits innerhalb des ersten Viertels der Systole, der Rest in den folgenden beiden Vierteln.
Protodiastole
Dies ist das letzte Viertel der Systole. In dieser Zeit wird kein Blut mehr ausgeworfen; die Kammern bleiben jedoch noch kontrahiert. Während dieser Phase fällt der arterielle Druck ab, weil große Blutmengen über die Arterien in die peripheren Gefäße einströmen.
Am Ende der Systole erschlafft der Ventrikel schlagartig und die Drücke fallen rasch ab. Da die Drücke in den Arterien (Aorta, Pulmonalis) jetzt größer als die Ventrikeldrücke sind, fließt Blut zurück in Richtung Ventrikel. Hierdurch schließen sich die Aorten- und die Pulmonalisklappe, sodass kein Blut in die Ventrikel zurückströmen kann.
Herzvolumina
Während des Herzzyklus befinden sich jeweils unterschiedliche Blutmengen in den Herzkammern.
Enddiastolisches Volumen
Dies ist das Volumen in den Ventrikeln am Ende der Diastole. Es beträgt etwa 120–130 ml.
Endsystolisches Volumen
Während der Systole werfen die Ventrikel ein Schlagvolumen von ca. 80 ml aus. Zurück bleibt das endsystolische Volumen; das sind ca. 50–60 ml. Bei starker Kontraktion des Ventrikels nimmt das endsystolische Volumen noch weiter ab und das Schlagvolumen damit zu. Das Schlagvolumen kann weiterhin gesteigert werden, wenn das enddiastolische Volumen zunimmt, also mehr Blut in die Herzkammern einströmt (Frank-Starling-Mechanismus).
Ejektionsfraktion, EF (Auswurffraktion)
Sie bezeichnet den Anteil des enddiastolischen Volumens, der mit jedem Herzschlag ausgeworfen wird; dies sind in Ruhe 50–70%, d. h. die EF beträgt 0,5–0,7.
Bei einer EF von 30% bzw. 0,3 liegt eine schwere Funktionsstörung des linken Ventrikels vor.
Funktion der Herzklappen
Das Herz besitzt vier Klappen: zwei atrioventrikuläre Segelklappen (Trikuspidalis und Mitralis) sowie zwei Semilunar- bzw. Taschenklappen (Aortenklappe und Pulmonalklappe, Abb. 47.4). Die AV-Klappen verhindern den Rückstrom von Blut aus den Kammern in die Vorhöfe während der Systole. Die Semilunarklappen verhindern den Rückstrom von Blut aus der Aorta und der A. pulmonalis in die Ventrikel während der Diastole. Alle vier Klappen öffnen und schließen sich passiv aufgrund der entstehenden Druckgradienten. Die Kontraktion der Papillarmuskeln unterstützt lediglich das „Stellen“ der Klappen im Blutstrom.
Steuerung der Herzfunktion
Die Aufgabe des Herzens besteht darin, ein dem Bedarf der Gewebe bzw. Organe angepasstes Herzminutenvolumen zu pumpen. In Ruhe beträgt das Herzminutenvolumen etwa 4–6 l/min; es nimmt jedoch bei Belastung entsprechend dem gesteigerten Bedarf um ein Vielfaches zu. Für die rasche Anpassung des Herzens an einen veränderten Bedarf stehen zwei grundlegende Steuermechanismen zur Verfügung:
der Frank-Starling-Mechanismus (Autoregulation) und
die Reflexkontrolle durch das autonome Nervensystem.
Frank-Starling-Mechanismus (Autoregulation)
Der venöse Rückstrom zum Herzen bestimmt ganz wesentlich, wie viel Blut das Herz jede Minute auswirft. Abhängig von diesem Rückfluss pumpt das Herz automatisch das zurückströmende Blut in den Körperkreislauf. Je mehr Blut zurückströmt, desto mehr Blut wird vom Herzen ausgeworfen und umgekehrt. Diese Fähigkeit des Herzens, sich an wechselnde Mengen zurückströmenden Blutes anzupassen, wird nach ihren beiden Entdeckern als Frank-Starling-Mechanismus bezeichnet. Das Frank-Starling-Gesetz sagt Folgendes aus:
Je stärker das Herz während der Diastole gefüllt wird, desto größer ist die in die Aorta ausgeworfene Blutmenge. Das Herz pumpt also, was es bekommt.
Das Herz kann somit höchst unterschiedliche Volumina pumpen, je nachdem, wie groß der venöse Rückstrom ist.
Worauf beruht der Frank-Starling-Mechanismus?
Durch die vermehrte diastolische Füllung werden die Herzmuskelfasern stärker gedehnt. Aufgrund dieser stärkeren Vordehnung kann sich der Muskel stärker kontrahieren und damit mehr Blut auswerfen; Er hat sich automatisch der erhöhten Blutmenge angepasst. Umgekehrt gilt: Wird das Herz während der Diastole weniger gefüllt, ist auch die Vordehnung der Muskelfasern geringer und die Kontraktion entsprechend weniger stark. Dadurch wird weniger Blut ausgeworfen.
Zwei weitere Mechanismen unterstützen zusätzlich die Pumpfunktion des Herzens, wenn der venöse Rückstrom zunimmt: Durch die vermehrte Dehnung der Vorhöfe nimmt die Herzfrequenz zu; durch Veränderung im Herzstoffwechsel die Kontraktilität.
Wichtig ist noch folgende Beziehung: Innerhalb bestimmter Grenzen ist das Herzminutenvolumen unabhängig vom Aortendruck, gegen den der linke Ventrikel anpumpen muss. Auch wenn der Aortendruck ansteigt, bleibt der venöse Rückstrom der entscheidende Faktor für den Herzauswurf. Erst wenn der Aortendruck Werte um 170 mmHg erreicht, beginnt das Herzzeitvolumen abzufallen.
Reflexkontrolle durch das autonome Nervensystem
Das Herz wird von sympathischen und parasympathischen Nerven versorgt. Die Nerven beeinflussen die Herzfrequenz und die Kontraktionskraft des Herzmuskels. Eine Stimulation des Parasympathikus (Vagus) verlangsamt die Herzfrequenz bis auf 20 Schläge/min bei maximaler Stimulation. Eine Stimulation des Sympathikus steigert die Herzfrequenz maximal auf etwa 250 Schläge/min.
Die Pumpleistung des Herzens wird durch diese beiden Effekte ebenfalls beeinflusst.
Herzfrequenz und Pumpleistung
Innerhalb bestimmter Grenzen gilt:
Je schneller das Herz schlägt, desto mehr Blut wird ausgeworfen und desto höher ist das Herzminutenvolumen.
Ab einer bestimmten Herzfrequenz nimmt jedoch das Herzzeitvolumen wieder ab. Zum einen, weil die Diastole so stark verkürzt wird, dass die Vorhöfe sich nicht mehr ausreichend in die Ventrikel entleeren können; und zum anderen, weil vermutlich die Energiereserven des Herzmuskels erschöpft werden.
Als kritische obere Grenze gilt beim untrainierten Herzgesunden eine Herzfrequenz von 180/min, als untere Grenze von etwa 48 Schlägen/min.
Nervale Kontrolle der Kontraktilität
Während die beiden Vorhöfe mit zahlreichen parasympathischen und sympathischen Nerven versorgt sind, werden die Herzkammern ganz überwiegend von sympathischen Fasern innerviert.
Eine Stimulation des Sympathikus steigert die Kontraktionskraft des Herzens, während eine Stimulation des Vagus die Kontraktionskraft vermindert. Bei maximaler Stimulation des Sympathikus kann die Kontraktionskraft um 100% zunehmen.
Rhythmische Erregung des Herzens
Das Herz besitzt eine Automatie, d. h. es erregt sich selbst und leitet diese Erregung an seine Muskelzellen weiter, die sich nachfolgend kontrahieren. Erregungsbildung und Erregungsleitung des Herzens erfolgen in einem speziellen Gewebe.
Reizbildungs- und Erregungsleitungsgewebe
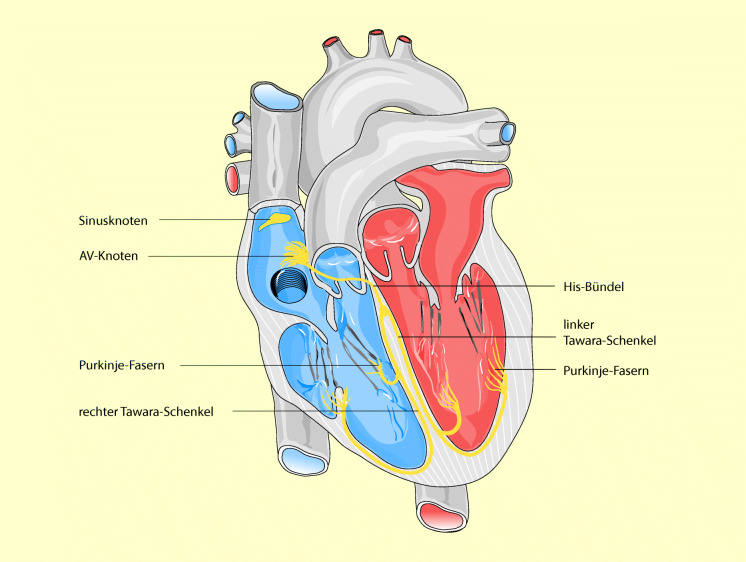
In Abb. 47.5 ist das Reizbildungs- und Erregungsleitungssystems des Herzens dargestellt. Die Selbsterregung des Herzens beginnt im Sinusknoten und läuft von dort zum AV-Knoten, wo sie vor dem Übertritt auf die Kammern etwas verzögert wird. Vom AV-Knoten läuft die Erregung über das AV-Bündel (His-Bündel) auf die Kammern und von dort über den linken und rechten Tawara-Schenkel zum Purkinje-Fasernetz. Von hier aus wird der Impuls über die gesamten Ventrikel geleitet.
Sinusknoten
Der Sinusknoten ist ein kleiner spezialisierter Muskelbezirk an der Hinterwand des rechten Vorhofs nahe der Einmündung der oberen Hohlvene (Abb. 47.5). Der Sinusknoten ist der normale Schrittmacher des Herzens. Zwar besitzen die meisten Herzmuskelfasern die Fähigkeit der Selbsterregung mit nachfolgender Kontraktion. Der Sinusknoten ist jedoch der dominierende Schrittmacher für die Erregung und Kontraktion des Herzens, weil seine Erregbarkeit am größten ist und seine Impulse mit höherer Frequenz ausgesandt werden als die Impulse aus anderen Bezirken, z. B. aus dem AV-Knoten oder aus den Purkinje-Fasern.
AV-Knoten
Vom Sinusknoten wird die Erregung über sog. internodale Bahnen auf den AV-Knoten übertragen. Dieser Knoten liegt in der Wand des rechten Vorhofs zwischen der Mündung des Koronarsinus und dem Ansatz der Trikuspidalklappen. Die Hauptfunktion des AV-Knotens besteht darin, die Erregung zu verzögern, damit sie nicht zu schnell auf die Herzkammern übergeleitet wird. Dadurch können sich die Vorhöfe in die Ventrikel entleeren, bevor diese sich kontrahieren. Auch der AV-Knoten ist, wie der Sinusknoten, in der Lage, sich spontan zu erregen und diese Impulse weiterzuleiten. Seine Aktivität wird aber normalerweise von den Impulsen des Sinusknotens unterdrückt.
Nervale Kontrolle von Herzrhythmus und Erregungsleitung
Der Parasympathikus innerviert v. a. den Sinusknoten und den AV-Knoten und in geringerem Maße die Muskulatur der Vorhöfe, während der Sympathikus ebenfalls die beiden Knoten und außerdem die übrigen Teile des Herzens versorgt.
Vagale Stimulation
Eine Stimulation des Herzvagus setzt an den Nervenendigungen den Transmitter Azetylcholin frei. Die Substanz wirkt in folgender Weise auf das Herz:
Die Frequenz der Erregungsbildung im Sinusknoten wird vermindert.
Die Erregbarkeit der Verbindungsfasern zwischen Vorhofmuskulatur und AV-Knoten wird herabgesetzt; hierdurch wird die Übertragung der Erregung auf die Ventrikel verlangsamt.
Bei maximaler Erregung des N. vagus kann die spontane Erregungsbildung im Sinusknoten oder die Erregungsleitung in den atrioventrikulären Verbindungsfasern vollständig unterdrückt werden. Als Folge werden keine Impulse mehr auf die Ventrikel übertragen. Das Herz bleibt stehen, springt jedoch nach etwa 5–10 s wieder an, weil tiefer liegende Strukturen des Erregungsleitungssystems beginnen, Impulse auszusenden. Es entsteht ein Kammerrhythmus mit niedriger Frequenz (20–40 Schläge/min).
Sympathikusstimulation
Eine Stimulation des Sympathikus setzt an den Nervenendigungen des Herzens den Transmitter Noradrenalin frei, der in folgender Weise auf das Herz wirkt:
Die Frequenz der Erregungsbildung im Sinusknoten wird erhöht.
Die Erregbarkeit und die Erregungsleitung werden im gesamten Herzen gesteigert.
Die Kontraktionskraft der gesamten Herzmuskulatur nimmt zu (positiv inotrope Wirkung).
Eine maximale Stimulation des Sympathikus verdreifacht die Herzfrequenz und verdoppelt die Kontraktionskraft.
Störungen der Erregung
Störungen des Herzrhythmus können durch abnorme Erregungsbildungen oder durch Beeinträchtigung der Erregungsleitung entstehen, z. B.:
abnormer Rhythmus des Schrittmachers,
Ausfall des Sinusknotens als Schrittmacher und Übernahme der Schrittmacherfunktion durch andere Teile des Herzens,
Unterbrechung der Erregungsleitung an verschiedenen Stellen des spezifischen Leitungsgewebes,
pathologische Spontanerregungen in beliebigen Teilen des Herzens.
Die wichtigsten Störungen der Erregungsbildung und -leitung: 10.1007/978-3-662-50444-4_50.
Elektrokardiogramm (EKG)
Die zuvor dargestellten Erregungsvorgänge am Herzen führen zu elektrischen Strömen, die sich über den gesamten Körper ausbreiten. Ein geringer Teil der Ströme erscheint auch an der Oberfläche des Körpers und kann hier in Form von Spannungsdifferenzen über Elektroden mit einem Elektrokardiographen gemessen und als Elektrokardiogramm registriert werden.
Ableitungssysteme
Da die Aktionsströme des Herzens sich über den gesamten Körper ausbreiten, können sie praktisch an jeder beliebigen Stelle abgeleitet werden. Meist werden jedoch folgende Standardableitungen gewählt:
bipolare Extremitätenableitungen,
unipolare Extremitätenableitungen,
unipolare Thoraxwandableitungen,
zusätzliche Thoraxwandableitungen.
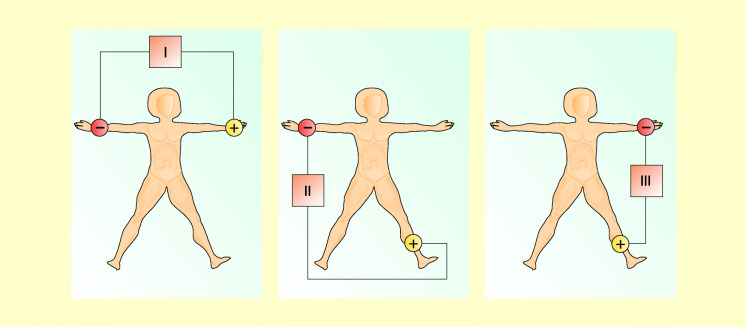
Bipolare Extremitätenableitungen (Einthoven )
Bei dieser Ableitung wird die Spannungsdifferenz (Potenzialdifferenz) zwischen zwei Elektroden (bipolar) gemessen. Hierzu werden die Elektroden oberhalb des Hand- und Fußgelenkes angebracht und in folgender Weise miteinander verbunden (Abb. 47.6):
Ableitung I: rechter Arm – linker Arm,
Ableitung II: rechter Arm – linkes Bein,
Ableitung III: linker Arm – linkes Bein.
Diese drei Ableitungen bilden das sog. Einthoven-Dreieck, in dessen Mitte etwa sich das Herz befindet.
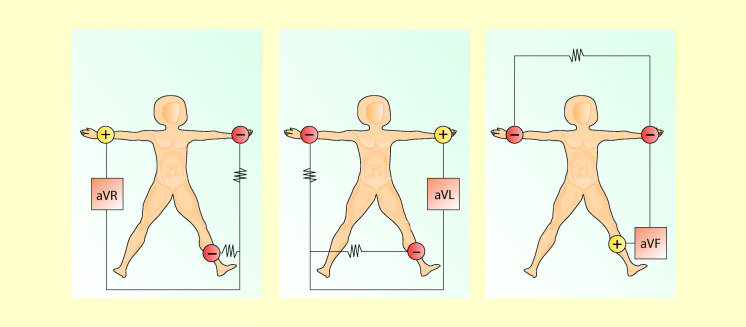
Unipolare Extremitätenableitungen ( Goldberger-Ableitungen)
Diese Ableitungen werden unipolar durchgeführt, d. h. die Spannungsdifferenzen in jeder Extremität für sich registriert. Wie bei den Einthoven-Ableitungen werden die Elektroden an beiden Armen sowie am linken Bein angebracht: aVR, aVL und aVF (Abb. 47.7). Hierbei wird der Unterschied in der Spannung einer Extremität (differente Elektrode) mit der Spannung der beiden zusammengeschalteten übrigen Extremitäten (indifferente oder Nullelektrode) gemessen. Der Buchstabe a bei den Ableitungen bedeutet „augmented“ (verstärkt).
Unipolare Thoraxwandableitungen ( Wilson)
Auch hier wird unipolar abgeleitet. Die differenten Brustwandelektroden werden an genau bezeichneten 6 Stellen des Thorax (V1–V6) angelegt (Abb. 47.8). Als indifferente (Null)elektrode dient die durch Zusammenschluss der drei Extremitätenableitungen entstehende Sammelelektrode. Durch die Kombination von Extremitäten- und Thoraxwandableitungen kann das Herz nicht nur flächenhaft, sondern auch räumlich erfasst werden. Hierdurch wird die Diagnostik von Störungen der Erregung des Herzens wesentlich verbessert.

Zusätzliche Thoraxwandableitungen
Neben den beschriebenen Standardableitungen gibt es noch einige andere spezielle Ableitungen, die internistischen Fragestellungen vorbehalten sind, z. B. die Ableitung nach Nehb.
Normales Elektrokardiogramm
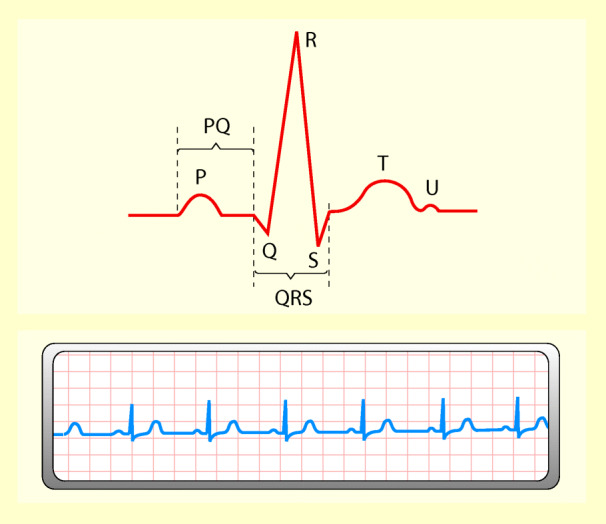
Das normale EKG besteht aus folgenden Zacken und Wellen: P, Q, R, S, T und U (Abb. 47.9). Außerdem gibt es eine isoelektrische Linie, die Nulllinie, bei der keine elektrische Aktivität registriert wird. Diese Linie ist die Bezugslinie zur Vermessung des EKG.
P-Zacke
Die P-Zacke wird durch die elektrische Erregung der Vorhöfe verursacht. Sie geht der Kontraktion der Vorhöfe voran. Amplitude maximal 0,2 mV (Kinder 0,25); Dauer unter 0,11 s.
PQ-Intervall
Die PQ-Zeit entspricht der atrioventrikulären Überleitungszeit. Sie reicht vom Beginn der P-Zacke bis zum Beginn der Q-Zacke. Die PQ-Zeit ist frequenzabhängig; je höher die Herzfrequenz, desto kürzer die PQ-Zeit. Dauer unter 0,21 s.
QRS-Komplex
Er wird durch die elektrische Erregung der Ventrikel hervorgerufen und geht der Kontraktion der Kammern voran. Breite 0,06–0,10 s. Die Q-Zacke ist die erste negative Zacke nach dem PQ-Intervall (Ausschlag nach unten). Sie sollte kleiner sein als die R-Zacke. Die R-Zacke ist die größte Zacke des normalen EKG. In den Thoraxwandableitungen sind die R-Zacken in V1 und V2 klein; sie nehmen nach V5 hin immer mehr zu.
ST-Strecke
Sie reicht vom Beginn der S-Zacke bis zum Beginn der T-Zacke. In diesem Zeitraum sind beide Kammern vollständig depolarisiert. Diese Strecke darf maximal 0,1 mV (1 mm) ober- oder unterhalb der isoelektrischen Linie verlaufen.
T-Zacke
Sie entspricht der Erregungsrückbildung in den Herzkammern (Repolarisation).
QT-Dauer
Die QT-Zeit reicht vom Beginn der Q-Zacke bis zum Ende der T-Zacke; sie entspricht der gesamten elektrischen Kammersystole (nicht der mechanischen Kontraktion!).
U-Welle
Die U-Welle tritt nach der T-Zacke auf. Ihre Bedeutung ist unklar.
Bei der Beurteilung des EKG muss Folgendes beachtet werden: Das EKG erlaubt nur Aussagen über die elektrische Aktivität des Herzens, nicht hingegen über die mechanische Funktion des Herzens oder gar des Kreislaufs.
Kreislauf
Hämodynamik
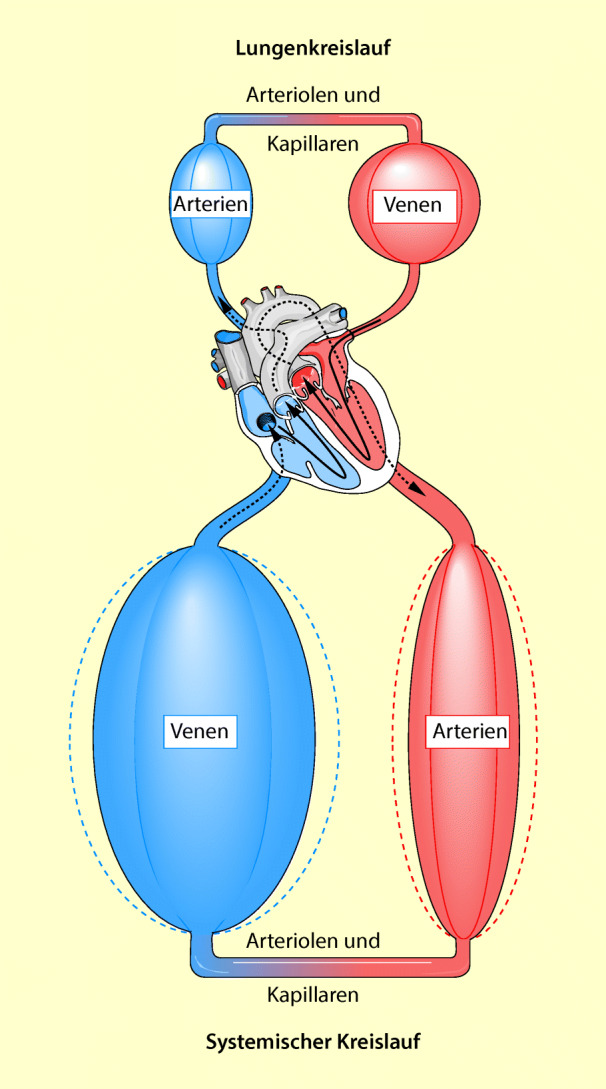
Der Blutkreislauf besteht aus zwei Hauptteilen (Abb. 47.10):
systemischer Kreislauf,
Pulmonalkreislauf.
Im Kreislauf fließt, angetrieben durch die Herzpumpe, das Blut. Während das Blut in den großen Gefäßen nahezu ohne Widerstand strömt, setzen die Arteriolen und Kapillaren wegen ihres geringen Durchmessers dem Blutstrom den größten Widerstand entgegen. Um den Widerstand dieser kleinen Gefäße zu überwinden, muss das Herz das Blut unter hohem Druck in die Arterien pumpen: ca. 120 mmHg systolisch im großen Kreislauf und ca. 20 mmHg im kleinen Kreislauf.
Physikalische Eigenschaften von Blut
Blut ist eine visköse Flüssigkeit, die aus Plasma und Zellen besteht. Die Zellen sind fast ausschließlich Erythrozyten.
Hämatokrit
Der Hämatokrit beschreibt den Anteil der Zellen im Blut in Prozent. Wird ein Hämatokrit von 40% gemessen, so beträgt der Zellanteil 40%, der Plasmaanteil hingegen 60% des gesamten Blutvolumens.
Blut ist viskös (zähflüssig) und diese Viskosität erschwert die Strömung des Blutes. Die Viskosität hängt direkt vom Hämatokrit ab: je höher der Hämatokrit, desto visköser das Blut. Steigt die Viskosität an, muss das Herz einen höheren Druck erzeugen, damit das Blut ausreichend strömen kann.
Plasma
Das Plasma hat nahezu die gleiche Zusammensetzung wie die interstitielle Flüssigkeit, enthält jedoch mit 7% einen wesentlich höheren Anteil an Eiweißen (Proteinen) als die interstitielle Flüssigkeit (2%). Die Proteine können nur in geringem Maße durch die Poren der Kapillaren in das Interstitium abwandern und bleiben aus diesem Grund im Gefäßsystem.
Blutfluss, Blutdruck und Widerstand
Blutfluss
Der Blutstrom in einem Blutgefäß hängt von zwei Faktoren ab:
der Druckdifferenz zwischen den beiden Enden des Gefäßes; sie ist die treibende Kraft für die Blutströmung, nicht der absolute Druck im Gefäß: je größer die Druckdifferenz, desto höher der Blutfluss,
dem Gefäßwiderstand, der dem Blutfluss im Gefäß entgegen gerichtet ist.
Der Blutfluss oder Blutstrom bezeichnet die Blutmenge in ml oder Liter, die innerhalb einer bestimmten Zeit durch einen bestimmten Abschnitt des Kreislaufs fließt. Der gesamte Blutfluss im Körper beträgt in Ruhe etwa 5 l/min. Er wird als Herzminutenvolumen bezeichnet.
Normalerweise strömt das Blut laminar, d. h. jede Blutschicht bleibt während der Strömung immer in gleicher Entfernung von der Gefäßwand, also der zentrale Blutstrom immer in der Gefäßmitte. Als turbulenter Strom wird hingegen ein Blutfluss bezeichnet, der in alle Richtungen innerhalb des Gefäßes fließt und sich ständig innerhalb des Gefäßes mischt. Turbulenz tritt, z. B. auf, wenn das Blut zu schnell fließt oder scharf die Flussrichtung ändert. Bei Turbulenz steigt der Widerstand an.
Blutdruck
Der Blutdruck ist die Kraft, die das Blut auf einen beliebigen Abschnitt der Gefäßwand ausübt:
Der Druck wird meist in mmHg gemessen, manchmal auch in cmH2O.
Widerstand
Der Widerstand ist die Behinderung des Blutflusses beim Durchströmen eines Blutgefäßes. Er kann nicht direkt gemessen, sondern muss aus dem Blutfluss und der Druckdifferenz im Gefäß errechnet werden:
Als totaler peripherer Widerstand wird der Gesamtwiderstand des systemischen Kreislaufs bezeichnet.
Der Widerstand eines Gefäßes hängt ganz wesentlich von seinem Durchmesser ab: je kleiner der Durchmesser, desto höher der Widerstand gegen die Blutströmung und umgekehrt.
Auch der Blutdruck beeinflusst den Gefäßwiderstand: Da die Gefäße dehnbar sind, nimmt ihr Durchmesser mit steigendem Blutdruck zu. Dadurch nimmt der Widerstand ab. Umgekehrt gilt: Fällt der Druck, so nimmt der Widerstand zu. Wird der Druck aber zu niedrig, so hört die Blutströmung ganz auf. Dieser Druck, bei dem die Blutströmung aufhört, wird als kritischer Verschlussdruck bezeichnet. Er beträgt etwa 20 mmHg.
Dehnbarkeit der Gefäße
Die verschiedenen Gefäße des Körpers unterscheiden sich erheblich in ihrer Dehnbarkeit und damit in ihrer Kapazität. So sind die dünnwandigen Venen etwa 6- bis 10-mal dehnbarer als die Arterien mit ihren dickeren Wänden. Bei einem entsprechenden Druckanstieg können sie darum auch 6- bis 10-mal mehr Blut aufnehmen als Arterien vergleichbarer Größe. Wegen ihrer hohen Dehnbarkeit können die Venen große Mengen Blut speichern, ohne dass der Druck im Gefäß wesentlich zunimmt. Darum werden die Venen auch als Kapazitäts- oder Speichergefäße bezeichnet. Die Venen stehen unter Kontrolle des sympathischen Nervensystems. Durch Zunahme des Venentonus über eine Sympathikusstimulation können große Blutmengen zum Herzen verschoben werden.
Mittlerer Kreislauffüllungsdruck
Der mittlere Kreislauffüllungsdruck ist ein Maß für den Füllungszustand des gesamten Kreislaufsystems. Dies ist der Druck, der unmittelbar nach einem Kreislaufstillstand im Gefäßsystem gemessen werden könnte. Der mittlere Kreislauffüllungsdruck bestimmt, wie schnell das Blut zum rechten Vorhof zurückfließt und hat damit maßgeblichen Einfluss auf die Größe des Herzzeitvolumens.
Systemischer Kreislauf
Der systemische Kreislauf wird auch als Großkreislauf oder peripherer Kreislauf bezeichnet. Seine wichtigsten funktionellen Bestandteile sind:
Arterien
Sie leiten das Blut unter hohem Druck zu den Geweben. Ihre Gefäßwand ist stark, die Blutströmung im Gefäß hoch.
Arteriolen
Dies sind die kleinsten Arterien. Ihre Gefäßwand ist muskelstark und kann das Gefäß komplett verschließen oder um das 7-fache erweitern. Auf diese Weise wirken die Arteriolen (Widerstandsgefäße) als Regulierventile für den Blutstrom. Sie steuern den Einstrom des Blutes in die Kapillaren.
Kapillaren
Über die Kapillaren findet der Austausch von Flüssigkeit, Nährstoffen, Elektrolyten, Hormonen usw. mit den Geweben statt. Darum besitzen die Kapillaren eine sehr dünne Wand, die für niedermolekulare Stoffe durchgängig ist.
Venolen
Sie sammeln das Blut aus den Kapillaren und gehen in größere Venen über.
Venen
Diese dienen als Leitungen für den Rücktransport des Blutes von den Geweben zum Herzen. Ihre Wand ist zwar dünn, kann sich jedoch kontrahieren oder erweitern.
Verteilung des Blutvolumens
Das Blut im systemischen Kreislauf verteilt sich in folgender Weise:
Arterien: 15%,
Kapillaren: 5%,
Venen: 64%.
Hieraus ergibt sich: ca. 84% des Blutvolumens befindet sich im systemischen Kreislauf, davon der allergrößte Teil in den Venen, der Rest im Herzen und im Lungenkreislauf.
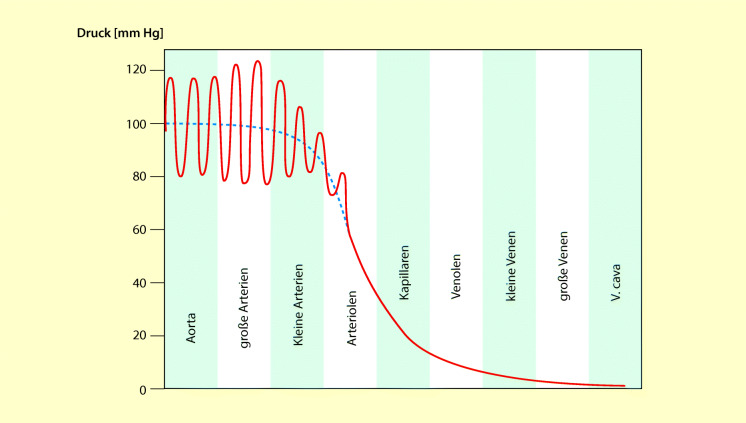
Drücke im systemischen Kreislauf
In Abb. 47.11 ist der Druckverlauf im systemischen Kreislauf dargestellt. Der arterielle Blutdruck ist in der Aorta am höchsten. Da das Herz einen pulsatilen (pulsierenden) Fluss erzeugt, schwankt der Blutdruck zwischen Systole und Diastole etwa um 40 mmHg. Bei weiterem Einstrom in den Systemkreislauf fällt der Druck fast auf 0 ab. Der Druckabfall in den verschiedenen Teilen des systemischen Kreislaufs hängt direkt vom Gefäßwiderstand ab. Er ist in den Arteriolen am größten, weil diese Gefäße der Blutströmung den größten Widerstand entgegensetzen.
Arterieller Druckpuls
Das Herz erzeugt einen pulsierenden (pulsatilen) Blutfluss. Dadurch strömt das Blut nicht kontinuierlich, sondern rhythmisch in die Arterien ein, sodass ein Druckpuls entsteht. Der höchste Wert des Druckpulses entspricht dem systolischen Druck, der niedrigste hingegen dem diastolischen Druck. Die Differenz zwischen den beiden Drücken wird als Pulsdruck bezeichnet. Der Pulsdruck hängt v. a. vom Schlagvolumen und von der Dehnbarkeit des arteriellen Gefäßsystems ab. Im Allgemeinen gilt: je höher das Schlagvolumen, desto größer der Pulsdruck.
Radialispuls
Der Griff an den Radialispuls gehört zu den typischen Handbewegungen der meisten Ärzte. Manchmal können hiermit folgende Veränderungen festgestellt werden:
Schwacher Puls
Häufigste Ursachen sind: niedriges Schlagvolumen oder Dämpfung der Pulswelle durch Gefäßspasmen (z. B. bei Zentralisation).
Paradoxer Puls
Der Pulsdruck wechselt mit der Atmung: schwach, stark, schwach usw. Diese Veränderungen entstehen durch die Schwankungen des HZV mit der Atmung.
Pulsdefizit
Hierzu muss der Puls gefühlt und gleichzeitig das Herz auskultiert werden. Bei Vorhofflimmern sind z. B. mehr Herztöne zu hören als Pulsschläge zu fühlen, d. h. nicht alle Herzschläge werfen genügend Blut aus, um eine Pulswelle zu erzeugen.
Alternierender Puls
Das Herz schlägt von Schlag zu Schlag unterschiedlich stark, entsprechend wechselt die Pulsstärke.
Funktion der Arteriolen und Kapillaren
Die Arteriolen kontrollieren durch Eng- oder Weitstellung den Blutfluss zu den einzelnen Organen, während über die Kapillaren die Austauschvorgänge zwischen Blut und Geweben ablaufen.
Die Arteriolen sind kurz und stark verzweigt; eine Arteriole versorgt 10–100 Kapillaren. In den peripheren Geweben gibt es über 50 Billionen Kapillaren mit einer Gesamtoberfläche von 500 m2.
Die Kapillarmembran ist sehr dünn und stark durchlässig für Wasser und alle im Plasma und in den Geweben gelösten Substanzen, mit Ausnahme der Eiweiße.
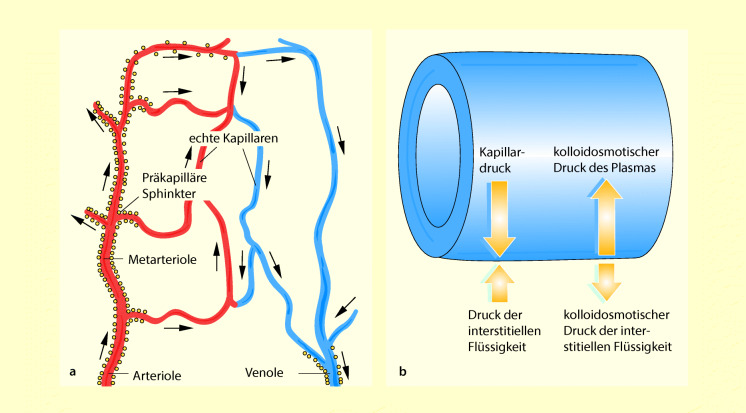
Kolloidosmotischer Druck
Weil die Eiweiße das Gefäßsystem nicht verlassen können, üben sie einen Druck aus, den kolloidosmotischen Druck. Er spielt eine wichtige Rolle beim Flüssigkeitsaustausch an der Membran. Die Flüssigkeitsbewegung durch die Kapillarmembran hängt von zwei Druckgradienten ab (Abb. 47.12):
hydrostatischer Druckgradient zwischen Innen- und Außenseite der Membran,
kolloidosmotischer Druckgradient zwischen den beiden Membranseiten.
Ist der hydrostatische Druck im Gefäß im Vergleich zum hydrostatischen Druck im Gewebe hoch, strömt Wasser aus der Kapillare in das Gewebe. Diesem Ausstrom wirkt der kolloidosmotische Druck in der Kapillare entgegen; denn dieser Druck ist im Gefäß wesentlich höher als im Gewebe. Normalerweise stehen hydrostatischer und kolloidosmotischer Druck untereinander im Gleichgewicht, sodass der Nettoaustausch von Flüssigkeit zwischen Gefäß und Gewebe gering ist. Wäre dies nicht so, würden im Gewebe fortlaufend Ödeme entstehen.
Steigt jedoch unter pathologischen Verhältnissen der Druck in der Kapillare zu stark an, geht Flüssigkeit aus dem Kreislauf ins Gewebe verloren: es entsteht ein Ödem. Fällt hingegen der Druck in der Kapillare ab, strömt die Flüssigkeit zurück ins Gefäß.
Funktion der Venen, Venendrücke
Das gesamte Blut des Körpers sammelt sich in den Venen und fließt über diese Gefäße in den rechten Vorhof.
Der Druck im rechten Vorhof bzw. in den großen herznahen Venen wird als zentraler Venendruck (ZVD ) bezeichnet. Er beträgt im (zeitlichen) Mittel 3–5 mmHg.
Der Druck in den peripheren Venen wird ganz wesentlich durch den zentralen Venendruck beeinflusst. Damit Blut zum Herzen zurückfließen kann, muss ein Druckgefälle zwischen den peripheren Venen und dem zentralen Venendruck bestehen, d. h. der zentrale Venendruck bzw. Druck im rechten Vorhof muss niedriger sein als der Druck in den peripheren Venen. Der Druck in den peripheren Venen liegt etwa 4–9 mmHg über dem zentralen Venendruck. Ein Teil der peripheren Venen ist bereits unter normalen Umständen kollabiert. So werden z. B. die Halsvenen im Stehen so stark durch den Luftdruck komprimiert, dass sie teilweise kollabieren. Hingegen kollabieren die Venen innerhalb des Thorax nicht, weil der negative Druck im Thorax auf sie erweiternd wirkt.
Hydrostatischer Druck
Das Blut besitzt als Flüssigkeit ein bestimmtes Gewicht und übt damit, auch wenn der Kreislauf steht, einen bestimmten Druck im Gefäßsystem aus, den hydrostatischen Druck. Den Einfluss des hydrostatischen Drucks auf die Venendrücke zeigt Abb. 47.13.
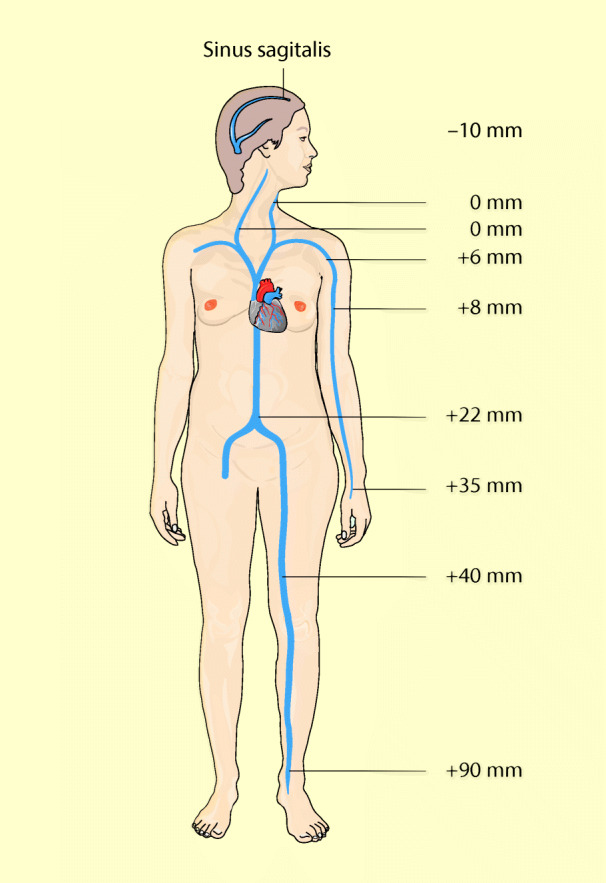
Steht eine Person absolut still, bleibt der Druck im rechten Vorhof etwa bei 0–4 mmHg, weil das Blut ständig weggepumpt wird. In den Venen des Fußes steigt hingegen der Druck aufgrund des Gewichts der Blutsäule und ihrer Entfernung zum Herzen auf 85–90 mmHg an. In den Halsvenen ist der Druck hingegen 0 mmHg, weil die Venen durch den Umgebungsdruck kollabieren. Andererseits gilt: Steigt der Druck in den Halsvenen an, öffnen sie sich und der Druck fällt wieder ab: Die Venen innerhalb des Schädels können nicht kollabieren, darum ist der Druck in den Blutsinus der Dura im Stehen z. T. negativ. Der negative Druck (Sog) entsteht durch den hydrostatischen Sog zwischen Schädeldach und Schädelbasis. Darum kann bei neurochirurgischen Operationen eine große Menge Luft angesaugt werden, wenn der Sinus oberhalb des Herzens liegt.
Damit nun aber der Venendruck, z. B. im Fuß, wegen des hydrostatischen Drucks nicht ständig 90 mmHg beträgt, besitzen die Venen Klappen. Diese Klappen verhindern, dass Blut in den Venen rückwärts fließt. Außerdem werden die Venen mit jeder Bewegung durch die Muskeln komprimiert und ausgepresst, ein Vorgang, der als Muskelpumpe bezeichnet wird. Muskelpumpe und Venenklappen bewirken, dass der Venendruck im Fuß normalerweise unter 25 mmHg liegt. Steht jedoch der Mensch ganz still, so arbeitet die Muskelpumpe nicht und der Druck in den Venen kann auf den hydrostatischen Druck von 90 mmHg ansteigen. Dann schwellen die Füße an, weil der Kapillardruck stark zunimmt. Das zirkulierende Blutvolumen nimmt ab: es versackt in den unteren Extremitäten.
Referenzpunkt für Druckmessungen
Bei allen Druckmessungen im Herz-Kreislauf-System muss ein Punkt als hydrostatischer Referenzpunkt (0-Druck) gewählt werden.
Der hydrostatische Referenzpunkt ist die Ebene der Trikuspidalklappe.
An dieser Stelle beträgt der hydrostatische Druck um 0 mmHg. Er wird hier auch durch Lageveränderungen des Körpers um nicht mehr als 1 mmHg beeinflusst. Darum beziehen sich alle gemessenen Druckwerte im Kreislauf auf diesen Referenzpunkt.
Venen als Blutreservoir
In den gesamten Venen des Körpers einschließlich des Lungenkreislaufs befindet sich eine große Blutmenge, die z. B. als funktionelles Reservoir angesehen werden kann. Geht Blut aus den Gefäßen verloren, kontrahieren sich die Venen unter dem Einfluss des sympathischen Nervensystems. Hierdurch wird Blut aus den Venen zum Herzen verschoben und der Blutverlust innerhalb bestimmter Grenzen (etwa 20–25% Blutverlust) kompensiert.
Steuerung der Durchblutung
Die Durchblutung der einzelnen Organe unterscheidet sich voneinander. Sie wird durch lokale, nervale und humorale Faktoren gesteuert.
Lokale Steuerung
Die meisten Organe steuern ihren aktuellen Blutbedarf selbst, entsprechend ihrem Bedarf an Sauerstoff und Nährstoffen. Sie besitzen eine Autoregulation: sinkt ihr Bedarf, drosseln sie ihre Durchblutung, nimmt er zu, steigern sie ihre Durchblutung. Eine wichtige regulatorische Rolle spielt hierbei die sog. Mikrozirkulation. Im Mittelpunkt der Mikrozirkulation steht das Kapillarbett, in dem der Stoff- und Flüssigkeitsaustausch zwischen Blut und Geweben stattfindet. Der Einstrom vom Blut in das Kapillarbett erfolgt über die Arteriolen und Metarteriolen, der Ausstrom über Venolen. Arteriolen und Venolen stehen unter der Kontrolle des sympathischen Nervensystems.
Nervale Steuerung
Das sympathische Nervensystem (10.1007/978-3-662-50444-4_2) besitzt vasodilatatorische, v. a. aber vasokonstriktorische Fasern. Diese vasokonstriktorischen Fasern sind praktisch über das gesamte Gefäßsystem verteilt. Das vasokonstriktorische System wird durch das Vasomotorenzentrum im Gehirn (in der Medulla oblongata) kontrolliert. Dieses Zentrum steht über das Rückenmark mit den konstriktorischen Fasern der Blutgefäße in direkter Verbindung.
Neben dem Gefäßtonus kontrolliert das Vasomotorenzentrum auch die Aktivität des Herzens.
Der Überträgerstoff an den Nervenendigungen der vasokonstriktorischen Fasern ist das Noradrenalin. Wird diese Substanz freigesetzt, kontrahieren sich die Blutgefäße.
Neben den beschriebenen Mechanismen gibt es noch eine nervale Reflexkontrolle des Kreislaufs, die den Blutdruck, das Blutvolumen und die Körpertemperatur mitreguliert.
Humorale Steuerung
Unter humoraler Steuerung versteht man die Beeinflussung der Herz-Kreislauf-Funktion durch bestimmte körpereigene Substanzen, z. B. Hormone oder Ionen:
vasokonstriktorische Substanzen: Noradrenalin, Adrenalin, Angiotensin, antidiuretisches Hormon (Vasopressin),
vasodilatatorische Substanzen: Histamin, Serotonin, Bradykinin, Prostaglandine.
Auch Ionen können den Gefäßtonus beeinflussen: Kalziumionen führen zur Vasokonstriktion, Kaliumionen zur Vasodilatation, ebenso Magnesiumionen.
Arterieller Blutdruck
Der mittlere arterielle Blutdruck muss relativ konstant bleiben, damit die Organe ihre eigene Durchblutung selbst steuern können. Der mittlere arterielle Blutdruck ist der Durchschnittsdruck während des gesamten Herzzyklus. Er beträgt etwa 96 mmHg. Dieser Druck ist dafür verantwortlich, dass die Blutsäule durch das Gefäßsystem getrieben wird; es gilt:
mittlerer arterieller Druck (MAP) = HZV × totaler peripherer Widerstand.
Die Formel zeigt: ändert sich das HZV oder der periphere Widerstand und bleibt die andere Größe konstant, ändert sich auch der arterielle Blutdruck.
Der arterielle Blutdruck wird nicht durch ein einziges System, sondern durch zahlreiche Mechanismen reguliert. Hierbei können sofort wirkende Mechanismen von verzögert einsetzenden unterschieden werden.
Barorezeptorenreflexe
In den Wänden von Aortenbogen und Karotissinus liegen Dehnungsrezeptoren, die bei einem Druckanstieg im Gefäß gestreckt werden und auf diese Streckung hin Impulse zum zentralen Nervensystem aussenden. Diese Impulse hemmen das Vasokonstriktorenzentrum und erregen das Vaguszentrum: Die Aktivität des Sympathikus wird vermindert. Die Folgen sind:
Vasodilatation im peripheren Kreislauf,
Abnahme der Herzfrequenz,
Abnahme der Kontraktionskraft des Herzens.
Es gilt daher: eine Erregung der Barorezeptoren durch einen Blutdruckanstieg senkt nachfolgend den erhöhten Blutdruck. Bei einem Blutdruckabfall senden die Rezeptoren weniger Impulse aus, weil ihre Dehnung geringer ist. Folglich nimmt die Aktivität des Vasokonstriktorentonus zu, der Blutdruck steigt wieder an.
Die Reflexreaktion durch die Barorezeptoren tritt praktisch sofort auf. Neben den Barorezeptorenreflexen gibt es noch zahlreiche andere Reflexmechanismen, durch die der Blutdruck sofort beeinflusst wird.
Hormonelle Kontrolle
Neben den nerval vermittelten Sofortreaktionen bestehen noch hormonelle Regulationsmechanismen für den arteriellen Blutdruck:
Noradrenalin – Adrenalin
Diese beiden Hormone werden im Nebennierenmark freigesetzt, gelangen mit dem Blutstrom zu den Blutgefäßen und wirken dort wie eine direkte Sympathikusstimulation. Die Wirkung tritt sofort ein.
Renin – Angiotensin
Wenn der Blutdruck abfällt, werden große Mengen Angiotensin II freigesetzt. Diese Substanz gehört zu den stärksten Vasokonstriktoren überhaupt. Die Bildung von Angiotensin wird über eine Freisetzung des Hormons Renin aus der Niere gesteuert. Die maximale Wirkung des Systems wird nach etwa 20 min erreicht.
Vasopressin (ADH)
Fällt der Blutdruck ab, wird aus dem Hypophysenhinterlappen Vasopressin (ADH) in großer Menge freigesetzt. Diese Substanz wirkt direkt konstriktorisch auf die Blutgefäße.
Die Langzeitkontrolle des Blutdrucks erfolgt v. a. durch renale Mechanismen.
Regulation des Herzzeitvolumens (HZV)
Herzzeitvolumen und venöser Rückstrom sind eng miteinander verbunden.
Herzzeitvolumen
Das Herzzeitvolumen ist die Blutmenge, die pro Minute vom Herzen in die Aorta gepumpt wird. Der venöse Rückstrom ist die Blutmenge, die in jeder Minute aus dem Körper in den rechten Vorhof zurückfließt.
Beide Größen, HZV und venöser Rückstrom, müssen gleich sein, wenn das Herzzeitvolumen aufrechterhalten werden soll. Abweichungen voneinander sind lediglich für einige wenige Herzschläge möglich. Nimmt also der venöse Rückstrom ab, wird das HZV kleiner.
Die Hauptaufgabe des Herz-Kreislauf-Systems besteht darin, ein ausreichendes Herzzeitvolumen aufrechtzuerhalten, damit die Organe ihre Funktion richtig erfüllen können.
Normwerte
Herzzeitvolumen: ca. 4–6 l/min
Herzindex (Cardiac Index, Cl) = HZV/m2 Körperoberfläche: ca. 2,4–4,2 l/min/m2
HZV und peripherer Kreislauf
Der periphere Kreislauf bestimmt ganz entscheidend die Größe des Herzzeitvolumens, nicht das Herz selbst! Denn aufgrund des Frank-Starling-Mechanismus pumpt das Herz automatisch innerhalb bestimmter Grenzen jede Blutmenge, die aus dem Körper in den rechten Vorhof strömt, auch wieder heraus in den Körperkreislauf. Die Blutmenge, die automatisch, d. h. unabhängig vom autonomen Nervensystem, durch das Herz gepumpt werden kann, beträgt 13–15 l/min und liegt damit weit über dem Ruhebedarf von 5 l/min. Es gilt somit:
Innerhalb der Grenzen bis max. 13–15 l/min wird die Größe des Herzzeitvolumens v. a. vom venösen Rückstrom aus dem peripheren Kreislauf gesteuert.
Letztendlich hängt die Größe des HZVs von der Stoffwechselaktivität des Körpers ab. Je größer der Stoffwechsel, desto größer der Bedarf an Sauerstoff und Nährstoffen und desto größer auch das Herzzeitvolumen. Darum nimmt bei körperlicher Anstrengung oder Fieber das HZV zu. Bei körperlicher Anstrengung spielt das sympathische Nervensystem eine wichtige Rolle in der Regulation des HZV.
HZV und sympathisches Nervensystem
Bei einer Sympathikusstimulation pumpt das Herz stärker, weil die Kontraktionskraft zunimmt. Die peripheren Gefäße einschließlich der Venen kontrahieren sich. Eine Abnahme des Sympathikotonus hat den umgekehrten Effekt.
Lungenkreislauf
Das Herzzeitvolumen des rechten Ventrikels ist genau so groß wie das Herzzeitvolumen des linken Ventrikels, d. h. durch den Lungenkreislauf fließt die gleiche Blutmenge wie durch den Körperkreislauf.
Die Durchblutung der Lunge erfolgt durch den rechten Ventrikel. Von hier strömt das venöse Blut durch die Pulmonalklappe in die A. pulmonalis und von dort über die Pulmonalarterien zu den Lungenkapillaren in den Alveolen. Hier findet der pulmonale Gasaustausch statt. Danach sammelt sich das „arterialisierte“ Blut in den Lungenvenen und strömt über den linken Vorhof durch die Mitralklappe in den linken Ventrikel. Neben diesen Gefäßen gibt es noch Bronchialarterien, die das Lungengewebe mit arteriellem Blut aus dem Körperkreislauf versorgen. Dieses Blut entleert sich nach dem Stoffwechsel im Gewebe über Pulmonalvenen als venöses Blut in den linken Vorhof und vermischt sich dort mit dem arterialisierten Blut.
Drücke im Lungenkreislauf
Der Druckverlauf im rechten Ventrikel und im Lungenkreislauf ist in Abb. 47.14, vergleichend mit dem Druckverlauf im Körperkreislauf, dargestellt. Hieraus wird ersichtlich, dass die Drücke im rechten Ventrikel und Lungenkreislauf erheblich niedriger sind als im Körperkreislauf.
Blutvolumen in der Lunge
Die Lunge ist eine Art Blutreservoir. Normalerweise beträgt das Blutvolumen in der Lunge etwa 450 ml. Diese Menge kann unter bestimmten Bedingungen um rund 200% zunehmen. Die Lungengefäße verhalten sich wie passiv dehnbare Röhren: Sie erweitern sich, wenn der Druck ansteigt und sie verengen sich wieder, wenn der Druck abnimmt.
Die Durchblutung der Lunge ist aufgrund von hydrostatischen Druckgradienten nicht gleichmäßig. Es lassen sich drei Zonen unterscheiden:
Zone I liegt im Bereich der Lungenspitzen; hier ist die Durchblutung am geringsten.
Zone II liegt in den mittleren Teilen der Lunge; hier ist die Durchblutung mittelstark.
Zone III betrifft die unteren Lungenabschnitte; hier ist die Durchblutung am stärksten.
Die Koronardurchblutung ist in 10.1007/978-3-662-50444-4_21 und die Hirndurchblutung in 10.1007/978-3-662-50444-4_24 beschrieben.
Contributor Information
Collaborators: Tobias Fink and Tilmann Müller-Wolff
Nachschlagen und Weiterlesen
- [1].Ban SA, Bauer TO, Nagy ZZ. Herz und Kreislauf, Blut und Gefäße. Wien: Maudrich; 2011. [Google Scholar]
- [2].Schmidt RF, Lang F, Heckmann M. Physiologie des Menschen. Mit Pathophysiologie. Heidelberg Berlin: Springer; 2010. [Google Scholar]
- [3].Schweitzer R. Herz-Kreislauf-System. München: Elsevier; 2010. [Google Scholar]
Internet
- [4].Wikipedia. Kategorie: Herz-Kreislauf-Physiologie. www.wikipedia.org