Abstract
Die respiratorische Insuffizienz gehört zu den häufigsten Störungen beim Intensivpatienten, besonders nach großen Operationen. Grundlegende Mechanismen sind Hypoventilation, Verteilungsstörungen der Atemluft, venöse Beimischung in der Lunge (Links-rechts-Shunt) und Diffusionsstörungen der Atemgase. In schweren Fällen führt die respiratorische Insuffizienz zu O2-Mangel und Hyperkapnie. Die Behandlung richtet sich in erster Linie nach den zugrunde liegenden Ursachen.
Die respiratorische Insuffizienz gehört zu den häufigsten Störungen beim Intensivpatienten, besonders nach großen Operationen. Grundlegende Mechanismen sind Hypoventilation, Verteilungsstörungen der Atemluft, venöse Beimischung in der Lunge (Links-rechts-Shunt) und Diffusionsstörungen der Atemgase. In schweren Fällen führt die respiratorische Insuffizienz zu O2-Mangel und Hyperkapnie. Die Behandlung richtet sich in erster Linie nach den zugrunde liegenden Ursachen.
Definitionen und Klassifizierung
Eine respiratorische Insuffizienz entsteht durch Störungen der Ventilation, des pulmonalen Gasaustausches oder der Lungendurchblutung. Sie ist durch pathologische Veränderungen der arteriellen Blutgase gekennzeichnet. Klinisch kann zwischen Störungen der Oxygenierung und Störungen der Ventilation unterschieden werden.
Respiratorische Partial- und Globalinsuffizienz
Störungen der Oxygenierung, auch als respiratorische Partialinsuffizienz (Teilinsuffizienz) bezeichnet, führen zum Abfall des arteriellen pO2, zur Hypoxie und – bei Atmung von Raumluft – auch der arteriellen O2-Sättigung
Störungen der Ventilation führen zum Anstieg des arteriellen pCO2 (Hyperkapnie) und zum Abfall des arteriellen pO2 (Hypoxie) und der arteriellen O2-Sättigung, d. h. zur respiratorischen Globalinsuffizienz
Begriffe
Arterielle Hypoxie: Abfall des paO2 auf unter 70 mmHg,
hypoxische Hypoxämie: Abfall des arteriellen O2-Gehalts, caO2, auf unter 18 ml/dl,
Hyperkapnie: Anstieg des arteriellen pCO2 auf über 45 mmHg.
Klassifizierung
Die respiratorische Insuffizienz wird auch in folgender Weise klassifiziert.
Typ I: Oxygenierungsversagen (pulmonales Parenchymversagen): Störungen des Belüftungs-Durchblutungs-Verhältnisses führen zum Abfall des paO2; der paCO2 ist normal oder erniedrigt (kompensatorische Hyperventilation); der alveoloarterielle O2-Partialdruckgradient, die venöse Beimischung und der Totraumanteil des Atemzugvolumens sind erhöht.
Typ II: Ventilationsversagen (pulmonales Pumpversagen): Es besteht eine alveoläre Hypoventilation; der paCO2 ist erhöht, der paO2 und die saO2 (bei Atmung von Raumluft) sind erniedrigt; der alveoloarterielle O2-Partialdruckgradient bleibt hingegen unverändert.
Typ III: Kombination von Oxygenierungs- und Ventilationsversagen: Es besteht ein niedriger paO2 und ein erhöhter paCO2 (Hypoxie und Hyperkapnie), der alveoloarterielle pO2-Gradient ist erhöht, ebenso die venöse Beimischung und der Totraumanteil des Atemzugvolumens.
Welche Art von Störung vorliegt, kann durch die Bestimmung der arteriellen Blutgase festgestellt werden (Tab. 53.1).
| paO2 | paCO2 | |
|---|---|---|
| Typ I: Oxygenierungsversagen | Erniedrigt | Erniedrigt |
| Typ II: Ventilationsversagen | Erniedrigt | Erhöht |
| Typ III: kombiniertes Versagen | Erniedrigt | Erhöht |
Pathophysiologie und Ursachen
Vier Mechanismen sind die Hauptursachen für eine akute respiratorische Insuffizienz:
Hypoventilation,
Verteilungsstörungen der Atemluft,
venöse Beimischungen in der Lunge,
Diffusionsstörungen der Atemgase.
Diese Mechanismen treten häufig kombiniert auf. Gelegentlich kann auch ein O2-Mangel in der Inspirationsluft eine akute respiratorische Insuffizienz auslösen. Klinisch spielt eine ungenügende Anreicherung der Narkosegase mit Sauerstoff die wichtigste Rolle. Andere Gründe sind z. B. Urlaub in den Anden, Bergsteigen im Himalaya, Segelfliegen in zu großer Höhe.
Hypoventilation
Hypoventilation (ventilatorisches Pumpversagen) ist eine zu geringe Belüftung der Lunge. Wird eine große Zahl von normal durchbluteten Alveolen zu wenig belüftet, steigt in der Alveolarluft die Kohlendioxidkonzentration an, während die O2-Konzentration abnimmt. Hierdurch werden in den betroffenen Gebieten die beiden Gase ungenügend ausgetauscht. Es tritt eine globale Ateminsuffizienz ein: Bei Atmung von Raumluft fällt der paO2 ab, der paCO2 steigt immer an.
Hypoventilation = Hypoxie + Hyperkapnie.
Ursachen der Hypoventilation
- Hypoventilation bei gesunden Lungen
- Zentrale Atemdepression
- Anästhetika, Sedativa, Hypnotika
- Schädel-Hirn-Trauma
- Schlaganfall
- Neuromuskuläre Störungen
- Muskelrelaxanzien
- Myasthenia gravis
- Tetanus, Botulismus
- Thoraxtrauma
- Hypoventilation bei Erkrankungen des Respirationstraktes
- Obstruktion der Atemwege
- Asthma
- Chronische Bronchitis
- Lungenemphysem
- Elastizitätsverlust des Lungengewebes
- Lungenemphysem
- Restriktive Lungenerkrankungen
- Kyphoskoliose
- Pickwick-Syndrom
Pneumonie und Lungenödem führen meist nicht zur Hypoventilation. Die Atmung ist sogar in der Regel gesteigert, sodass die Hypoxie mit einer Hypokapnie (niedriger paCO2) einhergeht.
Die Diagnose „Hypoventilation“ wird anhand der Blutgasanalyse gestellt. Die Therapie ist darauf ausgerichtet, die Ventilation zu steigern und hierdurch den pulmonalen Gasaustausch zu verbessern. Die spezielle Therapie richtet sich nach der zugrunde liegenden Ursache.
Verteilungsstörungen
Unter physiologischen Bedingungen sind die Belüftung der Lunge (V˙) und ihre Durchblutung (Q˙) genau aufeinander abgestimmt. Anders bei den Verteilungsstörungen: hier sind die Atemgase inhomogen über die Lunge verteilt. Das Verhältnis von Belüftung zu Durchblutung (V˙/Q˙) ist gestört. In Abb. 53.1 sind die beiden Mechanismen dargestellt, die bei Verteilungsstörungen zur Hypoxämie führen können: Entweder ist die Belüftung im Vergleich zur Durchblutung hoch oder sie ist niedrig. Hierbei spielt die zu geringe Belüftung einer normal durchbluteten Region die wichtigere Rolle: Sie führt zur Hypoxie (Abfall des paO2). Der arterielle pCO2 bleibt meist normal, weil die Atmung kompensatorisch gesteigert wird.
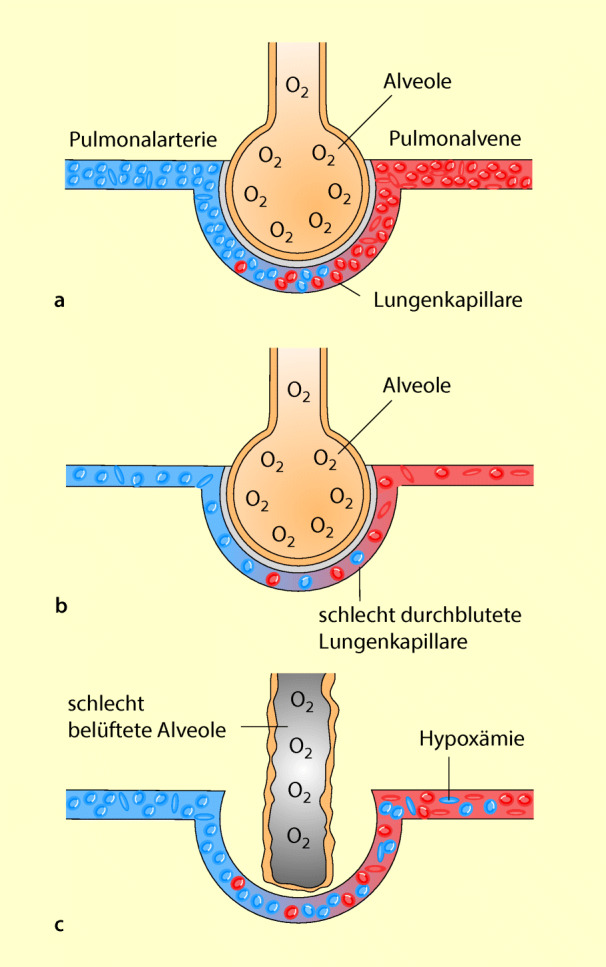
Verteilungsstörung = Belüftung der Lunge vermindert, Durchblutung normal.
Die Verteilungsstörung führt zur respiratorischen Partialinsuffizienz, weil nur der Austausch für Sauerstoff gestört wird.
Ursachen für Verteilungsstörungen der Atemluft
- Obstruktion der Atemwege
- Sekret, Fremdkörper, Ödem, Entzündung
- Bronchospasmus
- Emphysem
- Asthma
- Restriktive Lungenerkrankungen
- Kyphoskoliose
- Fettsucht
- Interstitielle Lungenerkrankungen
Erkrankungen der Lungengefäße
Die Diagnose „Verteilungsstörung“ kann nicht allein aufgrund der Blutgasanalyse gestellt werden. Die Blutgasanalyse zeigt lediglich eine Hypoxie.
Die Verteilungsstörung spricht gut auf die Zufuhr von Sauerstoff an. Die spezielle Therapie richtet sich nach der zugrunde liegenden Ursache.
Pulmonaler Rechts-links-Shunt venöse Beimischung)
Beim pulmonalen Rechts-links-Shunt wird ein Teil der Alveolen zwar noch durchblutet, jedoch nicht mehr belüftet. Hierdurch bleibt dieses Blut ungesättigt (venös). Es vermischt sich mit dem gesättigten Blut von belüfteten Alveolen und erniedrigt durch diese Beimischung dessen O2-Gehalt (Abb. 53.2). Der paCO2 bleibt normal, weil die gut belüfteten Alveolen kompensatorisch hyperventiliert werden. Diese Art von venöser Beimischung wird als funktioneller Rechts-links-Shunt bezeichnet. Typisches Beispiel sind Atelektasen.
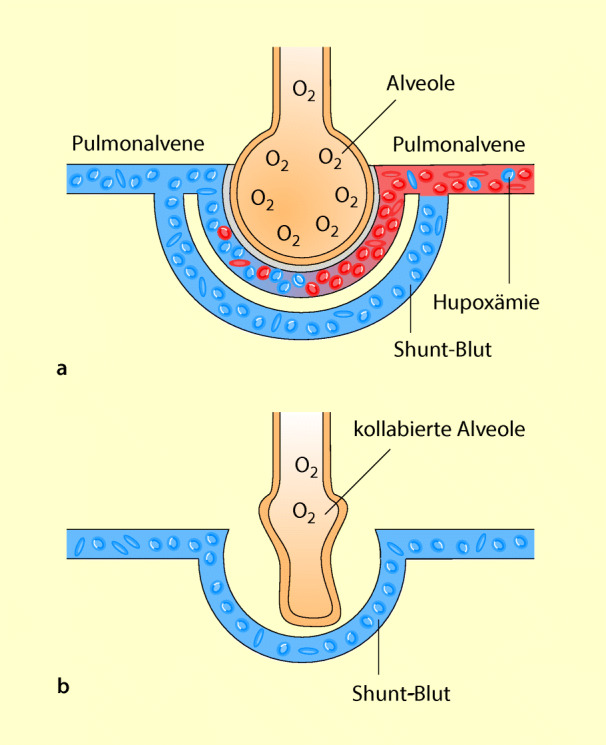
Daneben gibt es noch einen anatomischen Rechts-links-Shunt durch pathologische Direktverbindungen von der Lungenarterie zur Lungenvene. Dieses Kurzschlussblut passiert die Alveolen nicht und kann daher auch nicht am Gasaustausch teilnehmen (Abb. 53.2).
Pulmonaler Rechts-links-Shunt = Hypoxie durch venöse Beimischung in der Lunge.
Ursachen des Rechts-links-Shunts
- Funktioneller Shunt – Blut fließt durch nichtbelüftete Alveolen:
- Alveolarkollaps
- Atelektasen
- Pneumothorax
- Hämatothorax
- Pleuraerguss
- Alveolen mit Fremdmaterial gefüllt
- Lungenödem
- Pneumonie
- ARDS
- Anatomischer Shunt – Blut fließt an Alveolen vorbei:
- Normaler anatomischer Shunt: Bronchial-, Pleural- und thebesische Venen
- Pathologischer intrapulmonaler Shunt (AV-Fistel), intrakardialer Shunt (Fallot-Tetralogie usw.)
Die Diagnose „Rechts-links-Shunt“ wird gestellt durch:
Blutgasanalyse: Hypoxie mit normalem oder erniedrigtem paCO2,
100%-O2-Atmung: Bleibt die große Differenz zwischen alveolärem pO2 und arteriellem pO2 bestehen, kann der Shuntanteil ausgerechnet werden.
Für die Therapie ist wichtig: Die Zufuhr von Sauerstoff hat keinen Einfluss auf den Rechts-links-Shunt. Die Hypoxie bleibt bestehen. Die Therapie muss sich nach den zugrunde liegenden Ursachen richten.
Diffusionsstörungen
Bei dieser Störung ist die Diffusion des Sauerstoffs von der Alveole in die Kapillare behindert, weil entweder die Diffusionsstrecke durch Verdickung der alveolokapillären Membran verlängert ist (Abb. 53.3) oder weil die Kontaktzeit der Erythrozyten für die Aufsättigung des Blutes mit Sauerstoff in den Kapillaren verkürzt ist. Beide Mechanismen führen zur Hypoxie. Die Diffusion von CO2 ist dagegen nicht gestört. Meist ist der paCO2 durch eine kompensatorische Hyperventilation sogar erniedrigt.
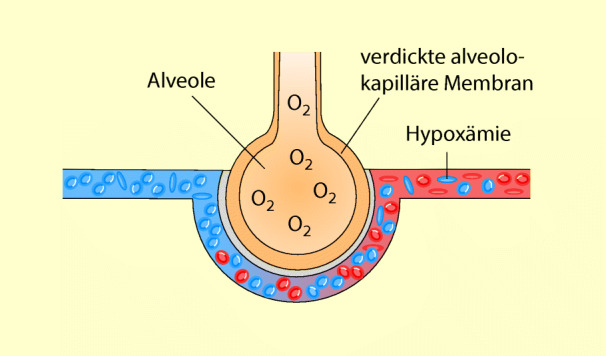
Diffusionsstörung = Hypoxie durch Behinderung der O2-Diffusion in der Lunge.
Ursachen von Diffusionsstörungen
- Zunahme der Diffusionsstrecke
- Ansammlung von Flüssigkeit
- Lungenödem
- Bindegewebe im Interstitium
- Lungenfibrose
- Sarkoidose
- Lungengefäßerkrankungen
- Verkürzung der Kontaktzeit des Blutes
- Lungenemphysem
- Lungenfibrose
Die Diagnose „Diffusionsstörung“ kann nicht allein anhand der Blutgasanalyse gestellt werden.
Bei Diffusionsstörungen wird die Hypoxie bereits durch eine geringe Erhöhung der inspiratorischen O2-Konzentration beseitigt.
Andere Ursachen für Sauerstoffmangel
Eine Hypoxämie (genauer: hypoxämische Hypoxie bzw. ein erniedrigter Sauerstoffgehalt des arteriellen Blutes) ist per Definition immer durch eine respiratorische Störung bedingt. Ein O2-Mangel (Hypoxie) kann jedoch auch bei völlig ungestörter Atemfunktion auftreten. Unabhängig von der Ursache sind aber die Auswirkungen der Hypoxie im Wesentlichen gleich.
Auswirkungen und Zeichen
Die respiratorische Insuffizienz führt zu Hypoxie, Hyperkapnie und Veränderungen im Säure-Basen-Haushalt. Ihre Folgen hängen ganz wesentlich davon ab, ob die Störung akut eintritt oder schleichend beginnt und chronisch verläuft.
Hypoxie
Kompensationsreaktionen
Die Hypoxie löst meist über eine Stimulation des sympathischen Nervensystems kardiovaskuläre Reaktionen aus, durch die der erniedrigte O2-Gehalt im arteriellen Blut zunächst kompensiert wird. Die wichtigsten Reaktionen sind:
Tachykardie,
Blutdruckanstieg,
Zunahme des Herzzeitvolumens.
Die Durchblutung von Gehirn, Herz und Lungen nimmt zu, die von Haut und Eingeweiden hingegen ab. Ein Abfall des paO2 führt auch zu kompensatorischer Hyperventilation. Hierbei ist die Steigerung der Atmung am deutlichsten ausgeprägt bei paO2-Werten zwischen 50 und 25 mmHg. In Spätstadien der akuten Hypoxie fallen Blutdruck, Herzfrequenz und HZV ab.
Schädigende Wirkungen der Hypoxie
Ein O2-Mangel im Blut führt auch zum O2-Mangel im Gewebe. Hierdurch werden die Organe zunächst in ihrer Funktion und später auch in ihrer Struktur u. U. irreversibel geschädigt.
Bei welchen paO2-Werten Störungen der Organfunktion zu erwarten sind, lässt sich nicht mit Sicherheit vorhersagen. Ist die Durchblutung aufgrund der vorher beschriebenen Kompensationsmechanismen hoch, können auch niedrige paO2-Werte längere Zeit toleriert werden. Ist hingegen die Durchblutung bei Hypoxie niedrig, treten die Funktionsstörungen früher auf. Liegt zusätzlich noch eine Anämie und/oder ein gesteigerter O2-Bedarf vor (Fieber), muss mit rascher Schädigung lebenswichtiger Organe gerechnet werden.
Als kritischer Wert für eine ausreichende Organfunktion wird ein paO2 von 30 mmHg angesehen; ein paO2 <20 mmHg ist akut lebensbedrohlich. Besonders empfindlich reagiert hierauf das Gehirn.
Klinische Zeichen der Hypoxie
Die klinischen Zeichen des O2-Mangels sind unspezifisch und werden nicht selten durch Sedierung und Muskelrelaxierung überdeckt. Im Vordergrund stehen zunächst meist die Kompensationsreaktionen; später treten die Zeichen der gestörten Organfunktion hinzu:
Tachykardie,
mäßiger Blutdruckanstieg,
gesteigerte Atmung,
Schwitzen,
Zyanose,
Unruhe, Erregung, Verwirrtheit,
Schläfrigkeit,
Blutdruckabfall,
Bradykardie, Herzrhythmusstörungen.
Aufgrund dieser Zeichen allein kann die Diagnose Hypoxie nicht gestellt werden. Hierfür ist eine arterielle Blutgasanalyse erforderlich. Sie sollte bei dem geringsten Verdacht auf eine Hypoxie unverzüglich durchgeführt werden, um eine weitere Verschlechterung des Zustandes zu verhindern.
Hyperkapnie
Eine Hyperkapnie stimuliert ebenfalls das zentrale Nervensystem. Hierdurch wird die Atmung meist stark gesteigert. Dagegen sind die Auswirkungen auf das Herz-Kreislauf-System komplex. Durch die zentrale Kreislaufstimulation tritt eine Gefäßkonstriktion ein; Herzfrequenz, Blutdruck und Herzzeitvolumen nehmen meist zu. In der Peripherie wirkt jedoch das CO2 auf zahlreiche Gefäßgebiete direkt dilatierend, sodass der Nettoeffekt insgesamt wechselnd ist. Die Hirndurchblutung wird aber durch den pCO2-Anstieg immer gesteigert (10.1007/978-3-662-50444-4_24), während in den Lungengefäßen eine Konstriktion auftritt. Mit zunehmenden paCO2-Werten wird das zentrale Nervensystem mehr und mehr gedämpft, bis schließlich eine CO2-Narkose eintritt.
CO2 wirkt auch auf den Säure-Basen-Haushalt (Abschn. 53.3.3) und die O2-Bindungskurve. Hyperkapnie verschiebt die Bindungskurve nach rechts (10.1007/978-3-662-50444-4_52; 10.1007/978-3-662-50444-4_52#Fig5); hierdurch nimmt – bei gleichem paO2 – die O2-Sättigung des Hämoglobins und damit auch der O2-Gehalt des arteriellen Blutes ab. Allerdings wird durch die Rechtsverschiebung mehr Sauerstoff an das Gewebe abgegeben.
Klinische Zeichen der Hyperkapnie
Es gibt keine eindeutigen klinischen Zeichen der Hyperkapnie. Hinweise können sein:
gerötete Haut,
Schwitzen,
Tachykardie, Herzrhythmusstörungen,
Blutdruckanstieg,
Somnolenz, Koma (paCO2 80–100 mmHg),
flache und/oder langsame Atmung (hoher paCO2),
Muskelzuckungen, Krämpfe (sehr hoher paCO2).
Die Diagnose wird durch eine Blutgasanalyse gesichert. Sie sollte frühzeitig gestellt werden, bevor schwere Schäden eintreten.
Säure-Basen-Veränderungen
Eine akute Hyperkapnie führt immer zum akuten Abfall des pHa (respiratorische Azidose ). Der pH-Abfall scheint für die herzkreislaufdämpfenden Wirkungen des Kohlendioxids verantwortlich zu sein.
Funktionsdiagnostik
Arterielle Blutgasanalyse
Dies ist die wichtigste Methode zur Beurteilung des pulmonalen Gasaustausches. Sie dient außerdem zur Verlaufskontrolle der maschinellen Beatmung und der Lungenstörung, die zur respiratorischen Insuffizienz geführt hat.
Alveoloarterielle Sauerstoffdruckdifferenz (DAaO2)
Sie ist ein halbquantitatives Maß für den physiologischen Rechts-links-Shunt, d. h. für die Blutmenge, die, ohne mit Sauerstoff gesättigt zu werden, direkt von der Lungenarterie in die Lungenvene einströmt. Die DAaO2 ist die Differenz zwischen dem alveolären und dem arteriellen O2-Partialdruck. Sie beträgt bei 100%iger O2-Atmung für eine gesunde Lunge 20–35 mmHg. Das entspricht einem normalen Shuntanteil von 3–5% des HZV. Anders ausgedrückt: 3–5% des durch die Lunge fließenden HZVs werden kurzgeschlossen, und zwar über Lungenvenen und thebesische Venen, die direkt in das linke Herz münden. Die DAaO2 wird bestimmt, indem der Patient für 20 min 100% Sauerstoff atmet.
Rechts-links-Shunt
Der pulmonale Rechts-links-Shunt kann mit Hilfe der Shuntgleichung errechnet werden. Hierfür muss der O2-Gehalt in Lungenkapillarblut, arteriellem Blut und gemischtvenösem Blut bekannt sein.
Physiologischer Totraumanteil
VD/VT kann nach der Bohr-Gleichung ermittelt werden. Normal ist ein Verhältnis von 0,25–0,4.
CO2-Produktion
Diese kann ebenfalls relativ einfach bestimmt werden. Hierfür muss das ausgeatmete Gas über einen bestimmten Zeitraum gesammelt werden.
Spirometrie
Mit Hilfe der Spirometrie kann die Ventilation beurteilt werden:
Vitalkapazität,
Atemzugvolumen,
inspiratorische Kraft (Sog),
Atemfrequenz,
Atemminutenvolumen.
Daneben gibt es noch eine Reihe anderer Lungenfunktionsprüfungen, die aber für die klinische Intensivtherapie meist eine untergeordnete Rolle spielen.
Behandlung
Die Behandlung der respiratorischen Insuffizienz richtet sich v. a. nach den zugrunde liegenden Ursachen.
Contributor Information
Collaborators: Tobias Fink and Tilmann Müller-Wolff
Nachschlagen und Weiterlesen
- [1].Bein T, Pfeifer M. Intensivbuch Lunge: Von der Pathophysiologie zur Strategie der Intensivtherapie. Berlin: Medizinisch Wissenschaftliche; 2010. [Google Scholar]
- [2].Bungeroth U. Pneumologie BASICS. München: Elsevier; 2010. [Google Scholar]
- [3].Hien P. Praktische Pneumologie. Berlin Heidelberg: Springer; 2012. [Google Scholar]


