Abstract
Die neurochirurgische Intensivmedizin umfasst die Intensivüberwachung und -therapie nach neurochirurgischen Operationen und die Behandlung von Patienten mit schweren Schädel-Hirn-Traumen und akuten traumatischen Rückenmarkläsionen. Demgegenüber gehört zu den wichtigsten Aufgaben der neurologischen Intensivmedizin die Behandlung schwerer neurologischer Erkrankungen mit vitaler Bedrohung, z. B. progredienter Schlaganfall, Meningitis, Enzephalitis, Krampfanfall bzw. Status epilepticus, aufsteigende Lähmungen, progrediente Muskelschwäche, akute oder progrediente Querschnittsyndrome, akute oder progrediente Hirndruckanstiege. Daneben ergeben sich Überschneidungen mit sog. neurochirurgischen Krankheitsbildern, die teils von Neurologen allein oder in Zusammenarbeit mit den Neurochirurgen behandelt werden, so z. B. die zerebrale Aneurysmablutung oder die traumatische Querschnittlähmung.
Die neurochirurgische Intensivmedizin umfasst die Intensivüberwachung und -therapie nach neurochirurgischen Operationen und die Behandlung von Patienten mit schweren Schädel-Hirn-Traumen und akuten traumatischen Rückenmarkläsionen. Demgegenüber gehört zu den wichtigsten Aufgaben der neurologischen Intensivmedizin die Behandlung schwerer neurologischer Erkrankungen mit vitaler Bedrohung, z. B. progredienter Schlaganfall, Meningitis, Enzephalitis, Krampfanfall bzw. Status epilepticus, aufsteigende Lähmungen, progrediente Muskelschwäche, akute oder progrediente Querschnittsyndrome, akute oder progrediente Hirndruckanstiege. Daneben ergeben sich Überschneidungen mit sog. neurochirurgischen Krankheitsbildern, die teils von Neurologen allein oder in Zusammenarbeit mit den Neurochirurgen behandelt werden, so z. B. die zerebrale Aneurysmablutung oder die traumatische Querschnittlähmung.
Intensivmedizinisch wichtige neurologische Störungen
Zu den wesentlichen Aufgaben der Neurointensivmedizin gehören, neben der Sicherung der Vitalfunktionen, das Erkennen, die Behandlung und die Verhütung krankheitsspezifischer Verschlechterungen und Komplikationen. Ein wichtiger Bestandteil dieser intensivmedizinischen Aufgabe ist die auch vom Fachpflegepersonal durchzuführende klinisch-neurologische Überwachung des Patienten. Sie umfasst v. a. die folgenden neurologischen Störungen:
Bewusstseinsstörungen,
Pupillenstörungen,
Störungen wichtiger Hirnnerven,
Störungen von Reflexaktivitäten,
motorische Lähmungen,
Sensibilitätsstörungen,
Krampfanfälle.
Bewusstseinsstörungen
Störungen des Bewusstseins gehören zu den häufigsten Gründen für eine neurointensivmedizinischen Überwachung und Behandlung.
Was ist Bewusstsein?
Eine verbindliche Definition von Bewusstsein liegt bislang nicht vor, obwohl, wie die Hirnforscher Edelman und Tononi ironisch anmerken, jeder wisse, was Bewusstsein sei, „nämlich das, was uns jeden Abend, wenn wir einschlafen, verlässt und am anderen Morgen, wenn wir aufwachen, wieder in Erscheinung tritt“.
Bewusstsein ist ein komplexer Begriff und umfasst nach Roth alle Zustände, die von einem Menschen erlebt werden können. Danach tritt Bewusstsein in einer großen Zahl unterschiedlicher Zustände in Erscheinung. Die allgemeine Form von Bewusstsein ist Wachheit (Vigilanz). Wachheit selbst ist in der Regel mit Inhalten erfüllt.
Wo ist der Ort des Bewusstseins?
Es besteht Einigkeit, dass Bewusstsein untrennbar an Prozesse des Gehirns gebunden ist. Allerdings gibt es kein einzelnes Hirnzentrum für Bewusstsein. Die unterschiedlichen Formen des Bewusstseins entstehen vielmehr durch die spezifische Interaktion verschiedener Zentren im ganzen Gehirn. Jedoch sind alle Arten von Bewusstsein an die Aktivität der assoziativen Großhirnrinde (Neokortex oder Isokortex) gebunden.
Nach heutiger Vorstellung besteht das sog. Bewusstseinssystem des Gehirns aus drei Komponenten:
aktivierendes noradrenerges retikuläres aufsteigendes System (ARAS),
System der generellen Bewusstwerdung im Thalamus und in den Basalganglien,
System des Selbstbewusstseins im Parietallappen.
Grade der Bewusstseinsstörung
Eine verbindliche Einteilung der Bewusstseinsstörungen liegt derzeit nicht vor, jedoch werden klinisch üblicherweise folgende Grade von Minderungen der Bewusstseinshelligkeit oder Bewusstseinstrübungen unterschieden:
Somnolenz,
Sopor,
Koma.
Definitionen der Vigilanzstörungen
Somnolenz
Abnorme Schlafneigung oder Schläfrigkeit. Der Patient kann jederzeit durch mehr oder weniger starke Reize, wie Beklopfen oder Anrufen, geweckt und zu einfachen Reaktionen veranlasst werden.
Sopor
Schlafähnlicher Zustand, aus dem der Patient nur mit starken Reizen, z. B. Schmerzen, erweckbar ist.
Koma
Unerweckbare Bewusstlosigkeit.
Die Begriffe Somnolenz, Stupor und Sopor sind unscharf und werden daher bei neurochirurgischen und neurologischen Intensivpatienten nur selten verwendet. Hilfreicher ist eine plastische Beschreibung des Bewusstseinszustands, z. B. „erkennt seine Angehörigen“, „öffnet die Augen nach Aufforderung“, „reagiert nicht auf Schmerzreiz“.
Komakategorien
Die Tiefe des Komas kann anhand verschiedener Kategorien beschrieben werden. Gebräuchlich ist folgende Einteilung:
einfaches Koma ohne herdneurologische Zeichen,
Koma mit das Gesicht einschließender Hemiparese,
Koma mit Hirnstammbeteiligung,
Koma mit multiplen fokalen Zeichen,
Koma mit meningealen Reizsyndromen.
International wird sehr häufig die Glasgow-Koma-Skala eingesetzt, um die Komatiefe zu beschreiben (Abschn. 61.4.3). Diese für die Beurteilung des Schädel-Hirn-Traumas entwickelte Skala erfasst verschiedene Grade von Bewusstseinstrübung, aber auch die Komatiefe. Allerdings fehlen hierbei die Pupillenreaktion auf Licht und die Pupillenweite.
Im Gegensatz zur Glasgow-Koma-Skala beschränkt sich die Skala der Weltgemeinschaft der Neurochirurgen (WFNS) auf die Klassifizierung der Komatiefe. Verschiedene Grade der Bewusstseinstrübung werden nicht erfasst.
Komaeinteilung der Weltgemeinschaft der Neurochirurgen
Grad I: nicht erweckbar, keine neurologischen Ausfälle
Grad II: nicht erweckbar, Pupillenstörung und/oder Lähmungen (Paresen)
Grad III: nicht erweckbar, Beuge- und Strecksynergismen (der Muskeln)
Grad IV: nicht erweckbar, schlaffe Reflexlosigkeit (Areflexie), keine Schmerzreaktion, Pupillen beidseits weit, keine Spontanatmung
Für die Subarachnoidalblutung wird die Skala von Hunt u. Hess verwendet (10.1007/978-3-662-50444-4_26).
Komaursachen
Eine Bewusstlosigkeit kann durch zerebrale oder extrazerebrale Schädigungen hervorgerufen werden. Bei neurochirurgischen und neurologischen Patienten stehen die zerebralen Komaursachen im Vordergrund:
Schädel-Hirn-Trauma,
intrakranielle Blutungen,
Hirninfarkt,
Hirnvenenthrombose,
Enzephalitits, Meningitis,
Hirntumoren,
epileptischer Anfall.
Zu den wichtigsten extrazerebralen Komaursachen gehören Herz-Kreislauf-Störungen, Hypoxie, respiratorische Insuffizienz, metabolische Störungen (z. B. hyperglykämisches oder urämisches Koma), weiterhin physikalische Ursachen wie Hypothermie oder Stromschlag.
Vom echten Koma müssen Syndrome unterschieden werden, die bei oberflächlicher Betrachtung dem Koma ähneln, hiervon aber klar abgegrenzt werden müssen; hierzu gehören:
apallisches Syndrom oder Status vegetativus bzw. Wachkoma (Coma vigile),
Locked-in-Syndrom,
akinetischer Mutismus,
prolongierte Hypersomnie.
Hirnstammsyndrome
Für die Intensivmedizin sind v. a. das Mittelhirnsyndrom und das Bulbärhirnsyndrom von Bedeutung.
Mittelhirnsyndrom
Zu Beginn besteht Schläfrigkeit oder Agitiertheit und Widerstand gegen passive Bewegung der Extremitäten. Die Pupillen sind eng, die Atmung ist regelmäßig. Später tritt Bewusstlosigkeit ein, Schmerzreize führen nicht mehr zur Weckreaktion; Spontanbewegungen der Extremitäten sind nicht vorhanden; auf Schmerzreize treten Beuge-Streck-Synergismen auf. Die Pupillen sind jetzt etwas weiter, die Lichtreaktion ist erhalten.
Im Vollbild sind die Pupillen mittelweit; die Lichtreaktion ist erloschen, auf Schmerzreize treten Strecksynergismen auf. Außerdem finden sich erhöhter Blutdruck, gesteigerte Speichelsekretion und Hyperglykämie.
Bulbärhirnsyndrom
Zeichen sind: Bewusstlosigkeit ohne Strecksynergismen, keine Reaktion auf Schmerzreize, der Muskeltonus ist schlaff; die Pupillen sind weit bis maximal weit, die Lichtreaktion ist erloschen. Die Atmung wird flacher und langsamer bis hin zur Schnappatmung.
Apallisches Syndrom ( Coma vigile, vegetativer Zustand)
Klinischer Zustand, der sich meist aus einem Koma heraus entwickelt: Der Patient ist wach, kann aber sich selbst und seine Umwelt nicht erleben. Die vegetativen Funktionen sind weitgehend erhalten, die geistigen Fähigkeiten dagegen verloren. Im Gegensatz zum Koma sind beim vegetativen Zustand Schlaf-Wach-Zyklen vorhanden. Im Wachzustand reagiert der Patient dennoch nicht gezielt auf äußere Reize; Aufmerksamkeit, Zuwendung und Sprachverständnis sind ebenfalls nicht vorhanden.
Die Augen sind geöffnet, jedoch ohne dauerhafte Fixierung; der Patient schaut vielmehr durch den Beobachter hindurch. Oft besteht eine Streck- oder Beugespastik, die zu erheblichen Kontrakturen führen kann.
Orale Automatismen (Saug- und Kaureflexe) oder ungezielte Bewegungen des Patienten im vegetativen Zustand dürfen nicht als Zeichen zielgerichteter Reaktionen fehlgedeutet werden!
Unartikulierte Laute und Massenbewegungen auf Schmerzreize kommen vor; es besteht Stuhl- und Urininkontinenz, die Ernährung muss über eine Magensonde erfolgen.
Verlauf des Status vegetativus
Als persistierend wird ein vegetativer Zustand bezeichnet, der länger als 6 Monate anhält. Eine Erholung nach 3-monatiger Dauer kommt in seltenen Fällen vor, ist jedoch meist mit einer erheblichen klinischen Einschränkung verbunden. Ein persistierender vegetativer Zustand kann bei entsprechender Pflege viele Jahre überlebt werden; die Lebenserwartung ist allerdings meist reduziert.
Locked-in-Syndrom
Diese Patienten sind wach und bei vollem Bewusstsein, können jedoch nur stark eingeschränkt auf ihre Umwelt reagieren, da kortikospinale und kortikobulbäre Bahnen im Bereich der Pons (Brücke) des Gehirns zerstört sind. Ursache eines Locked-in-Syndroms sind meist beidseitige pontine Infarkte aufgrund einer Basilaristhrombose.
Beim typischen Locked-in-Syndrom besteht eine vollständige Tetraparese mit Lähmung der Atemmuskulatur und der Hirnnerven. Meist ist die maschinelle Beatmung über eine Trachealkanüle erforderlich. Die Kommunikation mit der Umwelt kann zumeist über vertikale Blickbewegungen oder Oberlidbewegungen erfolgen. Die Prognose ist schlecht.
Akinetischer Mutismus
Das klinische Bild ist durch extreme Antriebsstörungen mit fehlender Abwehr auf Schmerzreize und Fehlen von Spontanbewegungen gekennzeichnet. Schlaf- und Wachphasen sind vorhanden, die Kontaktaufnahme mit der Umwelt ist extrem verlangsamt. Ursache des akinetischen Mutismus sind erhebliche Schädigungen des Frontalhirns.
Prolongierte Hypersomnie
Die Patienten sind durch ein extremes Schlafbedürfnis gekennzeichnet; sie lassen sich kurzzeitig erwecken, schlafen jedoch schnell wieder ein. Ursache sind Schäden im Thalamus-/Hypothalamusbereich.
Pupillenstörungen
Die Beurteilung der Pupillenfunktion gehört, wie die Kontrolle der Bewusstseinslage, zu den wichtigsten Überwachungsmaßnahmen beim neurochirurgischen Intensivpatienten. Da akute Pupillenveränderungen oft Hinweise auf eine Verschlechterung des Patientenzustands sind, die therapeutische oder diagnostische Maßnahmen erfordern, gehört die Überwachung der Pupillenfunktion des Intensivpatienten zu den Aufgaben des Pflegefachpersonals. Überwacht werden:
Pupillenweite,
Seitendifferenz,
Pupillenform,
Lichtreaktion,
Konvergenzreaktion.
Pupillomotorik
Bei mittlerer Beleuchtung sind die Pupillen gewöhnlich seitengleich, mittelweit und rund. Bei gesteigertem Sympathikotonus erweitern sich beide Pupillen leicht; im höheren Lebensalter sind die Pupillen wegen der Rigidität der Iris enger.
Folgende Abweichungen werden unterschieden:
Mydriasis (Erweiterung),
Miosis (Verengung),
Anisokorie (Seitendifferenzen im Durchmesser).
Mydriasis
Beim Intensivpatienten ist v. a. die einseitige Erweiterung der Pupille von Bedeutung. Ursachen sind:
Lähmung der parasympathischen Innervation des M. sphincter pupillae (N. oculomotorius = III. Hirnnerv); die Pupille ist nicht maximal erweitert,
Reizung der sympathischen Fasern des M. dilatator pupillae durch Medikamente oder Drogen; die Pupille ist maximal weit,
krankhafte Veränderung im Ganglion ciliare, z. B. bei Pupillotonie,
anticholinerges Syndrom: beiderseits erweitert, lichtstarr.
Die akute Pupillenerweiterung des neurochirurgischen bzw. neurologischen Intensivpatienten ist ein Alarmzeichen, bei dem bis zum Beweis des Gegenteils von einer bedrohlichen Mittellinienverlagerung des Gehirns mit Einklemmung des N. oculomotorius zwischen Tentoriumrand und Hirnschenkel ausgegangen werden muss.
Hierbei muss sofort diagnostisch (CT) abgeklärt werden, ob eine neurochirurgische Intervention zur Verhinderung einer akuten Einklemmung des Hirnstamms erforderlich ist.
Miosis
Die Verengung der Pupille kann einseitig oder doppelseitig auftreten. Ursachen sind:
Horner-Syndrom (Sympathikuslähmung),
Wirkung von Opioiden und Cholinesterasehemmern,
pontine Läsionen: beiderseits stecknadelkopfgroße Pupillen.
Lichtreaktion
Bei Beleuchtung und bei Konvergenzbewegung verengt sich die Pupille normalerweise sofort und ausgeprägt. Folgendes ist bei der Lichtreaktion zu unterscheiden:
direkte Lichtreaktion: Prüfung jeder Pupille durch plötzliche Belichtung einer von der Seite angenäherten Lampe,
konsensuelle Lichtreaktion: wird die eine Pupille beleuchtet, so muss sich die andere ebenfalls verengen,
Konvergenzreaktion: der Patient blickt auf den ca. 1 m entfernten Finger des Untersuchers; dann nähert der Untersucher seinen Finger rasch auf etwa 10 cm; mit der Konvergenz der Augen auf den Finger des Untersuchers verengen sich auch beide Pupillen.
Amaurotische Pupillenstarre
Hierbei sind die pupillosensorischen Fasern im N. opticus des betroffenen Auges unterbrochen. Bei Belichtung des amaurotischen („blinden“) Auges wird weder eine direkte (gleichseitige) noch eine konsensuelle (gegenseitige) Lichtreaktion ausgelöst. Wird hingegen das gesunde Auge belichtet, tritt im gegenseitigen (amaurotischen Auge) eine Lichtreaktion auf (konsensuelle Lichtreaktion). Die Konvergenzreaktion ist erhalten.
Absolute Pupillenstarre
Die Pupille reagiert weder direkt noch indirekt auf Lichteinfall; die Konvergenzreaktion ist aufgehoben. Wichtige Ursachen sind:
Verletzung des Auges,
periphere Okulomotoriuslähmung,
Mittelhirnläsion,
Parasympathikuslähmung, z. B. durch Belladonna-Alkaloide,
Sympathikusreizung durch Kokain oder Weckamin,
Botulismus.
Reflektorische Pupillenstarre
Die direkte und indirekte Lichtreaktion ist (meist auf beiden Augen) erloschen, die Konvergenzreaktion ist intakt. Häufig sind die Pupillen anisokor und entrundet. Ursache ist eine Lues des ZNS.
Pupillotonie
Die Pupille reagiert stark verzögert auf Lichteinfall; die Naheinstellungsreaktion ist verzögert, die Akkomodation erschwert. Meist ist zunächst nur eine Pupille betroffen, später beide. Ursache ist eine Schädigung des Ganglion ciliare.
Störungen des N. vagus (X. Hirnnerv)
Tumoren, Blutungen oder Infarkte im Bereich der hinteren Schädelgrube können zu Funktionsstörungen des N. vagus führen. Sie manifestieren sich als Schluckstörungen und Aufhebung der Schutzreflexe im Nasen-Rachenraum mit erheblicher Aspirationsgefahr. Daher gilt: Vor Extubation des Patienten Schutzreflexe prüfen!
Atemstörungen
Schädigungen des zentralen oder peripheren Nervensystems können zu Atemstörungen führen, allerdings ist es meist nicht möglich, aus dem Muster der Atemstörung die zugrunde liegende Ursache zu bestimmen. Folgende zentral bedingten Atemstörungen sind häufiger zu beobachten:
Cheyne-Stokes-Atmung,
zentrale Hyperventilation,
ataktische Atmung,
Schnappatmung.
Cheyne-Stokes-Atmung
Dieser Atemtyp ist durch eine periodische, allmähliche Vertiefung und Abflachung der Atemzüge gekennzeichnet. Sie entsteht durch eine Störung der CO2-Reagibilität. Zu den wichtigsten zentralen Ursachen gehören bilaterale Hirninfarkte und die hypertensive Enzephalopathie. Andere Ursachen sind: Herzinsuffizienz oder Urämie. Außerdem muss ein obstruktives Schlafapnoesyndrom ausgeschlossen werden.
Zentrale Hyperventilation (Maschinenatmung)
Sie ist gekennzeichnet durch eine rasche, regelmäßige und vertiefte Atmung mit Hypokapnie und respiratorischer Alkalose. Ursache sind v. a. Läsionen des zentralen Hirnstamms.
Ataktische Atmung ( Biot-Atmung)
Frequenz und Atemtiefe sind vollkommen unregelmäßig. Ursache der Biot-Atmung sind Läsionen in der Formatio reticularis der dorsalen Medulla.
Die ataktische Atmung kann jederzeit in einen Atemstillstand übergehen. Daher ist die sofortige Intubation und Beatmung erforderlich.
Schnappatmung
Die Schnappatmung tritt als präfinales Zeichen bei nahezu allen Läsionen des unteren Hirnstamms auf.
Vegetative Entgleisungen
Erhebliche vegetative Störungen treten häufig bei direkter Schädigung der zentralen sympathischen und parasympathischen Regulationsstellen z. B. durch Entzündungen oder intrakraniellen Druckanstieg auf; hierzu gehören:
Temperaturentgleisungen: Hyperthermie oder Hypothermie,
metabolische Störungen,
Kreislaufinstabilität mit raschem Wechsel von Blutdruckabfall und Blutdruckanstieg, Tachykardie zu Bradykardie.
Sprachstörungen (Aphasien)
Als Aphasien werden Störungen im kommunikativen Gebrauch der Sprache bezeichnet, während Dysarthrophonien (Dysarthrien) Störungen der Artikulationsmotorik, Stimmgebung und Sprechatmung umfassen. Unterschieden werden folgende Aphasien:
Broca-Aphasie,
Wernicke-Aphasie,
globale Aphasie,
amnestische Aphasie.
Broca-Aphasie
Die Patienten sprechen spontan nur sehr wenig, nach Aufforderung zögernd sie ringen nach Worten und sprechen mit abgehackter Betonung. Die Artikulation ist undeutlich, die Sätze sind sehr kurz und beschränken sich auf kommunikativ wichtige Substantive, Verben und Adjektive (Telegrammstil). Störungen des Sprachverständnisses sind ebenfalls vorhanden, beeinträchtigen aber nicht die Kommunikation. Das Schreibvermögen ist beeinträchtigt. Ursache der Broca-Aphasie sind Schädigungen der dritten Frontalwindung der dominanten Hemisphäre.
Wernicke-Aphasie
Die Störung ist gekennzeichnet durch Paraphasien, d. h. Verwechslung von Wörtern, Silben und Buchstaben, weiterhin durch fehlerhaften Satzbau (Paragrammatismus) und stark gestörtes Sprachverständnis. Melodie und Rhythmus der Spontansprache sind hingegen ungestört. Ursache der Wernicke-Aphasie sind Schädigungen im Temporallappen der dominanten Hemisphäre.
Globale Aphasie
Sprachverständnis und Sprachproduktion sind erheblich beeinträchtigt. Im Akutstadium nimmt der Patient kaum sprachlich Kontakt mit seiner Umgebung auf; die sprachlichen Reaktionen sind kaum zu verstehen und beschränken sich auf stereotyp wiederholte Wortfragmente; die Lesefähigkeit ist ebenfalls gestört.
Amnestische Aphasie
Bei der amnestischen Aphasie bestehen Wortfindungsstörungen, die der Patient durch Umschreibungen und schablonenhafte Ausdrucksweise zu umgehen versucht. Die Sprechweise ist zögernd, der Informationsgehalt der Aussagen gering; die Schriftsprache ist ähnlich beeinträchtigt, das Sprachverständnis hingegen unauffällig.
Störungen der Motorik
Lähmungen gehören zu den häufigen Störungen des neurochirurgischen bzw. neurologischen Intensivpatienten. Sie sind v. a. für die Pflege von Bedeutung.
Lähmungen: Begriffe und Definitionen
Parese: unvollständige Lähmung, d. h. verminderte Kraft
Plegie oder Paralyse: vollständige Lähmung
Monoparese: Lähmung einer Extremität
Paraparese: Lähmung beider Extremitäten
Hemiparese: Halbseitenlähmung
Tetraplegie: vollständige Lähmung aller 4 Extremitäten
spastische Lähmung: Zunahme des Muskeltonus bei Ausfall kortikospinaler Systeme
Rigor: gesteigerter Tonus der Skelettmuskulatur (Agonisten und Antagonisten) mit typischer Steifigkeit bei passiver Bewegung (teigiger, nichtfedernder Widerstand, oft mit Zahnradphänomen) bei Erkrankungen des extrapyramidalmotorischen Systems
Hypotonie: verminderter Tonus der Muskulatur
Grundsätzlich wird zwischen peripheren und zentralen Lähmungen unterschieden.
Periphere (motorische) Lähmung
Sie entsteht durch eine Schädigung des peripheren motorischen Neurons. Die Nervenzelle des motorischen Neurons befindet sich im Vorderhorn des Rückenmarks. Ihr Neurit verläuft über die Vorderwurzel, den Spinalnerv, Plexus und peripheren Nerv zur motorischen Endplatte. Die periphere Lähmung ist in folgender Weise gekennzeichnet:
Hypotonie, d. h. herabgesetzter Muskeltonus bzw. schlaffe Lähmung,
Atrophie der Muskelfasern wegen fehlender Beanspruchung,
Verminderung (Parese) oder Aufhebung (Paralyse) der groben Kraft,
Beeinträchtigung der Feinmotorik,
Eigenreflexe abgeschwächt oder aufgehoben; pathologische Reflexe fehlen.
Zentrale Lähmung
Die zentrale Lähmung beruht auf einer Schädigung der Pyramidenbahn bzw. des Tractus corticospinalis sowie kortikopontiner und kortikobulbärer Bahnen. Die Kennzeichen der zentralen Lähmung sind:
Beeinträchtigung oder Verlust der Feinmotorik; Masseninnervation beim Versuch, differenzierte Bewegungen durchzuführen,
Verminderung der groben Kraft,
spastische Tonuserhöhung der Muskulatur (entwickelt sich in einer variablen Zeit nach der Schädigung),
keine Muskelatrophie,
Eigenreflexe gesteigert, evtl. bis zum Klonus; Fremdreflexe abgeschwächt, pathologische Reflexe auslösbar, z. B. Babinski-Reflex.
Die Spastik bei zentraler Lähmung führt oft zu Beuge- oder Streckkontrakturen mit entsprechend erschwerter Pflege.
Prüfung der Motorik beim Bewusstlosen
Durch Prüfung der motorischen Reaktion kann der Grad der Bewusstlosigkeit und die Lokalisation der Schädigung eingeschätzt werden:
spontane Minderbewegung einer Seite: Hinweis auf eine Hemiparese,
unregelmäßige myoklonische Zuckungen einzelner oder mehrerer Muskeln: Zeichen hypoxischer oder metabolischer Enzephalopathie.
Reagiert der Patient nicht nach Aufforderung, wird die Reaktion auf Schmerzreize überprüft. Hierbei lassen sich folgende Reaktionen unterscheiden:
gezielte Abwehr,
ungezielte Abwehr,
abnorme Flexion: stereotype Beugung im Ellbogen- und Handgelenk mit Schulteradduktion,
abnorme Extension: Streckung der Beine und Arme mit Adduktion und Innenrotation der Schultern; Hinweis auf eine schwere Schädigung,
keinerlei motorische Reaktion.
Sensibilitätsstörungen
Die Sensibilität umfasst folgende Empfindungen:
Berührung,
Schmerz,
Temperatur,
Bewegung,
Vibration.
Die Sensibilität wird beim bewusstseinsklaren Patienten mit Berührungsempfindungen, Spitz-stumpf- und Warm-kalt-Unterscheidung sowie Lage- und Vibrationsempfinden untersucht. Außerdem werden die Nervendehnungszeichen überprüft. Störungen der Sensibilität entstehen durch Querschnittlähmungen oder Läsionen peripherer Nerven.
Spezielle technische Überwachungsverfahren
In der Neurointensivmedizin werden spezifische apparative Verfahren eingesetzt, um Störungen der Hirnfunktion zu erfassen; hierzu gehören:
Messung des intrakraniellen Drucks (Abschn. 61.4.4),
Bulbusoxymetrie,
Nahinfrarotspektroskopie,
evozierte Potenziale.
Bulbusoxymetrie
Bei diesem Verfahren wird über die V. jugularis interna ein fiberoptischer Oxymetriekatheter retrograd in den sich im Schädel befindenden Bulbus oder Sinus der V. jugularis vorgeschoben und die hirnvenöse O2-Sättigung (sjvO2) kontinuierlich gemessen. Ziel der Maßnahme ist die frühzeitige Erkennung eines zerebralen O2-Mangels, bedingt durch einen Abfall der Hirndurchblutung (zerebrale Ischämie), z. B. beim Schädel-Hirn-Trauma. Nimmt die Hirndurchblutung ab, wird mehr Sauerstoff aus dem Blut entnommen und die arterio-hirnvenöse O2-Gehaltdifferenz wird größer, erkennbar an einem Abfall der O2-Sättigung im Blut des Bulbus V. jugularis. Aussagen sind allerdings nur über die Gesamtdurchblutung des Gehirns möglich; regionale Durchblutungsstörungen können hiermit nicht erfasst werden.
Sauerstoffsättigung im Sinus V. jugularis
Normwerte: 54–70%
Desaturation: Abfall auf 50% und weniger
Hyperämie: Anstieg auf 75% und mehr
Ein episodischer Abfall der O2-Sättigung (Desaturationen ) von mehr als 15 min Dauer wirkt sich ungünstig auf die Morbidität und Letalität von Patienten mit schwerem Schädel-Hirn-Trauma aus.
Nahinfrarotspektroskopie (NIRS)
Die NIRS ist ein nichtinvasives Verfahren für die Überwachung der zerebralen O2-Versorgung. Erfasst werden sollen damit Phasen zerebraler Hypoxie bzw. Minderdurchblutung. Das Gerät besteht aus einem Sensor mit Lichtquelle und mehreren Lichtdetektoren. Der an den Monitor angeschlossene Sensor wird frontotemporal auf der Haut befestigt.
Je nach Gerätetyp werden folgende Parameter erfasst:
regionale O2-Sättigung des Gewebes (rsO2),
oxy- und desoxygeniertes Hämoglobin,
reduzierte Zytochromoxydase.
Die Absolutwerte dieser Parameter können mit der NIRS nicht gemessen werden. Das Verfahren eignet sich nicht für die Überwachung der zerebralen O2-Versorgung beim Patienten mit Schädel-Hirn-Trauma.
Evozierte Potenziale
Evozierte Potenziale sind elektrische Reaktionen des Gehirns auf wiederholte spezifische periphere Reize. Je nach Stimulus werden unterschieden:
elektrisch: somatosensorisch evozierte Potenziale (SSEP),
akustisch: akustisch, auditorisch evozierte Potenziale (AEP),
Lichtreiz: visuell evozierte Potenziale (VEP).
Bei allen EP-Verfahren werden die Zeit zwischen Reizbeginn und maximalem Potenzial (Latenz in ms) und die Amplitude des Gipfels (peak) bestimmt.
In der Intensivmedizin werden auditorisch evozierte Hirnstammpotenziale und somatosensorisch evozierte Potenziale bestimmt, um bei Bewusstlosen die Funktion bestimmter Leitungsbahnen in Gehirn und Rückenmark zu überprüfen.
Allgemeine Behandlungs- und Pflegeschwerpunkte in der Neurointensivmedizin
Erstversorgung von Bewusstlosen
Wesentliche Ziele der Erstversorgung von Bewusstlosen sind die Sicherung der Vitalfunktionen, die Klärung der möglichen Komaursache und die Einschätzung der Komatiefe. Die Erstversorgung erfolgt in der Regel in der Notfallaufnahme der Klinik.
Erstversorgung bewusstloser Patienten
- Sicherung der Vitalfunktionen
- Atmung: endotracheale Intubation; oft auch maschinelle Beatmung
- Blutdruck, Herzfrequenz und -rhythmus
- Einschätzung der Komatiefe
- Erweckbarkeit: Anrufen, Schmerzreize setzen
- Glasgow-Koma-Skala erfassen; GCS <9: endotracheale Intubation
- Orientierender Hirnnervenstatus
- Bulbusstellung
- Pupillenweite und Lichtreaktion
- Puppenkopfphänomen
- Kornealreflexe, Trigeminusreiz
- Grimassieren auf Schmerzreize
- Schluck- und Hustenreflex
- Meningismus
- Subarachnoidalblutung: CT
- Fieber: Meningitis? Hirnabszess?
- Körperliche Untersuchung (wenn noch nicht erfolgt)
- Kopfwunden?
- Blutungen aus Mund, Nase, Ohren?
- Austritt von Liquor?
- Hinweise auf Thoraxtrauma, z. B. Prellmarken, instabile Atmung?
- Abdomen: Abwehrspannung?
- Rücken, Wirbelsäule: hat Patient Arme und Beine bewegt?
- HWS-Röntgen nach jedem Trauma, evtl. auch BWS und LWS
- Extremitätenfrakturen?
- Hinweis auf Drogenkonsum? Einstichstellen?
- Hautabschürfungen?
- Alte oder neue Hämatome?
- Hinweise auf Störungen der Blutgerinnung?
Darüber hinaus sollten Angehörige oder Zeugen zur Vorgeschichte befragt werden.
Lässt sich die Bewusstlosigkeit klinisch nicht abklären, muss ein CT oder MRT des Schädels durchgeführt werden.
Aufnahme des Patienten
Die Aufnahme des Patienten auf die Intensivstation erfolgt aus der Notfallaufnahme, dem OP, als Notfall von der Allgemeinstation oder direkt aus anderen Krankenhäusern. Meist sind die Patienten mit ihrer Verdachts- oder endgültigen Diagnose angemeldet, sodass der Bettplatz entsprechend vorbereitet werden kann.
Die Übergabe von Patienten aus dem OP erfolgt nach den in 10.1007/978-3-662-50444-4_39 dargestellten Prinzipien in der Regel durch den Anästhesisten oder Operateur an den zuständigen Arzt und das Pflegepersonal der Intensivstation.
Übergabe-Check für Neurointensivpatienten
Präoperativer Zustand, insbesondere neurologischer Status, Krampfleiden, Begleiterkrankungen, präoperative Medikamenteneinnahme
Art und Umfang der Operation; Lage der Drainagen
Narkoseverfahren und -verlauf
Blutverluste und Volumenersatz
Sonstige intraoperative Besonderheiten, wie Hirnschwellung, anhaltende Blutungen, Eröffnung von Nebenhöhlen
Intraoperativ erhobene Laborwerte
Postoperative Verordnungen, v. a. von Medikamenten (z. B. Dexamethason, Mannitol, Antikonvulsiva, Antibiotika)
Art der postoperativen Überwachung
Postoperative Nachbeatmung
CT-Kontrollen
Lagerung des Patienten
Die meisten Patienten werden mit leicht erhöhtem Oberkörper (15–30°) gelagert, Patienten mit operativ versorgtem subduralem Hämatom dagegen flach, ebenso Patienten mit Verletzungen der Wirbelsäule.
Maschinelle Beatmung
Auch für den neurochirurgischen und neurologischen Intensivpatienten gelten die in 10.1007/978-3-662-50444-4_56 dargestellten Grundprinzipien der Beatmung, jedoch müssen die Auswirkungen auf den intrakraniellen Druck bei dieser Patientengruppe besonders beachtet werden.
Hyperventilation vermindert die Hirndurchblutung und den intrakraniellen Druck,
Hypoventilation steigert die Hirndurchblutung und den intrakraniellen Druck.
Patienten mit erhöhtem intrakraniellen Druck werden in der Regel kontrolliert beatmet; hierbei wird die volumenkonstante gegenüber der druckkontrollierten Beatmung bevorzugt, um eine Hypoventilation zu vermeiden.
Grundsätzlich sollte der mittlere Atemwegdruck und damit der intrathorakale Druck so niedrig wie möglich gehalten werden, damit der venöse Abfluss aus dem Gehirn nicht beeinträchtigt wird. Eine leichte Oberkörperhochlagerung (15–30°) unterstützt den gewünschten Effekt.
Beatmungsparameter bei erhöhtem intrakraniellen Druck und ungestörtem pulmonalen Gasaustausch
Volumenkonstante, kontrollierte Beatmung
Atemzugvolumen 6–8 ml/kgKG
Beatmungsfrequenz 10–15/min
Atemzeitverhältnis 1 : 2 bis 1 : 1
Atemhubvolumina oder Atemminutenvolumina: je nach gewünschtem paCO2
PEEP ca. 5–8 mbar
Höhere PEEP-Werte sowie eine IRV sollten nur unter Kontrolle des ICP durchgeführt werden.
Assistierende Beatmungsverfahren
Während der kontrollierten Hyperventilation sind assistierende Verfahren nicht indiziert. Erst nach Normalisierung des intrakraniellen Drucks (und bei ausreichendem Atemantrieb) können die Spontanatmung unterstützende Verfahren wie BiPAP oder SIMV eingesetzt werden. Diese Methoden wirken sich günstig auf den intrathorakalen Druck aus. Folgendes muss aber beachtet werden:
Bei partiellen Beatmungsformen besteht die Gefahr der Hypoventilation mit Anstieg des intrakraniellen Drucks. Daher lückenlose Überwachung des paCO2!
Kontrollierte Hyperventilation
Die gezielte Absenkung des arteriellen paCO2 durch kontrollierte Beatmung wird als kontrollierte Hyperventilation bezeichnet. Ziel ist die Abnahme der Hirndurchblutung bzw. des zerebralen Blutvolumens und damit des erhöhten intrakraniellen Drucks.
Die Hirndurchblutung nimmt pro mmHg paCO2-Absenkung um etwa 2 ml/min × 100 g Hirngewebe ab.
Bei einem paCO2 von 15–20 mmHg beträgt der Abfall der Hirndurchblutung 40–60% des Normwerts, bei einem paCO2 von 70–80 mmHg steigt sie maximal um 100–120% an. Diese Veränderungen treten innerhalb weniger Minuten auf. Der Effekt der kontrollierten Hyperventilation hält allerdings nur einige Stunden an.
Wichtigste Gefahr der Hyperventilation ist eine zu starke Abnahme der Hirndurchblutung mit Schädigung des Gehirns (Hirnischämie): paCO2-Werte von 25 mmHg sollten daher nicht unterschritten werden!
Praktisches Vorgehen
Die kontrollierte Hyperventilation sollte nur bei akuten, bedrohlichen Anstiegen des intrakraniellen Drucks durchgeführt werden.
Bei normalem intrakraniellen Druck ist die kontrollierte Hyperventilation nicht indiziert.
Eine prophylaktische Hyperventilation hat beim Schädel-Hirn-Trauma keinen günstigen Effekt und ist daher ebenfalls nicht indiziert.
Die kontrollierte Hyperventilation sollte möglichst unter Kontrolle des intrakraniellen Drucks durchgeführt werden.
Der Nutzen einen längeren Hyperventilation (mehr als 12–24 h) ist nicht gesichert.
Während der kontrollierten Hyperventilation muss ein ausreichend hoher zerebraler Perfusionsdruck sichergestellt sein (50–70 mmHg).
Die Hyperventilation sollte ausschleichend beendet werden, um einen überschießenden Anstieg der Hirndurchblutung und des intrakraniellen Drucks zu vermeiden.
Analgosedierung und Muskelrelaxierung
Bei wesentlich erhöhtem Hirndruck werden die Patienten stark sediert, um den Hirnstoffwechsel zu senken. Durch die Sedierung wird bei den meisten Patienten der Atemantrieb vollständig ausgeschaltet und so die kontrollierte Beatmung ermöglicht. Eine Muskelrelaxierung ist in der Regel nicht erforderlich und sollte wegen ihrer ungünstigen Wirkungen nur erfolgen, wenn keine Anpassung des Patienten an den Respirator möglich ist.
Ernährung
Für die Ernährung des Neurointensivpatienten gelten u. a. die in 10.1007/978-3-662-50444-4_43 genannten Grundsätze.
Energiebedarf
Der Energiebedarf neurochirurgischer Patienten entspricht im Wesentlichen dem anderer Traumapatienten. Bei Patienten mit Schädel-Hirn-Trauma wird für die ersten zwei Wochen nach dem Trauma eine Umsatzsteigerung von 20–50% oberhalb des Ruheenergieumsatzes angegeben. Patienten mit Bulbärhirnsyndrom weisen einen erniedrigten, Patienten mit Mittelhirnsyndrom einen besonders hohen Ruheenergieumsatz auf. Ursache der Energieumsatzsteigerungen sind hormonelle Störungen (10.1007/978-3-662-50444-4_43). Streckkrämpfe steigern durch die Muskelaktivität den Energieumsatz.
Eiweißstoffwechsel
Direkt nach dem Trauma mit einem Maximum zwischen dem 2. und 4. Tag besteht ein erheblicher Katabolismus mit gesteigertem Eiweißumsatz, gesteigerten renalen Stickstoffverlusten und Störungen im Muster der freien Aminosäuren.
Glukose
Der Energiebedarf des Gehirns wird zu mehr als 95% von Glukose gedeckt. Hypoxische Hirnareale verstoffwechseln Glukose ohne Sauerstoff (anaerob). Bei übermäßiger Glukosezufuhr kann es daher zu einer intrazellulären Laktatazidose mit sekundärer Hirnschädigung kommen. Nach derzeitiger Auffassung kann eine Hyperglykämie den sekundären Hirnschaden und das posttraumatische Hirnödem verstärken.
Thromboseprophylaxe
Bei immobilen Patienten ist das Risiko thromboembolischer Komplikationen erhöht. Dies gilt auch für Patienten mit schwerem Schädel-Hirn-Trauma. Ab dem 2. Tag nach dem Trauma kann eine Prophylaxe mit unfraktioniertem oder niedermolekularem Heparin durchgeführt werden, wenn keine neurochirurgischen Interventionen erforderlich sind. Das Blutungsrisiko ist aber zu beachten! Die Leitlinien empfehlen zusätzlich Kompressionsstrümpfe, wenn keine Verletzungen der unteren Extremität vorliegen.
Spezielle Pflege des Neurointensivpatienten
Grundsätzlich gelten die in 10.1007/978-3-662-50444-4_38 dargestellten Prinzipien der Intensivpflege auch für den Neurointensivpatienten. Bei den einzelnen Erkrankungen ergeben sich einige Besonderheiten, auf die in den entsprechenden Abschnitten eingegangen wird. Auch sollten die Möglichkeiten der basalen Stimulation angewandt werden.
Transport des Patienten
Innerklinische Transporte des Neurointensivpatienten sind v. a. für diagnostische oder auch für operative Maßnahmen erforderlich. Hierzu gehören CCT, NMR, Angiographie usw. EEG, Ultraschalluntersuchungen, EMG, ENG und evozierte Potenziale können hingegen auf der Station durchgeführt werden.
Der Transport erfordert ein geplantes Vorgehen mit Bereitstellung des gesamten Transport- und Versorgungszubehörs; außerdem sollte sich die Herz-Kreislauf-Funktion des Patienten in stabilem Zustand befinden.
Transport des Patienten
Transportbegleitung: 1 Arzt und mindestens 1 Pflegeperson
Transportliege mit Transportmonitor und Transportbeatmungsgerät, Beatmungsbeutel mit Maske
Erforderliche Perfusoren oder Infusomaten
Notfallmedikamente, Notfallzubehör
Die Verlegung von Neurointensivpatienten in andere Krankenhäuser erfolgt unter Arztbegleitung.
Lagerung und Mobilisation
Die Standardlagerung für Patienten mit erhöhtem intrakraniellen Druck ist die Oberkörperhochlagerung, um den Abfluss des hirnvenösen Blutes zu gewährleisten. Halbseitenlagerung mit erhöhtem Oberkörper ist hierbei ebenfalls möglich. Die Bauchlagerung und Kopftieflagerung sind bei Neuro-Intensivpatienten besonderen Indikationen vorbehalten und bedürfen der Anordnung durch den Arzt.
Auch die Mobilisierung des Patienten hängt vom Krankheitsbild und dessen Verlauf ab und bedarf ebenfalls der Rücksprache mit dem Arzt. Einzelheiten zur Lagerung und Mobilisation sind bei den jeweiligen Krankheiten dargestellt.
Körpertemperatur
Unmittelbar postoperativ tritt häufig ein leichter Anstieg der Körpertemperatur (bis ca. 38°C) auf. Anhaltend erhöhte Körpertemperatur sollte aber zu bakteriologischen Untersuchungen veranlassen (Urin, Trachealsekret, intravasale Zugänge, externe Ventrikeldrainage).
Zentrale Hyperpyrexie
Als zentrales Fieber wird ein Anstieg der Körperkerntemperatur auf über 40°C bezeichnet. Häufigste Ursachen sind massive intrakranielle Blutungen oder Läsionen im Hypothalamus.
Überwachung und Pflege von Drainagen
Bei neurochirurgischen Patienten dienen Drainagen der Ableitung von Blut, Wundsekret oder Liquor. Blut und Wundsekret außerhalb der Hirnventrikel wird über Redon- und Robinson-Drainagen abgeleitet; die Ableitung von Liquor erfolgt über externe Liquordrainagen.
Redon-Drainage
Die Redon-Drainage dient der Ableitung von Blut und Wundsekret. Die Ableitung erfolgt offen durch Schwerkraft oder durch Sog. Die Redon-Drainage wird oberhalb der Dura mater, unter der Galea oder epidural, platziert. Die Aufgaben des Pflegepersonals sind:
regelmäßige Kontrolle von Art und Menge der drainierten Flüssigkeit,
bei Verdacht auf Liquorbeimischung: Abklemmen der Drainage, um unkontrollierte Liquorverluste und die Entwicklungen einer Liquorfistel zu vermeiden,
Entfernung der Drainage in der Regel nach 24 h,
bei längerer Drainagedauer: tägliche Kontrolle der Eintrittstelle.
Robinson-Drainage
Sie dient der Ableitung von Blut aus der Wundhöhle durch Schwerkraft, d. h. ohne externen Sog. Praktische Gesichtspunkte sind:
Liegedauer beträgt 1–3 Tage,
der Sammelbeutel muss sich unterhalb des Kopfes befinden, damit die Schwerkraft wirken kann.
Jackson-Pratt-Drainage
Diese Drainage dient der Ableitung von Blut und Wundsekret unter leichtem Sog. Der Sog kann per Hand variabel eingestellt werden. Praktische Gesichtspunkte sind:
Liegedauer beträgt 1–3 Tage, je nach gefördertem Volumen,
das Reservoir muss sich unterhalb des Drainageaustritts befinden,
auf luftdichten Verschluss des Systems muss geachtet werden, um das Vakuum zu erhalten.
Saug-Spül-Drainage
Die Saug-Spül-Drainage wird v. a. nach operativer Sanierung von Abszessen und anderer infizierter Gewebe angewandt. Das Drainagesystem enthält einen Zu- und Ablauf für die Spülung des betroffenen Gewebes. Die Spülung erfolgt mit desinfizierender oder mit Antibiotika enthaltenden Lösungen. Praktische Gesichtspunkte sind:
Spülmenge pro Stunde festlegen; Spüllösung zuführen und passiv über den gesonderten Drainageschlauch ablaufen lassen,
genaue Bilanzierung (Rückstau? Zusätzlich Liquor vorhanden?),
Liegedauer 3 bis max. 5 Tage,
zunächst den Zulauf des Systems entfernen, 12–24 h später den Ablauf.
Bei lokaler Spülung des Hirngewebes mit Antibiotika besteht die Gefahr von Krampfanfällen!
Liquordrainagen
Unterschieden werden die externe und die lumbale Ventrikeldrainage.
Externe Ventrikeldrainage
Die externe Ventrikeldrainage erfüllt zwei Funktionen:
Entnahme von Liquor zur intrakraniellen Volumenentlastung und Senkung des ICP,
Messung des intrakraniellen Drucks für die Überwachung.
Außerdem kann die intrakranielle Compliance bestimmt werden.
Indikationen
Zu den wichtigsten Indikationen der externen Ventrikeldrainage gehören:
Schädel-Hirn-Trauma: Messung und Senkung des ICP,
Subarachnoidalblutung, v. a. in Verbindung mit Hydrozephalus,
bei Kindern: Tumoren der hinteren Schädelgrube, Shuntinfektion,
posthämorrhagischer Hydrozephalus bei Neugeborenen.
Lokalisation
Die externe Ventrikeldrainage wird paramedian, in Höhe der Koronarnaht, am frontalen Pol des Seitenventrikels platziert. Soll die hintere Schädelgrube entlastet werden, kann auch okzipital eingegangen werden. Das einfache System besteht aus Kunststoffschläuchen mit Öffnungen am proximalen Ende, einem Auffangbehälter und einem distalen Ende, an dem der ICP in cm Wassersäule abgelesen werden kann. Bei Bergmann-Systemen kann der ICP über einen elektronischen Druckwandler gemessen werden.
Praktische Hinweise
Für einen Drainagedruck von 20 mmHg muss der Auffangbehälter 27 cmH2O über dem Nullpunkt (äußerer Gehörhang) platziert werden.
Für die Überwachung des intrakraniellen Drucks wird eine Drainagehöhe von 15–20 cmH2O empfohlen.
Bei Anschluss des Systems an den Monitor sollten atem- und pulssynchrone Schwankungen der intrakraniellen Druckkurve sichtbar sein.
Fehlt eine Kurve, liegt eine technische Komplikation oder eine verminderte intraventrikuläre Liquormenge vor.
Bei geöffneter Drainage stündliche Drainagemenge und die Liquorfarbe erfassen und protokollieren. Die Drainagemenge kann bis zu 500 ml/24 h betragen und richtet sich nach der Höhe des intrakraniellen Drucks.
Für die Überwachung des intrakraniellen Drucks die Drainage verschließen. Der intrakranielle Druck sollte unter 20 mmHg liegen.
Lässt sich durch Ablauf von Liquor keine ausreichende Senkung des ICP erreichen, müssen andere Maßnahmen ergriffen werden, z. B. die Zufuhr von Mannitol oder eine kontrollierte Hyperventilation.
Für Transporte sollte die Drainage abgeklemmt werden.
Der Ventrikelkatheter sollte so früh wie möglich entfernt werden.
Entfernung der Drainage bei komatösen Patienten: Wenn bei 24 h abgeklemmter Drainage ICP <20 mmHg beträgt, keine weiteren Maßnahmen der ICP-Senkung erforderlich sind und die Drainagemenge <50 ml pro Tag beträgt.
Komplikationen
Zu den wichtigsten Komplikationen gehören:
technisch bedingt: Verschluss des Systems durch Blut oder Luft, Diskonnektion, Leckage, Fehllage der Katheterspitze,
Infektionen: Ventrikulitis, Meningitis, Enzephalitis; Häufigkeit abhängig von der Liegedauer: insgesamt ca. 10%,
Blutung nach Anlage der Drainage, Nachblutung,
drainierte Liquormenge zu hoch.
Lumbale Liquordrainage (Tuohy)
Das System dient der Ableitung von Liquor aus dem lumbalen Subarachnoidalraum bei freier Liquorpassage. Der Punktionsort liegt meist bei L3/L4 oder L4/L5. Der Abfluss von Liquor wird, wie bei der Ventrikeldrainage, durch Variationen in der Höhe des Auffangbehälters reguliert.
Praktische Hinweise
Sorgfältige Kontrolle der drainierten Liquormenge: ca. 150 ml/24 h.
Vor der Mobilisierung des Patienten Drainage abklemmen.
Die Liegedauer des Drainagesystems sollte so kurz wie möglich sein.
Beim Auftreten von Liquorleckagen wird die Drainage sofort entfernt.
Nach Entfernen der Drainage können postspinale Kopfschmerzen auftreten.
Frührehabilitation auf der Intensivstation
Erworbene Hirnschäden führen zu vorübergehenden oder bleibenden neurologischen und psychischen Störungen. Durch Maßnahmen der Frührehabilitation bereits auf der Intensivstation wird versucht, solche Beeinträchtigungen zu minimieren. Zu den wichtigsten Maßnahmen gehören:
Physiotherapie,
Ergotherapie,
physikalische Therapie,
integrierte neurophysiologische Pflege,
Medikamente.
Physiotherapie
Die Physiotherapie ist für Patienten mit erworbener Hirnschädigung von herausragender Bedeutung.
Stimulation durch Sinnesreize
Diese Maßnahme umfasst die Förderung der taktil-kinästhetischen Wahrnehmung, die Beeinflussung von Aufmerksamkeit und Antrieb, das Üben der Hand-Mund- und der Mund-Auge-Koordination sowie die Aktivierung des Gleichgewichtssystems.
Tonusregulation
Mit bestimmten Maßnahmen wird versucht, einen erhöhten Muskeltonus zu senken, einen erniedrigten dagegen zu normalisieren.
Herstellen der physiologischen Balance
Sitzen an der Bettkante, unterstütztes Stehen, axiale Belastungen der Wirbelsäule und der Extremitäten sowie Aufrichten durch Bewegungswechsel fördern die Wiederherstellung der physiologischen Balance.
Kontrakturprophylaxe
Bewegen und Lagern, Manualtherapie, häufige Fersenbelastung und die Tonushemmung in den proximalen Gelenken gehören zu den wichtigen Maßnahmen der Kontrakturprophylaxe.
Pneumonieprophylaxe und Atemstimulation
Die wesentlichen Maßnahmen sind in 10.1007/978-3-662-50444-4_54 dargestellt.
Ergotherapie
Hierzu gehören die basale Stimulation (Einzelheiten: 10.1007/978-3-662-50444-4_39), die Behandlung von Wahrnehmungsstörungen (Orientierungen am Körper, im Raum, Interaktion mit der Umwelt usw.) sowie das faziorale Takttraining, d. h. die Behandlung sensomotorischer Störungen im Gesicht und im Mundbereich, mit dem Ziel, Essen, Trinken und nonverbale Kommunikationsfähigkeit wieder zu erlangen.
Physikalische Therapie
Die physikalische Therapie wird beim Intensivpatienten nur in begrenztem Umfang durchgeführt.
Neurophysiologische Pflege
Hierzu gehören u. a. die Beurteilung des Bewusstseins, das Verstehen der aktuell möglichen Kommunikationsformen des Patienten, Wahrnehmung und Verstehen, außerdem die Beurteilung des Sich-Bewegen- und des Sich-Pflegen-Könnens, die Nahrungsaufnahme, die Ausscheidungsfunktionen, der Tag-Nacht-Rhythmus und individuelle Besonderheiten, außerdem die Körperpflege (10.1007/978-3-662-50444-4_39).
Medikamente
Medikamente können eingesetzt werden, um die Frührehabilitation zu unterstützen, so z. B. β-Blocker, aber auch Clonidin bei vegetativen Funktionsstörungen, Neuroleptika bei Erregungs- und Verwirrtheitszuständen sowie antispastisch wirkende Medikamente bei anhaltender Spastik.
Beteiligung von Angehörigen
Zunächst muss den Angehörigen geholfen werden, ihren anfänglichen Schock zu überwinden. Danach sollten sie an der Frührehabilitation und Pflege beteiligt werden, da sie oft leichter Zugang zum Patienten finden als professionelle Helfer. Wichtig sind v. a. der Aufbau eines Dialogs, Körperkontakt und Körperpflegemaßnahmen einschließlich Mundhygiene, die von den Angehörigen durchgeführt werden.
Schädel-Hirn-Trauma (SHT)
Etwa 250.000 Menschen pro Jahr erleiden in Deutschland ein Schädel-Hirn-Trauma. Bei 5% ist die Schädelhirnverletzung schwer, bei 4% mittelschwer und bei 91% leicht. Etwa 2.750 Menschen sterben, davon 60% innerhalb von 2 h nach dem Schädel-Hirn-Trauma. Die hohe Frühmortalität kann nur gesenkt werden, wenn unmittelbar nach der Aufnahme des Patienten eine intensive Behandlung durch geschultes und erfahrenes Personal eingeleitet oder fortgesetzt wird.
Offene Schädel-Hirn-Verletzung
Dies sind alle Verletzungen, bei denen die Dura eröffnet wurde. Häufigste Ursache sind penetrierende Verletzungen, z. B. durch Schuss- oder Stichwaffen. Die Infektionsgefahr für die Hirnhäute und das Hirn selbst ist besonders groß.
Gedeckte Schädel-Hirn-Verletzung
Hierzu gehören alle Verletzungen, bei denen die Dura unversehrt geblieben ist. Sie können mit oder ohne Schädelfraktur einhergehen.
Schweregrade des Schädel-Hirn-Traumas
Der Schweregrad eines Schädel-Hirn-Traumas kann nach der Glasgow-Koma-Skala (GCS, Abschn. 61.4.3) in folgender Weise klassifiziert werden:
leichtes Schädel-Hirn-Trauma: GCS 13–15 Punkte,
mittelschweres Schädel-Hirn-Trauma: GCS 9–12 Punkte,
schweres Schädel-Hirn-Trauma: GCS 3–8 Punkte.
Ältere Einteilungen wie Commotio, Contusio und Compressio cerebri sind ungenau und gelten als überholt.
Schweres Schädel-Hirn-Trauma
Ein schweres Schädel-Hirn-Trauma liegt vor bei einer GCS-Punktzahl von 8 oder weniger für einen Zeitraum von 6 h oder länger.
Sekundäre Hirnschädigung
Für die Behandlung und Prognose des Schädel-Hirn-Traumas ist es sinnvoll, zwischen primären und sekundären Hirnschädigungen zu unterscheiden. Primäre Hirnschäden treten im Moment des Unfalls selbst auf. Hierbei handelt es sich um Kontusionen des Gehirns sowie diffuse neuronale Funktionsstörungen und Schädigungen, die therapeutisch nicht beeinflussbar sind. Sekundäre Hirnschäden hingegen sind Folgen von Komplikationen, die sich in einem späteren Stadium des Schädel-Hirn-Traumas entwickeln. Hierbei können intrakranielle und extrakranielle Komplikationen unterschieden werden. Die wichtigsten sind:
intrakranielle Blutungen,
posttraumatische Hirnschwellung,
hypoxische/ischämische Hirnschädigung,
Fettembolie,
Meningitis,
Hirnabszess,
Hirninfarkt.
Das gesamte neurochirurgische Behandlungskonzept ist darauf ausgerichtet, eine weitere Schädigung des Gehirns durch sekundäre Komplikationen zu verhindern.
Intrakranielle Blutungen
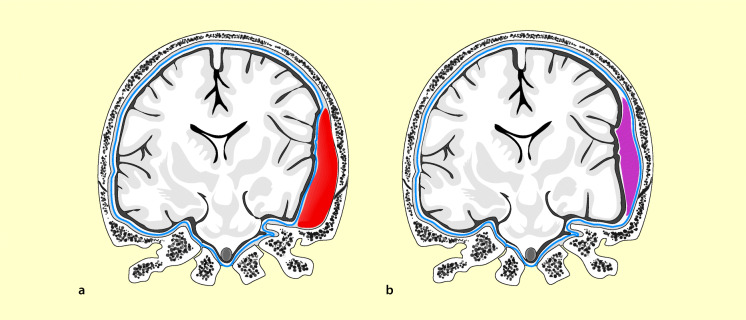
Intrakranielle Blutungen sind eine Komplikation des Schädel-Hirn-Traumas, die zumeist operativ behandelt werden muss. Die folgenden intrakraniellen Blutungen werden unterschieden (Abb. 61.1).
Epidurales (extradurales) Hämatom
Diese Blutung entsteht am häufigsten durch Zerreißung eines Astes der A. meningea media, manchmal als venöse Blutung bei durch den Sinus verlaufenden Frakturen. Ein epidurales Hämatom findet sich bei etwa 5% aller Schädel-Hirn-Traumen; bei 80% der Erwachsenen und 50% der Kinder liegt eine Schädelfraktur vor (Abb. 61.2). Die Blutung ist zumeist in der Temporalgegend gelegen.

Als typische Symptomatik, die jedoch nur bei einem Drittel der Patienten auftritt, gilt:
unmittelbar nach dem Trauma kurzer Bewusstseinsverlust,
danach freies („luzides“) Intervall mit Normalisierung des neurologischen Status,
dann sekundär Kopfschmerzen und zunehmende Eintrübung des Bewusstseins,
schließlich gleichseitige Pupillenerweiterung (bei 80% der Patienten),
Verlust des Bewusstseins,
Cheyne-Stokes-Atmung,
Bradykardie, Tod durch Atem- und Herz-Kreislauf-Versagen.
Treten bei einem Patienten mit Schädel-Hirn-Trauma (insbesondere mit Schädelfraktur) Kopfschmerzen und Schläfrigkeit auf, muss immer an ein epidurales Hämatom gedacht werden. Das Hirndruckzeichen ist eine Indikation zur sofortigen Operation.
Die Diagnose wird durch zerebrale Computertomographie gesichert. Die Behandlung besteht in sofortiger chirurgischer Entlastung, wenn das Volumen mehr als 30 ml beträgt – unabhängig vom GCS. Abwarten ist möglich bei einem Volumen von <30 ml, einer Hämatomdicke von <15 mm, einer Mittellinienverlagerung von <5 mm und einer GCS von >8. Die Prognose ist bei umgehender Ausräumung des Hämatoms gut, insbesondere sind keine irreversiblen neurologischen Ausfälle zu erwarten. Wird das epidurale Hämatom jedoch nicht rechtzeitig erkannt, so verschlechtert sich die Prognose.
Akutes subdurales Hämatom
Dies ist eine Blutansammlung im Subduralraum, die sich innerhalb von 72 h nach dem Trauma manifestiert. Subdurale Hämatome sind 3-mal häufiger als epidurale Hämatome; sie treten bei etwa 18% aller Schädel-Hirn-Traumen auf; unterschieden werden:
einfache akute Subduralhämatome: Ansammlung von Blut unter der Dura ohne darunter liegende Kontusionen oder Zerreißungen von Hirngewebe. Sie entstehen durch Zerreißungen von Brückenvenen.
Komplizierte akute Subduralhämatome: Ansammlung von Blut mit Kontusion und Zerreißung des Hirngewebes: häufig liegt auch eine arterielle Blutung aus dem kontusionierten oder lazerierten Hirn vor.
Das klinische Bild ist in folgender Weise gekennzeichnet:
Bewusstlosigkeit ohne freies Intervall,
Zeichen der Massenverschiebung: Hemiparese, einseitige Dezerebration, Pupillenerweiterung.
Manchmal ist ein freies Intervall vorhanden, einige Patienten verlieren nicht das Bewusstsein.
Die Diagnose wird durch zerebrale Computertomographie gesichert. Das Computertomogramm informiert über Größe und Lokalisation, Mittellinienverschiebung, Hirnödem und Begleitläsionen.
Die Behandlung besteht in umgehender Operation mit anschließender intensivmedizinischer Behandlung, wenn die Hämatomdicke >10 mm beträgt oder die Mittellinienverlagerung >5 mm, wiederum unabhängig von der GCS. Abwarten ist möglich bei nur geringer Raumforderung und einer GCS von ≥9. Bei Hirndruckzeichen muss umgehend operiert werden, ebenso bei gemessenen Hirndruckanstiegen von >20 mmHg oder Einklemmungszeichen.
Die Prognose ist ernst; besonders bei beiderseitigen Subduralhämatomen oder multiplen Lazerationen des Gehirns liegt die Sterblichkeit zwischen 60–100%.
Intrazerebrales Hämatom
Blutung in das Hirngewebe, oft im frontalen oder temporalen Bereich, manchmal auch tief in den Hemisphären. Große Hämatome werden operativ ausgeräumt.
Das klinische Bild hängt von der Lokalisation und Größe des Hämatoms ab, ist aber bei den einzelnen Hämatomarten oft sehr ähnlich. Die genaue Diagnose kann daher meist (aber nicht immer) nur durch ein zerebrales Computertomogramm gestellt werden. Beim epiduralen Hämatom tritt die klinische Verschlechterung gewöhnlich innerhalb der ersten 24 h ein; manchmal sogar sehr dramatisch. Bei intraduralen Hämatomen (subdural, intrazerebral) läuft die Verschlechterung des klinischen Zustandes eher verzögert ab. Allerdings ist es nicht möglich, die beiden Hämatome allein aufgrund des klinischen Verlaufs zuverlässig zu unterscheiden.
Bei Läsionen von <20 ml ohne raumfordernden Effekt ist abwartendes Verhalten indiziert, bei komatösen Patienten eine kontinuierliche ICP-Messung.
Bei Volumen >20 ml und zunehmender Raumforderung (Mittellinienverlagerung von >5 mm oder Kompression der basalen Zisternen) ist die Operation indiziert, ebenso bei einem Volumen von >50 ml.
Posttraumatische Hirnschwellung ( “Hirnödem“)
Im Anschluss an das Schädel-Hirn-Trauma kann eine Hirnschwellung mit Anstieg des intrakraniellen Drucks auftreten. Die Hirnschwellung kann durch einen erhöhten Wassergehalt (echtes Hirnödem) oder durch eine Zunahme des intrakraniellen Blutvolumens bei Vasoparalyse oder durch beide Faktoren zusammen bedingt sein. Die zerebrale Blutvolumenzunahme wird durch einen lokalen oder generalisierten Verlust der Autoregulation der Hirndurchblutung ausgelöst (10.1007/978-3-662-50444-4_24), das Hirnödem hingegen durch Störungen der Blut-Hirn-Schranke. Hierdurch tritt proteinreiche Flüssigkeit in den extrazellulären Raum über (vasogenes Hirnödem); im Bereich der Kontusionen wird dagegen das Wasser überwiegend intrazellular eingelagert (zytotoxisches Hirnödem). Während anfänglich die Volumenzunahme kompensiert wird, nimmt nach Erschöpfung der Kompensationsmechanismen der intrakranielle Druck zu (10.1007/978-3-662-50444-4_24), schließlich treten Massenverschiebungen des Gehirns auf, die zur Kompression und tödlichen Schädigung vegetativer Zentren führen. Außerdem wird durch die Abnahme des zerebralen Perfusionsdrucks die Hirndurchblutung vermindert (10.1007/978-3-662-50444-4_24).
Hypoxisch/ischämische Hirnschädigung
Extrakranielle Faktoren können ebenfalls sekundäre Hirnschäden hervorrufen. Ihre Bedeutung wird häufig unterschätzt. Im Mittelpunkt steht hierbei die Beeinträchtigung der O2-Versorgung des Gehirns durch:
respiratorische Insuffizienz,
verminderte O2-Transportkapazität,
arterielle Hypotension.
Intrakranielle Infektionen
Infektionen treten selten innerhalb der ersten Tage nach dem Schädel-Hirn-Trauma auf; sie beruhen meist auf einer offenen Verletzung, die entweder übersehen oder ungenügend behandelt wurde. Beim Hirnabszess entwickeln sich die Zeichen der intrakraniellen Raumforderung.
Notfallbehandlung
In der Akutphase werden, sofort nach der Aufnahme des Patienten in den Notfallbehandlungsraum, die initialen Basismaßnahmen eingeleitet; hierzu gehören:
Sicherung von Atemwegen, Atmung und Herz-Kreislauf-Funktion,
allgemeine Einschätzung und Diagnostik,
spezielle Behandlung.
Ist der Patient polytraumatisiert, müssen lebensrettende Maßnahmen erfolgen, bevor die Ursachen vollständig erkannt worden sind (10.1007/978-3-662-50444-4_33).
Weitere praktische Hinweise
Bewusstlosigkeit ist das Zeichen einer Hirnverletzung – bis zum Beweis des Gegenteils.
Im Schockzustand kann das wirkliche Ausmaß eines Schädel-Hirn-Traumas nicht richtig eingeschätzt werden.
Blutdruckabfall ist selten durch ein Schädel-Hirn-Trauma allein bedingt. Hier muss, v. a. bei Polytraumatisierten, immer nach anderen Blutungsquellen gesucht werden.
Ein schimpfender oder schreiender Patient hat zunächst ausreichend geschützte Luftwege.
Blutdruckabfall, Tachykardie und Blässe sind Hinweise auf eine Blutung in den Thorax oder das Abdomen, wenn keine äußeren Verletzungen erkennbar sind.
Störungen der Atemmechanik, abnorme Thoraxbewegungen oder Krepitieren (Knirschen) über dem Thorax sind Hinweise auf ein Thoraxtrauma. Eine sofortige Thoraxdrainage ist meist erforderlich.
Ein straff gespanntes Abdomen in den ersten Stunden nach einem Trauma ist das Zeichen einer massiven intraperitonealen Blutung.
Spezielle neurologische Einschätzung
Die neurologische Ersteinschätzung des Patienten mit Schädel-Hirn-Trauma hat im Wesentlichen folgende Ziele:
Ausmaß und Lokalisation der Hirnverletzung festzustellen,
einen neurologischen Ausgangsstatus zu erheben, der als Referenz für eine Besserung oder Verschlechterung des klinischen Zustands dient,
intrakranielle Blutungen zu erkennen, die eine dringliche chirurgische Intervention erfordern.
Die wichtigsten Bestandteile der neurologischen Kurzuntersuchung sind:
Bewusstseinslage und motorische Reaktion nach der Glasgow-Koma-Skala,
Pupillenweite und Lichtreaktion,
Kornealreflexe,
Augenbewegungen aufgrund von Hirnstammreflexen,
Atemfunktion,
Herzfrequenzmuster,
arterieller Blutdruck.
Glasgow-Koma-Skala
Die Schwere einer Hirnfunktionsstörung wird am häufigsten mit der Glasgow-Koma-Skala (GCS) eingeschätzt. Sie dient auch zur Verlaufsbeobachtung während der Intensivbehandlung und wird vom Pflegepersonal der Intensivstation ebenfalls verwendet.
Bei der Glasgow-Koma-Skala werden standardisiert die Funktionen Augenöffnen, motorische Reaktion und verbale Reaktion jeweils getrennt überprüft und eingeschätzt (Tab. 61.1). Die Patientenreaktion wird auf einfache und für jeden Untersucher reproduzierbare Weise benotet.
| Reaktion | Punkte |
|---|---|
| Augenöffnen | |
| Spontan | 4 |
| Auf Geräusche | 3 |
| auf Schmerz | 2 |
| Nicht | 1 |
| Verbale Reaktion | |
| Orientiert | 5 |
| Verwirrte Unterhaltung | 4 |
| Unangemessene Wörter | 3 |
| Unverständliche Geräusche | 2 |
| Keine | 1 |
| Beste motorische Reaktion | |
| Kommt Aufforderungen nach | 6 |
| Lokalisiert Schmerz | 5 |
| Zieht normal zurück | 4 |
| Beugt auf Schmerz | 3 |
| Streckt auf Schmerz | 2 |
| Keine | 1 |
Höchste Punktzahl: 15; Werte <8 entsprechen einer schweren Hirnfunktionsstörung.
Koma
Der komatöse Patient öffnet nicht die Augen, äußert keinerlei Worte und kommt keiner Aufforderung nach.
Pupillenreaktion und -form
Die Überprüfung der Pupillengröße und Pupillenreaktion auf Licht ermöglicht Aussagen über die Funktion des Mittelhirns und des III. Hirnnervs (N. oculomotorius).
Wichtig ist v. a. der Seitenvergleich:
Bei Einklemmung des Gehirns im Tentoriumschlitz erweitert sich eine Pupille (meist die der gleichen Seite). Die Dilatation entsteht durch Kompression des N. oculomotorius.
Erweitern sich beide Pupillen, werden entweder beide Okulomotoriusnerven komprimiert oder es liegt eine lokale Schädigung im Mittelhirn vor. Es kann aber auch eine sekundäre Kompression des Mittelhirns bei Einklemmung zugrunde liegen.
Beiderseits extrem enge Pupillen können durch sekundäre Kompression des Hirnstamms bei intrakraniellem Druckanstieg entstehen.
Weite, reaktionslose und entrundete Pupillen bei tiefem Koma sprechen für irreversiblen Ausfall der Hirnstammfunktion.
Motorik
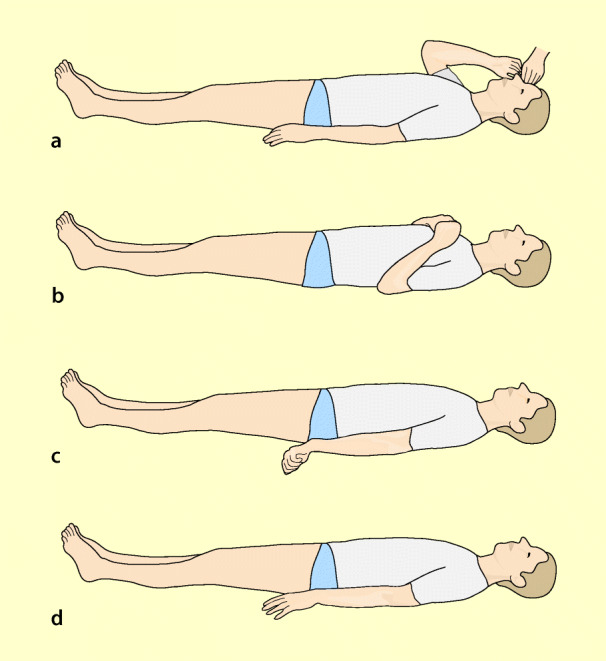
Die Untersuchung der motorischen Reaktion auf Schmerzreize (Abb. 61.3) ergibt beim Bewusstlosen Hinweise auf die Lokalisation und den Schweregrad der zerebralen Schädigung.
Keine motorische Reaktion
Zusammen mit schlaffem Muskeltonus und fehlenden Reflexen weist die fehlende motorische Reaktion auf eine schwere Schädigung des Hirnstammes hin. Sie findet sich bei Hirntod, im Terminalstadium eines Komas oder bei schwerer Schlafmittelintoxikation.
Streckmechanismen
Streckmechanismen weisen auf Schädigungen im Mittelhirn und der oberen Brücke (Pons) hin ( Dezerebration), können jedoch auch bei Coma hepaticum oder Koma nach Reanimation (ischämische Hirnschädigung) auftreten.
Beugemechanismen
Diese treten bei Schädigungen der Großhirnhemisphären auf oder bei einer stoffwechselbedingten Dämpfung der Hirnfunktion.
Gezielte Abwehr
Gezielte Abwehr auf Schmerzreize weist auf ein absichtsvolles Verhalten hin. Bewegungen nach Aufforderung beweisen, dass der Patient bei Bewusstsein ist.
Erhöhter Muskeltonus
Erhöhter Tonus manifestiert sich als Spastik und Rigor. Spastik ist ein federnder Dehnungswiderstand der Muskulatur und weist auf eine Schädigung der Pyramidenbahn hin. Rigor ist hingegen ein gleichmäßig erhöhter Widerstand der Muskulatur, der bei Schädigungen des extrapyramidal-motorischen Systems auftritt.
Kornealreflexe
Normale Reaktion: vorsichtiges Berühren der Hornhaut löst einen raschen Lidschluss aus.
Diese Hirnstammreaktion fehlt häufig bei traumatischer Bewusstlosigkeit. Aussagen über die Schwere oder die Prognose des Traumas können hieraus nicht abgeleitet werden. Die Bedeutung liegt mehr im pflegerischen Bereich, denn dieser Reflex dient normalerweise zum Schutz der Kornea; der Lidschlag verteilt außerdem die Tränenflüssigkeit, sodass die Anfeuchtung erhalten bleibt. Fehlt der Reflex, müssen die Augen künstlich angefeuchtet werden.
Augenbewegungen
Sie können durch bestimmte Hirnstammreflexe ausgelöst werden. Fehlen diese Reaktionen, liegt eine Schädigung des Hirnstamms vor:
Okulovestibularer Reflex: Er wird ausgelöst durch Spülen des äußeren Gehörgangs mit kaltem Wasser. Normalerweise tritt hierdurch ein Nystagmus auf. Mit zunehmender Hirnstammschädigung wird die Reaktion schwächer und bleibt schließlich ganz aus.
Okulozephaler Reflex: Rasches Drehen des Kopfes bewirkt eine Bewegung der Augen zur Gegenseite. Bei Hirnstammschädigung bleiben die Augen starr und in der Mitte fixiert („Puppenkopfphänomen“). Dieser Reflex darf nicht bei Verdacht auf eine Halswirbelschädigung überprüft werden.
Notfalltherapie
Die Notfalltherapie des Schädel-Hirn-Traumas beginnt so früh wie möglich nach der Verletzung, d. h. am Unfallort, im Rettungsfahrzeug oder spätestens unmittelbar nach der Aufnahme in die Notfallabteilung. Das Hauptziel der Notfallbehandlung besteht darin, sekundäre Schädigungen des Gehirns zu verhindern.
Atmung
Den Atemwegen muss beim komatösen Patienten die sofortige Aufmerksamkeit gelten, denn Obstruktion und Aspiration können rasch zu sekundärer Hirnschädigung führen.
Die Obstruktionsgefahr ist immer vorhanden, solange der komatöse Patient nicht endotracheal intubiert ist. Besondere Risiken ergeben sich zusätzlich, wenn der Patient innerhalb des Krankenhauses transportiert wird, z. B. vom Notfallbereich in den Diagnostikbereich oder in den OP.
Da der bewusstlose Patient seine Atemwege nicht ausreichend selbst schützen kann, muss die Indikation zur oralen endotrachealen Intubation großzügig gestellt werden: Bei schwerem Schädel-Hirn-Trauma sind Intubation und Beatmung obligat!
Besonders schwierig kann die Sicherung der Atemwege sein, wenn zusätzlich Gesichts-, Kiefer- und Mundverletzungen bestehen und dann die Atemwege durch oropharyngeale Blutungen, abgebrochene Zähne oder Gewebetrümmer verlegt werden.
Bei Mittelgesichtsfrakturen darf nicht nasotracheal intubiert werden. Besteht der Verdacht auf eine Halswirbelsäulenverletzung, darf der Kopf für die Intubation nicht überstreckt werden. Dies gilt ganz besonders für Densfrakturen, bei denen durch ausgiebige Kopf- und Halsbewegungen während der Intubation aber auch bei Lagerungsmaßnahmen eine Querschnittlähmung hervorgerufen werden kann.
Hypoxie ist geradezu typisch für die frühe Phase nach einem Schädel-Hirn-Trauma. Darum wird die Inspirationsluft immer mit Sauerstoff angereichert.
Herz-Kreislauf-Funktion
Hypotension ist besonders gefährlich für das Gehirn, weil sie zur Minderdurchblutung mit sekundärer Schädigung führen kann. Ein Blutdruckabfall durch die Hirnverletzung selbst tritt praktisch nur auf, wenn der Tod unmittelbar bevorsteht. Dann ist der Blutdruckabfall von Schnappatmung und schwerer Bradykardie begleitet.
Ist also der Blutdruck niedrig, muss immer nach multiplen Frakturen und Verletzungen im Bauchraum und Thorax gesucht werden. Gelegentlich können auch massive Blutungen aus Skalpwunden oder aus dem Ohr einen Schockzustand auslösen.
Besteht nur ein Schädel-Hirn-Trauma ohne Begleitverletzungen, ist rascher Volumenersatz selten dringend notwendig. Häufigster Fehler während der Erstbehandlung ist die massive Überwässerung. Hierdurch werden der Anstieg des intrakraniellen Drucks und die Bildung eines Hirnödems begünstigt.
Vor allem Kinder erhalten in der Initialphase der Behandlung nicht selten zu viel Flüssigkeit.
In jedem Fall muss frühzeitig ein sicherer Venenzugang gelegt werden. Laborwerte hoher Priorität beim Schädel-Hirn-Trauma sind:
Blutgruppe und Kreuzprobe,
Hämoglobin und Hämatokrit,
Gerinnungsteste und Thrombozyten,
Elektrolyte,
Harnstoff und Kreatinin,
Gesamteiweiß,
Blutzucker,
arterielle Blutgase.
Der Volumenersatz erfolgt, je nach Ausmaß der Verluste, mit Kristalloiden, Kolloiden oder Blut bzw. Blutderivaten (Einzelheiten: 10.1007/978-3-662-50444-4_16 und 10.1007/978-3-662-50444-4_17). Neben den venösen Zugängen sind erforderlich:
Blasenkatheter,
Magensonde,
arterielle Kanüle.
Osmotherapeutika
Während der Reanimationsphase sollte nicht routinemäßig Mannitol zugeführt werden, sondern nur, wenn sich der neurologische Zustand im Schockraum rasch verschlechtert (Abschn. 61.4.5).
Sedativa und Analgetika
Bestehen bei der Aufnahme starke Schmerzen, werden opiatartige Analgetika (z. B. Dipidolor) zugeführt. Bei starker Unruhe bzw. Streckkrämpfen sollten Benzodiazepine (z. B. Valium, Rivotril) injiziert werden. Es muss aber bedacht werden, dass jede Sedierung die Beurteilung der Bewusstseinslage erschwert.
Nach Abschluss der initialen Basismaßnahmen und Stabilisierung des Patienten können weiterführende diagnostische Maßnahmen erfolgen, um die zugrunde liegende Schädigung genauer festzustellen.
Weiterführende Diagnostik
Zwei diagnostische Maßnahmen stehen im Vordergrund: Röntgen des Schädels und zerebrale Computertomographie (CT).
Computertomogramm (CT) und Magnetresonanztomographie (MRT)
CT
Die Computertomographie ist eine einfache, sichere und rasch durchführbare Untersuchungsmethode. Folgendes kann mit der Computertomographie festgestellt werden:
intrakranielle Blutungen, deren Lokalisation und relative Größe,
Kontusionsblutungen,
Hirnschwellung,
Schädelfrakturen.
Allerdings sind schwere diffuse Hirnschädigungen nicht immer im CT erkennbar. Auf jeden Fall ermöglicht das CT eine rasche Beantwortung der entscheidenden Frage beim Schädel-Hirn-Trauma, nämlich, ob eine operativ zu versorgende Schädel-Hirn-Verletzung vorliegt.
MRT
Die Magnetresonanztomographie ist aufwendig und bei schwer verletzten Patienten in der Akutsituation nicht als primäres Untersuchungsverfahren. Allerdings können hiermit umschriebene Gewebeläsionen besser festgestellt werden als mit der CT. Sie ist daher bei Patienten mit neurologischen Störungen indiziert, bei denen im CT kein pathologischer Befunde erhoben werden konnte.
Operationsindikationen
Folgende raumfordernde intrakranielle Verletzungen sind absolut dringliche Operationsindikationen:
Intrakranielle Blutungen: Epiduralhämatom, Subduralhämatom, intrazerebrales Hämatom/Kontusion,
raumfordernde Impressionsfrakturen.
Verletzungen mit aufgeschobener Operationsdringlichkeit:
Offene oder geschlossene Impressionsfrakturen ohne Verlagerung der Mittellinienstrukturen,
penetrierende Verletzungen und basale Frakturen mit Liquorrhöe.
Liegt keine chirurgisch behandelbare Verletzung vor, wird umgehend mit der Intensivbehandlung begonnen. Voraussetzung ist jedoch, dass keine anderen, dringlich zu operierenden Verletzungen (z. B. Milzruptur) bestehen.
Intensivbehandlung
Die Behandlung des Schädel-Hirn-Traumas ist primär darauf ausgerichtet, sekundäre Hirnschäden zu verhindern. Hierfür sind hauptsächlich drei grundlegende Maßnahmen erforderlich:
Beseitigung systemischer Störungen, die zu einer Beeinträchtigung der Sauerstoffversorgung des Gehirns führen, wie z. B. Verlegung der Atemwege, Hypotension, Hypoxie, Hyperkapnie.
frühes Erkennen und Beseitigen intrakranieller Hämatome und Hirnschwellungen
Verhinderung einer intrakraniellen Infektion durch frühzeitige Diagnose und Behandlung einer offenen Schädel-Hirn-Verletzung.
Die Behandlung des Patienten mit schwerem Schädel-Hirn-Trauma beruht auf den allgemeinen Grundsätzen der Intensivmedizin. Außerdem treten einige Besonderheiten hinzu, die weiter unten beschrieben werden.
Überwachung des Schädel-Hirn-Trauma-Patienten
Die Überwachung von Patienten mit schwerem Schädel-Hirn-Trauma entspricht derjenigen eines kritisch kranken Intensivpatienten (10.1007/978-3-662-50444-4_44). Sie wird jedoch ergänzt durch eine spezielle neurologische Überwachung, die darauf ausgerichtet ist, bedrohliche Komplikationen rasch zu erkennen.
Fachpflegekräfte sollen folgende einfachen neurologischen Überwachungsmaßnahmen durchführen:
Einschätzung der Bewusstseinslage nach der Glasgow-Koma-Skala,
Prüfung der Pupillengröße und -reaktion,
Erkennen von Krämpfen,
Messen des intrakraniellen Drucks,
Erkennen von Verschlechterungen des neurologischen Status.
Daneben spielt die Überwachung der Vitalfunktionen ebenfalls eine bedeutsame Rolle.
Blutdruck
Ein plötzlicher Blutdruckanstieg kann eine Reflexreaktion auf einen Anstieg des intrakraniellen Drucks sein ( Cushing-Reflex) oder durch eine Hirnstammischämie ausgelöst werden. Blutdruckanstieg tritt gewöhnlich auch bei intrakranieller Blutung auf.
Herzfrequenz
Bradykardie zusammen mit Blutdruckanstieg ist meist Zeichen der Hirnstammkompression. Hier muss sofort die zugrunde liegende Ursache (z. B. subdurales Hämatom) beseitigt werden, um einen irreversiblen Herz-Kreislauf-Kollaps zu verhindern.
Fieber
Tritt Fieber bei einem Patienten mit Schädel-Hirn-Trauma auf, muss u. a. immer an eine Meningitis gedacht werden. Weitere neurologische Gründe für Fieber sind Hirnabszess, subdurales Empyem.
Bewusstseinslage
Die Überprüfung erfolgt nach den Abschn. 61.1.1 dargelegten Grundsätzen. Jede verbale Äußerung, auch Stöhnen, und sei es auch nur ein unverständliches Grunzen oder Gähnen, zeigt eine gewisse Hirnrindenfunktion.
Motorische Reaktion
Ist keine motorische Reaktion auf Schmerzreize auslösbar, besteht eine schwere Funktionsstörung des Hirnstammes, besonders wenn gleichzeitig Muskelschlaffheit und Areflexie bestehen.
Streckkrämpfe und Beugekrämpfe weisen auf eine Schädigung des Mittelhirns und der oberen Brücke hin. Sie können durch eine primäre Hirnstammverletzung oder sekundäre Hirnstammkompression durch steigenden intrakraniellen Druck hervorgerufen werden.
Pupillenzeichen
Bedeutung der Pupillenzeichen: Abschn. 61.1.2.
Messung des intrakraniellen Drucks
Die physiologischen und pathophysiologischen Grundlagen des intrakraniellen Drucks sind in 10.1007/978-3-662-50444-4_24 dargestellt.
Anstiege des intrakraniellen Drucks treten bei Patienten mit schwerem Schädel-Hirn-Trauma relativ häufig auf. Hierbei sollen alle wesentlichen Verschlechterungen des klinischen Zustandes mit Anstiegen des intrakraniellen Drucks einhergehen oder die Druckanstiege der Verschlechterung unmittelbar vorangehen.
Die klinischen Zeichen des intrakraniellen Druckanstieges sind unspezifisch und beim sedierten und beatmeten Patienten häufig nicht nachweisbar:
Kopfschmerzen,
Erbrechen,
Bewusstseinstrübung,
Nackensteife.
Mit zunehmender Kompression des Gehirns durch den weiter ansteigenden Druck treten folgende Zeichen der Einklemmung auf:
Bewusstlosigkeit,
Streckstellung der Extremitäten,
maximale Pupillenverengung oder träge Lichtreaktion,
Störungen der Atmung,
zunehmende Pupillenerweiterung,
Erlöschen der Schmerzreaktion,
Zusammenbruch von Atem- und Herz-Kreislauf-Funktion.
Auch hier ist wiederum die klinische Beurteilung beim sedierten und u. U. relaxierten Beatmungspatienten erschwert. Außerdem können diese Zeichen nicht nur durch einen intrakraniellen Druckanstieg, sondern auch durch ein akutes Mittel- bzw. Bulbärhirnsyndrom bei primärer Hirnstammschädigung hervorgerufen werden.
Aus diesen Gründen wird bei diesen Patienten der intrakranielle Druck in der Regel direkt gemessen.
Indikationen für ICP-Sonde bei Patienten mit schwerem Schädel-Hirn-Trauma
CT-Nachweis eines intrakraniellen Hämatoms, einer Kontusion, eines Hirnödems bzw. einer Kompression basaler Zisternen
- Unauffälliges Hirn-CT, aber Vorliegen von mindestens zwei der folgenden Kriterien:
- Ein- oder beidseitige Streck-und/oder Beugetendenzen am Unfallort
- therapierefraktäre arterielle Hypotension (systolischer Blutdruck <90 mmHg)
- Alter >40 Jahre
Für die Messung des intrakraniellen Drucks stehen verschieden Methoden zur Verfügung.
Ventrikeldruckmessung
Bei dieser Methode, dem Goldstandard, wird über ein frontales Bohrloch ein Kunststoffkatheter in das Vorderhorn eines Seitenventrikels eingeführt. Der mit physiologischer Kochsalzlösung gefüllte Katheter wird mit einem Transducer und einem Druckverstärker verbunden. Eine kontinuierliche Druckspülung wird nicht verwendet (Abb. 61.4).
Auf diese Weise kann der Liquordruck kontinuierlich gemessen und auch aufgezeichnet werden. Der Druckaufnehmer wird entweder direkt auf dem Kopf des Patienten angebracht oder neben dem Bett in Höhe des Foramen monroi.
Vorteile der Methode
Liquor kann zu diagnostischen und therapeutischen Zwecken entnommen werden.
Nachteile
Bei generalisierter Hirnschwellung ist das Einführen des Katheters erschwert. Außerdem wird der Katheter leicht durch Blut und Gewebe verlegt. Die Infektionsgefahr ist erhöht.
Subarachnoidale Druckmessung
Bei dieser Methode wird der intrakranielle Druck über eine subarachnoidale Schraube gemessen Abb. 61.4). Hierzu wird die Schraube über ein Bohrloch bis in den Subduralraum bzw. Subarachnoidalraum vorgeschoben. Der Transducer kann direkt über einen Dreiwegehahn oder über ein Zuleitungssystem mit der Schraube verbunden werden.
Vorteile
Direkte Messung des Liquordrucks ohne Punktion der Hirnventrikel.
Nachteile
Infektionsrisiko wie bei Ventrikeldruckmessung. Messung nur bei geschlossenem Schädel möglich. Hohe Drücke können das Messsystem blockieren.
Epidurale Druckmessung
Bei diesem Verfahren wird über ein frontales Bohrloch entweder ein Miniatur-Transducer direkt zwischen Dura und Knochen vorgeschoben oder aber ein Druckaufnehmer in einer Hülse im Bohrloch selbst platziert, wo er direkten Kontakt mit der Dura hat (Abb. 61.4).
Vorteile
Weniger invasiv. Geringere Infektionsgefahr. Nacheichung am Patienten möglich. Druckwandler kann bei Defekten ausgewechselt werden.
Nachteile
Bei hohen intrakraniellen Drücken liegen die epiduralen Drücke teilweise erheblich über den Ventrikeldrücken. Liquor kann nicht entnommen werden. Transducerplatzierung ist problematisch: Der Transducer darf die Dura nur berühren, jedoch nicht eindrücken.
Hirndruckbereiche
0–15 mmHg: normal
15–30 mmHg: leicht erhöht
30–50 mmHg: stark erhöht
>50 mmHg: pathologisch
Kurzfristige Anstiege des Hirndrucks, z. B. beim Husten oder Pressen, dürfen nicht als Hirndruckerhöhung angesehen werden. Echte Hirndruckanstiege liegen erst vor, wenn über längere Zeit ein bestimmter Wert überschritten wird und nicht in den Normbereich zurückkehrt. Hierbei gilt aufgrund klinischer Beobachtung:
Bei intrakraniellen Drücken unter 30 mmHg droht keine Einklemmung des Gehirns; hingegen beginnt ab 50 mmHg der kritische Bereich. Drücke von mehr als 20 mmHg sollten gesenkt werden.
Wellenformen
Blutdruck- und Atemschwankungen übertragen sich auf die intrakranielle Druckkurve (Abb. 61.4). Die Druckkurve kann wie eine arterielle Druckkurve aussehen, manchmal auch wie eine zentrale Venendruckkurve. Außerdem werden noch A-, B- und C-Wellen unterschieden.
A-Wellen Plateauwellen)
Spontane, rasch eintretende Druckanstiege zwischen 50 und 100 mmHg, die ca. 15 und 20 min anhalten (Abb. 61.4). Plateauwellen treten nur auf, wenn der intrakranielle Druck bereits erhöht ist; sie gehen häufig mit den klinischen Zeichen des erhöhten Hirndrucks einher. Plateauwellen sollen auf einer Zunahme des intrakraniellen Blutvolumens beruhen.
B-Wellen
Kleine rhythmische Wellen mit Drücken bis zu 50 mmHg; sie gehen mit Veränderungen der Atmung einher.
C-Wellen
Kleine rhythmische Wellen mit Drücken bis zu 20 mmHg. Sie stehen in Beziehung zu periodischen Veränderungen des arteriellen Blutdrucks.
Zerebraler Perfusionsdruck
Der intrakranielle Druck darf bei Patienten mit schwerem Schädel-Hirn-Trauma nicht isoliert, sondern immer nur im Zusammenhang mit dem zerebralen Perfusionsdruck betrachtet werden. Der zerebrale Perfusionsdruck ist die Differenz zwischen arteriellem Mitteldruck und intrakraniellem Druck.
Der zerebrale Perfusionsdruck sollte bei Patienten mit Schädel-Hirn-Trauma 70 mmHg nicht unterschreiten, damit keine Minderdurchblutung des Gehirns eintritt. Bei schweren Hirnschäden kann jedoch bereits ein zerebraler Perfusionsdruck von 70 mmHg zu niedrig sein.
Hirnprotektion und Behandlung des erhöhten Hirndrucks
Primäres Ziel der Intensivbehandlung ist die Verhinderung sekundärer Hirnschäden, die v. a. durch folgende Komplikationen oder Störungen hervorgerufen werden:
Faktoren, die das Gehirn sekundär schädigen
Hypoxämie bzw. zerebraler O2-Mangel
Hypotension bzw. niedriger zerebraler Perfusionsdruck
Hyperkapnie: steigert den Hirndruck
Hypokapnie: vermindert die Hirndurchblutung; kann zu zerebraler Mangeldurchblutung führen
Hyperthermie bzw. Fieber
Hyperglykämie und Hypoglykämie
Hyponatriämie und exzessive Hypernatriämie
Ein weiterer Grundpfeiler der Intensivtherapie des Schädel-Hirn-Trauma-Patienten ist die Kontrolle des intrakraniellen Drucks. Hierbei gelten folgende Ziele (DGN-Leitlinie).
Ziele der Hirndruckkontrolle
ICP <20 mmHg
CPP >50–70 mmHg
Hierdurch sollen die Kompression des Gehirns und die Verschiebung von Hirnteilen verhindert werden. Der Prophylaxe des intrakraniellen Druckanstiegs kommt dabei allergrößte Bedeutung zu. Zu den allgemein-prophylaktischen Maßnahmen gehört die richtige Lagerung des Patienten (30–35° Oberkörperhochlagerung; Abschn. 61.4.6) und die Aufrechterhaltung eines ausreichenden zerebralen Perfusionsdrucks, wobei ein CPP von 70 mmHg nicht überschritten werden sollte, um eine Hyperämie des Gehirns (bei gestörter Autoregulation) zu vermeiden. Außerdem müssen alle Maßnahmen vermieden werden, die den intrakraniellen Druck erhöhen (10.1007/978-3-662-50444-4_24). Bevorzugte Maßnahmen zur Kontrolle des erhöhten ICP sind:
Liquordrainage, wenn eine Ventrikelsonde liegt (Abschn. 61.3.8),
Infusion hyperosmolarer Lösungen (Mannitol),
Mäßige Hyperventilation auf paCO2-Werte von 30–35 mmHg.
Kontrollierte Hyperventilation
Eine mäßige kontrollierte Hyperventilation (Ziel-paCO2 30–35 mmHg) bei mäßig erhöhtem ICP bewirkt eine zerebrale Vasokonstriktion mit Abnahme der Hirndurchblutung (10.1007/978-3-662-50444-4_24) und des intrakraniellen Drucks.
Diese Methode ist nur wirksam, wenn die Ansprechbarkeit der Hirngefäße auf CO2 erhalten ist. Dies ist jedoch beim Schädel-Hirn-Trauma nicht immer der Fall. Außerdem hält der Effekt meist nur einige Stunden an. Gegenwärtig ist nicht gesichert, ob die kontrollierte Hyperventilation einen günstigen Einfluss auf den Verlauf des Schädel-Hirn-Traumas hat.
Osmotherapie, Diuretika
Osmotherapeutika, wie z. B. Mannitol (Osmofundin), können durch Entwässerung v. a. gesunder Hirnanteile den intrakraniellen Druck senken. Diuretika, wie z. B. Furosemid (Lasix), sind hingegen bei akuten Hirndruckanstiegen nicht ausreichend wirksam. Osmotherapeutika sollten nicht starr schematisch, sondern möglichst unter kontinuierlicher Messung des intrakraniellen Drucks zugeführt werden. Sie sind v. a. bei ausgeprägter Hirnschwellung indiziert.
Die Dosis beträgt etwa 0,3 g/kgKG per Infusion innerhalb von 15 min bis zu 12-mal/Tag. Die Wirkung setzt nach etwa 20 min ein; die Wirkdauer ist sehr unterschiedlich. Die ausgeschiedenen Flüssigkeits- und Elektrolytmengen müssen ersetzt werden, um Entgleisungen des Wasser- und Elektrolythaushaltes zu vermeiden. Die Serumosmolarität soll 320 mosmol nicht überschreiten.
Wenn diese Maßnahmen nicht ausreichen, um den ICP zu senken, können folgende Behandlungsversuche unternommen werden:
Kurzzeitige forcierte Hyperventilation (paCO2 28–30 mmHg). Vorsicht: Gefahr der zerebralen Mangeldurchblutung,
hochdosierte Barbiturattherapie (Barbituratkoma),
osteoklastische, dekompressive Kraniotomie mit Duraerweiterungsplastik,
induzierte Hypothermie.
Barbituratkoma
Die Wirksamkeit von Barbituraten ist nicht ausreichend belegt, kann jedoch bei nicht beherrschbaren Hirndruckkrisen erwogen werden. Durch hochdosierte Barbiturate werden der Hirnstoffwechsel und die Hirndurchblutung stark gesenkt (ca. um 40–50%) und der intrakranielle Druck nimmt ab. Es entwickelt sich ein tiefes Koma. Verwendet wird Thiopental. Der initiale Bolus beträgt 10 mg/kgKG, gefolgt von einer kontinuierlichen Infusion mit 3–5 mg/kgKG/h. Die Zufuhr muss unter EEG-Kontrolle erfolgen; anfangs ist ein Burst-suppression-Muster im EEG erforderlich.
Gefahren sind Herz-Kreislauf-Depression mit Blutdruckabfall; Zunahme von Infektionen.
Operative Dekompression
Bei dieser Methode wird der Schädelknochen beiderseits großflächig entfernt und die Dura durch eine Plastik erweitert. Die operative Entlastung wird jedoch nur noch durchgeführt, wenn die Hirnschwellung durch die zuvor beschriebenen Maßnahmen nicht mehr beherrscht werden kann und gleichzeitig eine Überlebenschance besteht. Nicht selten treten nach diesem Eingriff sog. Liquorkissen auf.
Unwirksame Therapiemaßnahmen
Folgende Maßnahmen sind beim Schädel-Hirn-Trauma nicht indiziert, da unwirksam:
Kortikosteroide,
Magnesium,
prophylaktische Hyperventilation,
prophylaktische Verabreichung von Antiepileptika gegen posttraumatische epileptische Anfälle.
Spezielle Pflege
Für die allgemeine Intensivpflege des Patienten mit Schädel-Hirn-Trauma gelten die in 10.1007/978-3-662-50444-4_38 dargestellten Grundsätze. Besonderheiten betreffen in erster Linie die Lagerung.
Lagerung
Die Lagerung des Patienten mit Schädel-Hirn-Trauma muss die Wirkung aller Maßnahmen auf den intrakraniellen Druck berücksichtigen. Am günstigsten für den intrakraniellen Druck ist in der Frühphase die Rückenlage mit gerade liegendem Kopf und leicht erhöhtem Oberkörper (30°); sie ermöglicht einen freien Abfluss des hirnvenösen Blutes und dient damit zur Prophylaxe der Hirnschwellung.
Seitenlagerung ist für den intrakraniellen Druck nicht günstig; besonders ein Abkippen des Kopfes mit Abflussbehinderung des Jugularvenenblutes muss unbedingt verhindert werden. Kopftieflage ist absolut verboten.
Lagerung bei Hirnstammschädigung
Bei Hirnstammschädigung werden tonische Reflexe aktiviert, die zu abnormen Körperhaltungen führen. Ein abnormer Muskeltonus wird durch diese Reflexe zusätzlich verstärkt.
Typische Komplikationen sind:
vermehrte Spastik,
Kontrakturen,
Skoliosen,
Subluxation der Hüfte.
Hier muss durch bestimmte Lagerungsmaßnahmen dem abnormen Muskeltonus entgegengewirkt werden.
Sehr häufig nimmt der Schädel-Hirn-Traumatisierte die Opisthotonus-Lage ein: Rücken und Kopf sind überstreckt, die Extremitäten steif und gerade oder ebenfalls überstreckt. Die Haltung wird in Rückenlage verstärkt. Sie kann mit folgender Lagerung durchbrochen werden (Abb. 61.5): Rotation des Stammes und Beugung der unteren Extremitäten.
Wichtig ist auch die Lagerung des Kopfes: Der asymmetrische tonische Nackenreflex wird ausgelöst, wenn die Extremität, zu deren Seite der Kopf gedreht ist, gestreckt und die andere Extremität gebeugt wird. Um den Muskeltonus in einer fest angezogenen Extremität zu vermindern, wird daher der Kopf zur gleichen Seite gedreht. Die Ausbildung von Kontrakturen muss durch intensive krankengymnastische Behandlung verhindert werden.
Komplikationen
Unruhezustände und Streckmechanismen
Motorische Unruhezustände entstehen durch primäre und sekundäre Schädigungen des Gehirns. Nicht selten verbergen sich hinter Unruhezuständen Komplikationen, wie z. B. Hirnödem, intrakranielle Blutung oder Hypoxie. Darum müssen solche Faktoren zunächst immer ausgeschlossen werden. Medikamentös wird eine Analgosedierung durchgeführt. Zur Unterdrückung von Streckkrämpfen wird vorzugsweise Clonazepam (Rivotril) verwendet. Die Medikamente müssen so dosiert werden, dass die Streckkrämpfe nur noch angedeutet vorhanden sind.
Krampfanfälle
Krampfanfälle können durch das Trauma bedingt sein oder bereits vor dem Unfall bestanden haben. Sie werden mit Phenytoin, Carbamazepin oder Phenobarbital behandelt. Die prophylaktische Gabe von Antikonvulsiva ist bei Patienten mit Schädel-Hirn-Trauma nicht indiziert, solange keine Krampfanfälle in der Anamnese bekannt sind.
Behandlung des Status epilepticus: 10.1007/978-3-662-50444-4_68.
Diabetes insipidus
Der Diabetes insipidus ist durch die übermäßige Ausscheidung eines stark verdünnten Urins gekennzeichnet. Das Syndrom tritt nicht selten nach einem Schädel-Hirn-Trauma auf. Es beruht auf einem zentralen Mangel an antidiuretischem Hormon (ADH). Die Störung kann vorübergehend oder bleibend sein. Die starke Ausscheidung von verdünntem Urin führt zu:
Hypernatriämie,
Hyperosmolarität,
Dehydrierung.
Die Verluste müssen entsprechend ersetzt werden. Medikamentös wird als Mittel der Wahl Desmopressin (Minirin) intranasal oder parenteral zugeführt; die Dosierung erfolgt nach Wirkung.
Syndrom der unangemessenen ADH-Sekretion
Dieses Syndrom ist gekennzeichnet durch:
Hyponatriämie,
Hypoosmolarität,
vermehrte Natriumausscheidung im Urin.
Das Syndrom beginnt meist 3–5 Tage nach dem Trauma. Bei richtiger Therapie hält es nicht länger als 10 Tage an. Die Behandlung besteht v. a. in einer Wasserrestriktion. Hypertone Kochsalzlösung ist nur selten indiziert.
Störungen des Blutzuckers
Hyperglykämien sind nach schweren Traumen keine Seltenheit, so auch beim Schädel-Hirn-Trauma. Blutzuckerwerte von über 200 mg/dl werden mit Altinsulin (Perfusor) behandelt.
Starke Entgleisungen der Blutzuckerwerte können Hinweis auf eine schwere Schädigung des Hirnstammes sein.
Hypoglykämien treten gelegentlich trotz ausreichender kalorischer Ernährung auf. Behandlung: hochprozentige Glukoselösung über zentralen Venenkatheter.
Störungen der Temperaturregulation
Störungen der Temperaturregulation treten bei Schädigungen des Zwischenhirns (Thalamus) auf. Im Vordergrund steht hierbei die Hyperthermie. Hypotherme Reaktionen werden ebenfalls beobachtet (10.1007/978-3-662-50444-4_71).
Störungen der Herzfrequenz
Am häufigsten werden zentral bedingte Tachykardien beobachtet. Sie sollten mit β-Blockern behandelt werden.
Bradykardien können Hinweis auf einen intrakraniellen Druckanstieg sein.
Störungen der Blutdruckregulation
Zentral bedingte Störungen der Blutdruckregulation manifestieren sich als Hypertonie oder Hypotonie. Deutliche Anstiege des arteriellen Mitteldrucks begünstigen die Hirnschwellung; sie müssen daher umgehend behandelt werden; und zwar unter kontinuierlicher Kontrolle des arteriellen Drucks. Im Mittelpunkt der Behandlung stehen Analgetika, Sedativa und, wenn nicht ausreichend, Sympathikolytika. Blutdrucksenkende Substanzen, wie Nitroglycerin oder Nitroprussid, sollten möglichst nicht eingesetzt werden, weil sie die Hirndurchblutung und den intrakraniellen Druck erhöhen können. Anzustreben ist ein arterieller Mitteldruck von etwa 90 mmHg (zerebralen Perfusionsdruck berücksichtigen!).
Ein Blutdruckabfall kann ebenfalls zentral ausgelöst werden; nicht selten beruht er jedoch auf einem relativen oder absoluten Volumenmangel. Therapie: Volumenersatz, Katecholamine. Auch hier ist eine Normalisierung des arteriellen Mitteldrucks anzustreben. Eine überschießende Blutdruckreaktion durch Überdosierung von Katecholaminen ist zu vermeiden.
Meningitis
Eine Entzündung der Hirnhäute entsteht zumeist durch eine offene Hirnverletzung. Darum erhalten Patienten mit offener Hirnverletzung prophylaktisch Antibiotika. Bei Bewusstlosen ist die Diagnose „Meningitis“ nicht einfach zu stellen. Unklare Fieberanstiege sollten stets den Verdacht erwecken. Diagnose: Erregernachweis im Liquor. Behandlung nach Antibiogramm.
Subakute intrakranielle Blutungen
Subakute Blutungen sind wegen ihres zumeist undramatischen Verlaufs nicht leicht zu diagnostizieren; Hinweise sind:
freies Intervall nach dem Unfall, an dessen Ende der Patient plötzlich unruhig wird und dann eintrübt,
Halbseitensymptomatik,
fokale Ausfälle,
unveränderter klinischer Zustand über längere Zeit.
Um subakute Blutungen zu erkennen, ist eine sorgfältige und kontinuierliche Überwachung erforderlich. Die endgültige Diagnose wird durch ein Computertomogramm gestellt. Die Computertomographie ist auch für die Verlaufskontrolle beim Schädel-Hirn-Trauma von großer Bedeutung. Sie wird ab der 3. Woche alle 10–14 Tage durchgeführt.
Bleibt ein Patient längere Zeit bewusstlos, kann auch ein subdurales Hygrom die Ursache der anhaltenden Bewusstlosigkeit sein. Hygrome werden über ein Bohrloch mehrere Tage lang drainiert.
Liquorfisteln
Liquorfisteln treten häufig nach Schädel-Basis-Frakturen auf. Sie sind z. B. am Austritt von Liquor durch die Nase erkennbar. Es besteht erhöhte Infektionsgefahr. Die Behandlung erfolgt zunächst medikamentös durch antibiotische Abschirmung. Tamponaden dürfen keinesfalls eingesetzt werden. Verschließt sich die Fistel nicht innerhalb einer Woche, ist der operative Verschluss indiziert.
Sinus-cavernosus-Fistel
Dies ist eine traumatische Verbindung zwischen A. carotis interna und dem venösen Sinus cavernosus. Durch den arteriovenösen Shunt besteht eine Minderdurchblutung der gleichseitigen Hemisphäre.
Die Zeichen sind:
Exophthalmus derselben Seite mit Lidschwellung,
pulssynchrones Rauschen,
multiple neurologische Ausfälle, je nach Ausmaß der Minderdurchblutung.
Die Diagnose wird durch Angiographie gesichert, die Behandlung erfolgt operativ.
Hirntod
Bei einigen Patienten führt das Schädel-Hirn-Trauma zum irreversiblen Hirntod. Bei diesen Patienten sollte die Intensivbehandlung nicht weiter fortgesetzt werden.
Die klinischen Zeichen des Hirntodes sind:
tiefe Bewusstlosigkeit,
keinerlei Schmerzreaktion,
keine Spontanatmung,
weite, lichtstarre Pupillen,
Abfall von Körpertemperatur und Blutdruck,
Ausfall der Hirnstammreflexe.
Bei diesen Befunden muss aber die Wirkung von Medikamenten sicher ausgeschlossen sein.
Beim Hirntod ist das EEG permanent isoelektrisch (Null-Linien-EEG), evozierte Potenziale sind nicht mehr auslösbar; angiographisch ist ein intrazerebraler Kreislaufstillstand nachweisbar (10.1007/978-3-662-50444-4_38).
Verlauf des Schädel-Hirn-Traumas
Der Verlauf des Schädel-Hirn-Traumas hängt wesentlich von der Schwere der Hirnschädigung ab.
Leichte bis mittelschwere Hirnverletzungen
Bei diesen Verletzungen wird gewöhnlich vor der Erholung ein Durchgangsstadium durchlaufen, das in folgender Weise gekennzeichnet ist:
schwankende Bewusstseinslage,
Desorientiertheit,
Überaktivität,
Aggressivität,
Delir.
In dieser Phase muss der Patient auf einer Intensivstation überwacht werden.
Das Durchgangsstadium dauert wenige Tage bis Wochen.
Schwere Hirnverletzungen
Hierbei ist der Verlauf in hohem Maße unterschiedlich. Gewöhnlich ist eine besonders intensive Betreuung erforderlich.
Apallisches Syndrom
Bei diesem Syndrom (Abschn. 61.1.1) ist der Hirnmantel (Pallidum) funktionell vom Hirnstamm entkoppelt. Nach Gerstenbrand entwickelt sich das Vollbild des apallischen Syndroms über drei Phasen:
prolongiertes Koma (Coma prolongé),
Phase der Parasomnie,
Phase des akinetischen Mutismus.
Prolongiertes Koma
Der Patient ist bewusstlos und reagiert nicht auf optische oder akustische Reize. Schmerzreize können Strecksynergismen auslösen. Die Extremitäten stehen in Beuge-Streck-Stellung, der Muskeltonus ist erhöht, die Augen stehen divergent. Es treten vermehrt orale Automatismen auf (Kauen, Schmatzen).
Phase der Parasomnie
Hierbei handelt es sich um einen schlafähnlichen Zustand ohne Reaktion auf optische oder akustische Signale. Schmerzreize lösen Massenbewegungen der oberen Extremitäten aus, während die Beine Streckbewegungen ausführen. Die oralen Automatismen sind stärker ausgebildet.
Phase des akinetischen Mutismus
Der Patient öffnet zeitweise die Augen, die horizontale Pendelbewegungen ausführen. Rumpf und Extremitäten sind gebeugt, Schmerzreize lösen Massenbewegungen der vier Extremitäten aus, hingegen tritt keine Reaktion auf optische und akustische Reize auf. Der Muskeltonus ist erhöht. Hinzu kommt eine Überaktivität des sympathischen Nervensystems, die mit Tachykardie, Blutdruckanstieg und Schwitzen einhergeht.
Remissionsstadium
Die Remission beginnt mit einer Bewusstseinsaufhellung; sie tritt meist nicht abrupt, sondern allmählich ein. Nach Zeichen der beginnenden Remission sollte gezielt gesucht werden:
Schmerzreize führen zu ersten gezielten Abwehrbewegungen,
energisches Ansprechen kann erste Reaktionen auslösen: Augenöffnen, Händedrücken, Zunge herausstrecken, Halten von Gegenständen usw.
In dieser Phase ist eine intensive Beschäftigung mit dem Patienten erforderlich, damit er nicht in das apallische Syndrom zurückfällt oder auf der Remissionsstufe stehen bleibt. Auch muss in dieser Phase eine besonders intensive physiotherapeutische Behandlung durchgeführt werden.
Im Vollbild der Remission treten differenzierte mimische Reaktionen, wie z. B. Lächeln oder Weinen auf; die Kooperationsbereitschaft und -fähigkeit nimmt zu. Die Therapie kann jetzt gezielter erfolgen:
Nahrungsaufnahme,
Körperpflege,
Sitzen und Gehen,
Sprechen,
Übung der Feinmotorik und Koordination,
Ausbau sozialer Kontakte,
Training von Konzentration, Merkfähigkeit und Ausdauer.
Die Physiotherapie muss intensiv fortgesetzt werden, um Paresen und Kontrakturen zu vermindern.
Rehabilitation
Das Hauptziel der Rehabilitation besteht darin, den Patienten wieder weitestgehend in sein soziales und berufliches Leben zu integrieren. Hierzu ist eine Betreuung durch speziell ausgebildetes Personal erforderlich. Die Nachbehandlung erfolgt daher am besten in Rehabilitationszentren für Schädel-Hirn-Verletzte.
Intensivbehandlung nach Kraniotomie
Nach einer Kraniotomie benötigen einige Patienten lediglich eine sorgfältige Überwachung von Atmung, Herz-Kreislauf- und neurologischen Funktionen, während bei anderen Patienten eine umfassende Intensivbehandlung erforderlich ist.
Überwachung nach Hirntumor operationen
Direkt nach der Aufnahme wird der Patient an das Beatmungsgerät, den Multifunktionsmonitor und die bereits liegenden Gefäßzugänge angeschlossen. Außerdem wird durch Auskultation die korrekte Tubuslage überprüft. Gleichzeitig erfolgt die Übergabe durch den Anästhesisten an den zuständigen Arzt und das Pflegepersonal der Intensivstation.
Standardüberwachung nach Kraniotomien
Vitalfunktionen: Atmung/Beatmung, Herz-Kreislauf-Funktion
- Neurologischer Status
- Bewusstseinslage (Glasgow-Koma-Skala)
- Pupillenweite und Lichtreaktion
- Paresen
- Hirnnervenausfälle
- Multifunktionsmonitor
- EKG
- Arterieller Blutdruck (invasiv gemessen)
- Zentraler Venendruck
- Pulsoxymetrie, Kapnometrie
- Körpertemperatur
- evtl. ICP
Arterielle Kanüle
Zentraler Venenkatheter
Blasenkatheter
Magensonde
Labor: Blutgase, Säure-Basen-Status, Serumelektrolyte, Blutzucker, Gerinnungsstatus
Thoraxröntgenaufnahme
Postoperative Nachblutung
Die Gefahr einer postoperativen Nachblutung wird durch Husten, Pressen, Verlegung der Atemwege und Kopftieflagerung erhöht. Diese Faktoren müssen daher in der Frühphase vermieden werden.
Supratentorielle Blutungen
Diese führen meist zu folgenden Zeichen:
Verschlechterung der Bewusstseinslage,
Halbseitenbefund, z. B. motorische Schwäche der Gegenseite; verzögerte Pupillenreaktion oder Pupillenerweiterung auf der betroffenen Seite.
Der Verdacht auf eine Nachblutung muss immer geäußert werden, wenn sich die Bewusstseinslage eines nach der Operation gut ansprechbaren Patienten wieder verschlechtert. Ein sofortiges CT ist indiziert; bei positivem Befund muss rekraniotomiert werden.
Infratentorielle Blutungen
Sie können nach Eingriffen in der hinteren Schädelgrube auftreten. Es entstehen die Zeichen der Hirnstammkompression bzw. -ischämie:
unregelmäßiges Atemmuster,
Hypertonus,
Herzrhythmusstörungen.
Auch hier ist die sofortige operative Ausräumung indiziert.
Hirnödem und Hirnschwellung
Ein Hirnödem bestimmten Ausmaßes tritt immer nach intrakraniellen Eingriffen auf und ist etwa nach 24–36 h maximal ausgeprägt; oft bestand auch bereits präoperativ ein fokales Ödem.
Tritt das Ödem auf, verschlechtert sich meist am 2. Tag die Bewusstseinslage. Bei einem Ödem in Nähe des Hirnstammes oder des 4. Ventrikels treten Atemstörungen auf, u. U. bis hin zum Atemstillstand; dieses Ödem ist jedoch nur vor kurzer Dauer. In der kritischen Phase sollte maschinell beatmet werden.
Ist die Autoregulation der Hirndurchblutung nach einem Eingriff gestört, besteht die Gefahr der postoperativen Hirnschwellung. Begünstigende Faktoren sind: Hypertonie, Hypoxie und Hyperkapnie.
Gefäßspasmus
Nach der Ruptur eines intrakraniellen Aneurysmas tritt häufig ein Gefäßspasmus im betroffenen Gebiet auf. Anhaltender Gefäßspasmus kann zum Hirninfarkt führen. Bei diesen Patienten müssen v. a. hypotensive Phasen vermieden werden, weil hierdurch die Hirndurchblutung weiter beeinträchtigt werden kann. Eine gezielte Behandlung des Vasospasmus ist gegenwärtig nicht möglich, jedoch werden meist Kalziumantagonisten eingesetzt (Abschn. 61.8.1).
Krämpfe
Krämpfe können nach Schädel-Hirn-Traumen, aber auch nach elektiven neurochirurgischen Eingriffen auftreten. Krämpfe steigern den zerebralen O2-Verbrauch erheblich und müssen daher umgehend unterbrochen werden.
Hypothermie und Hyperthermie
Eine Hypothermie entwickelt sich besonders nach lang dauernden operativen Eingriffen in kalten Operationssälen. Sie führt zu Vasokonstriktion, Muskelzittern und Hypertonie in der frühen postoperativen Phase und kann den O2-Verbrauch des Organismus erhöhen.
Eine Hyperthermie tritt nach Schädigung des Hirnstammes oder Zwischenhirns auf.
Nervenfunktionsstörungen
Lähmungen der Hirnnerven IX, X, XI und XII treten häufig nach der operativen Entfernung von Akustikusneurinomen oder anderen Brückenwinkeltumoren auf.
Nervenfunktionsstörungen werden auch nach Operationen in Nähe des IV. Ventrikels beobachtet. Oft ist eine endotracheale Intubation erforderlich, um eine Aspiration und Verlegung der Atemwege zu verhindern.
Für die Intensivbehandlung gelten die Grundsätze, die in Abschn. 61.4.4 dargelegt wurden.
Hirnabszess
Hirnabszesse sind umschriebene, abgekapselte Entzündungen des Gehirns. Sie können nach einem Schädel-Hirn-Trauma oder einer intrakraniellen Operation entstehen; häufigste Ursachen sind jedoch eitrige Entzündungen des Ohres (v. a. die chronische eitrige Otitis media). Daneben ist auch eine hämatogene Infektion durch einen streuenden Herd möglich. Häufige Erreger sind gramnegative Bakterien, bei subduralen Hämatomen meist Streptokokken, bei traumatischen Infektionen meist Staphylokokken; zahlreiche Abszesse sind zum Zeitpunkt der Drainage steril.
Wird der Abszess nicht rechtzeitig erkannt, entwickeln sich v. a. die Zeichen der intrakraniellen Drucksteigerung, vergleichbar der Symptomatik eines Hirntumors.
Die Behandlung besteht in der Drainage des Abszesses über Bohrlöcher, evtl. auch nach Entfernen eines größeren Knochendeckels. Bei erheblichem Hirndruck ist oft eine operative Dekompression (Kraniotomie) erforderlich.
Pädiatrische Neurointensivmedizin
Das Schädel-Hirn-Trauma und Hirntumoren sind die häufigsten Gründe für eine Neurointensivbehandlung von Kindern.
Überwachung neurologischer Funktionen
Grundsätzlich entspricht die neurologische Überwachung der Kinder denen der Erwachsenen (Abschn. 61.1, Abschn. 61.2, Abschn. 61.4.4); auch hier kann die Glasgow-Koma-Skala, ergänzt durch andere Verfahren, für die Verlaufsbeobachtung eingesetzt werden. Von besonderer Bedeutung ist auch in dieser Altersgruppe die Messung des intrakraniellen Drucks, die zwar keine Aussage über die neurologischen Funktionen selbst ermöglicht, jedoch für das Erkennen und die Behandlung von Hirndrucksteigerungen wichtige Anhaltspunkte liefert.
Erhöhter intrakranieller Druck
Die Ursachen für einen pathologischen Anstieg des intrakraniellen Drucks sind vielfältig und umfassen beim Kind folgende Faktoren:
Schädel-Hirn-Trauma mit Hirnödem und/oder intrakranieller Blutung,
Hirntumoren,
Infektionen des Gehirns,
Hirnödem nach zerebraler Hypoxie (z. B. nach Reanimation),
metabolische Entgleisungen,
Elektrolytstörungen, insbesondere Hyponatriämie.
Messung des intrakraniellen Drucks
Wie beim Erwachsenen, können auch beim Kind grundsätzlich drei verschiedene Verfahren der intrakraniellen Druckmessung eingesetzt werden:
über einen Katheter in den Hirnventrikeln,
über eine subarachnoidale Schraube oder
epidural.
Am häufigsten wird gegenwärtig die epidurale Druckmessung angewendet.
Die Normwerte entsprechen denen des Erwachsenen: 0–15 mmHg.
Bei der Behandlung des erhöhten intrakraniellen Drucks sollten Werte unter 20 mmHg angestrebt werden. Hierfür werden die gleichen Verfahren wie beim Erwachsenen eingesetzt. Es muss jedoch beachtet werden, dass die Kontrolle des intrakraniellen Drucks allein gewöhnlich nicht ausreicht, um zerebrale Schäden anderer Ursache günstig zu beeinflussen.
Schädel-Hirn-Trauma
Schädel-Hirn-Traumen gehören zu den häufigsten Ursachen für neurologische Funktionsstörungen im Kindesalter. Meist handelt es sich um stumpfe Traumen durch Auto-, Motorrad-, Fahrrad- oder Fußgängerunfälle. Beim geschlossenen Schädel-Hirn-Trauma entstehen die zerebralen Schäden durch Kontusion, intrakranielle Blutung sowie zerebrale Hyperämie oder Hirnödem mit massivem Anstieg des intrakraniellen Drucks.
Grundsätzlich entspricht die Behandlung der des Erwachsenen (Abschn. 61.4):
Sicherung und, wenn erforderlich, Unterstützung der Atem- und Herz-Kreislauf-Funktion,
Kontrolle des intrakraniellen Drucks,
operative Behandlung bei intrakraniellen Hämatomen und Impressionsfrakturen sowie externen Blutungen aus Skalpwunden, ggf. Ersatz von Blutverlusten.
Hirntumoren
Hirntumoren gehören, nach der Leukämie, zu den häufigsten malignen Erkrankungen im Kindesalter. Sie gehen meist mit erhöhtem intrakraniellen Druck einher und treten besonders im Alter zwischen 5 und 9 Jahren auf.
Klinisches Bild
Die Symptome entstehen v. a. durch den zunehmenden intrakraniellen Druck sowie die jeweilige Lokalisation des Tumors:
Erbrechen im Strahl, besonders nach dem Aufstehen und dem Frühstück,
Kopfschmerzen,
fokale neurologische Ausfälle, wie z. B. Sehstörungen, Nystagmus, Gangunsicherheit, Krämpfe.
Die häufigsten Tumoren sind:
Astrozytom des Kleinhirns
Ein langsam wachsender Tumor, der mit Anstieg des intrakraniellen Drucks, vermindertem Muskeltonus, abgeschwächten Reflexen, Nystagmus, Optikusatrophie und Erblindung einhergeht. Der Tumor kann im Ganzen entfernt werden.
Gliom des Hirnstamms
Ein Tumor, der zu Hirnnervenlähmung und Bewegungsstörungen führt und jeder Form von Behandlung nur wenig zugänglich ist.
Medulloblastom des Kleinhirns
Verläuft mehr akut, führt zu Kopfschmerzen, Erbrechen, Gewichtsabnahme und Gangstörungen. Da schwer zu entfernen: schlechte Prognose.
Ependymom
Wächst v. a. im 4., aber auch im 1. oder 2. Ventrikel. Geht einher mit Kopfschmerzen, Übelkeit und Erbrechen, Bewegungsstörungen. Eine vollständige chirurgische Entfernung ist gewöhnlich nicht möglich.
Kraniopharyngeom
Wächst neben der Hypophyse und führt zu zahlreichen Funktionsstörungen der Hypophyse und des Hypothalamus. Chirurgische Behandlung ist möglich, jedoch kann der Tumor nicht immer vollständig entfernt werden.
Postoperative Intensivbehandlung
Die Intensivbehandlung erfolgt nach den allgemeinen Grundsätzen, während die Intensivüberwachung sich, wie beim Erwachsenen, v. a. auf folgende Faktoren richtet:
Herz-Kreislauf- und Atemfunktion,
neurologischer Status,
Nachblutung,
Durchgängigkeit der Drainagen, Farbe, Menge und Geruch der drainierten Flüssigkeit,
postoperative Hirnschwellung,
Zeichen der Infektion,
Körpertemperatur,
Urinausscheidung: Diabetes insipidus nach Kraniopharyngeomoperation,
Blutzucker, Elektrolyte, Blutbild, Blutgase, Flüssigkeitsbilanz usw.
Traumatische Querschnittlähmung
Spinale Traumen sind die häufigste Ursache von Querschnittlähmungen. Hierbei können, je nach Höhe der Rückenmarkläsion, nur die unteren Extremitäten oder aber alle vier Extremitäten betroffen sein. Schädigungen oberhalb des 2.–4. Halswirbels sind wegen der Lähmung des Zwerchfells nicht mit dem Leben vereinbar.
Die meisten traumatischen Querschnittlähmungen treten in Verbindung mit Frakturen der Wirbelsäule auf (Abb. 61.6) und entstehen durch Kompression, Verdrehung oder Streckung mit Blutungen in der grauen Substanz und Ödem der weißen Substanz des Rückenmarks.

Schweregrade des spinalen Traumas
Folgende klinische Schweregrade des spinalen Traumas werden unterschieden:
Commotio spinalis: Funktionsstörung des Rückenmarks durch Trauma, die sich innerhalb von Stunden bis wenige Tagen wieder vollständig zurückbildet. Radiologisch lässt sich keine Schädigung nachweisen.
Contusio spinalis: Durch lokal umschriebene Schädigungen des Rückenmarks treten bleibende neurologische Defizite auf. Die Schäden können durch Kernspintomographie nachgewiesen werden.
Komplette Rückenmarkzerreißung: Sie führt zum kompletten und irreversiblen Querschnittsyndrom.
Compressio spinalis: Primäre Einengung des Spinalkanals durch Knochenfragmente oder Band- bzw. Bandscheibenmaterial oder sekundäre Kompression des Rückenmarks durch intraspinale Hämatome. Es können neurologische Defizite aller Schweregrade auftreten.
Pathophysiologie
Spinaler Schock
Unmittelbar nach der Verletzung mit funktioneller Unterbrechung des Rückenmarks tritt ein spinaler Schock ein, der in folgender Weise gekennzeichnet ist:
schlaffe Lähmung mit vollständigem Sensibilitätsausfall, Verlust der Temperaturregulation und Aufhebung der Reflexe unterhalb der Verletzungsstelle,
Blutdruckabfall durch Unterbrechung der Sympathikusfunktion mit anschließender Gefäßdilatation und Versacken des Blutes in der Peripherie; besonders ausgeprägt bei Lagewechsel, da Verlust orthostatischer Kreislaufreflexe,
häufig Herzrhythmusstörungen: Bradykardie, ventrikuläre Extrasystolen,
paralytischer Ileus.
In der Phase des spinalen Schocks ist der Patient besonders durch eine respiratorische Insuffizienz gefährdet.
Ursachen respiratorischer Störungen
Dies sind v. a. Hypoventilation durch Störungen der Atemmuskulatur, ungenügender Hustenmechanismus und Aspiration durch abgeschwächte oder fehlende Atemwegsreflexe.
Der spinale Schock hält etwa 1–3 Wochen an; nach mehreren Wochen kehren die spinalen Reflexe schrittweise zurück und es folgt der Übergang in das chronische Stadium. Die wichtigsten Störungen in der chronischen Phase sind:
Labilität des Herz-Kreislauf-Systems mit autonomer Hyperreflexie,
eingeschränkte Atemfunktion,
chronische Infektionen des Atem- und Urogenitaltrakts,
Anämie,
Beeinträchtigung der Temperaturregulation.
Atemfunktion
Verletzungen oberhalb von C2–C4 führen zu Zwerchfelllähmung und Apnoe. Bleibt hingegen die Zwerchfellfunktion ungestört, kann der Patient bei zervikaler Querschnittlähmung ein ausreichendes Atemminutenvolumen aufrechterhalten, der Hustenmechanismus ist jedoch gestört; oft findet sich in der Anfangsphase auch eine Hypoxie.
In der Phase des spinalen Schocks kann durch Absaugen des Nasen-Rachen-Raums oder der Lunge eine akute Reflexbradykardie bis hin zur Asystolie ausgelöst werden.
Autonome Hyperreflexie
Mit dem Verschwinden des spinalen Schocks und der Rückkehr spinaler Reflexe tritt eine autonome Hyperreflexie ein, die durch Bestreichen der Haut unterhalb der Verletzungsstelle ausgelöst werden kann, ebenso durch eine stark gefüllte Blase oder Dehnung des Rektums durch Kot oder durch operative Stimuli. Die Hyperreflexie entsteht durch afferente Impulse aus den unterhalb der Verletzungsstelle gelegenen peripheren und Eingeweidenerven zum isolierten Rückenmark, das nun nicht länger durch supraspinale (aus dem Gehirn kommende) Impulse gehemmt wird, sodass komplexe efferente Reaktionen auftreten:
Hypertonie und Bradykardie,
gesteigerte Reflexe, Rigidität und Spastik der Muskulatur.
Das Syndrom erreicht etwa vier Wochen nach der Verletzung seinen Höhepunkt und verschwindet danach allmählich, kann jedoch jederzeit (auch nach Jahren) zurückkehren. Zur Behandlung werden Ganglienblocker, Vasodilatatoren und Periduralanästhesie eingesetzt.
Erstversorgung
Zu den wichtigsten Maßnahmen am Unfallort gehören:
Einschätzung und Sicherung der Vitalfunktionen,
Erfragen der Vorgeschichte,
orientierende neurologische Untersuchung: Motorik, Sensibilität, Reflexe,
venöser Zugang,
Immobilisierung des Patienten, Kopf immer unter Zug halten,
anschließend Transport ins Krankenhaus.
Grundsätzlich sollte bei polytraumatisierten Patienten immer an eine Verletzung der Wirbelsäule bzw. des Rückenmarks gedacht werden.
In der Notaufnahme erfolgt die endgültige Diagnostik:
Sonographie des Abdomens,
Röntgen: Schädel, HWS, BWS und LWS in 2 Ebenen, Thorax, Becken,
CT: bei verdächtigen Befunden in der Röntgennativdiagnostik,
spinale Kernspintomographie: Darstellung der traumatischen Rückenmarkschädigung und intraspinaler Hämatome.
Gabe von Methylprednisolon
Die früher als günstige angesehene Routinezufuhr von Methylprednisolon unmittelbar nach traumatischer Rückenmarkschädigung wird in der Polytrauma-Leitlinie wegen des unzureichenden Effekts und der vermehrten Nebenwirkung nicht mehr generell empfohlen. Nur bei isolierter traumatischer Rückenmarksschädigung wird die Anwendung des Methylprednisolon-Behandlungsschema (NASCIS-III-Schema) diskutiert. Hier sollte eine Einzelfallentscheidung getroffen werden.
Intensivbehandlung
In der Initialphase der Querschnittlähmung ist wegen der lebensgefährlichen Komplikationsmöglichkeiten eine Intensivbehandlung erforderlich. Die Art der Komplikationen hängt v. a. von der Höhe der Querschnitt- und Begleitverletzungen ab.
Die Atemfunktion muss besonders sorgfältig überwacht werden, wenn die Verletzung im thorakalen Bereich gelegen ist. Querschnittlähmung bei Th6 führt zum Ausfall der Bauchmuskulatur und damit eines effektiven Hustenstoßes, noch höher gelegene Lähmungen vermindern die Vitalkapazität erheblich.
Bei hoher Querschnittlähmung kann in der Anfangsphase jederzeit eine tödliche Atemlähmung auftreten.
Um den beeinträchtigten oder gar aufgehobenen Hustenmechanismus zu kompensieren, sind entsprechende physiotherapeutische Maßnahmen erforderlich (10.1007/978-3-662-50444-4_51).
Lagerung
Die Lagerung des querschnittgelähmten Patienten erfolgt am besten im Drehbett mit regelmäßigem (2-stündlichem) Lagewechsel.
Praktisches Vorgehen
Rückenlage: Hüfte strecken und um 10° abduzieren, Knie ebenfalls strecken, Füße nach dorsal beugen.
Seitenlage: Hüfte und Knie leicht beugen, Schultern leicht abduzieren, Ellenbogen strecken, Hände in Funktionsstellung, sorgfältige Kontrolle auf Lagerungsschäden und Dekubitus.
Bei Spastik: Kontrakturprophylaxe durch passives Bewegungstraining: mehrmals am Tag für mehrere Minuten die Gelenke vorsichtig maximal bewegen.
Die eingeschränkte orthostatische Regulationsfähigkeit des Querschnittgelähmten bewirkt, dass Lagewechsel zu starkem Blutdruckabfall führen können.
Blasenfunktion
Im spinalen Schock tritt ein akuter Harnverhalt auf, später eine automatische oder autonome Blase.
Praktisches Vorgehen
Initial ist zumeist ein Dauerkatheter indiziert,
übermäßiger Füllungszustand der Blase muss vermieden werden: Gefahr von Blasenüberdehnung, Rückstau und Hyperreflexie,
frühzeitiger Beginn des Blasentrainings nach Entfernen des Katheters: Beklopfen und Ausdrücken der Blase, Suchen eines auslösenden Punktes für die Kontraktion der Harnblase,
regelmäßige bakteriologische Kontrolle des Harns.
Magen-Darm-Funktion
Die akute Querschnittlähmung geht mit einer vorübergehenden Magenatonie und paralytischem Ileus einher. Folgende Maßnahmen sind indiziert:
Legen einer Magensonde,
Flüssigkeits- und Nährstoffzufuhr in den ersten 48 h i.v.,
Zufuhr von Antazida und Histaminrezeptorantagonisten zur Ulkusprophylaxe,
Abführmittel, Darmrohr, Einläufe,
bei Beginn der Darmtätigkeit schrittweise mit der oralen Nahrungszufuhr beginnen.
Rehabilitation
Patienten mit traumatischer Querschnittlähmung sollten so früh wie möglich in eine Spezialklinik zur sozialen und beruflichen Rehabilitation verlegt werden. Einige Zentren können auch solche Patienten versorgen, die noch intensivmedizinisch betreut werden müssen.
Subarachnoidalblutung
Häufigste Ursache einer nichttraumatisch bedingten Subarachnoidalblutung SAB) ist die Ruptur eines Hirnarterienaneurysmas (Einzelheiten: 10.1007/978-3-662-50444-4_24). Die Blutung breitet sich in den sog. subarachnoidalen Räumen zwischen der Oberfläche des Gehirns und der Spinnwebhaut (Arachnoidea) aus und kann in schweren Fällen in das Ventrikelsystem oder in das Hirngewebe selbst einbrechen. Zu den wichtigsten diagnostischen Maßnahmen gehören:
zerebrale Computertomographie,
Lumbalpunktion (wenn bei Verdacht im CT keine Subarachnoidalblutung nachweisbar ist),
Angiographie der Hirngefäße, evtl. MR-Angiographie.
Wichtigste operative Maßnahme zur Verhinderung einer Rezidivblutung aus dem Aneurysma ist das mikrochirurgische Clipping. Postoperativ muss mit folgenden Komplikationen gerechnet werden:
zerebraler Vasospasmus,
Nachblutung,
Störungen des Wasser- und Elektrolythaushaltes,
Hydrozephalus,
Pneumonie, Lungenödem,
Störungen der Leber- und Nierenfunktion.
Postoperative Überwachung und Behandlung
Im Mittelpunkt steht die neurologische Überwachung, ergänzt durch das allgemeine intensivmedizinische Monitoring:
endotracheale Intubation und maschinelle Beatmung (bei Bewusstlosen),
Arterienkanüle,
zentraler Venenkatheter,
Magensonde,
Blasenkatheter,
Temperatursonde,
Hirndruckmessung bei erhöhtem ICP,
evtl. transkranielle Dopplersonographie, Messung der Hirndurchblutung,
evtl. Bulbuskatheter für die Oxymetrie,
Ventrikelkatheter bei Hydrozephalus,
Labor: Blutgase, pH-Wert, Elektrolyte, Blutbild und -gerinnung.
Zerebraler Vasospasmus
Bei etwa einem Drittel der Patienten tritt ca. 2–3 Tage nach der Blutung ein klinisch bedeutsamer zerebraler Vasospasmus auf, d. h. eine Engstellung der Hirngefäße mit Zunahme des Gefäßwiderstands.
Hauptgefahr des Vasospasmus ist die Mangeldurchblutung des Gehirns mit einer Verschlechterung neurologischer Funktionen.
Bei der Überwachung muss auf folgende neurologische Zeichen des Vasospasmus geachtet werden:
Änderung der Bewusstseinslage,
Störungen der Orientierung,
diskrete Aphasie.
Behandlung
Die sog. Triple-H-Therapie wird nicht mehr empfohlen.
Zur Prophylaxe des Vasospasmus wird der Kalziumantagonist Nimodipin (Nimotop) eingesetzt. Wesentlich ist weiterhin ein ausreichend erhöhter arterieller Blutdruck (systolisch 160–200 mmHg) in der postoperativen Phase.
Schlaganfall ( Apoplex, Stroke)
Ein Schlaganfall oder zerebraler Gefäßinsult liegt vor, wenn akut oder subakut neurologische Symptome auftreten, die durch eine umschriebene arterielle Durchblutungsstörung des Gehirns hervorgerufen werden. Bei weitem die häufigste Ursache des Apoplex ist eine Mangeldurchblutung (Ischämie) von Hirnregionen. Ein kleiner Anteil wird durch eine Massenblutung (Rhexisblutung) hervorgerufen. Zerebrale Insulte gehören nach den Herzerkrankungen und Tumorleiden zu den häufigsten Todesursachen. Die Letalität beträgt in den ersten vier Wochen nach dem Insult 10–30%, danach pro Jahr ca. 9%. Ein Drittel der Patienten bleibt dauerhaft behindert und auf Pflege angewiesen, ein Drittel kann vollständig beruflich und sozial rehabilitiert werden.
Ursachen und Risikofaktoren
Akute zerebrale Ischämien werden durch folgende Erkrankungen ausgelöst:
Thrombose bei Arteriosklerose hirnversorgender Arterien oder hypertonischer Arteriolosklerose (Hirnarteriolen),
Embolien: kardiogen oder arteriell,
Gefäßerkrankungen (Vaskulopathien),
kombinierte Ursachen,
unbekannte Ursachen.
Häufigste Ursache eines Schlaganfalls ist die zerebrale Mangeldurchblutung durch thrombotischen oder embolischen Verschluss von Hirngefäßen.
Zu den wichtigsten Risikofaktoren zerebraler ischämischer Insulte gehören:
arterielle Hypertonie (4- bis 8-fach höheres Risiko als bei normalem Blutdruck),
Herzkrankheiten, v. a. Arrhythmien, Vorhofthromben, Klappenfehler,
Hypercholesterinämie,
Diabetes mellitus,
Übergewicht,
Nikotinabusus,
Ovulationshemmer, besonders in Kombination mit starkem Rauchen,
Hyperurikämie.
Klinisches Bild
Da eine große Anzahl unterschiedlicher Hirnareale von der Mangeldurchblutung betroffen sein kann, gibt es eine Vielfalt klinischer Manifestationen bzw. neurologischer Störungen. Folgende Regeln sind für die Lokalisation hilfreich:
Infarkt im Gebiet der A. carotis: akute neuropsychologische Ausfälle mit homonymen Gesichtsfeldausfällen und sensomotorischem Hemisyndrom.
Partieller Infarkt: nur ein Körperteil, z. B. Arm oder Bein, ist betroffen oder es treten isolierte neuropsychologische Ausfälle auf.
Infarkt im vertebrobasiliären Gefäßgebiet: ipsilaterale Hirnnervenausfälle mit kontra- oder beidseitigen sensomotorischen Ausfällen, Augenbewegungsstörungen und Kleinhirnzeichen.
Lakunärinfarkt: isolierte sensible, motorische oder sensomotorische Ausfälle.
Diagnostik
Für die differenzierte Diagnostik eines Schlaganfalls und seiner auslösenden Ursachen reicht das klinische Bild nicht aus, vielmehr sind apparative Verfahren unverzichtbar. Hierzu gehört v. a. die bildgebende Diagnostik:
Computertomographie
Das CT gehört zu den obligaten, sofort durchzuführenden Untersuchungsverfahren. In der Akutphase kann hiermit eine intrazerebrale Blutung ausgeschlossen und zwischen Mikroangiopathie und embolischem Infarkt differenziert werden. Bereits wenige Stunden nach Beginn der Symptome ermöglicht das CT Aussagen über die Prognose.
Magnetresonanztomographie (MRT)
Durch spezielle Verfahren der MRT können bereits weniger als 2 h nach Beginn der Symptomatik ischämische Veränderungen des betroffenen Hirngewebes nachgewiesen werden.
PET und SPECT
Hiermit können Veränderungen physiologischer Parameter (Gewebedurchblutung und -stoffwechsel) erfasst und quantifiziert werden.
Duplexsonographie
Hiermit kann der Grad von Gefäßstenosen bestimmt und außerdem eine Dissektion von Gefäßen nachgewiesen werden.
Transkranielle Dopplersonographie (TCD)
Ermöglicht Aussagen über Geschwindigkeit des Blutflusses, Flussrichtung und Flusscharakteristik in den intrakraniellen Hirnbasisarterien, weiterhin über das Vorliegen von Gefäßstenosen oder -verschlüssen und Kollateralgefäßen. Außerdem können mit TCD sog. HITS als Hinweis für eine Embolie nachgewiesen werden.
Akutversorgung
Der Schlaganfall ist, wie der Herzinfarkt oder die Lungenembolie, ein medizinischer Notfall. Daher sollten die Patienten in einer Klinik mit einer sog. Schlaganfallstation (engl.: „stroke unit“) behandelt werden, auch wenn dafür längere Anfahrtswege in Kauf genommen werden müssen. Allerdings darf für die Anfahrt die 3-Stundenfrist für eine Thrombolyse nicht überschritten werden.
Präklinische Versorgung
In dieser Phase muss der Notarzt zunächst die Symptome des Schlaganfalls erkennen und dann den umgehenden Transport des Patienten in ein Krankenhaus mit Stroke Unit veranlassen. Hierbei sind folgende Maßnahmen durchzuführen:
Sicherung der Vitalfunktionen,
Venenkanüle,
Bestimmung des Blutzuckers mit Stix,
keine forcierte Blutdrucksenkung,
keine Gabe von Heparin oder ASS,
wenn möglich: Informationen über den Beginn der Symptomatik, Vorerkrankungen und aktuelle Medikamenteneinnahme einholen.
Erstversorgung in der Notaufnahme
Zur Erstversorgung in der Notaufnahme gehören die Stabilisierung und Sicherung der Vitalfunktion, die körperliche Untersuchung und die apparative Notfalldiagnostik. Nach Einschätzung des Schweregrades und Klärung der Ursache werden die einzuschlagende Therapie und der Ort der Behandlung (Intensivstation, Stroke Unit oder Allgemeinstation) festgelegt.
Basisversorgung von Schlaganfallpatienten in der Notaufnahme
Sicherung der Vitalfunktionen
Periphervenöser Zugang (wenn noch nicht vorhanden) und Infusion von Elektrolytlösungen zum Ausgleich von häufig bestehenden Flüssigkeitsdefiziten
Anschluss an Multifunktionsmonitor
Zufuhr von O2
Bei Bewusstlosen: endotracheale Intubation, bei respiratorischer Insuffizienz maschinelle Beatmung
Kontrolle des arteriellen Blutdrucks
Harnblasenkatheter (häufig Störungen der Blasenentleerung)
Labor: großes Blutbild, Gerinnungsstatus (evtl. auch AT III und Fibrinogenspaltprodukte), Serumelektrolyte, Blutzucker, Herzenzyme, Leberenzyme, Kreatinin, Harnstoff
Thoraxröntgenaufnahme
12-Kanal-EKG
Zerebrale Computertomographie zur Unterscheidung zwischen Ischämie (Mangeldurchblutung) und intrakranieller Blutung
Verlegung des Patienten zur Weiterbehandlung
Patienten mit akutem Schlaganfall sollen nach den Empfehlungen der Deutschen Gesellschaft für Neurologie auf einer speziellen Stroke Unit oder – wenn erforderlich – neurologischen Intensivstation behandelt werden. Nur in Ausnahmefälle ist eine Behandlung auf einer Allgemeinstation vertretbar.
Verlegungskriterien
- Stroke Unit oder Überwachungsstation („intermediate care station“)
- Akuter Schlaganfall (<24 h)
- Patient wach oder somnolent
- Wechselnde oder zunehmende neurologische Symptome
- Crescendo-transitorische ischämische Attacken (TIA)
- Instabile Herz-Kreislauf- und/oder Atemfunktion
- Frühe Antikoagulation
- Thrombolyse
- Neurologische Intensivstation
- Höhergradige Bewusstseinsstörungen: Sopor oder Koma
- Notwendigkeit der maschinellen Beatmung
- Zeichen des erhöhten intrakraniellen Drucks
- Internistische Komplikationen
Intensivüberwachung und Intensivbehandlung
Zu den wesentlichen Behandlungsmaßnahmen bei Patienten mit akutem Schlaganfall gehören:
symptomatische Akuttherapie,
rekanalisierende Therapie,
Prophylaxe von Komplikationen,
Behandlung von Komplikationen.
Symptomatische Akuttherapie (allgemeine Behandlung)
Nach Abschluss der Akutversorgung in der Notaufnahme wird die Akuttherapie auf der Intensivstation oder Stroke Unit fortgesetzt. Von grundlegender Bedeutung ist, neben der neurologischen Therapie, die Behandlung von Begleiterkrankungen, die sog. allgemeine Behandlung.
Respiratorische Therapie
Allgemein wird die Zufuhr von Sauerstoff (2–4 l/min) empfohlen, um eine ausreichende Oxygenierung des arteriellen Blutes zu gewährleisten. Bewusstlose werden intubiert, respiratorisch insuffiziente Patienten intubiert und maschinell beatmet.
Kardiale Therapie
Herzrhythmusstörungen und Zeichen eines akuten Herzinfarktessind beim Schlaganfallpatienten häufiger vorhanden. Grundsätzlich sollte die Auswurfleistung des Herzens optimiert werden, um eine ausreichende Blutversorgung des Gehirns zu gewährleisten. Wenn erforderlich müssen hierfür kardiovaskuläre Medikamente eingesetzt werden. Die Behandlung von Herzrhythmusstörungen sollte in Zusammenarbeit mit einem Kardiologen erfolgen.
Häufig besteht bei Schlaganfallpatienten eine Hypovolämie, die durch Zufuhr von Elektrolytlösungen ausgeglichen wird.
Arterieller Blutdruck
Ein Blutdruckabfall muss vermieden werden, da die Autoregulation im Infarktgebiet aufgehoben sein kann und dann direkt von der Höhe des arteriellen Blutdrucks abhängig ist.
Bei sonst normotensiven Patienten wird ein leicht erhöhter Blutdruck von 160–190 mmHg systolisch und 90–100 mmHg diastolisch angestrebt, bei Hypertonikern von 180 mmHg systolisch und 100–105 mmHg diastolisch.
Nach etwa drei Tagen kann eine medikamentöse Senkung des erhöhten Blutdrucks eingeleitet werden, sofern kein intrakranieller Druckanstieg durch den Schlaganfall zu erwarten ist. Blutdruckentgleisungen müssen jedoch umgehend behandelt werden, v. a. bei Herzinsuffizienz, Herzinfarkt, akutem Nierenversagen oder akuter hypertensiver Enzephalopathie. Gebräuchliche Antihypertensiva sind:
Kalziumantagonisten,
ACE-Hemmer,
β-Blocker,
Urapidil,
Clonidin.
Blutzucker
Der Diabetes mellitus gehört zu den Risikofaktoren des Schlaganfalls. Aber auch bei Nichtdiabetikern findet sich in der Akutphase häufig eine diabetische Stoffwechsellage. Da ein erhöhter Blutzucker möglicherweise die Prognose von Schlaganfallpatienten verschlechtert, sollten Blutzuckerwerte von mehr als 200 mg/dl mit Altinsulin behandelt werden.
Körpertemperatur
Eine erhöhte Körpertemperatur soll beim Schlaganfallpatienten die zerebrale Schädigung verstärken. Daher sollte eine Körpertemperatur von mehr als 37,5°C medikamentös gesenkt werden.
Flüssigkeits- und Elektrolythaushalt
Hypokaliämien kommen bei Schlaganfallpatienten vor, schwere Elektrolytentgleisungen sind jedoch selten. Grundsätzlich sollte der Flüssigkeits- und Elektrolythaushalt ausgeglichen sein.
Thrombolytische Therapie (Rekanalisierung)
Durch eine intravenöse thrombolytische Therapie innerhalb von 4,5 h nach Symptombeginn kann die Prognose des Patienten verbessert werden. Für eine Untergruppe von Schlaganfallpatienten kann diese Therapie auch bis zu 6 h nach Beginn der Symptome nützlich sein. Die Deutsche Gesellschaft für Neurologie empfiehlt:
Praktisches Vorgehen
Die i.v.-Lysetherapie erfolgt beim Schlaganfallpatienten innerhalb eines 4,5-Stunden-Fensters mit rtPA (Plasminogenaktivator) durch einen mit dieser Therapieform erfahrenen neurologischen Intensivmediziner.
Die Dosierung von rtPA beträgt 0,9 mg/kgKG bzw. max. 90 mg. 10% der Gesamtdosis werden i.v. als Bolus injiziert, der Rest über 90 min infundiert.
Eine Lysetherapie sollte nicht durchgeführt werden, wenn der Symptombeginn länger als 4,5 h zurückliegt; hierzu gehören auch Schlaganfälle, die beim Aufwachen des Patienten festgestellt werden.
Für die Behandlung proximaler intrakranieller Arterien wird die intraarterielle Zufuhr von rtPA empfohlen.
Akute Verschlüsse der A. basilaris sollten in auf diese Methode spezialisierten Zentren mit intraarterieller Zufuhr von Urokinase oder rtPA behandelt werden.
Kontraindikationen
Zu den wesentlichen Kontraindikationen für eine systemische Lysetherapie gehören:
Nachweis einer intrakraniellen Blutung im CT,
schwerstes neurologisches Defizit, z. B. mit Bewusstlosigkeit oder Hemiparalyse,
rasche Rückbildung neurologischer Symptome,
geringes neurologisches Defizit,
Krampfanfälle mit Symptombeginn,
systolischer Blutdruck trotz Behandlung >185 mmHg systolisch oder >110 mmHg diastolisch,
Vorbehandlung mit Antikoagulanzien (Wirksamkeitsnachweis mit Quick- oder PTT-Wert),
Thrombozytopenie <100.000/μl,
gastrointestinale oder urologische Blutung weniger als 21 Tage vor dem Schlaganfall,
großer operativer Eingriff weniger als 7 Tage vor dem Schlaganfall,
kürzlich abgelaufener Myokardinfarkt.
Frühe Sekundärprophylaxe mit Heparin oder ASS
Die Zufuhr von Heparin in einer Dosis, die zu einer Verlängerung der PTT führt, vermindert nicht die die Sterblichkeit oder der Häufigkeit eines erneuten Schlaganfalls.
Demgegenüber soll die Gabe von ASS in der Frühphase (<48 h nach Schlaganfall) zu einer leichten Abnahme der Letalität und der Häufigkeit eines Reschlaganfalls führen. Die Deutsche Gesellschaft für Neurologie stellt hierzu Folgendes fest:
In der Frühphase nach Schlaganfall sollten 100 mg ASS/Tag zugeführt werden.
Andere Thrombozytenaggregationshemmer sollten nicht generell für die Sekundärprophylaxe eines Schlaganfalls eingesetzt werden.
Die Heparinisierung in PTT-wirksamer Dosierung oder die Zufuhr niedermolekularer Heparine ist nicht wirksam.
Eine Vollheparinisierung kann bei bestimmten Patienten (Emboliequelle mit erhöhtem Rezidivrisiko) erwogen werden.
Die Hämodilutionsbehandlung und die „Neuroprotektion“ nach Schlaganfällen werden derzeit nicht empfohlen.
Prophylaxe und Behandlung von Komplikationen
In der ersten Woche nach dem Schlaganfall sind zerebrale Komplikationen (progrediente Verschlechterung, intrakranieller Druckanstieg) die häufigste Todesursache, später spielen andere Erkrankungen eine herausragende Rolle. Zu den wichtigsten Komplikationen gehören:
Aspirationspneumonie,
Harnwegsinfekte,
Lungenembolie,
Dekubitus,
epileptische Anfälle.
Lagerung und Frühmobilisation
Durch Lagerungsmaßnahmen und Frühmobilisation können zahlreiche Komplikationen verhindert oder in ihrer Häufigkeit vermindert werden. Dies gilt besonders für Dekubiti (10.1007/978-3-662-50444-4_42), tiefe Beinvenenthrombosen und Aspirationspneumonien. Einfache Hochlagerung des Oberkörpers vermindert die Aspirationgefahr und die Verlegung der oberen Atemwege, verbessert die Ventilation und senkt den intrakraniellen Druck.
Aspirationspneumonie
Die Aspirationspneumonie gehört zu den häufigsten Komplikationen in der Frühphase nach Schlaganfall. Die Letalität wird mit 15–20% angegeben. Betroffen sind v. a. bewusstseinsgetrübte Patienten mit fehlenden Schutzreflexen oder mit Schluckstörungen sowie bereits vorbestehenden Atemwegsinfekten. Therapie der Aspirationspneumonie: 10.1007/978-3-662-50444-4_54.
Harnwegsinfekte
Harnwegsinfekte treten bei Schlaganfallpatienten sehr häufig auf, oft hervorgerufen durch die transurethrale Harnblasenkatheterisierung. Daher sollte die Indikation für die suprapubische Katheterisierung großzügig gestellt werden. Bei manifestem Harnwegsinfekt sind Antibiotika indiziert.
Lungenembolie
Bis zu 5% der Schlaganfallpatienten sterben an den Folgen einer Lungenembolie. Durch frühzeitige Mobilisierung und subkutane Heparinzufuhr kann das Risiko vermindert werden. Bettlägerige Patienten oder Patienten mit Beinparesen sollten prophylaktisch niedermolekulares Heparin erhalten. Zu beachten ist aber das Risiko von Blutungskomplikationen.
Für die Prophylaxe tiefer Beinvenenthrombosen wird die tägliche Inspektion der unteren Extremitäten, ergänzt durch tägliche Krankengymnastik und Tragen von Kompressionsstrümpfen empfohlen.
Epileptische Krampfanfälle
Epileptische Anfälle (partielle oder generalisierte) treten in der Frühphase des Schlaganfalls bei 2–7% der Patienten auf; ein Status epilepticus ist dagegen selten. Für die Behandlung können folgende Medikamente eingesetzt werden:
Lorazepam, 1–2 mg i.v. oder
Clonazepam, 2 mg i.v.,
gefolgt von Phenytoin oder Carbamazepin.
Die Dauer der antiepileptischen Behandlung richtet sich nach dem Verlauf. Treten keine weiteren Krämpfe auf, kann die Zufuhr nach 3–6 Monaten ausschleichend beendet werden.
Treten beim Schlaganfallpatienten keine Krämpfe auf, ist eine Krampfprophylaxe mit Antikonvulsiva nicht indiziert.
Anstieg des intrakraniellen Drucks
In den ersten Stunden nach Beginn der Ischämie bzw. der Symptome entwickelt sich ein postischämisches Hirnödem, das nach 2–3 Tagen maximal ausgeprägt ist und den weiteren Verlauf ungünstig beeinflussen kann. Bei 10% aller Patienten mit Hirninfarkt handelt es sich um ein sog. malignes Hirnödem, das zur transtentoriellen Einklemmung führen kann. Massive Hirnschwellungen treten v. a. bei Patienten mit kompletten Mediainfarkten auf und sind mit einer sehr hohen Letalität (bis zu 80%) durch Einklemmung belastet. Entsprechende Verhaltensregeln sind:
Bei Patienten mit klinischen Symptomen oder radiologischen Zeichen des erhöhten intrakraniellen Drucks ist die Zufuhr von Osmotherapeutika wie Mannitol indiziert.
Bleiben die konservativen Maßnahmen ohne Wirkung (was häufig der Fall ist), kann bei raumfordernden supratentoriellen Infarkten durch eine dekompressive Kraniotomie die Letalität gesenkt und die Prognose verbessert werden.
Bei raumfordernden Kleinhirninfarkten gilt die Wirksamkeit der operativen Dekompression als gesichert.
Durch mäßige Hypothermie soll die Letalität nach ausgedehnten Hemisphäreninfarkten gesenkt werden. Das Verfahren ist aber spezialisierten Zentren vorbehalten.
Spontane intrazerebrale Blutungen (ICB )
Etwa 5–15% aller Schlaganfälle beruhen auf spontanen intrazerebralen Blutungen. Hierbei handelt es sich um Einblutungen in das Hirngewebe ohne vorangegangenes Trauma. Die Prognose ist schlecht: 20–56% der Patienten sterben in den ersten vier Wochen an den Folgen der Blutung, nur 15–20% bleiben ohne wesentliche Behinderung.
Grundsätzlich wird zwischen einer primären (hypertensiven) intrazerebralen und einer sekundären intrazerebralen Blutung im Rahmen anderer Erkrankungen unterschieden. Nach Lokalisation und Größe werden die Blutungen in folgender Weise eingeteilt:
Großhirnblutungen: parietal, temporal, frontal, okzipital,
Stammganglienblutungen,
Hirnstammblutungen: Pons, Mesenzephalon, Medulla oblongata,
Kleinhirnblutungen.
Bei supratentoriellen Blutungen gelten 50 ml als kritisch für den weiteren Verlauf, bei infratentoriellen hingegen 20 ml.
Risikofaktoren
Zu den Risikofaktoren der spontanen intrazerebralen Blutung gehören:
Hypertonie,
Nikotinabusus,
Alkoholabhängigkeit,
Drogenkonsum, v. a. Amphetamin, Kokain und Crack,
niedriges Serumcholesterin.
Klinisches Bild
Die ICB tritt meist abrupt auf und führt in den ersten Stunden zu progredienten neurologischen Ausfällen. Das klinische Bild hängt von der Größe und der Lokalisation der Blutung ab. Kleinere Blutungen unterscheiden sich kaum von ischämischen Hirninfarkten, größere Blutungen führen meist schlagartig zu neurologischen Defiziten; hierzu gehören:
lokale Ausfälle, die typisch für die jeweilige Blutungsstelle und -größe sind,
Zeichen des erhöhten intrakraniellen Drucks,
Bewusstseinsstörungen bis hin zum Koma.
Therapie
Die Erstversorgung von Patienten mit ICB entspricht im Wesentlichen der von Patienten mit ischämischem Schlaganfall. Die weitere Behandlung erfolgt zumeist auf einer Intensivstation und umfasst allgemeine, operative und intensivmedizinische Maßnahmen.
Intensivbehandlung der ICB
Sicherung und Aufrechterhaltung der Vitalfunktionen
Bei Bewusstseinstrübung Intubation, bei respiratorischer Insuffizienz außerdem maschinelle Beatmung
Blutdrucksenkung nach Sicherung der Diagnose
Behandlung von Bradykardien
Einstellung des Blutzuckers
Einstellung der Körpertemperatur (Vermeidung von Hyperthermien)
Behandlung von epileptischen Anfällen
Thromboseprophylaxe
Messung des ICP und Behandlung von Hirndruckanstiegen
Behandlung des Hydrozephalus
Operative Behandlung
Es besteht derzeit keine Einigkeit, wann und mit welcher Technik die ICB operativ behandelt werden soll. Patienten mit kleinen Hämatomen (<10 ml) werden meist nicht operiert, weil die Prognose gut ist. Bereits bei der Aufnahme komatöse Patienten werden ebenfalls meist nicht operiert, ebenso Patienten mit einer linksseitigen Hirnblutung.
Bei Kleinhirnblutung mit Hirnstammkompression wird zumeist eine Operation durchgeführt. Solitäre Hirnstamm- und Thalamusblutungen werden nicht operiert.
Bei Einbruch der Blutung in die Ventrikel und bei Behinderung des Liquorabflusses wird eine Ventrikeldrainage eingelegt.
Parkinson-Krisen
Bei diesen Erkrankungen können Komplikationen auftreten, die eine vorübergehende Intensivbehandlung erfordern:
akinetische Krise,
L-Dopa-Entzugssyndrom,
dopaminerge Psychose,
hyperkinetische Krisen.
Akinetische Krise
Die akinetische Krise entwickelt sich über wenige Tage oder Wochen und ist durch zunehmende Bewegungsunfähigkeit gekennzeichnet. Die Sprache ist oft unverständlich, die Extremitäten sind steif und häufig in Beugung fixiert. Aufgrund erheblicher Schluckstörungen kommt es zu verminderter Nahrungs- und Flüssigkeitsaufnahme mit schwerer Dehydratation. Weitere Komplikationen sind: Pneumonien, Harnwegsinfekte, tiefe Beinvenenthrombosen, Dekubiti.
Ursachen
Zu den wichtigsten Ursachen der akinetischen Krise des Parkinson-Kranken gehören:
Unterdosierung dopaminerger Medikamente,
Medikamentenentzug,
gastrointestinale Absorptionsstörungen mit ungenügender Aufnahme der Medikamente.
Therapie
Zu den wesentlichen Behandlungsmaßnahmen gehören:
Ausgleich der Flüssigkeits- und Elektrolytdefizite durch i.v.-Zufuhr,
Thromboseprophylaxe,
Behandlung von Infekten.
Dosierung der Antiparkinsontherapie
L-Dopa oral, z. B. 4×100 mg/Tag, wenn erforderlich Steigerung um 100–300 mg/Tag oder lösliches L-Dopa über Magensonde
Dopaminagonisten oral, z. B. Bromocriptin 4-mal 5–10 mg/Tag, Lisurid 4-mal 0,2–0,4 mg/Tag
Amantadin per Infusion, z. B. 1–3 bis max. 6 × 200 mg/Tag
Apomorphin s.c. 2–5 mg als Bolus oder 1–2 mg/h als s.c.-Infusion
L-Dopa-Infusion: 1–2 mg/kgKG/h bei schweren Formen
L-Dopa-Entzugssyndrom
Dieses seltene Syndrom entsteht bei abruptem Absetzen oder zu rascher Dosisreduktion von L-Dopa, außerdem bei gastrointestinalen Absorptionsstörungen. Das klinische Bild ähnelt der akinetischen Krise oder einem malignen neuroleptischen Syndrom. Außerdem finden sich folgende Zeichen:
Tachykardie,
Hypertonie,
Tachypnoe,
Anstieg der Körpertemperatur,
Verwirrtheit, Halluzinationen oder Somnolenz.
Bei akuter Verschlechterung der Beweglichkeit mit Fieber und Tachykardie ist eine Intensivbehandlung indiziert. Medikamente sind: Apomorphin s.c., L-Dopa, Amantadin und Bromcriptin.
Dopaminerge Psychose
10–20% der Parkinson-Kranken entwickeln während ihrer Behandlung dopaminerge Psychosen, gekennzeichnet durch Verwirrtheit, Halluzinationen und paranoide Wahnvorstellungen. Die Symptome hängen von der L-Dopa- oder Dopaminagonistendosis ab. Begünstigend wirken eine vaskuläre Enzephalopathie oder Demenzsyndrome.
Zu den wichtigsten Behandlungsmaßnahmen gehören:
ausreichende Rehydrierung des Patienten,
Thromboseprophylaxe,
Behandlung von Infekten,
Reduktion der Antiparkinsonmedikamente (um mindestens 50%) oder Absetzen,
Neuroleptika bei Bedarf, z. B. Clozapin oder bei Clozapinresistenz Serotoninantagonisten, z. B. Ondansetron (Zofran).
Hyperkinetische Krisen
Es handelt sich um die Komplikation einer meist langjährigen hoch dosierten L-Dopa-Therapie. Die Krise ist gekennzeichnet durch bizarre Haltungen des Rumpfes und der Extremitäten, evtl. begleitet von Tachykardie, Schwitzen und Atemstörungen. Die Behandlung sollte zunächst auf einer Intensivstation erfolgen. Wichtigste Maßnahme ist die vorsichtige Reduktion von L-Dopa.
Contributor Information
Collaborators: Tobias Fink and Tilmann Müller-Wolff
Nachschlagen und Weiterlesen
- [1].Gemerek A. Wachkoma. Medizinische, rechtliche und ethische Aspekte. Köln: Deutscher Ärzte; 2009. [Google Scholar]
- [2].Gold K, Schlegel Y, Stein KP. Pflege konkret Neurologie Psychiatrie. München: Elsevier; 2014. [Google Scholar]
- [3].Prange H, Bitsch A. Neurologische Intensivmedizin. Praxisleitfaden für neurologische Intensivstationen und Stroke Units. Stuttgart: Thieme; 2004. [Google Scholar]
- [4].Schwab S, Schellinger P, Werner C, Unterberg A, Hacke W. NeuroIntensiv. 3. Heidelberg Berlin: Springer; 2015. [Google Scholar]
- [5].Sitzer M, Stuckrad-Barre S, Schmutzhard E. Neurologische Notfall- und Intensivmedizin. München: Elsevier; 2004. [Google Scholar]
Internet
- [6].Deutsche Gesellschaft für Neurochirurgie (2015) Leitlinie Schädel-Hirn-Trauma im Erwachsenenalter. Update 2015 www.awmf.org/leitlinien
- [7].DGN und Deutsche Schlaganfall-Gesellschaft (DGS) (2012). Leitlinie: Akuttherapie des ischämischen Schlaganfalls. www.dgn.org