Abstract
Die Größe ist zwar der auffälligste, aber nicht der einzige wichtige Unterschied zwischen Kindern und Erwachsenen. Vielmehr bestehen bei Kindern – neben den anatomischen – auch physiologische, biochemische und nicht zuletzt psychologische Besonderheiten, die für Operationen und Narkosen von erheblicher Bedeutung sind. Hierbei gilt: Je kleiner das Kind, desto ausgeprägter die Unterschiede und desto schwieriger und risikoreicher das anästhesiologische Vorgehen. Besonders bei Kindern unter 1 Lebensjahr ist das Komplikationsrisiko hoch, v. a. weil Pflegepersonal und Ärzte zu wenig praktische Erfahrung mit dieser Altersgruppe haben. Denn nur 1% aller Narkosen wird bei Säuglingen durchgeführt. Gute theoretische Kenntnisse und umfassende Weiterbildung in der pädiatrischen Anästhesie sind aber für beide Berufsgruppen die Grundlage einer sicheren Narkosepraxis. Hierfür ist ein spezielles Training von Pflegepersonal und Anästhesisten erforderlich.
Die Größe ist zwar der auffälligste, aber nicht der einzige wichtige Unterschied zwischen Kindern und Erwachsenen. Vielmehr bestehen bei Kindern – neben den anatomischen – auch physiologische, biochemische und nicht zuletzt psychologische Besonderheiten, die für Operationen und Narkosen von erheblicher Bedeutung sind. Hierbei gilt: Je kleiner das Kind, desto ausgeprägter die Unterschiede und desto schwieriger und risikoreicher das anästhesiologische Vorgehen. Besonders bei Kindern unter 1 Lebensjahr ist das Komplikationsrisiko hoch, v. a. weil Pflegepersonal und Ärzte zu wenig praktische Erfahrung mit dieser Altersgruppe haben. Denn nur 1% aller Narkosen wird bei Säuglingen durchgeführt. Gute theoretische Kenntnisse und umfassende Weiterbildung in der pädiatrischen Anästhesie sind aber für beide Berufsgruppen die Grundlage einer sicheren Narkosepraxis. Hierfür ist ein spezielles Training von Pflegepersonal und Anästhesisten erforderlich.
Physiologische Grundlagen
Atmungssystem
Zwischen den Atemwegen von Kindern und Erwachsenen bestehen große Unterschiede, die v. a. für die Narkose wichtig sind. Neugeborene sind hiervon in besonderer Weise betroffen:
Nasenwege, Stimmritze, Ringknorpel und Trachea sind eng und können besonders leicht durch Schwellung verlegt werden, sodass die Atmung behindert wird.
Die Zunge ist groß. Hierdurch kann die Intubation erschwert werden.
Der Kehlkopf steht höher, die Epiglottis ist relativ lang und U-förmig gestaltet.
Die Trachea ist kurz: ca. 4 cm beim Neugeborenen und ca. 5,7 cm beim 8-jährigen Kind; der Durchmesser ist klein: ca. 6 mm beim Neugeborenen und ca. 11 mm beim 4-jährigen Kind.
Rechter und linker Hauptbronchus entspringen beide in einem Winkel von 55° von der Trachea. Eine einseitige Intubation ist daher nicht nur rechts, sondern auch links leicht möglich.
Der Hustenreflex ist unvollkommen ausgebildet. Hierdurch wird die Aspirationsgefahr vergrößert, die wache Intubation hingegen erleichtert.
Die alveoläre Ventilation ist 2-mal so hoch wie die des Erwachsenen. Die Atmung wird b. B. durch Zunahme der Atemfrequenz gesteigert, nicht so sehr durch vertiefte Atmung.
Die Größe des Totraums pro kg Körpergewicht sowie das Verhältnis von Totraum zu Atemzugvolumen entsprechen dem des Erwachsenen. Der Totraum von Anästhesiegeräten und -zubehör spielt jedoch beim Kind eine herausragende Rolle. Hierbei gilt: In der Kinderanästhesie muss spezielles Zubehör mit kleinstmöglichem Totraum verwendet werden.
In Tab. 19.1 sind für die Anästhesie wichtige Atemwerte von Neugeborenen und Erwachsenen vergleichend zusammengefasst.
| Atemwert | Neugeborene | Erwachsene |
|---|---|---|
| Atemfrequenz [pro min] | 40–60a | 20 |
| Atemzugvolumen VT [ml/kgKG] | 6 | 7 |
| Totraum VD [ml/kgKG] | 2,2 | 2,2 |
| VD/VT | 0,3 | 0,3 |
| paCO2 [mmHg] | 32–35 | 35–44 |
| paO2 [mmHg] | 40–80 | 65–105 |
a Bei Frühgeborenen liegt die Atemfrequenz zwischen 50 und 70/min
Herz-Kreislauf-System
Bald nach der Geburt schließen sich das Foramen ovale im Vorhof und der Ductus Botalli zwischen Aorta und A. pulmonalis: Der „Erwachsenenkreislauf“ ist damit hergestellt. Funktionell bestehen jedoch zahlreiche Unterschiede:
Der Kreislauf des Neugeborenen ist zentralisiert. Der größte Teil des Blutes befindet sich in den Eingeweiden. Der periphere Widerstand ist entsprechend hoch. Die Kompensationsmechanismen bei Blutverlusten sind eingeschränkt; das Schlagvolumen kann nicht gesteigert werden.
Die Herzfrequenz ist hoch: 120/min, das Schlagvolumen ist klein: 4–5 ml, das Herzzeitvolumen beträgt 500–600 ml/min. Es besteht ein ausgeprägter Sympathikotonus.
Der Blutdruck liegt zwischen 60 und 80 mmHg systolisch und 40–50 mmHg diastolisch. Eine richtige Blutdruckmessung ist schwierig: zu breite Manschetten ergeben falsch niedrige, zu schmale Manschetten falsch hohe Werte.
In Tab. 19.2 sind Herzfrequenz- und Blutdruckwerte für verschiedene Altersgruppen zusammengefasst.
| Alter | Herzfrequenz [pro min] | Systolischer Blutdruck [mmHg] |
|---|---|---|
| 1 Tag | 120–160 | 60 |
| 5 Tage | 120–160 | 80 |
| 6 Monate | 110–130 | 90 |
| 6 Jahre | 100 | 100 |
| 10 Jahre | 90 | 110 |
| 15 Jahre | 80 | 120 |
Blut
Die Hämoglobinkonzentration liegt bei der Geburt zwischen 18 und 22 g/dl, der Hämatokrit zwischen 50 und 60%. Beim 3 Monate alten Säugling fällt der Hb-Wert auf 10–11 g/dl und steigt in den folgenden Jahren auf 12–15 g/dl an. Die Elektrolytkonzentrationen im Serum unterscheiden sich nicht wesentlich von denen des Erwachsenen. Wichtig für Anästhesie und Operation sind das Blutvolumen und die Hb-Werte in den verschiedenen Altersgruppen (Tab. 19.3 und Tab. 19.4).
| Alter | Blutvolumen |
|---|---|
| Neugeborene | 80–85 ml/kgKG |
| 6 Wochen bis 2 Jahre | 75 ml/kgKG |
| 2–15 Jahre | 72 ml/kgKG |
| Alter | Hämoglobingehalt in g/dl |
|---|---|
| 1.–3. Tag | 14,5–18,5 |
| 1. Woche | 13,5–17,5 |
| 2. Woche | 12,5–16,5 |
| 1. Monat | 10–14 |
| bis 2. Monat | 9–11,5 |
| bis 3.–6. Monat | 9,5–11,5 |
| 1 Jahr | 10–12 |
| 5 Jahre | 11–13 |
| 12 Jahre | 12–14 |
| 16 Jahre, Mädchen | 14 |
| 16 Jahre, Jungen | 15 |
Weiterhin ist zu beachten:
Bei Neugeborenen und Kleinkindern führen bereits geringe Blutverluste zu lebensbedrohlichem Volumenmangel.
Der Blutdruck fällt proportional zum Blutverlust ab.
Während der Narkose besteht eine enge Beziehung zwischen systolischem Blutdruck und zirkulierendem Blutvolumen.
Bei Neugeborenen kann die Höhe des Blutdrucks als guter Anhalt für den Blutersatz gelten.
Reaktionen auf Hypoxie
Der O2-Verbrauch ist bei Neugeborenen doppelt so hoch wie beim Erwachsenen, dies führt schon nach kurzem Atemstillstand zu einer Hypoxie. Neugeborene reagieren auf Hypoxie, gleich welcher Ursache, mit
Bradykardie (!),
pulmonaler und systemischer Gefäßkonstriktion,
Abfallen des Herzzeitvolumens.
Bei ungeklärter Bradykardie muss immer an eine Hypoxie gedacht und sofort mit 100% Sauerstoff beatmet werden.
Regulation der Körpertemperatur
Neugeborene und Kleinkinder kühlen in kalter Umgebung rasch aus. Ältere Kinder reagieren hingegen mit Muskelzittern auf Kältereize (ab 6. Lebensjahr). Für alle Altersgruppen gilt aber: Während der Narkose und Operation soll die normale Körpertemperatur erhalten bleiben (Ausnahme: kontrollierte Hypothermie, z. B. in der Herzchirurgie). Andererseits kann jedoch die Körpertemperatur während einer Narkose auch bedrohlich ansteigen. Ursachen hierfür können sein:
Atropingabe,
Dehydrierung (Flüssigkeitsmangel),
zu starkes Abdecken mit OP-Tüchern,
Funktionsstörung der Wärmedecke,
maligne Hyperthermie.
Flüssigkeitsgleichgewicht und Stoffwechsel
Neugeborene und Kinder besitzen relativ mehr Körperwasser als Erwachsene und benötigen entsprechend größere Flüssigkeitsmengen. Flüssigkeitsverluste werden schlecht toleriert: Sie führen rasch zur Dehydrierung. Die Nieren des Neugeborenen sind, verglichen mit denen Erwachsener, unreif: ihre Fähigkeit, den Urin zu konzentrieren oder Wasser zu konservieren, ist begrenzt. In den ersten Lebenstagen sind Kohlenhydrate und Fette die Hauptenergiequelle.
Der Flüssigkeitsbedarf von Neugeborenen und Kindern hängt von der Stoffwechselaktivität sowie von insensiblen Verlusten und der Urinausscheidung ab.
Narkosevisite
Die Ziele der Narkosevorbereitung sind die gleichen wie bei Erwachsenen, im praktischen Vorgehen bestehen jedoch zahlreiche Unterschiede.
Einschätzung
Zur Einschätzung des klinischen Zustandes informiert sich der Anästhesist über die Krankengeschichte des Kindes, befragt zusätzlich die Eltern und führt eine begrenzte körperliche Untersuchung durch. Besondere Aufmerksamkeit gilt hierbei den oberen Luftwegen und dem Zustand der Zähne. Neben der Inspektion von Mundhöhle und Rachen sowie der Venenverhältnisse werden Herz und Lunge auskultiert.
Präoperative Laborwerte
Für die präoperative Bestimmung von Laborwerten empfiehlt der Arbeitskreis Kinderanästhesie der DGAI Folgendes:
Die routinemäßige Bestimmung von Blutbild, Elektrolyten und Gerinnungsparametern vor kleinen operativen Eingriffen ist überflüssig.
Vor Regionalanästhesien, Adenotomien und Tonsillektomien ist bei unauffälliger Anamnese kein Gerinnungsstatus erforderlich.
Bei bestimmten Erkrankungen und großen Operationen empfiehlt die DGAI die in Tab. 19.5 zusammengestellten Laborparameter zu bestimmen.
| Vorerkrankung/Operation | Laborwerte |
|---|---|
| Große Operationen mit möglichen Blutverlusten | Blutgruppe, Blutzucker, Gerinnungsstatus |
| Ileus, akutes Abdomen, Pylorushypertrophie | Na+, K+, Säure-Basen-Status |
| Leberinsuffizienz | Na+, K+, Blutbild, Transaminasen, Quick, NH4, Bilirubin |
| Niereninsuffizienz | Na+, K+, Blutbild, Kreatinin, Harnstoff, Säure-Basen-Status |
| Herzinsuffizienz | Na+, K+, Blutbild, Transaminasen, Laktat, Kreatinin, Harnstoff |
| Gerinnungsstörungen | Gerinnungsstatus, Thrombozyten; Abklärung eines v.-Willebrand-Jürgens-Syndroms |
| Hämatopoetische/onkologische Krankheiten | Na+, K+, Blutbild, evtl. Differenzialblutbild, Blutgerinnung |
Thoraxröntgenbild, EKG
Diese Untersuchungen werden präoperativ ebenfalls nicht routinemäßig durchgeführt, sondern nur bei Kindern mit Hinweisen auf Erkrankungen des Herzens oder der Lunge.
Impfabstände
Es gibt keinerlei Hinweise, dass eine Narkose bei frisch geimpften Kindern zu Komplikationen führt. Entsprechend müssen elektive Eingriffe wegen einer kürzlich erfolgten Impfung auch nicht verschoben werden. Impfexperten empfehlen allerdings – ohne wissenschaftliche Beweise – folgende Zeitabstände vor elektiven Narkosen/Eingriffen einzuhalten:
14 Tage bei Impfung mit Lebendimpfstoffen wie bei Masern, Mumps, Röteln, Polio (oral), Varizellen, BCG, Typhus,
3 Tage bei Impfungen mit Totimpfstoff wie bei Diphtherie, Tetanus, Pertussis, Polio (parenteral), Influenza, Hepatitis, Tollwut, FSME, Cholera.
Akute Atemwegsinfekte
Akute Atemwegsinfekte erhöhen bei Kindern das Risiko perioperativer respiratorische Komplikationen wie Laryngospasmus, Bronchospasmus, Schwellung der Atemwege mit Verlegung, Krupp sowie postoperative Atelektasen und Pneumonien. Daher sollten elektive Eingriffe bei Fieber (>38,4°C), eitrigem Sekret oder eitrigem Auswurf mindestens bis zum Abklingen des Akutstadiums verschoben werden.
Psychologische Vorbereitung
Die Aufnahme ins Krankenhaus und die damit verbundenen medizinischen Maßnahmen und die Trennung von den Eltern führen bei sehr vielen Kindern zu Ängsten und Rückzugverhalten, bei einigen sogar zum psychischen Trauma mit langanhaltenden Wirkungen. Hierbei gelten folgende Beziehungen:
Kleinkinder unter 6 Monaten werden durch die Trennung von den Eltern wenig gestört, solange eine weibliche Pflegeperson als Ersatzmutter vorhanden ist.
Kinder zwischen 6 Monaten und 4 Jahren reagieren gewöhnlich am stärksten auf die Trennung von den Eltern; sie wird nicht selten sogar als Bestrafung empfunden. Gefährliche Situationen werden instinktiv wahrgenommen (z. B. Lagerung auf dem OP-Tisch), ihr Sinn jedoch nicht verstanden, Erklärungen werden nicht akzeptiert.
Zwischen 4 und 6 Jahren bestehen noch immer Trennungsängste, das Kind ist aber für Erklärungen über den Sinn von Maßnahmen zugänglicher. Dafür tauchen konkrete Ängste (v. a. Verstümmelungsängste) vor der Operation auf.
Ab 6 Jahren werden Trennungen von den Eltern noch besser ertragen. Jetzt bestehen aber nicht selten differenzierte Ängste vor Narkose und Operation (z. B. Erwachen während der Operation).
Je älter das Kind schließlich wird, desto mehr nähern sich seine Reaktionsweisen auf Narkose und Operation denen des Erwachsenen an.
Verhalten der Eltern und des Klinikpersonals, Dauer des Krankenhausaufenthalts und der Trennung von den Eltern sowie frühere Krankenhausaufenthalte haben ebenfalls wesentlichen Einfluss auf die Reaktion des Kindes.
Um die Ängste zu mindern, sollte die präoperative Visite des Anästhesisten im Beisein der Eltern stattfinden. Im Idealfall sollte der Anästhesist von der zuständigen Pflegekraft begleitet werden.
Hierbei müssen Anästhesist und Pflegekraft das Vertrauen des Kindes gewinnen. Kindern über drei Jahren werden die Maßnahmen zur Narkoseeinleitung mit einfachen Worten genau erklärt. Alle Fragen müssen aufrichtig beantwortet werden. Lügen haben kurze Beine: Belogene Kinder verlieren rasch ihr Vertrauen. Ist eine postoperative Intensivbehandlung zu erwarten, müssen die wichtigsten Maßnahmen (Tubus, „Nichtsprechenkönnen“, Beatmung, Drainagen) ebenfalls erklärt werden.
Präoperative Nahrungskarenz
Anders als beim Erwachsenen ist ein dem Alter angepasstes Fütterungsschema erforderlich (Tab. 19.6). Eine zu lange prä- und postoperative Nahrungskarenz führt bei kleinen Kindern rasch zu Hypoglykämie, Dehydratation und Ketoazidose und muss daher strikt vermieden werden.
| Alter | Feste Nahrung, Muttermilch | Milchnahrung | Klare Flüssigkeita |
|---|---|---|---|
| <1 Jahr | 4 Stunden | 4 Stunden | 2 Stunden |
| >1 Jahr | 6 Stunden | Keine | 2 Stunden |
a „klare“ Flüssigkeiten sind z. B. Tee oder Apfelsaft mit Zucker, Wasser, Mineralwasser, Cola, Fanta. Sie dürfen weder Fett, noch Partikel, noch Alkohol enthalten. Einige Autoren empfehlen klare Flüssigkeiten sogar bis zu 1 h vor OP
Bei speziellen Erkrankungen, z. B. Diabetes mellitus, kann das Schema modifiziert werden.
Postoperativ können Kinder 3–4 h nach unkomplizierten Eingriffen und Narkosen wieder Nahrung erhalten.
Prämedikation
Verwendet werden: Benzodiazepine, v. a. Midazolam (Dormicum), bei Schmerzen auch Opioide. Ein starres Prämedikationsschema muss vermieden werden.
Prämedikationsgrundsätze
Kinder unter 6 Monaten benötigen keine Prämedikation.
Die Prämedikation sollte schmerzlos sein: darum möglichst keine i.m.-Spritzen! Kinder unter 3 Jahren werden bevorzugt oral oder rektal prämediziert, z. B. mit Midazolam (► unten).
Atropin sollte frühestens (wenn überhaupt) während oder kurz nach der Einleitung i.v. gegeben werden. Dosierung: 0,01 mg/kgKG, Minimaldosis 0,1 mg, Höchstdosis 0,5 mg.
Midazolam
Dieses Benzodiazepin gilt als Standardsubstanz für die Prämedikation in der Kinderanästhesie. Die sedierende und angstlösende Wirkung tritt rasch ein (► unten) und hält ca. 20–40 min an. Bei vielen Kindern entwickelt sich eine eher gelöst-lustige, auch läppische Stimmung, in der die anschließende Punktion einer Vene oder eine Maskeneinleitung bei sehr schlechten Venenverhältnissen meist ohne wesentliche Abwehr toleriert werden. Für die Prämedikation kann die Substanz oral oder rektal sowie sublingual und transnasal zugeführt werden.
Orale Zufuhr: Dosierung ca. 0,4–0,6 mg/kgKG, Gabe ca. 30 min vor der Trennung von den Eltern bzw. vor Transport in den OP. Höhere Dosen führen zu Gleichgewichtsstörungen und evtl. auch Missstimmung. Die Wirkung hält ca. 45 min an, d. h. innerhalb dieser Zeit sollte auch mit der Narkoseeinleitung begonnen werden.
Rektale Instillation: Dosierung ca. 0,5–1 mg/kgKG; Wirkungseintritt nach ca. 10–15 min, Wirkdauer ca. 50 min.
Transnasale Zufuhr: Vorteil: rascherer Wirkungseintritt; ist aber bei Kindern ein unbeliebtes Verfahren! Dosierung: 0,4 mg/kgKG. Wirkungseintritt nach ca. 10 min. Gefahr der Atemdepression mit Abfall der arteriellen O2-Sättigung. Darum lückenlose Überwachung unter Notfallbereitschaft, z. B. im Aufwachraum oder Narkoseeinleitungsraum.
Sublinguale Zufuhr: Dosierung: 0,4 mg/kgKG; rascher Wirkungseintritt nach ca. 10 min, Überwachung wie bei transnasaler Zufuhr erforderlich.
Intravenöse und nasale Zufuhr von Midazolam bei Kindern nur unter Notfallbereitschaft und in direkter Gegenwart des Arztes!
Auswahl der Narkosemittel und Adjuvanzien
Für Kinder ist die Allgemeinnarkose das Verfahren der Wahl; alleinige Regionalanästhesien bleiben die Ausnahme. In der Kinderanästhesie werden die gleichen Narkosemittel und Adjuvanzien angewendet wie bei der Narkose für Erwachsene.
Inhalationsanästhesie
Die Aufnahme und Elimination von Inhalationsanästhetika verläuft bei kleinen Kindern wegen der höheren alveolären Ventilation – bei kleinerer Residualkapazität und der geringeren Blutlöslichkeit – schneller als bei älteren Kindern und Erwachsenen, der Dosisbedarf ist höher und nimmt mit zunehmendem Alter ab. Für die Einleitung der Narkose über eine Maske ist lediglich Sevofluran geeignet, nicht hingegen Isofluran und Desfluran.
Anästhetikabedarf
Nach Ablauf der Neugeborenenperiode sind bei Säuglingen und jüngeren Kindern höhere Konzentrationen der volatilen Anästhetika erforderlich als beim Erwachsenen, während Früh- und Neugeborene empfindlicher reagieren und der Bedarf geringer ist als bei Kindern jenseits dieses Lebensalters. Folgendes sollte beachtet werden:
Kardiovaskuläre Wirkungen
Bei Säuglingen und kleineren Kindern sind die kardiovaskulären Nebenwirkungen der Inhalationsanästhetika stärker ausgeprägt. So kann bei Überdosierung, v. a. in der Einleitungsphase, leichter eine Bradykardie mit Blutdruckabfall oder gar ein Herzstillstand auftreten als bei älteren Kindern und Erwachsenen.
Respiratorische Wirkungen
Wie beim Erwachsenen dämpfen Inhalationsanästhetika konzentrationsabhängig den zentralen Atemantrieb und zwar bereits in sehr niedrigen Konzentrationen. Daher sollten gerade kleine Kinder während der Inhalationsanästhesie kontrolliert beatmet werden.
Sevofluran
Die Narkoseeinleitung mit Sevofluran verläuft sehr rasch, ebenso die Elimination und das Erwachen aus der Narkose (Einzelheiten: 10.1007/978-3-662-50444-4_9).
Die Atemwege werden durch Sevofluran nicht oder nur unwesentlich irritiert, sodass die Substanz für die Narkoseeinleitung per Inhalation gut geeignet ist. Sevofluran kann, wie die anderen volatilen Anästhetika, eine maligne Hyperthermie auslösen.
Klinische Anwendung
Wegen seiner günstigen pharmakokinetischen Eigenschaften und der geringeren kardialen Nebenwirkungen ist Sevofluran das Standardanästhetikum für die Inhalationsanästhesie bei Kindern.
MAC-Werte von Sevofluran bei Kindern
Neugeborene: 3,3 Vol.-%
Säuglinge: 3,2 Vol.-%
1–12 Jahre: 2,5 Vol.-%
Der Zusatz von 60% Lachgas reduziert den MAC-Wert um ca. 25% (Erwachsene: ca. 60%)
Einleitung per Inhalation
Kinder können mit sehr hohen Sevoflurankonzentrationen (8 Vol.%) innerhalb von ca. 1 min per Inhalation eingeleitet werden, wenn vorher das Narkosesystem mit Frischgas und Anästhetikum gefüllt wurde.
Hierbei sollte aber unmittelbar nach dem Bewusstseinsverlust noch keine Stimulationen, wie z. B. die Punktion einer Vene, durchgeführt werden, da die Narkose noch nicht tief genug ist und die Kinder mit Wegziehen der Extremität reagieren. Die endexspiratorische Sevoflurankonzentration, mit der bei 50% der Kinder eine Larynxmaske eingeführt werden kann, beträgt ca. 2 Vol.-%, für die endotracheale Intubation ohne Muskelrelaxanzien dagegen ca. 2,7–2,8 Vol.-%.
Aufwachzeiten und -verhalten
Im Allgemeinen erwachen Kinder nach einer Sevoflurananästhesie rasch. In der Ausleitungsphase tritt bei zahlreichen Kindern eine erhebliche Unruhe und Agitiertheit („Aufwachdelir“) auf. Diese Reaktion ist nicht zwangsläufig durch Schmerzen bedingt, da sie auch auftritt, wenn intraoperativ eine Lokalanästhesie des Wundgebietes oder eine regionale Nervenblockade durchgeführt wurde. Die intraoperative Gabe von Clonidin scheint prophylaktisch zu wirken, nicht jedoch die Gabe von Benzodiazepinen. Bei stärkerer Agitation sind Sedativa erforderlich (z. B. 1 mg/kgKG Propofol).
Isofluran
Isofluran riecht stechend und kann bei der Narkoseeinleitung – wie Desfluran – zu Husten, Laryngospasmus oder Atemanhalten bis hin zur Hypoxämie führen. Daher ist die Substanz für die Einleitung der Narkose per Inhalation nicht gut geeignet. Isofluran kann aber nach i.v.-Einleitung als primäres Inhalationsanästhetikum auch bei Kindern eingesetzt werden, allerdings empfiehlt es sich, die Konzentration langsam zu steigern, um respiratorische Effekte zu vermeiden.
MAC-Werte von Isofluran bei Kindern
Neugeborene: 1,6 Vol.-%
Frühgeborene <32. Woche: 1,3 Vol.-%, 32.–37. Woche: 1,4 Vol.-%
Säuglinge 6–12 Monate: 1,8 Vol.-%
1.–5. Lebensjahr: 1,6 Vol.-%
der Zusatz von 60% Lachgas reduziert den MAC-Wert um ca. 40%
Nebenwirkungen
Blutdruckabfall,
Atemdepression,
Laryngospasmus bei Narkoseausleitung und Extubation.
Desfluran
Desfluran stimuliert die oberen Atemwege und führt bei einer hohen Anzahl von Kindern und Erwachsenen zu Atemanhalten, Husten und Laryngospasmus. Daher gilt:
Desfluran ist wegen seiner respiratorischen Effekte für die Inhalationseinleitung von Kindern nicht geeignet.
Wirkungsstärke
Desfluran ist wegen seiner geringen Löslichkeit das schwächste der volatilen Anästhetika.
MAC-Werte von Desfluran bei Kindern
Neugeborene: 9,2 Vol.-%
1–6 Monate: 9,4 Vol.-%
6–12 Monate: 9,2 Vol.-%
1–12 Jahre: 8 Vol.-%
der Zusatz von 60% Lachgas reduziert den MAC-Wert um ca. 20% (Erwachsene: ca. 60%)
Kardiovaskuläre Wirkungen
10.1007/978-3-662-50444-4_9.
Intravenöse Anästhetika
Am häufigsten werden Propofol und Thiopental (Trapanal) verwendet, manchmal auch Etomidat (Hypnomidate) oder Ketamin (z. B. bei Verbrennungen). Dosierung von i.v.-Anästhetika: Tab. 19.7.
| Substanz | Dosis [mg/kgKG] | Wirkungseintritt [min] | Nebenwirkungen, Komplikationen |
|---|---|---|---|
| Intravenöse Injektion | |||
| Thiopental | 4–6 | 1–2 | Injektionsschmerz |
| Propofol | 3–5 mg bei kleinen Kindern, 2,5 mg bei älteren | 1 | Starker Injektionsschmerz |
| Etomidat | 0,3–0,4 | 1 | Myoklonien, Hemmung der Kortisolsynthese |
| Ketamin | 1–3 | 1 | Gesteigerte Speichelsekretion (Atropin vorgeben!), verzögertes Erwachen bei kurzen Eingriffen, Dysphorie oder Erregungszustände (Benzodiazepine vorgeben!) |
| Intramuskuläre Injektion | |||
| Ketamin | Sedierung: 2–3 | oben | |
| Anästhesie: 8–12 | |||
| Rektale Zufuhr | |||
| Thiopental | 40 | 5–15 | Schluckauf |
| Ketamin | 6–10 | 7–15 | oben |
Propofol
Grundsätzlich entsprechen die hypnotischen und anästhetischen Wirkungen von Propofol bei Kindern denen von Erwachsenen (10.1007/978-3-662-50444-4_10), Unterschiede bestehen jedoch in der Dosis-Wirkung-Beziehung: Kinder benötigen höhere Dosen als Erwachsene. Bei Allergien gegen Soja oder Erdnüsse darf Propofol nicht angewandt werden.
Einleitungsdosen
Für die meisten Kinder ist eine Einleitungsdosis von mindestens 3–4 mg/kgKG erforderlich, je nach Art der Prämedikation und Zustand des Kindes reichen manchmal aber auch weniger als 2,5 mg/kgKG aus. Kinder unter 3 Jahren benötigen meist eine etwas höhere Propofoldosis als ältere Kinder.
Aufrechterhaltung der Narkose
Auch hierfür sind bei Kindern höhere Dosen erforderlich als bei Erwachsenen (25–50%). Wiederum benötigen Kinder unter 3 Jahren etwas höhere Dosen als ältere. Im Allgemeinen sind für die Aufrechterhaltung der Anästhesie etwa 9–15 mg/kgKG/h Propofol notwendig.
Muskelrelaxanzien
In der Kinderanästhesie sind nichtdepolarisierende Muskelrelaxanzien (ND-Relaxanzien) die Substanzen der Wahl, zumal mit Mivacurium ein ND-Relaxans für kurzdauernde Eingriffe, z. B. in der HNO, zur Verfügung steht. In Tab. 19.8 sind die Eigenschaften gebräuchlicher ND-Relaxanzien zusammengestellt.
| Relaxans | Intubationsdosis [mg/kgKG] | Anschlagzeit [min] | Wirkdauer bei Neugeborenen und Säuglingen [min] | Wirkdauer bei älteren Kindern [min] |
|---|---|---|---|---|
| Mivacurium | 0,2–0,25 (ab 12 Monate) | ca. 2 | ca. 6 | ca. 10 |
| Cisatracurium | 0,1 | 3–5 | ca. 32 | |
| Atracurium | 0,3 (Neugeborene) bis 0,5 (ältere Kinder) | ca. 3,8 | ca. 32 | ca. 25 |
| Rocuronium | 0,6–0,8 | 45–90 s | 40 | 25 |
| Vecuronium | 0,1 | 1,5 | 55–73 | 20–35 |
| Pancuronium | 0,07 | 1,5 | 70 | 35 |
Succinylcholin
Kinder unter 1 Jahr benötigen höhere Succinylcholindosen (mind. 2 mg/kgKG i.v. oder 2–4 mg/kgKG i.m.) als ältere Kinder (1 mg/kgKG). Nach 60–90 s ist meist eine vollständige Relaxierung eingetreten. Die Wirkdauer von Succinylcholin ist bei Neugeborenen und Kindern erheblich kürzer als bei Erwachsenen – trotz geringerer Cholinesteraseaktivität – und beträgt etwa 3–10 min. Die Wirkung kann nicht durch Anticholinesterasen antagonisiert werden.
Succinylcholin ist eine Substanz mit vielen potenziellen, teils lebensbedrohlichen Nebenwirkungen (10.1007/978-3-662-50444-4_11). Daher gilt:
Succinylcholin ist in der Kinderanästhesie nur ein Notfall- bzw. Reservemedikament!
Herzrhythmusstörungen
Die Bradykardie ist eine typische Komplikation der i.v.-Injektion von Succinylcholin, besonders bei der 2. Injektion. Ursache ist eine vagale Stimulation. Die Bradykardie kann daher durch i.v.-Vorinjektion von Atropin (0,01 mg/kgKG) verhindert werden.
Vor der i.v.-Injektion von Succinylcholin sollte bei Kindern Atropin i.v. injiziert werden, um eine schwerwiegende Bradykardie oder gar Asystolie zu verhindern.
Plötzlicher Herzstillstand und Myopathien
Bei Kindern mit Muskeldystrophie vom Typ Duchenne kann Succinylcholin zu schwerer Rhabdomyolyse, Myoglobinurie und hyperkaliämischem Herzstillstand führen. Darum ist Succinylcholin bei dieser Erkrankung absolut kontraindiziert.
Die besondere Empfindlichkeit gegenüber Succinylcholin besteht bereits, bevor sich die genetisch bedingte, nahezu ausschließlich beim männlichen Geschlecht auftretende Duchenne-Muskeldystrophie (Häufigkeit ca. 1 auf 10.000 Geburten) klinisch manifestiert. Auch aus diesem Grund wird bei Kindern auf die Routineanwendung von Succinylcholin verzichtet.
Masseterspasmus und maligne Hyperthermie
Succinylcholin kann einen Spasmus der Kaumuskulatur (Masseterspasmus) hervorrufen. Bei 15% dieser Kinder entwickeln sich Veränderungen der Blutgase, die als Kriterium einer malignen Hyperthermie (MH) angesehen werden. Muskelbiopsien haben jedoch ergeben, dass ca. 50% der Kinder mit Masseterspasmus nach Succinylcholin MH-empfindlich sind. Noch höher ist das MH-Risiko bei Kindern, die neben dem Masseterspasmus eine generalisierte Muskelsteife nach Succinylcholin entwickeln. Folgendes sollte aber beachtet werden:
Eine vorübergehende Zunahme des Muskeltonus nach Injektion von Succinylcholin ist eine normale Reaktion, die nicht im Zusammenhang mit einer malignen Hyperthermie steht.
Ileuseinleitung und Notfallanwendung
Der Einsatz von Succinylcholin bei Kindern sollte sich, gerade angesichts geeigneter ND-Relaxanzien und Inhalationsanästhetika, auf Notfälle beschränken. Selbst bei der Ileuseinleitung (Blitzintubation) müssen Nutzen und Risiken kritisch erwogen werden, zumal hierfür das leicht mit Sugammadex antagonisierbare Rocuronium zur Verfügung steht.
Intubation („Ileuseinleitung“)
Da heutzutage auch kleinste Fiberendoskope für Kinder zur Verfügung stehen, kann bei nicht nüchternen Kindern auch eine fiberendoskopische Intubation im Wachzustand erwogen werden.
Narkosezubehör
Für die Kinderanästhesie ist spezielles Zubehör erforderlich, das auf die anatomischen Besonderheiten der verschiedenen Altersgruppen zugeschnitten ist.
Narkosemasken
Für kleine Kinder müssen Masken mit minimalem Totraum verwendet werden. Rendell-Baker-Masken (Abb. 19.1) sind nicht aufblasbar, Totraum und Gewicht sind gering, die Form ist dem Gesicht kleiner Kinder angepasst, die Abdichtung ist aber v. a. bei Kleinkindern oft schwierig.
Besser geeignet sind runde Masken und Masken mit aufblasbarem Rand. In Tab. 19.9 sind gebräuchliche Größen mit dem zugehörigen Totraum zusammengefasst.
| Alter | Maskengröße | Totraum [ml] | Größe |
|---|---|---|---|
| Frühgeborene | 0 | 2 | 1 |
| Neugeborene | 1 | 4 | 1 |
| 1–3 Jahre | 2 | 8 | 2, 3 |
| 4–8 Jahre | 3a | 15 | 3 |
a Die Maske Nr. 3 dichtet schlecht ab und sollte daher nicht verwendet werden
Atembeutel
Erwachsenenatembeutel sollten bei Kindern nicht verwendet werden, da hiermit die Beatmung schlecht steuerbar ist. Die Wahl der Atembeutelgröße sollte sich vielmehr am Gewicht des Kindes orientieren (Tab. 19.10).
| Körpergewicht in kg | Atembeutelgröße in l |
|---|---|
| <15 kg | 1-l-Beutel |
| 15–50 kg | 2-l-Beutel |
| >50 kg | 3-l-Beutel |
Guedel-Tuben
Diese oropharyngealen Tuben dienen bei Maskennarkosen der Freihaltung der Atemwege. Bei Intubationsnarkosen verhindern sie ein Zubeißen des Tubuslumens. Der Tubus darf nicht zu klein gewählt werden, weil sonst die Zunge nicht ausreichend heruntergedrückt wird. Gebräuchliche Größen für Kinder sind je nach Alter: 000, 00, 0, 1, 2 und 3.
Endotrachealtuben
Endotrachealtuben für Kinder (Abb. 19.1) sollten eine Längenmarkierung in Abständen von 1 cm aufweisen, die Spitze sollte schwarz eingefärbt sein. Die Größe des Tubus richtet sich primär nach dem Alter des Kindes (Tab. 19.11), bei Kindern unter 2 Jahren am ehesten nach dem Durchmesser des Kleinfingers. Da die engste Stelle des Kehlkopfes der Ringknorpel ist, muss die richtige Tubusgröße sehr sorgfältig ausgesucht werden. Als grober Anhalt für die Tubusgröße in der Altersgruppe von 2–14 Jahren können folgende Formeln dienen:
| Alter | Innerer Durchmesser [mm] |
|---|---|
| Frühgeborenes | 2,5–3 |
| Neugeborenes | 3,5 |
| 1 Jahr | 4 |
| 2 Jahre | 4,5 |
| 4 Jahre | 5 |
| 6 Jahre | 5,5 |
| 8 Jahre | 6 |
| 10 Jahre | 6,5 |
| 12 Jahre | 7 |
| 14 Jahre | 7,5 |
| 16 Jahre | 8 |
Ungeblockter Tubus:
Geblockter Tubus:
Geblockter Tubus:
Bei Tuben ohne Cuff sollte neben dem altersentsprechenden Tubus noch der nächst größere und kleinere bereitgelegt werden Wie weit ein Tubus vorgeschoben wird, richtet sich ebenfalls nach dem Alter (10.1007/978-3-662-50444-4_8, 10.1007/978-3-662-50444-4_8#Tab1). Die Gefahr der rechtsseitigen, aber auch der linksseitigen (!) endobronchialen Intubation ist in dieser Altersgruppe besonders groß. Für eine Tubuslage in Tracheamitte kann bis zum Alter von etwa 14 Jahren folgende Formel als Anhaltspunkt gelten:
Alternativ kann folgende einfacher zu berechnende Formel verwendet werden:
Der Tubus liegt korrekt, wenn sich die Spitze beim Neugeborenen 2 cm, bei älteren Kindern 2–4 cm über der Karina befindet. Die korrekte Tubuslage muss durch sorgfältige Auskultation überprüft werden.
Grundsätzlich sollte die Eindringtiefe des Tubus an der Zahnleiste mit permanentem Farbstift markiert und außerdem im Narkoseprotokoll vermerkt werden. Folgendes sollte noch beachtet werden:
Lageveränderungen des Kopfes verschieben die Tubusspitze: Bei Überstrecken des Kopfes entfernt sich die Tubusspitze von der Karina; im Extremfall gleitet der Tubus aus der Luftröhre in den Ösophagus. Umgekehrt bei Kopfbeugung (Kinn auf die Brust): Die Tubusspitze dringt tiefer in die Trachea ein: Gefahr der einseitigen Intubation.
Für die kurzzeitige Intubation wird bei Kindern meist oral intubiert. Vorteil: es kann ein größerer Tubus mit geringerem Widerstand gewählt werden als bei der nasalen Intubation. Hierdurch wird auch das Absaugen erleichtert.
Für die postoperative Nachbeatmung oder Langzeitintubation wird nasal intubiert. Der Tubus lässt sich sicherer fixieren und wird auch besser toleriert. Eine versehentliche Extubation ist weniger leicht möglich. Hierbei muss aber beachtet werden: Wenn der Tubus nicht sicher fixiert ist, kann er bei Kopfbewegungen sehr leicht in einen Hauptbronchus oder aus der Trachea heraus und in den unteren Rachen bzw. Ösophagus gleiten.
Tuben mit oder ohne Cuff?
Bei Früh- und Neugeborenen bzw. bis zum 4. Lebensmonat werden Tuben ohne Blockmanschette eingesetzt, danach, ab ca. 3 kg Körpergewicht, Tuben mit Blockmanschette. Bei diesen Tuben muss der Cuffdruck kontrolliert und auf maximal 20 cmH2O begrenzt werden.
Den größten Tubus verwenden, der leicht durch die Stimmritze und die subglottische Region gleitet. Ein Leck sollte erst ab einem Beatmungsdruck von 20 cmH2O auftreten.
Der Tubusadapter muss mindestens den gleichen inneren Durchmesser aufweisen wie der Tubus, um einen festen Sitz zu gewährleisten.
Laryngoskope
Die Auswahl des Spateltyps (Abb. 19.1) – gerade oder gebogen – hängt von der persönlichen Bevorzugung des Anästhesisten ab. Gerade Spatel erleichtern die Einstellung und Immobilisierung des Kehlkopfs von Neugeborenen und Kleinkindern, bei Kindern mit Zähnen sind dagegen gebogene Spatel vorteilhafter. Folgende Größen sollten auf dem Intubationsset für die Kinderanästhesie bereitgestellt werden:
Spatelgrößen bei Kindern
0 gerade: Frühgeborene
1 gerade: Neugeborene
1 gebogen: Säuglinge
2 gebogen: Kinder
Narkosesysteme
Halbgeschlossene Narkosesysteme sind der Standard in der Kinderanästhesie. Diese Systeme haben folgende Vorteile:
gute Anfeuchtung und Erwärmung der Atemgase,
geringerer Narkosegasverbrauch,
Low-flow- und Minimal-flow-Narkosen möglich,
weniger Umweltbelastung,
bessere Überwachungsmöglichkeiten.
Blutdruckmanschetten
Die Größe der Blutdruckmanschette muss dem Armumfang des Kindes angepasst werden, damit richtige Blutdruckwerte gemessen werden. Die Manschette muss 2/3–3/4 des Arterienverlaufs am Oberarm umschließen.
Magensonden
Magensonden werden v. a. bei abdominalen Eingriffen eingeführt, außerdem zur Entlastung des Magens, wenn bei der Maskenbeatmung Luft in größerer Menge in den Magen eingedrungen ist. Die Sonden können nasal oder oral vorgeschoben werden.
Richtgrößen für Magensonden bei Kindern
Frühgeborene: 5 Charr
bis 1 Jahr: 8 Charr
1–2 Jahre: 10 Charr
2–6 Jahre: 12 Charr
6–12 Jahre: 14 Charr
>12 Jahre: 16 Charr
Blasenkatheter
Beträgt die voraussichtliche Operationszeit mehr als 2 h oder muss die Urinausscheidung kontinuierlich überwacht werden, wird ein Blasenkatheter eingeführt. Bei Neugeborenen werden ungeblockte Katheter verwendet, bei Säuglingen und anderen Kindern Ballonkatheter.
Richtgrößen für Blasenkatheter bei Kindern
Neugeborene: 4–6 Charr
5–10 kgKG: 6 Charr
10–20 kgKG: 8 Charr
20–40 kgKG: 10 Charr
>40 kgKG: 12 Charr
Überwachung während der Narkose
Die Basisüberwachung bei Routineeingriffen umfasst:
EKG,
Blutdruck (automatische Messung),
Pulsoxymeter,
Kapnometer,
Thermosonde: rektal oder ösophageal.
Ein präkordiales Stethoskop oder ein Ösophagusstethoskop kann, neben den Atemgeräuschen, zusätzlich Informationen über die Herz-Kreislauf-Funktion liefern, da die Lautstärke der Herztöne sich bei Kindern gleichsinnig zum Blutdruck verändert: Ein Leiserwerden der Herztöne kann Zeichen des Blutdruckabfalls sein, eine normale Lautstärke Zeichen eines ausreichenden Blutdrucks.
Je nach Operation können die Überwachungsmaßnahmen erweitert werden
Relaxometrie (N. ulnaris am Handgelenk, alternativ: N. peronaeus am Fibulaköpfchen, N. tibialis am Fußknöchel),
invasive arterielle Druckmessung (A. radialis, A. femoralis, A. axillaris),
ZVD bei großen Eingriffen,
Urinausscheidung: bei allen größeren Operationen,
Blutgase, Säure-Basen-Parameter und andere Laborwerte.
Praktisches Vorgehen bei der Narkose
Narkoseeinleitung
Die Narkoseeinleitung ist für Kinder ein besonders kritischer Zeitpunkt. Sie muss, behutsam und geduldig, in ruhiger Umgebung erfolgen. Grundvoraussetzung ist eine gute Prämedikation, in der Regel mit Midazolam. Folgende Methoden sind für die Einleitung möglich:
per Inhalation,
intravenös,
intramuskulär,
rektal.
Intravenöse Einleitung
Die Narkose sollte bevorzugt i.v. eingeleitet werden, v. a. bei Neugeborenen und Säuglingen.
Vorteile: schnell, geruchlos, keine Maske.
Nachteile: schmerzhafter Stich, wenn kein EMLA-Pflaster verwendet wird, evtl. schwierige Venenpunktion bei Säuglingen.
Praktisches Vorgehen
Intravenös einleiten, wenn Venen gut zu punktieren sind und das Kind den Nadelstich gut toleriert.
Venen an folgenden Stellen überprüfen: Handrücken, Radialvene, V. saphena und andere Venen im Fußbereich.
Kanüle aus dem Sichtfeld des Kindes halten, Aufmerksamkeit ablenken. Vor dem Einstich aber warnen: „Jetzt gibt‘s einen kleinen Pik!“
Kommt das Kind bereits mit einem Venenzugang in den Operationssaal, sollte immer i.v. eingeleitet werden.
Zur i.v.-Narkoseeinleitung können Propofol, Thiopental oder Etomidat verwendet werden, sehr selten Ketamin.
Propofol
Die Substanz wird häufig für die Narkoseeinleitung von Kindern eingesetzt, allerdings ist eine höhere Dosis erforderlich als beim Erwachsenen. Wegen der geringeren Injektionsschmerzen sollte die 0,5%ige Lösung (Propofol-lipuro 5 mg/ml) für Kinder bevorzugt werden. Dosierung: Tab. 19.7.
Propofol kann bei Kindern auch als Bestandteil der totalen i.v. Anästhesie kontinuierlich infundiert werden, z. B. mit Remifentanil. Auch hier sind wiederum deutlich höhere Dosen erforderlich als beim Erwachsenen.
Einleitung per Inhalation
Sevofluran ist das Inhalationsanästhetikum der Wahl für die Narkoseeinleitung von Kindern unter 7–8 Jahren. Desfluran und Isofluran sind hierfür nicht geeignet. Die Inhalationseinleitung erfordert einen in der Kinderanästhesie erfahrenen Facharzt, denn besonders bei Kindern im ersten Lebensjahr treten hierbei häufiger Bradykardien, Blutdruckabfälle und Herzstillstände auf als bei älteren Kindern.
Praktisches Vorgehen
Vor der Einleitung das gesamte Narkosezubehör bereitstellen und die Funktionsfähigkeit überprüfen (10.1007/978-3-662-50444-4_6). Absauggerät und Absaugkatheter nicht vergessen!
Blutdruckmanschette anlegen, Pulsoxymeter anschließen.
Kinder, die sich nicht hinlegen wollen, werden im Sitzen eingeleitet.
Allergrößte Vorsicht beim Umgang mit der Maske! Niemals ohne Warnung direkt auf das Gesicht setzen. Wird die Maske heftig abgewehrt: ohne Maske einleiten!
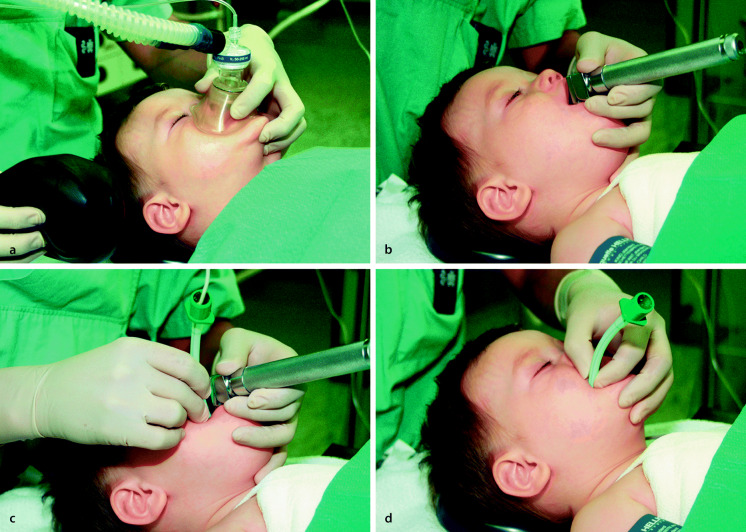
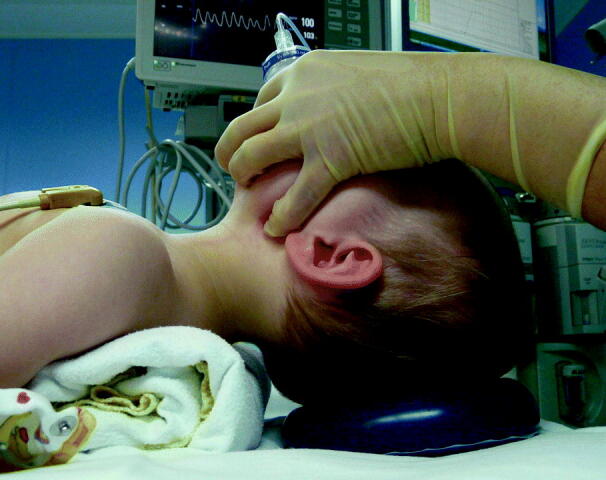
Gut prämedizierte Kinder „schleichend einleiten“ und nicht zur Einleitung aufwecken. Wenn möglich eine durchsichtige Maske wählen. Für eine rasche Inhalationseinleitung das System mit Atemgas und Sevofluran (in sehr hoher Konzentration) füllen, dann das Kind die hohe Konzentration bis zum Bewusstseinsverlust einatmen lassen. Bei der langsamen Inhalationseinleitung wird dagegen Sauerstoff (und evtl. Lachgas) mit niedrigem Flow zugeführt, und schrittweise erhöht, dann nach einigen Minuten Sevofluran in ansteigender Konzentration zugesetzt. Sobald das Kind schläft, Kinn anheben und Kopf überstrecken (Abb. 19.2). Noch keine stimulierenden Maßnahmen durchführen.
Ängstliche und widerstrebende Kinder sind eine Herausforderung an den Einfallsreichtum des Anästhesisten. Bewährt hat sich bei vielen Kindern folgende Methode: Die Aufmerksamkeit wird durch schnelles Einreden auf das Kind abgelenkt, während heimlich die Narkosegase in sehr hoher Konzentration zugeführt werden, um rasch einen Bewusstseinsverlust zu erreichen.
Erregte Kinder sollten nicht mit Gewalt per Inhalation eingeleitet werden. Hier empfiehlt sich die erneute Zufuhr von Midazolam, z. B. nasal oder rektal. Alternativ kann auch Ketamin oder Esketamin oral oder nasal (am besten versprüht) verabreicht werden.
Intramuskuläre Einleitung
Dieses Verfahren sollte nur in Ausnahmefällen angewandt werden; z. B. wenn ein Kind allen anderen Einleitungsbemühungen erfolgreich widerstanden hat oder wenn schlechte Venenverhältnisse vorliegen. Als Einleitungsanästhetikum dient Ketamin (Ketanest) in einer Dosis von 6–10 mg/kgKG i.m. Die Einleitung verläuft zuverlässiger als bei der rektalen Methode mit 10–15 mg.
Venöser Zugang
Spätestens nach der Narkoseeinleitung – bei schwerkranken Kindern bereits vorher – sollte ein venöser Zugang gelegt werden. Hierzu gehören bei kleinen Kindern Geschicklichkeit und Geduld.
Praktisches Vorgehen
Die Kanülen müssen ausreichend groß sein: Frühgeborene 22–24 G; Kinder bis zu etwa 5 Jahren 20 G; ab etwa 5 Jahren 18 G.
Als Punktionsstellen sind besonders geeignet: V. saphena im Knöchelbereich; V. radialis am Handgelenk; V. jugularis externa am Hals.
1–2 h vor der Punktion EMLA-Pflaster für die Lokalanästhesie der Punktionsstelle aufkleben; wegen der durch Prilocain bedingten Gefäßkonstriktion mind. 10 min vor der Punktion wieder entfernen, Reste abwischen.
Punktionsarm oder -bein durch einen Helfer gut fixieren, dann die Vene punktieren.
Fließt Blut in die Kanüle zurück, wurde die Vene getroffen. Stahlkanüle wegen der Perforationsgefahr jetzt nicht mehr weiter vorschieben, sondern nur noch die Kunststoffkanüle.
Kanüle danach sofort sicher fixieren.
Zentraler Venenkatheter
Die wichtigsten Indikationen für einen zentralen Venenkatheter sind:
große operative Eingriffe,
Messung des zentralen Venendrucks,
parenterale Ernährung,
Zufuhr von Zytostatika oder vasoaktiven Medikamenten,
wiederholte Blutentnahmen.
- Zentrale Venenzugänge bei Neugeborenen und Kindern:
- V. jugularis interna,
- V. jugularis externa,
- V. subclavia,
- V. femoralis.
Die Katheterisierung der V. jugularis interna oder der V. subclavia erfolgt bei kleinen Kindern in der Regel in Allgemeinnarkose! Dagegen kann die V. femoralis häufig unter leichter Sedierung katheterisiert werden. Bei Neugeborenen kann versucht werden, einen Silikonkatheter von peripher (Ellenbeuge, Knöchelgegend) – ohne Sedierung oder Narkose – vorzuschieben.
Die Katheteranlage sollte unter Ultraschallkontrolle erfolgen. Die Katheterspitze sollte bei Jugularis-, Subklavia- und peripher vorgeschobenen Kathetern in der V. cava superior liegen, bei Femoraliskathetern in der V. cava inferior. Die Lage wird EKG-gesteuert (z. B. mit α-Card) oder mit anschließendem Röntgenbild kontrolliert.
V. jugularis interna
Die Vene wird mit Seldinger-Technik katheterisiert; die rechte Vene sollte bevorzugt werden.
Praktisches Vorgehen
Narkose einleiten,
Kind auf den Rücken lagern, Kissen unter die Schultern legen,
Punktionsgebiet desinfizieren, dann mit sterilen Tüchern abdecken,
Kopf leicht zur Gegenseite drehen, außerdem etwas überstrecken, um die Haut zu straffen, dann Kopf mit Kissen oder zusammengerolltem Tuch abstützen.
Bei ultraschallgestützter Punktion: Schallkopf in sterile Schutzhülle verpacken. Je nach persönlichem Geschick: Punktion in Inline- oder Out-of-plane-Technik,
Punktion der Vene in Höhe des Schildknorpels unmittelbar lateral von der A. carotis in nur wenigen mm Tiefe.
- Liegt der Draht sicher in der Vene, wird der Stichkanal dilatiert, dann der Katheter vorgeschoben, auf korrekte Lage kontrolliert (Durchleuchtung) und sicher fixiert (am besten mit Naht). Für den Abstand vom Hautniveau bis zur Katheterspitze gelten in der Regel folgende Maße:
- Neugeborene und Säuglinge: ca. 4–6 cm,
- Kleinkinder: ca. 6–8 cm.
Komplikationen
Versehentliche Punktion (oder Katheterisierung!) der A. carotis,
Pneumothorax,
Punktion des Ösophagus oder der Trachea,
Verletzung von Nerven.
V. jugularis externa
Die Vene kann bei Kindern meist leicht punktiert werden, jedoch gelingt es in einem hohen Prozentsatz nicht, den Katheter in die obere Hohlvene vorzuschieben. Durch Verwendung eines J-Drahts wird die Erfolgsrate verbessert.
V. subclavia
Die V. subclavia kann bereits bei Neugeborenen katheterisiert werden; die Pflege ist einfach und das Kind wird durch den Katheter nur wenig gestört. Das Vorgehen entspricht weitgehend dem bei Erwachsenen, allerdings ist praktisch immer eine Narkose erforderlich.
Praktisches Vorgehen
Zunächst wie bei V. jugularis interna,
Kind auf dem Rücken lagern, Schultern durch kleines Kissen oder Laken unterpolstern, Kopf zur Gegenseite drehen, den Arm der Punktionsseite leicht nach unten ziehen, rechte Vene bevorzugen!
Kanüle vorschieben bis sicher Blut aspiriert werden kann (bei Säuglingen in ca. 1–1,5 cm Tiefe),
- dann Seldinger-Draht mit J-Spitze (gelegentlich auch mit geradem Draht) vorsichtig in das Gefäß einführen, nun den Katheter vorschieben (am besten unter Durchleuchtung mit abschließendem Röntgenbild), für den Abstand von der Haut bis zur Katheterspitze gelten zumeist folgende Maße:
- Neugeborene und Säuglinge: 4–6 cm,
- Kleinkinder: 6–8 cm.
Komplikationen
Wie beim Erwachsenen:
Pneumothorax,
Punktion der A. subclavia,
Punktion der Trachea,
Punktion der Aorta (bei linkem Zugang).
V. femoralis
Die Vene kann bei großen Eingriffen im Kopfbereich katheterisiert werden, weiterhin bei kardiopulmonaler Reanimation (wegen der leichten Zugänglichkeit). Bei großen Unterbaucheingriffen sollte dieses Verfahren wegen der erhöhten Thrombosegefahr dagegen nicht eingesetzt werden.
Die Vene verläuft etwa 4–5 mm innen (medial) von der A. femoralis. Die günstigste Einstichstelle befindet sich etwa 1 cm unterhalb der Leistenhautfalte. Die Komplikationsrate bei der Punktion ist gering.
Arterielle Kanülierung
Bei großen Eingriffen, wiederholten Blutentnahmen, dem Einsatz vasoaktiver Medikamente oder postoperativer Beatmung wird häufig eine arterielle Kanülierung durchgeführt. Für die Kanülierung kommen folgende Arterien infrage:
A. radialis,
A. ulnaris,
A. femoralis,
A. axillaris,
A. dorsalis pedis.
Punktionsort der ersten Wahl ist die A. radialis, gefolgt von der A. femoralis! Verwendet werden Kunststoffkanülen oder kurze, mit Seldinger-Technik eingeführte Katheter. Die Kanülierung erfolgt meist erst nach der Narkoseeinleitung.
Anhaltswerte für arterielle Kathetergrößen bei Kindern
<5 kgKG: 0,6–0,7 mm (26 oder 24 G)
5–30 kgKG: 0,9 mm (22 G)
>30 kgKG: 1,1 mm (20 G)
Praktisches Vorgehen
10.1007/978-3-662-50444-4_42.
Bei Blutentnahme vorsichtige Aspiration, da starkes Ansaugen die Gefäßinnenhaut schädigt.
Nur langsame Bolusinjektion von Kochsalz zur Spülung! Rasche Injektion kann die Flüssigkeit rückwärts in die A. subclavia oder A. carotis pressen; dabei Gefahr der zerebralen Luft- oder Gerinnselembolie.
Komplikationen
Die Kanülierung der A. radialis ist ein sicheres Verfahren. Bei Kanülierung der A. femoralis muss sorgfältig auf Durchblutungsstörungen des Beines (Ischämie) geachtet werden.
Endotracheale Intubation
Bei Neugeborenen und Säuglingen (<1 Jahr) sollte immer eine Intubationsnarkose durchgeführt werden. Für die übrigen Kinder gelten ähnliche Indikationen wie bei den Erwachsenen. Auch Neugeborene werden in Narkose intubiert, nicht im Wachzustand. Meist werden ND-Relaxanzien eingesetzt, Succinylcholin nur im Notfall (Vorinjektion von Atropin, ca. 0,01 mg/kgKG).
Die Intubation kann in tiefer Inhalationsnarkose oder mit Hilfe von Muskelrelaxanzien (10.1007/978-3-662-50444-4_11) durchgeführt werden und oral oder nasal erfolgen (Abb. 19.3).
Auch die nasotracheale Intubation wird unter direkter Laryngoskopie durchgeführt (10.1007/978-3-662-50444-4_8). Anschließend wird der mit Gel bestrichene Tubus durch das größere Nasenloch (oft rechts) in den Rachenraum eingeführt und von dort mit einer kleinen Magill-Zange in die Trachea vorgeschoben. Der Tubus darf vor der Intubation nicht abgeschnitten werden.
Auch bei Kindern aller Altersgruppen ist die Verwendung eines Videolaryngoskops ein gutes und sicheres Hilfsmittel, um die endotracheale Intubation zu erlernen.
Fiberendoskopische und videolaryngoskopische Intubation
Fiberbronchoskope und Videolaryngoskope (z. B. Glidescope) können bei Kindern aller Altersklassen bis hin zum Neugeborenen für die schwierige Intubation eingesetzt werden. Flexible Kinderbronchoskope passen – sofern der Adapter abgenommen wird – in Tuben bis zu einem inneren Durchmesser von 2,5 mm. Die Technik der fiberendoskopischen Intubation entspricht grundsätzlich der des Erwachsenen und kann oral oder nasal erfolgen, jedoch bestehen auch einige wichtige Besonderheiten.
Oberflächenanästhesie, Sedierung, Narkose
Bei kleinen Kindern ist die Intubation im Wachzustand mit erhaltener Spontanatmung und Oberflächenanästhesie das sicherste Verfahren. Soll unter Sedierung oder in flacher Narkose endoskopisch intubiert werden, kann durch eine Oberflächenanästhesie die Akzeptanz verbessert und die Gefahr des Laryngospasmus verringert werden. Vor Beginn der Endoskopie sollte ein Anticholinergikum injiziert werden, um die Sekretproduktion durch die Stimulation zu vermindern.
Bei Kindern im Vorschulalter kann die Intubation, nach Injektion von Ketamin in Kombination mit Midazolam, bei erhaltener Spontanatmung erfolgen. Bei korrekter Endoskopietechnik soll die Gefahr einer Hyperreagibilität der Atemwege durch Ketamin sehr gering sein.
Besonders ängstliche und unkooperative Kinder, bei denen nicht mit Schwierigkeiten bei der Maskenbeatmung gerechnet werden muss, können auch nach Einleitung der Narkose mit Sevofluran videolaryngoskopisch oder fiberendoskopisch intubiert werden. Dagegen ist die Anwendung von Propofol wegen der Gefahr der zu starken Sedierung mit Apnoe eher dem Erfahrenen vorbehalten.
Orale endoskopische Intubation
Dies ist die Standardtechnik. Bei der bronchoskopischen Intubation empfiehlt es sich, sehr flexible Spiraltuben zu verwenden, v. a. bei schwierigen anatomischen Verhältnissen.
Nasale fiberendoskopische Intubation
Bei wachen Neugeborenen und Säuglingen sollte die nasale endoskopische Intubation bevorzugt werden, da sie einfacher durchzuführen ist als die orale. Auch ist hierbei das Zubeißen oder das Wegschieben des Bronchoskops mit der Zunge nicht möglich. Allerdings besteht bei Kindern die Gefahr einer Verletzung vergrößerter Adenoide, sodass dann wegen der entstehenden Blutung keine Sicht mehr möglich ist. Für die nasale Intubation kann ein oraler Tubus eingeführt werden, der die Zunge von der Epiglottis abhebt und den Blick auf die Glottis verbessert.
Fiberendoskopische Intubation durch die Larynxmaske
Wie beim Erwachsenen können auch bei Kindern Endotrachealtuben durch eine Larynxmaske vorgeschoben werden. Am besten geeignet sind hierfür die speziellen Intubationslarynxmasken mit entsprechenden Endotrachealtuben.
Larynxmaske
Larynxmasken (Abb. 19.4) können auch bei Neugeborenen und Kindern eingesetzt werden. Im Vergleich zur Maskennarkose sollen hiermit seltener hypoxische Episoden auftreten. Weiterhin kann die Larynxmaske auch bei Kindern als Schiene für das Einführen eines Kinderbronchoskops verwendet werden. Die Aspiration von Sekreten und Blut aus dem Bereich oberhalb des Cuffs der Larynxmaske wird zumeist verhindert. Außerdem wird die Larynxmaske bei Kindern eingesetzt, die nicht zu intubieren sind.

Kontraindikationen
Im Wesentlichen gelten dieselben Kontraindikationen wie beim Erwachsenen.
Einführen der Larynxmaske
Die Auswahl der Maskengröße richtet sich nach dem Körpergewicht (Tab. 19.12). Die Maske darf gerade bei Kindern erst dann eingeführt werden, wenn die Narkose ausreichend tief ist, da sonst Husten oder ein bedrohlicher Laryngospasmus auftreten können. Die Narkose kann per Inhalation mit Sevofluran eingeleitet werden, alternativ i.v. mit Propofol, 3–4 mg/kgKG. Thiopental in der bei Kindern üblichen Dosierung dämpft möglicherweise die pharyngealen und laryngealen Reflexe nicht ausreichend.
| Maskengröße | Körpergewicht [kgKG] | Maximales Cuff-Volumen [ml] | Größter einführbarer Endotrachealtubus (ID) [mm] |
|---|---|---|---|
| 1 | <5 | 4 | 3,0 |
| 1,5 | 5–10 | 7 | 3,5 |
| 2 | 10–20 | 10 | 4,0 |
| 2,5 | 20–30 | 14 | 5 |
| 3 | 30–50 | 20 | 6 |
Die Technik des Maskeneinführens entspricht weitgehend der beim Erwachsenen (10.1007/978-3-662-50444-4_8). Die Maske wird mit einer glatten Bewegung so weit vorgeschoben, bis der Widerstand des oberen Ösophagussphinkters zu spüren ist. Danach wird die Manschette aufgeblasen, ohne den Schaft der Maske festzuhalten. Dabei tritt die typische Auswärtsbewegung der Maske auf, möglicherweise wölben sich auch Schildknorpel und Krikoid vor. Die Linie im Schaft sollte in der Mittellinie liegen. Unter kontrollierter Beatmung tritt gewöhnlich bei ca. 18 cm H2O ein Luftleck auf.
Schwierigkeiten beim Einführen der Maske
Bei den allermeisten Kindern lässt sich die Maske im ersten Versuch korrekt platzieren, Schwierigkeiten beim Einführen beruhen zumeist auf falscher Technik, großer Zunge oder hypertrophierten Tonsillen.
Für das Vorgehen bei Einführungsschwierigkeiten werden verschiedene Verfahren angegeben.
Praktisches Vorgehen bei Platzierungsschwierigkeiten
Herausziehen der Zunge: hierdurch entsteht mehr Platz,
Einführen mit Hilfe eines Laryngoskops,
Einführen mit partiell geblockter Manschette,
umgekehrtes Einführen der Maske mit nach hinten gerichtetem Lumen, dann beim Verspüren der hinteren Pharynxwand Rotation der Maske; durch dieses Manöver, auch als Rotationstechnik bezeichnet, wird die Zunge nach vorn geschoben und das Entlanggleiten der Maske an der hinteren Pharynxwand erleichtert.
Intraoperative Komplikationen
Die wichtigsten intraoperativen Schwierigkeiten und Komplikationen sind:
Laryngospasmus,
Dislokation der Maske,
pulmonale Aspiration.
Laryngospasmus
Der Laryngospasmus ist eine typische Komplikation der Kinderanästhesie, die auch während der Larynxmaskennarkose auftreten kann. Wichtigste Ursachen sind eine zu flache Narkose oder das Eindringen von Sekreten, Blut o.ä. in den Kehlkopf.
Dislokation der Maske
Wie beim Erwachsenen kann auch bei Kindern die Larynxmaske während der Operation verschoben werden, sodass eine korrekte Beatmung nicht mehr möglich ist und außerdem die Aspirationsgefahr erhöht wird. Undichtigkeiten treten häufig bei unzureichender Narkosetiefe mit Zunahme des Tonus der Pharynxmuskulatur auf, weiterhin bei Lagerungsmanövern, wenn hierfür der Maskenschaft nicht vom Beatmungssystem getrennt wird.
Die Dislokation der Larynxmaske ist sehr gefährlich und muss sofort erkannt und behoben werden!
Pulmonale Aspiration
Grundsätzlich besteht bei der Larynxmaske die Gefahr der pulmonalen Aspiration, da ein absolut dichter Sitz nicht erreicht wird. Auch befindet sich bei bis zu 10% der Kinder der Ösophagus im Bereich der Maske, sodass erbrochener oder regurgitierter Mageninhalt direkt in den Larynx gelangen kann. Zu den wichtigsten Ursachen der Aspiration bei liegender Larynxmaske gehören:
ungenügende Narkosetiefe,
Entfernen der Maske vor Rückkehr der Schutzreflexe.
Treten die ersten Zeichen der Regurgitation bzw. Aspiration auf, sollte das Kind in Kopftiefposition gebracht, die O2-Konzentration auf 100% erhöht, die Narkose vertieft und das Kind vorsichtig kontrolliert beatmet werden. Außerdem sollte das Lumen der Maske freigesaugt werden. Anschließend kann eine fiberendoskopische Untersuchung der Lunge erfolgen und die Bronchien, wenn erforderlich, abgesaugt werden. Wurde pulmonal aspiriert, sollte die Larynxmaske umgehend durch einen Endotrachealtubus ersetzt werden.
Wann soll die Maske entfernt werden?
Husten und Laryngospasmus sind die bekannten Gefahren der Narkoseausleitung bei Kindern. Diese Komplikationen können auch beim Entfernen der Larynxmaske auftreten, und zwar unabhängig davon, ob die Maske in tiefer Narkose oder nach Rückkehr der Schutzreflexe entfernt wird.
Larynxmaske bei schwierigem Atemweg
Die Larynxmaske kann auch beim schwierigen Atemweg des Neugeborenen oder Kleinkindes erfolgreich eingesetzt werden. Krikoiddruck erschwert das Einführen der Maske und sollte daher in solchen Situationen nicht angewandt werden.
Aufrechterhaltung der Narkose
Am häufigsten werden bei Kindern eine balancierte Anästhesie (Opioid + volatiles Anästhetikum) oder Inhalationsnarkosen durchgeführt, bei Bedarf ergänzt durch ND-Relaxanzien.
Totale intravenöse Anästhesie
Bei Kindern kann alternativ zur balancierten Anästhesie auch eine totale intravenöse Anästhesie mit Propofol und einem Opioid durchgeführt werden. Von den verfügbaren i.v. Anästhetika eignet sich wegen der guten Steuerbarkeit am besten Propofol, bei schmerzhaften Eingriffen kombiniert mit Remifentanil. Propofol muss für die TIVA wesentlich höher dosiert werden als beim Erwachsenen.
TIVA bei Kindern
- Propofol
- initialer Bolus von 2,5–5 mg/kgKG i.v. (je nach Alter des Kindes)
- kontinuierliche Infusion von 8–15 mg/kgKG/h, je nach erforderlicher Narkosetiefe
- bei Kombination mit Remifentanil: Reduktion von Propofol um 25% oder mehr
- Remifentanil
- 0,2–0,5 μg/kgKG/min
Die alleinige Infusion von Propofol eignet sich besonders für nichtchirurgische Maßnahmen, z. B. Kernspinuntersuchungen.
Beatmung während der Narkose
Manuelle Beatmung
Sie wird nur selten durchgeführt, da für alle Altersgruppen entsprechende Narkoserespiratoren zur Verfügung stehen. Bei Neugeborenen wird der Atembeutel des halbgeschlossenen Systems mit hoher Frequenz und kleinen Volumina manuell ausgedrückt. Eine Hyperventilation muss vermieden werden.
Die manuelle Beatmung ist in der Regel der maschinellen Beatmung nicht überlegen.
Maschinelle Beatmung
Die Narkosebeatmung erfolgt bei allen Altersgruppen im halbgeschlossenen Kreissystem. Low-flow- und Minimal-flow-Anästhesie sind auch bei Kindern möglich.
Grundeinstellung des Respirators bei Kindern
- Atemfrequenz
- Bis 10 kgKG:20-40/min
- 10–20 kgKG: 20–30/min
- 20–40 kgKG: 15–25/min
Atemzugvolumen: initial 7 ml/kgKG, bis ca. 10 ml/kgKG
- Atemminutenvolumen:
- Bis 10 kgKG ca. 200 ml/kgKG
- 10–20 kgKG ca. 150 ml/kgKG
- 20–40 kgKG ca. 100 ml/kgKG
Verhältnis von In- zu Exspiration: 1 : 1 bis 1 : 2
PEEP, wenn indiziert: initial 3–5 mbar, schrittweise um 2–3 mbar steigern
Inspiratorische O2-Konzentration: nur so hoch, dass paO2 im Normbereich
Die Beatmung sollte druckkontrolliert erfolgen, dabei sollten die arteriellen Blutgase im Normbereich liegen: paO2 60–80 mmHg, paCO2 35–45 mmHg.
Kontrolle der Atemfunktion
- Klinisch:
- Hautfarbe (Zyanose?),
- Thoraxexkursionen (seitengleich?),
- Atemgeräusche (Stethoskop),
- apparativ:
- Atemfrequenz,
- Inspirationsdruck,
- Atemvolumina,
- inspiratorische O2-Konzentration,
- Pulsoxymetrie,
- Kapnometrie,
- bei größeren Operationen: arterielle Blutgase.
Wärmeschutz
Schutz vor Auskühlung ist bei allen Kindern erforderlich. Besonders gefährdet sind Neugeborene und Kleinkinder. Darum muss bei allen Allgemeinnarkosen die Körpertemperatur kontinuierlich überwacht werden. Bis zum 2. Lebensjahr soll die Temperatur rektal gemessen werden.
Maßnahmen für den Wärmeschutz
Vorheizen des Operationssaals auf 24°C oder höher, bei >26°C bleiben die meisten Kleinkinder und selbst Frühgeborene normotherm,
Transport von Neugeborenen im Inkubator,
unnötiges Entkleiden vermeiden,
Infrarotstrahler während der Einleitung von Neugeborenen,
konvektive (servogesteuerte) Wärmedecke intraoperativ,Erwärmung der Atemgase (geringer Effekt),
angewärmte Infusionslösungen,
bei der Narkoseausleitung von Neugeborenen erneut Infrarotstrahler verwenden, eine leichte Hypothermie um 34–36°C am Narkoseende soll weder die Atemfunktion beeinträchtigen noch das Erwachen verzögern.
Flüssigkeitszufuhr
Die Infusionstherapie bei Kindern (Tab. 19.13) muss folgende Teilmengen berücksichtigen:
präoperatives Flüssigkeitsdefizit,
Erhaltungsbedarf,
intraoperativer Korrekturbedarf,
Blutverluste.
| Teilmenge | Volumen | Infusionslösung |
|---|---|---|
| Grundinfusion | 10 ml/kgKG/h | Vollelektrolytlösunga mit 1–2% Glukose oder Vollelektrolytlösung |
| Flüssigkeitstherapie | 10–20 ml/kgKG | Vollelektrolytlösung mit 1–2% Glukose oder Vollelektrolytlösung |
| Volumentherapie | 5–10 mg/kgKG | Albumin, Gelatine, HÄS |
| Transfusion | Nach Bedarf | EK, FFP, TK |
a Vollelektrolytlösung: mit Azetat oder Malat
Praktisches Vorgehen
Um das präoperative Flüssigkeitsdefizit so gering wie möglich zu halten, sollten Kinder bis zu 2 h vor der Operation klare Flüssigkeit (Abschn. 19.2.3) zu trinken erhalten.
Größere Flüssigkeitsdefizite sollten vom Pädiater möglichst vor der Narkose durch entsprechende Infusionstherapie ausgeglichen werden.
Bei größeren präoperativen Defiziten kann in der 1. Stunde eine Gesamtflüssigkeitszufuhr von 10–20 ml/kgKG/h erforderlich sein. Steigt hierunter der Blutzucker an, wird die glukosehaltige Vollelektrolytlösung reduziert oder beendet und stattdessen reine Vollelektrolytlösung zugeführt.
Um Hypoglykämien zu vermeiden, sollten Neugeborene, Säuglinge und Kleinkinder perioperativ Vollelektrolytlösungen mit 1–2%igem Glukosezusatz erhalten. Bei älteren Kleinkindern und bei Schulkindern können dagegen auch glukosefreie Vollelektrolytlösungen zugeführt werden.
Halb- oder Drittelelektrolytlösungen und reine Glukoselösungen dürfen wegen der Gefahr der lebensbedrohlichen Hyponatriämie nicht zugeführt werden
Für kurze Eingriffe (<1 h) ist eine intraoperative Flüssigkeitszufuhr nicht zwingend erforderlich, wenn sich präoperativ kein wesentliches Flüssigkeitsdefizit entwickelt hat, die Kinder postoperativ wieder trinken dürfen und die intraoperativen Blutverluste minimal sind, z. B. Zirkumzision, Hydrozele-OP, Leistenhernie-OP.
Bei mittelgroßen oder länger dauernden Eingriffen wird intraoperativ Flüssigkeit zugeführt. Basisflüssigkeit ist eine Vollelektrolytlösung mit 1–2%igem Glukosezusatz). Der Erhaltungsbedarf richtet sich nach dem Körpergewicht (10er Regel, Tab. 19.13). Hierbei müssen die Fastenstunden bzw. Nüchternzeiten berücksichtigt werden.
Bei Eingriffen mit zusätzlichen Flüssigkeitsverlusten durch Verdunstung, Gewebetrauma oder Verlust in dritte Räume muss der Erhaltungsbedarf entsprechend korrigiert werden (Tab. 19.13).
Bei Neugeborenen und Kleinkindern sollte die Flüssigkeit über Perfusoren infundiert werden, damit die zugeführte Menge genau kontrolliert werden kann.
Blutersatz
Je kleiner das Kind, desto schwieriger sind intraoperative Blutverluste einzuschätzen. Ab welchen Hämoglobinwerten bei sonst gesunden Kindern Blut transfundiert werden sollte, muss individuell ermittelt werden, da derzeit keine verbindlichen Transfusionstrigger für Kinder existieren (10.1007/978-3-662-50444-4_17). Hierbei ist zu beachten, dass bei Neugeborenen und jungen Säuglingen die kardialen Kompensationsreaktionen auf akute Blutverluste – HZV-Anstieg durch Steigerung der Herzfrequenz und des Schlagvolumens – eingeschränkt sind.
Kritische Hämoglobinwerte, die bei sonst gesunden Kindern nicht unterschritten werden sollten
1.–2. Lebenstag: 13 g/dl
3 Tage bis 2 Wochen: 11 g/dl
3 Wochen: 10 g/dl
4 Wochen: 9 g/dl
>4 Monate 7 g/dl, Hkt 21%
Praktisches Vorgehen
Bis die kritischen Schwellenwerte erreicht sind, werden Blutverluste mit Vollelektrolytlösungen im Verhältnis 3:1 oder Kolloiden (HES, Albumin, jeweils 1:1) ersetzt, weitere Blutverluste mit Erythrozytenkonzentraten.
Die Zufuhr von Erythrozytenkonzentraten kann bolusweise über eine 10- oder 20-ml-Spritze erfolgen, alternativ über einen Perfusor. Dosierungen: 5–15 ml/kgKG. Bei hypovolämischem Schock, Austauschtransfusionen und Operationen mit der Herz-Lungen-Maschine sind höhere Dosen erforderlich.
Die Gabe von 3 ml EK/kgKG erhöht die Hämoglobinkonzentration um ca. 1 g/dl. Die Wirkung von Bolusinjektionen kann direkt anhand des Blutdruckanstiegs kontrolliert werden.
Bei Neugeborenen sollte möglichst frisches Erythrozytenkonzentrat (bis 4 Tage alt) verwendet werden.
Frischplasma, Fibrinogen
Massive Blutverluste erfordern den Ersatz von Gerinnungsfaktoren (10.1007/978-3-662-50444-4_17). Empfohlen wird – wie beim Erwachsenen – ein ROTEM-basiertes Vorgehen.
Aufwachraum
Im Anschluss an die Operation werden die Kinder in den Aufwachraum gebracht. Sie bleiben dort so lange, bis sie wach sind und die Wirkung der Anästhetika abgeklungen ist. Postoperative Überwachung und Komplikationen: 10.1007/978-3-662-50444-4_32 und 10.1007/978-3-662-50444-4_33.
Spezielle Anästhesie bei Neugeborenen
Definitionen
Neugeborenenperiode: 0–28 Tage
Gewicht: 2.500–3.500 g
Länge: 48–52 cm
Unreifes Neugeborenes: <2.500 g, fehlende Reifezeichen
Frühgeborene s: Geburt vor der 37. Schwangerschaftswoche
Der Transport von Neugeborenen erfolgt in speziellen Transportinkubatoren. Vor dem Transport müssen ateminsuffiziente Kinder intubiert und, wenn erforderlich, beatmet werden. Hypovolämie, metabolische Azidose, Hypoglykämie, Hypokalzämie, Pneumothorax müssen vor dem Transport behandelt werden.
Der Operationssaal muss rechtzeitig vor der Operation auf 26–30°C erwärmt werden.
Zubehör für die Neugeborenenanästhesie
Wärmedecke, Infrarotstrahler
Atemmasken: 0, 1
Guedel-Tuben: 000, 00, 0
Endotrachealtuben oral u. nasal, 2,5, 3, 3,5
Laryngoskope gerade und gebogen: 0, 1
Gleitmittel für Tubus
Absauggerät
Absaugkatheter ab 5F
Narkoserespirator
Ösophagusstethoskop, präkordiales Stethoskop
Blutdruckmanschette: 3,75 cm breit
Pulsoxymeter
Kapnometer
EKG-Monitor
Elektrisches rektales Thermometer
Venenkanülen: Kunststoff 22–26 G; Butterfly: 20 G
Infusionslösungen: balancierte Elektrolytlösung, HES
Perfusoren
Blut (im Kühlschrank)
- Medikamente aufgezogen in Spritzen:
- Thiopental, Dosierung: 3–4 mg/kg KG
- Atropin, Dosierung: 0,01 mg/kg KG i.v.
- Succinylcholin, Dosierung: 2 mg/kg KG i.v.; 3 mg/kgKG i.m. (nur als Notfallmedikament!)
- ND-Relaxans, z. B. Atracurium, Dosierung: 0,3–0,5 mg/kgKG i.v. oder Rocuronium, Dosierung: 0,6 mg/kgKG
- Opioide, z. B. Remifentanil, Fentanyl
- Notfallmedikamente in Bereitschaft
Praktisches Vorgehen
Kind im Inkubator lassen, bis alle Vorbereitungen abgeschlossen sind.
Kind zur Einleitung in Isolierfolie einwickeln.
Alle Operationen in Intubationsnarkose durchführen. Narkose i.v. einleiten.
Die Intubation sollte am narkotisierten Kind erfolgen, nicht am wachen.
Tubus nicht weiter als 2 cm unterhalb der Stimmbänder vorschieben. Thorax sorgfältig auskultieren.
Tubus zusammen mit Guedel-Tubus sicher in Mundmitte fixieren.
Narkose bevorzugt balanciert. Relaxierung, wenn erforderlich, z. B. mit Atracurium.
Flüssigkeitsersatz: Basisbedarf 4 ml/kgKG/h Vollektrolytlösung mit 1–2% Glukosezusatz. Volumenersatz mit Plasmaexpandern, ab 10–15% Blutverlust mit Blut (10- oder 20-ml-Spritzen verwenden, vorher anwärmen).
Am Ende der Operation nichtdepolarisierende Muskelrelaxanzien antagonisieren: Rocuronium mit Sugammadex, andere ND-Relaxanzien mit 0,08 mg/kgKG Prostigmin + 0,01 mg/kgKG Atropin i.v.
Extubation erst, wenn Muskeltonus und Spontanatmung ausreichend sowie Körpertemperatur normal.
Intraoperative Überwachung
Beatmungsparameter,
Herztöne: Frequenz und Lautstärke,
Blutdruck,
EKG,
Pulsoxymeter,
Kapnometer,
Körpertemperatur (rektal) kontinuierlich.
Frühgeborene
Praktisches Vorgehen
Vor Narkosebeginn das kleinste Zubehör bereitstellen.
Atmung sorgfältig überwachen, bei Frühgeborenen treten häufig Apnoen auf – auch postoperativ!
Für ausreichenden Wärmeschutz sorgen. Frühgeborene reagieren extrem empfindlich auf Wärmeverlust e. Vorsicht beim Einsatz von Infrarotstrahlern: Verbrennungsgefahr!
Nicht zu viel Sauerstoff zuführen: Gefahr der Erblindung durch retrolentale Fibroplasie, wenn paO2 über dem Normwert liegt. Ist Lachgas kontraindiziert, wird O2 in Druckluft zugeführt.
Glukose 1–2% in Vollektrolytlösung infundieren: Hypoglykämie ist typisch für Frühgeborene.
Vorsicht bei der Flüssigkeitszufuhr. Volumenüberladung vermeiden. Spülflüssigkeiten und Medikamente mitbilanzieren.
Nekrotisierende Enterokolitis
Die nekrotisierende Enterokolitis ist eine lebensbedrohliche hämorrhagische Entzündung des Dünn- und Dickdarms. Betroffen sind v. a. sehr kleine Frühgeborene mit einem Körpergewicht von <1500 g. Die genaue Ursache der Erkrankung ist unbekannt, jedoch führt eine Abnahme der Darmdurchblutung zur Darmischämie, Nekrose, Darmperforation und Sepsis.
Durch den Verlust größerer Flüssigkeitsmengen in den ischämischen Darm können sich Hypovolämie, Blutdruckabfall, Lethargie und schließlich eine Apnoe entwickeln. Mit fortschreitender Aufblähung des Abdomens, Hypotension und Sepsis tritt eine zunehmende Hypoventilation mit Hyperkapnie und Hypoxämie ein, bei Sepsis auch eine disseminierte intravasale Gerinnung und Hypothermie und durch die Darmnekrose eine Hyperkaliämie.
Die anfängliche Behandlung besteht aus folgenden Maßnahmen:
Beseitigung der Dehydratation,
Entlastung des Abdomens,
Behandlung der respiratorischen und metabolischen Azidose und Hyperkaliämie.
Anästhesiologische Besonderheiten
Besteht eine Sepsis bei Ankunft im Operationssaal, muss ausreichend Volumen substituiert werden. Wegen der respiratorischen Insuffizienz müssen die Kinder meist mit hohen inspiratorischen O2-Konzentrationen beatmet werden. Bei schwerem Krankheitsbild sollte die i.v.-Anästhesie einer Inhalationsanästhesie vorgezogen werden. Von Nutzen ist neben einer ausreichenden Zahl von Venenkanülen für den Volumenersatz ein zentraler Venenkatheter.
Omphalozele und Gastroschisis
Die Omphalozele ist eine Herniation der Baucheingeweide in die Nabelschnurbasis, die sich kugelförmig nach außen vorwölbt. In der Omphalozele befinden sich Teile des Darms, eingehüllt in einen dünnen Sack.
Bei der Gastroschisis besteht eine Öffnung in der Bauchwand, durch die Eingeweide nach außen vorfallen. Eine bedeckende Membran ist nicht vorhanden.
Bei der Operation der Omphalozele und Gastroschisis werden die vorgefallenen Eingeweide in den Bauch zurückverlagert und der Defekt in der Bauchwand verschlossen. Bei großen Defekten ist ein mehrzeitiges Vorgehen erforderlich.
Anästhesiologische Besonderheiten
Neugeborene mit Omphalozele oder Gastroschisis sind durch folgende Faktoren gefährdet:
Wärmeverluste über die nach außen vorgefallenen Eingeweide,
Störungen des Wasser- und Elektrolyt-Haushalts durch Transsudation von Flüssigkeit aus den vorgefallenen Eingeweiden,
intraoperative Behinderung des venösen Rückstroms durch Kompression der unteren Hohlvene bei der Rückverlagerung der Eingeweide: Bradykardie und Blutdruckabfall, evtl. Herzstillstand,
postoperative Atembehinderung durch den Verschluss der Bauchwand.
Praktisches Vorgehen
Für den Transport die vorgefallenen Eingeweide mit steriler Kunststofffolie abdecken.
Magensonde einführen und Magen absaugen.
Venösen Zugang legen und Flüssigkeits- und Elektrolytdefizite ausgleichen.
Transfusionsblut vor Beginn der Operation bereithalten.
Im Wachzustand endotracheal intubieren.
Für die Narkose kein Lachgas zuführen, um eine Erweiterung der Darmschlingen zu vermeiden.
Zufuhr von Muskelrelaxanzien möglichst vermeiden, damit die Bauchdeckenspannung bei Verschluss des Defektes besser beurteilt werden kann.
Bei größeren Defekten: postoperative Nachbeatmung für 12–24 h.
Kongenitale Zwerchfellhernie
Bei der angeborenen Zwerchfellhernie ist ein Teil der Eingeweide in den Thorax verlagert und bewirkt eine respiratorische Insuffizienz durch Verschiebung des Mediastinums. Die Lunge der betroffenen Seite ist hypoplastisch und bei der Geburt nicht entfaltet. Nicht selten entwickelt sich ein Pneumothorax. Die Zwerchfellhernie muss nach einer Stabilisierungsphase umgehend operativ verschlossen werden.
Praktisches Vorgehen
Neugeborenes mit leicht erhöhtem Oberkörper auf die betroffene Seite lagern.
Magensonde legen und Magen absaugen.
Bei Ateminsuffizienz nicht mit dem Atembeutel beatmen, um eine Aufblähung der Eingeweide zu vermeiden.
Kind im Wachzustand intubieren, danach Narkose i.v. einleiten und ausreichend relaxieren. Kein Lachgas zuführen!
Beatmungsdruck so niedrig wie möglich halten.
Ösophagusatresie und tracheoösophageale Fistel
Am häufigsten ist der blind endende obere Ösophagus mit einer Fistel zwischen Trachea und distalem Ösophagussack. Zu den anästhesiologischen Besonderheiten gehören:
pulmonale Aspiration,
Verlegung der Atemwege.
Praktisches Vorgehen
Neugeborenes im Wachzustand intubieren und den Tubus über den Bereich der Fistel hinaus vorschieben, danach endotracheal absaugen.
Während der Narkose manuell beatmen.
Schlürfsauger im Ösophagus.
Pylorusstenose
Diese Erkrankung betrifft v. a. männliche Kinder im Alter von 3–6 Wochen. Der Muskel des Sphinkter pylori ist hypertrophiert und führt zu Obstruktion mit Erbrechen, Flüssigkeitsverlusten und hypochlorämischer Alkalose (Salzsäureverluste).
Anästhesiologische Besonderheiten
Typische präoperative Störungen sind Entwässerung und Alkalose; sie müssen präoperativ ausgeglichen werden. Bei der Narkose ist die Gefahr des Erbrechens mit pulmonaler Aspiration erhöht!
Praktisches Vorgehen
Magensonde einführen und den Magen kontinuierlich absaugen.
Flüssigkeitsdefizit mit NaCl-Lösung 0,9% ausgleichen, b. B. Kalium zusetzen. Hierfür ist gewöhnlich eine Zeit von 48 h erforderlich.
Operation erst, wenn Kind ausreichend rehydriert ist und Elektrolyte sowie Säure-Basen-Parameter im Normbereich liegen, nicht als Notfalleingriff!
Blitzeinleitung wie bei vollem Magen oder (von einigen Anästhesisten praktiziert) wache Intubation.
Für absolut ruhiges Operationsfeld bei der Spaltung des Pylorusmuskels sorgen.
Extubation erst, wenn Kind wach, bevorzugt in Seitenlage.
Regionalanästhesie bei Kindern
Grundsätzlich können bei Kindern aller Altersgruppen bis hin zu Früh- und Neugeborenen auch Nervenblockaden, Plexusanästhesien, Periduralanästhesien und Spinalanästhesien durchgeführt werden. Jedoch sind die regionalen Anästhesieverfahren bei vielen Anästhesisten nicht sonderlich beliebt, v. a. aus folgenden Gründen:
Ablehnung der schmerzhaften Punktion durch das wache Kind,
größere Erfahrung und Geschick des Anästhesisten erforderlich,
bei einigen Verfahren relativ großer Zeitaufwand,
Furcht vor Komplikationen.
Am wenigsten umstritten sind unter den regionalen Anästhesieverfahren die axilläre Plexusblockade und die Kaudalanästhesie, eingeschränkt auch die lumbale Periduralanästhesie.
Die wichtigsten Indikationen
Akutversorgung von Verletzungen beim nicht nüchternen Kind,
Vermeidung der endotrachealen Intubation und Beatmung, z. B. bei zu erwartenden Intubationsschwierigkeiten und postoperativen Atemstörungen (z. B. erhöhte postoperative Apnoegefahr bei Frühgeborenen),
frühe postoperative Analgesie.
Die Kontraindikationen für Regionalanästhesien bei Kindern entsprechen im Wesentlichen denen der Erwachsenen.
Allgemeines Vorgehen
Bei den meisten Kindern, v. a. in der Altersgruppe von unter 8 Jahren, muss der Block am schlafenden (bzw. anästhesierten) oder sedierten Kind angelegt werden, da zu erwarten ist, dass die Kinder auf die schmerzhafte Punktion mit heftiger Abwehr reagieren. Folgende Lokalanästhetika werden verwendet:
- Langwirkende Lokalanästhetika:
- Ropivacain, Maximaldosis 3 mg/kgKG,
- Bupivacain, Maximaldosis 2,5 mg/kgKG,
- Levobupivacain, Maximaldosis 2,5 mg/kgKG.
- Kurzwirkende Lokalanästhetika:
- Prilocain, Maximaldosis 5 mg/kgKG bei Neugeborenen und Säuglingen, 7 mg/kgKG bei Kindern >1 Jahr,
- Mepivacain, Maximaldosis 6 mg/kgKG,
- Lidocain, Maximaldosis 5 mg/kgKG.
Obere Plexusblockaden
Obere Plexusblockaden sind besonders für die Erstversorgung von Frakturen und Verletzungen der oberen Extremität geeignet und werden oft auch ohne wesentliche Sedierung von den Kindern akzeptiert, vorausgesetzt, der Anästhesist geht einfühlsam vor. Sedierung mit Propofol oder Ketamin ist häufig ratsam.
Der axilläre Plexusblock gilt bei kleinen Kindern als Methode der Wahl, v. a. wegen der einfachen Technik und der geringen Komplikationsrate. Hilfreich sind ein Nervenstimulator oder ein Ultraschallgerät, um das Nervengeflecht aufzusuchen. Die Kanüle sollte senkrecht zum Verlauf des Plexus eingestochen werden, um Verletzungen des Nervengeflechts zu vermeiden Bei korrekter Lage pulsiert die Kanüle.
Gebräuchliche Lokalanästhetika (Dosierung: Tab. 19.14):
Ropivacain 0,2% zur postoperativen Analgesie, 0,75% zur langwirksamen Anästhesie,
Prilocain 1% oder Lidocain 1% zur kurzwirksamen Anästhesie.
| Alter (Jahre) | ml |
|---|---|
| Neugeborene | 3 |
| 1–3 | 6–9 |
| 7–9 | 14–20 |
| 10–12 | 21–25 |
| 13–15 | 28–35 |
Sakralblock ( Kaudalanästhesie)
Die beim Kind einfach durchzuführende Kaudalanästhesie eignet sich für alle Eingriffe unterhalb des Nabels, weiterhin zur Schmerzbehandlung nach Eingriffen im Genital- und Analbereich.
Die Injektion erfolgt am schlafenden (anästhesierten) oder stark sedierten Kind in Seiten- oder Bauchlage durch den Hiatus sacralis (Abb. 19.5). Punktiert wird mit einer 22- oder 25-G-Kanüle, die ca. 1 cm in den Kaudalkanal vorgeschoben wird (Vorsicht: Gefahr der Duraperforation).
Gebräuchliche Lokalanästhetika:
Ropivacain 0,2%,
Bupivacain 0,125–0,25%.
Prilocain 1%
Über die Dosierung besteht keine Einigkeit, die Angaben bewegen sich zwischen 0,7 und 1,6 ml/Segment. Mit 1 ml/kgKG liegt man meistens richtig.
Mögliche Komplikationen:
i.v. oder subarachnoidale Injektion des Lokalanästhetikums,
Injektion in den Knochen,
- postoperativ:
- Harnverhalt,
- motorische Schwäche der Beine (besonders mit Bupivacain 0,5%),
- Erbrechen (bis zu 30%).
Blutdruckabfälle sind nicht zu erwarten, wenn die Blockade auf das Gebiet unterhalb von Th10 beschränkt wird.
Peniswurzelblock
Die Blockade der beiden dorsalen (sensiblen) Penisnerven mit Lokalanästhetika bewirkt eine gute, 12–24 h anhaltende Analgesie. Der Block eignet sich v. a. für die Schmerztherapie nach Zirkumzisionen, reicht allerdings nach Hypospadiekorrektur allein oft nicht aus, wenn auch an der Penisbasis operiert wurde. Dann empfiehlt sich die Kombination mit einem Kaudalblock. Die suprapubische Blockadetechnik weist die geringsten Komplikationen auf und sollte daher bevorzugt werden.
Praktisches Vorgehen
Der Block wird unmittelbar nach Einleitung der Allgemeinanästhesie angelegt (Abb. 19.6).
Das Kind wird für die Blockade auf den Rücken gelegt; danach wird die Symphyse mit einem Stift markiert, ebenso die beiden Einstichstellen knapp unterhalb der Symphyse, etwa 0,5–1 cm beidseits der Mittellinie.
Dann wird der Penis heruntergezogen und mit einem Pflaster am Oberschenkel fixiert.
Danach wird eine 25-G-Kanüle in Richtung auf den Nerv vorgeschoben und – nach Aspiration – das Lokalanästhetikum injiziert.
Dosierung des Lokalanästhetikums: 2×0,1 ml/kgKG Bupivacain 0,5%, maximal 10 ml.
Lumbale und thorakale Periduralanästhesie
Die Punktion des Periduralraumes kann auch bei Kindern mit der Widerstandsverlustmethode erfolgen (durch einen geschickten und erfahrenen Anästhesisten). Punktiert wird in Seitenlage am wachen, sedierten oder anästhesierten Kind. Bei kleinen Kindern werden 20- oder 22-G-Tuohy-Kanülen für die „Single-shot“-Anästhesie verwendet, hingegen 18- oder 20-G-Kanülen für die Katheterperiduralanästhesie. Sobald die Kanüle im Lig. flavum liegt, kann kein Kochsalz mehr aus der Spritze injiziert werden. Wird das Band durchstochen, lässt der Widerstand abrupt nach. Die Identifikation des Periduralraumes ist einfach, jedoch muss der nur geringe Abstand zwischen Haut und Periduralraum beim Vorschieben der Kanüle beachtet werden.
Nachteile der PDA
Nicht sicher vorhersehbare Wirkung,
schlechte Überprüfbarkeit der Anästhesieausdehnung,
Gefahr der Rückenmarkschädigung bei thorakaler PDA (daher sehr strenge Indikationsstellung).
Gebräuchliche Lokalanästhetika
Ropivacain 0,2–0,5%,
Bupivacain 0,25–0,5%,
Lidocain 2%, Prilocain 2% mit Adrenalin.
- Das jeweils erforderliche Volumen hängt vom Alter ab:
- 0–8 Jahre: ca. 0,95 ml/Segment,
- 8–11 Jahre: ca. 1,75 ml/Segment,
- 11–14 Jahre: ca. 2,2 ml/Segment.
Spinalanästhesie
Beim Kind lässt sich die Spinalanästhesie in der Regel leicht durchführen, selbst bei Früh- und Neugeborenen. Grundsätzlich ist die Methode bei den meisten Eingriffen unterhalb des Zwerchfells anwendbar. Jedoch Vorsicht: bei Kindern bis zum 1. Lebensjahr kann das Rückenmark bis in die Höhe von L3 herunterreichen. Punktionen sollten daher im Bereich von L4/L5 bzw. L5/S1 (Früh- und Neugeborene) durchgeführt werden. Der Abstand zwischen Haut und Liquorraum beträgt ca. 1–1,5 cm.
Kopfschmerzen als Komplikation scheinen bei Kindern nur sehr selten aufzutreten.
Das Kind im Aufwachraum
Für Kinder gelten die gleichen Grundsätze der postoperativen Überwachung und Schmerztherapie wie beim Erwachsenen (10.1007/978-3-662-50444-4_33). Kinder sollten postoperativ in einer ruhigen und freundlichen Umgebung überwacht werden. Die Anwesenheit der Eltern ist dabei in der Regel eine große Hilfe und wirkt sich beruhigend auf das Kind aus. Ein in der pädiatrischen Anästhesie erfahrener Facharzt muss im Notfall umgehend verfügbar sein.
Aufwachdelir
Sehr häufig entwickelt sich bei Kindern – unabhängig vom Anästhesieverfahren – im Aufwachraum ein sog. Aufwachdelir, gekennzeichnet durch Unruhe- oder Erregungszustände. Die Ursache ist unbekannt; Kinder im Alter zwischen 2 und 5 Jahren sind besonders häufig betroffen. Der Erregungszustand beginnt meist in den ersten 30 Minuten nach der Narkose und hält bis zu etwa 15 Minuten an, gelegentlich auch wesentlich länger.
Wesentliche Gefahren postoperativer Erregungszustände sind das Herausziehen von venösen und arteriellen Kathetern, Blasenkathetern und Drainagen sowie Selbstverletzungen und eine Beeinträchtigung des Operationsergebnisses.
Starke Erregungszustände müssen umgehend behandelt werden:
Schutz des Kindes vor Verletzungen und vor der Dislokation von Kanülen, Kathetern und Drainagen,
- medikamentöse Therapie:
- Fentanyl 1–2 ug/kgKG,
- Piritramid 0,05 mg/kgKG,
- Midazolam 0,02–0,1 mg/kgKG,
- Propofol 0,5–1 mg/kgKG,
- Clonidin 0,5 μg/kgKG,
- Dexmedetomidin 0,5 μg/kgKG.
PONV
Übelkeit und Erbrechen sind häufige postoperative Komplikationen bei Kindern. Die für Erwachsene geltenden Risikofaktoren sind bei ihnen allerdings nicht anwendbar. Für sie kann der POVOC (Postoperative Vomiting In Children Score) eingesetzt werden:
PONV-Risikoscore für Kinder (POVOC-Score )
Je 1 Punkt für folgende Faktoren:
OP-Dauer >30 Minuten
Alter >3 Jahre
Strabismus-OP, HNO-OP
Postoperativer Einsatz von Opioiden
Anamnese für PONV oder Reisekrankheit
Ab 3 Punkten liegt ein erhöhtes PONV-Risiko vor.
In diesem Fall kann eine Prophylaxe erfolgen:
TIVA mit Propofol statt Inhalationsanästhesie,
zusätzlich Gabe von Ondansetron, 0,1 mg/kgKG (maximal 4 mg) und/oder Dexamethason, 0,15 mg/kg KG (maximal 4 mg)
Ondansetron ist auch das Mittel der Wahl zur Behandlung von PONV, sofern es nicht bereits zur Prophylaxe gegeben worden ist. Dann kann Dimenhydrinat, 0,5 mg/kg (maximal 62 mg) eingesetzt werden. Droperidol, 0,01 mg/kg KG, ist dagegen das Mittel der letzten Wahl bei der Behandlung von PONV.
Postoperative Schmerztherapie
Die Schmerzreaktion des Kindes unterscheidet sich von der des Erwachsenen v. a. wegen der Unreife des zentralen Nervensystems. Weiterhin hängt die Schmerzreaktion vom Entwicklungsstadium des Kindes und zahlreichen situativen Faktoren ab, z. B. Angst und Furcht, übertriebene Aufmerksamkeit und Besorgtheit durch die Eltern. Nicht selten setzen Kinder Schmerzäußerungen ein, um besondere Aufmerksamkeit zu erlangen. Grundsätzlich gilt: je jünger das Kind, desto schwieriger die Beurteilung der Schmerzreaktion, v. a. wenn verbale Schmerzäußerung nicht möglich sind.
Schmerzreaktionen
Neugeborene
Auf Schmerzen reagiert das Neugeborene mit ungerichteten Bewegungen der oberen und unteren Extremitäten sowie Grimassieren und meist auch Weinen. Starke Schmerzen führen entsprechend zu stärkerem Weinen oder Schreien und motorischer Agitiertheit. Schreien kann aber, neben Schmerz, auch durch Hunger, Durst oder Ermüdung bedingt sein. Erfahrene Pflegekräfte erkennen zumeist die Ursache des Schreiens.
Säuglinge
Diffuse Körperbewegungen auf Schmerz nehmen ab und es entwickelt sich zunehmend eine Lokalisierung. Ein ca. 3 Monate altes Kind zieht auf einen Nadelstich die betreffende Extremität weg. Auf starke Schmerzen können Säuglinge mit Ess- und Schlafstörungen sowie Abwendung von den Eltern bzw. Bezugspersonen reagieren.
Krabbelalter
Der Schmerz wird mehr und mehr lokalisiert, die Schmerzreaktion komplexer: nicht nur Wegziehen einer betroffenen Extremität, sondern auch „Zähnezusammenbeißen“, Schaukeln, aggressives Verhalten und Schreien sind zu beobachten.
Vorschulalter
Mit 4–6 Jahren sind die Kinder sensorisch orientiert; weiterhin besteht eine sehr starke Abhängigkeit vom Familienverband. Eigene Schmerzverarbeitung ist nur wenig möglich, während die Eltern großen Einfluss auf die Schmerzreaktion haben. Darum sollte besonders in dieser Phase möglichst ein Elternteil im Aufwachraum zum Kind gelassen werden, damit es ihm gegenüber seine Schmerzen und Befürchtungen äußern kann.
Schulalter
Mit zunehmendem Alter nimmt die Schmerzschwelle zu, dafür gewinnt aber die kulturelle und psychologische Komponente des Schmerzes mehr und mehr an Bedeutung. Starke Schmerzen können zum regressiven Verhalten (Rückzug) des Kindes führen.
Einschätzung des Schmerzes
Da kleinen Kindern die Worte fehlen, um ihre Schmerzen zu beschreiben, müssen Ärzte und Pflegekräfte das Verhalten beobachten und auf Veränderungen physiologischer Parameter achten, um die postoperativen Schmerzen einzuschätzen. Geeignet ist die nachfolgend dargestellte Skala (Tab. 19.15).
| Beobachtung | Bewertung | Punkte |
|---|---|---|
| Weinen | Gar nicht | 0 |
| Stöhnen, jammern, wimmern | 1 | |
| Schreien | 2 | |
| Gesichtsausdruck | Entspannt, lächelnd | 0 |
| Mund verzerrt | 1 | |
| Mund und Augen grimassieren | 2 | |
| Rumpfhaltung | Neutral | 0 |
| Unstet | 1 | |
| Aufbäumen, krümmen | 2 | |
| Beinhaltung | Neutral | 0 |
| Strampeln, treten | 1 | |
| An den Körper gezogen | 2 | |
| Motorische Unruhe | Nicht vorhanden | 0 |
| Mäßig | 1 | |
| Ruhelos | 2 |
Auf dieser Skala bedeuten: 0 Punkte: keine Schmerzen, 10 Punkte: heftige Schmerzen.
Ab 4 Punkten: Schmerztherapie erforderlich, hohe Punktzahl: Schmerztherapie ist dringlich.
Die Einschätzung nach der Skala sollte in festen Abständen wiederholt werden. Zu beachten ist hierbei der Wachheitsgrad des Kindes. Schläft das Kind, ist keine Schmerztherapie erforderlich.
Ab dem 4. Lebensjahr werden auch Skalen für die Selbsteinschätzung eingesetzt, z. B. die Smiley-Skala (; 10.1007/978-3-662-50444-4_34), ab dem 6.–7. Lebensjahr auch Analogskalen mit einem Bereich von 0–10 (10.1007/978-3-662-50444-4_34).
Medikamentöse Schmerztherapie
Für die postoperative Schmerztherapie werden häufig Analgetika mit Regionalanästhesieverfahren kombiniert (Tab. 19.16). Bereits vor Anästhesiebeginn sollte dieses Vorgehen eingeplant werden.
| Eingriff | Maßnahme |
|---|---|
| Leistenhernien-OP, Orchidopexie | Kaudalblock oder Paracetamol, evtl. Opioid |
| Zirkumzision | Peniswurzelblock oder Paracetamol |
| Hypospadie | Kaudalblock, Paracetamol |
| Tonsillektomie | Paracetamol, evtl. Opioide |
| Abdominelle Eingriffe |
Paracetamol + Opioid, Transversus-abdominis-plane-Block (TAP) |
| Thorakale Eingriffe | Interkostalkatheter oder Paracetamol + Opioid |
| Klumpfußkorrektur | Ischiadikusblock, Kaudalkatheter, Paracetamol (+ Opioid) |
| Kniegelenk-OP, Oberschenkelosteotomie | 3-in-1-Block oder Paracetamol + Opioid |
| Beckenosteotomien | Kaudalkatheter oder Paracetamol + Opioid |
Für die Behandlung postoperativer Schmerzen werden – wie beim Erwachsenen – zwei Gruppen von Medikamenten eingesetzt:
Nicht-Opiod-Analgetika (nichtsteroidale antiinflammatorische Analgetika, NSAID und antipyretische Analgetika),
Opioide.
Zufuhr
Unmittelbar postoperativ werden die Analgetika i.v. oder rektal zugeführt. Intramuskuläre Injektionen sollten vermieden werden (10.1007/978-3-662-50444-4_34). Bei länger anhaltenden Schmerzen kann die Zufuhr über eine Perfusor erfolgen, einfache Tropfinfusionsflaschen mit Analgetika sollten hingegen nicht eingesetzt werden.
Im Aufwachraum werden Analgetika i.v. oder rektal zugeführt.
Nicht-Opioid-Analgetika
Nicht-Opioid-Analgetika sind die Basis der Schmerztherapie. Sie werden in fester, gewichtsbezogener Dosierung verabreicht. Gebräuchlich sind folgende Substanzen:
Paracetamol (i.v.-Präparat Perfalgan)
Metamizol (z. B.: Novalgin),
Diclofenac,
Ibuprofen.
Wichtigste Vorteile sind ihre lange Wirkdauer und die fehlende Atemdepression.
Paracetamol
Diese (auch fiebersenkende) Substanz wird nach wie vor am häufigsten eingesetzt, v. a. bei leichteren bis mäßigen Schmerzen. Die analgetische Wirkung ist eher schwach, eine entzündungshemmende Wirkung fehlt, die Thrombozytenfunktion wird nicht gestört. Bei der postoperativen Schmerztherapie gibt es für die meisten Kinder wirksamere NSAR-Substanzen als Paracetamol.
Paracetamol kann rektal, p. o. oder i.v. zugeführt werden. Nach rektaler Zufuhr werden Spitzenkonzentrationen im Blut erst nach 2–3 h erreicht, daher ist, z. B., direkt nach einer Adenotomie keine Wirkung zu erwarten, selbst wenn die Substanz unmittelbar nach der Narkoseeinleitung gegeben wurde. Außerdem wird Paracetamol häufig unterdosiert. Um therapeutische Konzentrationen im Blut zu erreichen, sollten initial 40 mg/kgKG zugeführt werden, danach 20 mg/kgKG alle 6–8 h. Die maximale Therapiedauer für Paracetamol beträgt 3 Tage (<3 Monate: 2 Tage). Während einer Therapie mit Paracetamol ist die Angabe und Dokumentation der Tageshöchstdosis zwingend vorgeschrieben!
Paracetamol ist lebertoxisch und die häufigste Ursache für ein Leberversagen bei Kindern. Darum muss die Tageshöchstdosis obligatorisch überprüft werden
Bei fieberhaften Viruserkrankungen mit Dehydratation und Hypovolämie muss nach Zeichen der Lebertoxizität gesucht werden. Möglicherweise begünstigt Paracetamol auch das Auftreten von Asthma. Es sollte daher bedacht werden, dass für die Schmerztherapie bei Kindern bessere NSAR-Substanzen verfügbar sind als Paracetamol.
Dosierung von Paracetamol (z. B. ben-u-ron und andere Generika) bei Kindern
rektal: zu Beginn 40 mg/kgKG (Neugeborene 20 mg/kgKG), danach 20 mg/kgKG alle 6–8 h
oral: zu Beginn 20 mg/kgKG, danach 15 mg alle 4–8 h
intravenös: 15 mg/kgKG als Kurzinfusion über 15 min (ab 1 Jahr)
Maximaldosen: 90 mg/kgKG/Tag; <3 Monate 60 mg/kgKG/Tag
Ibuprofen
Diese Substanz ist stärker analgetisch wirksam als Paracetamol und wird häufig im Kindesalter eingesetzt, besonders bei Knochen- und Weichteilschmerzen. Sie kann oral (z. B. als Nurofensaft) und rektal zugeführt werden.
Dosierung von Ibuprofen
Dosis: 10 mg/kgKG alle 8 Stunden
Tagesmaximaldosis 40 mg/kgKG
Bei Leber- und Nierenerkrankung ist die Ausscheidung von Ibuprofen eingeschränkt.
Bei vorbestehender Nierenerkrankung darf Ibuprofen nicht eingesetzt werden.
Als Nebenwirkungen können auftreten:
Bauchschmerzen,
Übelkeit,
Gastritis.
Sie sind aber bei Kurzzeitanwendung sehr selten.
Diclofenac
Wie Ibuprofen ist auch Diclofenac bei Knochen- und Weichteilschmerzen gut wirksam. Diese Substanz kann rektal oder i.v. verabreicht werden. Kontraindikationen für eine Gabe sind eine erhöhte Blutungsneigung und eine vorbestehende Nierenerkrankung.
Dosierung von Diclofenac (z. B. Voltaren)
Dosis: 1 mg/kgKG alle 8 Stunden, rektal
Tagesmaximaldosis 3 mg/kgKG
Metamizol
Die Substanz wirkt mittelstark analgetisch, außerdem fiebersenkend und spasmolytisch. Sie kann ohne spezielle Gefahren auch bei Kindern angewandt werden. Indiziert ist Metamizol bei starken postoperativen Schmerzen. Die Zufuhr erfolgt i.v., rektal oder oral. Bei Säuglingen unter 3 Monaten oder unter 5 kgKG ist eine strenge Indikationsstellung erforderlich.
Dosierung von Metamizol (z. B. Novalgin, Novaminsulfon, Baralgin)
Dosis: 10–20 mg/kgKG i.v. als Kurzinfusion. 1- bis 4-mal pro Tag
Tagesmaximaldosis 80 mg/kgKG
Acetylsalicylsäure (ASS)
ASS kann bei Kindern in seltenen Fällen zu Hirnödem mit Leberfunktionsstörungen (Reye-Syndrom ) führen. Daher sollte diese Substanz nicht mehr verwendet werden.
Opioidanalgetika
10.1007/978-3-662-50444-4_34
Sedierung und Analgesie außerhalb des Operationssaals
Bei Kindern werden zahlreiche diagnostische oder therapeutische Maßnahmen außerhalb des Operationssaals durchgeführt. Häufig ist hierfür eine Sedierung mit Medikamenten erforderlich, um die Kinder ruhigzustellen oder eine bessere Kooperation zu erreichen. Meist werden die Maßnahmen ohne Anästhesisten durchgeführt. Ist jedoch eine tiefe Sedierung erforderlich, sollte ein Anästhesist beteiligt werden.
Sedierungsstadien
In Anlehnung an die American Academy of Pediatrics und die ASA unterscheidet die DGAI die in Tab. 19.17 aufgeführten Sedierungsstadien.
| Sedierungsgrad | Benennung | Kennzeichen |
|---|---|---|
| I | Minimale Sedierung (Anxiolyse) | Erweckbar durch Ansprechen, volle Kontrolle über die Atemwege, Spontanatmung nicht eingeschränkt |
| II | Moderate Sedierung | Erweckbar durch Berührung und Ansprechen, Schutzreflexe erhalten, Atemwegskontrolle ohne Hilfsmittel |
| III | Tiefe Sedierung | Nicht unmittelbar erweckbar, Schutzreflexe teilweise aufgehoben, Atemwegskontrolle teilweise fehlend |
| IV | Allgemeinanästhesie | Tief bewusstlos und schmerzfrei, vollständiger Verlust der Schutzreflexe und der Atemwegskontrolle |
Risiken der Sedierung
Die wichtigsten Risiken der Sedierung sind:
Verlust der Atemwegsschutzreflexe,
Verlegung der Atemwege durch die zurückfallende Zunge,
Atemdepression,
Herzstillstand durch Hypoxie bzw. O2-Mangel.
Diese Risiken bestehen v. a. bei tiefer Sedierung, nicht hingegen bei wacher Sedierung. Darum müssen Kinder mit tiefer Sedierung lückenlos überwacht werden, und zwar durch einen Arzt, der die lebensrettenden Maßnahmen bei Kindern sicher beherrscht.
Substanzen für die Sedierung
Hauptziel der Sedierung ist ein angstfreies Kind, an dem die erforderliche Maßnahme ohne Abwehrbewegung und ohne Schmerzen durchgeführt werden kann. Da bei tiefer Sedierung Aspirationsgefahr besteht, muss das Kind nüchtern sein. Bei schmerzhaften Maßnahmen sollte ergänzend eine Lokalanästhesie durchgeführt werden. Von Anästhesisten werden häufig folgende Substanzen für die Sedierung verwendet:
-
Midazolam (z. B. Dormicum): für die minimale Sedierung/Anxiolyse
- 6 Monate bis 5 J: 0,05-0,1 mg/kgKG i.v.,
- 6–12 J: 0,025–0,05 mg/kgKG i.v.,
- >12 J: 2–2,5 mg i.v. als Einzeldosis.
- Per os: 0,4–0,5 mg/kgKG
- Rektal 0,5–1 mg/kgKG; maximal 15 mg
- Intranasal: 0,2–0,3 mg/kgKG
- Propofol: für tiefere Sedierungsstadien; ca. 3 mg/kgKG i.v. bei längeren Prozeduren 6–10 mg/kgKG/h über Perfusor.
- Esketamin : tiefe Sedierung: ca. 0,5–1 mg/kgKG i.v., danach alle 10–15 min 0,25–0,5 mg/kgKG oder kontinuierlich 1–2 mg/kgKG/h.
- Remifentanil: nach Wirkung titriert, ca. 0,05–0,3 μg/kgKG/min mit erhaltener Spontanatmung.
Wenn möglich sollte bei Sedierungen auf einen „Medikamentenmix“ verzichtet werden, um Wechselwirkungen, verlängerte Wirkzeiten und Komplikationen zu vermeiden. Opioide sollten nur bei schmerzhaften Eingriffen verwendet werden (Atemdepression!).
Überwachung der Sedierung
Neben der klinischen Überwachung von Atmung, Herzfrequenz, Bewusstsein und Reaktion auf Stimuli, sollten für die Sedierung ab Grad III folgende Überwachungsgeräte eingesetzt werden:
EKG-Monitor,
nichtinvasive Blutdruckmessung,
Pulsoxymeter,
bei tiefer Sedierung: Kapnometrie über Nasensonde. Hiermit kann schnell ein Atemstillstand festgestellt werden.
Bei tiefer Sedierung sollte das Kind kontinuierlich durch eine nur dafür zuständige Person, vorzugsweise ein Anästhesist oder Intensivmediziner mit spezieller Erfahrung, klinisch überwacht werden. Auch muss das Instrumentarium zur sofortigen Beatmung bereitstehen: Respirator, Intubationszubehör, Larynxmaske oder andere supraglottische Atemwege, Absauggerät, Defibrillator.
Ambulante Anästhesie
Um Kosten zu sparen und Wartelisten abzubauen, werden auch bei Kindern die üblichen Standardeingriffe ambulant durchgeführt. Neben der Kostenentlastung weisen ambulante Operationen aber auch für die Kinder und ihre Familie erhebliche Vorteile auf, da hierdurch ein Teil der bei stationärer Behandlung häufigen Verhaltensauffälligkeiten wie Schlafstörungen, Einnässen und andere regressive Verhaltensweisen, seltener auftreten. Störungen des Familienlebens sind geringer, außerdem wird das Risiko krankenhauserworbener Infektionen gesenkt.
Auswahlkriterien für ambulante Eingriffe
Gut geeignet für ambulante Eingriffe sind v. a. ansonsten gesunde Kinder, aber auch Kinder mit medikamentös gut eingestellten Erkrankungen wie Asthma oder Epilepsie.
Vorbestehende Erkrankungen
Schnupfen
Etwa ¼ aller Kinder kommt mit einer „laufenden Nase“ in die Ambulanz. Meist handelt es sich um eine nichtinfektiöse Rhinitis oder eine Infektion der Adenoide. Bei beiden Erkrankungen besteht kein Grund, den Eingriff zu verschieben, da keine Besserung zu erwarten ist.
Infektionen der Atemwege
Klinisch manifeste Infektionen des Respirationstraktessollten als Kontraindikation für den elektiven ambulanten Eingriff angesehen werden, da hierdurch die Gefahr postoperativer respiratorischer Komplikationen erhöht wird, möglicherweise auch das Auftreten einer Myokarditis im Zusammenhang mit der virämischen Phase der Erkrankung.
Herzgeräusche
Besonders bei Kindern im 1. Lebensjahr sollten bis dahin nicht bekannte Herzgeräusche zur weiteren Diagnostik veranlassen. Danach sollte neu entschieden werden.
Herzfehler
Nichtkorrigierte komplexe Herzfehler sind immer eine Kontraindikation für ambulante Operationen. Hingegen sollte bei unkomplizierten, klinisch nicht auffälligen Fehlern (z. B. kleiner Vorhofseptumdefekt) oder asymptomatischen korrigierten Fehlern individuell entschieden werden.
Untere Altersgrenze
Die untere Altersgrenze bei sonst gesunden Kindern richtet sich v. a. nach der Erfahrung des Anästhesisten und des Pflegepersonals sowie den vorhandenen Ressourcen. So können in Häusern der Maximalversorgung und in Spezialkliniken auch bei reifen Neugeborenen kleinere diagnostische oder therapeutische Eingriffe, wie z. B. Augenuntersuchungen oder MRT, ambulant erfolgen, wenn die Möglichkeit einer stationären Aufnahme gegeben ist.
Frühgeborene und ehemalige Frühgeborene bis zu einem postkonzeptionellen Alter von mindestens 50 Wochen sollten nicht ambulant anästhesiert werden.
Für die Versorgung in nichtspezialisierten Praxen wird häufig eine untere Altersgrenze von 6 Monaten bis zu 1 Jahr festgelegt.
Eingriffe
Im Wesentlichen gelten ähnliche Kriterien wie bei Erwachsenen (10.1007/978-3-662-50444-4_30). Eingriffe an der Körperoberfläche ohne Eröffnung einer Körperhöhle stellen den wichtigsten Anteil dar.
Präoperative Untersuchungen
Ein präoperatives Screening kann bereits einige Tage vor dem Eingriff durch einen Kinderarzt erfolgen oder durch die Ärzte der Ambulanz. Sieht der Anästhesist das Kind am Tag der Operation zum ersten Mal, sollte er eine körperliche Untersuchung durchführen und hierbei sein Augenmerk auf Herz und Lunge richten. Insbesondere sollten akute respiratorische Infekte ausgeschlossen werden. Für Laborwerte gilt:
Routinelaboruntersuchungen für ambulante Eingriffe sind überflüssig, da die meisten Kinder gesund sind.
Prämedikation
Ambulante Kinder werden im Allgemeinen nicht prämediziert. Im Einzelfall sollte jedoch auf eine Prämedikation nicht verzichtet werden, besonders bei sehr ängstlichen oder agitierten Kindern, aber auch bei in kurzen Abständen wiederholten Eingriffen oder Maßnahmen.
Midazolam
Sollen die Kinder prämediziert werden, gilt Midazolam als Substanz der Wahl, da hierdurch der Entlassungszeitpunkt nach der Operation nicht verzögert und auch die Rate der stationären Aufnahmen nicht erhöht wird.
EMLA-Pflaster
Ist die i.v.-Einleitung geplant, sollte 60–90 min vorher EMLA-Pflaster angewandt werden.
Einsatz der Larynxmaske
Die meisten ambulanten Eingriffe einschließlich Adenotomie, Zahnextraktionen und Strabismuschirurgie können in Larynxmaskennarkose durchgeführt werden. Hierdurch lässt sich der Einsatz von Muskelrelaxanzien vermeiden, ebenso ein intubationsbedingter postoperativer Stridor.
Wird die Larynxmaske verwendet, sollte die Narkose mit Propofol eingeleitet oder die Larynxmaske in tiefer Inhalationsnarkose eingeführt werden. Thiopental steigert die Atemwegsreflexe und ist daher weniger geeignet.
Flüssigkeitszufuhr
In der Regel ist kein Volumenersatz erforderlich. In folgenden Situationen sollte jedoch intraoperativ balancierte Elektrolytlösung zugeführt werden:
nach einer längeren Nüchternheitsphase,
bei Eingriffen mit erhöhter Blutungsgefahr, z. B. Adenotonsillektomien,
bei Eingriffen mit erhöhter Rate postoperativen Erbrechens.
Postoperative Analgesie
Durch intraoperative Lokalanalgesie kann der Bedarf an Analgetika in der postoperativen Phase hinausgezögert werden. Zu den gebräuchlichen Verfahren gehören die Wundinfiltration, periphere Nervenblockaden und der Sakralblock (Tab. 19.16).
Nichtsteroidale Analgetika (NSAID)
Sie bilden die Grundlage der postoperativen Analgesie für ambulante Eingriffe. Zu den gebräuchlichsten Substanzen gehört das Paracetamol, p.o. oder rektal zugeführt (Dosierung: Abschn. 19.12.3).
Es ist üblich, die erste Dosis der NSAID unmittelbar nach der Narkoseeinleitung rektal (z. B. 40 mg/kgKG Paracetamol) zuzuführen, um eine optimale postoperative Analgesie zu erreichen.
Opioide
Länger wirkende Opioide sollten ambulant operierten Kindern nicht verabreicht werden: Sie führen zu starker postoperativer Sedierung und erhöhen die Häufigkeit von Übelkeit und Erbrechen. Nur in Ausnahmefällen, v. a. bei Nichtansprechen auf NSAID und/oder lokale Analgesie, kann es sinnvoll sein, starke akute Schmerzen mit Fentanyl i.v. zu beseitigen.
Grundsätzlich sollte das Kind erst nach Hause entlassen werden, wenn die Schmerzen unter Kontrolle sind.
PONV
Übelkeit und Erbrechen sind häufige Komplikationen der ambulanten Kinderanästhesie: Adenotomie/Tonsillektomie bis zu 70%, Strabismuschirurgie bis zu 80%, Korrektur abstehender Ohren bis zu 60%. Während Kinder unter 3 Jahren fast nie betroffen sind, steigt die Häufigkeit ab dem 3. Lebensjahr sprunghaft an. Weitere begünstigende Faktoren sind:
Opioide,
frühe postoperative Mobilisierung,
zu frühe orale Flüssigkeitszufuhr.
Eine routinemäßige antiemetische Prophylaxe wird nur für Hochrisikogruppen (Abschn. 19.11) empfohlen. Bei Adenotomien/Tonsillektomien kann mit 0,15 mg/kgKG Dexamethason eine zuverlässige PONV-Prophylaxe erreicht werden, auch sollen hierdurch postoperative Schmerzen vermindert werden. Behandlung von PONV (Abschn. 19.11).
Entlassungskriterien
Die Entscheidung über die Entlassung des Kindes darf niemals schematisch erfolgen, sondern nur individuell unter Berücksichtigung von Eingriff, Narkoseverfahren, Stridor nach der Extubation, postoperativen Schmerzen, Übelkeit und Erbrechen, Familiensituation usw.
Die Entlassungszeit nach einer Intubationsnarkose beträgt etwa 2 h, jedoch sollte auch hier individuell entschieden werden.
Anhaltende motorische Blockade der unteren Extremität nach Sakralblock ist kein Hinderungsgrund für die Entlassung von Säuglingen oder Krabbelkindern. Bei älteren Kindern sollte jedoch die Rückkehr der Motorik abgewartet werden.
Vor der Entlassung müssen die Eltern eindeutige und ausreichende Instruktionen für die Nachsorge des Kindes erhalten. Hierzu gehören v. a. die postoperative Analgesie und Verhaltensregeln für die postoperative Phase (Nahrungsaufnahme, Ruhezeiten, Verkehrsfähigkeit, Überwachen), Verhalten bei Probleme oder Komplikationen mit Angabe von Kontaktmöglichkeiten (Telefonnummer angeben).
Entlassungskriterien für ambulante Eingriffe
Normale Vitalfunktionen
Pulsoxymetrisch bestimmte SO2 >95% unter Raumluftatmung
Ausreichende Schutzreflexe der Atemwege
Bewusstseinslage wie vor der Operation
Kein Stridor, keine respiratorische Insuffizienz
Keine Narkosezwischenfälle
Keine Blutungen oder andere chirurgische Komplikationen
Geringer oder kein Schmerz
Geringe oder keine Übelkeit/Erbrechen
Entlassung durch den Chirurgen oder Anästhesisten
Mündliche und schriftliche Instruktionen für die Begleitpersonen
Transportbegleitung durch Erwachsenen
Stationäre Aufnahme
Die Häufigkeit einer stationären Aufnahme nach geplanten ambulanten Eingriffen wird mit 0,3–2% angegeben. Die wichtigsten Gründe sind Erbrechen und starke Schmerzen, weiterhin chirurgische oder anästhesiologische Komplikationen, v. a. ein Stridor nach Intubationsnarkosen.
Contributor Information
Collaborators: Tobias Fink and Tilmann Müller-Wolff
Nachschlagen und Weiterlesen
- [1].Becke K, Eberius C, Siebert C, Kretzt FJ. Memorix Kinderanästhesie. Stuttgart: Thieme; 2011. [Google Scholar]
- [2].Frei FJ, Erb T, Jonmarker C, Sümpelmann R, Werner O. Kinderanästhesie. 4. Berlin Heidelberg: Springer; 2009. [Google Scholar]
- [3].Hilgendorff A, Dürr G. Ich hab’ mir wehgetan - Kindern Verletzungen erklären. Stuttgart: Thieme; 2006. [Google Scholar]
- [4].Kretz FJ, Becke K. Anästhesie und Intensivmedizin bei Kindern. Stuttgart: Thieme; 2007. [Google Scholar]
- [5].Jöhr M. Das nicht-kooperative Kind – Prophylaxe, Vorgehen, Tipps. Anästh Intensivmed. 2015;56:475–483. [Google Scholar]
- [6].Jöhr M. Kinderanästhesie. 8. München: Elsevier; 2013. [Google Scholar]
- [7].Reich A (20010) Regionalanästhesie im Kindesalter. Uni-Med, Bremen Boston London
- [8].Weiss M, Gerber A. Geblockte Tuben bei Kindern – Rationaler und sicherer Einsatz. AINS. 2012;47:232–237. doi: 10.1055/s-0032-1310411. [DOI] [PubMed] [Google Scholar]
- [9].Zernikow B. Schmerztherapie bei Kindern, Jugendlichen und jungen Erwachsenen. Berlin Heidelberg: Springer; 2015. [Google Scholar]
Internet
- [10].DAGI (2013) DGAInfo: Einsatz von Lachgas zur minimalen Sedierung von Kindern in der Zahnheilkunde. www.dgai.de
- [11].DGAI (2011) Narkosen durch pädiatrische Intensivmediziner. www.dgai.de
- [12].DGAI (2010) Analgosedierung für diagnostische und therapeutische Maßnahmen im Kindesalter. www.dgai.de
- [13].DGAI (2007). Handlungsempfehlungen zur präoperativen Diagnostik, Impfabstand und Nüchternheit im Kindesalter. Empfehlungen des Wissenschaftlichen Arbeitskreises Kinderanästhesie. www.dgai.de
- [14].DGAI (2007). Empfehlungen zur perioperativen Infusionstherapie bei Neugeborenen, Säuglingen und Kleinkindern. www.dgai.de
- [15].DGAI (2007) Handlungsempfehlungen zur Regionalanästhesie bei Kindern. www.dgai.de
- [16].DGAI (2007) Handlungsempfehlung zur perioperativen Schmerztherapie. www.dgai.de
- [17].DGAI (2007) Empfehlungen zur ambulanten Anästhesie bei Neugeborenen, Säuglingen und Kleinkindern. www.dgai.de
- [18].DGAI (2007) Handlungsempfehlung zur Risikoeinschätzung, Prophylaxe und Therapie von postoperativem Erbrechen im Kindesalter. www.dgai.de
- [19].DGAI (2016) S1-Leitlinie Perioperative Infusionstherapie beim Kindk. www.awmf.org