Abstract
Schwangerschaft und Geburtsvorgang führen zu physiologischen Veränderungen, die für die geburtshilfliche Anästhesie von großer klinischer Bedeutung sind. Sie bestimmen nicht nur die Auswahl der Anästhetika und des Narkoseverfahrens für geburtshilfliche Eingriffe, sondern gehen auch mit spezifischen Gefahren für die Gebärende und den Feten einher, die das anästhesiologische Vorgehen wesentlich bestimmen. Durch eine weitgehende Standardisierung der geburtshilflichen Anästhesie ist die Häufigkeit primär anästhesiebedingter Todesfälle in der Geburtshilfe auf ca. 2% gesunken.
Ein Weib, wenn sie gebiert, so hat sie Traurigkeit: denn ihre Stunde ist gekommen. Wenn sie aber das Kind geboren hat, denket sie nicht mehr an die Angst um der Freude willen, dass der Mensch zur Welt geboren ist. (Johannes 16.21)
Schwangerschaft und Geburtsvorgang führen zu physiologischen Veränderungen, die für die geburtshilfliche Anästhesie von großer klinischer Bedeutung sind. Sie bestimmen nicht nur die Auswahl der Anästhetika und des Narkoseverfahrens für geburtshilfliche Eingriffe, sondern gehen auch mit spezifischen Gefahren für die Gebärende und den Feten einher, die das anästhesiologische Vorgehen wesentlich bestimmen. Durch eine weitgehende Standardisierung der geburtshilflichen Anästhesie ist die Häufigkeit primär anästhesiebedingter Todesfälle in der Geburtshilfe auf ca. 2% gesunken.
Physiologische Grundlagen
Physiologische Veränderungen durch die Schwangerschaft und den Geburtsvorgang, die für die Anästhesie von Bedeutung sind, betreffen v. a.:
Respirationstrakt und Atmung,
Herz und Kreislauf,
Blutzusammensetzung,
Verdauungstrakt.
Respirationstrakt und Atmung
Anatomische Veränderungen
Die Schleimhäute in Nasen-Rachen-Raum, Kehlkopf, Trachea und Bronchien werden vermehrt durchblutet. Sie sind daher geschwollen und gerötet und leicht verletzbar, z. B. beim Einführen von Tuben oder Sonden.
Der wachsende Uterus schiebt das Zwerchfell um ca. 4 cm nach oben. Dennoch nimmt die Vitalkapazität der Lungen nicht ab, weil kompensatorisch die Seiten- und Tiefendurchmesser des Thorax um etwa je 2 cm zunehmen. Hierdurch wird die Stellung der Rippen abgeflacht. Zusätzlich werden die Bauchmuskeln schlaffer und die Beweglichkeit des Zwerchfells größer.
Atmung
Bereits im 2. oder 3. Schwangerschaftsmonat wird die Atmung gesteigert: das Atemminutenvolumen nimmt im weiteren Verlauf der Schwangerschaft um etwa 50% zu, das Atemzugvolumen um etwa 40%, die Atemfrequenz hingegen nur um 2 Atemzüge/min. Diese physiologische Schwangerschaftshyperventilation führt dazu, dass die Blutgase sich in folgender Weise verändern: der paCO2 fällt ab und der paO2 steigt an:
Arterielle Blutgase bei Schwangeren
paCO2: 32–33 mmHg
paO2: 106–108 mmHg
Im 5. Schwangerschaftsmonat ändern sich auch die Lungenvolumina: das exspiratorische Reservevolumen und die Residualkapazität nehmen ab. Hierdurch sinkt auch die funktionelle Residualkapazität (FRK) um etwa 300 ml. Die Vitalkapazität ändert sich hingegen nicht, weil das inspiratorisches Reservevolumen und die Inspirationskapazität zunehmen.
Unter der Geburt nehmen Atemminutenvolumen (ca. 65%) und O2-Bedarf weiter zu, besonders unter dem Einfluss von Wehenschmerz, Angst und Aufregung.
Klinische Bedeutung der respiratorischen Veränderungen
Die Einleitung von Inhalationsanästhesien verläuft schneller, weil die Anflutungszeit der Anästhetika verkürzt ist (niedrige FRK).
Die Ausleitung von Inhalationsnarkosen verläuft ebenfalls schneller, weil die Abflutungszeit der Anästhetika verkürzt ist.
Schwangere am Geburtstermin sind bei Narkosen besonders durch Hypoxie, Hyperkapnie und respiratorische Azidose gefährdet.
Während des Atemstillstands bei der endotrachealen Intubation fällt der arterielle pO2 wesentlich rascher ab als bei Nichtschwangeren (Abschn. 20.5.5).
Herz und Kreislauf
Das Herzzeitvolumen nimmt zu. Der Anstieg beginnt etwa in der 8. Woche und erreicht in der 28. Woche ein Maximum von 30–50% des Ausgangswertes.
Der arterielle Blutdruck fällt geringfügig ab, weil der periphere Widerstand vermindert ist. Folgendes sollte beachtet werden:
Erhöhte Blutdruckwerte in der Schwangerschaft sind immer pathologisch. Als obere Grenzwerte gelten 140/90 mmHg.
Blutdruckwerte von 160 mmHg systolisch oder von 110 mmHg diastolisch sind bei Schwangeren Zeichen der schweren Hypertonie.
Die Herzfrequenz nimmt um 10–15 Schläge/min zu. Der Venendruck bleibt, mit Ausnahme in den unteren Körperpartien, unverändert.
Regionalanästhesie und Herzzeitvolumen
Während einer kontinuierlichen Periduralanästhesie ist der HZV-Anstieg weniger stark. Dieser Effekt ist besonders günstig bei Patienten mit Herzerkrankungen (z. B. Mitralklappenfehler) und anderen Erkrankungen, bei denen eine Belastung des Herzens vermieden werden muss.
Einfluss von Medikamenten auf die Uterusdurchblutung
Vasopressoren können die Uterusdurchblutung vermindern. Daher sollte die Indikation für die Gabe von Vasopressoren sehr sorgfältig gestellt werden.
Bei Blutdruckabfall können Cafedrin-Theodrenalin (Akrinor) oder Ephedrin gegeben werden. Diese Substanzen beeinflussen die Uterusdurchblutung am wenigsten.
Noradrenalin, Dopamin oder Adrenalin sollen nicht zur Anhebung eines erniedrigten Blutdrucks verwendet werden.
Oxytocin ( Syntocinon, Orasthin) ist ein wehenauslösendes und wehensteigerndes Medikament, das Blutdruckanstieg oder -abfall, Tachykardie und Anstieg des HZV sowie Angina pectoris hervorrufen kann. Bei Überdosierung besteht die Gefahr einer Dauerkontraktion des Uterus und eines Herzstillstands. Antagonistisch wirken β2-Sympathikomimetika und Kalzium.
Methergin, ebenfalls ein kontraktionsförderndes Medikament, kann einen Blutdruckanstieg bewirken.
Blutzusammensetzung
Das totale Blutvolumen nimmt im Verlauf der Schwangerschaft zu, die Erythrozytenzahl und das Plasmavolumen ebenfalls. Da aber das Plasmavolumen schneller und stärker zunimmt als die Erythrozytenzahl, tritt eine Hämodilution (Blutverdünnung) ein.
Untere Grenzwerte bei Schwangeren
Hämoglobin: 11 g/dl im 1. und 3. Trimenon, 10,5 g/dl im 2. Trimenon (Trimenon = 3 Monate)
Plasmaalbumin 4,4 g/100 ml
Blutgerinnung
Die Thrombozyten und zahlreiche Gerinnungsfaktoren steigen kontinuierlich an. Hierdurch wird die Gerinnbarkeit des Blutes gesteigert, sodass ein größerer Schutz vor Blutverlusten während der Geburt besteht. Andererseits nimmt aber die Anfälligkeit für thromboembolische Komplikationen zu.
Der Uterus enthält eine erhöhte Konzentration von Aktivatoren der Fibrinolyse. Dringen diese Aktivatoren, z. B. bei einer Uterusruptur, in die Blutbahn der Schwangeren ein, können lebensbedrohliche Blutungen auftreten.
Magen-Darm-Trakt
Veränderungen im Verdauungstrakt sind für den Anästhesisten besonders wichtig: Im Verlauf der Schwangerschaft werden Magen und Därme durch den sich zunehmend vergrößernden Uterus in Kopfrichtung verschoben und die Achse des Magens von vertikal nach horizontal verlagert. Außerdem steigt der Druck im Magen an, während der Tonus am Übergang zwischen Magen und Speiseröhre abnimmt, sodass die Regurgitationsgefahr vergrößert wird.
Unter der Geburt wird die Magenentleerung verzögert. Nicht selten wird außerdem unter der Geburt reichlich Luft verschluckt und die Magensäureproduktion gesteigert. In jedem Fall ist bei einer Schwangeren die Nahrungsretention im Magen unvorhersehbar. Unter der Geburt wurden bei nahezu allen untersuchten Schwangeren noch 4–8 h nach der Aufnahme feste Nahrungsbestandteile nachgewiesen.
Jede Hochschwangere und jede Gebärende gelten als nicht nüchtern und damit als aspirationsgefährdet!
Psyche
Typisch Ängste von Schwangeren sind:
Ängste vor dem Unbekannten,
Todesängste um sich selbst und das Kind,
Furcht vor Komplikationen während der Geburt,
Befürchtungen, ein missgebildetes Kind zu bekommen,
Angst vor der Operation und Narkose.
Die meisten Ängste können durch einfühlsamen Umgang gemildert werden.
Pathophysiologische Grundlagen
Wirkung von Anästhetika und Adjuvanzien auf Uterus und Wehentätigkeit
Anästhetika und andere Medikamente können die Kontraktilität des Uterus beeinflussen und dadurch den Geburtsverlauf verändern. Klinisch werden diese Wirkungen v. a. anhand der Dauer des Geburtsverlaufs und der Aktivität des Uterus beurteilt. Hierbei wird besonders auf die Frequenz und Stärke der Wehen sowie den uterinen Ruhetonus geachtet.
Inhalationsanästhetika
Volatile Anästhetika wie Isofluran, Sevofluran und Desfluran hemmen die Wehentätigkeit und den Ruhetonus des Uterus bis hin zur Uteruserschlaffung.
Die Uterusrelaxierung durch volatile Anästhetika ist dosisabhängig. Höhere Dosen führen zur Atonie des Uterus, die meist auch durch Oxytocin nicht zu beeinflussen ist.
Eine Uterusatonie durch volatile Inhalationsanästhetika kann unmittelbar nach der Sectio zu lebensbedrohlichen Blutverlusten aus dem Uterus führen.
Wird die Zufuhr des Inhalationsanästhetikums unterbrochen, verschwindet die Atonie wieder vollständig.
Ist eine Erschlaffung des Uterus erwünscht, z. B. bei manueller Plazentalösung, können volatile Anästhetika von Vorteil sein. Unmittelbar nach Ablösung der Plazenta kann wegen der Atoniegefahr auf ein anderes Narkoseverfahren übergegangen werden.
Lachgas hat keinen wesentlichen Einfluss auf die Uterusaktivität.
Injektionsanästhetika und Sedativhypnotika
Barbiturate beeinflussen die Uterusaktivität nur geringfügig.
Ketamin kann, dosisabhängig, den Uterustonus bis hin zur schweren Wehenfunktionsstörung steigern.
Analgetika und Sedativa (z. B. Benzodiazepine) verlangsamen in hoher Dosis die Eröffnung des Muttermundes und damit den Geburtsvorgang. Ist die Geburt jedoch bereits vollständig in Gang gekommen, wird der weitere Ablauf meist nicht mehr behindert.
Muskelrelaxanzien
Diese Substanzen haben keinerlei Wirkung auf den Uterusmuskel. Die Wehentätigkeit wird nicht beeinflusst.
Lokalanästhetika
Unmittelbar nach der Injektion von Lokalanästhetika nehmen die Wehenfrequenz und die Wehenstärke ab. Der Effekt ist häufig vorübergehend und kann außerdem durch Zufuhr des wehenfördernden Oxytocin aufgehoben werden. Fällt zusätzlich der Blutdruck während der Regionalanästhesie ab, wird die Wehentätigkeit weiter vermindert.
Vasoaktive Substanzen
Adrenalin (Suprarenin) hemmt in klinischen Dosen die Wehentätigkeit durch Stimulation der β2-Rezeptoren des Uterus. Noradrenalin (Arterenol) kann die Wehentätigkeit bis hin zu schweren tetanischen Kontraktionen steigern.
Wirkung von Anästhetika und Adjuvanzien auf den Fetus
Nahezu alle in der Anästhesie verwendeten Pharmaka passieren rasch die Plazenta und erscheinen danach in Blut und Gewebe des Feten. Es gilt:
Alle Anästhetika passieren die Plazenta und bewirken bei längerer Zufuhr oder Anwendung hoher Dosen immer eine Depression des Neugeborenen.
Lachgas (N2O)
Lachgas passiert rasch die Plazenta und wird sehr schnell vom fetalen Gewebe aufgenommen. Bereits nach 4 min besteht nur noch ein sehr geringer Konzentrationsunterschied zwischen der Schwangeren und dem Fetus.
Verlängerte Lachgaszufuhr (>15 min) führt immer zu fetaler Depression!
Vermeidung von Komplikationen durch Lachgas
Zügiges operatives Vorgehen bzw. kurze Operationszeit bis zur Entbindung des Kindes.
Begrenzung der Lachgaskonzentration auf 50%.
Isofluran, Sevofluran und Desfluran
Diese Substanzen führen, konzentrationsabhängig, immer zur Dämpfung bzw. Narkose des Neugeborenen, besonders bei langer Anästhesiedauer. Hypnotisch wirkende Konzentrationen von Isofluran, Desfluran und Sevofluran führen in der Regel nicht zu fetalen Depression und können daher bei der Sectio caesarea angewandt werden.
Barbiturate
Thiopental passiert leicht die Plazenta. Hierbei gilt: Je höher die zugeführte Barbituratdosis, desto ausgeprägter die Dämpfung des Neugeborenen! Für die Injektion von Thiopental (Trapanal) wird Folgendes empfohlen:
Die Gesamtdosis von Thiopental sollte 4–7 mg/kgKG nicht überschreiten.
Die Dauer der Thiopental/Lachgas-Inhalationsanästhetikum/O2-Narkose muss auf ein geburtshilflich vertretbares Minimum beschränkt werden.
- Die Barbiturat-Dosis muss vermindert werden bei:
- Präeklampsie,
- Eklampsie,
- Blutungen,
- Hypertonie.
Propofol
Propofol passiert die Plazenta, bewirkt jedoch mit Einleitungsdosen von ca. 2,5 mg/kgKG keine fetale Depression. Wird die Substanz wiederholt nachinjiziert, muss allerdings mit einer Depression des Neugeborenen gerechnet werden.
Opioide
Alle Opioide passieren nach i.v.-Injektion rasch die Plazenta und bewirken eine Atemdepression beim Feten bzw. Neugeborenen. Daher gilt:
Geburtshilfliche Operationen dürfen bis zur Geburt des Kindes nicht in Opioidnarkose durchgeführt werden.
Bei der Narkose von opioidabhängigen Schwangeren wird der Opioidantagonist Naloxon (Narcanti) bereitgelegt und nach der Geburt in die Nabelvene injiziert, wenn sichere Zeichen der Neugeborenendepression vorliegen.
Opioidanalgetika, 2–3 h vor der Geburt i.m. injiziert, können ebenfalls zu fetaler Atemdepression führen.
Ketamin
Die Substanz passiert rasch die Plazenta. Einleitungsdosen haben keinen wesentlichen Einfluss auf den Feten, höhere Dosen (ca. 1,5 mg/kgKG) bewirken jedoch eine Dämpfung des Neugeborenen.
Benzodiazepine
Diazepam (Valium) und Midazolam (Dormicum) passieren rasch die Plazenta und verändern den fetalen Herzschlag. Nach Zufuhr höherer Dosen an die Schwangere muss mit folgenden unerwünschten Nebenwirkungen beim Neugeborenen gerechnet werden:
Störungen der Temperaturregulation mit Hypothermie,
Schläfrigkeit,
verminderter Muskeltonus,
Fütterungsschwierigkeiten.
Benzodiazepine sollten möglichst nicht routinemäßig vor der Abnabelung des Kindes gegeben werden, sondern nur dann, wenn die Schwangere sehr aufgeregt ist.
Lokalanästhetika
Diese Substanzen passieren leicht die Plazenta, weil sie meist niedermolekular, gut fettlöslich und z. T. wenig ionisiert sind. Hohe Dosen können beim Feten einen Herzstillstand auslösen.
Bupivacain, Levobupivacain und Ropivacain scheinen wegen ihrer hohen Eiweißbindung gegenwärtig die sichersten Amidlokalanästhetika zu sein.
Aus Sicherheitsgründen sollten folgende Regeln eingehalten werden:
Ropivacain und Bupivacain sind die Mittel der Wahl für die geburtshilfliche Anästhesie.
Die Lokalanästhetika sollten so niedrig wie möglich dosiert werden.
Mepivacain sollte wegen der langen Halbwertszeit und der Dämpfung der Muskelfunktion des Neugeborenen nicht mehr in der geburtshilflichen Anästhesie eingesetzt werden.
Muskelrelaxanzien
Succinylcholin, in einer Dosis bis zu 200 mg der Schwangeren injiziert, relaxiert das Neugeborene nicht.
Rocuronium, Atracurium oder Cisatracurium , passieren zwar in bestimmter Menge die Plazenta, beeinflussen jedoch in klinischen Dosen nicht den Muskeltonus des Neugeborenen. Aber auch für die ND-Muskelrelaxanzien gilt: hohe Dosen müssen vermieden werden!
Atropin
Die i.v.-Injektion von 0,5 mg Atropin führt innerhalb von 1 min zum Anstieg der mütterlichen und der fetalen Herzfrequenz. Auf die Gabe von Atropin sollte jedoch bei Bradykardien nicht verzichtet werden.
Tokolytika
Tokolytika (= Wehenhemmer, von gr. Tokus = Geburt) werden eingesetzt, um die Wehentätigkeit zu hemmen und den Geburtsvorgang zu verzögern, z. B. bei drohendem Abort oder zur Unterdrückung der Wehentätigkeit vor einer Sectio. Gebräuchlich sind β2-Sympathikomimetika, wie z. B. Fenoterol. Sie stimulieren die β2-Rezeptoren des Uterus. Hierdurch wird die Uterusaktivität vermindert. Nebenwirkungen sind:
Tachykardie, Blutdruckabfall,
Anstieg des Herzzeitvolumens und des pulmonalarteriellen Drucks,
vermehrte Wasser- und Elektrolytretention.
Tokolytika erhöhen außerdem das Risiko eines peripartalen Lungenödems. Darum vorsichtige Volumenzufuhr und sorgfältige Bilanz der Ein- und Ausfuhr.
Uterotonika
Diese Medikamente werden eingesetzt, um die Wehentätigkeit zu stimulieren.
Kontraindikationen sind: Hypertonie, Präklampsie/Eklampsie, ischämische Gefäßerkrankungen, Leber- und Nierenfunktionsstörungen, Sepsis.
Oxytocin
Dieses körpereigene Hormon der Hypophyse löst normalerweise die Wehentätigkeit aus und steigert die Uteruskontraktionen. Das Präparat Oxytocin wird eingesetzt, um die Geburt einzuleiten, bereits vorhandene Wehen zu verstärken und nach der Geburt die Kontraktion des Uterus zu fördern. Hat die Schwangere längere Zeit, d. h. über mehrere Stunden Oxytocin zur Unterstützung der Wehentätigkeit erhalten, nimmt häufig die Ansprechbarkeit des Uterus auf die Substanz ab, sodass bei einer Sectio alternative Uterotonika (Prostaglandin, z. B. Misoprostol und/oder Methylergometrin) eingesetzt werden sollten, statt die Oxytocindosis zu erhöhen.
Mögliche Nebenwirkungen von Oxytocin sind Blutdruckabfall, Tachykardie, Kopfschmerzen, Angina pectoris, Übelkeit, Hautrötung, Wasserretention sowie starker Blutdruckanstieg bei gleichzeitiger Zufuhr eines Vasopressors.
Methylergometrin (Methergin)
Dieses aus dem Mutterkorn gewonnene Secalealkaloid bewirkt Kontraktionen des Uterus und erhöht den Ruhetonus. Die Substanz darf wegen der Steigerung des Ruhetonus erst nach Abnabelung des Kindes zugeführt werden, z. B. bei der Sectio, um eine rasche Rückbildung des Uterus und Verminderung von Nachblutungen zu erreichen. Vorsicht: Die Substanz kann zu starken Blutdruckanstiegen führen und darf nur noch – bis zu 0,1 mg (= ½ Amp.) – langsam i.v. bei verstärkter postpartaler Blutung angewandt werden. Die weiteren Nebenwirkungen entsprechen denen von Oxytocin.
Gefahren der geburtshilflichen Anästhesie
Drei typische Komplikationen gefährden das Leben der Hochschwangeren und damit auch des Feten bei geburtshilflichen (Allgemein-)Anästhesien:
V.-cava-Kompressionssyndrom,
pulmonale Aspiration,
Blutdruckabfall und Kreislaufversagen durch eine Regionalanästhesie.
V.-cava-Kompressionssyndrom
Bei etwa 10% aller Spätschwangeren tritt in Rückenlage ein Syndrom auf, das durch folgende Zeichen charakterisiert ist:
Übelkeit,
Schwäche,
Schwitzen,
Blässe,
Luftnot,
Blutdruckabfall,
Tachykardie, Bradykardie.
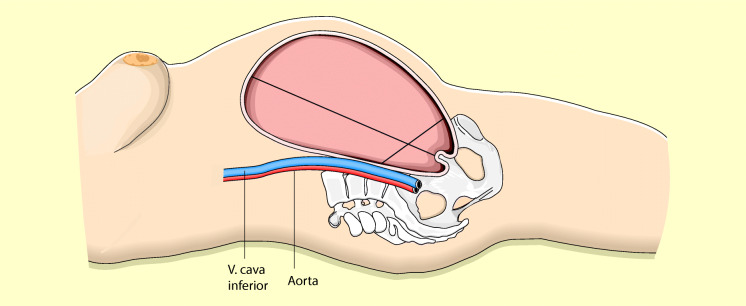
Legt die Schwangere sich sofort wieder auf die Seite, verschwinden diese Zeichen. Ursache des Syndroms ist die Kompression der V. cava inferior durch den vergrößerten Uterus (Abb. 20.1). Hierdurch wird der Rückstrom des venösen Blutes zum rechten Herzen so stark behindert, dass ein schockartiges Krankheitsbild auftritt, das auch den Feten gefährdet.
Das V.-cava-Kompressionssyndrom muss standardmäßig durch Linksseitwärtsverschieben des Uterus mit der Hand, Unterschieben eines Keilkissens oder durch Kippen des OP-Tisches verhindert werden.
Aspiration
Die pulmonale Aspiration ist die häufigste anästhesiebedingte Todesursache bei Schwangeren.
Schwangere sind stärker durch Erbrechen oder Regurgitation mit nachfolgender pulmonaler Aspiration gefährdet als Nichtschwangere. Das liegt hauptsächlich an der Unvorhersehbarkeit des Geburtsvorgangs im Hinblick auf die Nahrungsaufnahme und an den unter Abschn. 20.1 beschriebenen physiologischen Veränderungen des Magen-Darm-Traktes.
Häufigste Ursache der Aspiration sind Intubationsschwierigkeiten oder das Misslingen der Intubation.
Mit Intubationsschwierigkeiten ist v. a. bei Patientinnen mit folgenden Merkmalen zu rechnen:
Starkes Übergewicht mit großen Brüsten,
kurzer Hals,
fliehendes Kinn,
vorstehende Oberkieferzähne.
Mendelson-Syndrom
Sofort nach der Aspiration von saurem Magensaft können folgende Reaktionen auftreten:
Bronchospasmus,
Rasselgeräusche,
Zyanose,
pulmonale Gefäßkonstriktion.
Es entsteht eine Hypoxämie. Der saure Magensaft führt gleichzeitig zu einer chemischen Verletzung der Lunge, zur Aspirationspneumonitis (Mendelson-Syndrom, benannt nach dem englischen Geburtshelfer, Einzelheiten: 10.1007/978-3-662-50444-4_57).
Aspiration fester Nahrungspartikel
Die Aspiration von festem Material führt zur Bronchusobstruktion mit teilweiser oder kompletter Atelektase und Reflexbronchospasmus.
Wichtigste Maßnahmen zum Schutz vor Aspiration
Allgemeinnarkose nur mit Intubation,
keine Beatmung über die Maske bei der Narkoseeinleitung,
Narkoseeinleitung in leichter Oberkörperhochlagerung und Seitwärtsverschiebung des Uterus,
evtl. Krikoiddruck bei der Narkoseeinleitung,
Blitzintubation und rasche Blockung der Manschette,
Extubation erst nach Rückkehr der Schutzreflexe.
Prophylaktische Maßnahmen mit unsicherer Wirkung: Antazida, H2-Blocker (Cimetidin), Magensonde (10.1007/978-3-662-50444-4_32).
Behandlung der Aspiration 10.1007/978-3-662-50444-4_32
Blutdruckabfall durch Regionalanästhesie
Während der Schwangerschaft sind die bei einer Regionalanästhesie zu erwartenden Reaktionen des Herz-Kreislauf-Systems verstärkt.
Blutdruckabfälle bei der Schwangeren führen zu Übelkeit und Erbrechen, außerdem vermindern sie die Uterusdurchblutung und gefährden den Fetus: Je nach Ausmaß und Dauer des Blutdruckabfalls entsteht eine fetale Asphyxie. Blutdruckabfälle (<100 mmHg systolisch bei Schwangeren mit sonst normalen Blutdruckwerten) müssen daher unbedingt vermieden oder, wenn aufgetreten, sofort behandelt werden.
Prophylaktische Maßnahmen
Ein häufig praktiziertes Verfahren ist die Anhebung des intravasalen Volumens durch Infusion von balancierten Elektrolytlösungen kurz vor Anlage einer Regionalanästhesie. Abgesehen von den Gefahren einer Volumenüberladung ist die Wirksamkeit dieses Vorgehens nicht gewährleistet, d. h. bei vielen Patientinnen fällt der Blutdruckabfall trotz Volumenvorgabe ab. Damit ist zumindest fraglich, ob das Verfahren noch routinemäßig angewandt werden sollte. Auf keinen Fall sollte eine Regionalanästhesie so lange verzögert werden, bis die Infusion vollständig eingelaufen ist.
Hochlagern der Beine nach Injektion des Lokalanästhetikums wirkt dem, durch Sympathikusblockade bewirkten Blutdruckabfall entgegen.
Sofortmaßnahmen nach dem Blutdruckabfall
In der Regel ist sofort ein Vasopressor erforderlich: Akrinor 0,5–1 Amp. langsam i.v. (ca. 1 ml/min) oder Ephedrin 10–20 mg i.v., evtl. nachinjizieren oder Phenylephrin 0,05–0,1 mg.
Wenn möglich: Beine kurzzeitig anheben.
Die Überdosierung der Vasopressoren vermindert die Uterusdurchblutung und führt evtl. zu fetaler Hypoxie. Zudem kann bei der Schwangeren ein starker Blutdruckanstieg mit heftigen Kopfschmerzen, evtl. auch Brustschmerzen ausgelöst werden.
Periduralanalgesie für die vaginale Geburt
Die Periduralanalgesie ist die wirksamste Methode zur Schmerzbekämpfung während der Geburt. Bei korrekter Anwendung befreit sie in der Regel sicher von Schmerzen, vermeidet mütterliche und fetale Depression, schaltet die Aspirationsgefahr aus und ermöglicht der Schwangeren eine aktive Beteiligung am Geburtsvorgang (Pressen).
Schmerzen während der Geburt
Der Geburtsvorgang wird schematisch in zwei Phasen eingeteilt: Eröffnungsphase und Austreibungsphase.
Eröffnungsphase
Diese Phase umfasst die Zeit von den ersten regelmäßigen Wehen bis zur vollständigen Eröffnung des Muttermundes. Sie dauert bei Erstgebärenden 10–12 h und bei Mehrgebärenden 6–8 h. Die in der Eröffnungsphase auftretenden Schmerzen entstehen durch:
Uteruskontraktionen und relative Minderdurchblutung der Uterusmuskulatur während der Kontraktionen,
Dilatation der Zervix (Gebärmutterhals) und des unteren Uterinsegmentes,
Zug an uterinen Bändern.
Die Schmerzimpulse treten über viszerale Afferenzen zusammen mit sympathischen Nervenfasern bei Th10–L1 in das Rückenmark ein und können in dieser Region peridural geblockt werden. Die Schmerzen werden von der Schwangeren im Unterbauch empfunden. Sie ziehen vom Nabel bis in die Leiste und seitlich vom Beckenkamm bis zum Trochanter major. Im Rücken manifestieren sie sich als Kreuzschmerzen (Abb. 20.2). Zu Beginn der Wehen ist der Schmerz in den Segmenten Th11 und Th12 lokalisiert; im weiteren Verlauf sind die Segmente Th10, L1 und L2 mitbeteiligt.
Austreibungsphase
Diese Phase umfasst den Zeitraum zwischen vollständiger Eröffnung des Muttermundes (10 cm) und Geburt des Kindes. Sie dauert bei Erstgebärenden ca. 30–40 min, bei Mehrgebärenden 20–30 min.
Die Schmerzen werden auch in diesem Stadium über die für die Eröffnungsphase beschriebenen Nervensegmente geleitet. Hinzu kommen aber somatische Afferenzen und Aδ-Fasern im N. pudendus, die über tiefe lumbale und sakrale (S2–S4) Nerven mit dem Rückenmark in Verbindung stehen.
Neurale Blockade der Geburtsschmerzen
Aus den Besonderheiten der Schmerzmechanismen während des Geburtsvorganges lässt sich die Grundlage für die segmentäre peridurale Blockadetechnik ableiten:
Während der Eröffnungsphase werden nur die Rückenmarksegmente Th10–L1 (L2) blockiert.
Hierdurch werden der Wehenschmerz und der Zervixdilatationsschmerz ausgeschaltet. Im Idealfall bleiben die Sensibilität in den sakralen Segmenten sowie der Tonus der Beckenbodenmuskulatur erhalten und die Drehung des kindlichen Kopfes wird erleichtert.
Während der Austreibungsphase werden neben den Segmenten Th10–L2 zusätzlich die sakralen Rückenmarksegmente geblockt. Die sensible Blockade reicht dann von Th10–S5. Der Geburtsschmerz ist meist vollständig ausgeschaltet, allenfalls wird ein vages Druckgefühl verspürt. Vaginale, jedoch keine abdominalen geburtshilflichen Eingriffe können jetzt durchgeführt werden (einschließlich Episiotomie und Naht).
Damit die Blockade rein sensibel bleibt, wird das Lokalanästhetikum in niedriger Konzentration injiziert. Keineswegs darf auch motorisch blockiert werden, weil hierdurch der Geburtsvorgang erheblich beeinträchtigt wird (kein Pressen mehr möglich!).
Indikationen
Neben dem Wunsch der Schwangeren gibt es noch besondere Indikationen, bei denen eine Periduralanästhesie sich günstig auf die Geburt auswirken kann:
Frühgeburt,
Herzerkrankungen der Schwangeren,
Präeklampsie,
Einleitung der Geburt mit Oxytocin (z. B. Syntocinon),
Mehrlingsschwangerschaft,
Beckenendlage,
unkoordinierte Uterusaktivität,
Diabetes mellitus,
operative vaginale Entbindungen,
Adipositas per magna bzw. BMI >40.
Kontraindikationen
Es gelten die allgemeinen Kontraindikationen für die Periduralanästhesie (10.1007/978-3-662-50444-4_14) sowie spezielle geburtshilfliche Gründe:
tiefer Sitz der Plazenta (Placenta praevia),
Nabelschnurvorfall,
akute fetale Asphyxie.
Eine vaginale Entbindung nach vorangegangener Sectio ist keine Kontraindikation für eine PDA.
Besonderheiten
Periduralraum
Die Venen des Periduralraumes sind in der Schwangerschaft stark gefüllt. Dadurch ist der sonst negative Druck im Periduralraum aufgehoben. Außerdem sind die Wirbelsäulenbänder aufgelockert, sodass insgesamt die Identifizierung des Periduralraumes schwieriger ist als bei Nichtschwangeren (Widerstandsverlust oft weniger ausgeprägt).
Lokalanästhetika
Die Konzentration des Lokalanästhetikums muss aus fetalen Gründen so niedrig wie möglich gehalten werden, ebenso die verabreichte Gesamtdosis. Hohe Dosen und hohe Konzentrationen der Lokalanästhetika können außerdem in der Eröffnungsphase den Beckenboden relaxieren und dadurch die Drehung des Kopfes beeinträchtigen.
Grundsätzlich sollten Lokalanästhetika verwendet werden, deren Wirkungen auf die Motorik geringer ausgeprägt ist (z. B. Ropivacain oderBupivacain), denn eine motorische Blockade beeinträchtigt den Geburtsverlauf.
Kombination des Lokalanästhetikums mit einem Opioid
Bei diesem Verfahren wird das Lokalanästhetikum, z. B. Ropivacain (bis 0,175%) oder Bupivacain (bis 0,125%) mit einem Opioid, z. B. Sufentanil (0,5–1,0 µg/ml), gemischt und peridural injiziert oder infundiert. Vorteile sind:
Dosisreduktion des Lokalanästhetikums,
hierdurch geringere oder keine motorische Blockade,
zweifach höhere Rate normaler vaginaler Entbindungen,
5-fache Abnahme der Zangenextraktionsrate.
Pressdrang
Der starke, unfreiwillige Pressdrang in der Austreibungsphase wird durch die Periduralanästhesie beeinträchtigt oder sogar aufgehoben. Freiwilliges Pressen nach Aufforderung ist jedoch nach wie vor möglich, wenn die Blockade rein sensibel bleibt. Die Effektivität ist aber geringer als ohne Periduralanästhesie.
Geburtsdauer
Insgesamt wird die Dauer der Geburt durch die Periduralanästhesie mit 0,25%igem Bupivacain meist um etwa 1,5 h verlängert.
Praktisches Vorgehen für vaginale Entbindungen
Hierbei gelten zunächst einige Grundsätze:
Die Anlage der PDA ist schwieriger als bei Nichtschwangeren und sollte daher nur vom Erfahrenen oder unter dessen Anleitung zusammen mit entsprechend qualifiziertem Personal durchgeführt werden.
Bei Risikokonstellation mit hoher Wahrscheinlichkeit für eine sekundäre Sectio wie Präeklampsie, Mehrlingsschwangerschaft, bei zu erwartenden Intubationsschwierigkeiten oder bestehender antithrombotischer Medikation sollte die PDA so früh wie möglich angelegt werden. Über die PDA muss ein Anästhesieprotokoll geführt werden. Die Vitalparameter der Schwangeren sind in regelmäßigen Abständen zu kontrollieren und zu dokumentieren, ebenso die Anästhesieparameter.
Vor jeder PDA wird ein venöser Zugang angelegt und eine balancierte Elektrolytlösung angeschlossen. Die Zufuhr großer Flüssigkeitsmengen wirkt wahrscheinlich wehenhemmend und sollte daher vermieden werden.
Erhält die Patientin (in seltenen Fällen) zusätzlich einen zentralen Venenkatheter, müssen die Zuspritzpforten beider Katheter eindeutig gekennzeichnet werden.
Wegen einer möglichen Sectio sollten die Nüchternzeiten für feste Nahrung (6 h) eingehalten werden. Klare, kalorienhaltige Flüssigkeit kann dagegen zugeführt werden.
Lokalanästhetikum der Wahl ist Ropivacain (Naropin), alternativ Bupivacain möglichst kombiniert mit einem Opioid, z. B. Sufentanil, um die Analgesiequalität zu verbessern. Diese Medikamente sollten intermittierend oder patientenkontrolliert als Bolus zugeführt werden, nicht kontinuierlich über Perfusor, weil die kontinuierliche Gabe häufiger zu motorischen Blockaden führt. Ist ein Vasopressor erforderlich, sollten Akrinor oder Ephedrin oder Phenylephrin verwendet werden.
Direkt vor und nach Beginn der PDA sollte das CTG (über einen Zeitraum von 30 min nach Beginn der PDA) kontrolliert werden.
Der Anästhesist muss nach Anlegen der PDA so lange bei der Schwangeren bleiben, bis die Anästhesie ihre volle Wirksamkeit erreicht hat und außerdem stabile Blutdruckverhältnisse vorliegen. Dieser Zeitraum beträgt nach den Empfehlungen der DGAI 30 Minuten.
Anschließend erforderliche Bolusinjektionen des Lokalanästhetikums können an qualifiziertes Assistenzpersonal delegiert werden. Der Arzt muss sich von der Kompetenz der Assistenzperson überzeugt haben. Die Assistenzperson muss Mutter und Feten überwachen können und sich selbst als kompetent einschätzen.
Ein erfahrener Arzt muss jederzeit verfügbar sein. Auftretende Komplikationen müssen sofort und adäquat behandelt werden können.
Nachinjektionen des Lokalanästhetikums dürfen nur an der liegenden Schwangeren vorgenommen werden.
- Schwangere mit PDA dürfen unter folgenden Voraussetzungen umhergehen:
- Begleitperson verfügbar,
- unauffälliger Geburtsverlauf,
- unauffälliges CTG (Kardiotokogramm),
- keine Hypotonie,
- erhaltene Muskelkraft.
Praktisches Vorgehen
Der Periduralkatheter wird in linker Seitenlage oder in sitzender Position der Schwangeren eingeführt und maximal 3 cm in den Periduralraum vorgeschoben. Lässt sich der Katheter nicht korrekt platzieren, kann alternativ eine Single-shot-Spinalananalgesie mit 7,5 μg (= 1,5 ml) Sufentanil durchgeführt werden oder eine i.v.-PCA mit Remifentanil.
Zeitpunkt der Injektion des Lokalanästhetikums: bei Schmerzen und zwar unabhängig von der Weite des Muttermundes.
Vor der Injektion des Lokalanästhetikums muss zum Ausschluss einer subarachnoidalen oder intravasalen Fehllage des Katheters aspiriert werden. Die Injektion einer Testdosis ist nicht erforderlich, solange die Substanzen fraktioniert verabreicht werden. Die Wirkung der PDA tritt meist innerhalb von 15–20 min ein.
In der Eröffnungsphase sollten niedrige Konzentrationen von Ropivacain (bis maximal 0,175%) oder Bupivacain (bis maximal 0,125%) angewandt werden, um die Mobilität der Schwangeren zu erhalten. Das Lokalanästhetikum sollte intermittierend injiziert und nicht kontinuierlich infundiert werden. Alternative: patientenkontrollierte PDA.
Die Analgesiequalität kann durch Zusatz eines Opioids zum Lokalanästhetikum meist verbessert werden
Auffrischdosen müssen immer injiziert werden, bevor die Schmerzen zurückkehren. Die Dosierung erfolgt wie bei der Ausgangsdosis. Die Wirkdauer beträgt ca. 1–1,5 h. Vor und nach jeder Injektion muss aspiriert werden!
Bei stabiler PDA können Auffrischdosen, wie oben beschrieben, auch durch geschultes medizinisches Personal injiziert werden Austreibungsphase
Um die Blockadetechnik dem jeweiligen Geburtsverlauf anzupassen, ist eine enge Zusammenarbeit zwischen Anästhesist und Geburtshelfer bzw. Hebamme erforderlich. In zahlreichen Kliniken wird die Periduralanästhesie nur noch in der Eröffnungsphase angewandt, um den unfreiwilligen Pressdrang zu erhalten und dadurch die sonst erhöhte Zangenentbindungsrate zu senken. Die Austreibung bleibt ungeblockt (Abb. 20.3). Soll die Ausbreitungsphase geblockt werden, müssen höhere Lokalanästhetikumkonzentrationen angewandt werden, z. B. 0,15–0,25% Bupivacain.
Verfahren der geburtshilflichen Periduralanästhesie
Intermittierende Periduralanalgesie
Initialer Bolus in der Eröffnungsphase: 10–16 ml Ropivacain 0,175% mit 0,5–1 μg/ml Sufentanil oder Bupivacain 0,125% mit 0,5–1 μg/ml Sufentanil fraktioniert, jeweils bis Analgesieniveau bei Th10,
Repetitionsdosen, nach ca. 60–90 min wie Initialdosis, fraktioniert bzw. nach Bedarf.
Patientenkontrollierte peridurale Analgesie (PCA)
Ansatz für Spritzenpumpe: Ropivacain 0,175% oder Bupivacain 0,125% und Sufentanil 0,5–1 μg/ml,
initialer Bolus wie oben fraktioniert, bis Analgesie bei Th10, danach
Infusion mit 4–10 ml/h fakultativ,
abrufbarer Bolus: 3–5 ml,
Lock-out-Intervall 15–30 min.
Mobile Periduralanalgesie
Die geburtshilfliche Periduralanästhesie mit 0,25% Bupivacain oder 0,2% Ropivacain beeinträchtigt die Muskelkraft und den Lagesinn der Kreißende, sodass sie hierunter in der Regel nicht das Bett verlassen und umherlaufen kann. Durch weitere Dosisreduktion des Lokalanästhetikums und Kombination mit einem Opioid gelingt es bei vielen Schwangeren, die Mobilität zu erhalten, sodass ein begleitetes Herumgehen möglich wird. Ein derzeit praktiziertes Dosierungsschema für die mobile Periduralanalgesie ist nachfolgend zusammengestellt.
Dosierungsempfehlungen
- Mobile epidurale Analgesie
- Keine Testdosis
- Initial 12 ml Ropivacain 0,125% + 5–10 μg Sufentanil als Bolus
- Maximale kumulative Sufentanildosis 30 μg/24 h epidural, bei Bedarf auch darüber hinaus
- Mobile epidurale PCA
- Keine Testdosis
- Initial 12 ml Ropivacain 0,1% + 5–10 μg Sufentanil als Bolus
- Lock-out-Zeit: 25 min, PCA-Boli von 12 ml Bupivacain 0,125% oder Ropivacain 0,08% + 0,156 μg/ml Sufentanil
- Bei Schmerzen: Bolus von 6 ml Bupivacain 0,25% durch Arzt oder Hebamme
- Maximale kumulative Sufentanildosis: 30 μg/24 h, bei Bedarf auch mehr
Praktisches Vorgehen bei der Mobilisierung
Erster Mobilisierungsversuch ca. 30 min nach Injektion des Lokalanästhetikums, aber nur dann, wenn sich die Patientin hierzu in der Lage fühlt,
zunächst die Patientin die Beine aus dem Bett heben lassen, um die vorhandene Kraft einzuschätzen,
danach die Patientin auf der Bettkante sitzen lassen, Puls und Blutdruck messen,
wenn unauffällig: Patientin vor dem Bett stehen lassen, danach die Knie leicht beugen lassen, hierbei auch nach Schwindelgefühl fragen,
wenn erfolgreich: Patientin mit Begleitperson umhergehen lassen, aber nicht außerhalb der Entbindungsstation.
Nachteile der Periduralanalgesie
Mangelhafte Analgesie: ca. 2–15%, je nach Übung des Anästhesisten. Häufige Ursachen: Katheterfehllage, zu späte Nachinjektion.
Ungeblockte Segmente treten bei etwa 7% der Schwangeren auf, gehäuft im perianalen Bereich. Sie lenken oft die ganze Aufmerksamkeit der Schwangeren auf den Schmerz in diesem Bereich. Bei zahlreichen Patientinnen kann durch Neueinführen oder Zurückziehen (eines zu weit eingeführten) Katheters noch eine befriedigende Analgesie erreicht werden.
Abgeschwächte Motorik bei höheren Lokalanästhetikumkkonzentrationen.
Einsatz von Oxytocin häufiger erforderlich als ohne PDA.
Häufiger regelwidrige Kindslagen.
Zangen- bzw. Vakuumextraktionen möglicherweise häufiger erforderlich als ohne PDA.
Schwierige Technik, setzt größere Erfahrung voraus. Höhere Gefahr der Durapunktion mit postspinalem Kopfschmerz.
Kombinierte Spinal-/Epiduralanalgesie (CSE)
Das Verfahren ermöglicht eine rasche Schmerzausschaltung durch den spinalen Block und eine verlängerte Analgesie entsprechend dem Bedarf durch die Kombination mit einer epiduralen Zufuhr des Lokalanästhetikums. Als vorteilhaft gilt die spinale Injektion eines Opioids im ersten Stadium der Geburt (Wirkdauer ca. 2–3 h; keine motorische Blockade), weil hiermit die Mobilität erhalten bleibt. Allerdings ist die Schmerzausschaltung nicht immer befriedigend. Demgegenüber kann in der Austreibungsphase durch spinale Injektion eines Lokalanästhetikums in niedriger Dosierung sofort eine Analgesie herbeigeführt werden.
Die Punktion des Epiduralraums erfolgt mit einer 17- oder 18-G-Tuohy-Kanüle nach der Widerstandsverlustmethode; anschließend wird der Katheter eingeführt, danach über die Epiduralnadel eine lange, „nichtschneidende“ Spinalkanüle (25- oder 27-G-Whitacre- oder Sprotte-Nadel). Dann folgt zunächst die intraspinale Injektion der gewählten Substanzen (z. B. 5–7,5 μg Sufentanil). Bei Bedarf können dann Lokalanästhetikaboli epidural verabreicht werden.
Gefährlichste Nebenwirkung der spinal zugeführten Opioide ist die frühe Atemdepression. Sie tritt zumeist in den ersten 20 min auf, sodass eine entsprechende Überwachung der Atemfunktion erforderlich ist. Von Nachteil ist weiterhin der opioidinduzierte Juckreiz (Häufigkeit 40–80%). Weitere Nebenwirkungen: 10.1007/978-3-662-50444-4_34.
Anästhesie für die Sectio caesarea
Durch die Schnittentbindung kann die Geburt zu jedem beliebigen Zeitpunkt, unter Umgehung des vaginalen Weges, beendet werden. Grundsätzlich muss gewährleistet sein, dass hierfür ein Anästhesist innerhalb von 10 min im Kreissaal zur Verfügung steht. Die Wahl des Anästhesieverfahrens trifft der Anästhesist.
Indikationen
Eine Sectio wird in der Regel durchgeführt, wenn die Geburt beendet werden muss und eine instrumentelle Entbindung auf vaginalem Wege aus bestimmten Gründen nicht möglich oder kontraindiziert ist. Dabei kann die Sectio aus vorbeugenden Gründen oder aber wegen einer akuten Bedrohung des Lebens von Mutter und/oder Kind erforderlich sein.
Entsprechend kann zwischen geplanter und Notfallsectio unterschieden werden. Dazwischen liegen die dringliche (Mutter und Fetus sind beeinträchtigt, aber nicht unmittelbar lebensbedrohlich) und die baldige Sectio.
Geplante Sectio
Hierauf sind die Patientinnen meist gut vorbereitet. Der körperliche Allgemeinzustand ist ebenfalls meist gut. Daher kann jede der derzeit gebräuchlichen Anästhesietechniken angewandt werden: Allgemeinnarkose, Periduralanästhesie, Spinalanästhesie.
Notfallsectio
Wenn plötzlich – und meist unerwartet – Komplikationen in der Spätschwangerschaft oder unter der Geburt die Schwangere oder das Kind oder beide gefährden und diese Gefahr nicht mit anderen geburtshilflichen Methoden besser behandelt werden kann, wird eine Notfallsectio vorgenommen. Indikationen für die Notfallsectio sind, z. B.:
Placenta praevia (= tiefer Sitz der Plazenta),
Nabelschnurvorfall,
Tetanus uteri,
schwere Eklampsie,
Plazentaablösung.
Notfallsectios müssen so gut wie immer in Allgemeinnarkose durchgeführt werden, bei dringlichen Operationen ist auch eine Spinalanästhesie möglich. Bei bestehendem oder drohendem Schock sind die regionalen Anästhesieverfahren kontraindiziert, weil durch ihre sympathikusblockierende Wirkung der Schockzustand verschlimmert wird.
Wahl des Anästhesieverfahrens
Mit regionalen Anästhesieverfahren werden lebensbedrohliche Intubationsschwierigkeiten/Fehlintubationen und die pulmonale Aspiration von Mageninhalt vermieden. Für den Zustand des Neugeborenen (Apgar-Werte) spielt es dagegen keine Rolle, welches Anästhesieverfahren angewandt wird, vorausgesetzt, die Allgemeinnarkose dauert nicht zu lange. Nach einer Umfrage aus dem Jahre 2011 werden in Deutschland derzeit folgende Anästhesieverfahren bei der Sectio eingesetzt:
Spinalanästhesie: ca. 91%,
Periduralanästhesie: ca. 5%,
CSE: ca. 0,9%,
Intubationsnarkose ca. 1,7%.
Die Schnittentbindung in Spinal- oder Periduralanästhesie kann, bei planmäßigem Verlauf, für die Mutter zu einem beglückenden Erlebnis werden, weil sie die Geburt ihres Kindes trotz operativem Eingriff bewusst miterlebt. Angst und Schmerzen während der Operation verwandeln jedoch sehr rasch die gutgemeinten Absichten des Anästhesisten in einen Alptraum für die Schwangere. Der Anästhesist und der Geburtshelfer dürfen eine stark widerstrebende und ängstliche Patientin nicht zu einem regionalen Anästhesieverfahren überreden, denn diese Patientinnen sind während der Operation häufig schwer zu führen.
Nüchternzeit
Für beide Anästhesieverfahren muss bei elektiven Sectios eine Nüchternzeit von 6 h für feste Nahrung und von 2 h für klare Flüssigkeit eingehalten werden. Außerdem wird eine medikamentöse Aspirationsprophlaxe empfohlen (DGAI).
Adipositas per magna
Bei Schwangeren mit Adipositas per magna muss vermehrt mit folgenden Komplikationen gerechnet werden: Schwangerschaftsdiabetes, Schwangerschaftshypertonus, Präeklampsie/Eklampsie, großes Kind, erhöhte Sectiorate, Schwierigkeiten bei der Anlage einer Regionalanästhesie, intraoperative Wachheit bei Allgemeinanästhesie, postoperative respiratorische Insuffizienz.
Vorbereitung auf peripartale Blutungen (PPH)
Bei Placenta praevia, accreta oder increta sowie bei vorausgegangener Uterusatonie oder vorzeitiger Plazentalösung ist das Risiko massiver peripartaler Blutungen (akuter Blutverlust von >1.500–2.000 ml) und dadurch auch die Müttersterblichkeit erhöht. Daher sind entsprechende Vorbereitungen erforderlich:
Frühzeitige Anlage großlumiger Venenkanülen,
rasche Verfügbarkeit von Blutprodukten, Gerinnungsfaktoren und Antifibrinolytika,
Möglichkeiten für die aktive Erwärmung der Patientin, Druckinfusion und maschinelle Autotransfusion.
Anwesenheit von Vätern oder Bezugspersonen
Bei einer Sectio in Allgemeinanästhesie sollten Väter oder Bezugspersonen nur ausnahmsweise anwesend sein, bei einer Notfallsectio dagegen grundsätzlich nicht. Keine Einwände bestehen aber gegen deren Anwesenheit bei einer elektiven Sectio unter Regionalanästhesie. Widersprechen Fachärzte der beteiligten Disziplinen (v. a. Anästhesisten oder Neonatologen) der Anwesenheit, muss sie unterbleiben. Bei zu großer psychischer Belastung muss nach den Leitlinien der Berufsverbände der Vater den OP auf ärztliche Anweisung umgehend verlassen (Leitlinie DGAI; BDA 2004).
Spinalanästhesie
Die Spinalanästhesie ist in Deutschland das Standardverfahren bei Sectio caesarea. Sie kann auch bei dringlichen Sectios angewandt werden, in ausgewählten Fällen auch bei Notsectiones. Die Spinalanästhesie weist gegenüber der Periduralanästhesie folgende Vorteile auf (Tab. 20.1):
einfachere Technik,
rascher Wirkungseintritt,
gute Analgesie einschließlich der sakralen Segmente,
keine toxischen Wirkungen des Lokalanästhetikums.
| Spinalanästhesie | Periduralanästhesie | |
|---|---|---|
| Technischer Schwierigkeitsgrad | Einfach | Schwierig |
| Wirkungseintritt | Rasch | Verzögert (bis zu 45 min) |
| Obere Blockadeausbreitung | Variabel, nicht vorhersehbar | Meist bis Th4 |
| Untere Blockadeausbreitung | Meist befriedigend bis S4 | Variabel mit Aussparungen im S-Bereich |
| Intensität der Blockade | Ausgeprägt | Variabel |
| Dauer der motorischen Blockade | Je nach Substanz verlängert | Gewöhnlich nicht verlängert |
| Systemische Absorption des Lokalanästhetikums | Zu vernachlässigen | Potenziell toxische Konzentrationen |
| Blutdruckabfall | Häufig, meist abrupt | Graduell |
| Muskelzittern | Selten | Häufig |
| Postspinaler Kopfschmerz | Variabel | Keiner |
| Möglichkeit der postoperativen Schmerztherapie | Nein | Kontinuierlich |
Die Versagerquote liegt, wie bei der Periduralanästhesie, bei etwa 4%.
Als wesentliche Nachteile der Spinalanästhesie gegenüber der Periduralanästhesie gelten:
größeres Risiko des schlagartigen Blutdruckabfalls aufgrund der rascher eintretenden Sympathikusblockade,
nicht vorhersehbare Ausbreitung der Anästhesie nach thorakal/zervikal, bei isobaren Lokalanästhetika,
häufiger vagal bedingte Bradykardien,
postspinale Kopfschmerzen.
Es gibt keine sicheren Hinweise, welches der beiden Verfahren für das Neugeborene günstiger ist.
Die Technik der Spinalanästhesie unterscheidet sich nicht von der bei Nichtschwangeren (10.1007/978-3-662-50444-4_14); bis auf wenige Besonderheiten entspricht das Vorgehen dem für die Periduralanästhesie beschriebenen.
Wahl des Lokalanästhetikums
Bupivacain
Diese Substanz ist derzeit wegen ihrer längeren Wirkdauer und geringeren motorischen Blockade vermutlich das Standardmittel. Verwendet werden die 0,5%ige hyperbare oder die 0,5%ige isobare Lösung. Für eine vollständige operative Anästhesie werden ca. 10 mg benötigt. Eine Anpassung der Dosis an Lebensalter, Körpergröße, Körpergewicht und Länge der Wirbelsäule ist nach Angaben in der Literatur nicht erforderlich, da diese Faktoren ohne Einfluss auf die Ausdehnung sind. Bei 15 mg muss mit einer sehr hohen Blockade (bis Th2) gerechnet werden, gelegentlich auch bis C1 oder C2.
Dosierung von Bupivacain für die Spinalanästhesie
10 mg bzw. 2 ml (Bereich 7,5–15 mg) 0,5%ige Lösung + 5 μg Sufentanil oder 5–10 μg Fentanyl
Vorgehen bei der Spinalanästhesie
Die Technik der Spinalanästhesie ist ausführlich in 10.1007/978-3-662-50444-4_13 beschrieben, daher wird an dieser Stelle nur auf die Besonderheiten bei Schwangeren eingegangen.
Praktisches Vorgehen
Venenkanüle einführen, Infusion (plasmaisotone Elektrolytlösung) anschließen und einlaufen lassen,
Patientin auf die rechte Seite oder sitzend lagern,
Spinalkanal zwischen L3 und L4 oder L4 und L5 mit einer 24- bis 27-G-Pencil-point-Nadel über eine Einführungskanüle punktieren,
Injektion von 10 mg Bupivacain hyper- oder isobar mit 2,5–5 µg Sufentanil oder 5–10 µg Fentanyl,
sofort nach der Injektion des Lokalanästhetikums die Patientin auf den Rücken lagern, Uterus links seitwärts verschieben, prophylaktisch Akrinor injizieren,
Blutdruck und Herzfrequenz jede Minute messen, Sauerstoff bis zur Entwicklung des Kindes oder länger über Nasensonde zuführen,
Ausbreitung der sensorischen Blockade alle 30 s mit Kältereiz oder Nadelstichen überprüfen; wenn Th10 erreicht ist: Oberkörper und Beine leicht erhöhen, um eine Ausdehnung der Blockade über Th4–Th6 hinaus zu vermeiden,
bei Blutdruckabfall auf ca. 100 mmHg: sofort Vasopressor injizieren: Akrinor, oder Ephedrin oder Phenylephrin,
bei Bradykardie <60/min: Atropin i.v.; bei erheblicher Bradykardie: Adrenalin (Suprarenin),
nach Abnabelung des Kindes: langsame Injektion oder Kurzinfusion von 3–5 IE Oxytocin nach Angabe des Operateurs, anschließend Oxytocininfusion (10 IE/500 ml), Methergin nur, wenn absolut erforderlich,
vorsichtige Umlagerung am Ende der Operation, da Gefahr des Blutdruckabfalls mit Übelkeit und Erbrechen aufgrund der noch vorhandenen Sympathikusblockade.
Periduralanästhesie
Die Periduralanästhesie ist technisch schwieriger als die Spinalanästhesie und zeitlich wesentlich aufwendiger. Daher ist sie für dingliche oder Notfallsectios nicht geeignet. Bei versehentlicher Punktion der Dura treten bei den meisten Patientinnen postspinale Kopfschmerzen auf.
Wahl des Lokalanästhetikums
Empfohlenes Mittel der Wahl ist Ropivain in Kombination mit einem Opioid.
Kombination des Lokalanästhetikums mit epiduralen Opioiden
Der Zusatz von Opioiden zum Lokalanästhetikum gilt als Standardverfahren bei der Sectio caesarea. Am häufigsten werden Sufentanil oder Fentanyl eingesetzt.
Durch die kombinierte peridurale Injektion von Lokalanästhetika und Opioiden kann die Qualität der operativen Anästhesie verbessert werden. Die bei konventioneller Periduralanästhesie häufig auftretenden Schmerzen im Bereich der Harnblase und bei der Entwicklung des fetalen Kopfes lassen sich hiermit weitgehend verhindern. Auch sollen weniger Übelkeit und Erbrechen bei den operativen Manipulationen am Uterus auftreten.
Bei epiduraler Verwendung von Sufentanil oder Fentanyl muss mit folgenden typischen Nebenwirkungen gerechnet werden:
Juckreiz,
Übelkeit und Erbrechen,
frühe Atemdepression (selten),
Harnverhalt.
Komplikationen
Versehentliche Durapunktion
Die unbeabsichtigte Punktion der Dura mater ist eine häufige Komplikation der geburtshilflichen Periduralanästhesie: Sie führt bei den meisten Patientinnen zu sehr unangenehmen postspinalen Kopfschmerzen , die zu dem die Mobilität beeinträchtigen. Ein standardisiertes Vorgehen nach versehentlicher Durapunktion mit der Tuohy-Nadel gibt es derzeit nicht. Ein Blutpatch sollte bei anhaltenden Kopfschmerzen, frühestens 2–3 Tage nach der Duraperforation angelegt werden (weitere Einzelheiten zur Behandlung der Kopfschmerzen: 10.1007/978-3-662-50444-4_13).
Blutdruckabfall
Der Blutdruckabfall ist eine typische Komplikation der Peridural- und Spinalanästhesie, jedoch muss auch ein V.-cava-Kompressionssyndrom als Ursache des Blutdruckabfalls ausgeschlossen werden. Während ein leichter Blutdruckabfall von zahlreichen Schwangeren toleriert wird, reagiert der Fetus empfindlicher, denn unter der Peridural- oder Spinalanästhesie nimmt die Uterusdurchblutung mit fallendem Blutdruck ab, da keine Autoregulation besteht. Je nach Ausmaß und Dauer des Blutdruckabfalls entwickelt sich eine fetale Azidose („Asphyxie“). Klinisch sollte Folgendes beachtet werden.
Systolische Blutdruckwerte der Schwangeren von <70 mmHg führen regelmäßig zu fetaler Bradykardie.
Anhaltende systolische Blutdruckwerte von <100 mmHg bei sonst normotensiven Schwangeren führen unter Regionalanästhesie zu fetaler Azidose und niedrigen Apgar-Werten des Neugeborenen.
Prophylaxe und Therapie
Als unterer Grenzwert gilt ein systolischer Blutdruck von 100 mmHg oder ein Abfall um 30% des Ausgangswertes. Jedoch ist zu beachten, dass einige Schwangere bereits auf einen nur wenige mmHg betragenden Abfall des systolischen Drucks unter den Ausgangswert der Schwangerschaft mit Übelkeit, evtl. auch Erbrechen reagieren. Warnhinweise sind Gähnen und die Angabe eines „komischen Gefühls“ durch die Schwangere.
Ein Blutdruckabfall sollte sofort mit einem Vasopressor (Akrinor, Ephedrin, Phenylephrin) behandelt werden. Zu hohe Dosen müssen aber vermieden werden.
Muskelzittern
Muskelzittern tritt bei Schwangeren häufiger im Zusammenhang mit einer Periduralanästhesie für die Sectio auf. Die Ursachen sind vielfältig, jedoch muss immer an die zentralen Wirkungen des resorbierten Lokalanästhetikums gedacht werden. Besteht der dringende Verdacht auf eine zerebrale toxische Reaktion, sollte 100%iger Sauerstoff zugeführt werden, evtl. ergänzt durch ein Benzodiazepin mit guter antikonvulsiver Wirksamkeit. Angstbedingtes Zittern kann häufig ebenfalls durch diese Maßnahmen beseitigt werden. Bei Kältezittern sollten wärmekonservierende Maßnahmen ergriffen werden, bei heftigem Zittern können Pethidin, titriert nach Wirkung oder Clonidin (Catapresan) injiziert werden (Sedierung beachten, bei Clonidin auch die Gefahr des Blutdruckabfalls).
Toxische Reaktionen auf das Lokalanästhetikum
Bei generalisierten Krämpfen oder Kreislaufkollaps bzw. Asystolie muss der Fetus sofort entwickelt und die Schwangere reanimiert werden.
Totale Spinal- oder Periduralanästhesie
10.1007/978-3-662-50444-4_13 und 10.1007/978-3-662-50444-4_13.
Ungenügende Analgesie
Selbst bei korrekter Katheterlage muss bei bis zu 20% der Patientinnen mit Schmerzen während der Operation gerechnet werden, wenn das Lokalanästhetikum nicht mit einem epiduralen Opioid kombiniert wird. Betroffen sind häufig die oberen sakralen Segmente. Oft gelingt es, durch Zuspruch und Ermunterung die schmerzhaften Episoden zu überbrücken. Empfohlen wird auch die Zufuhr von 30–40% Lachgas in Sauerstoff oder, als letztes Mittel, Ketamin in niedriger Dosierung (0,25 mg/kgKG). Nach der Abnabelung kann zusätzlich ein Analgetikum, z. B. Fentanyl, i.v. injiziert werden. Vorsicht ist bei der Kombination von Opioiden mit Sedativhypnotika geboten, da hierdurch eine bedrohliche, möglicherweise zu spät bemerkte Atemdepression auftreten kann. Lässt sich keine ausreichende Analgesie erzielen, muss auf eine Intubationsnarkose übergegangen werden.
Thoraxschmerzen
Bei einigen Patientinnen können nach der Abnabelung des Kindes im weiteren Verlauf der Operation Angina-pectoris-artige Schmerzen auftreten, deren genaue Ursache nicht geklärt ist. Im Allgemeinen sind die Thoraxschmerzen ein isoliertes Phänomen ohne wesentliche klinische Bedeutung. Sie können aber in seltenen Fällen zusammen mit anderen Zeichen, wie Dyspnoe und Abfall der arteriellen O2-Sättigung, Hinweis auf eine Embolie oder Myokardischämie sein.
Soll die Patientin sediert werden?
Fast alle Patientinnen fürchten, während der Operation Schmerzen zu empfinden. Hinzu kommen diffuse Ängste, die sich häufig um die Unversehrtheit des ungeborenen Kindes drehen. Bei den meisten Patientinnen gelingt es aber, Angst und Aufgeregtheit durch einfühlsame Führung und beruhigenden Zuspruch so weit zu reduzieren, dass die Zufuhr sedierender Medikamente nicht erforderlich ist – vorausgesetzt, es besteht eine ausreichende operative Analgesie.
Übelkeit und Erbrechen
Übelkeit mit oder ohne Erbrechen gehört zu den häufigeren (und unangenehmen) Komplikationen der Periduralanästhesie für die Sectio caesarea. Wenngleich verschiedene Ursachen in Frage kommen, sollte zuerst der Blutdruck gemessen und ein Blutdruckabfall ausgeschlossen werden. Bereits ein geringer Abfall unter den systolischen Ausgangswert der Schwangerschaft sollte zu blutdrucksteigernden Maßnahmen veranlassen.
Lässt sich hierdurch die Übelkeit nicht beseitigen, kann vor Abnabelung des Kindes Ondansetron verabreicht werden.
Andere Ursachen für Übelkeit sind eine Bradykardie oder die chirurgische Stimulation der Eingeweide und des Peritoneums.
Atemnot
Gelegentlich klagen die Patientinnen perioperativ über Atemnot. Zu den wichtigsten Ursachen dieses Symptoms gehören:
eine zu hohe motorische Blockade,
Blutdruckabfall,
Angst und Aufregung,
ein Lungenödem oder eine Lungenembolie (selten).
Die Behandlung richtet sich jeweils nach der zugrunde liegenden Ursache.
Vorgehen bei der PDA
Ein Blutdruckabfall muss bei der Schwangeren unter allen Umständen vermieden werden. Tritt er dennoch auf, muss er sofort behandelt werden
Für eine wirksame Schmerzausschaltung ist bei der Sectio eine Blockade von Th4–S5 erforderlich.
Praktisches Vorgehen
Zunächst das gesamte Zubehör – einschließlich Material für eine Intubationsnarkose – bereitstellen und auf Funktionsfähigkeit überprüfen.
Instrumentarium für die Notfallversorgung des Neugeborenen nicht vergessen!
Patientin in linker Seitenlage in den Einleitungsraum fahren.
1–2 Venenverweilkanülen einführen und
Patientin zum Anlegen der PDA entweder auf die Seite lagern oder in die sitzende Position bringen. Mit Punktionsbeginn Infusionslösung einlaufen lassen. Anschließend Periduralkatheter sicher auf der Haut fixieren. Patientin auf die linke Seite lagern.
Lokalanästhetikum fraktioniert (ohne vorangehende Testdosis) injizieren: etwa 15–22 ml Ropivacain 0,75% oder 15–22 ml Bupivacain 0,5%
Bei Bedarf (nicht routinemäßig) Sauerstoff über eine Gesichtsmaske oder Nasensonde zuführen.
Blutdruck und Puls in kurzen Abständen kontrollieren. Klagt die Patientin: „Mir ist so komisch. Ich glaube ich muss mich übergeben“, sofort den Blutdruck messen! Nicht sagen: „Das kommt von der Aufregung“. Blässe, Übelkeit und Erbrechen sind meist zuverlässige Zeichen des Blutdruckabfalls!
Bei Blutdruckabfall (<100 mmHg bzw. 30% unter Ausgangswert): sofort Akrinor, 0,5–1 Amp. langsam i.v. oder Ephedrin 15–25 mg i.v. Rasche Volumenzufuhr, wenn möglich: Beine anheben.
Patientin erst zur Operation freigeben, wenn Anästhesieausdehnung genau getestet und für ausreichend befunden worden ist. Das Messer des Operateurs ist zwar ein scharfes, aber für diesen Test untaugliches Instrument.
Während der Operation die Patientin durch Gespräche ablenken. Nicht vergessen der Mutter das Kind zu zeigen.
Nach Ablösung der Plazenta 3–5 IE Oxytocin (Syntocinon) langsam i.v. oder als Kurzinfusion und Infusionslösung mit 10 IE Oxytocin einlaufen lassen (2–6 IE/h oder nach Absprache mit Operateur).
Übelkeit und Erbrechen sowie Druckgefühl, Ziehen oder Schmerzen können bis zum Verschluss des Peritoneums auftreten und lassen zumeist erst nach, wenn die intraabdominalen Manipulationen beendet sind.
Blutverluste während der Operation mit HES-Lösung oder plasmaisotoner Vollelektrolytlösungen ersetzen. Der anfängliche Blutverlust beträgt bei unkomplizierter Sectio etwa 900–1000 ml. Eine Bluttransfusion ist nur in seltenen Fällen erforderlich.
Bei inkompletter Blockade die Patientin nicht leiden lassen, sondern eine Intubationsnarkose durchführen.
Nach der Operation: Patientin vorsichtig ins Bett legen (Gefahr des Blutdruckabfalls!). Katheter entfernen und auf Vollständigkeit überprüfen oder zur postoperativen Schmerzbehandlung liegen lassen.
Allgemeinanästhesie
Die Allgemeinanästhesie ist das Verfahren der Wahl für Notfallsectios und für geplante Sectios, wenn die Schwangere eine Regionalanästhesie strikt ablehnt oder andere Kontraindikationen dafür vorliegen.
Wegen der großen Aspirationsgefahr bei Hochschwangeren ist für die Sectionarkose immer die endotracheale Intubation erforderlich. Maskennarkosen sind kontraindiziert.
Bei der Allgemeinanästhesie für eine Sectio ist immer eine Ileuseinleitung erforderlich!
Maskennarkosen oder Narkosen über eine Larynxmaske dürfen nur durchgeführt werden, wenn die Schwangere nach der Narkoseeinleitung nicht intubiert werden kann.
Vorteile
Verglichen mit der Regionalanästhesie kann die Allgemeinanästhesie rasch eingeleitet und die Operation entsprechend frühzeitig begonnen werden. Außerdem gewährleistet die Allgemeinanästhesie in der Regel eine größere kardiovaskuläre Stabilität, da kein durch Sympathikusblockade (wie bei der SPA und PDA) ausgelöster Blutdruckabfall auftritt.
Neben diesen Vorteilen bestehen allerdings auch schwerwiegende Nachteile, die bei der Wahl des Anästhesieverfahrens sorgfältig bedacht werden müssen.
Risiken
Die Hauptgefahren der Allgemeinnarkose für die Sectio caesarea sind:
Intubationsschwierigkeiten, v. a. bei erheblicher Adipositas und sehr großen Brüsten,
versehentliche und unbemerkte Intubation des Ösophagus,
pulmonale Aspiration von Mageninhalt,
V.-cava-Kompressionssyndrom (auch bei Regionalanästhesie!),
Depression des Neugeborenen bei längerer Operations- und Narkosedauer.
Anästhetika für die Einleitung
Alle gebräuchlichen i.v. Anästhetika passieren die Plazenta und können bei länger dauernder Einwirkung zur Depression des Neugeborenen führen. Um eine intraoperative Wachheit der Patientin zu verhindern, müssen die i.v.-Anästhetika bis zur Entwicklung des Kindes mit anderen Substanzen (Inhalationsanästhetika oder Ketamin) kombiniert werden. Nach der Entwicklung des Kindes werden in der Regel zusätzlich Opioide eingesetzt.
Thiopental
Diese Traditionssubstanz wird standardmäßig für die Sectio eingesetzt, obwohl sie bei allen anderen Eingriffen weitgehend durch Propofol ersetzt worden ist und die betroffenen Anästhesisten daher nur noch über wenig Erfahrung mit Thiopental verfügen.
Für die Sectio werden Dosen von 4–7 mg/kgKG empfohlen. Höhere Dosen führen allerdings zur Neugeborenendepression und sollten möglichst vermieden werden. Thiopental erscheint in der Muttermilch, allerdings sind die Konzentrationen so niedrig, dass das Stillen deshalb nicht verschoben werden muss.
Um intraoperative Wachheit und Schmerzen zu vermeiden, muss Thiopental ausreichend hoch dosiert und mit anderen Substanzen, z. B. Ketamin oder Inhalationsanästhetika, kombiniert werden.
Propofol
Propofol ist für schwangere Patientinnen zugelassen (Einleitungsdosis bis zu 2,5 mg/kgKG, Aufrechterhaltung der Narkose bis zu 6 mg/kgKG/h). Die Wirkung setzt rasch ein und hält nur kurz an. Bis zur Entwicklung des Kindes muss Propofol mit volatilen Anästhetika oder Ketamin kombiniert werden, um Schmerzen und intraoperative Wachheit zu verhindern. Danach werden Opioide zugesetzt.
Ketamin
Diese Substanz wird bevorzugt bei geburtshilflichen Blutungen oder hämodynamisch instabilen Schwangeren eingesetzt, weil sie in diesen Situationen eine größere kardiovaskuläre Stabilität gewährleisten kann, den Uterus nicht relaxiert und seltener mit intraoperativer Wachheit der Mutter verbunden ist. Die Dosierung für die Einleitung bei einer Sectio beträgt im Durchschnitt 1 mg/kg KG. Höhere Dosen können zur Neugeborenendepression führen und sollten daher vermieden werden. Bei Patientinnen mit Schwangerschaftshypertonie bzw. Präeklampsie/Eklampsie sollte Ketamin nicht eingesetzt werden.
Etomidat
Etomidat geht häufig mit Myoklonien einher und erfordert die Vorinjektion von Fentanyl. Die Substanz ist daher für die Sectio wenig geeignet und wird nur ausnahmsweise (bei kardialen Risikopatienten) angewandt.
Aufrechterhaltung der Narkose
Bei der Aufrechterhaltung der Narkose für die Sectio caesarea sind folgende Besonderheiten zu berücksichtigen:
die Phase bis zur Geburt des Kindes,
die Phase nach der Abnabelung des Neugeborenen,
die Auswirkungen der Anästhetika auf die Kontraktion des Uterus.
Vom Operationsbeginn bis zur Geburt
Zahlreiche Anästhesisten beschränken sich in dieser Phase, aus Angst vor neonataler Depression, auf die einmalige Bolusinjektion von Thiopental und Succinylcholin und beatmen die Patientin mit einem Lachgas/Sauerstoff-Gemisch oder nur mit reinem Sauerstoff. Dieses Vorgehen ist aber nur dann gerechtfertigt, wenn es dem Operateur gelingt, das Kind innerhalb weniger Minuten zu entwickeln.
Verzögert sich hingegen die operative Entbindung, muss mit intraoperativem Erwachen der relaxierten Schwangeren und erheblichen Schmerzen (Zeichen: große Pupillen) gerechnet werden. Um diese für die Schwangere unzumutbare Situation zu vermeiden, ist die Zufuhr weiterer Anästhetika erforderlich. Allerdings sind wiederholte Nachinjektionen von Thiopental für diesen Zweck nicht zu empfehlen, da hierdurch das Erwachen verzögert wird und außerdem häufig ein längerer Nachschlaf eintritt – ebenfalls ein unerwünschter Effekt, da die meisten Mütter ihre Kinder möglichst kurz nach der Geburt sehen möchten. Geeignet ist vielmehr die Zufuhr von Inhalationsanästhetika oder von Ketamin, jeweils in niedriger Dosierung (► unten).
Von der Abnabelung bis zum Operationsende
In dieser Phase müssen bei unkomplizierter Sectio v. a. die Auswirkungen der Anästhetika auf die Uterusaktivität berücksichtigt werden. Wie bereits dargelegt, führen alle volatilen Anästhetika zu einer konzentrationsabhängigen Relaxation des Uterus bis hin zur Atonie mit der Gefahr erheblicher Nachblutungen. Diese Effekte spielen bei Lachgas und den Opioiden keine wesentliche Rolle.
Volatile Inhalationsanästhetika
Diese Substanzen können in niedriger Konzentration – auch zusammen mit 50% Lachgas – eingesetzt werden, um eine ausreichende Narkosetiefe zu gewährleisten. In der Schwangerschaft ist der Anästhetikabedarf vermindert, auch stellt sich wegen der erniedrigten FRK rascher ein Gleichgewichtszustand ein, d. h. die volatilen Anästhetika fluten schneller an und ab. Dies gilt besonders für Desfluran und Sevofluran. Hohe Konzentrationen der volatilen Anästhetika führen v. a. bei länger dauernder Anwendung zu neonataler Depression und Uterusrelaxation und müssen daher vermieden werden.
Lachgas
Wie bereits dargelegt, passiert Lachgas rasch die Plazenta und innerhalb von 3 min wird ein fetales/maternales Konzentrationsverhältnis von 0,8 erreicht. Lachgaskonzentrationen von 50% gelten derzeit als sicher, jedoch sind auch höhere Konzentrationen (70%) angewandt worden, ohne dass hierdurch ungünstige Auswirkungen auf das Neugeborene nachweisbar waren. Länger dauernde Lachgaszufuhr (>15 min) führt aber zu neonataler Depression und sollte möglichst vermieden werden. Bei erheblich beeinträchtigten Feten sollte auf die Zufuhr von Lachgas verzichtet und stattdessen die Konzentration des Inhalationsanästhetikums erhöht werden.
Opioide
Bis zur Entwicklung des Kindes sollten möglichst keine Opioide zugeführt werden, um eine Neugeborenendepression zu vermeiden. Nach der Geburt des Kindes können die Opioide dagegen in üblicher Dosierung angewandt werden. Waren Opioide bereits vor der Geburt erforderlich, kann die Atemdepression beim Neugeborenen mit Naloxon antagonisiert werden.
Muskelrelaxanzien
Muskelrelaxanzien sind für die Einleitung der Narkose erforderlich und, je nach eingesetzter Substanz, auch für die Aufrechterhaltung. Hierbei ist zu beachten, dass alle Muskelrelaxanzien die Plazenta passieren und in höheren Dosen zur Relaxierung des Feten bzw. Neugeborenen führen können. Bei Begrenzung der Dosis können diese Substanzen jedoch ohne Gefährdung des Feten auch vor der Abnabelung angewandt werden. Bei einer Magnesiumtherapie im Rahmen einer Präeklampsie muss mit verstärkter und verlängerter Relaxanzienwirkung gerechnet werden, daher Dosisreduktion!
Succinylcholin
Bei der Narkose für die Sectio ist eine Blitzeinleitung (Ileuseinleitung) erforderlich, um rasch eine ausreichende Kontrolle über die Atemwege der Patientin zu erlangen. Succinylcholin gilt trotz seiner Nebenwirkungen nach wie vor als Relaxans der Wahl für die Intubation bei einer Sectio caesarea. Wenngleich die Plasmacholinesteraseaktivität in der Schwangerschaft erniedrigt ist, wird die Wirkung von Succinylcholin hierdurch in der Regel nicht verlängert, jedoch sollte bei anhaltender Blockade an diese Möglichkeit gedacht werden.
Bei Schwangeren kann die Injektion von Succinylcholin zu ausgeprägter, vagal bedingter Bradykardie oder Herzrhythmusstörungen führen. Daher muss Atropin immer griffbereit sein. Die Präkurarisierung mit einem nichtdepolarisierenden Relaxans in niedriger Dosis wird nicht mehr empfohlen.
Nichtdepolarisierende Relaxanzien
ND-Muskelrelaxanzien werden in der Regel erst nach Abnabelung des Kindes eingesetzt, meist in erniedrigter Dosis. Ist Succinylcholin kontraindiziert, kann auch das schnell wirkende ND-Relaxans Rocuronium für die Intubation eingesetzt werden, zumal dessen Wirkung durch Sugammedex am Ende der Operation nachhaltig antagonisiert werden kann.
Präoxygenierung
In der Schwangerschaft ist der O2-Verbrauch um ca. 20% erhöht und die funktionelle Residualkapazität um ca. 20% vermindert. Darum fällt selbst bei kurzdauernder Apnoe für den Intubationsvorgang der arterielle pO2 bei Schwangeren erheblich rascher ab als bei nichtschwangeren Patientinnen. Entsprechend kann sich bei Intubationsschwierigkeiten sehr schnell eine bedrohliche Hypoxie entwickeln, wenn die Schwangere vor der Narkoseeinleitung nicht ausreichend präoxygeniert worden ist.
Wenn möglich: Keine Narkoseeinleitung bei Sectio ohne ausreichende Präoxygenierung!
Die Präoxygenierung muss bei Schwangeren über eine dicht aufgesetzte Gesichtsmaske und für einen Zeitraum von mindestens 3–5 min erfolgen. Wenn Eile geboten: 8 tiefste Atemzüge! Eine vollständige Auffüllung der O2-Speicher der Lungen gelingt jedoch in der Regel nicht, d. h. es steht weniger Zeit für die Intubation zur Verfügung als bei Nichtschwangeren.
Wachheit während der Narkose
Bei konventioneller Anästhesie mit Thiopentaleinleitung und Beatmung mit Sauerstoff bis zur Abnabelung des Kindes muss in einem hohen Prozentsatz mit Wachheit und Schmerzen der relaxierten Schwangeren gerechnet werden, v. a. wenn sofort nach der Injektion mit der Operation begonnen wird. Erst durch Supplementierung mit einem volatilen Anästhetikum in hypnotisch wirkender Konzentration kann die Wachheit vollständig verhindert werden.
Konzentrationen bis zu 0,7 MAC eines volatilen Anästhetikums (Desfluran, Sevofluran, Isofluran) gelten als sicher für Schwangere und Kind.
Diese Konzentrationen gehen nicht mit höheren Blutverlusten einher und sollten daher auch eingesetzt werden. Denn es gilt: Wachheit mit Schmerzen ist nicht akzeptabel!
Alternativ kann auch Ketamin eingesetzt werden.
Vorgehen bei der Allgemeinnarkose
Es gilt der Grundsatz: Die Allgemeinnarkose bei Sectio caesarea ist eine Intubationsnarkose!
Praktisches Vorgehen
Patientin auf die linke Seite lagern (25–30°). Den Oberkörper zur Narkoseeinleitung erhöht lagern.
Nicht schweigsam sein! Mit der Schwangeren sprechen! Sie hat Angst und möchte beruhigt werden. Alle Maßnahmen kurz erklären.
1–2 Venenkanülen legen. Bei Placenta praevia oder increta auf massive Blutungen vorbereitet sein
Ca. 5 min Sauerstoff voratmen lassen, wenn Eile geboten: 8 tiefste Atemzüge.
Narkoseeinleitung mit Thiopental (Trapanal) 4–7 mg/kgKG, alternativ Ketamin 1 mg/kgKG, nicht zu langsam injizieren.
Wenn Patientin schläft: 1,5 mg/kgKG Succinylcholin oder Rocuronium, 1 mg/kgKG. Auf keinen Fall mit der Maske beatmen!
Intubation der Trachea nach 30–60 s. Hierbei kann ein erfahrener Helfer den Kehlkopf fest in Richtung Speiseröhre drücken („Krikoiddruck)“, jedoch nicht bei schwieriger Intubation.
Bei Misslingen der Intubation: Keine Panik, keine wiederholten Intubationsversuche, sondern Larynxmaske einführen und hierüber mit 100%igem O2 beatmen.
Sofort mit der Operation beginnen lassen.
Am Respirator Lachgas und Sauerstoff im Verhältnis 1 : 1 einstellen, ergänzt durch ca. 0,7 MAC eines volatilen Anästhetikums; Relaxierung nach Bedarf. Kontrollierte Hyperventilation auf einen paCO2 von etwa 32 mmHg. Exzessive Hyperventilation vermeiden.
Wenn Narkose zu flach (Pupillen weit, Blutdruck hoch, Herzfrequenz schnell, Schluckbewegungen, Tränenfluss): Inhalationsanästhetikum höher dosieren.
1–2 min vor Abnabelung des Kindes: Lachgas abstellen; mit 100% Sauerstoff beatmen (gilt nicht als zwingend erforderlich).
Nach Abnabelung des Kindes: Narkose vertiefen, z. B. jetzt Remifentanil/Lachgas/O2-Anästhesie-Technik oder TIVA; wenn erforderlich mit Atracurium in niedriger Dosis nachrelaxieren. Inzwischen versorgt der Pädiater oder ein anderer qualifizierter Arzt das Neugeborene (Abschn. 20.10).
Nach Entfernung der Plazenta: langsame Injektion von 3–5 IE Oxytocin (Syntocinon) i.v. und Infusion mit 10 IE Oxytocin in Rücksprache mit Operateur einlaufen lassen. Während der Narkose sollte möglichst kein Methergin i.v. injiziert werden (Gefahr des exzessiven Blutdruckanstiegs).
Nach OP-Ende: Rocuronium (wenn eingesetzt): mit 2–4 mg/kgKG Sugammadex antagonisieren, wenn TOF ≤0,9
Postoperative Schmerztherapie: wenn PD-Katheter vorhanden: epidurale Analgesie, sonst Opioide, kombiniert mit NSAID.
Spezielle geburtshilfliche Anästhesie
Adipositas per magna
Adipositas per magna geht bei Schwangeren häufiger mit Schwangerschaftsdiabetes, Schwangerschaftshypertonie, Gestosen und Makrosomie (hohes Geburtsgewicht) des Kindes einher als bei normalgewichtigen Schwangeren. Die Sectiorate ist erhöht, ebenso die geburtshilfliche Letalität. Ein BMI von >40 erschwert die Anlage einer Spinal- oder Periduralanästhesie, sodass häufiger auf eine Allgemeinanästhesie übergegangen werden muss, besonders, wenn die Anlage unter Zeitdruck erfolgt. Darum sollte ein Periduralkatheter frühzeitig angelegt werden. Postoperativ ist eine lückenlose, sorgfältige Überwachung erforderlich, auch nach Regionalanästhesien.
Beckenendlage
Bei vaginaler Entbindung kann eine Periduralanästhesie durchgeführt werden. Hierbei dürfen jedoch die zum Pressen erforderlichen Muskelkräfte nicht ausgeschaltet werden. Der Beckenboden muss für die Austreibung gut anästhesiert sein.
Ist eine Allgemeinnarkose vorgesehen, wird die Patientin intubiert und relaxiert. Für eine Zangenextraktion ist eine gute Uterusrelaxierung erforderlich. Methode der Wahl ist die tiefe Inhalationsnarkose + 100% Sauerstoff. Die Narkose muss rasch eingeleitet werden.
Das Inhalationsanästhetikum wird nur solange zugeführt, bis Gesäß und Füße des Kindes entwickelt worden sind. Danach Zufuhr des Anästhetikums sofort abstellen und durch Hyperventilation rasch eliminieren (sonst besteht die Gefahr der Uterusatonie mit Verblutungsgefahr!).
Zwillingsgeburt
Bei der Zwillingsgeburt bestehen folgende Besonderheiten, die für den Anästhesisten von Bedeutung sind:
die hämodynamischen Veränderungen bei der Schwangeren sind oft ausgeprägter,
Präeklampsie/Eklampsie ist häufiger,
abnorme Kindslagen sind zu erwarten,
Blutverluste sind größer,
die Kinder sind mehr gefährdet, besonders das Zweitgeborene,
die Unreife der Kinder ist 10-mal höher als bei Einlingen.
Praktische Grundsätze bei der Zwillingsgeburt
Die vaginale Entbindung sollte in Peridural- oder Spinalanästhesie durchgeführt werden: Sie erleichtert das geburtshilfliche Vorgehen und wirkt sich dadurch günstig für die Kinder aus.
Kann das 2. Kind aus ungünstiger Geburtslage nur mit geburtshilflichen Maßnahmen entwickelt werden, empfiehlt sich die bei der Beckenendlage beschriebene Inhalationsnarkosemethode (Abschn. 20.6.1).
Bei Sectio caesarea kann eine Allgemeinnarkose oder eine Periduralanästhesie durchgeführt werden.
Frühgeburt
Frühgeborene werden durch die Anästhesie besonders gefährdet. Sie reagieren sehr empfindlich auf Opioide, Sedativa und Anästhetika, die der Mutter während des Geburtsvorgangs verabreicht wurden.
Vaginale Entbindung
Sie erfolgt gewöhnlich langsam und behutsam mit geringem Pressen durch die Schwangere. Nach Episiotomie (Dammschnitt) wird meist eine Zangenextraktion unter regionaler Anästhesie des Beckenbodens durchgeführt. Hierfür eignet sich besonders gut die Periduralanästhesie, weil sie den Beckenboden vollständig relaxiert, wenn das Lokalanästhetikum in höherer Konzentration angewandt wird.
Sectio caesarea
Die Spinal- oder Periduralanästhesie ist vorzuziehen, weil sie die zentral dämpfenden Wirkungen der Allgemeinanästhetika auf den Feten vermeidet. Unabhängig von der Anästhesiemethode ist aber immer mit erheblicher Depression des Neugeborenen zu rechnen, sodass häufig Reanimationsmaßnahmen erforderlich sind.
Peripartale Blutungen
Blutungen in der Spätschwangerschaft sind nach der Lungenembolie die zweithäufigste Ursache der Müttersterblichkeit. Weltweit sterben ca. 140.000 jährlich durch peripartale Blutungen. Folgende wesentliche Grundmechanismen können eine peripartale Blutung auslösen:
Uterusatonie (mit 75% die Hauptursache),
Placenta praevia, increta oder accreta,
vorzeitige Placentalösung,
geburtstraumatische Verletzungen: Zervixrisse, Scheidenrisse, Uterusruptur,
Gerinnungsstörungen nach Fruchtwasserembolie, Verdünnungskoagulopathie.
Bei der Placenta praevia ist die normale Plazenta an falscher Stelle im Uterus eingewachsen: Die Implantation erfolgte im unteren Uterussegment oder im Gebärmutterhals. Wenn sich der Muttermund während der Geburt erweitert, löst sich die Plazenta von ihrer muskulären Unterlage. Hierdurch können massivste Blutungen auftreten. Bei der Placenta increta sind die Plazentazotten bis in das Myometrium (Uterusmuskulatur) eingewachsen, bei der Placenta percreta bis in die Nachbarorgane
Bei vorzeitiger Plazentalösung löst sich die normal implantierte Plazenta bereits vor der Entbindung des Kindes. Hierdurch können ebenfalls erhebliche Blutverluste auftreten.
Blutungen gehören zu den führenden mütterlichen Todesursachen in der Geburtshilfe. Sie treten oft unerwartet auf und können innerhalb von Minuten zum Tod durch Verbluten führen!
Praktische Grundsätze bei präpartalen Blutungen
Bereits für die Untersuchung der nichtanästhesierten Schwangeren müssen Erythrozytenkonzentrate transfusionsbereit vorhanden sein.
Außerdem werden mehrere großlumige Venenkanülen gelegt.
Steht die Diagnose „Placenta praevia“ fest, wird bei lebensbedrohlicher Blutung und/oder Beeinträchtigung des Feten umgehend eine Sectio in Allgemeinnarkose durchgeführt. Ist die Patientin bereits im hypovolämischen Schock, müssen die Anästhetika besonders vorsichtig dosiert werden. Eine Regionalanästhesie ist im Schock immer kontraindiziert.
Bei vorzeitiger Plazentalösung mit schwerer Blutung wird die Sectio ebenfalls immer in Allgemeinnarkose durchgeführt.
Nach der Entbindung können bei der Mutter schwerste Gerinnungsstörungen mit erheblichen Blutverlusten auftreten. Bei Hyperfibrinolyse wird Tranexamsäure zugeführt. Der Fibrinogenspiegel sollte mit etwa 2–4 g Fibrinogen im Bereich von >150 mg/dl gehalten werden. Bei Thrombozytenzahlen <50.000/μl werden Thrombozytenpräparate zugeführt.
Präeklampsie und Eklampsie
Die Pathophysiologie dieser Erkrankung ist in 10.1007/978-3-662-50444-4_70 beschrieben. Sie muss bei allen Anästhesieverfahren besonders berücksichtigt werden.
Praktische Grundsätze bei Präeklampsie und Eklampsie
Gezielt auf Nebenwirkungen der antikonvulsiven Therapie (Magnesiumsulfat, Benzodiazepine, Phenytoin) achten (10.1007/978-3-662-50444-4_68).
Blutdruckabfälle müssen unbedingt vermieden werden, weil die ohnehin bereits eingeschränkte Uterusdurchblutung hierdurch weiter abnimmt. Gefährdung des Feten!
Blutdruckanstiege (>160 mmHg systolisch) müssen ebenfalls strikt vermieden werden, da sie zur Hirnblutung führen können. Akutbehandlung: Nifedipin oder Urapidil über Perfusor (off label).
Für die vaginale Entbindung ist die Periduralanästhesie meist gut geeignet, weil sie Schmerzen, Angst und Aufregung beseitigt. Die Periduralanästhesie darf aber nicht eingesetzt werden, um den erhöhten Blutdruck zu senken!
Vasopressoren dürfen nur mit allergrößter Vorsicht eingesetzt werden.
Die Sectio caesarea sollte in Allgemeinnarkose (bevorzugt mit dem kurz wirkenden Remifentanil) durchgeführt werden; bei stabilen und bewusstseinsklaren Patientinnen sind auch regionale Anästhesieverfahren möglich (PDA, SPA).
Blutdruckanstiege bei der Intubation und bei OP-Beginn müssen strikt vermieden werden; wenn erforderlich, können bei der Narkoseeinleitung prophylaktisch β-Blocker, z. B. Esmolol oder Metoprolol zugeführt werden!
Rasche Zufuhr von Volumen kann bei Präeklampsie-/Eklampsie-Patientinnen ein akutes Linksherzversagen auslösen und muss daher unterbleiben.
Magnesium verstärkt die Wirkung depolarisierender und nichtdepolarisierender Muskelrelaxanzien.
Postoperativ sollten Patientinnen mit schwerer Präeklampsie/Eklampsie auf eine Intensivstation verlegt werden.
Herzerkrankungen
Bei Patientinnen mit Herzerkrankungen darf niemals starr schematisch vorgegangen werden. Vielmehr müssen die pathophysiologischen Veränderungen durch die Herzerkrankung zusammen mit den durch die Schwangerschaft ausgelösten kardiovaskulären Veränderungen eingeschätzt werden. Hiernach wird das anästhesiologische Vorgehen festgelegt.
Anästhesie während der Schwangerschaft
Grundsätzlich kommt es bei Narkosen während der Schwangerschaft für nichtgeburtshilfliche Eingriffe darauf an, ungünstige Einflüsse des Anästhesieverfahrens auf den Feten zu verhindern. Weitere Informationen zur Arzneimittelsicherheit in der Schwangerschaft bieten Suchportale im Internet wie z. B. www.embryotox.de (Seite der Charite, Berlin).
Praktische Grundsätze
Wahleingriffe sollten frühestens 6 Wochen nach Ende der Schwangerschaft durchgeführt werden.
Dringlichere Operationen, die aber noch etwas verschoben werden können, sollten erst im 2. oder 3. Drittel der Schwangerschaft erfolgen. Während dieser Zeit ist aber die Aspirationsgefahr erhöht. Hierauf muss entsprechend Rücksicht genommen werden. Das gilt in gleicher Weise für das V.-cava-Kompressionssyndrom. Die linke Seitenlage sollte darum bevorzugt werden.
Wenn möglich sollten regionale Anästhesieverfahren angewandt werden. Hierbei darf der Blutdruck aber nicht abfallen.
Wird eine Allgemeinnarkose durchgeführt, so spielt nach dem jetzigen Wissensstand die Auswahl des Narkosemittels keine wesentliche Rolle.
Während der Narkose müssen v. a. die arteriellen Blutgase im Normbereich der Schwangerenwerte gehalten werden.
Die Uterusdurchblutung darf nicht durch Anästhetika oder Anästhesieverfahren vermindert werden.
Medikamente während der Schwangerschaft
Die meisten von einer Schwangeren eingenommenen Medikamente gelangen über die Plazenta zum Feten. Einige wenige wirken reproduktionstoxisch (teratogen), besonders in der Zeit vom 18.–85. Tag nach der Befruchtung, aber auch in der Fetal- und Peripartalphase. Die gebräuchlichen Anästhesiesubstanzen sind dagegen als sicher anzusehen, ebenso die meisten der kurzfristig bei Narkosen eingesetzten Hilfsmedikamente. Eine umfassende Übersicht reproduktionstoxischer Medikamente und Substanzen findet sich auf der Webseite „Embryotox“ der Charite´ Universitätsmedizin Berlin.
Anästhesie während der Stillperiode
Bisher ist nicht bekannt, in welchen Konzentrationen die während der Stillperiode zugeführten Anästhetika und Hilfssubstanzen in der Muttermilch erscheinen und welche Wirkungen sie beim Kind hervorrufen. Weiterhin ist nicht bekannt, wie groß der Sicherheitsabstand zwischen Narkoseende und Wiederaufnahme des Stillens sein soll. Es kann jedoch nach den bisherigen Erfahrungen davon ausgegangen werden, dass die während einer Narkose in der Muttermilch erreichten Konzentrationen so gering sind, dass keine klinischen Effekte beim Kind auftreten. Daher gilt Folgendes:
Mit dem Stillen kann wenige Stunden nach der Operation wieder begonnen werden, sofern aus geburtshilflichen Gründen keine Kontraindikationen bestehen.
Regionalanästhesien könnten bei stillenden Müttern von Vorteil sein, da hiernach die Brustfütterung früher wieder aufgenommen werden kann.
Erstversorgung des Neugeborenen
Auf die Erde voller kaltem Wind
Kamt ihr alle als ein nacktes Kind.
Frierend lagt ihr ohne alle Hab
Als ein Weib euch eine Windel gab.
(Bert Brecht „Von der Freundlichkeit der Welt“)
Das Leben des Neugeborenen beginnt mit einschneidenden Veränderungen: Die intrauterin mit Flüssigkeit gefüllte Lunge entfaltet sich und übernimmt die eigene Atmung, während gleichzeitig der fetale Kreislauf umgeschaltet wird und das rechte Herz sein gesamtes Blutvolumen in den Lungenkreislauf pumpt. Diese Umstellung wird normalerweise ohne wesentliche Störung vollzogen. Etwa 10% aller Neugeborenen gelingt jedoch der Anpassungsvorgang nicht ohne äußere Hilfe. Atemstörungen stehen hierbei ganz im Vordergrund: Sie sind die häufigste Todesursache bei Neugeborenen.
Erstmaßnahmen
Die ersten Schritte bei der Versorgung eines Neugeborenen sind, unabhängig vom klinischen Zustand, immer gleich:
Sicherung der Atemwege,
Wärmeschutz.
Sicherung der Atemwege
Die aktuellen Leitlinien empfehlen, ein vitales, spontan atmendes Neugeborenes nicht abzusaugen. Selbst bei grünem Fruchtwasser bietet das Absaugen nach Durchtritt des Kopfes, aber vor dem ersten Schreien keine Vorteile. Sollte es jedoch durch Schleim, Blut und Lungenwasser in den oberen Luftwegen zur Behinderung der Eigenatmung des Neugeborenen kommen wird mit dem Absaugen des Mundes begonnen. Der untere Rachen darf hierbei nicht stimuliert werden, damit keine Bradykardie oder ein Laryngospasmus auftritt. Die Schwerkraft kann wirkungsvoll eingesetzt werden, um die Atemwege freizuhalten. Hierzu wird das Kind bereits vor der Abnabelung in die Kopf-tief-Position gebracht und auch in dieser Lage zum Versorgungstisch getragen. Das Absaugen erfolgt, mit speziellen Vorrichtungen, steril unter angepasstem Sog. Hierbei wird eine bestimmte Reihenfolge eingehalten:
Mund,
Rachen,
Nase,
Ösophagus und Magen.
Niemals darf die Nase zuerst abgesaugt werden, weil hierdurch die Atmung stimuliert wird und nachfolgend der in der Rachenhöhle befindliche Schleim oder Mekonium aspiriert werden können.
Sind Mund und Rachen abgesaugt worden, erfolgt die Sondierung der Nase; dies dient gleichzeitig zum Ausschluss einer Choanalatresie (Nasenmuschelatresie).
Hat sich die Atmung stabilisiert, kann der Magen abgesaugt werden. Durch Absaugen des Magens wird eine Regurgitation und Aspiration verhindert und außerdem die Durchgängigkeit des Ösophagus überprüft. Können mehr als 25 ml Mageninhalt abgesaugt werden, muss an eine Obstruktion des oberen Magen-Darm-Traktes gedacht werden.
Wärmeschutz
Wärmeschutz ist von allergrößter Bedeutung für das Neugeborene. Ein Abfall der Körpertemperatur steigert den O2-Verbrauch und führt zu metabolischer Azidose. Neugeborene können ihre Körpertemperatur nicht konstant halten, das Kältezittern fehlt. Auf eine kalte Umgebung reagiert die Haut mit Vasokonstriktion. Zur Wärmeproduktion wird das an verschiedenen Stellen des Körpers vorkommende braune Fettgewebe abgebaut. Beträgt die Temperatur im Entbindungszimmmer nur 20°C, fällt die Hauttemperatur des ungeschützten Neugeborenen innerhalb von 15 min um etwa 4°C ab.
Praktisches Vorgehen
Das Kind so schnell wie möglich nach der Geburt einhüllen und abtrocknen (trockene Neugeborenen haben einen ca. 5-mal geringeren Wärmeverlust).
Innerhalb 1 min nach der Geburt das Neugeborene in eine kontrollierte warme Umgebung bringen. Die Körpertemperatur sollte zwischen 36,5 und 37,5°C gehalten werden. Wärmeschutz wird z. B. erreicht durch einen Wärmestrahler über dem Versorgungstisch.
Hyperthermie muss vermieden werden, weil hierdurch ebenfalls der O2-Verbrauch gesteigert wird.
Klinische Einschätzung des Neugeborenen
Das Neugeborene wird bereits unmittelbar nach der Geburt klinisch eingeschätzt. Zu den einfachen Maßnahmen gehören die Beobachtung des ersten Atemzugs und Schreis und der kontinuierlichen Atmung sowie die Erhebung des Apgar-Scores. Ergänzend wird der Thorax auskultiert und, wenn erforderlich, der Blutdruck und die Körpertemperatur gemessen.
Erweiterte Maßnahmen sind: Bestimmungen der Blutgase, der Säure-Basen-Parameter, des Blutzuckers und des Hämatokrits.
Apgar-Score
Mit Hilfe des von der amerikanischen Anästhesistin Virginia Apgar entwickelten Scores kann der Zustand des Neugeborenen auf einfache Weise klinisch eingeschätzt werden. Der Apgar-Score berücksichtigt fünf Merkmale:
Atmung,
Puls,
Grundtonus,
Aussehen,
Reflexerregbarkeit.
Die Apgar-Werte werden 1, 5 und 10 min nach der Geburt bestimmt. Fehlen, Vorhandensein und Stärke eines Merkmals werden mit 0, 1 oder 2 benotet. Jedes Merkmal muss getrennt beurteilt werden.
Atmung
Während und unmittelbar nach der Geburt wird Flüssigkeit aus der Lunge in den Kehlkopf und den Mund gepresst.
Der erste Atemzug erfolgt nach 20–30 s. Hierbei erzeugt das Kind einen Sog von etwa 70 cmH2O; Luft dringt langsam in die Lungen ein. Danach wird der Atem für 2 s angehalten. Der größte Anteil der zuerst eingeatmeten Luft bleibt in der Lunge als Teil der sich entwickelnden funktionellen Residualkapazität. Die nächsten Atemzüge laufen ähnlich ab; es bleibt jedoch jedes Mal weniger Luft in der Lunge zurück.
Der erste Schrei sollte innerhalb von 1½ min nach der Geburt zu vernehmen sein.
Die Spontanatmung sollte ebenfalls innerhalb von 1½ min nach der Geburt „regelmäßig“ sein. Die Atemfrequenz liegt normalerweise zwischen 30 und 60/min.
Ursachen von Atemstillstand oder langsamer Atmung (<30/min)
Intrauteriner Asphyxie,
Hirnschädigung,
Medikamentenzufuhr an die Mutter (Anästhetika, Sedativa, Analgetika),
Infektionen usw.,
eine Apnoe kann allein oder in Verbindung mit Blutdruckabfall und Bradykardie auftreten.
Ursachen einer Tachypnoe (>60/min)
Volumenmangel (weiße Asphyxie),
Hypoxie,
Hirnblutungen,
Atemnotsyndrom,
Aspiration usw.
Puls
Zum Zeitpunkt der Geburt beträgt die Herzfrequenz meist 120–160/min. Frequenzen <100/min werden als Bradykardie bezeichnet. Sie sind häufig mit schwerer Asphyxie und niedrigem Herzzeitvolumen verbunden. Tachykardien können durch Schock bedingt sein.
Die Blutdruckmessung gehört nicht zur Routineeinschätzung, der Normalwert liegt bei >40 mmHg systolisch.
Grundtonus
Die meisten Neugeborenen, auch die Frühgeborenen, sind gleich nach der Geburt aktiv und bewegen alle Extremitäten. Ein schlaffer oder verminderter Muskeltonus tritt v. a. auf bei:
Asphyxie,
Medikamentenzufuhr an die Mutter (Anästhetika, Sedativa, Analgetika) und
Hirnschädigung.
Aussehen
Alle Kinder sind unmittelbar nach der Geburt blau (evtl. Ausnahme: Sectio), werden aber rasch rosig, sobald sich die Atmung stabilisiert hat.
Innerhalb von 90 s sind die meisten Kinder am Stamm rosig, während die Füße, Hände und Lippen meist noch blau sind. Sind die Kinder nach 90 s immer noch blau, so kommen v. a. folgende Ursachen infrage:
niedriges Herzzeitvolumen,
Atemnotsyndrom,
zyanotischer Herzfehler,
Methämoglobinämie,
Verlegung der Atemwege,
Lungenhypoplasie,
Polyzythämie.
An diese Erkrankungen muss v. a. gedacht werden, wenn durch O2-Zufuhr die Hautfarbe nicht rosig wird. Ist das Neugeborene blass, so sind die Blutgefäße eng gestellt. Die wichtigsten Ursachen sind:
Hypovolämie (weiße Asphyxie),
schwere Azidose,
Mekoniumaspiration,
Anämie.
Sieht ein Neugeborenes auch bei Luftatmung hellrosa aus, können folgende Ursachen vorliegen:
Magnesiumintoxikation (Eklampsietherapie der Mutter),
Alkoholintoxikation,
Alkalose.
Reflexerregbarkeit
Die normale Reaktion auf Beklopfen der Fußsohlen besteht in einer aktiven Bewegung der Beine.
Das Einführen eines Nasenkatheters führt zu Niesen oder Husten.
Fehlende Reflexerregbarkeit wird beobachtet bei:
Hypoxie,
Azidose,
Medikamentenzufuhr an die Mutter,
Schädigung des zentralen Nervensystems.
Ergebnis des Apgar-Scores
Die fünf Merkmale werden anhand des nachstehenden Apgar-Schemas (Tab. 20.2) beobachtet und benotet.
| Merkmal | 0 | 1 | 2 |
|---|---|---|---|
| Atmung | Fehlt | Schnappatmung, unregelmäßig | Gut, schreit kräftig |
| Puls | Fehlt | <100 | >100 |
| Grundtonus | Schlaff | Mittel, geringe Beugung | Gut, aktive Bewegung |
| Aussehen | Blass oder blau | Stamm rosig, Extremitäten blau | Rosig |
| Reflexe | Keine | Grimassiert | Niesen, Husten, Schreien |
Einstufung nach den Apgar-Werten
Apgar 8, 9, 10: lebensfrische Neugeborene, die gut atmen oder kräftig schreien. Dies sind 90% aller Neugeborenen. Routinebehandlung: Abtrocknen, Wärmeschutz. Nach 5 min erneut Apgar-Kontrolle
Apgar 5, 6, 7: leichte Neugeborenendepression
Apgar 3, 4: mäßige Neugeborenendepression
Apgar 0, 1, 2: schwere Neugeborenendepression
Wertigkeit der Apgar-Merkmale
Die Apgar-Werte dürfen nicht isoliert, sondern müssen immer zusammen beurteilt werden. Die Festlegung der ersten Einstufung nach 1 min ist willkürlich und wird nicht allen Neugeborenen gerecht. So können sich, z. B., anfänglich als gut bewertete Kinder sekundär durch Verlegung der Atemwege verschlechtern. Zudem wäre es unsinnig, bei schwer asphyktischen Kindern die Benotung und Behandlung erst nach Ablauf 1 min zu beginnen. Insgesamt sollte in den ersten Minuten bei der Einschätzung und Behandlung nicht starr nach Schema, sondern flexibel vorgegangen werden.
Für die neurologische Prognose eines Kindes reichen die Apgar-Werte nicht aus, sodass bei schlechten Apgar-Werten zum Zeitpunkt der Einschätzung eine pessimistische Haltung nicht gerechtfertigt ist.
Erstversorgung des unauffälligen Neugeborenen
Hierbei handelt es sich um Neugeborene nach komplikationslosem Geburtsvorgang bei klarem Fruchtwasser und unauffälligem erstem Schrei. Das Vorgehen geschieht in folgender Reihenfolge:
abnabeln,
abtrocknen,
wärmen.
- Dann folgt die Einschätzung von:
- Aussehen: Haut rosig, periphere/zentrale Zyanose,
- Atmung: Thoraxbewegungen, Atemfrequenz: f = 40–60/min,
- Herzfrequenz: 130–140/min,
- Zustandsbeurteilung nach dem Apgar-Schema.
Von praktischer Bedeutung ist die Einschätzung der Atmung und der Herzfrequenz nach 1 und nach 5 min.
Praktisches Vorgehen
Wärmeschutz,
Lagerung auf dem Rücken, wenn erforderlich 2–3 cm dickes Tuch unter die Schultern,
nur wenn indiziert: Absaugen von 1. Mund und 2. Nase (max. Sog 0,1 bar),
taktile Stimulation der Atmung: Rücken reiben, Fußsohlen stimulieren, Absaugen,
wenn erforderlich: Sauerstoff über Gesichtsmaske.
Reanimation bei Neugeborenendepression
Das Ausmaß der Neugeborenendepression kann bei den allermeisten Kindern mit dem Apgar-Score eingeschätzt werden. Dabei gilt der nach 1 min erhobene Apgar-Wert als Richtschnur für die Wiederbelebungsmaßnahmen. Bei einem offensichtlich schwer asphyktischen Neugeborenen ist es aber falsch, gelassen 1 min abzuwarten, um den Apgar-Wert zu erheben. Vielmehr muss sofort mit der Reanimation begonnen werden.
Notfallausrüstung
Eine funktionierende Notfallausrüstung und Notfallmedikamente müssen vor der Geburt beim Versorgungstisch bereitgestellt werden.
Das wichtigste Zubehör der Notfallausrüstung
Verstellbarer Reanimationstisch
Infrarotstrahler als Wärmeschutz
Absaugvorrichtung
Absaugkatheter 5–12 F
Laryngoskop mit geradem Spatel 0 und 1 und gebogen 1
Endotrachealtuben 2,5, 3 und 3,5 mm
Babybeatmungsbeutel, evtl. Beatmungsgerät
Guedel-Tuben 000, 00, 0, 1
Atemmasken 0, 1, 2
O2-Quelle mit Flowmeter
Aufgewärmte, trockene Tücher
Warmhaltefolie
EKG-Monitor mit Elektroden
Pulsoxymeter, Ultraschallblutdruckmessgerät, Stoppuhr, Thermometer
Scheren
Spritzen und Kanülen, Pflaster, Dreiwegehähne
Abnabelungsbesteck
Freilegungsbesteck und Katheter zur Katheterisierung der Nabelschnurgefäße (3,5 und 5 F)
Magensonde 5 F
Blutgasanalysator
Medikamente zur Herz-Kreislauf-Wiederbelebung: Atropin, Kalzium, Adrenalin, Isoproterenol, Dopamin
Puffersubstanzen: Natriumbikarbonat, Trispuffer
Glukoselösung 10–20%, Humanalbumin, Plasmaexpander
Konakion-Ampullen
Leichte Neugeborenendepression : Apgar 5, 6, 7
Diese Kinder haben wahrscheinlich kurz vor der Geburt eine leichte Asphyxie erlitten (Asphyxie = Hypoxie + Hyperkapnie; immer mit einer Azidose verbunden). Sie hypoventilieren oder sind apnoisch, reagieren aber meist auf kräftige Stimulation oder O2-Zufuhr über Maske.
Praktisches Vorgehen
Zunächst Atemwege freimachen. Nach Geburt des Kopfes Mund und Nase vorsichtig absaugen. Anschließend das Kind unter den Wärmestrahler auf die Seite in leichte Kopf-tief-Position legen.
Sanft stimulieren durch Abreiben des Körpers mit einem Tuch und vorsichtiges Beklopfen der Fußsohlen.
Dann Maske über das Gesicht halten und Sauerstoff zuführen (Abb. 20.4).
Maskenbeatmung oder Intubation sind meist nicht erforderlich. Zyanotische Kinder mit besseren Apgar-Werten erhalten ebenfalls Sauerstoff per Maske.
Mäßige Neugeborenendepression: Apgar 3, 4
Diese Kinder sind meist zyanotisch und hypoventilieren. Diagnostisch hilfreich sind Blutgase und ein Säure-Basen-Status aus Nabelarterien- oder Nabelvenenblut.
Praktisches Vorgehen
Atemwege freimachen, Wärmeschutz, Beatmung mit Maske/Beutel, zunächst mit Raumluft Abb. 20.5) Steigt hierunter die periphere saO2 nicht zufriedenstellend an, sollte die inspiratorische O2-Konzentration entsprechend erhöht werden. Während der Überdruckbeatmung den Kopf in neutraler Position lagern.
Hat das Kind noch nicht selbst geatmet, kann die Beatmung über die Maske sehr schwierig sein. Dann sollte intubiert werden.
Die ersten Beatmungszüge sollten das Atemmuster des Kindes nachahmen: Inspiration für 1–2 s anhalten. Der Druck für die Entfaltung der Lungen liegt meist unter 30 cm H2O.
Steigt der Apgar-Wert unter dieser Behandlung an, ist die Prognose gut.
Verschlechtert sich hingegen der Apgar-Wert, müssen weitere korrigierende Maßnahmen ergriffen werden (Abschn. 20.12.4).

Schwere Neugeborenendepression: Apgar 0, 1, 2 (3)
Diese Kinder sind schwer asphyktisch: Sie atmen nicht, sind schlaff und blass und reagieren nicht oder nur wenig auf Stimulation.
Neugeborene mit schwerer Depression müssen sofort reanimiert werden. Das Vorgehen ist im ERC-Algorithmus dargestellt (Abb. 20.6).
Reanimation der Atmung
Praktisches Vorgehen
Die wichtigsten Maßnahmen sind das Freimachen der Atemwege und die Belüftung der Lunge; erst dann erfolgt die Intubation.
Die Lungen mit sanftem Druck beatmen (Frequenz 40–60/min); meist reichen Drücke zwischen 20 und 30 cmH2O aus. Ist die Lunge jedoch sehr schlecht dehnbar (Lungenanomalien), sind nicht selten Drücke zwischen 50 und 60 cmH2O erforderlich.
Der paO2 sollte im Normbereich von 50–80 mmHg liegen. Hohe arterielle pO2-Werte müssen v. a. bei Frühgeborenen unbedingt vermieden werden (Gefahr der retrolentalen Fibroplasie mit Erblindung).
- Die Wirksamkeit der Beatmung wird an folgenden Zeichen erkannt:
- Der Brustkorb hebt sich beidseits.
- Die Atemgeräusche sind beidseits gleich laut zu hören.
- Die Herzfrequenz steigt an.
- Die Haut wird rosig.
Technik der Intubation (Abb. 20.7): Kleines oder mittelgroßes Laryngoskop mit geradem Spatel mit Daumen und Zeigefinger der linken Hand halten. Mittel- und Ringfinger dieser Hand ergreifen das Kinn des Neugeborenen, während der kleine Finger der linken Hand Druck auf das Zungenbein ausübt. Durch den Druck wird der Kehlkopf nach hinten verschoben, sodass die Glottis intubationsgerecht eingestellt werden kann. Tubus bis etwa 2–3 cm unterhalb der Glottis vorschieben. Ist die Intubation nicht möglich und reicht die Maskenbeatmung nicht aus, kann bei Neugeborenen >2.000 gKG und ≥34 SSW alternativ eine Larynxmaske eingeführt werden.
Bei der Intubation treten häufig Herzrhythmusstörungen auf.
Spricht das Kind nicht sofort auf eine richtig durchgeführte Beatmung an, liegt wahrscheinlich eine schwere Azidose vor.
Behandlung der Azidose
Während die respiratorische Komponente der Azidose durch ausreichende Ventilation beseitigt wird, muss die metabolische Komponente mit Puffersubstanzen korrigiert werden. Allerdings ist die Zufuhr von Puffersubstanzen nur selten erforderlich.
Blindpufferung
Eine Blindpufferung (nur, wenn Bestimmung des Säure-Basen-Status nicht möglich ist!) mit 1–3 mmol/kgKG 4,2%igem Natriumbikarbonat über 15 min oder 3–5 ml Trispuffer 0,3 molar wird durchgeführt, wenn trotz ausreichender O2-Beamtung
der Apgar-Wert nach 2 min 2 oder weniger beträgt,
der Apgar-Wert nach 5 min 5 oder weniger beträgt.
Pufferung nach Säure-Basen-Werten
Bei schwerer Neugeborenendepression sollte die metabolische Azidose immer nur anhand der Säure-Basen-Werte korrigiert werden.
Nach den Säure-Basen-Werten wird gepuffert, wenn:
der pH-Wert anfangs unter 7,0 liegt und der paCO2 normal ist,
der pH-Wert nach 5 min unter 7,05 liegt.
Leichte bis mäßige Azidosen (pH 7,05–7,3 mit Basendefizit von 5–15 mmol/l) benötigen zumeist keine Pufferung.
Für die Pufferung wird ein 3-Charr- oder 5-Charr-Katheter unter sterilen Bedingungen in die Nabelvene oder in eine der Nabelarterien eingeführt. Der Nabelarterienkatheter wird soweit vorgeschoben, bis Blut aspiriert werden kann; dann folgt ein weiteres Vorschieben um etwa 2 cm. Der Katheter liegt nun etwa in Höhe der Aortenbifurkation.
Der Nabelvenenkatheter wird durch die Nabelvene in den Ductus venosus und von hier aus in die untere Hohlvene bis in die Nähe des rechten Vorhofs geschoben. Eine Kanülierung der Lebervenen ist unbedingt zu vermeiden (später Röntgenkontrolle!).
Nebenwirkungen von Natriumbikarbonat
Hypernatriämie,
Hyperosmolarität,
Hirnblutungen.
Nebenwirkungen von Trispuffer
Apnoe,
Hypoglykämie,
Hypokaliämie.
Behandlung des Schocks
Eine schwere intrauterine Asphyxie führt bei den meisten Kindern zu einem Volumenmangel mit nachfolgendem Schock. Hiermit ist v. a. zu rechnen bei der Ruptur von Plazenta- oder Nabelschnurgefäßen, schwieriger Steißgeburt und Nabelschnurkompression.
Zeichen des Schocks
Blasse, kalte Extremitäten
Schwache Pulse
Tachykardie
Tachypnoe
Der Schockzustand ist häufig maskiert, weil die Gefäße kontrahiert sind und der Blutdruck zunächst normal bleibt. Nach Korrektur der Azidose fällt dann der Blutdruck ab. Der Blutdruckabfall bleibt aber meist unbemerkt, weil die Blutdruckmessung beim Neugeborenen nicht routinemäßig durchgeführt wird.
Zur Diagnostik gehören:
Blutgase,
Säure-Basen-Werte,
Hämatokrit,
Blutdruck,
evtl. Röntgenbild.
Der Schockzustand muss sofort behandelt werden.
Praktisches Vorgehen
Blut transfundieren, evtl. Plazentablut (aber: Infektionsgefahr),
steht kein Blut zur Verfügung: 10 ml/kgKG Vollelektrolytlösung, bei Bedarf wiederholt infundieren.
- Andere Gründe für einen Blutdruckabfall sind:
- Hypoglykämie (Blutzucker <20 mg/dl): 5–10 ml Glukose 10% injizieren!
- Hypokalzämie: 100 mg/kgKG Kalzium injizieren!
- Pneumothorax: Thoraxdrainage legen!
Kardiale Wiederbelebung
Die extrathorakale Herzkompression ist beim Neugeborenen nur sehr selten erforderlich. Sie muss erfolgen, wenn
keine Herztöne zu hören sind,
nach 15–30 s Beatmung die Herzfrequenz unter 60/min liegt.
Zur Herzmassage beide Daumen zwischen unterem und mittlerem Sternumdrittel aufsetzen (Abb. 20.8). Das Sternum jeweils 1–2 cm tief eindrücken, dabei kontinuierlich weiterbeatmen.
Kardiopulmonale Reanimation des Neugeborenen
Herzmassage: 120/min
Beatmung: 30/min
Verhältnis 3 : 1 (ergibt ca. 90 Kompressionen pro Minute)
Während der Kompressionen nicht beatmen
Alle 30 s Herzfrequenz überprüfen; wenn >60/min: Nicht mehr komprimieren, aber weiter beatmen
Die Wirksamkeit der kardiopulmonalen Wiederbelebung ist an folgenden Zeichen erkennbar:
die Hautfarbe am Stamm wird rosig,
die Pupillen werden mittelweit oder eng (unzuverlässiges Zeichen),
die Pulse der großen Arterien sind tastbar.
Für die medikamentöse Wiederbelebung werden die gleichen Medikamente zugeführt wie beim Erwachsenen (10.1007/978-3-662-50444-4_48). Fehlerhafte Anwendung und falsche Dosierung sind jedoch beim Neugeborenen besonders gefährlich. Die Medikamente werden in die Nabelvene bzw. einen Nabelgefäßkatheter injiziert. Vor der Injektion sollte der pH-Wert über 7,2 angehoben werden, um die Wirksamkeit der Medikamente zu verbessern. Bei Asystolie so rasch wie möglich 10–30 μg/kgKG Adrenalin als Bolus i.v. Die endotracheale Zufuhr von Adrenalin wird nicht mehr empfohlen. Reagiert das Neugeborene nicht auf diese Maßnahmen, sollte die Zufuhr von Vollelektrolytlösung, 10 ml/kgKG, erwogen werden, b. B. auch wiederholt (Blutverluste; Schock). Vorsicht bei Frühgeborenen: Gefahr von Hirnblutungen durch übermäßige Volumenzufuhr!
Beendigung der Reanimation
Ist beim gerade geborenen Kind keine Herzaktion vorhanden und bleibt sie auch für weitere 10 Minuten aus, kann die Einstellung der Reanimationsmaßnahmen erwogen werden. Die Entscheidung wird aber oft durch weitere Faktoren beeinflusst wie Ursache des Herzstillstandes, Gestationsalter, Reversibilität des Zustandes u.a.m.
Schwieriger ist die Entscheidung, wenn die Herzfrequenz nach der Geburt weniger als 60/min beträgt und trotz korrekter Reanimationsmaßnahmen nach 10–15 Minuten nicht wesentlich ansteigt. Für diesen Fall gibt es keine eindeutigen Empfehlungen, wie vorzugehen ist.
Die Eltern des Kindes sollten über den Zustand des Kindes im Verlauf unterrichtet werden, auch über die durchgeführten Maßnahmen und die Gründe dafür (im Krankenblatt dokumentieren!).
Spezielle Neugeborenenversorgung
Mekoniumaspiration
Das Vorhandensein von fetalem Darminhalt (Mekonium, Kindspech) ist ein Hinweis auf intrauterinen Stress und muss alle Beteiligten in Alarmbereitschaft versetzen! Nach den aktuellen ERC-Leitlinien wird das Absaugen eines vitalen Kindes nicht zwingend empfohlen. Bei nicht vitalen Neugeborenen oder Verlegung der Atemwege sollte jedoch eine Absaugung erwogen werden. Die routinemäßige tracheale Intubation wird bei nicht vitalen Neugeborenen nicht mehr generell empfohlen, sondern nur bei Verdacht auf eine Verlegung der Atemwege mit Mekonium.
Bei Verdacht auf eine Mekoniumaspiration hat die suffiziente Atemhilfe höchste Priorität, nicht die endotrachealee Intubation!
Unterkühlung
Unterkühlte Neugeborene sind zumeist azidotisch, oft auch hypoglykämisch, sodass die Zufuhr von Puffersubstanzen und Glukoselösung indiziert ist.
Die Aufwärmung des Neugeborenen muss langsam erfolgen, am besten in einem servoregulierten Inkubator, dessen Temperatur zunächst nur 2–3°C über die Rektaltemperatur des Kindes eingestellt wird. Die Aufwärmzeit sollte etwa 1,5°C/h betragen.
Dämpfung durch Opioide
Eine Atemdepression kann beim Neugeborenen bestehen, wenn die Schwangere unter der Geburt Opioide erhalten hat oder opioidabhängig ist.
Praktisches Vorgehen
Beruht die Atemdepression auf einer während der Geburt verabreichten (zu hohen) Opioiddosis, wird mit Naloxon (Narcanti) 0,01 mg/kgKG i.v. antagonisiert.
Ist die Atemdepression hingegen durch eine Opioidabhängigkeit der Mutter bedingt, darf kein Naloxon injiziert werden, weil hierdurch beim Neugeborenen ein akutes Entzugssyndrom ausgelöst werden kann.
Intoxikation mit Lokalanästhetika
Eine Intoxikation des Neugeborenen mit Lokalanästhetika kann auftreten, wenn sich bei der Schwangeren im Zusammenhang mit einer geburtshilflichen Regionalanästhesie hohe Blutspiegel des Lokalanästhetikums entwickelt haben (z. B. nach Überdosierung oder versehentlicher intravasaler Injektion).
Zeichen einer Lokalanästhetikumintoxikation
Bradykardie,
niedriger Blutdruck,
Atemstillstand,
schlaffer Muskeltonus,
generalisierte Krämpfe.
Behandlung
Reanimation,
Magenspülung,
Austauschtransfusion.
Pneumothorax
Ist die Lunge des Neugeborenen gesund, beruht ein Pneumothorax zumeist auf exzessiver Überdruckbeatmung durch den Ersthelfer. Andere Ursachen können sein:
Spontanpneumothorax,
Pneumothorax bei Mekoniumaspiration,
Zwerchfellhernie,
Lungenhypoplasie.
Bei einem Spannungspneumothorax muss sofort im 2. Interkostalraum (in der Medioklavikularlinie) punktiert und aspiriert werden. Danach folgen das Einlegen einer Thoraxdrainage und der Anschluss an einen Dauersog.
Contributor Information
Collaborators: Tobias Fink and Tilmann Müller-Wolff
Nachschlagen und Weiterlesen
- [1].Berger TM, Pilgrim S. Reanimation des Neugeborenen. Der Anästhesist. 2009;58:39. doi: 10.1007/s00101-008-1439-2. [DOI] [PubMed] [Google Scholar]
- [2].Dudenhausen J, Pschyrembel W, Obladen M. Praktische Geburtshilfe mit geburtshilflichen Operationen. Berlin: De Gruyter; 2011. [Google Scholar]
- [3].Goerke K, Steller J, Valet A. Klinikleitfaden Gynäkologie und Geburtshilfe. München: Elsevier; 2010. [Google Scholar]
- [4].Markus HE, Behrend A, Schier R. Anästhesiologisches Management der Sectio caesarea. Deutschlandweite Umfrage. 2011;60:916–928. doi: 10.1007/s00101-011-1931-y. [DOI] [PubMed] [Google Scholar]
- [5].Monsierus KG, Nolan JP, Bossaert LL, et al. Kurzdarstellung. Kapitel 1 der Leitlinien zur Reanimation 2015 des Europeas Resuscitation Council. Notfall Rettungsmed. 2015;18:655–747. doi: 10.1007/s10049-015-0097-6. [DOI] [Google Scholar]
- [6].Richmond S, Wyllie J. Versorgung und Reanimation des Neugeborenen. Notfall + Rettungsmedizin. 2010;13:665–678. doi: 10.1007/s10049-010-1373-0. [DOI] [Google Scholar]
- [7].Vetter K (2008) Die Versorgung des Neugeborenen durch den Geburtshelfer. Gynäkologe: 10.1007/s00129-007-2093–2095
Internet
- [8].DGAI,BDA, DGGG (2009) Empfehlungen: Durchführung von Analgesie- und Anästhesieverfahren in der Geburtshilfe. www.dgai.de
- [9].DGAI, BDA, DGGG (2011) Leitlinie Anwesenheit der Väter bei Sectio caesarea. AWMF online. www.dgai.de
- [10].Deutsche Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin, Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (2012) Leitlinie Betreuung des gesunden Neugeborenen im Kreißsaal und während des Wochenbettes der Mutter. www.uni-duesseldorf.de/AWMF
- [11].Embryotox. Arzneimittelsicherheit in der Schwangerschaft. www.embryotox.de
- [12].ERC-Leitlinien (2015) Die Versorgung und Reanimation des Neugeborenen. 10.1007/978-3-662-50444-4_7 der Leitlinien zur Reanimation 2015 des ERC www.cprguidelines.eu
- [13].Kainer F, Hasbargen U (2008) Notfälle in der Geburtshilfe – peripartale Blutungen. Deutsches Ärzteblatt 105 (37):629-638 und www.aerzteblatt.de/pdf/105/37/m629.pdf [DOI] [PMC free article] [PubMed]
- [14].WallenbornJ (2014) Notfallsituationen in der geburtshilflichen Anästhesie. Aktuelles Wissen für Anästhesisten. Refresher Kurs Nr. 40. www.ai-online.info