Abstract
Herzoperationen gehören zu den gefährlichsten Eingriffen in der operativen Medizin. Sie sind häufig gekennzeichnet durch rasch wechselnde Phasen extremer kardiovaskulärer Instabilität. Die Assistenz bei der herzchirurgischen Anästhesie gehört daher zu den anspruchsvollsten fachpflegerischen Tätigkeiten und erfordert ein hohes Maß an Kompetenz, Kooperationsfähigkeit, Flexibilität, Umsicht und Besonnenheit.
Herzoperationen gehören zu den gefährlichsten Eingriffen in der operativen Medizin. Sie sind häufig gekennzeichnet durch rasch wechselnde Phasen extremer kardiovaskulärer Instabilität. Die Assistenz bei der herzchirurgischen Anästhesie gehört daher zu den anspruchsvollsten fachpflegerischen Tätigkeiten und erfordert ein hohes Maß an Kompetenz, Kooperationsfähigkeit, Flexibilität, Umsicht und Besonnenheit.
Herz-Lungen-Maschine (HLM)
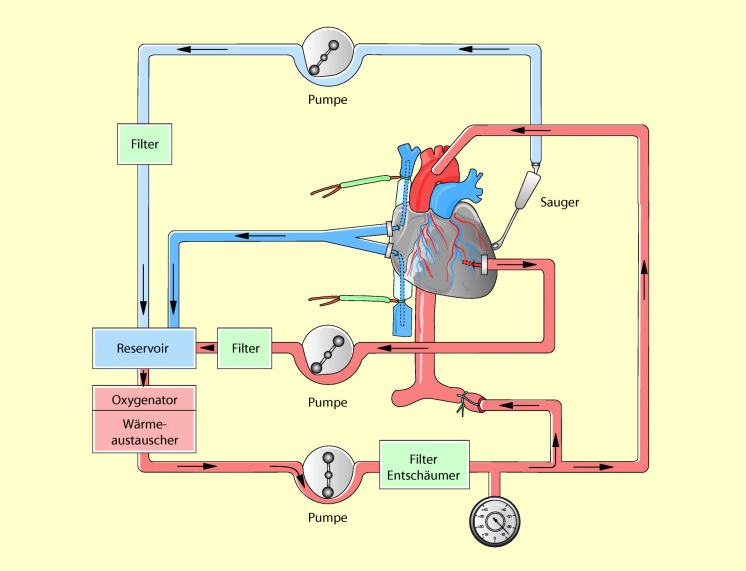
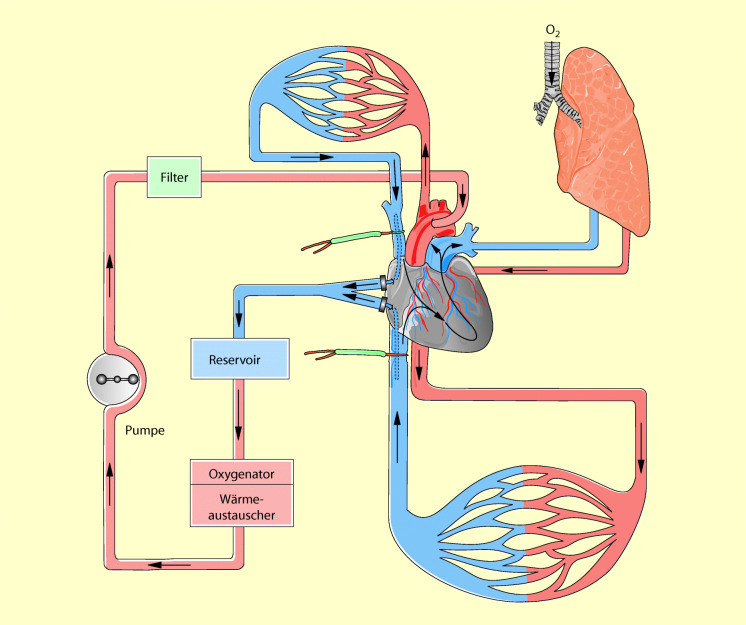
Zahlreiche Operationen des Herzens und der großen Gefäßen sind nur bei stillstehendem Herzen möglich. Darum müssen für diese Eingriffe das Herz und die Lungen aus dem normalen Kreislauf ausgeschaltet werden. Ihre Funktion wird durch eine außerhalb des Körpers befindliche Herz-Lungen-Maschine übernommen: die extrakorporale Zirkulation (EKZ) oder der Herz-Lungen-Bypass. Während des extrakorporalen Kreislaufs fließt das gesamte Venenblut des Patienten in den Oxygenator der Herz-Lungen-Maschine und wird von dort, nach Anreicherung mit Sauerstoff und Elimination von CO2, mit einer Rollerpumpe in den arteriellen Kreislauf des Patienten zurücktransportiert.
Extrakorporale Zirkulation – Bypassarten
Totaler Bypass
Beim totalen Bypass (Abb. 21.1) fließt das gesamte Blut über eine Kanüle im rechten Vorhof passiv aufgrund der Schwerkraft (Patient liegt höher als die HLM) in den Oxygenator und wird von dort, nach dem Gasaustausch, in eine große Arterie des Körpers – Aorta oder A. femoralis – zurückgepumpt. Hierbei fließt kein Blut mehr in das Herz und den Lungenkreislauf zurück. Beide Organe sind vollständig aus der normalen Zirkulation ausgeschaltet. Da der Oxygenator die Lungenfunktion übernimmt, ist eine Beatmung während des totalen Bypasses nicht erforderlich. Auch während des totalen Bypasses strömt noch eine gewisse Blutmenge über die Vv. thebesi und die Lungenvenen in das linke Herz ein. Dieses Blut wird über eine Kanüle im linken Ventrikel („Vent“) kontinuierlich abgesaugt, damit das Herz während des Stillstands nicht überdehnt wird.
Partieller Bypass
Während des partiellen Bypasses (Abb. 21.2) fließt ein Teil des Venenblutes wie bisher in den rechten Ventrikel und über den Lungenkreislauf in den linken Ventrikel und von dort in die Arterien des Körperkreislaufs. Die Pumpfunktion des Herzens ist hierbei also noch erhalten. Der restliche Teil des Blutes fließt über die noch nicht fest angeschlungene Hohlvenenkanüle zur HLM und wird von dort, nach Oxygenierung und CO2-Elimination, direkt über die Aorten- oder Femoraliskanüle, unter Umgehung von Herz und Lungen, in den arteriellen Kreislauf gepumpt. Während des partiellen Bypasses müssen die Lungen des Patienten beatmet werden.
Der partielle Bypass ist eine Übergangsphase zum Ein- oder Entwöhnen, jeweils wenige Minuten vor Beginn und nach Beendigung des totalen Bypasses. Außerdem wird der partielle Bypass unmittelbar nach dem operativen Eingriff eingesetzt, um das Herz beim Low-output-Syndrom vorübergehend zu unterstützen.
Aufhebung der Blutgerinnung
Vor Beginn der Kanülierung für die extrakorporale Zirkulation muss die Blutgerinnung vollständig mit Heparin aufgehoben werden, damit das Blut nicht in der Maschine gerinnt. Hierzu werden anfangs 300–400 IE/kgKG unfraktioniertes Heparin i.v. (zentralvenös) injiziert. Während des Bypasses wird die Blutgerinnung mit dem ACT-Test (ACT = activated clotting time) kontrolliert. Nachinjektionen erfolgen in Abhängigkeit vom ermittelten ACT-Wert mit 1/3 –1/2 der Ausgangsdosis direkt in die Herz-Lungen-Maschine.
ACT-Normalwerte 80–100 s,
angestrebte ACT-Werte während der extrakorporalen Zirkulation 400–600 s.
Hämodilution, Hypothermie, Thrombopenie und Thrombozytenaggregationshemmer verlängern die ACT. Beim Wiedererwärmen mit der HLM wird die ACT um ca. 10–30% verkürzt.
Bei HIT II werden Bivalidurin, Danaparoid oder Argatroban anstelle von Heparin eingesetzt.
Am Ende der extrakorporalen Zirkulation wird das Heparin mit Protamin antagonisiert und die Blutgerinnung auf diese Weise wiederhergestellt.
Dosierung
1 ml Protamin neutralisiert 1.000 IE Heparin.
Hypothermie
Die O2-Aufnahme eines Oxygenators ist begrenzt, ebenso der Blutfluss. Um die Organe vor den möglichen Folgen eines O2-Mangels während der extrakorporalen Zirkulation zu schützen, wird der O2-Verbrauch durch Abkühlung des Patienten auf etwa 30°C mit einem Wärmeaustauscher der HLM stark vermindert. Bei bestimmten Operationen angeborener Herzfehler wird die Temperatur sogar auf 16–20°C gesenkt. Unter dieser Temperatur kann der Kreislauf für eine begrenzte Zeit (bis zu 60 min) vollständig unterbrochen werden, sodass Operationen ohne Blutfluss und behindernde Schläuche in den großen Gefäßen durchführbar sind.
Myokardschutz
Struktur und Funktionsfähigkeit des Herzens werden durch die extrakorporale Zirkulation in hohem Maße gefährdet. Herzoperationen unter EKZ sind daher im Allgemeinen ohne spezielle myokardschützende Maßnahmen nicht möglich. Durch zwei Verfahren kann der Energiebedarf des Herzens so weit gesenkt werden, dass eine Koronardurchblutung auch bei länger dauernden Operationen nicht erforderlich ist: Hypothermie und Kardioplegie („Herzstillstand“). Das Myokard kann durch Übergießen des Herzens mit kalter Elektrolytlösung gekühlt werden; die Kardioplegie erfolgt durch Infusion einer kardioplegischen Lösung in den Koronarkreislauf. Durch die Kardioplegie entsteht ein schlaffer Herzstillstand.
Komplikationen durch extrakorporale Zirkulation
Durch die extrakorporale Zirkulation können vielfältige Störungen auftreten: Die wichtigsten sind:
Störungen der Blutgerinnung,
Wasser- und Elektrolytstörungen,
Blutzuckeranstieg,
Embolien,
Lungenfunktionsstörungen,
neurologische Störungen.
Störungen der Blutgerinnung
Ursachen
Die wichtigsten Ursachen von Blutungen in der Herzchirurgie sind, neben den chirurgischen, die Gerinnungsstörungen. Hierfür kommen v. a. folgende Faktoren in Frage:
Abfall und Funktionsverlust der Thrombozyten,
Überdosierung von Protamin,
ungenügende Antagonisierung von Heparin mit Protamin,
Mangel an plasmatischen Gerinnungsfaktoren durch Verbrauch,
Verbrauchskoagulopathie.
Daneben können weitere Faktoren zu Störungen der Blutgerinnung beitragen:
zyanotischer Herzfehler,
sehr lange Bypasszeit,
Patchverschlüsse von Defekten am Herzen,
anhaltende Unterkühlung,
extreme Hämodilution.
Prophylaxe
Für die Prophylaxe von Blutungen nach dem kardiopulmonalen Bypass werden fakultativ folgende Medikamente eingesetzt:
Desmopressin ( Minirin): Steigert die Konzentration bestimmter Gerinnungsfaktoren (Faktor VIII). Dosierung: 0,3–0,4 µg/kgKG als Kurzinfusion (mind. 20 min). Bei zu rascher Zufuhr: Gefahr des Blutdruckabfalls.
Synthetische Antifibrinolytika ( Aminokapronsäure, Tranexamsäure): Verhindern die Bindung zwischen Plasmin und Fibrinogen und wirken so einer Fibrinolyse entgegen. Dosierung: 100–150 mg/kgKG Aminokapronsäure oder 10–30 mg/kgKG Tranexamsäure als Bolus; danach ggf. kontinuierliche Infusion von 1–2 mg/kgKG/h.
Neurologische Störungen
Neurologische Störungen nach Operationen mit der Herz-Lungen-Maschine gehören zu den häufigen und typischen Komplikationen. Wichtigste Ursachen sind Embolien durch Luft, Fett, Mikroaggregate, Kalk und Plaques aus den großen Gefäßen. Hingegen scheint eine ungenügende Hirndurchblutung während der extrakorporalen Zirkulation ursächliche keine wesentliche Rolle zu spielen.
Neurologische Störungen können sich in folgender Weise manifestieren:
irreversibles Koma,
Schlaganfall,
fokale neurologische Ausfälle,
Verwirrtheit, Desorientiertheit, verzögertes Erwachen, vorübergehende Persönlichkeitsveränderungen.
Psychische und psychiatrische Störungen
Sie treten nach Herzoperationen ebenfalls gehäuft auf. Beobachtet werden Veränderungen der Gefühlslage, Verwirrtheit, Schlaflosigkeit, Unruhe, Depression, Delir oder Alpträume. Die Ursache dieser Störungen ist nicht bekannt.
Praxis der herzchirurgischen Anästhesie
Spezielle Einschätzung
Bei der präoperativen Visite muss sich der Anästhesist sorgfältig über Art und Schweregrad der Herzerkrankung informieren. Außerdem wird gezielt nach bestimmten Begleiterkrankungen gesucht, die den Verlauf und das Ergebnis der Operation beeinflussen können. Dies sind v. a.:
respiratorische Erkrankungen,
Infektionskrankheiten,
Nierenfunktionsstörungen,
Gerinnungsstörungen,
periphere Gefäßerkrankungen.
Wichtig ist auch die medikamentöse Vorbehandlung des Patienten. Besondere Aufmerksamkeit erfordert das aufklärende Gespräch, denn kaum eine Operation ist, aus verständlichen Gründen, so sehr mit Angst besetzt wie der Eingriff am Herzen.
Prämedikation
Die Prämedikation muss jeweils individuell dem Krankheitsbild und dem Schweregrad angepasst werden. Einzelheiten sind bei den entsprechenden Erkrankungen angegeben. Auf die Gabe von Atropin wird im Allgemeinen verzichtet.
Auswahl der Narkosemittel
Grundsätzlich werden Anästhetika verwendet, die eine möglichst geringe Wirkung auf das Herz-Kreislauf-System haben, gleichzeitig aber auch genügend Schutz vor anästhesiologischen und chirurgischen Stimuli bieten. Keine Substanz erfüllt für sich allein diese Forderungen. Darum wird meist eine balancierte Anästhesie (Opioid + Inhalationsanästhetikum) oder TIVA, z. B. Opioid + Propofol oder (bei kardialen Hochrisikopatienten) Opioid + Benzodiazepin) durchgeführt. Für die Narkoseeinleitung, werden je nach kardialem Funktionszustand, Etomidat oder Propofol, manchmal auch Ketamin eingesetzt. Die Muskelrelaxierung erfolgt mit ND-Relaxanzien.
Herz-Kreislauf-wirksame Pharmaka
Perioperativ müssen beim herzchirurgischen Patienten häufig kardiovaskuläre Medikamente zugeführt werden. Die wichtigsten Substanzen und ihre Dosierung sind in Tab. 21.1 zusammengefasst. Wegen der besseren Steuerbarkeit sollten Herz-Kreislauf-Medikamente mit einem Perfusor zugeführt werden. Weitere Einzelheiten 10.1007/978-3-662-50444-4_2 und 10.1007/978-3-662-50444-4_45.
| Medikament | Dosierung (über Perfusor) |
|---|---|
| Noradrenalin | 0,2–1 µg/kgKG/min |
| Dopamin | 3–30 µg/kgKG/min |
| Dobutamin | 2–20 µg/kgKG/min |
| Adrenalin | 0,005–0,5 µg//kgKG/min |
| Lidocain | 1–5 mg/min |
| Nitroglycerin | 25–300 µg/min |
Anstelle von Elektrolytlösungen kann auch Glukose 5% als Infusionslösung gewählt werden.
Überwachung während der Narkose
Bei herzchirurgischen Eingriffen muss die Herz-Kreislauf-Funktion umfassend überwacht werden. Hierfür ist ein invasives Vorgehen erforderlich. Folgende Überwachungsmaßnahmen werden eingesetzt:
- Vor der Narkoseeinleitung:
- EKG-Monitor,
- Pulsoxymeter,
- intraarterielle Blutdruckmessung.
- Nach der Narkoseeinleitung:
- Kapnometer,
- zentrale Venendruckmessung,
- Pulmonaliskatheter, linker Vorhofkatheter, TEE,
- Temperatursonde,
- Blasenkatheter,
- arterielle und venöse Blutgase, Hämatokrit, Elektrolyte (Kalium!), Osmolarität, Blutzucker.
Praktisches Vorgehen bei Operationen mit der Herz-Lungen-Maschine
Operationen mit der Herz-Lungen-Maschine (Abb. 21.3) werden in der Regel in Rückenlage des Patienten durchgeführt. Der Zugang zum Herzen erfolgt über eine mediane Sternotomie.
Vor der Narkoseeinleitung
Praktisches Vorgehen
- Sofort nach der Ankunft des Patienten:
- EKG-Monitor und Pulsoxymeter anschließen,
- Blutdruck und Herzfrequenz bestimmen,
- Werte ins Narkoseprotokoll eintragen.
Danach großlumige Venenkanüle legen, Elektrolytinfusionslösung anschließen und Antibiotikum zuführen.
Bei hohem Blutdruck und/oder Tachykardie durch Angst und Aufregung (Koronarkranke!): Sedativum injizieren; Dosierung immer nach Wirkung, niemals schematisch, z. B. Midazolam, Flunitrazepam, evtl. auch Fentanyl (Atmung überwachen!).
Bei pektanginösen Beschwerden: Nitroglycerin als Spray verabreichen.
Arterielle Kanüle in die A. radialis der nicht dominanten Hand (unter Lokalanästhesie, vor Narkoseeinleitung) legen. Größen: Erwachsene 20 G, Kinder 20 oder 22–24 G. Ausnahmen: Bei Entnahme der linken A. radialis als Bypass: rechte A. radialis kanülieren. Bei Operationen an der Aorta wird die rechte A. radialis kanüliert, weil durch die Aortenklemme die linke A. subclavia abgeklemmt werden kann (dann Puls- und Drucklosigkeit in der linken A. radialis).
Bei vorangegangenen Herzkatheterisierungen arterielle Kanüle nicht auf der Seite des Herzkatheterzugangs legen, weil hierbei oft intraoperativ Störungen der Druckmessung auftreten. Alternativer Zugangsweg, auch bei Kindern: Katheterisierung der A. femoralis mit Seldinger-Technik (17, 18 oder 20 G).
Wenn erforderlich Pulmonaliskatheter mit Seldinger-Technik über die V. jugularis interna oder die V. subclavia einführen. Der Katheter dient zur Messung von Pulmonalarteriendruck, Lungenkapillarenverschlussdruck (Wedge-Druck) und Herzzeitvolumen (Kälteverdünnungsmethode).
Narkoseeinleitung
Die Narkoseeinleitung muss immer zu zweit erfolgen! Eine Person injiziert die Medikamente und überwacht dabei die Herz-Kreislauf-Funktion, die andere Person sichert die Atemwege und unterstützt die Atmung des Patienten.
Für die Einleitung gilt der Grundsatz: ruhig – besonnen – ohne Hast! Alle Medikamente müssen langsam injiziert und nach Wirkung dosiert werden; das Körpergewicht dient nur als Anhaltspunkt.
Um eine ausreichende Narkosetiefe für die Intubation zu erreichen, müssen meist mehrere Medikamente kombiniert werden. In jedem Fall ist ein individuelles Vorgehen erforderlich, das sich v. a. an der zugrunde liegenden Herzerkrankung orientieren muss.
Praktisches Vorgehen (Beispiel)
O2-Voratmung 3–5 min über Maske.
Sufentanil, 0,01–0,03 µg als Bolus langsam i.v. oder 0,1–0,3 mg Fentanyl. Zu schnelle Injektion kann zu Blutdruckabfall und Bradykardie führen; meist ist auch die Muskelsteife stärker ausgeprägt. Falls erforderlich: zusätzlich kleine Dosen Midazolam oder Flunitrazepam.
Kommando-Atmung, dann assistierte/kontrollierte Beatmung über Maske. Hierbei nicht zu hohen Überdruck anwenden, da sonst der intrathorakale Druck ansteigt und hierdurch der Blutdruck abfällt!
ND-Muskelrelaxanz in Intubationsdosis, z.B. Rocuronium 0,6–0,12 mg/kgKG i.v.
Etomidat 0,2–0,3 mg/kgKG (Richtdosis) alternativ: Propofol, dosiert nach Wirkung,
danach Laryngoskopie (erster größerer Stimulus!). Reagiert der Kreislauf des Patienten nicht mehr auf die Laryngoskopie, erfolgt der nächste Schritt:
Endotracheale Intubation: bevorzugt oral, da bei nasaler Intubation Gefahr von Blutungen unter der Heparinisierung.
Besonders für den Koronarkranken ist die Intubation ein maximaler Stimulus, bei dem der Blutdruck und/oder die Herzfrequenz bedrohlich ansteigen können, wenn die Narkose nicht tief genug ist.
Mehrlumenkatheter über rechte V. jugularis interna einführen (meist nach Narkoseeinleitung). Der Katheter dient der Messung des zentralen Venendrucks und der Zufuhr Herz-Kreislauf-wirksamer Medikamente sowie von Heparin, Puffersubstanzen usw. Bei Kleinkindern: V. jugularis interna mit Seldinger-Technik, 18 oder 20 G. Die V. jugularis externa kann ebenfalls punktiert werden; häufig lässt sich jedoch der Katheter nicht zentral platzieren.
Wenn erforderlich: zusätzlich Schleuse in die rechte V. jugularis interna einlegen (für Pulmonaliskatheter oder raschen Volumenersatz).
Blasenkatheter,
Magensonde, oral einführen wegen Blutungsgefahr,
Thermosonde (rektal und/oder ösophageal),
Augenschutz.
Tranexamsäure 10–30 mg/kgKG i.v. oder Aminokapronsäure i.v., 100–150 mg/kgKG, danach 10% der Anfangsdosis.
Nach diesen Stimulationen sinkt der Bedarf an Anästhetika zunächst ab. In der folgenden Phase müssen dann v. a. Blutdruckabfälle verhindert werden Darum sollten Inhalationsanästhetika und Vasodilatatoren (z. B. Nitroglycerin) reduziert werden.
Bei leichten Blutdruckabfällen: sofort Beine hoch bzw. Kopftieflage, Volumenzufuhr steigern.
Spricht der Patient auf diese Maßnahmen nicht an: Vasopressoren (z. B. Akrinor oder Arterenol) titrierend injizieren.
Koronarkranke bzw. Hypertoniker reagieren häufig bereits auf geringste Dosen von Vasopressoren mit exzessiven Blutdruckanstiegen. Bei diesen Patienten muss besonders vorsichtig infundiert werden. Niemals Noradrenalin „im Strahl“ zuführen.
Narkoseführung bis zum Herz-Lungen-Bypass
Praktisches Vorgehen
Die Narkose wird mit Sufentanil (oder Remifentanil) in einer Dosierung von etwa 0,5–1 μg/kgKG/h aufrechterhalten (per Infusion), ergänzt durch Propofol, ca. 3–4 mg/kgKG/h über Perfusor. Bei Patienten mit guter Ventrikelfunktion kann auch ein Inhalationsanästhetikum zugeführt werden.
Die weitere Muskelrelaxierung erfolgt, z. B., mit Rocuronium.
Volumenzufuhr: plasmaisotone Elektrolytlösung für den Erhaltungsbedarf.
Einstellung des Respirators anhand der Blutgaswerte; Normoventilation.
Besonderheiten: Die stärksten chirurgischen Reize sind Hautinzision, Sternotomie und Präparation der großen Gefäße. Zu diesen Zeitpunkten ist der Anästhetikabedarf gewöhnlich am größten.
Kardiopulmonaler Bypass
Anschluss an die Herz-Lungen-Maschine (Abb. 21.4)

Praktisches Vorgehen
Nach Eröffnung des Perikards schlingt der Operateur die obere und untere Hohlvene an.
Kontrollmessung der Blutgerinnung: ACT-Test. Danach werden 300–600 IE/kgKG Heparin in den zentralen Venenkatheter injiziert. Mit Kochsalzlösung nachspülen und Operateur informieren: „Heparin ist gegeben“! Erneute Kontrolle des ACT-Wertes nach ca. 2 min. Liegt der ACT-Wert >400 s, kann mit dem Bypass begonnen werden.
Der Operateur führt dann über den rechten Vorhof je eine Kanüle in die obere und untere Hohlvene oder lediglich einen Vorhofschlauch ein. Anschließend wird die Aorta ascendens kanüliert, in besonderen Fällen die A. femoralis.
Nach Abschluss der Kanülierungen beginnt der partielle Bypass.
Partieller Bypass
Praktisches Vorgehen
Den Patienten mit 100% Sauerstoff beatmen.
Narkose z. B. mit Remifentanil oder Sufentanil per Infusion in Kombination mit Propofol fortführen. Zufuhr eines Inhalationsanästhetikums in die Herz-Lungen-Maschine ist ebenfalls möglich, wenn eine Gasabsaugung (obligat!) eingesetzt wird.
Den Patienten erneut mit ausreichend hoher Rocuroniumdosis (4–8 mg) nachrelaxieren, damit er während der extrakorporalen Zirkulation nicht atmet.
Der partielle Bypass dauert nur wenige Minuten. In dieser Phase kann der Ventrikelsauger eingelegt und mit der Abkühlung des Patienten begonnen werden.
Totaler Bypass
Die Anweisung des Operateurs hierzu lautet: „Untere Hohlvene zu, obere Hohlvene zu!“
Praktisches Vorgehen
Beatmung sofort unterbrechen. Am Rotameter des Beatmungsgeräts Gasfluss von 1 l/min einstellen, sodass ein ständiger Druck von etwa 5 mmHg auf die Lungen einwirkt (nicht obligat).
Alle Infusionen, mit Ausnahme der Anästhetikaperfusoren, abstellen.
Bei Inhalationsanästhesie: Verdampfer nach Stabilisierung der extrakorporalen Zirkulation in den Kreislauf der HLM einschalten.
Alle erforderlichen Medikamente können über die HLM zugeführt werden.
Pupillengröße kontrollieren und auf dem Narkoseprotokoll vermerken.
Nach Platzierung des Ventrikelsaugers („Vent“) und Abkühlung beginnt das Herz meist spontan zu flimmern; oder das Flimmern wird induziert, indem der Operateur kalte Ringerlösung über das Herz gießt. Die Aorta wird abgeklemmt („Aorta zu!“) und anschließend eiskalte Kardioplegielösung in die Aortenwurzel infundiert. Sie fließt über den Koronarkreislauf in den rechten Vorhof und wird von dort abgesaugt.
Überwachung während des Bypasses
Klinische Überwachung
Die Kapillarfüllung soll prompt erfolgen.
Pupillengröße: eng und seitengleich in Opioidanästhesie; Pupillenerweiterung erst in tiefer Hypothermie.
Narkosetiefe: wenn verfügbar: EEG-Monitoring mit BIS oder Narcotrend.
Hypothermie verstärkt die Narkosetiefe und vermindert den Narkosemittelbedarf.
Zwerchfellbewegungen: Relaxierungsgrad unzureichend, pCO2 zu hoch!
EKG: Asystolie bei Kardioplegie, Kammerflimmern bei Hypothermie und erhaltener Koronardurchblutung, R-S-R bei Operationen in Normothermie am schlagenden Herzen. Auf Ischämiezeichen und Leitungsstörungen achten!
Temperatur: Messung im Blut (HLM), rektal, in der Harnblase oder ösophageal.
Hämodynamische Überwachung
Perfusionsdruck
Der Perfusionsdruck (mittlerer arterieller Blutdruck, MAP), gemessen in der A. radialis oder A. femoralis, soll zwischen 50 und 100 mmHg liegen.
Es gilt folgende einfache Beziehung: MAP = HZV × peripherer Gesamtwiderstand (Wper).
Das HZV ist durch die Maschine vorgegeben; daher verändert sich der MAP direkt durch den peripheren Gefäßwiderstand, wenn der Maschinenfluss konstant bleibt. Der MAP kann durch Medikamente, die den peripheren Widerstand beeinflussen, verändert werden.
Der Perfusionsdruck ist zu hoch (>100 mmHg):
Narkose vertiefen,
Nitroglycerin oder Urapidil (Ebrantil) infundieren (in die HLM).
Der Perfusionsdruck ist zu niedrig (<50 mmHg):
Narkose abflachen,
Noradrenalin (Arterenol) verabreichen (in die HLM).
In tiefer Hypothermie werden niedrigere Perfusionsdrücke toleriert (30–50 mmHg). Mit niedrigen Perfusionsdrücken ist v. a. kurz nach Beginn des Bypasses und in der Wiedererwärmungsphase zu rechnen.
Zentraler Venendruck
Er wird in der oberen Hohlvene gemessen. Der Katheter muss oberhalb der Hohlvenenkanüle für die HLM liegen. Bei Abflussbehinderungen aus dem Kopf steigt der zentrale Venendruck an (Hirnödemgefahr!). Bei gutem venösem Abfluss in die HLM ist der Venendruck 0 oder nahe 0.
Pulmonalarteriendruck, Wedge-Druck und linker Vorhofdruck
Sie sollen während des Bypasses ebenfalls 0 sein. Steigen die Drücke an, so deutet dies auf eine Überdehnung des linken Ventrikels hin (ungenügende Vent-Funktion).
Herzzeitvolumen
Die Pumpleistung der HLM wird während des totalen Bypasses zwischen 2,2–2,5 l/min/m2 gehalten. Sie kann je nach Körpertemperatur und Blutgaswerten um ±20% variiert werden. Bei Aorteninsuffizienz muss der Flow erhöht werden, wenn die Aorta nicht abgeklemmt ist.
Weiterhin ist zu beachten: Die Standard-Herz-Lungen-Maschine erzeugt einen nichtpulsierenden Blutfluss.
Urinausscheidung
Bei ausreichender Nierenfunktion (Pumpleistung) beträgt die Urinausscheidung 1 ml/kgKG/h. Bei zu geringer Urinausscheidung müssen die Ursachen gefunden und beseitigt werden:
Blasenkatheter verstopft oder diskonnektiert,
Blutfluss der HLM zu niedrig,
Volumenmangel (Diuretikavorbehandlung!),
Obstruktion der unteren Hohlvene,
tiefe Hypothermie,
nichtpulsatiler Fluss.
Behandlung während des Bypasses
Pumpleistung erhöhen,
Volumenmangel korrigieren,
Perfusionsdruck steigern,
Diuretika geben: Furosemid (Lasix), Mannitol (Osmofundin),
bei Hämolyse mit Hämaturie: Urinausscheidung mit Diuretika steigern, Urin mit ca. 50 mval Natriumbikarbonat i.v. alkalisieren.
Blutuntersuchungen während des Bypasses
Arterielle und zentralvenöse Blutgase und Säure-Basen-Parameter 5 min nach Beginn des totalen Bypasses, danach alle 30 min während des Bypasses und 5 min nach Abgehen von der HLM kontrollieren,
pO 2 , pCO 2 und pH müssen auf die Körpertemperatur des Patienten korrigiert werden. Die Werte sollten im Normbereich liegen.
Hämatokrit (am Bypass ca. 20-30%), Elektrolyte, Kalzium, Blutzucker,
ACT.
Narkose während des Bypasses
Grundsätzlich gilt: Der Narkosebedarf ist in Hypothermie stark herabgesetzt. In tiefer Hypothermie ist überhaupt keine Narkose erforderlich:
Remifentanil oder Sufentanil mit Propofol über Perfusoren verabreichen.
Die Zufuhr eines Inhalationsanästhetikums direkt über die Herz-Lungen-Maschine ist ebenfalls möglich (Narkosegasabsaugung!), wird aber wegen des Aufwands selten praktiziert.
Entwöhnung von der Herz-Lungen-Maschine
Voraussetzungen
Blutgase und Säure-Basen-Parameter normalisieren,
Kalium >4,0 mval/l,
Serumkalzium normalisieren, Körpertemperatur über 35°C rektal,
errechnete Protamindosis zur Infusion vorbereiten,
ausreichend Blutkonserven vorbereiten,
Herz-Kreislauf-wirksame Medikamente bereitstellen,
Pupillenweite kontrollieren.
Beginnt das Herz nach dem Aufwärmen nicht spontan zu entflimmern, wird es mit ca. 10–20 J intern defibrilliert. Nach Ausgleich der oben angegebenen Faktoren sowie Entlüftung von Herzkammern, Koronartransplantaten und Aortenwurzel wird mit der Entwöhnung von der Herz-Lungen-Maschine begonnen. Die Entwöhnung dauert in der Regel wenige Minuten, bei sehr schlechter Ventrikelfunktion erheblich länger.
Partieller Bypass
Den Patienten mit 100% Sauerstoff beatmen; kontrollieren, ob beide Lungen gut belüftet sind,
Höhe des Beatmungsdrucks überprüfen,
- nach Entfernen der Gefäßkanülen:
- Blutgerinnung nach Absprache mit dem Operateur mit Protamin wiederherstellen. Im Allgemeinen sind dafür 100–130% Protamin erforderlich.
- Faustregel: 1 ml Protamin neutralisiert 1000 IE Heparin. Protamin nicht als Bolus injizieren (Gefahr des Blutdruckabfalls), sondern über mindestens 15 min infundieren!
Nach dem kardiopulmonalen Bypass
Praktisches Vorgehen
Volumenverluste ersetzen. Möglichst frische Erythrozytenkonzentrate verwenden, keine Routinezufuhr von Gerinnungsfaktoren, Frischplasma oder Humanalbumin. Bei niedrigen Thrombozytenwerten: Thrombozytenkonzentrate infundieren. Steuerung der Volumenzufuhr v. a. nach dem zentralen Venendruck, der Ventrikelfüllung (TEE) und dem Blutdruck oder dem linken Vorhofdruck.
Blutungen sind meist chirurgisch bedingt. Andere wichtige Ursachen sind Thrombozytenmangel oder Thrombozytenfunktiosstörungen (z. B. durch die EKZ und durch Medikamente); ungenügende Neutralisierung von Heparin, Überdosierung von Protamin, Mangel an Gerinnungsfaktoren durch Hämodilution; extrem selten: Verbrauchskoagulopathie.
Vor dem Transport auf die Intensivstation den Patienten an einen transportablen Herzkreislaufmonitor (arterieller Druck und EKG, Pulsoxymeter, Kapnometer) anschließen. Notfallmedikamente bereitstellen.
Den Patienten erst dann auf die Intensivstation verlegen, wenn die Herz-Kreislauf-Funktion ausreichend stabil ist.
Für den Transport auf die Intensivstation sind 2 Personen erforderlich; davon 1 Anästhesist, der den Patienten dem diensthabenden Arzt der Intensivstation übergibt.
Koronarbypassoperationen
Koronarkreislauf und Sauerstoffverbrauch des Herzens
Die Funktion des Herzens ist von einer ausreichenden Blut- bzw. Energiezufuhr abhängig; sie erfolgt über den Koronarkreislauf. Unter physiologischen Bedingungen wird der Energiebedarf des Herzens durch den Abbau von Glukose, Laktat (!), Pyruvat und freien Fettsäuren gedeckt. Hierfür ist Sauerstoff erforderlich.
Die Koronardurchblutung passt sich dem Energiebedarf des Herzens automatisch an, ein Vorgang, der, wie beim Gehirn, als Autoregulation bezeichnet wird: Steigt der O2-Bedarf des Herzens, nimmt die Koronardurchblutung „automatisch“ zu, sinkt der O2-Bedarf, fällt die Koronardurchblutung ab. Diese automatische Anpassung der Koronardurchblutung an den Energiebedarf des Herzens ist über weite Bereiche vom koronaren Perfusionsdruck unabhängig (koronarer Perfusionsdruck = diastolischer Aortendruck – linksventrikulärem enddiastolischen Druck).
Koronardurchblutung und myokardialer O2-Verbrauch
Koronardurchblutung: 70–90 ml/min/100 g
O2-Verbrauch des Herzens: 7–11 ml/min/100 g
Sauerstoffverbrauch des Herzens
Der O2-Verbrauch des Herzens hängt ganz wesentlich von hämodynamischen Größen ab; sie werden als Hauptdeterminanten (bestimmende Faktoren) des myokardialen O2-Verbrauchs bezeichnet. Die Hauptdeterminanten sind für den Anästhesisten besonders wichtig, weil gerade sie durch Anästhetika sowie durch narkose- und operationsbedingte Stimuli beeinflusst werden.
Hauptdeterminanten des myokardialen Sauerstoffverbrauchs
Herzfrequenz
Kontraktilitätszustand
Wandspannung des Myokards
Herzfrequenz
Die Herzfrequenz wird ständig durch das autonome Nervensystem beeinflusst. Eine Stimulation des Parasympathikus verlangsamt, eine Stimulation des Sympathikus steigert die Herzfrequenz. Ein Anstieg der Herzfrequenz steigert auch die Arbeit des Herzens und erhöht den O2-Bedarf des Myokards. Ein Abfall der Herzfrequenz vermindert hingegen den O2-Bedarf des Herzens.
Myokardiale Kontraktilität
Die myokardiale Kontraktilität (Inotropie) bezieht sich auf die Kraft und Geschwindigkeit der Kontraktion sowie die Verkürzungsfähigkeit der Muskulatur in der Ventrikelwand. Ein Anstieg der Kontraktilität steigert den O2-Verbrauch des Herzens und umgekehrt. Die Kontraktilität wird von der Herzfrequenz, von Medikamenten und Anästhetika sowie von Erkrankungen der Ventrikelmuskulatur beeinflusst.
Wandspannung des Herzmuskels
Nehmen Ventrikelvolumen oder Ventrikeldruck zu, steigen auch die Wandspannung des Myokards und entsprechend der O2-Bedarf des Herzens an. Die Wandspannung kann mit Hilfe des endsystolischen Volumens (ESV) und des linksventrikulären enddiastolischen Drucks (LVEDP) sowie der maximalen Druckanstieggeschwindigkeit des linken Ventrikels eingeschätzt werden.
Koronare Hämodynamik
Die Koronardurchblutung hängt unter physiologischen Bedingungen hauptsächlich vom koronaren Perfusionsdruck und vom koronaren Widerstand ab. Sie erfolgt für den linken Ventrikel ganz überwiegend während der Diastole. Hypotone und hypertone Druckschwankungen haben gewöhnlich keinen Einfluss auf die Koronardurchblutung, weil Tonusänderungen in den Widerstandsgefäßen den Druckschwankungen entgegenwirken. Fällt der Perfusionsdruck, erweitern sich die Arteriolen kompensatorisch. Auf diese Weise bleibt die Durchblutung unverändert.
Dennoch darf natürlich ein kritischer Perfusionsdruck nicht unterschritten werden, damit keine Mangeldurchblutung des Herzmuskels auftritt.
Koronare Herzkrankheit
Die Angina pectoris ist das führende Symptom der Koronarkrankheit. Angina pectoris tritt auf, wenn der O2-Bedarf des Herzens die O2-Zufuhr zum Herzen mit dem Koronarblut überschreitet. Häufigste Ursache ist eine arteriosklerotische Einengung in einer oder mehreren größeren Koronararterien. Durch die Stenose ist die automatische Anpassung der Koronardurchblutung an den Energiebedarf des Herzens eingeschränkt. Je schwerer die Einengung der Koronararterie, desto weniger kann die Koronardurchblutung bei Belastung gesteigert werden. Schließlich tritt ein myokardiales Ungleichgewicht auf. Der O2-Bedarf ist größer als der Nachschub an Sauerstoff mit dem Koronarblut: eine Mangeldurchblutung des Myokards (Myokardischämie) ist die Folge. Bei schwerer Mangeldurchblutung tritt ein Myokardinfarkt auf.
Für die Narkosepraxis bedeutet dies:
Beim Koronarkranken dürfen keine Anästhetika verwendet werden, die den O2-Bedarf des Herzens steigern.
Blutdruckabfälle, z. B. durch Anästhetika, sind ebenfalls gefährlich, weil sie den koronaren Perfusionsdruck senken. Da aber durch die Stenose die kompensatorische Gefäßerweiterung eingeschränkt oder sogar ganz aufgehoben ist, nimmt die Koronardurchblutung ab und es kann eine Myokardischämie auftreten.
Das myokardiale O2-Gleichgewicht ist in Tab. 21.2 zusammengestellt. Auf der linken Seite der Tabelle sind die klinisch wichtigen Faktoren aufgeführt, die das O2-Angebot an das Herz bestimmen (Koronardurchblutung und O2-Gehalt im Koronarblut), und auf der rechten Seite die Faktoren, die im Wesentlichen den O2-Bedarf des Herzens beeinflussen. Störungen des Gleichgewichts können von beiden Seiten – auch in Kombination – ausgehen. Sie führen, je nach Ausprägung, zur Myokardischämie und zum Herzinfarkt.
| Sauerstoffangebot | Sauerstoffbedarf |
|---|---|
|
Koronardurchblutung: – Durchgängigkeit der Koronarien – Aortendruck – LVEDP – Diastolische Füllungszeit |
– Herzfrequenz – Blutdruck („afterload“) – Ventrikelvolumen („preload“) – Kontraktilität |
|
O2-Gehalt im Koronarblut: – Hämoglobingehalt – arterielle O2-Sättigung – O2-Bindungskurve |
Operation
Bei der aortokoronaren Bypass-Operation (ACB-Operation) wird der stenotische (verengte) Bereich der Koronararterie mit einem neu implantierten Gefäß (körpereigene Arterien und Venen) umgangen.
Aortokoronare Bypass-Operation
- OP: Überbrückung der Koronarstenose mit Bypass-Grafts (A. radialis, A. mammaria, V. saphena)
- Mit HLM = On-Bypass: Standardverfahren
- Ohne HLM am schlagenden Herzen = Off-pump-Bypass (OPCAB) oder minimal invasiv (MIDCAP)
OP-Lagerung: Rücken, mediane Sternotomie
OP-Dauer: ca. 3–4 h
Chirurgische Stimulation: sehr stark
Blutverluste: mäßig, 2–4 EKs
Anästhesie: ITN, 1 arterielle Kanüle, 2 Venenkanülen, 1 ZVK (3-Lumen), Blasenkatheter, Magensonde (oral) 2 Thermosonden, evtl. TEE
Vorbereitungen
Wie unter Abschn. 21.2.6 beschrieben. Bei Verwendung der linken A. radialis: linken Arm freilassen. Venenkanüle und arterielle Kanüle am rechten Unterarm einführen.
Anästhesie
Myokardischämie und Herzinfarkt sind die beiden Hauptrisiken für den Koronarpatienten in der perioperativen Phase.
Grundsätze für die Narkose
Herzfrequenz zwischen 50 und 60/min
Systolischer Druck nicht höher als 15–20% über oder unter Ausgangswert
Diastolischer Druck über 60 mmHg
Wedge-Druck unter 12 mmHg
Keine extreme Hämodilution
Postoperative Besonderheiten
Meist sind nur wenige Stunden Nachbeatmung auf der Intensivstation erforderlich: eine frühe Extubation ist besonders bei Verwendung von Remifentanil möglich (Fast-track-Anästhesie ). Eine postoperative Hypertonie tritt v. a. bei Hypertonikern auf.
Wichtigste OP-Komplikationen sind:
Myokardischämien bzw. Myokardinfarkt,
atriale Herzrhythmusstörungen: Vorhofflimmern oder -flattern,
bradykarde Herzrhythmusstörungen, AV-Überleitungsstörungen,
Verschluss des Bypasses: früh postoperativ 10% der venösen Bypässe.
Klappenchirurgie
Mitralstenose
Bei einer Mitralstenose wird der Blutstrom aus dem linken Vorhof in den rechten Ventrikel durch die verengte Mitralklappe behindert.
Operation
Die chirurgische Behandlung erfolgt, wenn möglich, als Mitralklappenrekonstruktion (bessere Langzeitergebnisse, geringere Frühletalität), ansonsten durch prothetischen Herzklappenersatz (mechanischen oder biologischen), jeweils unter Einsatz der HLM.
Mitralstenose-Operation
OP: offene Kommissurotomie und Klappenrekonstruktion mit HLM oder Klappenersatz mit HLM
OP-Lagerung: Rücken, mediane Sternotomie
OP-Dauer: 3–4 h
Chirurgische Stimulation: stark bis sehr stark
Blutverlust: mäßig, 2 EKs bereithalten
Anästhesie: ITN balanciert oder TIVA, 1 arterielle Kanüle, 2 Venenkanülen, 1 ZVK (3-Lumen), Magensonde (oral), Blasenkatheter, 2 Thermosonden, evtl. TEE
Anästhesie
Praktisches Vorgehen
Prämedikation
Wichtigstes Ziel der Prämedikation: Angst und Aufregung, die mit Tachykardie einhergehen, vermeiden! Tachykardie vermindert bei der Mitralstenose die diastolische Füllung des linken Ventrikels. Die Prämedikation muss dem Schweregrad der Mitralstenose angepasst sein.
Narkoseeinleitung
Mit Blutdruckabfällen ist zu rechnen bei Patienten, die präoperativ mit Diuretika ausgeschwemmt worden sind. Vorsichtig Volumen infundieren!
Volumenzufuhr
Die Füllungsdrücke des Ventrikels sollten so hoch wie möglich gehalten werden, ohne dass ein Lungenödem auftritt.
Herzfrequenz
Die Herzfrequenz niedrig halten: 60–65/min! Tachykardie ist gefährlich für Patienten mit Mitralstenose. Darum gilt:
Substanzen vermeiden, die die Herzfrequenz steigern.
Sympathikusreaktionen durch ausreichend tiefe Narkose dämpfen.
Schwere Anämie und Volumenmangel vermeiden.
Eine Tachykardie muss sofort behandelt werden: z. B. mit β-Blockern in niedriger Dosis, Verapamil oder Kardioversion.
Lungenfunktion
Lungenfunktionsstörungen durch lang anhaltende pulmonale Stauung sind bei Patienten mit Mitralstenose nicht selten. Diese Störungen müssen bei der Narkosebeatmung berücksichtigt werden.
Postoperative Besonderheiten
Zu den typischen postoperativen Komplikationen gehören:
Low-output-Syndrom (v. a. nach Mitralklappenersatz),
Rechtsherzversagen durch pulmonale Hypertonie.
Zu den wichtigsten Behandlungsmaßnahmen gehören:
Maschinelle Atemunterstützung in der frühen postoperativen Phase,
ausreichende Unterstützung des rechten Ventrikels,
Senkung der rechtsventrikulären Nachlast im Pulmonalkreislauf,
Antikoagulation (Quick-Wert bei mechanischer Prothese 15–20%),
Endokarditisprophylaxe.
Mitralinsuffizienz
Bei der Mitralinsuffizienz strömt Blut aus dem linken Ventrikel während der Systole in den linken Vorhof zurück (Regurgiration).
Operation
Bei NYHA-Schweregrad III und IV ist im Allgemeinen eine operative Behandlung indiziert, bei Patienten ohne klinische Symptome aber mit eingeschränkter linksventrikulärer Funktion und deutlich vergrößertem Ventrikel auch bei geringerem NYHA-Schweregrad. Wenn möglich sollte eine Mitralklappenrekonstruktion durchgeführt werden (niedrigere Frühsterblichkeit, bessere Langzeitergebnisse). Ist die Rekonstruktion nicht möglich, wird die Klappe durch mechanische oder biologische Prothesen ersetzt. Beide Operationsverfahren werden unter Einsatz der HLM durchgeführt.
Mitralinsuffizienz-OP
OP: Klappenrekonstruktion mit HLM oder Klappenersatz mit HLM
OP-Lagerung: Rücken
OP-Dauer: 3–4 h
Chirurgische Stimulation stark bis sehr stark
Blutverluste: mäßig, 2 EKs bereithalten
Anästhesie: Abschn. 21.4.1
Anästhesie
Praktisches Vorgehen
Tachykardien werden besser toleriert als bei der Mitralstenose (Abschn. 21.4.1)! Angestrebte Herzfrequenz: 80–100/min. Bradykardien müssen vermieden werden, da sie die Regurgitationszeit verlängern.
Inhalationsanästhetika sollten wegen ihrer negativ inotropen Wirkung nicht oder nur in niedriger Konzentration verwendet werden.
Gesteigerter peripherer Widerstand erhöht das Regurgitationsvolumen und muss unbedingt vermieden werden. Ist der Widerstand angestiegen, wird Nitroglycerin infundiert.
Die Volumenzufuhr muss behutsam und mit größtem Fingerspitzengefühl erfolgen, weil durch zu starke Volumenzufuhr ein Lungenödem entstehen kann.
Blutdruckabfälle während der Narkoseeinleitung oder Operation werden mit inotropen Substanzen behandelt, die das Schlagvolumen steigern und gleichzeitig den peripheren Widerstand herabsetzen: z. B. Dobutamin, Adrenalin.
Postoperative Besonderheiten
Zu den typischen Komplikationen in der frühen postoperativen Phase gehören:
Low-output-Syndrom aufgrund einer Pumpfunktionsstörung des linken Ventrikels, bedingt durch den Wegfall der systolischen Entleerung in den linken Vorhof. Therapie: Senkung der Nachlast durch arterielle Vasodilatatoren,
Rechtsherzversagen durch pulmonale Hypertonie, Therapie: Senkung der Nachlast im Pulmonaliskreislauf.
Antikoagulation und Endokarditisprophylaxe: Abschn. 21.4.1
Aortenstenose
Bei der Aortenstenose ist der Ausstrom des Blutes in die Aorta behindert. Chirurgische Therapie der Wahl ist der Klappenersatz durch mechanische oder biologische Prothesen.
Aortenstenose-Operation
OP: Klappenrekonstruktion mit HLM oder Klappenersatz mit HLM; transapikal auch am schlagenden Herzen möglich
OP-Lagerung: Rücken, mediane Sternotomie
OP-Dauer: ca. 2–3 h
Chirurgische Stimulation: stark bis sehr stark
Blutverluste: mäßig, 2 EKs bereithalten
Anästhesie: ITN balanciert oder TIVA, 1 Arterie, 2 Venenkanülen, 1 ZVK (3-Lumen), Magensonde (oral), Blasenkatheter, 2 Thermosonden, evtl. TEE
Anästhesie
Praktisches Vorgehen
Prämedikation
Sie darf bei Patienten mit Linksherzinsuffizienz nicht zu stark sein, weil sonst das HZV abfallen kann. Eine Hypoventilation durch zu starke Prämedikation muss ebenfalls vermieden werden.
Intraoperatives Besonderheiten
Volatile Inhalationsanästhetika müssen vorsichtig dosiert werden.
Eine Angina pectoris vor der Narkoseeinleitung wird zunächst mit O2-Zufuhr behandelt, evtl. zusätzlich mit Nitroglycerin.
Bei der Aortenstenose muss der Sinusrhythmus erhalten bleiben, damit der linke Ventrikel gut gefüllt werden kann. Darum gilt: bei supraventrikulärer Tachykardie sofort Kardioversion, auch wenn der kardiopulmonale Bypass unmittelbar bevorsteht.
Bradykardien (<45/min) müssen ebenfalls vermieden werden, weil hierdurch das HZV abfallen kann. Erhebliche Tachykardien sind bedrohlich und müssen sofort behandelt werden. Vorsichtig β-Blocker geben.
Blutdruckanstiege müssen bei der Aortenstenose vermieden werden. Darum Vorsicht bei der Intubation, Hautinzision, Sternotomie und Kanülierung der Gefäße. Die Therapie erfolgt mit einem Vasodilatator.
Blutdruckabfälle werden ebenfalls schlecht toleriert: Sie können zu Herz- und Hirninfarkt führen. Behandlung: Noradrenalin.
Der linke Ventrikel ist steif und verdickt; nicht selten werden positiv inotrope Substanzen wie Dobutamin benötigt, um die Kontraktion zu verbessern.
Postoperative Besonderheiten
Zu den typischen postoperativen Komplikationen gehören:
totaler AV-Block durch Schädigung des Reizleitungssystems während der Operation,
neurologische Ausfälle durch Luft- oder Kalkembolien während der Operation (3–5%).
Die Operationsletalität beträgt 3–5%. Spätere Komplikationen sind: Thromboembolien, Prothesenendokarditis, Degeneration der biologischen Klappe.
Antikoagulation
Bei mechanischen Klappen ist eine lebenslange orale Antikoagulation erforderlich, bei Bioklappen für 6 Wochen bis 3 Monate nach der Operation. Angestrebt wird ein Quickwert von 20–30% bzw. eine INR von 2. Patienten bei denen zusätzlich eine koronare Bypassoperation durchgeführt wurde, erhalten außerdem ASS 100 mg/Tag.
Endokarditisprophylaxe
Bei allen operativen Eingriffen oder medizinischen Maßnahmen sowie Zuständen, in denen eine Bakteriämie auftreten kann, ist eine Antibiotikaprophylaxe erforderlich.
Aorteninsuffizienz
Bei einer Aorteninsuffizienz fließt während der Diastole Blut aus der Aorta in den linken Ventrikel zurück. NYHA-Grad III und IV gelten als Indikation für eine operative Behandlung, wenn möglich als Klappenrekonstruktion, ansonsten Ersatz der Klappe durch eine mechanische oder biologische Prothese.
Aorteninsuffizienz-Operation
OP: Aortenklappenersatz mit HLM, evtl. Rekonstruktion
OP-Lagerung: Rücken, mediane Sternotomie
OP-Dauer: ca. 2–3 h
Vorgehen: Abschn. 21.4.3
Anästhesie
Praktisches Vorgehen
Das HZV ist frequenzabhängig.
Bei Patienten mit schwerer Insuffizienz muss die Prämedikation leicht sein, zumal eine Tachykardie meist gut toleriert wird. Ein Blutdruckabfall oder eine Hypoventilation durch zu starke Prämedikation müssen unbedingt vermieden werden.
Volatile Inhalationsanästhetika sollten wegen ihrer negativ inotropen Wirkung nur sehr vorsichtig dosiert werden.
Bradykardien werden sehr schlecht vertragen und müssen darum verhindert werden. Therapie: Atropin, Vorhof-Pacing. Als wünschenswert gelten Herzfrequenzen von 90/min.
Wichtig ist eine ausreichende Kontraktilität des Herzens: Wenn ungenügend: positiv inotrope Substanzen zuführen, z. B. Dobutamin oder Adrenalin.
Postoperative Besonderheiten
Typische postoperative Komplikationen sind (wie bei der Aortenstenose-Operation, Abschn. 21.4.3):
totaler AV-Block durch operative Schädigung des Reizleitungssystems,
neurologische Störungen durch Embolien.
Kombinierte Herzklappenfehler
Bei kombinierten Klappenfehlern haben die Erkrankungen der Mitral- und Aortenklappe im anästhesiologischen Denken den Vorrang.
Praktisches Vorgehen
Hohe Beatmungsdrücke und Venodilatation vermeiden! Hierdurch wird der venöse Rückstrom gehemmt, das HZV fällt ab.
Blutvolumen und zentralen Venendruck anheben! Hierdurch wird das Rechtsherzschlagvolumen aufrechterhalten und eine ausreichende Füllung des linken Ventrikels gewährleistet.
Anstiege des pulmonalen Gefäßwiderstandes verhindern! Sonst droht eine Rechtsherzinsuffizienz. Auslösende Faktoren können sein: Hypoxie, Hyperkapnie, Azidose, α-Rezeptoren-Stimulatoren (Noradrenalin), Lachgas. Vasodilatatoren sollen nützlich sein, um den pulmonalen Gefäßwiderstand zu senken.
Herztransplantation
Herztransplantationen werden bei Herzerkrankungen im terminalen Stadium durchgeführt, wenn alle anderen Therapiemöglichkeiten nicht mehr wirksam sind. Wichtigste Erkrankung ist die dilatative Kardiomyopathie mit fortgeschrittener Herzinsuffizienz.
Nicht indiziert ist die Herztransplantation bei schwerer pulmonaler Hypertonie mit irreversiblen Gefäßveränderungen, weiterhin bei Patienten mit Tumorerkrankungen oder insulinpflichtigem Diabetes mellitus. In Deutschland werden 200–300 Herzen pro Jahr transplantiert, die 5-Jahres-Überlebensrate beträgt derzeit mehr als 70%.
Nach Anschluss des Empfängers an die Herz-Lungen-Maschine werden Aorta und Pulmonalarterie durchtrennt und das Herz im atrioventrikulären Übergang – unter Belassung von Vorhofstümpfen – herausgeschnitten.
Anschließend wird das Spenderherz mit den beiden Vorhöfen, der Aorta und der Pulmonalarterie anastomosiert (Dauer ca. 90 min).
Anästhesie
Das Vorgehen unterscheidet sich nicht wesentlich von anderen Herzoperationen. Da die Patienten bereits präoperativ Immunsuppressiva erhalten, ist bei allen Maßnahmen ein strikt aseptisches Vorgehen erforderlich!
Praktisches Vorgehen
Vor Legen der Gefäßkatheter Zufuhr der ersten prophylaktischen Dosis eines Antibiotikums.
Für den ZVK die linke V. jugularis interna bevorzugen, da die rechte Vene postoperativ als Zugang für Myokardbiopsien verwendet wird.
Bei pulmonaler Hypertonie evtl. Pulmonaliskatheter einführen, um die Drücke zu messen.
Größte Vorsicht bei der Narkoseeinleitung, da es sich meist um sehr instabile Patienten handelt.
Einen Abfall des arteriellen Mitteldrucks auf unter 70 mmHg umgehend beseitigen.
Die endotracheale Intubation erfolgt mit sterilem Intubationszubehör einschließlich steriler Handschuhe.
Intraoperativ Kortikoide zuführen.
Nach Öffnen der Aorta: Sympathikomimetikum infundieren, um die Kontraktionskraft und die Herzfrequenz zu steigern. Angestrebte Herzfrequenz 100–110/min (denerviertes Spenderherz!).
Wedge-Druck ca. 12 mmHg.
Nach Abgehen vom Bypass muss mit Blutungen gerechnet werden. Darum Erythrozytenkonzentrate, Thrombozytenkonzentrate, Fibrinogen und Frischplasma bereithalten. Außerdem sorgfältige Antagonisierung von Heparin (ACT-Test).
Nach der Transplantation können ventrikuläre Herzrhythmusstörungen oder länger anhaltenden Bradyarrhythmien auftreten.
Fortsetzung der Sympathikomimetikazufuhr in der unmittelbaren postoperativen Phase.
Postoperative Behandlung
Sie entspricht im Wesentlichen der Behandlung nach anderen Herzoperationen. Wichtigste Gefahr ist das Rechtsherzversagen; bereits ein Anstieg des Venendrucks sollte als Warnhinweis gewertet werden. Die Zufuhr von Sympathikomimetika in niedriger Dosierung sollte in den ersten 4–5 Tagen fortgesetzt werden. Mit der immunsuppressiven Therapie wird sofort begonnen. Die meisten Patienten können am ersten postoperativen Tag extubiert werden. Die Mobilisierung sollte so früh wie möglich erfolgen.
Angeborene Herz- und Gefäßmissbildungen
Die häufigsten Herz- und Gefäßmissbildungen sind in Tab. 21.3 zusammengestellt.
| Zyanotische Herzfehler (Rechts-links-Shunt) |
Fallot-Tetralogie Transposition der großen Arterien (TGA) Gemeinsamer Ventrikel Totale Lungenvenenfehlmündung Trikuspidalatresie Ebstein-Anomalie Pulmonalatresie |
| Azyanotische Herzfehler mit Links-rechts-Shunt |
Vorhofseptumdefekt (ASD) Endokardissendefekt Ventrikelseptumdefekt (VSD) Persistierender Ductus arteriosus (PDA) Truncus arteriosus |
| Herzfehler ohne Shunt |
Aortenstenose Aortenisthmusstenose (ISTHA) Gefäßringe Pulmonalstenose |
Azyanotische Herzfehler mit Links-rechts-Shunt
Bei diesen Kindern ist die Lungendurchblutung gesteigert, eine Zyanose besteht nicht. Ist der Shunt sehr groß, drohen folgende Gefahren:
Linksherzinsuffizienz,
pulmonale Hypertonie.
Persistierender Ductus arteriosus (Ductus Botalli)
Bei diesen Kindern hat sich der Ductus arteriosus, die normale fetale Gefäßverbindung zwischen A. pulmonalis und Aorta, nach der Geburt nicht verschlossen. Hierdurch fließt Blut aus der Aorta in den Lungenkreislauf. Bei sehr großem Shunt kann das Verhältnis von Lungendurchblutung zu systemischer Durchblutung mehr als 3 : 1 betragen.
Therapie der Wahl ist die Ligatur des Ductus in rechter Seitenlage, ohne Herz-Lungen-Maschine.
Praktisches Vorgehen
Intubationsnarkose als TIVA oder balancierte Anästhesie.
Eine gut laufende Venenkanüle. Ein zentraler Venenkatheter ist nicht erforderlich.
- Überwachung:
- Ösophagusstethoskop,
- EKG-Monitor,
- Blutdruckmanschette,
- Kapnometer,
- prä- und postduktales Pulsoxymeter,
- Thermometer.
Vor der Thorakotomie: Blut bereitstellen. Blutverluste sind gewöhnlich minimal, können aber bei plötzlichen Gefäßabrissen lebensbedrohlich sein.
Während der Unterbindung des Ductus das Kind manuell beatmen, dabei die Beatmung während des Legens der Nähte unterbrechen.
Sofort nach OP-Ende das Kind aufwachen lassen und extubieren.
Ventrikelseptumdefekt
Hierbei fließt Blut aus dem linken in den rechten Ventrikel und von dort in die Lunge. Der Defekt wird unter Einsatz der Herz-Lungen-Maschine verschlossen.
Praktisches Vorgehen
Intubationsnarkose als TIVA oder balancierte Anästhesie.
- Gefäßzugänge:
- 1 arterielle Kanüle, 20 oder 22 G,
- 1 zentraler Venenkatheter,
- 2 gut laufende Venenkanülen.
Überwachung: wie bei Erwachsenen-HLM. Gute Relaxierung während der extrakorporalen Zirkulation, damit das Kind nicht atmet (Herz ist offen!).
Vorhofseptumdefekt
Bei diesem Herzfehler fließt Blut während der Systole aus dem linken in den rechten Vorhof und von dort über den rechten Ventrikel in die Lunge. Die operative Korrektur erfolgt unter Einsatz der Herz-Lungen-Maschine. Anästhesiologisches Vorgehen wie beim Ventrikelseptumdefekt.
Zyanotische Herzfehler
Bei diesen Fehlern fließt Blut aus dem rechten in das linke Herz (Rechts-links-Shunt ). Die Lungendurchblutung ist vermindert. Es besteht eine Untersättigung des arteriellen Blutes mit Zyanose. Kompensatorisch sind das Hämoglobin und der Hämatokrit erhöht. Insbesondere bei Fallot-Tetralogie können plötzlich zyanotische Anfälle auftreten, wenn der Rechts-links-Shunt durch Schreien, Füttern aber auch spontan zunimmt. Bewusstlosigkeit, schwere Hypoxämie und evtl. auch Herzstillstand können die Folge sein.
Fallot-Tetralogie
Bei diesem Herzfehler bestehen vier Missbildungen:
großer Ventrikelseptumdefekt,
Pulmonalstenose,
Rechtsherzhypertrophie,
eine über beiden Ventrikeln „reitende“ Aorta.
Bei schwerer Pulmonalarterienobstruktion kann der Druck im rechten Ventrikel so hoch wie im Körperkreislauf sein. Vor der endgültigen Operation werden bei einigen Kindern zunächst Palliativoperationen durchgeführt, um die Lungendurchblutung zu verbessern. Die wichtigsten Eingriffe sind:
Blalock-Taussig-Anastomose: Eine A. subclavia wird mit der Pulmonalarterie End-zu-Seit anastomosiert.
Potts-Anastomose: Seit-zu-Seit-Anastomose zwischen A. pulmonalis und Aorta descendens.
Cooley-Anastomose: Die rechte Pulmonalarterie wird mit der Aorta ascendens anastomosiert.
Alle Anastomosenoperationen werden in Seitenlage, ohne HLM, durchgeführt. Mit Blutverlusten muss gerechnet werden.
Die Korrektur der Fallot-Tetralogie erfolgt unter Einsatz der Herz-Lungen-Maschine.
Praktisches Vorgehen
Besondere Gefahren drohen durch Blutdruckabfall, Hypoxämie und Hämokonzentration sowie systemische Luftembolien.
Die Narkoseeinleitung mit Sevofluran ist verlängert, weil die Lungendurchblutung vermindert ist. Darum bevorzugt i.v. einleiten. Schreien des Kindes vermeiden: Gefahr des zyanotischen Anfalls.
Je nach klinischem Zustand wird die Narkose mit Opioid/N2O/O2 oder Sevofluran durchgeführt.
- Gefäßzugänge:
- 1 arterielle Kanüle,
- 1 Mehrlumenvenenkatheter (zentral),
- 2 gut laufende Venenkanülen.
Überwachung: wie bei Erwachsenen-HLM (Abschn. 21.2.6).
Transposition der großen Gefäße ( TGA)
Bei kompletter Transposition entspringt die Aorta aus dem rechten Ventrikel und die A. pulmonalis aus dem linken Ventrikel. Ein Überleben ist ohne intrakardiale Shuntverbindungen nicht möglich. Zur Korrektur der Transposition wird in tiefer Hypothermie die Switch-Operation durchgeführt: Durchtrennen von Aorta und A. pulmonalis oberhalb der Klappen, Implantation der Koronararterien in den Stumpf der A. pulmonalis (Neoaorta), Annähen der Aorta an den linken Ventrikel und der A. pulmonalis an den rechten Ventrikel. Die anästhesiologischen Probleme entsprechen im Wesentlichen denen der Fallot-Tetralogie (tiefe Hypothermie: Abschn. 21.6.4).
Obstruktion der Ausflussbahnen
Bei diesen Kindern ist der Blutfluss durch eines der großen Gefäße behindert. Das Herz hypertrophiert kompensatorisch. Später entwickelt sich eine Herzinsuffizienz.
Pulmonalstenose
Bei dieser Erkrankung ist der Ausstrom des Blutes aus dem rechten Ventrikel durch eine Verengung der Pulmonalklappe behindert. Hierdurch steigt der Druck im rechten Ventrikel stark an. Zur Korrektur wird eine Valvotomie in extrakorporaler Zirkulation durchgeführt. Das Vorgehen bei der Narkose entspricht im Wesentlichen dem für den Vorhof- und Ventrikelseptumdefekt.
Aortenstenose
Bei der Aortenstenose ist der Ausfluss des Blutes aus dem linken Ventrikel behindert. Die Stenose kann über, unter oder innerhalb der Aortenklappe liegen. Der Druck im linken Ventrikel steigt durch die Stenose stark an. Die Korrektur – Inzision, Dilatation oder Patch des stenosierten Bezirks – wird in extrakorporaler Zirkulation durchgeführt.
Bei der Narkose müssen Tachykardien und Hypertonie vermieden werden.
Aortenisthmusstenose
Bei dieser Erkrankung liegt eine Verengung der Aorta descendens vor. Das Lumen der Aorta ist an dieser Stelle zumeist vollständig verschlossen. Darum bildet sich ein Umgehungskreislauf aus. Durch die Stenose entwickelt sich eine kompensatorische Linksherzhypertrophie. Der Blutdruck steigt in der oberen Körperhälfte an. Zur Korrektur wird eine Anastomosenoperation in rechter Seitenlage, ohne Herz-Lungen-Maschine, durchgeführt.
Praktisches Vorgehen
Die größten Gefahren während der Operation sind: Blutverlust und Blutdruckanstieg. Darum ausreichend Erythrozytenkonzentrate bereitstellen und Vasodilatator vorbereiten.
Blutdruckmanschette, arterielle Kanüle, Venenzugänge am rechten Arm anlegen.
Beim Abklemmen der Aorta: starke Blutdruckanstiege vermeiden bzw. sofort behandeln.
Beim Öffnen der Aortenklemme auf Blutverluste vorbereitet sein.
Tiefe Hypothermie mit Herzstillstand
Die tiefe Hypothermie wird bei der intrakardialen Korrektur bestimmter Herzmissbildungen von Kleinkindern eingesetzt. Hierfür wird das Kind zunächst in Narkose oberflächlich mit einer Kühlmatte abgekühlt, dann mit Hilfe der Herz-Lungen-Maschine auf 16–18°C Rektaltemperatur weiter abgekühlt. Anschließend werden die Schläuche der Herz-Lungen-Maschine entfernt, sodass ungehindert operiert werden kann. Die Wiedererwärmung erfolgt ebenfalls mit der HLM.
Praktisches Vorgehen
Nach Narkoseeinleitung Rektal- und Ösophagusthermometer einführen.
Die Oberflächenkühlung erfolgt bis zu einer Ösophagustemperatur von ca. 30–31°C. Sie kann durch Vasodilatatoren beschleunigt werden.
Rechtzeitig Heparin geben, solange der Kreislauf noch ausreichend ist.
Während der Abkühlung mit der HLM keine Inhalationsanästhetika zuführen (Löslichkeit nimmt mit der Kälte zu!).
Während des hypothermen Herzstillstands keine Medikamente injizieren.
Postoperativ ca. 24 h nachbeatmen.
Herzschrittmacherimplantation
Als Indikationen für die Implantation eines Herzschrittmachers gelten:
Adam-Stokes-Anfälle,
AV-Blockierungen,
SA-Blockierungen,
bradykarde Herzinsuffizienz,
pathologische Sinusbradykardie,
Bradyarrhythmia absoluta,
Sinusknotensyndrom,
Karotissinussyndrom.
Implantation des Schrittmachers
Die Schrittmachersonden werden transvenös oder transthorakal platziert, am häufigsten transvenös über die V. subclavia mit Hilfe der Seldinger-Technik oder indirekt durch Freilegung und Katheterisierung der V. cephalica. Alternative Wege können sein: V. jugularis interna und externa, V. femoralis.
Die Platzierung der Sonde im Herzen erfolgt unter Bildwandlerkontrolle. Ventrikelelektroden werden in der Spitze des rechten Ventrikels fixiert, Vorhofelektroden im rechten Herzohr oder im Sinus coronarius. Bei der transthorakalen Methode werden die Elektroden in das Epikard eingenäht oder eingedreht. Hierzu ist eine Thorakotomie in Allgemeinnarkose erforderlich.
Die richtige Lage der Elektroden wird durch Messung der Myokardpotenziale und Bestimmung der Reizschwelle kontrolliert. Die Batterie des Schrittmachers wird im subkutanen Gewebe des Thorax implantiert. Die Implantation kann in Lokal- oder Allgemeinanästhesie erfolgen.
Folgendes ist zu beachten:
Besteht präoperativ ein kompletter AV-Block oder eine schwere Bradykardie, muss vor der Narkose bzw. Operation ein temporärer Schrittmacher gelegt werden.
Grundsätze für die Narkose
Ob Lokalanästhesie oder Allgemeinnarkose: bis zur endgültigen Platzierung des Schrittmachers ist immer eine sorgfältige Überwachung der Herzfunktion erforderlich. Die Standardmaßnahmen sind:
Blutdruck (NIBP),
EKG-Monitor,
Pulsoxymeter,
Kapnometer (bei Allgemeinnarkose),
Temperatur (bei Allgemeinnarkose).
Wenn möglich, sollte die Implantation des Schrittmachers in Lokalanästhesie durchgeführt werden, weil die Anästhetika die schwer gestörte Herzfunktion noch mehr beeinträchtigen können. Ausnahmen sind die epikardiale Elektrodenplatzierung und die Implantation bei kleinen Kindern.
Praktisches Vorgehen
Allgemeinnarkose: Narkoseeinleitung mit den üblichen i.v.-Anästhetika in reduzierter Dosis; Aufrechterhaltung mit TIVA oder balancierter Anästhesie.
Bei Patienten mit temporärer Schrittmachersonde kann Kammerflimmern auftreten, wenn der Schrittmacher auf ein falsch geerdetes elektrisches Gerät gelegt wird. Während der Operation sollte der Schrittmacher in Kopfnähe des Patienten liegen, entfernt von anderen elektrischen Geräten.
Beim Einführen der Sonde können ventrikuläre Herzrhythmusstörungen ausgelöst werden. Behandlung, wenn erforderlich, z. B. mit Lidocain (Xylocain), ca. 1 mg/kgKG i.v., evtl. als Dauerinfusion.
Nach Platzierung der Sonde und Implantation des Schrittmachers wird der temporäre Schrittmacher ausgestellt. Danach sofort Pulskontrolle. Stimmt die Pulsfrequenz nicht mit der Frequenz des implantierten Schrittmachers überein, wird der temporäre Schrittmacher erneut eingeschaltet.
Unmittelbar postoperativ sollte die Schrittmacherfunktion noch für einige Zeit im Aufwachraum überwacht werden.
AICD-Implantation
Bei Patienten mit lebensbedrohlichen ventrikulären Herzrythmusstörungen, die auf Medikamente nicht ansprechen, kann ein automatischer Kardioverter bzw. Defibrillator (AICD) implantiert werden. Hierdurch wird das Risiko eines akuten Herztods vermindert. Die Implantation des AICD erfolgt paraumbilikal unter der Bauchdecke, das Einführen der Sonde über die rechte V. subclavia in HLM-Bereitschaft.
Anästhesiologische Besonderheiten
Es handelt sich um Hochrisikopatienten. Hauptgefahren sind die perioperative Kammertachykardie und das Kammerflimmern.
Praktisches Vorgehen
Präoperativ: 1 großlumige Venenkanüle und eine arterielle Kanüle in Lokalanästhesie,
Narkoseeinleitung wie unter Abschn. 21.2.6 beschrieben; Muskelrelaxans nur für Intubation.
Nach Narkoseeinleitung zentralen Venenkatheter und Blasenkatheter legen,
Fortsetzung als TIVA oder balancierte Anästhesie, weitere Muskelrelaxierung ist nicht erforderlich,
Extubation direkt nach OP-Ende.
Typische perioperative Komplikationen sind Hypertonie und Tachykardie oder Bradykardie.
Contributor Information
Collaborators: Tobias Fink and Tilmann Müller-Wolff
Nachschlagen und Weiterlesen
- [1].Ennker J, Bauer S, Konertz T. Checkliste Herzchirurgie. Stuttgart: Thieme; 2002. [Google Scholar]
- [2].Bolanz H, Osswald P, Ritsert H. Pflege in der Kardiologie/Kardiochirurgie. München: Elsevier; 2007. [Google Scholar]
- [3].Larsen R. Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. Berlin Heidelberg: Springer; 2016. [Google Scholar]
- [4].Lederhuber . BASICS Kardiologie. München: Elsevier; 2013. [Google Scholar]
- [5].Schmid C, Philipp A. Leitfaden extrakorporale Zirkulation. Heidelberg: Springer; 2011. [Google Scholar]
Internet
- [6].Deutsche Gesellschaft für Thorax-, Herz- und Gefäßchirurgie. S3-Leitlinie zur intensivmedizinischen Versorgung herzchirurgischer Patienten. Hämodoynamisches Monitoring und Herz-Kreislauf. www.awmf.de