Abstract
Objectifs
Le coronavirus SARS-CoV-2 mis en évidence en fin d’année 2019 en Chine a atteint tous les continents, avec plus de 28 millions de cas déclarés dont plus de 920 000 décès au 17/9/2020. Le plus souvent à l’origine d’un syndrome infectieux bénin, associant à différents degrés des symptômes (fièvre, toux, myalgies, céphalées et éventuels troubles digestifs), voire totalement asymptomatique, le SARS-CoV-2 peut être à l’origine de pathologies pulmonaires graves et parfois de décès.
Méthode
Au vu de l’évolution de l’épidémie, le Collège national des gynécologues obstétriciens français a décidé de mettre à jours les avis émis précédemment. Pour cela, le même groupe d’experts, a été sollicité avec réalisation d’une revue de la littérature et prise en compte des avis de la Direction Générale de la Santé, la Haute Autorité de Santé, du Haut Conseil de Santé Publique.
Résultats
Les données pendant la grossesse sont plus nombreuses et plus précises. Les données publiées semblent montrer que les symptômes chez les femmes enceintes sont les mêmes que ceux de la population générale et qu’un sur risque existe chez la femme enceinte particulièrement au troisième trimestre. Un cas de transmission materno-fœtale intra utérine a été formellement identifié. Une prématurité induite et des cas de détresses respiratoires chez les nouveau-nés de mères infectées ont été décrits.
Conclusion
À la lumière des nouvelles données, nous proposons une actualisation des recommandations de prise en charge. Ces propositions peuvent encore évoluer avec l’avancée de la pandémie et de potentielles nouvelles connaissances chez la femme enceinte.
Mots clés: Coronavirus SARS-CoV-2, Grossesse, Transmission materno-fœtale, Covid-19, Nouveau-né
Abstract
Objectives
The coronavirus SARS-CoV-2 identified late 2019 in China had spread across all continents. In the majority of cases, patients have mild symptoms (fever, cough, myalgia, headache, some digestive disorders) or are asymptomatic, however it can cause serious lung diseases and lead to death. On September 2020, over 28 million people have been infected with over 920,000 deaths.
Methods
In view of the evolution of the epidemic the French National College of Obstetricians and Gynecologists has decided to update the recommendations previously issued. To do this, the same group of experts was called upon to carry out a review of the literature and take into account the opinions of the General Directorate of Health (DGS), the “Haute Autorité de Santé” (HAS) and the “Haut Conseil de santé Publique” (HCSP).
Results
The data on consequences during pregnancy have accumulated. The symptoms in pregnant women appear to be similar to those of the general population, but an increased risk of respiratory distress exists in pregnant women especially in the third trimester. A case of intrauterine maternal-fetal transmission has been clearly identified. Induced prematurity and cases of respiratory distress in newborns of infected mothers have been described.
Conclusion
In light of the new data, we propose updated recommendations. These proposals may continue to evolve in view of the pandemic and of advances in studies in pregnant women.
Keywords: Coronavirus SARS-CoV-2, COVID-19, Pregnancy, Maternal-fetal transmission, Newborn
1. Introduction
L’objectif de la rédaction de ce document est d’actualiser les connaissances des professionnels de santé sur le SARS-Covid-2, ses symptômes, la connaissance actuelle sur la transmission inter individuelle et pendant la grossesse et de proposer un protocole de prise en charge pour les femmes enceintes en France modifiant celui proposé précédemment [1]. Il est important de noter que la situation est toujours très évolutive et que les définitions des zones à risques, des clusters, des cas possibles, et le protocole proposé peuvent évoluer et varier selon les régions françaises.
2. Matériel et méthode
Au vu de l’évolution de l’épidémie de SARS-CoV-2, le Collège national des gynécologues obstétriciens français (CNGOF) a décidé de mettre à jours les avis émis en mars 2020 [1]. Pour cela, le même groupe d’experts, infectiologues et gynécologues obstétriciens a été sollicité. Cette mise à jour s’est basée sur une revue de la littérature et la prise en compte des avis de la Direction générale de la santé (DGS), Haute Autorité de santé (HAS), du Haut Conseil de Santé publique (HCSP) [2], [3] disponibles au moment de la rédaction de ces lignes. Pour l’analyse de la littérature, une recherche a été effectuée sur la base de donnée Pubmed en utilisant les mots clés associant « codiv-19 », « Sars-Co-V-2 », « Pregnancy », « congenital infection », « delivery », « maternal outcome ». Les articles analysés étaient en anglais ou en français et publiés entre décembre 2019 et le moment de la rédaction de ces avis (septembre 2020). La dernière version a été validée par l’ensemble des experts participant, par le conseil scientifique et le président du CNGOF.
2.1. Le virus
Le nouveau coronavirus (SARS-CoV-2) est une nouvelle souche de coronavirus responsable de la pathologie appelée COVID-19. Les coronavirus sont des virus à ARN. On les retrouve largement chez l’homme, les mammifères, les oiseaux et les chauves-souris. Ces virus peuvent provoquer des infections des voies respiratoires, du système gastro-intestinal et du système nerveux [4], [5], [6]. Ainsi, d’autres infections causées par des coronavirus sont connues et sont très variables telles que les rhumes simples (HCoV 229E, NL63, OC43 et HKU1), ou les syndromes respiratoires plus sévères comme le Syndrome Respiratoire du Moyen Orient (MERS-CoV) ou le Syndrome Respiratoire Aigu Sévère (SARS-CoV). Cette nouvelle souche de coronavirus présente 79 % d’identité nucléotidique en commun avec le SARS-CoV et environ 50 % avec le MERS-CoV [7].
2.2. Épidémiologie
Cette nouvelle souche a été pour la première fois identifiée dans la ville de Wuhan dans la province du Hubei en Chine en fin d’année 2019. Le virus s’est ensuite propagé rapidement à travers les différents continents. La situation évolue de façon rapide partout dans le monde. L’OMS a décrit le 30 janvier 2020 la situation comme une urgence mondiale de Santé publique [4], [5], [6], [7], [8] et comme une pandémie à dater du 11/3/2020. Il s’est particulièrement développé en Europe : l’Italie, l’Espagne, la France et le Royaume-Uni ont été les pays d’Europe avec le plus grand nombre de cas (CIVD-19 Map-John Hopkins Resource Center, https://coronavirus.jhu.edu/map.html). Ensuite, le continent américain a été fortement touché ainsi que l’Inde et la Russie.
Les différents états essaient de lutter contre l’épidémie selon différentes politiques de confinement puis de déconfinement progressif pour éviter une résurgence. Certains états dont la France font actuellement face à une ré-augmentation du nombre de cas détectés.
D’après le compte du Johns Hopkins Coronavirus Resource Center [7] il y a, au 1er septembre 2020, 25 760 920 cas détectés de coronavirus et 857 623 décès dans le monde. À cette même date en France le nombre de cas détectés est de 306 951 avec 30 518 décès.
Le virus semble transmis principalement par les gouttelettes et la transmission manuportées entre 2 individus [4], [8]. Une transmission par les aérosols ou par les surfaces contaminées n’est cependant pas exclue [9], [10]. Ainsi, le port du masque dans les espaces clos et en extérieur dans certains lieux et villes se généralise afin d’essayer d’éviter une « seconde vague » avec une nouvelle saturation du système hospitalier et une augmentation des décès.
2.3. Symptômes
2.3.1. Dans la population générale
La majorité des personnes (80 %) [11] qui ont été infectées par le SARS-CoV-2 et qui étaient symptomatiques n’ont eu qu’une légère rhinite ou un syndrome grippal léger ou modéré. Il pouvait y avoir en particulier une toux, une fièvre et une dyspnée. Cependant, des symptômes plus graves ont également été décrits dans ce contexte (16 à 32 %) comme la pneumonie ou le syndrome de détresse respiratoire aiguë (SDRA) qui sont présents majoritairement chez les personnes âgées, les patients présentant une immunodépression ou des comorbidités telles que le diabète, un cancer ou une maladie respiratoire chronique et les femmes enceintes [4], [8], [12], [13], [14], [15], [16], [17].
Les caractéristiques épidémiologiques, cliniques, biologiques et radiologiques ont été décrites dans la population générale en premier par Huang et al. chez des patients testés positifs au SARS-CoV-2 [8]. Dans leurs analyses sur 41 cas, 73 % étaient des hommes et l’âge moyen était de 49 ans. Les symptômes les plus courants au début de la maladie étaient la fièvre (98 %), la toux (76 %) la fatigue ou les myalgies (44 %), les expectorations (28 %) et les céphalées (8 %).
Les mêmes descriptions cliniques ont été faites dans d’autres études plus larges [11], [18], [19], [20] avec une fréquence des différents symptômes très variables allant par exemple de 43,8 % [6] à 98,6 % [8] pour la fièvre et étant de 16 % environ pour les formes sévères avec notamment une pneumopathie.
D’autres manifestations cliniques ont ensuite été décrites telles que des troubles digestifs avec des diarrhées [21], des signes neurologiques centraux ou périphériques [22].
Une étude européenne multicentrique [20] a étudié 1420 personnes avec des formes bénignes ou modérées de la Covid-19. Ils relevaient notamment des céphalées dans 70,3 %, une obstruction nasale dans 67,8 %, une toux dans 63,3 %, une fièvre dans 45,4 %. La durée des symptômes était en moyenne de 11 jours (±5 jours) et les symptômes variaient selon l’âge et le sexe. Ils ont également étudié 417 personnes et ont noté dans 79,6 % une anosmie et dans 88,8 % des cas une dysgueusie [19].
Certaines études suggèrent également des complications cardio-vasculaires avec des myocardites [23], [24], des atteintes thromboemboliques [25], des atteintes dermatologiques avec des urticaires ou des éruptions diffuses [26], [27] ou ophtalmologiques [28]. Il peut y avoir des anomalies biologiques avec des cytolyses dans 15 à 53 % des cas [29], des hyperbilirubinémies modérées ou des augmentations des gamma GT.
Certains patients pourraient être asymptomatiques mais l’incidence n’en est pas connue et les différentes études retrouvent des résultats très variables [30], [31] sur leur taux et leur potentiel de transmission.
L’estimation globale du taux de létalité a été évaluée précédemment à 1 % environ (en incluant les personnes asymptomatiques et symptomatiques) [32], [33] mais doit être considérée avec précautions car les connaissances sur l’épidémie évoluent chaque jour et le taux de létalité est étroitement lié à la politique de dépistage des différents pays. Selon l’institut Pasteur utilisant des modèle mathématiques, il serait actuellement de l’ordre de 0,7 % (0,4–1,0) [34].
Chez les enfants, le SARS-CoV-2 semble être plus rarement identifié et la plupart d’entre eux présenteraient des symptômes bénins [35], [36], [37], [38], [39].
Les données de la littérature suggèrent que la période d’incubation serait d’environ 5 jours (entre 2 et 14 jours) [8]. La période de contagiosité pourrait précéder les symptômes de 48 h [40].
2.3.2. Chez la femme enceinte
La littérature actuelle, encore limitée chez la femme enceinte, semble montrer que les symptômes sont légèrement différents de ceux de la population générale [13], [15], [41] sans que cela ait un impact clinique. La grande majorité des femmes ne ressentiraient que de légers symptômes de rhinite ou un syndrome grippal avec potentiellement de la toux, une fièvre ou une dyspnée. Ces femmes peuvent également présenter des symptômes plus graves tels que la pneumonie ou le SDRA comme les autres populations à risque [12], [13], [14], [15], [41], [42], [43]. Il faut souligner que la majorité des patients symptomatiques étaient apyrétiques.
Initialement, les données chez la femme enceinte pour le SARS-CoV-2 étant limitées, des rapprochements ont été faits avec ce qui était connu dans le cadre des autres pneumopathies ou des autres coronavirus tels que le SARS-CoV ou le MERS-CoV. La pneumopathie est une cause importante de morbi-mortalité chez les femmes enceintes [44], [45]. Ainsi, les patientes développant une pneumopathie quelle qu’en soit l’étiologie devaient, dans une étude assez ancienne, dans 25 % des cas être hospitalisées dans des unités de soins intensifs avec une assistance ventilatoire [46]. En effet, comme pour d’autres maladies infectieuses, les changements physiologiques maternels normaux accompagnant la grossesse avec une modification de l’immunité [47] et des changements cardiopulmonaires pourraient être à l’origine de la plus grande sensibilité et de l’augmentation de la gravité clinique de la pneumopathie [48], [49]. En 2009, les femmes enceintes représentaient 1 % des patients infectés par le virus H1N1 mais elles représentaient 5 % de tous les décès liés au virus [50]. Les patientes avec des pneumopathies seraient également plus à risque de rupture prématurée des membranes, d’accouchements prématurés, de morts fœtales in utero, de retards de croissance intra utérins et de décès néonatals [46], [51], [52].
Lorsque que l’on analyse ce qui avait été retrouvé pour le SARS ou le MERS, sur des très petites séries, il y avait dans certains cas des issues obstétricales défavorables avec des fausses-couches, des accouchements prématurés et des décès maternels mais sans comparaison à des patientes non exposées [5], [6], [53], [54]. D’autres études, quant à elles ne montraient pas de relation significative entre l’infection et le risque de fausse-couche ou de perte fœtale au deuxième trimestre [54]. Par ailleurs, au-delà de l’éventuelle gravité de l’infection maternelle il y a des préoccupations concernant l’effet potentiel sur l’issue fœtale et l’état néonatal via une potentielle transmission materno-fœtale. Les femmes enceintes constituent donc un groupe nécessitant une attention particulière pour la prévention le diagnostic et la prise en charge [55], même si les conséquences du SARS-Cov-2 sont bien moindres qu’avec le MERS ou SARS-Cov [56].
Les Centers for Disease Control and Prevention américains [17] ont publié une étude cas-témoin comparant les données de 8207 femmes enceintes et 83 205 femmes non enceintes, toutes avec infection prouvée à SARS-Cov-2. Cette étude montre un plus grand risque d’hospitalisation en soins intensifs (RR 1,2 [1,2–1,8]), de ventilation mécanique (RR 1,9 [1,4–2,6]), mais pas plus de mortalité. A contrario, une autre étude américaine n’a quant à elle pas montré de différence en termes d’admission en soins intensifs pour les femmes enceintes par rapports aux autres femmes (9,6 % vs 15,1 %, p = 0,22) [41], [57], [58].
Une analyse réalisée au Royaume-Unis sur les morts maternelles entre le 1er mars et le 31 mai 2020 retrouvait 10 femmes enceintes décédées porteuses du SARS-CoV-2. Six sont décédées suite à des complications cardiorespiratoires de la maladie et une après une thrombose cérébrale. Pour une femme l’étiologie précise n’avait pu être documentée et pour deux l’infection n’était pas le motif du décès. Les patientes avaient toutes en commun le fait d‘avoir contracté la maladie au troisième trimestre de la grossesse et d’être décédées après l’accouchement. Au total, le taux de mortalité associé au SARS-CoV-2 était de 6,2/100 000 femmes enceintes (vs 2,5/100 000 pour les suicides) en incluant tous les décès chez des femmes infectées quelle que soit la raison du décès. Ce taux peut être artificiellement haut car la période d’analyse est courte et une analyse plus longue serait nécessaire pour des résultats plus précis [59].
Une méta-analyse publiée en septembre 2020 [41] a inclus 77 études avec des femmes enceintes. Les auteurs retrouvent de la fièvre dans 40 % des cas et de la toux dans 39 % des cas. Les femmes enceintes en comparaison à celles non enceintes présentent moins de fièvre (OR 0,43, IC95 % (0,22–0,85), I2 = 74 %, 5 études, n = 80 521) et de myalgies (0,48, IC95 % (0,45–0,51), I2 = 0 %, 3 études, n = 80 409).
Elles sont plus souvent hospitalisées en unité de soins intensifs (1,62, IC95 % [1,22–1,96], I2 = 0 %) et nécessitent plus de ventilation invasive (1,88, IC95 % [1,36–2,60), I2 = 0 %, 4 études, n = 91 606]. Ils relèvent 73 décès (0,1 %, 26 études, n = 11 580). Les facteurs de risque d’une forme sévère sont : l’âge, l’indice de masse corporelle élevé, l’HTA chronique et le diabète. Ainsi, une patiente avec des comorbidités préexistantes a plus de risque d’être admise en unité de soins intensifs qu’une femme sans comorbidités (OR = 4,21, IC95 % [1,06–16,7], I2 = 0 %, 2 études, n = 320). Les femmes enceintes infectées ont un risque d’accouchement prématuré plus élevé que celles non infectées (OR = 3,03, IC95 % [1,16–7,85], I2 = 1 %, 2 études, n = 339).
Si on se focalise sur les publications issues de cohortes françaises, il existe 4 publications [13], [14], [15], [16] et les tendances se confirment.
L’étude de Badr et al. est une étude cas-témoin franco-belge incluant des patientes infectées enceintes après 20SA (n = 83) et des femmes non enceintes (n = 107) qui retrouve plus de besoins d’oxygénothérapie d’hospitalisations en soins intensif ou de ventilation mécanique chez les femmes enceintes (11,8 % vs 2,38 % p = 0,024) que chez les femmes non enceintes. Ils montrent également que les symptômes peuvent légèrement différer chez la femme enceinte avec moins de myalgies, de troubles gastro intestinaux, d’anosmie, de symptômes ORL [15].
Une série multicentrique réalisée depuis la survenue de l’épidémie en France, sur des données agrégées issues de 33 maternités [14], a rapporté un nombre de 617 femmes enceintes avec un test positif pour le SARS-CoV-2 [13]. Parmi celles-ci, les symptômes décrits le plus fréquemment étaient la toux (62,2 %), la fièvre (46,2 %), l’anosmie (27,2 %), une dyspnée (26,7 %) ou une diarrhée (8,8 %). La proportion d’asymptomatique n’est pas évaluable par cette étude, car la politique française était de tester uniquement les formes symptomatiques ou les cas contacts dans cette période d’étude (1er mars au 14 avril). Concernant la gravité de la maladie, 128 patientes (soit 20,7 %) ont eu besoin d’assistance respiratoire, 29 patientes ont subi une ventilation mécanique (4,7 %), 6 patientes ont eu besoin d’oxygénation extracorporelle (ECMO) soit 1 % de l’ensemble des femmes et une patiente est décédée (0,2 %). Dans cette population de femmes enceintes, les facteurs significativement associés au risque de nécessiter une assistance respiratoire étaient l’âge supérieur à 35 ans, l’indice de masse corporelle > 30 kg/m2 avant la grossesse, la présence d’un diabète préexistant ou d’un antécédent de pré-éclampsie et un diagnostic d’HTA gravidique ou de pré-éclampsie pour la grossesse en cours. Ces facteurs de risque sont donc similaires à ceux trouvés en population générale.
Les issues de grossesse n’étaient connues que pour 181 patientes, les autres n’ayant pas encore accouché au moment de la publication. Le taux de prématurité parmi les femmes ayant été infectées par le SARS-CoV-2 et ayant accouché pendant la période était de 27,6 %. Parmi les 58 femmes ayant nécessité une assistance respiratoire et ayant accouché pendant la période d’étude, 41 (soit 70,7 %) ont subi une césarienne pour cause de COVID-19. Cependant la description de ces issues n’est qu’une estimation approximative qui devra être complétée par les issues des femmes ayant guéri du COVID-19 et poursuivi leur grossesse.
Une autre série française monocentrique réalisée à Strasbourg [16] a décrit en plus les anomalies biologiques chez 54 femmes avec une suspicion de COVID-19 ou une infection confirmée. Dans 44 % des cas une lymphopénie était observée, la CRP était élevée dans 41 % des cas, et une cytolyse hépatique était rapportée dans 20 % des cas. Les auteurs de cette série rapportent trois cas de femmes ayant nécessité une césarienne avant 29 SA alors qu’elles étaient en détresse respiratoire sévère, l’indication de cette prématurité sévère induite étant la tentative d’améliorer l’état respiratoire maternel. Ils décrivent également un taux d’hémorragie de la délivrance à 23,8 % (5/21) avec 19 % de leurs patientes qui ont nécessité une transfusion. Ces chiffres sont plus importants que ceux rapportés chez la femme non infectée [16]. Ceci pourrait s’expliquer par des modifications de l’hémostase secondaire à l’infection en phase aiguë. Des coagulopathies avec des anticorps antiphospholipides ont ainsi été rapportées chez des patients infectés en dehors de la grossesse. Il faudra évaluer si ce risque reste élevé même à distance de l’épisode sévère de la maladie.
Enfin, une autre série française multicentrique portant sur 100 femmes enceintes avec une infection certaine rapporte 5 cas de césariennes avant 32 SA pour cause de COVID chez des patientes hospitalisées en réanimation. Cette étude rapporte une association intéressante entre le degré de lymphopénie à l’entrée et la sévérité de la maladie par la suite [13].
Antoun et al., retrouvent un surrisque de complication obstétricale (prééclampsie (10,5 %), prématurité (36,8 %), césarienne (84 %)) augmenté mais sur une cohorte de faible taille (23 patientes dont 19 accouchements) [60]. Di Mascio et al. retrouvent 16,2 % de prééclampsie chez leur patientes avec le SARS-CoV-2 ou le SARS-CoV-1 ou le MERS [61], [62].
Mendoza et al. [62] ont réalisé une étude observationnelle qui montre que les patientes avec des cas sévères d’infection peuvent avoir des tableaux cliniques de « prééclampsie like ». 2 de leurs patientes ont eu une guérison en même temps que la guérison de la pré-éclampsie. Un cas similaire a été décrit en France par Dap et al. avec un tableau pouvant évoquer à la fois une prééclampsie ou une infection sévère au SARS-CoV-2 à 37SA [63]. Devant le tableau la patiente a été césarisée puis a présenté une détresse respiratoire sévère ayant nécessité une ventilation mécanique. Pour Liu et al. la présence d’une protéinurie est un facteur de gravité de l’infection [64].
Il semblerait dans ces études qu’un rapport sFlt-1/PlGF normal aiderait à discriminer une « vraie » pré-éclampsie (ratio élevé) d’une atteinte uniquement lié au SARS-CoV-2 [61]. Il faut cependant attendre d’autres études plus vastes pour réellement évaluer l’intérêt du ratio dans ce contexte [62], [65].
La fixation du virus au récepteur ACE2 va empêcher la conversion de l’angiotensine, ce qui a un effet vasoconstricteur et pro thrombotique [66]. La malperfusion placentaire pourrait aussi être secondaire à l’inflammation [67].
Chez la femme enceinte infectée :
Augmentation de la morbidité avec augmentation du taux d’oxygénothérapie, d’hospitalisation en soins intensifs, de ventilation mécanique.
Augmentation de la prématurité.
Augmentation du taux de césarienne.
Possibilité de présentation « prééclampsie like ».
Augmentation des hémorragies du post-partum si accouchement pendant la phase aiguë de l’infection.
2.3.3. Chez le fœtus et le nouveau-né
Les connaissances à l’heure actuelle sont limitées sur le sujet. Contrairement à certaines infections virales notamment par la Rubéole [68], le CMV [69], Ebola [36] ou le Zika [37] la probabilité de transmission intra utérine des coronavirus est faible. Dans l’expérience du MERS-CoV et du SRAS-CoV-1, il n’y avait pas eu de cas confirmés de transmission intra utérine [38], [39], [40], [41]. La transmission materno fœtale du SARS-CoV-2 a été l’objet de grands débats [70], [71], [72], [73]. Un seul cas de transmission materno-fœtale a été prouvé de façon certaine en France [74] et un autre est très probable [75]. Dans les deux cas l’infection maternelle était très grave.
D’un point de vue biologique, le récepteur du SARS-CoV-2, est aussi le récepteur de l’enzyme de conversion de l’angiotensine 2 (ACE2) et est nécessaire à son intégration cellulaire. L’expression de ce récepteur est faible dans la plupart des types cellulaires de l’interface materno-fœtale aux stades précoces du développement. Cependant l’expression de ce récepteur a été retrouvé par d’autres auteurs au niveau de l’interface materno-fœtale et plus tardivement dans le développement [76], [77], [78]. Faure-Bardon et al., n’ont cependant pas retrouvé ce récepteur au niveau des tissus cérébraux fœtaux (mais présent au niveau du tractus digestif et des reins) [79]. Ceci explique que le risque tératogène est à ce jour considéré comme extrêmement faible.
L’infection pourrait aussi être acquise lors du passage dans la filière génitale via les sécrétions maternelles ou via l’allaitement mais ces mécanismes sont assez rares pour les virus [16] ; La présence du virus dans le lait maternel est possible [80], [81] bien qu’aucun cas de transmission au nouveau-né par cette voie ne soit démontré en septembre 2020. La transmission pourrait aussi avoir lieu après l’accouchement via l’inhalation des gouttelettes produites par les parents ou les professionnels contaminés. Ces différentes hypothèses de transmission sont encore à évaluer plus précisément.
Il convient donc à l’heure actuelle d’être rassurant sur le risque fœtal, en particulier malformatif.
Il n’y a pas de données actuellement sur le risque de transmission in utero pour les femmes ayant une forme modérée ou sévère et accouchant à distance de l’épisode aigu. La pertinence de la recherche du virus chez le nouveau-né en cas de naissance plus d’un mois après la PCR positive de la mère est donc difficile à évaluer. Des prélèvements virologiques systématiques chez le nouveau-né (liquide amniotique, sang et selles) sont actuellement réalisés dans le cadre de la recherche (étude COVIPREG) et devraient permettre d’affirmer si cela est utile en pratique clinique.
2.3.4. Bilan biologique au diagnostic
Plusieurs anomalies biologiques ont été décrites chez les patients atteints de Covid-19. La première anomalie retrouvée est une lymphopénie, présente dès la phase de maladie virale. Des anomalies du bilan hépatique (élévation des transaminases) apparaissent ensuite au cours de la première semaine de la maladie [29]. La deuxième semaine est celle de la réponse inflammatoire : la CRP, la procalcitonine et la ferritine peuvent s’élever lors de cette phase [82]. Certains marqueurs biologiques ont été décrits comme étant associés à un risque d’évolution vers une forme grave : c’est le cas de la CRP, mais aussi d’une créatininémie élevée [83]. Dans le cadre de l’évaluation du risque thromboembolique en cas de Covid-19, l’algorithme conseillé par le HCSP utilise le dosage des D-Dimères et le fibrinogène [2] (https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=899) Rapport relatif à l’actualisation de la prise en charge des patients atteints de Covid-19. Haut Conseil de la Santé Publique. 23 juillet 2020). Cependant, il est connu que ces marqueurs sont plus difficilement interprétables pendant la grossesse, et il est également retrouvé des D-Dimères plus élevés chez les femmes enceintes Covid-19+ que chez des femmes du même âge non enceintes également Covid-19+ [15].
Dans tous les cas, avant de réaliser un bilan, il convient d’évaluer les conséquences pour la prise en charge que celui-ci entraînera. Peu d’étude ont évalué les apports du bilan biologique en cas de Covid-19 chez la femme enceinte. On considèrera les deux situations différentes que représentent la prise en charge ambulatoire et l’hospitalisation.
En cas de prise en charge ambulatoire, hors grossesse, le HCSP ne recommande aucun bilan biologique de manière systématique, mais précise que : « sont associées de façon significative aux formes graves de Covid-19 : une lymphopénie < 800/mm3, une thrombopénie < 150 000/mL, une hyperleucocytose à polynucléose, et une augmentation des D-dimères. ». Chez les femmes enceintes, la lymphopénie était également associée à un risque plus élevé d’hospitalisation en réanimation [13], aucune étude n’ayant la puissance nécessaire pour confirmer ou infirmer la valeur prédictive des plaquettes ou des D dimères, particulièrement dans le contexte de grossesse. Dans les formes non graves peut se discuter la réalisation, au minimum d’un bilan simple incluant NFS et D-Dimères.
En cas d’hospitalisation pour Covid-19, le bilan d’admission recommandé par le HCSP est au contraire extensif et comporte à « visée pronostique et de surveillance » :
Systématique :
-
•
NFS, plaquettes ;
-
•
ionogramme sanguin, urée, créatinine, bandelette urinaire ;
-
•
calcémie, phosphorémie ;
-
•
bilan hépatique, CPK, LDH, albumine, TP, TCA ;
-
•
troponine ;
-
•
CRP, fibrinogène, D-dimères.
Selon la présentation :
-
•
gazométrie artérielle si fréquence respiratoire > 25 ou SpO2 < 95 % ;
-
•
sérologies VIH, VHB et VHC de dépistage ;
-
•
hémocultures si fièvre ;
-
•
PCR multiplex naso-pharyngée, pour le diagnostic différentiel ou en cas de doute sur une infection associée ;
-
•
antigénurie légionelle et pneumocoque pour recherche de co-infections si pneumonie hypoxémiante.
Il n’y a pas de raison de modifier ce bilan à cause de l’existence d’une grossesse, hormis le fait que les sérologies de dépistage sont bien souvent déjà faites. Pour le HCSP, ce bilan doit être répété en cas de poursuite de l’hospitalisation à 7–9 jours de l’admission. La majorité des patientes hospitalisées pour COVID dans l’expérience française n’étaient plus hospitalisées après 7 jours, et celles qui ont eu une hospitalisation longue étaient prises en charge en réanimation [13]. La répétition des bilans sera donc à revoir en concertation avec les réanimateurs.
Enfin, il nous apparaît important de noter que plusieurs études ont rapporté des cas de Covid-19 sévères mimant des complications de la pré-éclampsie [62], [84] : hypertension artérielle, protéinurie, parfois cytolyse hépatique, thrombopénie voire insuffisance rénale. Dans ces cas le dosage des marqueurs sFlt-1 et PlGF pourrait être un élément pour aider au diagnostic différentiel [65]. En effet en cas de ratio sFlt-1/PlGF < 38, le diagnostic de pré-éclampsie peut être éliminé avec une excellente valeur prédictive négative (99,3 %) [85] sachant que ce ratio n’est pas actuellement encore recommandé.
2.3.5. Conséquences psychologiques
Ce contexte particulier de pandémie et les mesures de confinement qui ont été prises dans les différents États ont eu des conséquences psychologiques pour la population générale et notamment chez les femmes enceintes. Une étude chinoise multicentrique en population générale a recueilli 56 679 questionnaires parmi lesquels il était retrouvé 27,9 % de dépression, 31,6 % d’anxiété, 29,2 % d’insomnie et 24,4 % de stress chez l’ensemble des participants. Ils notaient une augmentation des risques de dépression chez les personnes infectées par le SARS-CoV-2 ou suspectées d’être infectées ainsi que chez leur famille ou amis qui étaient des cas contacts (pour la dépression ORa = 3,27, IC95 % (1,84–5,8) par rapport au non malades). Les personnes ayant gardé une activité professionnelle présentaient moins de conséquences psychologiques [86].
Une étude cas-témoins italienne a été réalisée chez la femme enceinte afin d’évaluer les conséquences psychologiques du confinement. Les cas (n = 91) étaient les femmes ayant accouché pendant la période du 8 mars au 8 mai 2020 et les témoins (n = 101) celles ayant accouché pendant la même période en 2019. Le score EPDS (Edinburgh Postpartum Depression Scale) était plus élevé chez les cas que chez les témoins (8,5 ± 4,6 vs 6,34 ± 4,1, p < 0,001). 28,6 % des patientes ayant accouché pendant la période de confinement avaient un score EPDS > 12 pouvant être le reflet d’une dépression [87].
Une étude espagnole s’est intéressée à la qualité de vie liée à la santé des femmes enceintes pendant le confinement avec comme résultat une diminution des 5 facteurs composant l’échelle de qualité de vie. Ainsi les patientes enceintes évaluée pendant le confinement avaient moins de mobilité (77,8 % vs 100 %), moins d’autonomie (90 % vs 98,9 %), elles faisaient moins leurs activités habituelles (55,5 % vs 93,3 %), présentaient plus souvent une douleur ou de l’inconfort (40 % n’étaient pas confortables vs 83,3 %) et elles avaient plus d’anxiété ou de dépression (58,9 % sans problèmes vs 92,2 % dans le groupe avant le confinement) [88].
Une étude Turque a également évalué l’attachement maternel à l’enfant avec le score MAI (Maternal Attachment Inventory allant de 26 à 104 avec un attachement plus important si le score est élevé). Ils retrouvaient dans leur population de femmes en postpartum un score moyen de 100 qui est différent de celui d’environ 73 retrouvé chez les patientes avec une dépression (p < 0,001). L’attachement semblait donc conservé. Ils n’ont pas non plus trouvé de surrisque de dépression en utilisant le score EPDS [89].
Les études sur les conséquences psychologiques de la maladie et des mesures restrictives en découlant sont à l’heure actuelle encore peu nombreuses mais les femmes enceintes étant pendant la grossesse et en post-partum a risque de conséquences psychologiques et notamment de dépression, elles nécessitent un soutien psychosocial pour prévenir ces risques.
2.3.6. Dépistage
Plusieurs publications ont décrit un dépistage systématique en maternité dans des pays différents, et à des moments divers. En raison de la nature même de la pandémie les taux de positivité retrouvés sont extrêmement variables. Ainsi, une étude dans une maternité de Madrid (Espagne) a rapporté 0,5 % de cas positifs (1/212) pendant le mois d’avril [90], un dépistage réalisé à Ankara (Turquie) entre le 15 avril et le 2 juin a rapporté un taux de positivité de 1,4 % (3/206) [91]. En Belgique, une étude réalisée entre le 30 mars et le 8 mai a rapporté 13 cas positif pour 470 femmes testées (2,8 %). Seules 5 des 13 femmes étaient asymptomatiques [92]. Au contraire, une étude réalisée à New York (USA) rapporte un taux de positivité plus élevé, de 10,4 % : 70/670, cette étude a été réalisée entre le 22 mars et le 19 avril, au moment du pic de l’épidémie à New York [93].
Ces taux sont très variables, ce qui est tout à fait attendu dans un contexte d’épidémie et pose la question du rapport coût/bénéfice de ce dépistage, quand 99,5 % des patientes sont testées négatives comme dans l’étude espagnole. Il semble donc que ce dépistage systématique à l’entrée en salle soit plus intéressant quand l’incidence est plus élevée puisque dans ce cas, il permet d’adapter la prise en charge de la patiente pour minimiser les risques de transmission au nouveau-né et au personnel (et inter patientes, cas des chambres doubles et/ou de nurseries communes). En France, la quantité de tests disponibles n’a pas permis d’instaurer ce dépistage au plus fort de l’épidémie (mi-mars) et certaines maternités l’ayant mis en place après le pic épidémique (à partir de début mai) ont rapporté un taux de positivité très faible (données non publiées) ayant conduit à l’arrêt du dépistage dans ces maternités françaises pilotes.
L’indication à réaliser un dépistage au moment de l’admission pour l’accouchement doit donc prendre en compte des considérations locales et temporelles d’organisation du service maternité en lien avec le service de virologie et de rendement attendu. La HAS recommande pour le moment un dépistage chez les patients à risque avant toute hospitalisation programmée, notamment pour un bloc opératoire.
Les patientes ayant déjà présenté une infection prouvée à SARS-CoV-2 ne doivent en théorie pas être exclues de la politique de dépistage éventuellement mise en place, car quelques publications récentes ont montré la possibilité d’une réinfection à distance [94], [95]. Quant au dépistage des co-parents pour autoriser leur venue en maternité, l’intérêt de le pratiquer n’a pas été évalué à ce jour. On ne peut pas recommander à ce jour de faire dépendre la présence du co-parent de la réalisation du dépistage. Tout doit être fait autant que faire se peut pour favoriser la présence du co-parent lors de l’accouchement et en suites de couches et s’adapter en fonction de l’évolution de l’épidémie et des organisations locales.
2.3.7. Place et pertinence du test sérologique chez la femme enceinte
Il n’existe pas d’étude spécifique de la fiabilité des tests sérologiques pendant la grossesse. Par soucis de concision, nous rapportons ici les conclusions de l’HAS [3] et du rapport du haut Conseil de la Santé Publique publié fin août 2020 [2].
Ce test est indiqué dans les cas suivants :
-
•
diagnostic initial de patients symptomatiques graves hospitalisés, en cas de tableau clinique ou scanographique évocateur et de RT-PCR négative ;
-
•
diagnostic de rattrapage de patients symptomatiques graves hospitalisés mais n’ayant pas été en mesure de réaliser un test RT-PCR dans les sept jours suivant l’apparition des symptômes ;
-
•
diagnostic initial de patients symptomatiques sans signes de gravité suivis en ville si tableau clinique évocateur et test RT-PCR négatif ;
-
•
diagnostic de rattrapage chez des patients symptomatiques avec suspicion clinique sans signes de gravité mais n’ayant pas été en mesure de réaliser un test RT-PCR dans les sept jours suivant l’apparition des symptômes ;
-
•
diagnostic étiologique à distance chez des patients symptomatiques sans signes de gravité diagnostiqué cliniquement mais n’ayant pas fait l’objet d’une RT-PCR et ce depuis la mise en place de la phase 2 (à partir de la semaine 10 de 2020).
2.4. Activité professionnelle des femmes enceintes
Sur saisine de la DGS, un groupe de travail du HCSP se réunit en septembre et octobre 2020 afin d’émettre des recommandations sur la gestion de l’activité professionnelle des femmes enceintes dans le contexte de pandémie à SARS-CoV-2. Le groupe d’expert n’a donc pas souhaité anticiper sur ce qui sera décidé à la suite de cette saisine.
2.4.1. Place de l’hospitalisation
L’hospitalisation d’une femme enceinte suspecte ou confirmée de COVID-19 ne doit pas être systématique. Elle est indiquée en cas de forme oxygéno-dépendante et en tenant compte des autres étiologies d’un syndrome infectieux. L’oxygénothérapie sera introduite en fonction de la saturométrie et de la fréquence respiratoire. Les seuils d’introduction d’une oxygénothérapie semblent devoir être relevés chez la femme enceinte : diminution de la SpO2 < 95 %. Il convient d’être vigilant en cas d’augmentation rapide des besoins en oxygène qui peut signer une aggravation nécessitant une prise en charge dans une unité spécialisée (unité de soins intensifs ou réanimation). La position ventrale est possible chez la femme enceinte et pourrait améliorer l’état respiratoire pour passer la phase aiguë et éviter d’induire une prématurité [96].
2.4.2. Traitements
Les patients présentent un sur-risque thrombotique induit par l’infection à SARS-CoV-2. Une évaluation du risque thrombotique est essentielle et systématique chez toutes les patientes avec infection prouvée [2]. Avant l’accouchement ou en cas d’accouchement par voie basse, les modalités de prévention seront adaptées en fonction de l’indice de masse corporelle, des comorbidités et de l’évolution de la maladie. En cas de forme sévère ou de césarienne, les posologies doivent être augmentées (cf. protocole de gestion). En cas de guérison consolidée, la prise en charge est la même qu’une patiente non-COVID.
En ce qui concerne l’antibiothérapie, les recommandations du HCSP [2] peuvent s’appliquer sans réserve à la femme enceinte :
-
•
aucune antibiothérapie n’est prescrite de principe chez un patient présentant des symptômes rattachés à un Covid-19 confirmé (en dehors d’un autre foyer infectieux) du fait du caractère exceptionnel de la co-infection bactérienne ;
-
•
dans l’attente de la confirmation du diagnostic virologique de Covid-19 :
-
∘
en cas de doute avec une infection bactérienne des voies respiratoires hautes, les recommandations de prise en charge (SPILF 2011) doivent être suivies : tableau de sinusite maxillaire : amoxicilline (pristinamycine si allergie aux bêta-lactamines), tableau de sinusite frontale/ethmoïdale/sphénoïdale : amoxicilline-acide clavulanique (levofloxacine si allergie aux bêta-lactamines), tableau d’angine bactérienne : amoxicilline (macrolide si allergie),
-
∘
en cas de doute avec une infection bactérienne des voies respiratoires basses, les recommandations de prise en charge (AFSSAPS 2010) doivent être suivies : sujet sain : amoxicilline (pristinamycine si allergie), sujet avec comorbidité : amoxicilline-acide clavulanique (pristinamycine si allergie), sujet avec signe de gravité : céphalosporine de 3e génération injectable associée à un macrolide.
2.5. Corticothérapie
En dehors de la maturation pulmonaire fœtale, l’indication de la corticothéapie est fondée sur les résultats préliminaires de l’étude RECOVERY [97], (essai randomisé, contrôlé, ouvert, adaptatif, comparant une gamme de traitements possibles vs les soins de support chez les patients hospitalisés pour Covid-19), de niveau de preuve élevé, a montré que l’utilisation de la dexaméthasone à la posologie de 6 mg par jour, pour une durée de 10 jours, permettait de réduire la mortalité à J28 (critère principal d’évaluation) d’un cinquième chez les patients hospitalisés pour Covid-19 avec pneumonie oxygéno-requérante, sans ventilation mécanique invasive (23,3 % vs 26,2 %, RR 0,82 [IC à 95 % 0,72 à 0,94]). Ce traitement peut être utilisé chez la femme enceinte.
La corticothérapie anténatale n’est pas contre-indiquée en cas d’infection à COVID-19 mais doit être réservée aux situations à risque de prématurité et ne substitue pas à une éventuelle indication de corticothérapie dans la prise en charge de COVID-19.
2.5.1. Traitements spécifiques
Hors grossesse, le HCSP a réalisé une étude large de la littérature ainsi qu’une revue des recommandations de plusieurs pays [2]. Il existe un consensus en septembre 2020 pour affirmer que :
-
•
la chloroquine ne doit être prescrite que dans le cadre d’essais cliniques. Il n’existe à ce jour aucune preuve de son efficacité quel que soit le stade de la maladie ;
-
•
le remdesivir semble utile chez les patients graves ;
-
•
l’association lopinavir/ritonavir, l’immunotherapie, l’utilisation de plasma de convalescents ne doivent être prescrits que lors d’essais cliniques.
Le HCSP [2] recommande, pour les patients atteints de COVID-19 pris en charge en ambulatoire, la mise en place d’un traitement symptomatique et l’abstention de prescription d’un traitement spécifique, sauf dans le cadre d’un essai clinique. Pour les patients hospitalisés avec pneumonie oxygéno-réquérante ou en réanimation, la mise en place d’un traitement symptomatique de support dsi « Standard of care » adapté à l’état du patient et l’inclusion prioritaire dans un essai thérapeutique.
Les données des thérapeutiques spécifiques à la femme enceinte sont extrêmement rares, notamment parce qu’elles sont le plus souvent exclues des essais thérapeutiques, ce qui est très regrettable.
Il y a peu de traitements validés, et certains sont en cours d’évaluation, parmi lesquels on pourrait envisager l’utilisation pendant la grossesse en l’absence de toxicité. Louchet et al. ont effectué une revue récente sur les conséquences pendant la grossesse des thérapeutiques qui ont fait l’objet d’essais thérapeutiques dans le traitement de la COVID [98]. Les corticoïdes, le lopinavir et le ritonavir, l’hydroxychloroquine ou la chloroquine, la colchicine, l’oseltamivir, l’azithromycine et certains anticorps monoclonaux pourraient être théoriquement utilisés chez la femme enceinte du fait d’un faible risque pour le fœtus et l’enfant si jamais l’efficacité devait être démontrée dans la prise en charge de la COVID. Par contre, les inhibiteurs du système rénine-angiotensine ne doivent pas être utilisés. Les données pendant la grossesse manquent actuellement pour les inhibiteurs de l’interleukine 6 (IL-6) et le remdesivir. Ainsi, au regard de ces éléments, les recommandations du HCSP peuvent être extrapolées à la femme enceinte.
3. Conclusions
Le groupe de travail du Collège national des gynécologues obstétriciens français, comme certains autres collèges internationaux [42], [43], a rédigé un protocole de prise en charge des cas possibles et confirmés de SARS-Cov-2 chez les femmes enceintes en France. Selon l’évolution épidémiologique et l’amélioration des connaissances, ce protocole est susceptible d’évoluer et doit être adapté selon les régions et l’organisation des soins dans les hôpitaux et les maternités. Des discussions multidisciplinaires au sein de chaque structure sont nécessaires, pouvant inclure les associations de patients. Les conséquences psychologiques de l’épidémie mais aussi de ses conséquences (confinement, isolement) ne sont pas sans conséquences psychologiques qu’il faut dépister et prendre en charge précocement. Une information des usagers en amont de l’accouchement est indispensable pour une meilleure préparation aux différentes situations possibles lors de l’accouchement.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Annexe 1. PROTOCOLE DE GESTION DES CAS CONTACTS, POSSIBLES OU ECONFIRMES
Cas contact :
Une RT-PCT doit-être réalisée selon les recommandations en vigueur et des mesures d’hygiène et d’isolement prises pendant 7 jours. La patiente ne doit pas consulter à l’hôpital sauf urgence ou apparition des signes cliniques. La patiente doit être informée des signes devant amener à consulter.
Prise en charge d’une patiente non suspecte d’être infectée (Figure 1)
En l’absence d’anamnèse infectieuse ou de contage, il n’y a pas lieu d’isoler la patiente. Le co-parent peut être présent s’il est asymptomatique et respecte les règles d’hygiène (masque, distanciation, lavage des mains).
Le dépistage systématique de la Covid en salle de naissance n’est à ce jour pas recommandé mais à adapter en fonction des cas et de l’évolution locale de l’épidémie.
Le port du masque est recommandé en présence des soignants. Pendant les efforts expulsifs, le port du masque serait souhaitable car il protège les soignants et la femme elle-même. Il ne peut être imposé. On peut proposer le recours à une visière adaptée au visage de façon à faciliter les efforts et la communication avec l’équipe soignante. Si la patiente n’a ni masque ni visière, le masque porté par le personnel doit être un masque FFP2 de manière à apporter une protection maximale au personnel de santé (+ lunettes de protection).
La présence du père est souhaitable au maximum, y compris pendant une éventuelle césarienne (sous couvert d’une charte des visiteurs, la recherche de symptômes compatibles avec un COVID, le respect des mesures barrières, et la limitation effective des déplacements).
En ce qui concerne les visites post natales, elles doivent être limitées afin de restreindre la déambulation de personnes dans l’hôpital et la maternité. Il existe un large consensus pour ne laisser rentrer dans la maternité que le co-parent ou un accompagnant. Les visites de fratries ne sont pas recommandées. Cela est à adapter à chaque maternité en fonction de sa situation (locaux, volume d’activité, nombre de personnels). Il faut encourager le retour à domicile rapide.
Il est impératif que tout cela soit l’objet d’informations claires aux usagers pendant le suivi de grossesse.
Cas particulier de la patiente ayant déjà eu une infection à SARS-Cov-2
On peut considérer qu’au-delà de 30 jours après l’épisode infectieux le risque d’excrétion virale résiduelle et quasi nul. Ainsi après ce délai, pour l’accouchement la patiente pourra être prise en charge comme une autre.
Ce délai est susceptible d’évoluer à la baisse : pour le HCSP le délai est de 14 jours de précautions après le début des symptômes chez un cas non grave et non immunodéprimé mais il n’y a pas de données chez la femme enceinte. Pour les consultations et les échographies, un délai de 14 jours semble raisonnable. Elles doivent cependant se faire avec les mesures barrières recommandées dans le cadre de la prévention du SARS-CoV-2
En cas de nouveaux symptômes une démarche diagnostique doit être mise en place, adaptée à la symptomatologie et un nouveau test PCR (pour le SARS-Cov-2 + PCR multiplex) peut être discuté et réalisé du fait des réinfections, exceptionnelles, mais possibles.
Cas possibles :
En cas de fièvre (inconstante dans la Covid), les autres causes de fièvre pendant la grossesse doivent être recherchées.
Le personnel d’accueil des urgences doit porter un masque chirurgical à changer au maximum toutes les 4 h. Dans l’idéal toute patiente ou tout visiteur se présentant à l’accueil général (avant même le passage aux urgences) doit avoir une prise de température non invasive et se voir administrer un questionnaire à la recherche de symptômes. Ceci permet soit d’interdire une visite soit d’engager la patiente sur un parcours spécifique diagnostique Covid.
La définition des cas possibles est changeante en fonction de l’évolution de l’épidémie et même de la région dans laquelle on exerce. Pour simplifier, les cas possibles peuvent être définis chez la femme enceinte comme toute patiente fébrile et/ou avec des signes respiratoires (dyspnée) ou signes de pneumonie ou anosmie/agueusie.
Conduite à tenir devant un « cas possible »
Prévenir le senior de Garde
Prendre les précautions gouttelettes et contact
-
-
Installation dans une pièce fermée, apposer l’affiche isolement sur la porte du box (isolement gouttelette et contact)
-
-
Faire porter un masque de soin à la patiente
-
-
Pour les soignants : masque chirurgical, gants non stériles, lunettes de sécurité, charlotte, surblouse
-
-
Avant de sortir du box, enlever gants et blouse (Déchets d’Activités de Soins à Risques Infectieux = DASRI)
-
-
À l’extérieur : Ôter le masque chirurgical, les lunettes et la charlotte (DASRI), se frictionner les mains avec la SHA
-
-
Désinfection appareil échographie (Surfa safe)
Autres mesures :
-
-
L’accompagnant est à risque d’être infecté et doit donc être orienté de façon à ce qu’il soit dépisté, et avoir les mesures d’isolement adaptées (7 jours). S’il est symptomatique il ne doit pas accompagner sa femme. S’il est asymptomatique sa présence est conditionnée au respect strict des mesures d’hygiène et des conditions d’acceptation locales. Une RT-PCR peut lui être prescrite.
-
-
Les prélèvements sanguins peuvent être réalisés par l’infirmière des urgences et dans le circuit normal des examens biologiques (cf. infra).
Prélèvement pour le test coronavirus
Le test doit être réalisé pour toute femme enceinte « cas possible ». Le prélèvement doit être fait en prenant soin de porter le masque FFP2, des lunettes de sécurité (ou une visière) et une surblouse.
Le circuit du prélèvement et le rendu du résultat doivent avoir été clairement organisés.
Réalisation de prélèvements par la sage-femme/sénior : test diagnostique initial SARS-CoV-2 sur prélèvements Virocult standard (cf. protocole annexe 1) un seul écouvillon
Cf. vidéo sur qualité du prélèvement : https://www.youtube.com/watch?v=DVJNWefmHjE
Les laboratoires de ville peuvent faire la recherche de SARS-CoV-2.
La place des tests rapides, antigéniques reste à définir.
Discussion sur l’hospitalisation
PAS D’HOSPITALISATION SYSTEMATIQUE de mère avec infection confirmée ou en attente du résultat.
Critères d’hospitalisation :
Critères d’Hospitalisation conventionnelle
PAC hypoxémiante oxygéno-requérante (Saturation en O2 < 95 % et fréquence respiratoire > 25/min en air ambiant) Ou IRA basse + comorbidités
Critères d’Hospitalisation en réanimation
Critères d’entrée PAC hypoxémiante oxygéno-requérante + comorbidités * Ou PaO2 ≤ 70 mmHg (sat < 94 % malgré 4 litre O2)
Notion évolutive de la détresse respiratoire
1) Si pas de critère d’hospitalisation
À l’heure actuelle il est recommandé de prélever toutes les patientes « cas possibles » plusieurs situations sont à considérer. Les indications de prélèvement peuvent évoluer en fonction du contexte épidémique et des disponibilités de matériel et des laboratoires.
Patiente non prélevée : à considérer comme positive par défaut. Un retour à son domicile est possible en l’attente des résultats avec respect des mesures d’hygiène
Patiente prélevée, résultat en attente : à considérer comme positive par défaut. Un retour à son domicile est possible en l’attente des résultats avec respect des mesures d’hygiène.
Patiente prélevée négative : garder le masque pour éviter de transmette un autre agent infectieux responsable des symptômes. Pas de surveillance particulière. Attention au risque de faux négatif du test. La réalisation d’un nouveau test est à rediscuter en fonction de l’évolution des symptômes.
Patiente prélevée positive : garder le masque à l’extérieur, procédure de surveillance ambulatoire selon organisation locale. La patiente doit être contactée tous les 48 h pour avoir des nouvelles de son état. En effet une aggravation ultérieure est possible. Elle doit respecter les mesures de confinement à domicile pendant 7 jours, ainsi que son conjoint. Un cahier peut être mis en place avec identification et coordonnées, pour traçabilité des résultats à récupérer et traçabilité des appels. Une surveillance par le système COVISAN peut être organisée. Privilégier la téléconsultation quand cela est possible. Après guérison, du fait du manque de connaissances sur les conséquences de la maladie : suivi par médecin recommandé ; discuter au cas par cas des échographies supplémentaires en fonction de la gravité des symptômes maternels (pas de risque tératogène connu, mais vérification de la croissance fœtale) ; pas d’impact sur le terme ou le mode d’accouchement.
En cas de prise en charge en ambulatoire :
Informer des éléments de surveillance devant amener la patiente à une réévaluation médicale
Surveillance de la température et de l’apparition de symptômes d’infection respiratoire (toux, difficultés à respirer…).
Expliquer les règles de protection intrafamiliales
Rester à domicile.
Au sein du logement : il est conseillé de rester dans une pièce spécifique, en évitant les contacts avec les autres occupants du domicile. Si possible, une salle de bain et des toilettes spécifiques sont à privilégier. Dans le cas contraire, il est recommandé de porter un masque, de se laver les mains fréquemment, de ne pas toucher d’objets communs et de laver quotidiennement les surfaces fréquemment touchées (poignées, etc.). Il est déconseillé de recevoir des visites sauf celles indispensables. Il est conseillé d’éviter tout contact avec les personnes fragiles (autres femmes enceintes, malades chroniques, personnes âgées…). Il est conseillé de limiter au maximum les déplacements, ne pas utiliser les transports en commun.
2) Si hospitalisation envisagée. Pas d’hospitalisation systématique en SMIT (Maladie infectieuses et tropicales) :
Cas possible (en attente des résultats)
Hospitalisation possible en unité d’obstétrique en l’absence de signes de détresse respiratoire, ou transfert en SMIT avec service de gynécologie obstétrique adapté à l’âge gestationnel.
Cas prouvé : hospitalisation possible en unité d’obstétrique, en chambre individuelle, ou regroupées en chambre double, adapté à l’âge gestationnel en l’absence de signes de détresse respiratoire, sinon transfert en SMIT ou service de soins intensifs avec service de gynécologie obstétrique adapté à l’âge gestationnel.
En cours d’hospitalisation :
Prélèvements sanguins (cf. Supra), Prises de constantes possibles par Infirmière avec respect des mesures d’hygiène et de protection.
Visites par Sage-femme, Interne et Sénior en respectant les mesures d’hygiène. Limiter le nombre d’intervenants.
RCF une fois par jour au 3e trimestre (ou avant en cas d’hypoxémie ou pathologie obstétricale associée).
Surveillance standard/4 h : FR, SpO2, débit O2 (0 à 4L/min lunettes), TA, FC, température
Objectifs : FR < 25 et SpO2 95–98 %
En cas de saturation < 95 % ou de FR > 25 instauration O2 2l/min ou augmenter le débit jusqu’à 4 l/min maximum, et prévenir l’obstétricien. Prévenir le réanimateur si SPO2 < 95 % malgré 4 L/min d’O2, FR > 25
En cas de difficultés respiratoires, une imagerie thoracique par TDM peut être réalisée après discussion multi disciplinaire. L’irradiation fœtale due à une radio de thorax (0,01mGy) ou un scanner thoracique (0,6 mGy) est largement en dessous du seuil à risque pour le fœtus (610 mGy).
La réalisation d’une cure de corticoïdes à visée de maturation fœtale peut être réalisée dans les cas où le risque d’accouchement prématuré est très important.
En cas de prématurité induite liée à un syndrome de détresse respiratoire, la corticothérapie de maturation fœtale est indiquée.
Anticoagulation (CARO/CNGOF)
FACTEURS DE RISQUE DE THROMBOSE EN PRé-PARTUM CHEZ LA FEMME ENCEINTE COVID-19 +
| Facteurs de risque majeurs | ATCD personnels thromboemboliques Thrombophilie asymptomatique à haut risque Sd des antiphospholipides symptomatique O2thérapie > 4 L/min ou ONHD ou ventilation artificielle |
| Facteurs de risque mineurs | Obésité (IMC > 30) ou poids > 120 kg Immobilisation prolongée et complète - O2thérapie ≤ 3 L/min |
Prévention selon le niveau de risque
| Risque faible | Aucun FDR | Pas de prophylaxie |
|---|---|---|
| Risque modéré | 1 à 2 FDR mineurs combinés | HBPM à dose prophylactique standard (ex : enoxaparine 4000 ou 6000 UI/24 h SC, voire plus selon co morbidités) |
| Risque élevé | FDR majeur(s) ou ≥ 3 FDR mineurs | HBPM à dose prophylactique renforcée (ex : enoxaparine 4000 UI/12 h SC ou 6000 UI/12 h SC si poids > 120 kg)* |
Durée : jusqu’à la guérison
Ne pas débuter la prophylaxie si accouchement imminent (avis obstétrical)
En cas d’HBPM à dose prophylactique renforcée, surveiller l’activité anti-Xa 4 heures après la 3e injection, puis régulièrement en cas d’insuffisance rénale, pour rechercher un surdosage (valeur seuil variable selon l’HBPM) exposant à un risque hémorragique plus élevé
Si symptômes COVID présents dans le post-partum, prise en charge selon la voie d’accouchement :
En cas de voie basse :
Risque faible : discuter HBPM à dose prophylactique ± Bas anti-thrombose
Risque modéré : HBPM à dose prophylactique ± Bas anti-thrombose
Risque élevé : HBPM à dose prophylactique renforcée ± Bas anti-thrombose
Durée : jusqu’à la guérison consolidée
En cas de césarienne :
HBPM à dose prophylactique standard ou renforcée selon niveau de risque et prise en compte des OR (cf. recommandations CNGOF 2015) ± Bas anti-thrombose. Durée : adaptée à l’odds ratio (cf. recommandations CNGOF 2015)
Antibiothérapie :
Le HCSP souligne l’absence d’indication d’antibiothérapie chez un patient présentant une infection à SARS-CoV-2 confirmée. Néanmoins, dans l’attente d’une confirmation du diagnostic d’infection à SARS-CoV-2, le HCSP précise les situations qui peuvent conduire à la prescription d’antibiothérapie en cas de doute avec une pneumopathie bactérienne (SPILF 2011).
À la sortie : La patiente doit être contactée tous les 48 h pour avoir des nouvelles de son état. Elle doit respecter les mesures de confinement à domicile pendant 7 jours, ainsi que son conjoint. Un cahier peut être mis en place avec identification et coordonnées, pour traçabilité des résultats à récupérer et traçabilité des appels. Privilégier la téléconsultation quand cela est possible. Consultation avec sénior 3 semaines après la sortie. Après guérison, du fait du manque de connaissances sur les conséquences de la maladie : suivi par médecin recommandé ; discuter au cas par cas des échographies supplémentaires en fonction de la gravité des symptômes maternels (pas de risque tératogène connu, mais vérification de la croissance fœtale) ; pas d’impact sur le terme ou le mode d’accouchement.
L’impact fœtal peut se faire de manière indirecte par l’hypoxie maternelle.
Il n’y a donc pas lieu de faire de prise en charge spécifiques de diagnostic prénatal des patientes infectées, sauf dans des circonstances rares :
1°) patiente ayant eu une hypoxie sévère, nécessitant une ventilation mécanique pouvant engendrer une hypoxie fœtale et des anomalies du développement cérébral (échographie diagnostique + IRM à recommander)
2°) pneumonie sévère sans hypoxie grave : des échographies de croissance peuvent se discuter par analogie avec le SARS.
Urgences Obstétricales :
En cas d’accouchement imminent, de travail en cours ou d’urgence obstétricale (hémorragie, hématome retro placentaire…) chez une patiente cas possible : en l’attente du résultat du prélèvement virologique il faut considérer la patiente comme infectée jusqu’à preuve du contraire.
Les services de maternité doivent anticiper cette possibilité en prévoyant à l’avance quelle salle de travail privilégier pour des raisons ergonomiques et de circulation des personnes.
Installation
Passage en salle de travail dédiée à la patiente. Le co-parent peut être présent s’il est asymptomatique, si les contraintes d’organisation le permettent et s’il s’engage à respecter les mesures de précaution d’hygiène et de déambulation limitée. Les contraintes d’organisation locales font que chaque maternité doit se prononcer individuellement sur ce point.
Mesures générales
Rien ne doit sortir de la salle : monitoring, chariot réa, scialytique…
Circuit sanguin standard, sauf si patiente présentant un SDRA
Si forme grave : avis du réanimateur pour évaluation, prise en charge initiale et le cas échéant, transfert dans l’unité de réanimation chirurgicale ou médicale ou polyvalente
Prise en charge en salle de travail d’une patiente avec infection possible ou prouvée <30 jours (attention délai susceptible d’évoluer à la baisse) :
Limiter le personnel contact.
Prévoir le nécessaire pour une réanimation néonatale dans la salle d’accouchement lorsque cela est possible
Une Sage-femme doit être dédiée à la patiente dans la mesure du possible. La patiente ne doit être prise en charge que par une seule sage-femme (sauf situation d’urgence).
Voie d’accouchement : pas de modification de la voie d’accouchement en raison de l’infection. Maintien des indications obstétricales classiques.
Précaution gouttelettes et contact (cf ci-dessus), comprenant une casaque stérile à usage unique.
À l’accouchement limiter le personnel au minimum indispensable.
En cas de césarienne équipe du bloc habituelle
En cas d’hémorragie : équipe habituelle
Attention aux selles qui peuvent être porteuses de virus
Virémie absente ou très faible en général
Le conjoint asymptomatique peut être présent
Tout personnel intervenant dans la salle d’accouchement doit respecter les mesures d’habillement et d’hygiène.
Si césarienne :
Port de masque FFP2 et des lunettes, équipe habituelle présente, tenue d’isolement pour tous
Eviter le passage en salle de réveil, surveillance en salle de travail ou en service de réanimation afin de maintenir l’isolement.
PEC néonatale avec une mère ayant une infection confirmée ou en l’attente du résultat
La SFN (Société Française de Néonatalogie) et Le GPIP (Groupe de pathologie Infectieuse Pédiatrique) ne recommandent actuellement pas la séparation mère enfant et ne contre indiquent pas l’allaitement.
Port du masque par la mère et mesures d’hygiène. Pas de masque pour l’enfant !
1 re situation : Le nouveau-né sans comorbidité peut rester avec sa mère, elle-même masquée (masque chirurgical), avec recommandation d’hygiène des mains strictes.
2 e situation : le nouveau-né requiert une hospitalisation en réanimation/soins intensifs (SI) de néonatalogie : hospitalisation en chambre individuelle, avec possibilité d’aération de la chambre sur l’extérieur… (dans cette situation de possible incubation chez le nouveau-né, dont on ignore la durée et la date de début de contagiosité, la prévention du risque chez les autres patients est primordiale).
3 e situation : Cas des enfants porteur d’une pathologie congénitale ne nécessitant pas une hospitalisation dont l’état de santé pourrait être dégradé par une infection à SARS-COVID-19. Il ne paraît pas justifié de séparer systématiquement l’enfant de sa mère et ce cas rejoint la situation no 1.
En cas de soins pédiatriques urgent chez le nouveau-né, il est plutôt recommandé de faire les soins dans la salle d’accouchement lorsque cela est possible, le pédiatre ayant la tenue de protection adéquate.
PEC en post-partum de mère avec infection confirmée ou en l’attente du résultat
Si résultat négatif : arrêt de l’isolement (sauf si forte suspicion clinique ou scanner positif (faux négatif de la rt-PCR)
Si résultat positif : surveillance classique en salle de travail ou isolement en suites de couches avec retour à domicile précoce (HAD). En cas de signes de détresse respiratoire discuter transfert en service de soins intensifs.
Contact avec le bébé ou mise au sein possible avec respect des règles d’hygiène adaptées : port du masque chirurgical et friction des mains avec une solution hydro-alcoolique.
Durant le sommeil, il est important de mettre le berceau à plus de deux mètres du lit pour éviter la projection de particules au cas où le masque se déplacerait pendant la nuit.
Ne pas quitter la chambre, pas de garde en nurserie.
Le conjoint asymptomatique peut être autorisé si les conditions locales permettent qu’il soit confiné avec sa femme et son bébé.
Suivi et évaluation psychologique avec notamment évaluation du score EPDS.
Sortie d’une mère COVID-19 positive et de son nouveau-né après l’accouchement
Comme toute personne confirmée COVID-19, un isolement à domicile d’une durée de 7 jours après le début des symptômes est recommandé.
Durant cet isolement, les recommandations appliquées lors de confinement en maternité de la mère et du nouveau-né se poursuivent (http://www.cngof.fr/actualites/707-covid-19-femme-enceinte)
De plus, la mère et son nouveau-né doivent :
-
-
Rester à domicile
-
-
Éviter les contacts trop rapprochés avec l’entourage intrafamilial
-
-
Le nouveau-né ne doit jamais porter de masque
La mère doit réaliser une surveillance active de sa température et de l’apparition de symptômes d’infection respiratoire (fièvre, toux, difficultés respiratoires, …)
La surveillance du nouveau-né est identique. Toute symptomatologie du bébé doit être signalée au professionnel de santé qui suit l’enfant et motivera une consultation, qui en cas d’urgence se fera aux urgences pédiatriques de l’hôpital de référence.
À la sortie du couple mère-bébé, organiser un passage au domicile par un professionnel de santé, si possible par une HAD obstétricale ou néonatale selon les secteurs, sinon par une sage-femme libérale en lien avec un pédiatre traitant ou le médecin de famille. Une attention particulière devra être portée sur le risque de conséquences psychologiques. La fréquence sera adaptée à la symptomatologie de l’enfant, mais devrait comporter une 1ère consultation dans les 48 heures suivant l’arrivée au domicile, et autour de J8 après la sortie.
RAPPEL : dans tous les cas et dans ce contexte, au cours du 1er mois de vie, pour tout examen du nouveau-né, il est recommandé de porter un masque et d’utiliser une SHA.
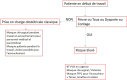
Figure 1 Prise en charge à l’arrivée en salle de travail.
Références
- 1.Peyronnet V., Sibiude J., Deruelle P., Huissoud C., Lescure X. [SARS-CoV-2 infection during pregnancy. Information and proposal of management care. CNGOF] Gynecol Obstet Fertil Senol. 2020;48:436–443. doi: 10.1016/j.gofs.2020.03.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.publique HCdlS . 2020. Rapport relatif à l’actualisation de la prise en charge des patients atteints de Covid-19. [Google Scholar]
- 3.Santé HAd . 2020. Place des tests sérologiques dans la stratégie de prise en charge de la maladie COVID-19. [Google Scholar]
- 4.Zhu N., Zhang D., Wang W., Li X., Yang B. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382:727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Song Z., Xu Y., Bao L., Zhang L., Yu P. From SARS to MERS, thrusting coronaviruses into the spotlight. Viruses. 2019;11:59. doi: 10.3390/v11010059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Hui D.S. Epidemic and emerging Coronaviruses (Severe Acute Respiratory Syndrome and Middle East Respiratory Syndrome) Clin Chest Med. 2017;38:71–86. doi: 10.1016/j.ccm.2016.11.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Lu R., Zhao X., Li J., Niu P., Yang B. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020;395:565–574. doi: 10.1016/S0140-6736(20)30251-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Huang C., Wang Y., Li X., Ren L., Zhao J. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.van Doremalen N., Bushmaker T., Morris D.H., Holbrook M.G., Gamble A. Aerosol and surface stability of HCoV-19 (SARS-CoV-2) compared to SARS-CoV-1. Lancet. 2020;395:497–506. doi: 10.1056/NEJMc2004973. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Asadi S., Bouvier N., Wexler A.S., Ristenpart W.D. The coronavirus pandemic and aerosols: Does COVID-19 transmit via expiratory particles? Aerosol Sci Technol. 2020;0:1–4. doi: 10.1080/02786826.2020.1749229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Guan W.J., Ni Z.Y., Hu Y., Liang W.H., Ou C.Q. Clinical characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382:1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Liu Y., Chen H., Tang K., Guo Y. Clinical manifestations and outcome of SARS-CoV-2 infection during pregnancy. J Infect. 2020 doi: 10.1016/j.jinf.2020.02.028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Vivanti A.J., Mattern J., Vauloup-Fellous C., Jani J., Rigonnot L. Retrospective description of pregnant women infected with severe acute respiratory syndrome Coronavirus 2, France. Emerg Infect Dis. 2020;26:2069–2076. doi: 10.3201/eid2609.202144. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kayem G., Lecarpentier E., Deruelle P., Bretelle F., Azria E. A snapshot of the Covid-19 pandemic among pregnant women in France. J Gynecol Obstet Hum Reprod. 2020;49:101826. doi: 10.1016/j.jogoh.2020.101826. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Badr D.A., Mattern J., Carlin A., Cordier A.G., Maillart E. Are clinical outcomes worse for pregnant women > = 20 weeks’ gestation infected with COVID-19? A multicenter case-control study with propensity score matching. Am J Obstet Gynecol. 2020 doi: 10.1016/j.ajog.2020.07.045. S0002-9378(20)30776-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Sentilhes L., De Marcillac F., Jouffrieau C., Kuhn P., Thuet V. COVID-19 in pregnancy was associated with maternal morbidity and preterm birth. Am J Obstet Gynecol. 2020 doi: 10.1016/j.ajog.2020.06.022. S0002-9378(20)30639-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ellington S., Strid P., Tong V.T., Woodworth K., Galang R.R. Characteristics of women of reproductive age with laboratory-confirmed SARS-CoV-2 infection by pregnancy status – United States, January 22-June 7, 2020. MMWR Morb Mortal Wkly Rep. 2020;69:769–775. doi: 10.15585/mmwr.mm6925a1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Wang D., Hu B., Hu C., Zhu F., Liu X. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lechien J.R., Chiesa-Estomba C.M., De Siati D.R., Horoi M., Le Bon S.D. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Otorhinolaryngol. 2020;277:2251–2261. doi: 10.1007/s00405-020-05965-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Lechien J.R., Chiesa-Estomba C.M., Place S., Van Laethem Y., Cabaraux P. Clinical and epidemiological characteristics of 1420 European patients with mild-to-moderate coronavirus disease 2019. J Intern Med. 2020;288:335–344. doi: 10.1111/joim.13089. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Cao Y., Liu X., Xiong L., Cai K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: a systematic review and meta-analysis. J Med Virol. 2020 doi: 10.1002/jmv.25822. 10.1002/jmv.25822. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Mao L., Jin H., Wang M., Hu Y., Chen S. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol. 2020;77:683–690. doi: 10.1001/jamaneurol.2020.1127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Madjid M., Safavi-Naeini P., Solomon S.D., Vardeny O. Potential effects of coronaviruses on the cardiovascular system: a review. JAMA Cardiol. 2020;5:831–840. doi: 10.1001/jamacardio.2020.1286. [DOI] [PubMed] [Google Scholar]
- 24.Bonow R.O., Fonarow G.C., O’Gara P.T., Yancy C.W. Association of coronavirus disease 2019 (COVID-19) with myocardial injury and mortality. JAMA Cardiol. 2020;5:751–753. doi: 10.1001/jamacardio.2020.1105. [DOI] [PubMed] [Google Scholar]
- 25.Grillet F., Behr J., Calame P., Aubry S., Delabrousse E. Acute pulmonary embolism associated with COVID-19 pneumonia detected with pulmonary CT angiography. Radiology. 2020;296:E186–E188. doi: 10.1148/radiol.2020201544. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Recalcati S. Cutaneous manifestations in COVID-19: a first perspective. J Eur Acad Dermatol Venereol. 2020;34:e212–e213. doi: 10.1111/jdv.16387. [DOI] [PubMed] [Google Scholar]
- 27.Marzano A.V., Genovese G., Fabbrocini G., Pigatto P., Monfrecola G. Varicella-like exanthem as a specific COVID-19-associated skin manifestation: multicenter case series of 22 patients. J Am Acad Dermatol. 2020;83:280–285. doi: 10.1016/j.jaad.2020.04.044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kuo I.C., O’Brien T.P. COVID-19 and ophthalmology: an underappreciated occupational hazard. Infect Control Hosp Epidemiol. 2020;41:1207–1208. doi: 10.1017/ice.2020.238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wong S.H., Lui R.N., Sung J.J. Covid-19 and the digestive system. J Gastroenterol Hepatol. 2020;35:744–748. doi: 10.1111/jgh.15047. [DOI] [PubMed] [Google Scholar]
- 30.Hoehl S., Rabenau H., Berger A., Kortenbusch M., Cinatl J. Evidence of SARS-CoV-2 infection in returning travelers from Wuhan, China. N Engl J Med. 2020;382:1278–1280. doi: 10.1056/NEJMc2001899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Pan X., Chen D., Xia Y., Wu X., Li T. Asymptomatic cases in a family cluster with SARS-CoV-2 infection. Lancet Infect Dis. 2020;20:410–411. doi: 10.1016/S1473-3099(20)30114-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Rasmussen S.A., Smulian J.C., Lednicky J.A., Wen T.S., Jamieson D.J. Coronavirus Disease 2019 (COVID-19) and pregnancy: what obstetricians need to know. Am J Obstet Gynecol. 2020;222:415–426. doi: 10.1016/j.ajog.2020.02.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Dorigatti I.O.L., Cori A. WHO collaborating Centre for Infectious Disease Modelling, RC Centre for Global Infectious disease analysis; IMperial College, London: 2020. Report 4: Severity of 2019 novel coronavirus (nCov) [Google Scholar]
- 34.Salje H., Tran Kiem C., Lefrancq N., Courtejoie N., Bosetti P. Estimating the burden of SARS-CoV-2 in France. Science. 2020;369:208–211. doi: 10.1126/science.abc3517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Shen K.L., Yang Y.H. Diagnosis and treatment of 2019 novel coronavirus infection in children: a pressing issue. World J Pediatr. 2020;16:219–221. doi: 10.1007/s12519-020-00344-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Dong Y., Mo X., Hu Y., Qi X., Jiang F. Epidemiology of COVID-19 among children in China. Pediatrics. 2020;145:e20200702. doi: 10.1542/peds.2020-0702. [DOI] [PubMed] [Google Scholar]
- 37.Tagarro A., Epalza C., Santos M., Sanz-Santaeufemia F.J., Otheo E. Screening and severity of coronavirus disease 2019 (COVID-19) in children in Madrid, Spain. JAMA Pediatr. 2020:e201346. doi: 10.1001/jamapediatrics.2020.1346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Kim L., Whitaker M., O’Halloran A., Kambhampati A., Chai S.J. Hospitalization rates and characteristics of children aged < 18 years hospitalized with laboratory-confirmed COVID-19 - COVID-NET, 14 States, March 1-July 25, 2020. MMWR Morb Mortal Wkly Rep. 2020;69:1081–1088. doi: 10.15585/mmwr.mm6932e3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Ludvigsson J.F. Children are unlikely to be the main drivers of the COVID-19 pandemic – A systematic review. Acta Paediatr. 2020;109:1525–1530. doi: 10.1111/apa.15371. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Han Y., Yang H. The transmission and diagnosis of 2019 novel coronavirus infection disease (COVID-19): a Chinese perspective. J Med Virol. 2020;92:639–644. doi: 10.1002/jmv.25749. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Allotey J., Stallings E., Bonet M., Yap M., Chatterjee S. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 2020;370:m3320. doi: 10.1136/bmj.m3320. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Chen H., Guo J., Wang C., Luo F., Yu X. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet. 2020;395:809–815. doi: 10.1016/S0140-6736(20)30360-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Teles Abrao Trad A., Ibirogba E.R., Elrefaei A., Narang K., Tonni G. Complications and outcomes of SARS-CoV-2 in pregnancy: where and what is the evidence? Hypertens Pregnancy. 2020;39:361–369. doi: 10.1080/10641955.2020.1769645. [DOI] [PubMed] [Google Scholar]
- 44.Schwartz D.A., Graham A.L. Potential maternal and infant outcomes from (Wuhan) Coronavirus 2019-nCoV infecting pregnant women: lessons from SARS, MERS, and other human coronavirus infections. Viruses. 2020;12:194. doi: 10.3390/v12020194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Rigby F.B., Pastorek J.G., 2nd. Pneumonia during pregnancy. Clin Obstet Gynecol. 1996;39:107–119. doi: 10.1097/00003081-199603000-00011. [DOI] [PubMed] [Google Scholar]
- 46.Madinger N.E., Greenspoon J.S., Ellrodt A.G. Pneumonia during pregnancy: has modern technology improved maternal and fetal outcome? Am J Obstet Gynecol. 1989;161:657–662. doi: 10.1016/0002-9378(89)90373-6. [DOI] [PubMed] [Google Scholar]
- 47.Jamieson D.J., Ellis J.E., Jernigan D.B., Treadwell T.A. Emerging infectious disease outbreaks: old lessons and new challenges for obstetrician-gynecologists. Am J Obstet Gynecol. 2006;194:1546–1555. doi: 10.1016/j.ajog.2005.06.062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Nyhan D., Quigley C., Bredin C.P. Acute respiratory failure in pregnancy due to staphylococcal pneumonia. Ir Med J. 1983;76:320–321. [PubMed] [Google Scholar]
- 49.Weinberger S.E., Weiss S.T., Cohen W.R., Weiss J.W., Johnson T.S. Pregnancy and the lung. Am Rev Respir Dis. 1980;121:559–581. doi: 10.1164/arrd.1980.121.3.559. [DOI] [PubMed] [Google Scholar]
- 50.Siston A.M., Rasmussen S.A., Honein M.A., Fry A.M., Seib K. Pandemic 2009 influenza A(H1N1) virus illness among pregnant women in the United States. JAMA. 2010;303:1517–1525. doi: 10.1001/jama.2010.479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Benedetti T.J., Valle R., Ledger W.J. Antepartum pneumonia in pregnancy. Am J Obstet Gynecol. 1982;144:413–417. doi: 10.1016/0002-9378(82)90246-0. [DOI] [PubMed] [Google Scholar]
- 52.Berkowitz K., LaSala A. Risk factors associated with the increasing prevalence of pneumonia during pregnancy. Am J Obstet Gynecol. 1990;163:981–985. doi: 10.1016/0002-9378(90)91109-p. [DOI] [PubMed] [Google Scholar]
- 53.Wong S.F., Chow K.M., Leung T.N., Ng W.F., Ng T.K. Pregnancy and perinatal outcomes of women with severe acute respiratory syndrome. Am J Obstet Gynecol. 2004;191:292–297. doi: 10.1016/j.ajog.2003.11.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Zhang J.P., Wang Y.H., Chen L.N., Zhang R., Xie Y.F. [Clinical analysis of pregnancy in second and third trimesters complicated severe acute respiratory syndrome] Zhonghua Fu Chan Ke Za Zhi. 2003;38:516–520. [PubMed] [Google Scholar]
- 55.Yang H., Wang C., Poon L.C. Novel coronavirus infection and pregnancy. Ultrasound Obstet Gynecol. 2020;55:435–437. doi: 10.1002/uog.22006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Dashraath P., Wong J.L.J., Lim M.X.K., Lim L.M., Li S. Coronavirus disease 2019 (COVID-19) pandemic and pregnancy. Am J Obstet Gynecol. 2020;222:521–531. doi: 10.1016/j.ajog.2020.03.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Blitz M.J., Grunebaum A., Tekbali A., Bornstein E., Rochelson B. Intensive care unit admissions for pregnant and nonpregnant women with coronavirus disease 2019. Am J Obstet Gynecol. 2020;223:290–291. doi: 10.1016/j.ajog.2020.05.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Blitz M.J., Rochelson B., Minkoff H., Meirowitz N., Prasannan L. Maternal mortality among women with coronavirus disease 2019 admitted to the intensive care unit. Am J Obstet Gynecol. 2020;223 doi: 10.1016/j.ajog.2020.06.020. 595 599.e5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Maternal NaiCORP . 2020. Rapid report: learning from sars-cov-2-related and associated maternal deaths in the UK. Saving Lives, Improving mother's care. [Google Scholar]
- 60.Antoun L., Taweel N.E., Ahmed I., Patni S., Honest H. Maternal COVID-19 infection, clinical characteristics, pregnancy, and neonatal outcome: a prospective cohort study. Eur J Obstet Gynecol Reprod Biol. 2020;252:559–562. doi: 10.1016/j.ejogrb.2020.07.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Di Mascio D., Khalil A., Saccone G., Rizzo G., Buca D. Outcome of coronavirus spectrum infections (SARS, MERS, COVID-19) during pregnancy: a systematic review and meta-analysis. Am J Obstet Gynecol MFM. 2020;2:100107. doi: 10.1016/j.ajogmf.2020.100107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Mendoza M., Garcia-Ruiz I., Maiz N., Rodo C., Garcia-Manau P. Pre-eclampsia-like syndrome induced by severe COVID-19: a prospective observational study. BJOG. 2020;127:1374–1380. doi: 10.1111/1471-0528.16339. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Dap M., Morel O. Proteinuria in Covid-19 pregnant women: Preeclampsia or severe infection? Eur J Obstet Gynecol Reprod Biol. 2020;252:612. doi: 10.1016/j.ejogrb.2020.07.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Liu R., Ma Q., Han H., Su H., Liu F. The value of urine biochemical parameters in the prediction of the severity of coronavirus disease 2019. Clin Chem Lab Med. 2020;58:1121–1124. doi: 10.1515/cclm-2020-0220. [DOI] [PubMed] [Google Scholar]
- 65.Federici L., Picone O., Dreyfuss D., Sibiude J. Successful continuation of pregnancy in a patient with COVID-19-related ARDS. BMJ Case Rep. 2020;13:e237511. doi: 10.1136/bcr-2020-237511. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Narang K., Enninga E.A.L., Gunaratne M., Ibirogba E.R., Trad A.T.A. SARS-CoV-2 infection and COVID-19 during pregnancy: a multidisciplinary review. Mayo Clin Proc. 2020;95:1750–1765. doi: 10.1016/j.mayocp.2020.05.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Shanes E.D., Mithal L.B., Otero S., Azad H.A., Miller E.S., Goldstein J.A. Placental pathology in COVID-19. medRxiv. 2020 doi: 10.1093/ajcp/aqaa089. 2020.05.08.20093229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Bouthry E., Picone O., Hamdi G., Grangeot-Keros L., Ayoubi J.M., Vauloup-Fellous C. Rubella and pregnancy: diagnosis, management and outcomes. Prenat Diagn. 2014;34:1246–1253. doi: 10.1002/pd.4467. [DOI] [PubMed] [Google Scholar]
- 69.Leruez-Ville M., Foulon I., Pass R., Ville Y. Cytomegalovirus infection during pregnancy: state of the science. Am J Obstet Gynecol. 2020;223:330–349. doi: 10.1016/j.ajog.2020.02.018. [DOI] [PubMed] [Google Scholar]
- 70.Egloff C., Picone O., Vauloup-Fellous C., Roques P. Mother to child SARS-CoV-2 transmission: fact or fantasy. Virologie (Montrouge) 2020;24:142–146. doi: 10.1684/vir.2020.0838. [DOI] [PubMed] [Google Scholar]
- 71.Egloff C., Vauloup-Fellous C., Picone O., Mandelbrot L., Roques P. Evidence and possible mechanisms of rare maternal-fetal transmission of SARS-CoV-2. J Clin Virol. 2020;128:104447. doi: 10.1016/j.jcv.2020.104447. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Auriti C., De Rose D.U., Tzialla C., Caforio L., Ciccia M. Vertical Transmission of SARS-CoV-2 (COVID-19): Are hypotheses more than evidences? Am J Perinatol. 2020;37:S31–S38. doi: 10.1055/s-0040-1714346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Lamouroux A., Attie-Bitach T., Martinovic J., Leruez-Ville M., Ville Y. Evidence for and against vertical transmission for severe acute respiratory syndrome coronavirus 2. Am J Obstet Gynecol. 2020;223 doi: 10.1016/j.ajog.2020.04.039. [91 e1–e4] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Vivanti A.J., Vauloup-Fellous C., Prevot S., Zupan V., Suffee C. Transplacental transmission of SARS-CoV-2 infection. Nat Commun. 2020;11:3572. doi: 10.1038/s41467-020-17436-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Alzamora M.C., Paredes T., Caceres D., Webb C.M., Valdez L.M., La Rosa M. Severe COVID-19 during pregnancy and possible vertical transmission. Am J Perinatol. 2020;37:861–865. doi: 10.1055/s-0040-1710050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Komine-Aizawa S., Takada K., Hayakawa S. Placental barrier against COVID-19. Placenta. 2020;99:45–49. doi: 10.1016/j.placenta.2020.07.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Chen W., Yuan P., Yang M., Yan Z., Kong S. SARS-CoV-2 entry factors: ACE2 and TMPRSS2 are expressed in peri-implantation embryos and the maternal-fetal interface. Engineering (Beijing) 2020 doi: 10.1016/j.eng.2020.07.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Valdes G., Neves L.A., Anton L., Corthorn J., Chacon C. Distribution of angiotensin-(1-7) and ACE2 in human placentas of normal and pathological pregnancies. Placenta. 2006;27:200–207. doi: 10.1016/j.placenta.2005.02.015. [DOI] [PubMed] [Google Scholar]
- 79.Faure-Bardon V., Isnard P., Roux N., Leruez-Ville M., Molina T. Anatomical and timely assessment of protein expression of angiotensin-converting enzyme 2, SARS-CoV-2 specific receptor, in fetal and placental tissues: new insight for perinatal counseling. Ultrasound Obstet Gynecol. 2020 doi: 10.1002/uog.22178. [Online ahead of print] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Hinojosa-Velasco A., de Oca P.V.B., Garcia-Sosa L.E., Mendoza-Duran J.G., Perez-Mendez M.J. A case report of newborn infant with severe COVID-19 in Mexico: detection of SARS-CoV-2 in human breast milk and stool. Int J Infect Dis. 2020;100:21–24. doi: 10.1016/j.ijid.2020.08.055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Centeno-Tablante E., Medina-Rivera M., Finkelstein J.L., Rayco-Solon P., Garcia-Casal M.N. Transmission of SARS-CoV-2 through breast milk and breastfeeding: a living systematic review. Ann N Y Acad Sci. 2020 doi: 10.1111/nyas.14477. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Wu C., Chen X., Cai Y., Xia J., Zhou X. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med. 2020;180:934–943. doi: 10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Bhargava A., Fukushima E.A., Levine M., Zhao W., Tanveer F. Predictors for severe COVID-19 infection. Clin Infect Dis. 2020:ciaa674. doi: 10.1093/cid/ciaa674. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Ahmed I., Eltaweel N., Antoun L., Rehal A. Severe pre-eclampsia complicated by acute fatty liver disease of pregnancy, HELLP syndrome and acute kidney injury following SARS-CoV-2 infection. BMJ Case Rep. 2020;13:e237521. doi: 10.1136/bcr-2020-237521. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Zeisler H., Llurba E., Chantraine F., Vatish M., Staff A.C. Predictive value of the sFlt-1:PlGF ratio in women with suspected preeclampsia. N Engl J Med. 2016;374:13–22. doi: 10.1056/NEJMoa1414838. [DOI] [PubMed] [Google Scholar]
- 86.Shi L., Lu Z.A., Que J.Y., Huang X.L., Liu L. Prevalence of and risk factors associated with mental health symptoms among the general population in china during the coronavirus disease 2019 pandemic. JAMA Netw Open. 2020;3:e2014053. doi: 10.1001/jamanetworkopen.2020.14053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Zanardo V., Manghina V., Giliberti L., Vettore M., Severino L., Straface G. Psychological impact of COVID-19 quarantine measures in northeastern Italy on mothers in the immediate postpartum period. Int J Gynaecol Obstet. 2020;150:184–188. doi: 10.1002/ijgo.13249. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Bivia-Roig G., La Rosa V.L., Gomez-Tebar M., Serrano-Raya L., Amer-Cuenca J.J. Analysis of the impact of the confinement resulting from COVID-19 on the lifestyle and psychological wellbeing of Spanish pregnant women: an internet-based cross-sectional survey. Int J Environ Res Public Health. 2020;17:5933. doi: 10.3390/ijerph17165933. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Oskovi-Kaplan Z.A., Buyuk G.N., Ozgu-Erdinc A.S., Keskin H.L., Ozbas A., Moraloglu Tekin O. The effect of COVID-19 pandemic and social restrictions on depression rates and maternal attachment in immediate postpartum women: a preliminary study. Psychiatr Q. 2020 doi: 10.1007/s11126-020-09843-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Herraiz I., Folgueira D., Villalain C., Forcen L., Delgado R., Galindo A. Universal screening for SARS-CoV-2 before labor admission during Covid-19 pandemic in Madrid. J Perinat Med. 2020 doi: 10.1515/jpm-2020-0236. [DOI] [PubMed] [Google Scholar]
- 91.Tanacan A., Erol S.A., Turgay B., Anuk A.T., Secen E.I. The rate of SARS-CoV-2 positivity in asymptomatic pregnant women admitted to hospital for delivery: experience of a pandemic center in Turkey. Eur J Obstet Gynecol Reprod Biol. 2020;253:31–34. doi: 10.1016/j.ejogrb.2020.07.051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Ceulemans D., Thijs I., Schreurs A., Vercammen J., Lannoo L. Screening for COVID-19 at childbirth: is it effective? Ultrasound Obstet Gynecol. 2020;56:113–114. doi: 10.1002/uog.22099. [DOI] [PubMed] [Google Scholar]
- 93.Prabhu M., Cagino K., Matthews K.C., Friedlander R.L., Glynn S.M. Pregnancy and postpartum outcomes in a universally tested population for SARS-CoV-2 in New York City: a prospective cohort study. BJOG. 2020 doi: 10.1111/1471-0528.16403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Parry J. Covid-19: Hong Kong scientists report first confirmed case of reinfection. BMJ. 2020;370:m3340. doi: 10.1136/bmj.m3340. [DOI] [PubMed] [Google Scholar]
- 95.Fernandes Valente Takeda C., Moura de Almeida M., Goncalves de Aguiar Gomes R., Cisne Souza T., Alves de Lima Mota M. Case report: recurrent clinical symptoms of COVID-19 in healthcare professionals: a series of cases from Brazil. Am J Trop Med Hyg. 2020 doi: 10.4269/ajtmh.20-0893. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Vibert F., Kretz M., Thuet V., Barthel F., De Marcillac F. Prone positioning and high-flow oxygen improved respiratory function in a 25-week pregnant woman with COVID-19. Eur J Obstet Gynecol Reprod Biol. 2020;250:257–258. doi: 10.1016/j.ejogrb.2020.05.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Group R.C., Horby P., Lim W.S., Emberson J.R., Mafham M. Dexamethasone in hospitalized patients with Covid-19 – preliminary report. N Engl J Med. 2020 [Google Scholar]
- 98.Louchet M., Sibiude J., Peytavin G., Picone O., Treluyer J.M., Mandelbrot L. Placental transfer and safety in pregnancy of medications under investigation to treat coronavirus disease 2019. Am J Obstet Gynecol MFM. 2020;2:100159. doi: 10.1016/j.ajogmf.2020.100159. [DOI] [PMC free article] [PubMed] [Google Scholar]


