Abstract
L’émergence du virus SARS-CoV-2 responsable de la maladie à COVID-19 a fait apparaître une nouvelle maladie dont les contours restent encore imparfaitement connus. Alors que les premières données suggéraient une infection purement respiratoire, les publications les plus récentes mettent en évidence un grand pléomorphisme de la maladie, responsable d’atteintes polyviscérales, au premier rang desquelles l’atteinte cardiaque. Cette atteinte cardiaque peut prendre la forme de myocardite aiguë. L’objectif de cette revue est de discuter le rationnel physiopathologique justifiant l’existence de myocardites à SARS-CoV-2 et d’analyser les données de la littérature concernant le diagnostic et le traitement de cette entité particulière.
Mots clés: Myocardite, Coronavirus, COVID-19, SARS-CoV-2, Atteinte cardiaque
Abstract
The outbreak of the SARS-CoV-2 virus responsible for the COVID-19 disease has given rise to a new disease whose boundaries are still to be discovered. While the first data suggested a purely respiratory infection, the most recent publications highlight a large pleomorphism of the disease, responsible for multiple organ damage, of which cardiac injury seems to be the most represented. This cardiac injury can present as acute myocarditis. Our aim was to discuss the pathophysiological rationale underlying the existence of SARS-CoV-2 myocarditis and to analyze the literature data regarding the diagnosis and treatment of this particular entity.
Keywords: Myocarditis, Coronavirus, COVID-19, SARS-CoV-2, Cardiac injury
1. Introduction
La maladie à COVID-19 est liée à un virus émergent à ARN, appelé SARS-CoV-2, et appartenant à la famille des Coronaviridae, virus respiratoires ubiquitaires parmi les humains et les mammifères. Le diagnostic positif est obtenu par une « RetroTranscriptase Polymerase Chain Reaction » (RT-PCR) sur un prélèvement respiratoire (écouvillonnage naso-pharyngé ou liquide d’aspiration bronchique). Il apparaît que la maladie est caractérisée par une première phrase virale peu symptomatique, marquée par la pénétration du coronavirus dans les cellules de l’hôte via le récepteur ACE-2 (récepteur de l’enzyme de conversion de l’angiotensine II), présent au niveau du poumon, des reins et du cœur. Les principaux symptômes sont pseudo-grippaux, à savoir la fièvre, la toux, les céphalées et les myalgies [1]. Cette première phase est suivie, chez certains patients (majoritairement comorbides ou âgés), d’une phase inflammatoire liée à un orage cytokinique et marquée par une dégradation clinique rapide vers une défaillance essentiellement respiratoire [2]. Au total, 81 % des patients présenteront des symptômes modérés, 14 % présenteront des symptômes sévères nécessitant une hospitalisation et 5 % présentent une forme critique nécessitant une prise en charge en réanimation [3]. La mortalité est difficile à estimer, et se situe aux alentours de 2 à 3 % environ. Des études récentes suggèrent une transmissibilité supérieure à celle du virus de la grippe, ce qui en fait un réel problème de santé publique [4].
Des manifestations extrarespiratoires ont également été décrites et dans environ 20 % des cas, la maladie à COVID-19 peut être responsable d’atteintes cardiaques [5], [6], [7] qui doivent être bien connues des cliniciens. Ces atteintes cardiaques, définies par l’élévation d’un marqueur de nécrose cardiomyocytaire (troponine et/ou CPK), prennent essentiellement la forme d’évènements thrombotiques veineux ou artériels, mais peuvent également se manifester par une myocardite aiguë dont le 1er cas suspecté a été rapporté en avril 2020 [8]. Ces atteintes cardiaques sont associées à une surmortalité [9], [10].
L’objectif de cette mise au point est d’aider à la compréhension des myocardites aiguës dans le cadre d’une infection à COVID-19. Après un rappel sur le diagnostic de myocardite, nous examinerons les données de la littérature qui suggèrent l’existence de myocardites à COVID-19 et en particulier en termes de caractéristiques cliniques et de modalités diagnostiques et thérapeutiques de cette entité particulière.
2. Généralités sur la myocardite
2.1. Définition et épidémiologie
La myocardite est une maladie inflammatoire du myocarde dont la définition repose sur les critères histologiques de Dallas. Le diagnostic nécessite la mise en évidence d’un infiltrat inflammatoire myocardique à prédominance lymphocytaire défini par la présence de > 14 leucocytes/mm3 dont plus de 4 monocytes > mm3 et 7 lymphocytes T CD3+/mm3, associé à une nécrose myocytaire d’origine non ischémique [11].
Dans les pays européens, la principale étiologie des myocardites aiguës est virale. Les hypothèses physiopathologiques sont variables et comprennent à la fois la lyse cellulaire liée à une toxicité virale directe, et des phénomènes inflammatoires liés à l’activation de la réponse immunitaire innée (production de cytokines pro-inflammatoires) puis cellulaire spécifique. Dans certaines situations, cette activation peut être excessive et conduit alors à une destruction importante des cardiomyocytes, à l'origine de dysfonction ventriculaire gauche pouvant évoluer vers un état de choc cardiogénique dans les formes les plus sévères (myocardite fulminante). Dans tous les cas, cette nécrose cardiomyocytaire est responsable de l’élévation de la troponine qui est un élément clé de la suspicion diagnostique.
2.2. Présentation clinique
Le ph é notype clinique de la myocardite est tr è s polymorphe, ce qui rend son diagnostic positif difficile. Le tableau clinique aigu peut aller de la douleur thoracique atypique à la défaillance hémodynamique foudroyante de la myocardite fulminante. La myocardite peut également être découverte au stade de cardiopathie dilatée. Dans la grande majorité des cas, la présentation clinique mime un syndrome coronarien aigu (douleur thoracique, modifications électriques) pouvant être associé à des signes d’insuffisance cardiaque. Une fois la coronaropathie éliminée (par une coronarographie ou un coroscanner selon le terrain et les facteurs de risque cardiovasculaires), le diagnostic est suspecté devant la symptomatologie clinique associée à une élévation de la troponine et éventuellement des marqueurs inflammatoires.
2.3. Diagnostic positif
L’échocardiographie est un examen clé de la prise en charge, permettant de rechercher des signes de gravité (dysfonction ventriculaire gauche, bas débit cardiaque) et de rechercher un épanchement péricardique associé. Cependant, il n’existe pas de signe échographique spécifique de myocardite.
Le « gold standard » reste donc à ce jour la biopsie endomyocardique. Une biopsie du ventricule droit et/ou du ventricule gauche est réalisée permettant ainsi l’analyse de multiples fragments. La biopsie des deux ventricules permet d’augmenter le rendement diagnostique et limite ainsi le risque de faux négatif en cas de lésion discontinues. Cependant, il s’agit d’un examen invasif pouvant se compliquer de tamponnade liée à une perforation des cavités cardiaques. Ainsi, il est proposé de réserver la biopsie endomyocardique aux situations suivantes, conformément aux recommandations :
-
•
suspicion de myocardite aiguë avec dysfonction ventriculaire gauche (FEVG < 50 %) ;
-
•
myocardite fulminante en état de choc cardiogénique, si le patient est stabilisé et transportable ;
-
•
choc cardiogénique sur une cardiopathie à coronaires saines a priori idiopathique, si le patient est stabilisé et transportable.
Depuis quelques années, l’IRM cardiaque est ainsi devenue une alternative fiable avec l’utilisation des critères de Lake Louise [12]. Plus récemment, les séquences paramétriques dites de « mapping » (T1 et T2) ont été proposées pour améliorer la pertinence diagnostique des critères précédemment décrits [13]. Le diagnostic de myocardite aiguë est donc posé devant la pr é sence d ’ un crit è re T1 (allongement du T1 myocardique, du volume extracellulaire ou présence d’un rehaussement tardif pathologique) et d ’ un crit è re T2(allongement global ou segmentaire du T2 myocardique ou hypersignal myocardique en T2).
2.4. Traitement
Il n’y a pas de traitement spécifique de la myocardite lymphocytaire. Lorsqu’il existe une dysfonction ventriculaire gauche, le traitement recommandé reste celui de l’insuffisance cardiaque associé à la contre-indication sportive en raison du risque rythmique à l’effort. Les études évaluant les immunosuppresseurs et les corticoïdes ont donné des résultats contrastés et leur intérêt est toujours débattu. En l’état actuel des connaissances, ces traitements sont réservés aux myocardites compliquées de dysfonction ventriculaire gauche résistantes au traitement médical de l’insuffisance cardiaque, aux formes fulminantes ou en cas d’étiologie spécifique [11], [14], [15]. Les myocardites fulminantes peuvent bénéficier d’assistance circulatoire en cas de défaillance hémodynamique aiguë, et ce d’autant qu’elles sont associées à un bon pronostic et à une récupération fonctionnelle fréquente.
3. Premiers indices de l’existence d’une atteinte cardiaque de la maladie à COVID-19
La prévalence exacte de la myocardite aiguë associée à une maladie à COVID-19 reste inconnue, car il existe une grande variété d’atteintes cardiaques potentielles du SARS-CoV-2 [16]. Les premières données suggérant l’existence de myocardite aiguë reposent sur la mise en évidence d’une atteinte cardiaque appelée « cardiac injury ». Selon les séries et la définition utilisée pour l’atteinte cardiaque (élévation de la troponine et/ou des peptides natriurétiques), celle-ci représente entre 19,7 et 27,8 % des 603 patients des 2 principales cohortes chinoises de Wuhan. Ainsi, une élévation de la troponine est objectivée chez 10 à 12 % des patients avec une nette prédominance chez les patients graves de réanimation [2], avec une association similaire pour le NT-pro-BNP [17]. Cette élévation de la troponine est associée à une mortalité significativement plus élevée (51,2 à 59,6 % vs 4,5 à 8,9 %) [9], [10]. Cependant, la signification exacte de l’élévation de ces biomarqueurs reste controversée. Elle peut être liée à l’hypoxie, à l’état septique ou au syndrome inflammatoire de réponse systémique [18]. Elle peut également être le témoin d’évènements thrombo-emboliques veineux [19], [20], [21] ou artériels [22], [23], en rapport avec un état hypercoagulable [24]. Elle peut enfin être en lien avec d’authentiques atteintes cardiaques virales et/ou inflammatoires prenant la forme de myocardites aiguës [25].
4. Quelle est la forme clinique des myocardites à COVID-19 ?
La présentation clinique des patients atteints ou suspects de myocardite aiguë est aspécifique. Elle comprend des symptômes classiques de COVID-19 (fièvre, asthénie, myalgies, toux, céphalées) associés à des symptômes évocateurs de myocardite aiguë (douleur thoracique, dyspnée, asthénie). Quatre-vingt-dix pour cent des patients avaient une élévation de la troponine, et 75 % présentaient des modifications électriques (troubles du rythme [18 %], décalage du segment ST [59 %], modification de la polarité des ondes T [13,6 %]) [26]. Devant l’association d’une douleur thoracique et/ou d’une défaillance hémodynamique associée à une élévation de troponine, il est important de se rappeler que le principal diagnostic différentiel reste le syndrome coronarien aigu, et ce d’autant plus que l’état hypercoagulable lié à l’infection à SARS-CoV-2 est propice aux thromboses coronaires. La première étape est donc d’éliminer une lésion coronaire aiguë [27].
L’échographie cardiaque, chez ces patients, a montré une dysfonction VG avec une FEVG moyenne mesuré à 38,5 %. Un épanchement péricardique a été objectivé chez 37 % des patients.
Parmi les 51 patients rapportés par Ho et al. [26], il est intéressant de noter que seuls 12 ont eu un diagnostic confirmé soit par l’IRM (n = 10), soit par la biopsie myocardique (n = 2) [28], [29], [30], [31], [32], [33], [34]. Les patterns d’imagerie remnographique objectivés comprenaient de l’œdème myocardique (n = 8) et un rehaussement tardif sur l’imagerie de rétention (n = 10), pouvant varier d’une prise de contraste sub-épicardique à transmurale. Un exemple est proposé Fig. 1, Fig. 2 . La topographie prédominante des lésions de rehaussement tardif était inféro-latérale. Seuls deux patients ont bénéficié d’un diagnostic histologique. L’un présentait un infiltrat lymphocytaire T diffus [35]. L’autre présentait, sur une analyse histologique post-mortem (mort subite), un infiltrat inflammatoire composé de lymphocytes, macrophages et éosinophiles avec de multiples localisations de nécrose myocytaire [36]. Aucun cas clinique rapporté dans la littérature n’a cependant mis en évidence le génome viral dans les tissus myocardiques, ce qui pose la question de l’imputabilité directe du virus.
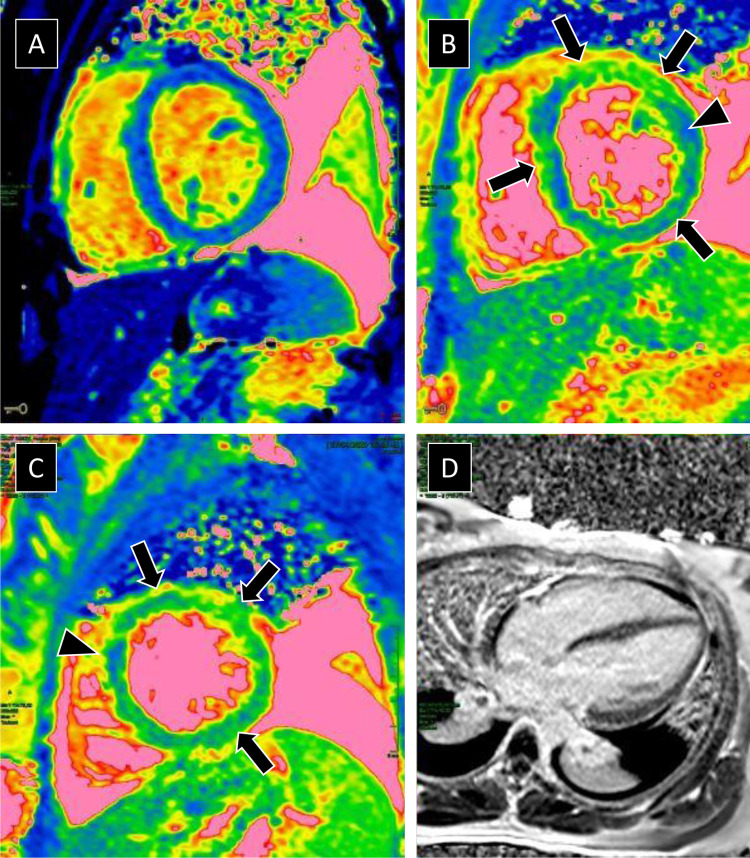
Fig. 1.
A. Séquence de relaxométrie T1 (dites de « mapping ») acquise en coupe petit axe. B et C. Séquence de relaxométrie T2 acquise en petit axe à 2 niveaux de coupe à la partie moyenne du VG. D. Séquence de rehaussement tardif acquise 15 min après injection en coupe 4 cavités. La séquence de T1 « mapping » objective une discrète élévation du T1 myocardique moyen (1070 ms) pour une normale à 1,5 T inférieure à 1000 ms. La séquence de T2 « mapping » détecte une élévation globale et franche du T2 myocardique qui est mesurée à 68 (B) et 72 ms en moyenne (couleur verte, flèches) pour une normale inférieure à 55 ms (couleur bleue). Noter une discrète hétérogénéité du T2 myocardique avec des zones anormales (vertes, flèches) et d’autres normales (bleues, tête de flèche). D. L’imagerie de rehaussement tardif ne montre pas d’anomalie particulière au niveau myocardique.
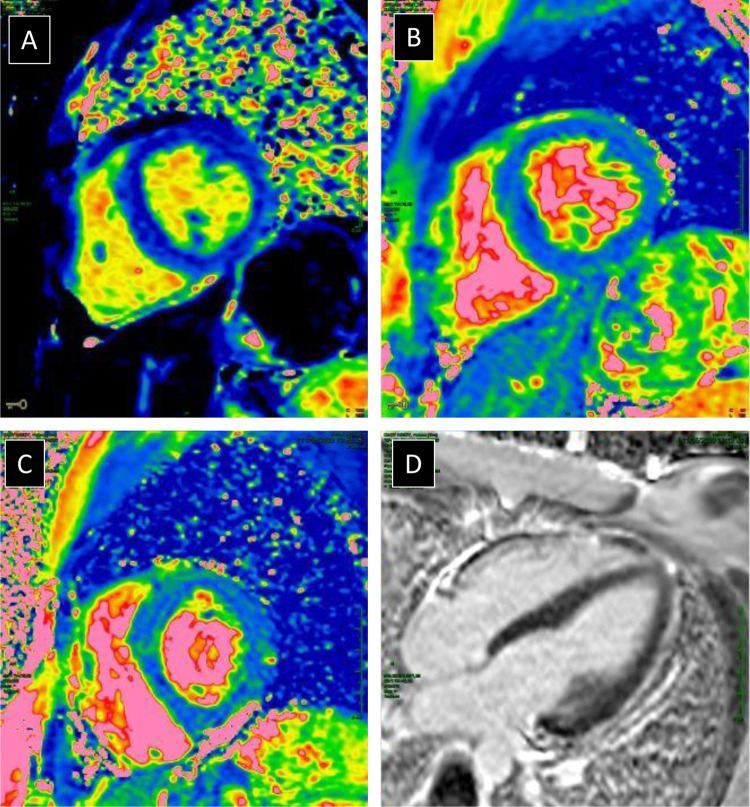
Fig. 2.
Même patiente que sur la Fig. 1. L’imagerie paramétrique T2 montre une normalisation du T2 myocardique (mesuré à 50 et 54 ms respectivement sur les coupes petit axe en B et C) à distance de l’épisode aigu. Noter la coloration bleue du myocarde comparativement à la Fig. 1 signant la disparition de l’œdème. L’imagerie T1 montre également une normalisation du T1 myocardique (mesuré à 950 ms). D. L’imagerie de rehaussement tardif ne montre pas d’anomalie.
5. Quelles sont les hypothèses physiopathologiques de la myocardite à COVID-19 ?
De la même façon que les autres coronavirus, le SARS-CoV-2 utilise le récepteur de l’enzyme de conversion de l’angiotensine II (ACE-2) pour l’entrée cellulaire. Ce récepteur est surexprimé dans les cellules alvéolaires pulmonaires, mais également dans les cardiomyocytes ce qui peut faciliter des lésions cellulaires par toxicité directe du virus, comme cela a été montré avec le MERS [37], [38]. Des modèles animaux du SARS et du MERS ont confirmé l’existence d’un tropisme cardiaque des coronavirus [39], [40]. L’hypothèse d’une toxicité directe par effet cytopathogène est donc plausible, et ce d’autant que cet effet a été mis en évidence chez un patient ayant présenté un choc cardiogénique sévère dans un contexte d’infection à SARS-CoV-2 [41]. Là encore, le génome viral n’a pas été mis en évidence et seules des particules virales de morphologie évocatrices d’un coronavirus ont été objectivées en microscopie électronique dans des cellules interstitielles. Par ailleurs, les cardiomyocytes présentaient des caractéristiques aspécifiques (lyse myofibrillaire, vacuoles lipidiques), sans que des particules virales ne soient observées dans les cellules ou l’endothélium.
Après la phase de pénétration cellulaire du virus, les mécanismes de l’immunité innée entrent en jeu. Les premières données biologiques issues des patients pris en charge dans l’épicentre de Wuhan ont montré une franche surproduction des protéines de l’inflammation (interleukines, interféron, TNF-alpha et VEGF) comparativement à des adultes sains. Ces concentrations étaient encore plus élevées chez les patients graves de réanimation comparé aux autres patients [2]. La production de ces protéines pro-inflammatoires par les lymphocytes T est la conséquence de la présentation des antigènes viraux aux lymphocytes T naïfs de l’hôte par les cellules dendritiques pulmonaires [42]. La suractivation de l’immunité innée est à l’origine de ce qui est appelé « l’orage cytokinique » essentiellement liée à l’interleukine-6 [43] qui exerce une toxicité directe sur les myocytes, comme cela a déjà été montré être en rapport avec la dégradation de la fonction cardiaque en réanimation (cardiomyopathie septique) [44]. Les mécanismes sous-jacents sont nombreux et probablement imbriqués : toxicité du NO et des radicaux libres, dysfonction microcirculatoire et endothéliale [45], inadéquation besoins/flux coronaires en situation d’élévation des besoins métaboliques. De nombreuses études ont montré que l’élévation importante des protéines de l’inflammation était associé à un plus mauvais pronostic et à un plus grand nombre de défaillances multiviscérales, ce qui conforte l’hypothèse inflammatoire [46].
6. Myocardite à COVID-19 : comment s’assurer du diagnostic ?
Bien que l’existence de la myocardite aiguë à COVID-19 soit supportée par l’existence de lésions histologiques et remnographiques typiques de myocardite, l’imputabilité directe du virus reste difficile à établir [47]. Nous venons de voir que deux mécanismes entrent en jeu dans le développement des « cardiac injuries » dans un contexte d’infection à COVID-19. Il est impossible de faire la part des choses entre l’effet cytopathogène direct et conséquence de l’orage cytokinique. L’existence de myocardites à COVID-19 reste donc assez empirique, et basée sur les éléments précédemment publiés dans le cadre des infections à MERS et SARS au début des années 2000. Le diagnostic reste complexe chez ces patients souvent graves et surtout contagieux, et donc non transportables pour une IRM ou une biopsie myocardique. L’absence, à ce jour, de la mise en évidence du génome viral dans les biopsies myocardiques (et a fortiori, sa réplication), doit conduire à une grande prudence diagnostique. Plutôt que de parler de myocardite « à » COVID-19, il convient de parler tout au plus d’une myocardite « associée » à l’infection à COVID-19. Le diagnostic étant généralement suspecté devant une élévation de troponine, il semble raisonnable de s’en tenir d’abord à une évaluation échographique et d’éliminer en premier lieu un syndrome coronarien aigu. Si l’IRM cardiaque est réalisable, celle-ci doit être réalisée pour documenter le diagnostic. Il n’y a actuellement pas de raison de recommander une biopsie myocardique systématique chez ces patients, en l’absence de traitement spécifique disponible. Les indications habituelles de la biopsie doivent donc s’appliquer, et les investigations diagnostiques invasives se discutent au cas par cas.
7. Traitement de la myocardite associée à l’infection à COVID-19
Dans le cas général, les recommandations de l’ESC sont de proposer en 1re intention un traitement symptomatique de l’insuffisance cardiaque par IEC et bêta-bloquants. De nombreuses controverses ont émergé concernant l’imputabilité potentielle des IEC dans l’aggravation des patients compte tenu du récepteur ACE-2 utilisé par le SARS-CoV-2. Cependant, il a été récemment montré que ces traitements n’influaient pas sur le pronostic [48]. Il n’y a donc pas de contre-indication spécifique à ces traitements.
L’essai RECOVERY a montré un bénéfice de la dexaméthasone chez les patients présentant une atteinte respiratoire sévère [49]. Les données sont insuffisantes pour appliquer ce traitement aux myocardites associées à la maladie à COVID-19, et il n’est donc pas recommandé de les utiliser en routine. Il semble raisonnable de s’en tenir aux indications habituelles des corticoïdes et des immunosuppresseurs dans la myocardite aiguë, à savoir les myocardites lymphocytaires avec persistance d’une dysfonction VG à 3 mois d’un traitement symptomatique.
Le remdesivir permet une diminution de la durée des symptômes sans bénéfice sur la mortalité [50]. Une méta-analyse récente a démontré que l’hydroxychloroquine n’apportait pas de bénéfice clinique net [51]. Les données sont donc insuffisantes pour recommander l’utilisation d’antiviraux ou d’hydroxychloroquine dans ce cadre.
Enfin, les traitements par plasma de patients convalescents restent actuellement à l’état de recherche et ne peuvent être recommandés de manière spécifique.
8. Conclusion
Il existe un rationnel physiopathologique suggérant l’existence d’authentiques myocardites à COVID-19 même s’il existe des myocardites purement inflammatoires liées à l’orage cytokinique. Le diagnostic suit les mêmes principes que les myocardites non liées à la COVID-19, à la différence près que, l’accès aux outils du diagnostic reste plus difficile en raison, d’une part, de la gravité des malades et, d’autre part, du risque de contagion induit par le transport de ces patients. Il paraît important de ne réserver le terme « myocardite » qu'aux seuls cas où il existe une preuve histologique ou des patterns IRM typiques. Le registre français MYOCOVID piloté par le CHU de Toulouse apportera certainement des informations précieuses dans la compréhension et la prise en charge de cette entité particulière. En attendant des études spécifiques, les principes du traitement restent pour l’instant calqués sur ceux d’une myocardite aiguë classique.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Guan W., Ni Z., Hu Y., Liang W., Ou C., He J. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Wu Z., McGoogan J.M. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in china: summary of a report of 72,314 cases from the Chinese center for disease control and prevention. JAMA. 2020;323:1239–1242. doi: 10.1001/jama.2020.2648. [DOI] [PubMed] [Google Scholar]
- 4.Zhang S., Diao M., Yu W., Pei L., Lin Z., Chen D. Estimation of the reproductive number of novel coronavirus (COVID-19) and the probable outbreak size on the Diamond Princess cruise ship: a data-driven analysis. Int J Infect Dis. 2020;93:201–204. doi: 10.1016/j.ijid.2020.02.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bavishi C., Bonow R.O., Trivedi V., Abbott J.D., Messerli F.H., Bhatt D.L. Acute myocardial injury in patients hospitalized with COVID-19 infection: a review. Prog Cardiovasc Dis. 2020 doi: 10.1016/j.pcad.2020.05.013. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus – infected pneumonia in Wuhan, China. JAMA. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Deng Q., Hu B., Zhang Y., Wang H., Zhou X., Hu W. Suspected myocardial injury in patients with COVID-19: evidence from front-line clinical observation in Wuhan, China. Int J Cardiol. 2020;311:116–121. doi: 10.1016/j.ijcard.2020.03.087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Zeng J., Huang J., Pan L. How to balance acute myocardial infarction and COVID-19: the protocols from Sichuan Provincial People's Hospital. Intensive Care Med. 2020:1–3. doi: 10.1007/s00134-020-05993-9. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Guo T., Fan Y., Chen M., Wu X., Zhang L., He T. Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19) JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.1017. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Shi S., Qin M., Shen B., Cai Y., Liu T., Yang F. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.0950. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Caforio A.L.P., Pankuweit S., Arbustini E., Basso C., Gimeno-Blanes J., Felix S.B. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34:2636–2648. doi: 10.1093/eurheartj/eht210. [DOI] [PubMed] [Google Scholar]
- 12.Friedrich M.G., Sechtem U., Schulz-Menger J., Holmvang G., Alakija P., Cooper L.T. Cardiovascular magnetic resonance in myocarditis: a JACC white paper. J Am Coll Cardiol. 2009;53:1475–1487. doi: 10.1016/j.jacc.2009.02.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ferreira V.M., Schulz-Menger J., Holmvang G., Kramer C.M., Carbone I., Sechtem U. Cardiovascular magnetic resonance in nonischemic myocardial inflammation: expert recommendations. J Am Coll Cardiol. 2018;72:3158–3176. doi: 10.1016/j.jacc.2018.09.072. [DOI] [PubMed] [Google Scholar]
- 14.Mason J.W., O’Connell J.B., Herskowitz A., Rose N.R., McManus B.M., Billingham M.E. A clinical trial of immunosuppressive therapy for myocarditis. The myocarditis treatment trial investigators. N Engl J Med. 1995;333:269–275. doi: 10.1056/NEJM199508033330501. [DOI] [PubMed] [Google Scholar]
- 15.Wei X., Fang Y., Hu H. Glucocorticoid and immunoglobulin to treat viral fulminant myocarditis. Eur Heart J. 2020;41:2122. doi: 10.1093/eurheartj/ehaa357. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Fried Justin A., Ramasubbu Kumudha, Bhatt Reema, Topkara Veli K., Clerkin Kevin J., Horn Evelyn The variety of cardiovascular presentations of COVID-19. Circulation. 2020;141:1930–1936. doi: 10.1161/CIRCULATIONAHA.120.047164. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chen C., Zhou Y., Wang D.W. SARS-CoV-2: a potential novel etiology of fulminant myocarditis. Herz. 2020:1–3. doi: 10.1007/s00059-020-04909-z. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Imazio M., Klingel K., Kindermann I., Brucato A., De Rosa F.G., Adler Y. COVID-19 pandemic and troponin: indirect myocardial injury, myocardial inflammation or myocarditis? Heart. 2020;106:1127–1131. doi: 10.1136/heartjnl-2020-317186. [DOI] [PubMed] [Google Scholar]
- 19.Chen J., Wang X., Zhang S., Liu B., Wu X., Wang Y. Findings of acute pulmonary embolism in COVID-19 patients. SSRN Electron J. 2020 doi: 10.2139/ssrn.3548771. [Article sous presse] [DOI] [Google Scholar]
- 20.Klok F.A., Kruip M.J.H.A., van der Meer N.J.M., Arbous M.S., Gommers DAMPJ, Kant K.M. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020 doi: 10.1016/j.thromres.2020.04.013. [S0049384820301201. Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Xie Y., Wang X., Yang P., Zhang S. COVID-19 complicated by acute pulmonary embolism. Radiol Cardiothorac Imaging. 2020;2:e200067. doi: 10.1148/ryct.2020200067. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Bangalore S., Sharma A., Slotwiner A., Yatskar L., Harari R., Shah B. ST-segment elevation in patients with COVID-19 – a case series. N Engl J Med. 2020 doi: 10.1056/NEJMc2009020. [NEJMc2009020. Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Akhmerov A., Marban E. COVID-19 and the heart. Circ Res. 2020 doi: 10.1161/CIRCRESAHA.120.317055. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020 doi: 10.1111/jth.14768. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Peretto G., Sala S., Caforio A.L.P. Acute myocardial injury, MINOCA, or myocarditis? Improving characterization of coronavirus-associated myocardial involvement. Eur Heart J. 2020 doi: 10.1093/eurheartj/ehaa396. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Ho J.S., Sia C.-H., Chan M.Y., Lin W., Wong R.C. Coronavirus-induced myocarditis: a meta-summary of cases. Heart Lung. 2020;49:681–685. doi: 10.1016/j.hrtlng.2020.08.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Siripanthong B., Nazarian S., Muser D., Deo R., Santangeli P., Khanji M.Y. Recognizing COVID-19 – related myocarditis: the possible pathophysiology and proposed guideline for diagnosis and management. Heart Rhythm. 2020;17:1463–1471. doi: 10.1016/j.hrthm.2020.05.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Inciardi R.M., Lupi L., Zaccone G., Italia L., Raffo M., Tomasoni D. Cardiac involvement in a patient with coronavirus disease 2019 (COVID-19) JAMA Cardiol. 2020;5:819. doi: 10.1001/jamacardio.2020.1096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Kim I.-C., Kim J.Y., Kim H.A., Han S. COVID-19-related myocarditis in a 21-year-old female patient. Eur Heart J. 2020;41(19):1859. doi: 10.1093/eurheartj/ehaa288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Luetkens J.A., Isaak A., Zimmer S., Nattermann J., Sprinkart A.M., Boesecke C. Diffuse myocardial inflammation in COVID-19 associated myocarditis detected by multiparametric cardiac magnetic resonance imaging. Circ Cardiovasc Imaging. 2020;13 doi: 10.1161/CIRCIMAGING.120.010897. [Article sous presse] [DOI] [PubMed] [Google Scholar]
- 31.Doyen D., Moceri P., Ducreux D., Dellamonica J. Myocarditis in a patient with COVID-19: a cause of raised troponin and ECG changes. Lancet Lond Engl. 2020;395:1516. doi: 10.1016/S0140-6736(20)30912-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Paul J.-F., Charles P., Richaud C., Caussin C., Diakov C. Myocarditis revealing COVID-19 infection in a young patient. Eur Heart J Cardiovasc Imaging. 2020 doi: 10.1093/ehjci/jeaa107. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Beşler M.S., Arslan H. Acute myocarditis associated with COVID-19 infection. Am J Emerg Med. 2020 doi: 10.1016/j.ajem.2020.05.100. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Coyle J., Igbinomwanhia E., Sanchez-Nadales A., Danciu S., Chu C., Shah N. A recovered case of COVID-19 myocarditis and ARDS treated with corticosteroids, tocilizumab, and experimental AT-001. JACC Case Rep. 2020;2:1331–1336. doi: 10.1016/j.jaccas.2020.04.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Sala S., Peretto G., Gramegna M., Palmisano A., Villatore A., Vignale D. Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection. Eur Heart J. 2020;41:1861–1862. doi: 10.1093/eurheartj/ehaa286. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Craver R., Huber S., Sandomirsky M., McKenna D., Schieffelin J., Finger L. Fatal eosinophilic myocarditis in a healthy 17-year-old male with Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2c) Fetal Pediatr Pathol. 2020;39:263–268. doi: 10.1080/15513815.2020.1761491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med. 2005;11:875–879. doi: 10.1038/nm1267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Alhogbani T. Acute myocarditis associated with novel Middle east respiratory syndrome coronavirus. Ann Saudi Med. 2016;36:78–80. doi: 10.5144/0256-4947.2016.78. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Agrawal A.S., Garron T., Tao X., Peng B.-H., Wakamiya M., Chan T.-S. Generation of a transgenic mouse model of Middle East respiratory syndrome coronavirus infection and disease. J Virol. 2015;89:3659–3670. doi: 10.1128/JVI.03427-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Schaecher S.R., Stabenow J., Oberle C., Schriewer J., Buller R.M., Sagartz J.E. An immunosuppressed Syrian golden hamster model for SARS-CoV infection. Virology. 2008;380:312–321. doi: 10.1016/j.virol.2008.07.026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Tavazzi G., Pellegrini C., Maurelli M., Belliato M., Sciutti F., Bottazzi A. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020;22:911–915. doi: 10.1002/ejhf.1828. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Zhu H., Rhee J.-W., Cheng P., Waliany S., Chang A., Witteles R.M. Cardiovascular complications in patients with COVID-19: consequences of viral toxicities and host immune response. Curr Cardiol Rep. 2020:22. doi: 10.1007/s11886-020-01292-3. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Lee D.W., Gardner R., Porter D.L., Louis C.U., Ahmed N., Jensen M. Current concepts in the diagnosis and management of cytokine release syndrome. Blood. 2014;124:188–195. doi: 10.1182/blood-2014-05-552729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Sato R., Nasu M. A review of sepsis-induced cardiomyopathy. J Intensive Care. 2015;3 doi: 10.1186/s40560-015-0112-5. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Varga Z., Flammer A.J., Steiger P., Haberecker M., Andermatt R., Zinkernagel A.S. Endothelial cell infection and endotheliitis in COVID-19. Lancet Lond Engl. 2020;395:1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Ruan Q., Yang K., Wang W., Jiang L., Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020:1–3. doi: 10.1007/s00134-020-05991-x. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Zhou R. Does SARS-CoV-2 cause viral myocarditis in COVID-19 patients? Eur Heart J. 2020 doi: 10.1093/eurheartj/ehaa392. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Fosbøl E.L., Butt J.H., Østergaard L., Andersson C., Selmer C., Kragholm K. Association of angiotensin-converting enzyme inhibitor or angiotensin receptor blocker use with COVID-19 diagnosis and mortality. JAMA. 2020;324:168. doi: 10.1001/jama.2020.11301. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.The RECOVERY collaborative group Dexamethasone in hospitalized patients with COVID-19 – preliminary report. N Engl J Med. 2020 doi: 10.1056/NEJMoa2021436. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Beigel J.H., Tomashek K.M., Dodd L.E., Mehta A.K., Zingman B.S., Kalil A.C. Remdesivir for the treatment of COVID-19 – preliminary report. N Engl J Med. 2020 doi: 10.1056/NEJMoa2007764. [Article sous presse] [DOI] [PubMed] [Google Scholar]
- 51.Fiolet T., Guihur A., Rebeaud M.E., Mulot M., Peiffer-Smadja N., Mahamat-Saleh Y. Effect of hydroxychloroquine with or without azithromycin on the mortality of coronavirus disease 2019 (COVID-19) patients: a systematic review and meta-analysis. Clin Microbiol Infect. 2020 doi: 10.1016/j.cmi.2020.08.022. [Article sous presse] [DOI] [PMC free article] [PubMed] [Google Scholar]