Abstract
目的
观察zeste基因增强子同源物2(EZH2)抑制剂GSK126对人舌鳞状细胞癌细胞体外增殖与凋亡的影响,并探讨其相关机制,为舌鳞状细胞癌的临床治疗提供新思路。
方法
将不同浓度的GSK126作用于舌鳞状细胞癌CAL-27细胞,通过甲基噻唑基四唑(MTT)、克隆形成、5-乙炔基-2′脱氧尿嘧啶核苷(EdU)荧光染色实验检测药物对细胞增殖能力的影响;采用Hoechst33342荧光染色、JC-1法观察细胞凋亡情况;采用Western blot法检测CAL-27细胞内相关蛋白细胞外调节蛋白激酶(ERK)、磷酸化的细胞外调节蛋白激酶(p-ERK)、Bax、Bcl-2、Cleaved caspase-9的表达水平。
结果
GSK126能抑制CAL-27细胞增殖并对细胞凋亡有促进作用。GSK126能下调细胞内p-ERK、Bcl-2的表达水平,同时可增加Bax、Cleaved caspase-9的表达(P<0.05)。
结论
GSK126可抑制舌鳞状细胞癌CAL-27细胞的增殖,并且能促进其凋亡,其机制可能与抑制MEK/ERK信号通路以及激活Bax/Bcl-2通路有关。
Keywords: 舌鳞状细胞癌, GSK126, 增殖, 凋亡
Abstract
Objective
This study aims to study the effect of the enhancer of zeste homolog 2 (EZH2) inhibitor GSK126 on the proliferation and apoptosis of human tongue squamous cell carcinoma cells in vitro and explore its related mechanisms in order to obtain insights into the clinical treatment of tongue squamous cell carcinoma.
Methods
Different concentrations of GSK126 were applied to CAL-27 cells of tongue squamous cell carcinoma, and the effects of drugs on cell proliferation were detected through methyl thiazolyl tetrazolium (MTT) assay, colony formation assay, and 5-ethynyl-2′-deoxyuridine (EdU) fluorescence staining. Hoechst33342 fluorescence staining and the JC-1 method were used in observing apoptosis. The expression levels of extracellular regulated protein kinases (ERK), phospho-extracellular regulated protein kinases (p-ERK), Bax, Bcl-2, and Cleaved caspase-9 in Cal-27 cells were detected through Western blot.
Results
GSK126 inhibited CAL-27 cell proliferation and promoted apoptosis. GSK126 down-regulated the expression of p-ERK and Bcl-2 and increased the expression of Bax and Cleaved caspase-9 (P<0.05).
Conclusion
GSK126 can inhibit the proliferation of CAL-27 cells in tongue squamous cell carcinoma and promote its apoptosis, and the related mechanism may be associated with the inhibition of the MEK/ERK signaling pathway and activation of the Bax/Bcl-2 pathway.
Keywords: tongue squamous cell carcinoma, GSK126, proliferation, apoptosis
头颈部癌症是全球第八大常见癌症。口腔鳞状细胞癌在口腔癌中发病率最高,其中发生在舌部最为多见。2018年,全世界约有345 900例口腔癌新病例,17.74万人死于口腔癌[1],且近年来,发病年龄趋向年轻化[2]。以手术为主的综合序列治疗是舌癌的主要治疗方法,但由于舌癌恶性程度较高,且易发生淋巴转移,普通的化疗药物有时难以取得令人满意的治疗效果[3]。因此,探索针对舌鳞状细胞癌的新型治疗药物具有重要意义。
果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)是多梳蛋白复合体家族的主要成员之一。研究[4]–[5]显示,在多种肿瘤组织中均可出现EZH2高表达现象。EZH2参与调节组蛋白H3第27位赖氨酸(H3K27)甲基化,在调控基因转录和基因沉默中发挥着重要的作用。GSK126作为一种高度选择性EZH2抑制剂[6],已被证实在前列腺癌、肺癌、乳腺癌等多种癌症中具有治疗效果[7],但目前在舌癌方面的研究不多。本文旨在观察GSK126对舌鳞癌CAL-27细胞增殖与凋亡的影响,并初步探讨其相关机制。
1. 材料和方法
1.1. 实验材料
人舌鳞状细胞癌细胞株CAL-27(中国生命科学院提供),胎牛血清(fetal bovine serum,FBS)、DMEM培养基(Gibco公司,美国),GSK126(Selleck公司,美国),Hoechst33342试剂(北京索莱宝科技有限公司),5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)试剂盒(广州锐博生物科技有限公司),JC-1试剂盒(上海爱必信生物科技有限公司),二辛可酸(bicinchoninic acid,BCA)蛋白定量试剂盒(上海碧云天生物技术有限公司),细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)抗体、磷酸化的细胞外调节蛋白激酶(phospho-extracellular regulated protein kinases,p-ERK)抗体、Bax抗体、Bcl-2抗体、Cleaved caspase-9抗体、β-actin抗体(CST公司,美国),电化学发光(electrochemiluminescence,ECL)试剂(沈阳万类生物科技有限公司)。
1.2. 方法
1.2.1. 细胞培养
使用含10%FBS和1%双抗(青霉素/链霉素)的DMEM培养基,将人舌癌CAL-27细胞置于5%CO2,37 °C恒温环境下培养。细胞传代时使用胰蛋白酶消化贴壁细胞,DMEM终止消化并离心,重悬后接种于培养皿中。
1.2.2. 药物干预
将GSK126用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解后放置于−80 °C保存,实验时各给药组按照不同浓度对储存液进行稀释,溶剂对照组加入相同体积的DMSO。
1.2.3. 甲基噻唑基四唑(methyl
thiazolyl tetrazolium,MTT)实验 取处于对数生长期的细胞,消化离心后将细胞密度调整为每孔5×103个,均匀铺于96孔板中。设置5个复孔,边缘孔使用无菌PBS补充。细胞贴壁后加入浓度梯度的GSK126(1、2.5、5、10、15 µmol·L−1),空白对照组不加药(0 µmol·L−1),溶剂对照组加入相同体积的DMSO,继续培养48 h后向每孔加入20 µL MTT溶液,孵育3 h后吸弃上清,加入150 µL DMSO,低速震荡使结晶充分溶解。最后用酶标仪测定各孔在490 nm处的光密度(optical density,OD)值,计算细胞存活率=(实验组OD值/空白对照组OD值)×100%。
1.2.4. 克隆形成实验
将对数生长期的CAL-27细胞消化,离心,重悬后接种于六孔板中,细胞密度设为每孔1 000个。待细胞贴壁且生长良好时按不同的浓度(5、10 µmol·L−1)给予药物处理,对照组加入同等体积的DMSO,继续培养10 d后吸弃上清,使用4%多聚甲醛室温固定30 min,再加入结晶紫染色,20 min后用PBS洗涤2次,拍照记录实验结果并计算每孔中的细胞群落数,克隆形成率=(克隆数/接种细胞数)×100%。
1.2.5. EdU增殖成像检测
将对数生长期的CAL-27细胞以细胞密度为每孔3×104个接种于3个共聚焦皿中,培养至正常生长阶段,药物处理浓度分别为5、10 µmol·L−1,对照组用等体积DMSO进行处理,培养48 h后更换细胞培养液为含EdU的培养基,孵育2 h,吸弃培养基,用4%多聚甲醛进行细胞固定化处理,用2 mg·mL−1甘氨酸脱色,加入渗透剂(0.5%Triton-100)后行Apollo染色,避光室温下摇床孵育30 min,用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染料染核,使用共聚焦显微镜拍照并记录每个视野内的阳性细胞数目。细胞增殖率=(EdU阳性细胞数/DAPI阳性细胞数)×100%。
1.2.6. Hoechst33342染色
实验收集处于对数生长期的CAL-27细胞并按照细胞密度为每孔5×104个均匀接种于3个小培养皿内,细胞贴壁且生长良好时分别加入浓度梯度为5、10 µmol·L−1的GSK126,并设置DMSO溶剂对照组,继续培养48 h后,向每个培养皿中加入Hoechst33342工作液充分覆盖细胞,37 °C恒温孵箱内孵育20 min,置于荧光显微镜下观察,拍照并记录实验结果。
1.2.7. JC-1染色实验
将CAL-27细胞按照细胞密度为每孔3×104个均匀接种在3个共聚焦皿中,细胞贴壁后分别加入5、10 µmol·L−1的GSK126,溶剂对照组不加药,培养48 h后吸去培养液,PBS洗涤1次,加入1 mL培养液及配置好的JC-1工作液,充分混匀,37 °C孵育20 min,孵育结束后吸除上清,用JC-1染色缓冲液洗涤2次,加入培养液并放置于共聚焦显微镜下观察红/绿荧光比例,拍照记录实验结果。
1.2.8. Western blot实验
收集经不同浓度GSK126处理后的舌癌细胞,加入蛋白裂解液置于冰上充分裂解,离心后取上清使用BCA蛋白定量法定量,测定蛋白浓度并制样。配置凝胶进行十二烷基磺酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)电泳,聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜转膜,5%牛血清白蛋白(bovine serum albumin,BSA)封闭2 h后,分别加入ERK、p-ERK、Bax、Bcl-2、Cleaved caspase-9兔抗人一抗及β-actin鼠抗人一抗,4 °C过夜,TBST洗膜3次后加入HRP标记的二抗,室温孵育2 h后再次洗膜,ECL显色。
1.3. 统计学分析
采用SPSS 22.0统计软件进行数据分析,各组细胞存活率、增殖率及克隆形成率均以均数±标准差表示,多组之间比较使用单因素方差分析,两两比较使用t检验,P<0.05表示差异具有统计学意义。
2. 结果
2.1. GSK126可抑制CAL-27细胞增殖
MTT实验结果表明,随着GSK126药物浓度变化(0、1、2.5、5、10、15 µmol·L−1),细胞存活率分别为100.00%±0.00%、88.13%±4.16%、83.76%±4.16%、53.73%±2.21%、31.47%±2.76%、13.11%±0.85%,细胞存活率随着药物浓度增加而持续下降(图1)。与DMSO组相比,GSK126对CAL-27细胞增殖具有明显的抑制作用,且呈浓度依赖性,差异有统计学意义(P<0.05)。
图 1. MTT法检测不同浓度GSK126对CAL-27细胞增殖的影响.
Fig 1 MTT assay was used to detect the effects of GSK126 with different concentrations on CAL-27 cell proliferation
与DMSO组相比,*P<0.05,**P<0.01。
与DMSO组相比,随着GSK126浓度增加,克隆形成的群落数逐渐减少,其中DMSO组、5 µmol·L−1组的克隆形成率分别为55.20%±3.91%、26.30%±2.91%。10 µmol·L−1组中肉眼未见有明显的克隆群落形成(图2)。方差分析结果显示,GSK126组和DMSO组间差异有统计学意义(F=244.794,P=0.000)。
图 2. GSK126对CAL-27细胞克隆形成能力的影响.
Fig 2 Effect of GSK126 on the colony formation ability of CAL-27 cells
左:克隆群落形成情况;右:细胞克隆形成率的定量分析,**P<0.01。
EdU增殖成像检测结果见图3。由图3可见,经5、10 µmol·L−1 GSK126处理后,CAL-27细胞的阳性比例明显较DMSO组降低,且呈浓度依赖性。DMSO组、5 µmol·L−1、10 µmol·L−1组增殖率分别为88.88%±7.87%、30.30%±10.02%、11.25%±13.15%。经方差分析,3组间差异具有统计学意义(F=58.582,P=0.000)。
图 3. EdU荧光染色实验检测细胞增殖能力 共聚焦显微镜.
Fig 3 Proliferation ability of cells was detected by EdU fluorescence staining confocal microscope
2.2. GSK126可促进CAL-27细胞凋亡
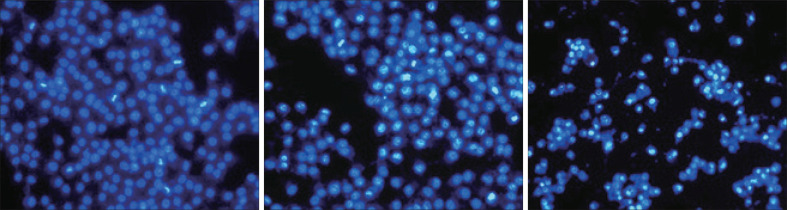
Hoechst33342染色后,DMSO组细胞形态正常,呈均匀淡染蓝色,核膜形态完整;5 µmol·L−1组见部分CAL-27细胞形态大小不均,出现碎片化,细胞核呈高亮状态;10 µmol·L−1组见细胞荧光强度更高,细胞核固缩、破碎更明显,大部分细胞形态变小且不规则,破裂成碎片状,死细胞明显增多(图4)。
图 4. Hoechst33342染色检测CAL-27细胞凋亡情况 倒置荧光显微镜 × 40.
Fig 4 Apoptosis of CAL-27 cells was detected by Hoechst33342 staining inverted fluorescence microscope × 40
左:DMSO组;中:5 µmol·L−1组;右:10 µmol·L−1组。
JC-1荧光探针检测结果见图5。DMSO组细胞活性良好,线粒体膜电位较高,JC-1聚集在线粒体基质中产生红色荧光;经不同浓度(5、10 µmol·L−1)的GSK126处理后,JC-1不能聚集在线粒体基质中,而是以单体形式存在,呈现出绿色荧光,提示线粒体膜电位较低,细胞可能正在发生早期凋亡。
图 5. JC-1荧光探针检测CAL-27细胞凋亡情况 共聚焦显微镜.
Fig 5 Apoptosis of CAL-27 cells detected by JC-1 fluorescent probe confocal microscope
2.3. GSK126影响CAL-27细胞增殖、凋亡的机制分析
Western blot检测结果见图6和表1。与对照组相比,GSK126作用后的CAL-27细胞内,ERK的表达水平无显著性变化(P>0.05),p-ERK表达水平呈降低趋势。Bax、Cleaved caspase-9表达水平升高,Bcl-2的表达水平降低,各条带呈现近似浓度依赖性。经方差分析,差异具有统计学意义(P<0.05)。
图 6. Western blot检测p-ERK、ERK、Bax、Bcl-2、Cleaved caspase-9蛋白表达.
Fig 6 Expressions of p-ERK, ERK, Bax, Bcl-2, Cleaved caspase-9 detected by Western blot
1~6:GSK126药物浓度分别为0、1、2.5、5、10、15 µmol·L−1。
表 1. 不同浓度GSK126下各蛋白的相对表达水平.
Tab 1 Relative expression levels of each protein at different concentrations of GSK126
| 浓度/(µmol·L−1) | ERK | p-ERK | Bax | Bcl-2 | Cleaved caspase-9 |
| 0 | 1.842±0.076 | 1.566±0.103 | 0.989±0.004 | 1.359±0.048 | 0.803±0.020 |
| 1 | 1.873±0.127 | 1.332±0.068 | 1.084±0.008 | 1.037±0.055 | 0.843±0.031 |
| 2.5 | 1.742±0.084 | 1.313±0.028 | 1.102±0.044 | 1.020±0.043 | 0.889±0.056 |
| 5 | 1.777±0.037 | 1.076±0.030 | 1.113±0.049 | 0.924±0.082 | 0.907±0.058 |
| 10 | 1.724±0.031 | 1.071±0.062 | 1.146±0.050 | 0.906±0.072 | 1.015±0.035 |
| 15 | 1.728±0.055 | 1.052±0.035 | 1.242±0.030 | 0.847±0.095 | 1.038±0.010 |
| F值 | 2.075 | 34.431 | 15.735 | 21.346 | 17.065 |
| P值 | 0.139 | 0.000 | 0.000 | 0.000 | 0.000 |
3. 讨论
舌鳞状细胞癌是口腔鳞状细胞癌中最具侵袭性的一种[8]。尽管在过去的30年里,各种治疗方法都取得了进步,但舌鳞状细胞癌患者的总体5年生存率仍不及50%[9]。化疗是舌癌的治疗方法之一,近年来,随着化疗技术的发展及新型化疗药物的问世,人们对于舌癌治疗药物的探索也逐步深入。
研究[10]–[11]表明,EZH2是多梳抑制复合物PRC2(polycomb repressive complex 2)的核心亚基,它可特异性催化组蛋白H3上第27位赖氨酸(H3K27)的甲基化,在表观遗传学领域发挥着不可替代的作用,目前已被证实EZH2与多种肿瘤的发生发展过程相关。GSK126是一种以EZH2为靶点的新型竞争性抑制剂[12],其作为一种新型抗癌药物,已处于临床试验阶段[13]。本实验通过MTT、克隆形成、EdU荧光染色、Hoechst33342荧光染色、JC-1染色、Western blot等一系列的实验方法表明,GSK126可以有效抑制人舌癌CAL-27细胞增殖并促进其凋亡,且呈浓度依赖性。
在克隆形成及EdU染色实验中可见,GSK126作用于舌癌CAL-27细胞后,细胞增殖水平明显下降。研究发现,MEK/ERK通路与肿瘤细胞增殖过程密切相关,此通路能通过层层级联反应将细胞外刺激信号转导至细胞及其核内[14]–[15],已经证实在舌鳞癌细胞中存在MEK/ERK过度激活现象[16],因此抑制ERK信号的激活与传导对于抗肿瘤研究具有重要意义。Western blot实验结果证实,GSK126抑制了p-ERK的表达水平,使进入活化状态的ERK减少,这可能与CAL-27细胞增殖率下降有关。
细胞凋亡是一种程序性细胞死亡过程[17],受到多种相关因子的共同调控,线粒体介导的细胞凋亡是其中一条途径。Bax和Bcl-2是参与调控细胞凋亡的一组基因,Bax过表达可促进细胞凋亡,而Bcl-2具有抑制凋亡作用。研究发现,正常情况下,细胞内部的Bax与Bcl-2比例固定,当细胞接收到凋亡信号时,Bax/Bcl-2比值增大,使线粒体膜通透性升高,细胞色素C(CytC)得以释放[18]–[19],进而激活下游Caspase-9,Caspase-3等相关凋亡蛋白,产生级联反应[20]。而当Bcl-2含量增多时,它可与Bax形成异源二聚体,阻碍Bax发挥促凋亡作用[21]。本研究Western blot结果显示,随着GSK126浓度升高,Bax含量升高而Bcl-2含量下降,Bax/Bcl-2比值增大,而Cleaved caspase-9也呈现上升趋势,表明经GSK126处理后,激活了Bax/Bcl-2通路,从而诱导更多的细胞进入了凋亡阶段。
综上所述,GSK126作为一种新型EZH2抑制剂,可抑制舌鳞状细胞癌CAL-27细胞的增殖并且促进其凋亡,其机制可能与MEK/ERK通路以及Bax/Bcl-2通路有关,提示GSK126可能成为一种具有前景的新型舌癌治疗药物。然而,舌癌的侵袭与发展过程复杂,GSK126对于舌癌的抑制效果是否还与其他机制有关仍有待进一步研究。
Funding Statement
[基金项目] 辽宁省自然科学基金(2015020326)
Supported by: Natural Science Foundation of Liaoning Province (2015020326).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Ferlay J, Colombet M, Soerjomataram I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J] Int J Cancer. 2019;144(8):1941–1953. doi: 10.1002/ijc.31937. [DOI] [PubMed] [Google Scholar]
- 2.Hussein AA, Helder MN, de Visscher JG, et al. Global incidence of oral and oropharynx cancer in patients younger than 45 years versus older patients: a systematic review[J] Eur J Cancer. 2017;82:115–127. doi: 10.1016/j.ejca.2017.05.026. [DOI] [PubMed] [Google Scholar]
- 3.De Paz D, Kao HK, Huang Y, et al. Prognostic stratification of patients with advanced oral cavity squamous cell carcinoma[J] Curr Oncol Rep. 2017;19(10):65. doi: 10.1007/s11912-017-0624-3. [DOI] [PubMed] [Google Scholar]
- 4.Kim KH, Roberts CW. Targeting EZH2 in cancer[J] Nat Med. 2016;22(2):128–134. doi: 10.1038/nm.4036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Li Z, Wang Y, Qiu J, et al. The polycomb group protein EZH2 is a novel therapeutic target in tongue cancer[J] Oncotarget. 2013;4(12):2532–2549. doi: 10.18632/oncotarget.1503. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Shen L, Cui J, Liang SM, et al. Update of research on the role of EZH2 in cancer progression[J] Onco Targets Ther. 2013;6:321–324. doi: 10.2147/OTT.S42453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Huang X, Yan J, Zhang M, et al. Targeting epigenetic crosstalk as a therapeutic strategy for EZH2-aberrant solid tumors[J] Cell. 2018;175(1):186–199. doi: 10.1016/j.cell.2018.08.058. [DOI] [PubMed] [Google Scholar]
- 8.Almangush A, Coletta RD, Bello IO, et al. A simple novel prognostic model for early stage oral tongue cancer[J] Int J Oral Maxillofac Surg. 2015;44(2):143–150. doi: 10.1016/j.ijom.2014.10.004. [DOI] [PubMed] [Google Scholar]
- 9.Tang QM, Cheng B, Xie MR, et al. Circadian clock gene bmal1 inhibits tumorigenesis and increases paclitaxel sensitivity in tongue squamous cell carcinoma[J] Cancer Res. 2017;77(2):532–544. doi: 10.1158/0008-5472.CAN-16-1322. [DOI] [PubMed] [Google Scholar]
- 10.Zeng DL, Liu MX, Pan JX. Blocking EZH2 methylation transferase activity by GSK126 decreases stem cell-like myeloma cells[J] Oncotarget. 2017;8(2):3396–3411. doi: 10.18632/oncotarget.13773. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Wu C, Jin X, Yang J, et al. Inhibition of EZH2 by chemo- and radiotherapy agents and small molecule inhibitors induces cell death in castration-resistant prostate cancer[J] Oncotarget. 2016;7(3):3440–3452. doi: 10.18632/oncotarget.6497. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Gulati N, Béguelin W, Giulino-Roth L. Enhancer of zeste homolog 2 (EZH2) inhibitors[J] Leuk Lymphoma. 2018;59(7):1574–1585. doi: 10.1080/10428194.2018.1430795. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Koppens MA, Bounova G, Cornelissen-Steijger P, et al. Large variety in a panel of human colon cancer organoids in response to EZH2 inhibition[J] Oncotarget. 2016;7(43):69816–69828. doi: 10.18632/oncotarget.12002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Deschênes-Simard X, Gaumont-Leclerc MF, Bourdeau V, et al. Tumor suppressor activity of the ERK/MAPK pathway by promoting selective protein degradation[J] Genes Dev. 2013;27(8):900–915. doi: 10.1101/gad.203984.112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kidger AM, Keyse SM. The regulation of oncogenic Ras/ERK signalling by dual-specificity mitogen activated protein kinase phosphatases(MKPs)[J] Semin Cell Dev Biol. 2016;50:125–132. doi: 10.1016/j.semcdb.2016.01.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Chan LP, Liu C, Chiang FY, et al. IL-8 promotes inflammatory mediators and stimulates activation of p38 MAPK/ERK-NF-κB pathway and reduction of JNK in HNSCC[J] Oncotarget. 2017;8(34):56375–56388. doi: 10.18632/oncotarget.16914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Xu XB, Lai YY, Hua ZC. Apoptosis and apoptotic body: disease message and therapeutic target potentials[J] Biosci Rep. 2019;39(1):BSR20180992. doi: 10.1042/BSR20180992. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bonneau B, Ando H, Kawaai K, et al. IRBIT controls apoptosis by interacting with the Bcl-2 homolog, Bcl2l10, and by promoting ER-mitochondria contact[J] Elife. 2016;5:e19896. doi: 10.7554/eLife.19896. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Maes ME, Schlamp CL, Nickells RW. Live-cell imaging to measure BAX recruitment kinetics to mitochondria during apoptosis[J] PLoS One. 2017;12(9):e0184434. doi: 10.1371/journal.pone.0184434. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Li P, Zhou LB, Zhao T, et al. Caspase-9: structure, mechanisms and clinical application[J] Oncotarget. 2017;8(14):23996–24008. doi: 10.18632/oncotarget.15098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Maes ME, Schlamp CL, Nickells RW. BAX to basics: how the BCL2 gene family controls the death of retinal ganglion cells[J] Prog Retin Eye Res. 2017;57:1–25. doi: 10.1016/j.preteyeres.2017.01.002. [DOI] [PMC free article] [PubMed] [Google Scholar]