Abstract
目的
检测E3泛素连接酶(WWP1)在慢性淋巴细胞白血病(CLL)患者中的表达,分析其与经典预后指标TP53、CD38、IGHV突变等的相关性及预后价值。
方法
48例初诊CLL患者肿瘤细胞WWP1的mRNA水平通过实时定量PCR(qPCR)检测,以9名年龄匹配的正常人作为对照组,分析其临床意义。
结果
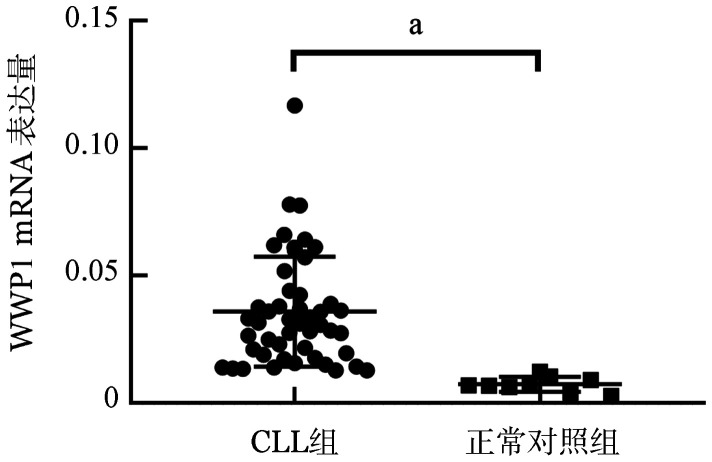
对照组WWP1 mRNA表达中位数为0.007(95%CI 0.005~0.010),CLL组表达水平为0.031(95%CI 0.019~0.044),两者的差异有统计学意义(P<0.001)。WWP1相对高转录者和低转录者中位诊断至第一次治疗的时间分别为24个月和35个月,两者的差异有统计学意义(P=0.022)。进一步亚组分析显示WWP1 mRNA表达水平与CD38表达和ZAP-70表达相关:CD38、ZAP-70阳性CLL患者较CD38、ZAP-70阴性患者的WWP1 mRNA表达水平显著升高(P值分别为0.012和0.029)。
结论
WWP1在CLL患者中存在异常高表达,而且与CLL临床预后因素ZAP-70和CD38的表达密切相关。
Keywords: 白血病,淋巴细胞,慢性, 逆转录聚合酶链反应, E3泛素连接酶, 预后
Abstract
Objective
This study aims to investigate the expression of E3 ubiquitin-ligase(WWP1)in chronic lymphocytic leukemia(CLL)patients and analyze its correlation with clinical prognostic indicators(TP53, CD38, IGHV mutation)and its prognostic value.
Methods
A total of 48 CLL patients and 9 age-matched normal subjects were enrolled in the study. The WWP1 expression was detected by SYBR Green-based real-time PCR, and the clinical relationship was analyzed by GraphPad Prism software.
Results
The WWP1 median expression was 0.007(95% CI 0.005–0.010)in the normal control group and 0.031(95% CI 0.019–0.044)in the CLL group(P<0.001). A sub-groups analysis implicated a statistically significant result(P=0.022), showing that the median time from a relatively high and low transcription level of WWP1 to the first treatment was 24 months and 35 months, respectively. Positive CD38 and ZAP-70 expressions were associated with a higher WWP1 expression(P=0.012 and 0.029, respectively).
Conclusion
An abnormal WWP1 mRNA expression was found in CLL patients with significant correlation with ZAP-70 and CD38 expressions, and WWP1 may become a new supplement of CLL prognostic markers.
Keywords: Chronic lymphocytic leukemia, Reverse transcription polymerase chain reaction, E3 ubiquitin ligase, Prognosis
慢性淋巴细胞白血病(CLL)是以CD5阳性、形态成熟的小淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征,主要发生在中老年人群中的一种成熟B淋巴细胞克隆增殖性肿瘤[1]。CLL患者的预后呈高度异质性,预后因素包括年龄、临床分期、细胞遗传学及分子遗传学等实验和临床指标[2]。E3泛素连接酶(WWP1)是近年来发现的重要致癌基因,与肿瘤的发生和发展密切相关。Sanarico等[3]发现WWP1在急性髓系白血病(AML)患者原代细胞和细胞系中高表达,抑制WWP1表达可以增加底物蛋白p27 Kip1并激活自噬以抑制肿瘤细胞生长,然而在CLL中WWP1的表达及临床意义尚未见报道。本研究采用定量PCR技术(qPCR)分析了48例CLL患者外周血肿瘤细胞中WWP1基因mRNA表达及其与临床预后因素的相关性,为CLL患者的精准和个体化治疗提供理论依据。
病例与方法
1. 病例:回顾性分析2011–2018年南京医科大学第一附属医院(江苏省人民医院)血液科收治的48例初诊CLL患者的临床资料。所有患者均符合CLL诊断标准[4],包括细胞形态学、免疫学(流式细胞术检测免疫表型)、细胞遗传学(常规染色体核型分析或FISH检测)以及分子生物学在内的综合诊断。收集本院体检中心年龄匹配的外周血标本9份作为正常对照。患者的一般临床数据包括性别、年龄、Rai分期、血清白蛋白和β2-微球蛋白(β2-MG)水平,初始淋巴细胞计数、CD38和ZAP-70表达、p53基因的缺失、p53和免疫球蛋白重链可变区(IGHV)基因突变等均纳入分析,并将TP53突变及缺失归为TP53基因异常。随访截至2019年12月,中位随访31(1~91)个月。
2. RNA提取和转录:收集CLL患者外周血标本3~4 ml,用PBS等体积稀释,然后使用Ficoll人淋巴细胞分离液(灏洋生物制品科技有限公司产品)分离单个核细胞。使用TRIzol试剂(美国Invitrogen公司产品)提取细胞总RNA,NanoDrop 2000超微量分光光度计(美国赛默飞世尔科技有限公司产品)定量RNA浓度及纯度,吸光度(A)A260/A280为1.8~2.0。cDNA合成:取0.5~1 mg总RNA,应用PrimeScript™ RT Master Mix逆转录试剂盒(日本Takara公司产品)进行逆转录,20 ml体系如下:5×PrimeScript T Master Mix 4 ml,RNA 1 mg,RNase Free dH2O补至20 ml。设置逆转录条件为:37°C 15 min,85°C 5 s,4°C冷却,−20°C保存。
3. qPCR检测WWP1 mRNA表达水平:使用ABI7300 RQ-PCR仪进行检测,并分析WWP1基因与内参(β-actin)的扩增曲线和分离曲线。根据基因扩增动力学得到各个标本的Ct值,目的基因mRNA的相对表达量=2−ΔCt×100%,ΔCt=目的基因Ct值−β-actin Ct值。qPCR使用SYBR Premix Ex Taq™Ⅱ试剂盒(日本TaKaRa公司产品),上海生工生物有限公司设计并合成了两对目的基因引物,PCR引物序列分别为:WWP1上游引物:5′-TGCTTCACCAAGGTCTGATACT-3′,下游引物:5′-GCTGTTCCGAACCAGTTCTTT T-3′;内参β-actin上游引物:5′-GTGGCCGAGGACTTTGATTG-3′,下游引物:5′-CCTGTAACAACGCATCTCATATT-3′。引物设计及优化使用Primer 6.1软件和blast对比,确保qPCR熔解曲线清晰,无其他异常波形出现且产物单一。反应体系为20 ml,包括SYBR Premix Ex taq™ 10 ml,cDNA 2 ml(相当于1000 ng RNA),上下游引物(10 mmol/L)各0.5 ml,ROX Reference Dye 0.5 ml,RNase-Free ddH2O 6.5 ml。反应条件:先95°C预变性30 s,然后95°C变性5 s,60°C退火30 s,72°C延伸30 s,共40个循环。每个反应设2个复孔,冰上操作。
4. 流式细胞术分析CLL细胞中CD38和ZAP-70蛋白的表达:CD5与CD19双阳性细胞设门(CLL细胞)分析CD38和ZAP-70的表达率,ZAP-70和CD38的cut-off值分别为30%和20%。具体操作参照文献[5]。
5. IGHV突变检测:IGHV基因引物和IGH体细胞超突变凝胶检测分析试剂盒(InVivoScribe)用于多个FCR和序列测定,以检测IGVH基因突变。具体操作参照文献[6]。Sanger测序检测p53基因突变。
6. 细胞培养:细胞系MEC1和JVM3(南京科佰生物科技有限责任公司产品)培养于含10% FBS、50µg/ml链霉素和50 U/ml青霉素(美国Gibco公司产品)的IMDM(Hyclone)培养基中,置于5% CO2培养箱内,37°C条件下培养。
7. 慢病毒载体转染及CCK-8细胞增殖实验:慢病毒载体介导的WWP1 shRNA1和空载shRNA-NC(汉恒生物科技有限公司产品)分别加入JVM3和MEC1细胞中,在24孔板中设置实验组和对照组,细胞密度为2×105/ml,24 h后细胞换液,转染5~7 d后,在培养基中加入嘌呤霉素(1µg/ml)筛选稳定细胞株。分别收集JVM3和MEC1实验组和对照组的细胞,细胞接种于96孔板中(100µl),密度1×104/孔。分别于2、24、48、72 h向每孔加入10µl CCK-8溶液,酶标仪检测450 nm处的A值。
8. 流式细胞术检测细胞周期和凋亡:Rnase A∶ PI(江苏凯基生物技术股份有限公司产品)以1∶9体积配备工作液,PBS洗涤细胞后,调整细胞密度为1×106/ml,制成细胞悬液,每管加入70%冷乙醇500µl固定2 h,每管加入配置好的500µl工作液,室温避光45 min,用流式细胞仪检测,记录激发波长488 nm处红色荧光:收集实验组和对照组细胞5×105/ml(600×g,5 min),用PBS洗涤细胞两次,加入500µl结合缓冲液悬浮细胞,加入5µl Annexin V-APC和7-AAD染液,混匀,室温避光15 min,流式细胞仪检测。实验重复3次。
9. Western blot:用RIPA裂解液(江苏凯基生物技术股份有限公司产品)提取总蛋白。用BCA试剂盒(碧云天生物技术股份有限公司)测定蛋白浓度。等量的蛋白质样品(35µg每孔)在10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,后110V电压2 h转移到聚偏氟乙烯(PVDF)膜,使用快速封闭液(生物技术股份有限公司)室温中封闭1 h,用1×TBST洗涤两次,然后将PVDF膜依次放置在一抗、二抗稀释液中,一抗孵育条件为4°C过夜,二抗孵育条件为室温下结合1 h。一抗和二抗分别以1∶1000和1∶5000稀释。最后通过ECL试剂(美国Millipore公司产品)对膜进行显色。以β-actin作为内参分析目的蛋白表达。
10. 统计学处理:使用GraphPad Prism 8.0软件进行统计学分析。使用Mann-Whitney U检验分析组间非正态分布样本的均值。检测值以样本均数和95%可信区间表示。计数资料间的比较采用χ2检验。生存分析使用Kaplan-Meier法。P<0.05为差异具有统计学意义。使用X-tile软件判断WWP1表达量的最佳界值。
结果
1. 临床特征:共分析48例CLL初治患者,男30例,女18例,中位年龄60(46~78)岁。>60岁患者26例(54.2%)。根据Rai临床分期系统,0~1期21例(43.8%),2~4期27例(56.2%)。26例(54.2%)患者β2-MG高于正常水平(正常值≤3.0 mg/L),22例(45.8%)患者初始时白蛋白低于正常水平(正常值≥40 g/L)。流式细胞术分析外周血淋巴细胞,CD38和ZAP-70阳性患者分别为15例(31.3%)和25例(52.1%)。6例(12.5%)患者p53基因异常,27例(56.3%)患者IGHV基因突变。
2. WWP1 mRNA在CLL中的表达和预后:qPCR检测到48例CLL患者WWP1 mRNA的中位表达水平为0.031(95%CI 0.019~0.044),正常对照样本WWP1 mRNA的中位表达水平为0.007(95%CI 0.005~0.010),两者的差异有统计学意义(P<0.001)(图1),提示WWP1在CLL患者中存在异常高表达。WWP1 mRNA相对高表达患者的中位诊断至首次治疗的时间(TTFT)较WWP1 mRNA相对低表达患者缩短(24个月对35个月,P=0.022)。
图1. 定量PCR法分析48例初治慢性淋巴细胞白血病(CLL)患者(CLL组)和9名健康成人(正常对照组)WWP1 mRNA的表达水平(aP<0.001).
3. WWP1 mRNA的表达水平与临床特征、分期、预后因素间的关系:分组分析显示,WWP1 mRNA的表达量与ZAP-70、CD38是否表达相关(P值分别为0.029和0.012),余预后因素与WWP1 mRNA的表达水平无明显相关性,具体数据详见表1。
表1. 48例慢性淋巴细胞白血病患者WWP1 mRNA表达水平与临床特征、分期、预后因素间的关系.
| 因素 | 例数 | WWP1 mRNA表达量[M(95%CI)] | P值 |
| 年龄 | 0.291 | ||
| ≤60岁 | 22 | 0.040(0.029~0.051) | |
| >60岁 | 26 | 0.032(0.025~0.040) | |
| 性别 | 0.110 | ||
| 男 | 30 | 0.034(0.025~0.042) | |
| 女 | 18 | 0.039(0.030~0.049) | |
| Rai分期 | 0.677 | ||
| 0~1 | 21 | 0.034(0.026~0.043) | |
| 2~4 | 27 | 0.037(0.027~0.047) | |
| 白蛋白 | 0.192 | ||
| 正常 | 26 | 0.032(0.025~0.039) | |
| 下降 | 22 | 0.041(0.030~0.052) | |
| β2-MG | 0.179 | ||
| 正常 | 22 | 0.031(0.023~0.039) | |
| 异常 | 26 | 0.040(0.030~0.050) | |
| CD38 | 0.012 | ||
| <30% | 33 | 0.032(0.025~0.038) | |
| ≥30% | 15 | 0.045(0.032~0.059) | |
| TP53异常 | 0.263 | ||
| 是 | 6 | 0.046(0.019~0.073) | |
| 否 | 42 | 0.034(0.028~0.041) | |
| IGHV突变 | 0.294 | ||
| 是 | 27 | 0.033(0.026~0.041) | |
| 否 | 21 | 0.039(0.028~0.050) | |
| ZAP-70表达 | 0.029 | ||
| <20% | 23 | 0.029(0.022~0.036) | |
| ≥20% | 25 | 0.042(0.032~0.052) | |
| 初始淋巴细胞计数 | 0.529 | ||
| >30×109/L | 23 | 0.039(0.028~0.050) | |
| ≤30×109/L | 25 | 0.033(0.026~0.040) |
注:WWP1:E3泛素连接酶;β2-MG:β2-微球蛋白;IGHV:免疫球蛋白重链可变区
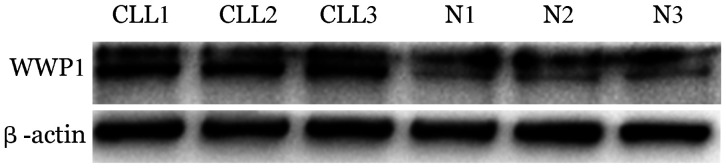
4. Western blot法检测CLL患者与对照组WWP1蛋白表达水平:随机抽取3例CLL患者,再抽取3名正常人作为对照组,Western blot法结果显示CLL患者的WWP1蛋白表达水平明显高于对照组(图2)。
图2. Western blot法检测慢性淋巴细胞白血病(CLL)患者与正常对照E3泛素连接酶(WWP1)蛋白表达水平.
N1、N2、N3:对照组;CLL1、CLL 2、CLL 3:患者;β-actin:内参
5. CCK-8法检测抑制WWP1对MEC1和JVM3细胞株增殖活性的影响:结果显示,抑制两株细胞的WWP1基因表达后均出现增殖活性的降低且敲低组和对照组在48 h、72 h的增殖差异均具有统计学意义(表2、3)。
表2. CCK-8法检测下调E3泛素连接酶(WWP1)对MEC1细胞增殖的影响[细胞活力(A450,x±s)].
| 组别 | 样本量 | 下调 WWP1后检测时间 |
|||
| 0h | 24h | 48h | 72h | ||
| SH-NC | 3 | 0.11±0.01 | 0.32±0.02 | 0.58±0.04 | 0.92±0.07 |
| SH-WWP1 | 3 | 0.12±0.01 | 0.18±0.01 | 0.35±0.02 | 0.61±0.06 |
| t值 | 1.23 | 10.84 | 8.91 | 5.82 | |
| P值 | 0.300 | <0.001 | <0.001 | 0.004 | |
注:SH-NC:转染空白质粒载体组;SH-WWP1:转染敲低WWP1慢病毒组
表3. CCK-8法检测下调E3泛素连接酶(WWP1)对JVM3细胞增殖的影响[细胞活力(A450,x±s)].
| 组别 | 样本量 | 下调WWP1后检测时间 |
|||
| 0h | 24h 48h | 72h | |||
| SH-NC | 3 | 0.11±0.01 | 0.22±0.02 | 0.44±0.04 | 0.79±0.08 |
| SH-WWP1 | 3 | 0.11±0.01 | 0.19±0.01 | 0.36±0.02 | 0.53±0.04 |
| t值 | 0 | 2.32 | 3.10 | 5.04 | |
| P值 | >0.900 | 0.080 | 0.040 | 0.007 | |
注:SH-NC:转染空白质粒载体组;SH-WWP1:转染敲低WWP1慢病毒组
6. 流式细胞术检测敲低WWP1后两细胞株的细胞周期分布情况:MEC1细胞株敲低WWP1后停止分裂时期(G0期)/DNA合成前期(G1期)细胞百分比较空白对照组升高[(63.6±1.4)%对(56.2±1.3)%,P<0.05],DNA合成期(S期)细胞百分比较空白对照组降低[(30.0±0.8)%对(38.4±0.6)%,P<0.001],而两组分裂期(M期)细胞百分比的差异无统计学意义[(6.4±1.8)%对(5.4±1.6)%,P=0.510]。在JVM3细胞株中也观察到同样的趋势,WWP1抑制组的G0期/G1期细胞百分比较空白对照组显著升高[(66.2±1.8)%对(55.3±1.3)%,P=0.001)],且S期细胞百分比显著降低[(38.2±0.6)%对(26.6±2.2)%,P=0.001],两组M期细胞百分比的差异无统计学意义[(6.5±1.8)%对(7.2±2.5)%,P=0.710]。细胞周期结果表明,在CLL细胞株中敲低WWP1可抑制细胞增殖,使处于G0期/G1期的细胞数增多,S期的细胞数减少。
8. 流式细胞术检测细胞凋亡水平:在MEC1细胞株中,抑制WWP1组和对照组总凋亡率分别为(24.0±1.1)%和(11.4±1.8)%,差异有统计学意义(P=0.001)。JVM3细胞株中,抑制WWP1组和对照组总凋亡率分别为(23.6±1.6)%和(11.8±1.4)%,差异有统计学意义(P=0.001)。因此抑制WWP1基因促进了MEC1和JVM3细胞凋亡。
讨论
泛素-蛋白酶体系统是蛋白质降解的主要调控途径,在细胞分裂、基因转录、信号转导等多个生物学过程中发挥重要作用,其成员在多种癌症中存在异常表达[7]。WWP1基因位于人类染色体8q21,是HECT的一个亚家族,属于Nedd4 E3泛素连接酶家族。泛素连接酶通过特异性识别蛋白质底物并通过泛素化降解调节靶蛋白的含量,在蛋白质的翻译修饰中起关键作用。功能研究发现,WWP1的异常表达与细胞增殖、凋亡、转录和蛋白质降解等密切相关[8]–[9]。越来越多的证据表明,WWP1与肿瘤进展直接相关,并且已被认为是部分肿瘤的致癌基因,包括胃癌[10]、肝癌[11]、口腔癌[12]等。Chen等[13]研究发现WWP1在结直肠癌患者中高表达,且与不良预后显著相关,进一步研究表明过表达WWP1可以促进肿瘤细胞增殖,抑制WWP1有相反的作用。Li等[14]研究发现miR-584-5p可以与WWP1直接结合,抑制胃癌细胞增殖并促进细胞凋亡。它可以作用于具有抑癌活性的多种底物,包括Smads、RNF11、p27、p53等[9],有助于肿瘤进展。Cheng等[11]发现内源性WWP1下调显著抑制了肝癌细胞的生长,诱导细胞凋亡,并促进凋亡相关蛋白(激活的caspase-3和p53)的表达。Wang等[15]发现硼替佐米可以通过降低Smurf1、Smurf2和WWP1的表达抑制前列腺癌及其骨转移。Lee等[16]研究发现WWP1负调控PTEN-Akt途径,抑制WWP1可以使PTEN重新激活进而杀伤肿瘤。因此,抑制WWP1将间接增加肿瘤抑制因子的表达,对于多种肿瘤可能是一种有前途的治疗策略。
迄今为止,对血液恶性肿瘤中WWP1异常表达的研究主要局限于AML,目前国际上尚无在CLL中表达的报道。本文着重探讨CLL细胞中WWP1的异常表达及其临床意义,并通过qPCR检测发现,CLL患者中WWP1 mRNA的表达水平明显高于正常人群(P<0.001),亚组分析显示WWP1相对高表达患者TTFT短于WWP1相对低表达的CLL患者,差异有统计学意义,提示WWP1可能参与CLL的发生发展。进一步的分析显示,CLL患者中WWP1的表达与疾病分期、年龄和初始淋巴细胞计数无显著相关性,而与CD38和ZAP-70的表达相关,CD38和ZAP-70阳性CLL患者WWP1的表达显著增高,提示WWP1可能与CLL预后不良相关。
总之,本研究发现WWP1 mRNA在CLL细胞中异常高表达,且与CLL预后因素CD38和ZAP-70的表达相关,生存分析提示WWP1高表达的患者TTFT较短,疾病进展较快,提示WWP1可能成为新的CLL预后因素。Li等[17]的研究表明,WWP1可以负向调控P53及家族成员P63的功能。在约90%的CLL初诊病例中,TP53基因在诊断时处于野生型状态,TP53异常的患者往往预后不佳。而在CLL中,WWP1调控TP53的机制还需要进一步研究。此外,抑制WWP1过表达可以诱导肿瘤细胞生长受抑和凋亡,也可成为CLL的潜在治疗靶点,为CLL的靶向治疗提供理论途径。
Funding Statement
基金项目:国家自然科学基金国际合作与交流项目(81720108002);国家科学和技术重大专项(2018ZX09734-007)
Fund program: International cooperation and exchange program of National Natural Science Foundation of China(81720108002); National Science and Technology Najor Project of China(2018ZX09734-007)
References
- 1.中华医学会血液学分会白血病淋巴瘤学组, 中国抗癌协会血液肿瘤专业委员会, 中国慢性淋巴细胞白血病工作组. 中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南 (2018年版)[J] 中华血液学杂志. 2018;39(5):353–358. doi: 10.3760/cma.j.issn.0253-2727.2018.05.001. [DOI] [Google Scholar]
- 2.Nabhan C, Raca G, Wang YL. Predicting Prognosis in Chronic Lymphocytic Leukemia in the Contemporary Era[J] JAMA Oncol. 2015;1(7):965–974. doi: 10.1001/jamaoncol.2015.0779. [DOI] [PubMed] [Google Scholar]
- 3.Sanarico AG, Ronchini C, Croce A, et al. The E3 ubiquitin ligase WWP1 sustains the growth of acute myeloid leukaemia[J] Leukemia. 2018;32(4):911–919. doi: 10.1038/leu.2017.342. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.李 建勇, 邱 录贵. 中国慢性淋巴细胞白血病诊断与治疗专家共识[J] 中华血液学杂志. 2010;31(2):141–144. doi: 10.3760/cma.j.issn.0253-2727.2010.02.020. [DOI] [Google Scholar]
- 5.Xu W, Li JY, Wu YJ, et al. CD38 as a prognostic factor in Chinese patients with chronic lymphocytic leukaemia[J] Leuk Res. 2009;33(2):237–243. doi: 10.1016/j.leukres.2008.06.026. [DOI] [PubMed] [Google Scholar]
- 6.Xu W, Li JY, Wu YJ, et al. Prognostic significance of ATM and TP53 deletions in Chinese patients with chronic lymphocytic leukemia[J] Leuk Res. 2008;32(7):1071–1077. doi: 10.1016/j.leukres.2007.10.009. [DOI] [PubMed] [Google Scholar]
- 7.Crusio KM, King B, Reavie LB, et al. The ubiquitous nature of cancer: the role of the SCF (Fbw7) complex in development and transformation[J] Oncogene. 2010;29(35):4865–4873. doi: 10.1038/onc.2010.222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ingham RJ, Gish G, Pawson T. The Nedd4 family of E3 ubiquitin ligases: functional diversity within a common modular architecture[J] Oncogene. 2004;23(11):1972–1984. doi: 10.1038/sj.onc.1207436. [DOI] [PubMed] [Google Scholar]
- 9.Zhi X, Chen C. WWP1: a versatile ubiquitin E3 ligase in signaling and diseases[J] Cell Mol Life Sci. 2012;69(9):1425–1434. doi: 10.1007/s00018-011-0871-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhang L, Wu Z, Ma Z, et al. WWP1 as a potential tumor oncogene regulates PTEN-Akt signaling pathway in human gastric carcinoma[J] Tumour Biol. 2015;36(2):787–798. doi: 10.1007/s13277-014-2696-0. [DOI] [PubMed] [Google Scholar]
- 11.Cheng Q, Cao X, Yuan F, et al. Knockdown of WWP1 inhibits growth and induces apoptosis in hepatoma carcinoma cells through the activation of caspase3 and p53[J] Biochem Biophys Res Commun. 2014;448(3):248–254. doi: 10.1016/j.bbrc.2014.04.117. [DOI] [PubMed] [Google Scholar]
- 12.Lin JH, Hsieh SC, Chen JN, et al. WWP1 gene is a potential molecular target of human oral cancer[J] Oral Surg Oral Med Oral Pathol Oral Radiol. 2013;116(2):221–231. doi: 10.1016/j.oooo.2013.05.006. [DOI] [PubMed] [Google Scholar]
- 13.Chen JJ, Zhang W. High expression of WWP1 predicts poor prognosis and associates with tumor progression in human colorectal cancer[J] Am J Cancer Res. 2018;8(2):256–265. [PMC free article] [PubMed] [Google Scholar]
- 14.Li Q, Li Z, Wei S, et al. Overexpression of miR-584-5p inhibits proliferation and induces apoptosis by targeting WW domain-containing E3 ubiquitin protein ligase 1 in gastric cancer[J] J Exp Clin Cancer Res. 2017;36(1):59. doi: 10.1186/s13046-017-0532-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Wang Z, Wang J, Li X, et al. Bortezomib prevents oncogenesis and bone metastasis of prostate cancer by inhibiting WWP1, Smurf1 and Smurf2[J] Int J Oncol. 2014;45(4):1469–1478. doi: 10.3892/ijo.2014.2545. [DOI] [PubMed] [Google Scholar]
- 16.Lee YR, Chen M, Lee JD, et al. Reactivation of PTEN tumor suppressor for cancer treatment through inhibition of a MYCWWP1 inhibitory pathway[J] Science. 2019;364(6441) doi: 10.1126/science.aau0159. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Li Y, Zhou Z, Chen C. WW domain-containing E3 ubiquitin protein ligase 1 targets p63 transcription factor for ubiquitin-mediated proteasomal degradation and regulates apoptosis[J] Cell Death Differ. 2008;15(12):1941–1951. doi: 10.1038/cdd.2008.134. [DOI] [PubMed] [Google Scholar]