Abstract
目的
观察不同剂量的双氢青蒿素(DHA)对C57BL/6小鼠特应性皮炎(AD)的治疗作用及相关机制。
方法
将42只C57BL/6小鼠随机分为7组,每组6只:空白对照组(无处理)、模型对照组(2, 4-二硝基氯苯DNCB)、溶剂对照组(DNCB+溶解剂)、25 mg/kg DHA治疗组(DNCB+25 mg/kg DHA)、75 mg/kg DHA治疗组(DNCB+75 mg/kg DHA)、125 mg/kg DHA治疗组(DNCB+125 mg/kg DHA)和地塞米松治疗组(DNCB+地塞米松)。每天观测各组搔抓次数和皮损程度并进行评分。连续7 d给药后,将各组小鼠背部及耳部皮损涂抹处取材进行HE染色,Masson染色,甲苯胺蓝染色,观察皮肤病理学改变及炎症反应的好转情况。
结果
25、75、125 mg/kg DHA治疗组,地塞米松治疗组均能缓解小鼠症状。小鼠皮损症状减轻,皮损评分降低,组织病理学改善,但125 mg/kg DHA治疗组效果最佳,能明显减少肥大细胞浸润,相对其余各组均具有统计学差异(P < 0.05)。
结论
DHA对小鼠AD有较好的治疗效果,125 mg/kg DHA组治疗效果最佳。推测DHA可能通过抑制肥大细胞浸润,调节局部免疫,改善AD症状。
Keywords: 特应性皮炎; 双氢青蒿素; 肥大细胞; 2, 4-二硝基氯苯
Abstract
Objective
To observe the therapeutic effect of different doses of dihydroartemisinin (DHA) on atopic dermatitis (AD) in mice and explore the mechanism.
Methods
Forty-two C57BL/6 mice were randomly divided into 7 groups (n=6), including a blank control group, a 2, 4-dinitrochlorobenzene (DNCB)-induced AD model group, a solvent-treated group, 3 DHA treatment groups treated with 25, 75, and 125 mg/kg DHA, and a dexamethasone treatment group. The counts of skin scratches were recorded and the lesion scores were evaluated on a daily basis. After 7 consecutive days of treatment, skin tissues were sampled from the lesions on the back and ear of the mice for pathological examination with HE staining, Masson staining and toluidine blue staining.
Results
Treatment with 25, 75, and 125 mg/kg DHA and dexamethasone all alleviated AD symptoms of mice, reduced the severity scores of skin lesions, and ameliorated pathological changes of the skin tissue. DHA at 125 mg/kg produced the most obvious therapeutic effect and significantly alleviated mast cell infiltration in the lesions as compared with the other treatment groups (P < 0.05).
Conclusion
DHA is effective for the treatment of AD in mice with an optimal dose of 125 mg/kg. The therapeutic effect of DHA is achieved probably through regulation of local immunity by inhibiting mast cell infiltration in the lesions.
Keywords: atopic dermatitis; dihydroartemisinin; mast cells; 2, 4-Dinitrochlorobenzene
特应性皮炎(AD)是一种常见的慢性、复发性和瘙痒性皮肤疾病[1]。可能由自身免疫、遗传因素、环境因素、皮肤屏障功能紊乱、细菌感染等致病因素引发[2-4]。主要表现为严重的瘙痒、皮肤破损、干燥脱屑、水肿和红斑等。目前的治疗主要是通过局部用药或者口服给药以减轻炎症和瘙痒等症状。外用糖皮质激素是AD常用的局部治疗方法,但存在可能导致皮肤萎缩、毛细血管扩张、色素沉着和全身吸收等不良反应,使其应用受到限制[5]。随着中药功能的不断发掘,研究可用于局部皮肤的中药药物以减轻AD患者皮肤症状和炎症反应非常必要。
双氢青蒿素是青蒿素的活性衍生物。具有高效的抗疟疾作用且毒性较低[6]。已有的临床和实验研究表明,双氢青蒿素可改善自身免疫性疾病和过敏性疾病的症状[7-9],并且可以通过抑制促炎细胞因子(IL-6、IL-1β、IL-10、TNF-α等)的释放而抑制炎症反应,调节机体免疫[10-12]。已有研究证实[13-14],DHA对小鼠系统性红斑狼疮,多发性硬化及银屑病等免疫相关疾病有一定的治疗作用。在AD的治疗方面,同为青蒿素衍生物的青蒿琥酯,已报道可用于AD的治疗[15],DHA是否也有此作用尚未见报道。在前期预实验中我们发现DHA在一定程度上能减轻皮损的局部症状。因此,本文拟通过建立C57BL/6小鼠特应性皮炎模型,探讨不同DHA给药剂量涂抹的治疗效果,并进一步研究其减轻皮炎过敏性反应,调节局部免疫功能可能的作用机制,为DHA在AD治疗中的应用提供初步的实验依据。
1. 材料和方法
1.1. 材料
1.1.1. 动物
6~8周的C57BL/6小鼠,体质量20 g左右,室内温度在20~25 ℃,相对湿度在40%~70%,标准动物饲料喂养,洁净饮水,自由取食。
1.1.2. 主要试剂
2, 4-二硝基氯苯(Aldrich, DNCB),双氢青蒿素(aladdin),无水乙醇(广东光华科技),橄榄油(上海麦克林生化科技),复方醋酸地塞米松(广州白云山医药),丙酮(广州化学试剂厂),Masson试剂盒(福州迈新生物技术),甲苯胺蓝(上海化学试剂厂),盐酸(广东广试试剂科技有限公司),多聚甲醛(天津市大茂化学试剂厂)。
1.1.3. 主要仪器
-80 ℃冰箱(U570-86),4 ℃冰箱(Sanyo),电子分析天平(梅特勒-托利多),高压灭菌器(Sanyo),正置显微镜(Leica),石蜡切片机(Leica),石蜡包埋机(Leica)。
1.2. 方法
1.2.1. DHA的配制
DHA经助溶剂无水乙醇溶解后, 加入橄榄油(无水乙醇:橄榄油=1:1)配制成DHA混悬剂,4 ℃保存备用[16-17]。DHA治疗组给药剂量分别为25、75和125 mg/kg。
1.2.2. AD模型的建立
参考文献方法[18-20]建立AD小鼠模型:36只C57BL/6小鼠适应性饲养1周,实验前1 d (第0天)小鼠背部脱毛(约2 cm×2 cm),实验第1天将2% DNCB溶液(丙酮:橄榄油=1:4)施用于背部皮肤(150 μL)及右耳(10 μL)进行1次致敏。实验第5,7,9,11,13 d,重复施用0.5% DNCB(丙酮:橄榄油=1:4)于背部皮肤(150 μL)及右耳(10 μL)进行激发,1次/2 d,连续涂抹10 d(造模方法见图 1A~C)。通过皮肤病理表现和皮损评分判定造模效果。
1.
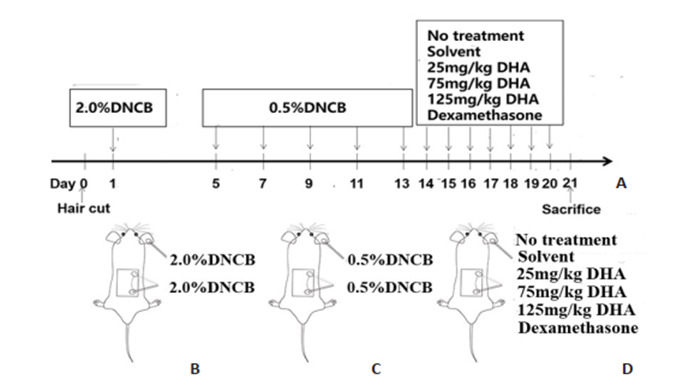
小鼠AD造模及各组处理方法
Atopic dermatitis (AD) modeling and treatments in mice. A: Time points for modeling and DHA treatment; B, C: Topical application of DNCB on dorsal and ear skin for AD modeling; B: 2.0% DNCB sensitization; C: 0.5% DNCB challenge; D: Treatments in each group.
1.2.3. 分组以及处理
DNCB涂抹造模后第14天,将36只C57BL/6小鼠随机分为模型对照组、溶剂对照组、25 mg/kg DHA治疗组、75 mg/kg DHA治疗组、125 mg/kg DHA治疗组和地塞米松治疗组,每组6只(图 1D)。模型对照组小鼠不作处理,溶剂对照组小鼠1次/d涂抹DHA的溶解剂,持续7 d。25 mg/kg DHA治疗组、75 mg/kg DHA治疗组、125 mg/kg DHA治疗组分别于皮损部1次/d涂抹相应给药剂量的DHA,连续涂抹7 d。地塞米松治疗组同样于皮损部1次/d涂抹地塞米松软膏,持续7 d。治疗后,各组小鼠背部及耳部涂抹处取材。空白对照组为正常小鼠脱毛后无DNCB造模和涂抹治疗处理组。
1.3. 观测指标
1.3.1. 皮损严重程度及皮损评分
皮损评分参照欧洲AD研究组(ETFAD)提出的SCORAD评分标准[21]每次处理前观察各组小鼠耳部、背部皮损炎症情况并拍照记录,评分标准如下:0,无; 1,轻度; 2,中度; 3,重度; 4,极重度,对脱屑(干燥)、水肿(丘疹)、红斑(出血)、表皮剥脱(抓痕)进行0~4的评分,绘制小鼠的积分变化趋势图,观察小鼠皮损的变化情况。
1.3.2. 小鼠搔抓次数
每次处理后,将小鼠单独置于安静环境中,统计10 min内小鼠搔抓身体各部位的次数,连续长时间搔抓计为1次。
1.3.3. H & E染色
取材皮损用4%多聚甲醛固定。进行石蜡包埋,切片,苏木精和伊红(H & E)染色。
1.3.4. Masson染色
石蜡切片脱蜡后,采用Masson试剂盒进行染色。二甲苯透明,封片。
1.3.5. 甲苯胺蓝染色
石蜡切片脱蜡至水,使用配置好的甲苯胺蓝染液进行染色。肥大细胞颗粒为蓝紫色。肥大细胞计数方法:染色切片置于200倍光镜下,随机选取5个高倍视野,进行肥大细胞计数,肥大细胞数目以每高倍视野下的平均肥大细胞个数显示。
1.3.6. 统计学分析
采用SPSS 20.0进行统计学分析,计量数据均以均数±标准差表示,多组间比较采用单因素方差分析,两两比较用LSD检验。组内符合正态分布采用配对t检验,不符合采用秩和检验。P < 0.05认为差异具有统计学意义。
2. 结果
2.1. AD造模成功
DNCB造模后,小鼠背部及耳部出现明显脱屑,皮肤破溃出血,黄色结痂,红斑,水肿,表皮剥脱。与空白对照组相比,皮损评分增高,搔抓次数增多,正在脱颗粒和已经脱颗粒的肥大细胞数量明显增多,差异有统计学意义(P < 0.01,图 2)。
2.
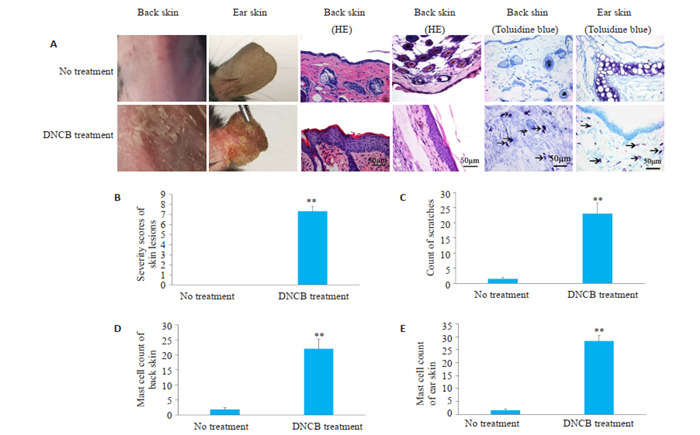
DNCB诱导小鼠AD模型
Topical application of DNCB induces AD in mice. A: Morphological change after DNCB treatment; B: Severity scores of skin lesions; C: Count of scratches; D: Mast cell counts in the dorsal skin lesions; E: Mast cell counts in ear skin lesions. **P < 0.01 vs blank control (no treatment) group.
2.2. 各组皮损表现及皮损评分
治疗后,皮损评分逐渐降低且具有剂量依赖性。125 mg/kg DHA治疗组较其余各组皮损恢复明显,差异具有统计学意义(P < 0.05,表 1)。
1.
给药前后皮损严重程度评分比较
Comparison of severity scores of skin lesions before and after treatments (Mean±SD)
| Group | Severity scores of skin lesions | |
| Before administration | After administration | |
| *P < 0.05 vs normal control group; #P < 0.05 vs model control group; !P < 0.05 vs solvent control group; ▲P < 0.05 vs 75 mg/kg DHA treatment group; ■P < 0.05 vs dexamethasone treatment group. | ||
| Normal control | 0 | 0 |
| Model control | 7.33±0.58* | 3.67±0.58* |
| Solvent control | 7.00±1.00* | 3.67±0.58* |
| 25 mg/kg DHA | 7.00±1.00* | 3.33±0.58* |
| 75 mg/kg DHA | 7.33±0.58* | 2.67±0.58*#! |
| 125 mg/kg DHA | 7.67±1.52* | 1.67±0.58*#!■▲ |
| Dexamethasone | 7.00±1.00* | 2.67±0.58*#! |
治疗后,模型对照组与溶剂对照组小鼠背部干燥,有黄色结痂,白色脱屑。DHA治疗组和地塞米松治疗组小鼠皮损有明显消退迹象,随着DHA剂量升高,小鼠皮炎改善更为明显。125 mg/kg DHA组小鼠背部,耳部基本恢复正常。地塞米松治疗组小鼠背部依然存在脱屑,耳部基本恢复正常(图 3)。
3.
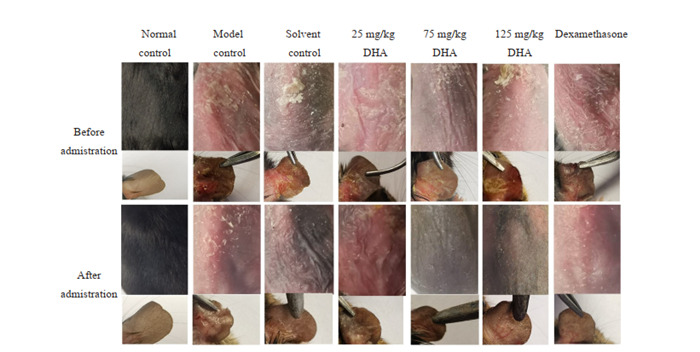
背部和耳部皮损表现
Lesions in dorsal and ear skin.
2.3. 各组小鼠搔抓次数比较
随着DHA给药剂量升高,DHA治疗组搔抓次数逐渐降低。125 mg/kg DHA治疗组搔抓次数最少,且与75 mg/kg DHA治疗组,地塞米松治疗组相比统计学差异显著(P < 0.05,表 2)。
2.
搔抓次数计数
Count of scratches of the mice before and after treatments
| Group | Count of scratches | |
| Before administration | After administration | |
| *P < 0.05 vs normal control group; #P < 0.05 vs model control group; !P < 0.05 vs solvent control group; △P < 0.05 vs 25 mg/kg DHA treatment group; ▲P < 0.05 vs 75 mg/kg DHA treatment group; ■P < 0.05 vs dexamethasone treatment group. | ||
| Normal control | 1.33±0.58 | 1.67±0.58 |
| Model control | 19.67±3.06* | 8.00±1.00* |
| Solvent control | 21.67±2.52* | 7.00±1.00* |
| 25 mg/kg DHA | 23.33±3.06* | 6.33±1.53* |
| 75 mg/kg DHA | 21.67±1.53* | 3.00±1.00#!△ |
| 125 mg/kg DHA | 24.33±4.04* | 0.67±0.58#!△▲■ |
| Dexamethasone | 23.33±2.06* | 4.33±0.58#!△ |
2.4. 各组皮损组织病理变化
模型对照组和溶剂对照组与空白对照组相比皮肤表皮增厚,过度角化,棘层肥厚,真皮炎性细胞浸润。治疗组与模型对照组相比,表皮增厚都有所减轻。且随着DHA给药剂量的升高,表皮和棘层增厚减轻,真皮炎性细胞浸润减少,125 mg/kg DHA治疗组改善最为明显(图 4)。
4.
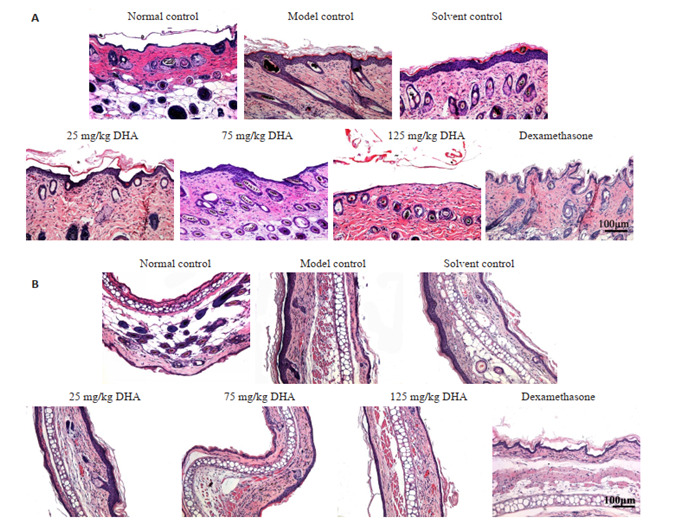
H & E染色检测小鼠病理损伤
Pathological examination of the lesions in the dorsal (A) and ear (B) skin with HE staining (Original magnification: ×100).
2.5. 各组Masson染色检测真皮组织胶原的生成与排布
空白对照组胶原纤维排列规则。DHA治疗组和地塞米松治疗组与模型对照组小鼠胶原纤维相比含量增多,排列更为规则,且随着给药剂量的升高,胶原蛋白合成更多,更规则。25 mg/kg DHA治疗组胶原纤维疏密不均,排列不一。75 mg/kg DHA治疗组胶原纤维增多,排列较为紊乱。125 mg/kg DHA治疗组胶原纤维明显增多,染色深,排列规则(图 5)。
5.
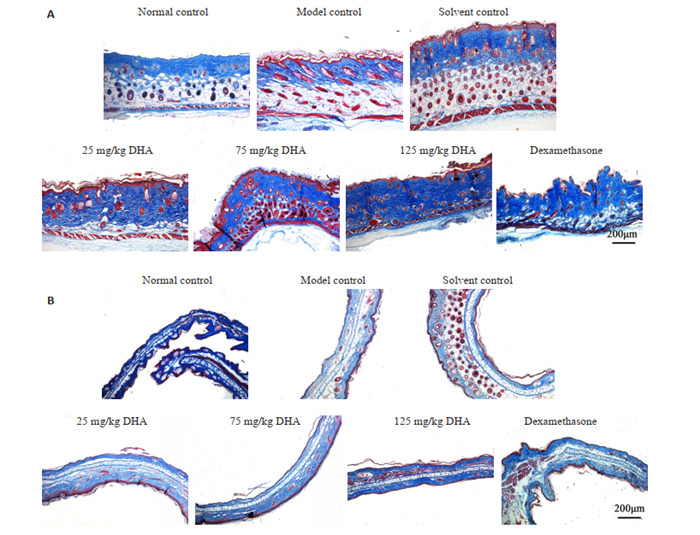
小鼠背部和耳部皮肤Masson染色
Masson staining of the lesions in the dorsal (A) and ear (B) skin (×50).
2.6. 各组肥大细胞分析
溶剂对照组与模型对照组中的肥大细胞数量明显增多,与空白对照组相比差异显著(P < 0.05)。DHA治疗后肥大细胞水平低于治疗前,且差异显著(P < 0.05)。并且随着DHA给药剂量升高,肥大细胞数量降低。75 mg/kg DHA治疗组、125 mg/kg DHA治疗组、地塞米松治疗组与模型对照组差异具有统计学意义(P < 0.05)。125 mg/kg DHA治疗组肥大细胞数目最少与其他各组相比均具有统计学意义(P < 0.05)(图 6~9)。
6.
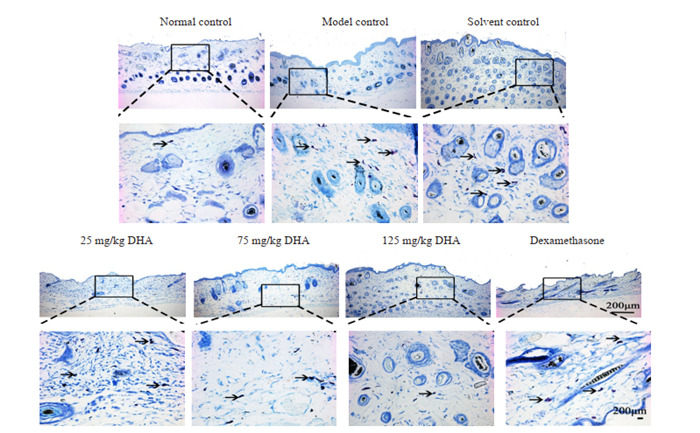
背部皮肤甲苯胺蓝染色
Toluidine blue staining of the lesions in the dorsal skin (upper panel: ×50; lower panel: ×200).
9.
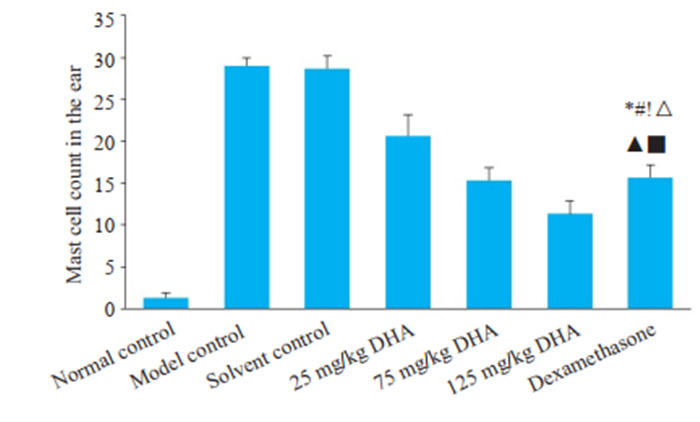
耳部肥大细胞计数
Mast cell count in the ear skin lesions. *P < 0.05 vs normal control group; #P < 0.05 vs model control group; !P < 0.05 vs solvent control group; △P < 0.05 vs 25 mg/kg DHA treatment group; ▲P < 0.05 vs 75 mg/kg DHA treatment group; ■P < 0.05 vs dexamethasone treatment group.
7.
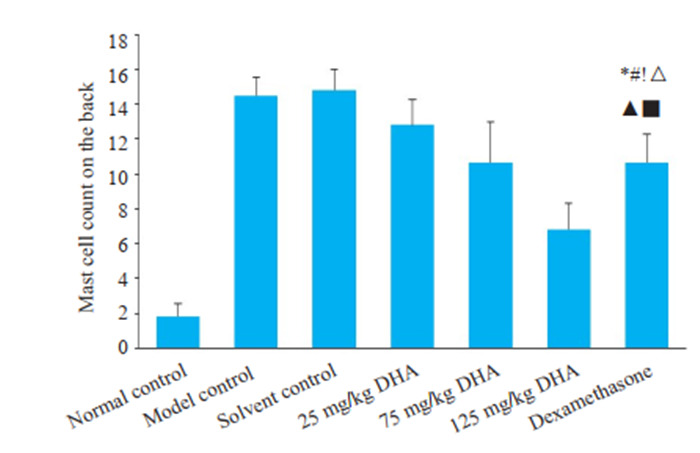
背部皮肤肥大细胞计数
Mast cell count in dorsal skin lesions. *P < 0.05 vs normal control group; #P < 0.05 vs model control group; !P < 0.05 vs solvent control group; △P < 0.05 vs 25 mg/kg DHA treatment group; ▲P < 0.05 vs 75 mg/kg DHA treatment group; ■P < 0.05 vs dexamethasone treatment group.
8.
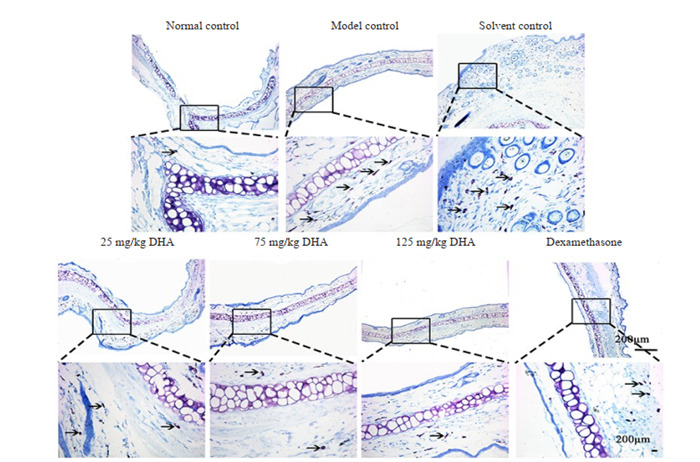
耳部甲苯胺蓝染色
Toluidine blue staining of the ear skin lesions (upper panel: ×50; lower panel: ×200).
3. 讨论
重复施用DNCB诱导制备AD小鼠模型是一种简单且可靠的AD造模方法[22]。通过DNCB背部及耳部皮肤涂抹后皮肤出现黄色结痂,表皮白色脱屑,水肿和红斑等表现。HE染色出现角化过度,表皮增厚,棘层肥厚, 真皮炎性细胞浸润等皮炎病理表现,提示AD模型制备成功。
在AD的治疗方面,已有文献报道,采用125、25、5 mg/kg 3个剂量的DHA灌胃给药能抑制小鼠血清中的炎性因子TNF-α的分泌,明显降低血清中抗ds-DNA抗体水平,对免疫性疾病系统性红斑狼疮有一定的治疗作用[23]。25 mg/kg、50 mg/kg剂量的DHA灌胃给药可以明显抑制HaCaT细胞所分泌的IL-17A和IL-23等细胞因子,缓解小鼠的银屑病样皮肤炎症反应[24]。本实验使用25、75、125、150、175、200 mg/kg剂量的DHA进行了前期预实验,发现适当剂量DHA涂抹在一定程度上能减轻皮损的局部症状,于是最终选用了25、75、125 mg/kg剂量的DHA进行AD的治疗实验。
受损部位皮损评分能反映造模后皮肤损伤程度和治疗后皮损的愈合程度。DNCB皮肤涂抹造模后,各组皮损评分结果说明造模导致了严重的皮损和明显的炎症反应(包括4个症状,即红斑/出血,水肿,剥脱/糜烂,干燥)。不同给药剂量DHA皮肤涂抹治疗后,各组皮损都有所减轻,炎症反应下降。模型对照组与溶剂对照组小鼠存在皮损和明显的炎症反应,即剥脱,干燥,结痂,脱屑。与模型对照组小鼠相比,DHA治疗组小鼠背部受损皮肤评分显著降低。随着DHA给药剂量升高,小鼠皮损症状改善明显。125 mg/kg DHA组小鼠背部和耳部基本恢复正常。地塞米松治疗组小鼠背部依然存在脱屑,耳部肿胀减轻。以上结果提示,DHA涂抹治疗可以改善AD小鼠的皮肤的皮损状况,且高给药剂量组(125 mg/kg DHA治疗组)最为明显。
皮肤瘙痒是AD的主要症状之一,其在一定程度上反映了AD的严重程度[25]。动物实验中,一定时间内小鼠的搔抓次数可代表其瘙痒程度,通常情况下搔抓次数与瘙痒程度成正相关[25]。通过对治疗后各组小鼠搔抓次数比较发现,溶剂对照组与模型对照组无统计学差异。125 mg/kg DHA治疗组搔抓次数明显减少与其余各组相比均有统计学意义。以上结果提示,DHA涂抹治疗能缓解小鼠的瘙痒症状,稳定小鼠的行为,尤其是125 mg/kg DHA治疗组最明显。
皮肤病理结果显示,模型对照组小鼠表皮细胞增殖、真皮层血管扩张和炎性细胞浸润。治疗组与模型对照组相比,表皮增厚减轻,棘层变薄,红细胞浸润减少,真皮炎性细胞浸润减少。125 mg/kg DHA治疗组改善最明显。胶原纤维是细胞外基质的主要成分,主要由肌纤维母细胞和成纤维细胞合成[26]。新生胶原可以促进组织修复,其整齐排布是修复后组织重构的标志[26]。病理组织Masson染色提示,DHA治疗组和地塞米松治疗组小鼠胶原蛋白含量增多,排列较对照组规则,尤其是125 mg/kg DHA治疗后胶原蛋白合成增多,排列更规则。以上结果提示,DHA皮肤涂抹能促进组织修复。
真皮组织中肥大细胞的积聚是AD的重要组织病理学特征。肥大细胞通过产生和分泌促炎介质如组胺,趋化因子,细胞因子和生长因子等,在IgE介导的超敏反应中作为效应细胞发挥关键作用[27]。IgE与肥大细胞表面的受体结合,导致促炎介质的脱颗粒和表达,随后引发皮肤损伤。DHA是青蒿琥酯主要的活性代谢产物[28]。已有研究表明,青蒿琥酯能通过阻断IgE诱导的肥大细胞脱粒而发挥抗过敏活性[29]。本研究表明,模型对照组与溶剂对照组中的肥大细胞数量明显增多。DHA和地塞米松治疗后肥大细胞数量明显低于其他对照组,尤其是125 mg/kg DHA治疗组降低最明显(差异具有统计学意义)。可见皮肤涂抹DHA后,可能通过减少肥大细胞渗出,促进皮损愈合。
综上所述,皮肤涂抹DHA对DNCB诱导的AD小鼠模型有一定治疗作用。小鼠的皮损评分、搔抓行为、组织病理变化、肥大细胞浸润、均有明显改善,且125 mg/kg DHA治疗组对AD小鼠的治疗效果优于临床常用药物地塞米松。其可能是通过抑制肥大细胞浸润,调节病变部位免疫功能,改善AD症状。
Biography
薛雪,在读硕士研究生,E-mail: xuexuexx1017@163.com
Funding Statement
广东省自然科学基金(2016A030310381,2018A030313468);广东省科技计划项目(2017A0202151888)
Contributor Information
薛 雪 (Xue XUE), Email: xuexuexx1017@163.com.
陈 英华 (Yinghua CHEN), Email: mrchch@126.com.
References
- 1.De Benedetto A, Agnihothri R, Mcgirt LY, et al. Atopic dermatitis: a disease caused by innate immune defects? J Invest Dermatol. 2009;129(1):14–30. doi: 10.1038/jid.2008.259. [De Benedetto A, Agnihothri R, Mcgirt LY, et al. Atopic dermatitis: a disease caused by innate immune defects[J]? J Invest Dermatol, 2009, 129(1): 14-30.] [DOI] [PubMed] [Google Scholar]
- 2.Kantor R, Silverberg JI. Environmental risk factors and their role in the management of atopic dermatitis. Expert Rev Clin Immunol. 2017;13(1):15–26. doi: 10.1080/1744666X.2016.1212660. [Kantor R, Silverberg JI. Environmental risk factors and their role in the management of atopic dermatitis[J]. Expert Rev Clin Immunol, 2017, 13(1): 15-26.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.McPherson T. Current understanding in pathogenesis of atopic dermatitis. Indian J Dermatol. 2016;61(6):649–55. doi: 10.4103/0019-5154.193674. [McPherson T. Current understanding in pathogenesis of atopic dermatitis[J]. Indian J Dermatol, 2016, 61(6): 649-55.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.罗 金成, 宋 志强. 特应性皮炎的发病机制. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhlcmyhbtfyzz201704012. 中华临床免疫和变态反应杂志. 2017;11(4):375–81. [罗金成, 宋志强.特应性皮炎的发病机制[J].中华临床免疫和变态反应杂志, 2017, 11(4): 375-81.] [Google Scholar]
- 5.Schoepe S, Schäcke H, May E, et al. Glucocorticoid therapy-induced skin atrophy. Exp Dermatol. 2006;15(6):406–20. doi: 10.1111/j.0906-6705.2006.00435.x. [Schoepe S, Schäcke H, May E, et al. Glucocorticoid therapy-induced skin atrophy[J]. Exp Dermatol, 2006, 15(6): 406-20.] [DOI] [PubMed] [Google Scholar]
- 6.付 岩松, 李 春宇, 钟 越, et al. 双氢青蒿素的研究进展. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=0120181105415221. 吉林医药学院学报. 2018;39(4):292–4. [付岩松, 李春宇, 钟越, 等.双氢青蒿素的研究进展[J].吉林医药学院学报, 2018, 39(4): 292-4.] [Google Scholar]
- 7.Yao WB, Wang F, Wang H. Immunomodulation of artemisinin and its derivatives. Sci Bull. 2016;61(18):1399–406. doi: 10.1007/s11434-016-1105-z. doi: 10.1007/s11434-016-1105-z. [Yao WB, Wang F, Wang H. Immunomodulation of artemisinin and its derivatives[J]. Sci Bull, 2016, 61(18): 1399-406.] [DOI] [Google Scholar]
- 8.Yan SC, Li YJ, Wang YJ, et al. Research progress of effect of artemisinin family drugs on T lymphocytes immunomodulation. China J Chin Mater Med. 2019;44(22):4992–9. doi: 10.19540/j.cnki.cjcmm.20190618.401. [Yan SC, Li YJ, Wang YJ, et al. Research progress of effect of artemisinin family drugs on T lymphocytes immunomodulation[J]. China J Chin Mater Med, 2019, 44(22): 4992-9.] [DOI] [PubMed] [Google Scholar]
- 9.Zhao Y, Wang YQ, Guo ZL, et al. Dihydroartemisinin ameliorates inflammatory disease by its reciprocal effects on Th and regulatory T cell function via modulating the mammalian target of rapamycin pathway. J Immunol. 2012;189(9):4417–25. doi: 10.4049/jimmunol.1200919. [Zhao Y, Wang YQ, Guo ZL, et al. Dihydroartemisinin ameliorates inflammatory disease by its reciprocal effects on Th and regulatory T cell function via modulating the mammalian target of rapamycin pathway[J]. J Immunol, 2012, 189(9): 4417-25.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Shakir L, Hussain M, Javeed A, et al. Artemisinins and immune system. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=811434d91ef56af759fa913a2c7ce02a. Eur J Pharmacol. 2011;668(1/2):6–14. doi: 10.1016/j.ejphar.2011.06.044. [Shakir L, Hussain M, Javeed A, et al. Artemisinins and immune system[J]. Eur J Pharmacol, 2011, 668(1/2): 6-14.] [DOI] [PubMed] [Google Scholar]
- 11.Zhang T, Zhang YW, Jiang N, et al. Dihydroartemisinin regulates the immune system by promotion of CD8 + T lymphocytes and suppression of B cell responses. Sci China Life Sci. 2020;63(5):737–49. doi: 10.1007/s11427-019-9550-4. [Zhang T, Zhang YW, Jiang N, et al. Dihydroartemisinin regulates the immune system by promotion of CD8 + T lymphocytes and suppression of B cell responses[J]. Sci China Life Sci, 2020, 63(5): 737-49.] [DOI] [PubMed] [Google Scholar]
- 12.Zhang ZL, Guo M, Zhao SF, et al. ROS-JNK1/2-dependent activation of autophagy is required for the induction of anti-inflammatory effect of dihydroartemisinin in liver fibrosis. Free Radic Biol Med. 2016;101:272–83. doi: 10.1016/j.freeradbiomed.2016.10.498. [Zhang ZL, Guo M, Zhao SF, et al. ROS-JNK1/2-dependent activation of autophagy is required for the induction of anti-inflammatory effect of dihydroartemisinin in liver fibrosis[J]. Free Radic Biol Med, 2016, 101: 272-83.] [DOI] [PubMed] [Google Scholar]
- 13.Huang X, Xie Z, Liu F, et al. Dihydroartemisinin inhibits activation of the Toll-like receptor 4 signaling pathway and production of type I interferon in spleen cells from lupus-prone MRL/lpr mice. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=42793742ec5d978d4b391ad87f92e44f. Inter Immunopharmacol. 2014;22(1):266–72. doi: 10.1016/j.intimp.2014.07.001. [Huang X, Xie Z, Liu F, et al. Dihydroartemisinin inhibits activation of the Toll-like receptor 4 signaling pathway and production of type I interferon in spleen cells from lupus-prone MRL/lpr mice[J]. Inter Immunopharmacol, 2014, 22(1): 266-72.] [DOI] [PubMed] [Google Scholar]
- 14.Shen M, Ge HL, He YX, et al. Immunosuppressive action of Qinghaosu. Sci Sin B. 1984;27(4):398–406. [Shen M, Ge HL, He YX, et al. Immunosuppressive action of Qinghaosu[J]. Sci Sin B, 1984, 27(4): 398-406.] [PubMed] [Google Scholar]
- 15.Bai XY, Liu P, Chai YW, et al. Artesunate attenuates 2, 4-dinitrochlorobenzene-induced atopic dermatitis by down-regulating Th17 cell responses in BALB/c mice. Eur J Pharmacol. 2020;874:173020. doi: 10.1016/j.ejphar.2020.173020. [Bai XY, Liu P, Chai YW, et al. Artesunate attenuates 2, 4-dinitrochlorobenzene-induced atopic dermatitis by down-regulating Th17 cell responses in BALB/c mice[J]. Eur J Pharmacol, 2020, 874: 173020.] [DOI] [PubMed] [Google Scholar]
- 16.张 婷, 赵 旭, 桑 晓宇, et al. 青蒿素及其衍生物抗寄生虫药理作用研究进展. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=dwyxjz201710018. 动物医学进展. 2017;38(10):98–102. [张婷, 赵旭, 桑晓宇, 等.青蒿素及其衍生物抗寄生虫药理作用研究进展[J].动物医学进展, 2017, 38(10): 98-102.] [Google Scholar]
- 17.杜 丰, 王 乃婕, 邱 琳, et al. 双氢青蒿素经皮给药体外透皮试验方法学研究. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=jfjyxxb200805009. 解放军药学学报. 2008;24(5):405–7. [杜丰, 王乃婕, 邱琳, 等.双氢青蒿素经皮给药体外透皮试验方法学研究[J].解放军药学学报, 2008, 24(5): 405-7.] [Google Scholar]
- 18.Lin L, Xie MY, Chen X, et al. Toll-like receptor 4 attenuates a murine model of atopic dermatitis through inhibition of langerin-positive DCs migration. Exp Dermatol. 2018;27(9):1015–22. doi: 10.1111/exd.13698. [Lin L, Xie MY, Chen X, et al. Toll-like receptor 4 attenuates a murine model of atopic dermatitis through inhibition of langerin-positive DCs migration[J]. Exp Dermatol, 2018, 27(9): 1015-22.] [DOI] [PubMed] [Google Scholar]
- 19.Lin L, Zhou YW, Li HF, et al. Polysaccharide extracted from Chinese white wax scale ameliorates 2, 4-dinitrochlorobenzene-induced atopic dermatitis-like symptoms in BALB/c mice. Saudi Pharm J. 2017;25(4):625–32. doi: 10.1016/j.jsps.2017.04.035. [Lin L, Zhou YW, Li HF, et al. Polysaccharide extracted from Chinese white wax scale ameliorates 2, 4-dinitrochlorobenzene-induced atopic dermatitis-like symptoms in BALB/c mice[J]. Saudi Pharm J, 2017, 25(4): 625-32.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.孙 博强, 康 巧珍, 潘 周浩, et al. DNCB诱导昆明小鼠特应性皮炎模型的建立. 生物技术世界. 2016;13(5):12–3. [孙博强, 康巧珍, 潘周浩, 等. DNCB诱导昆明小鼠特应性皮炎模型的建立[J].生物技术世界, 2016, 13(5): 12-3.] [Google Scholar]
- 21.Severity scoring of atopic dermatitis: the SCORAD index Consensus report of the european task force on atopic dermatitis. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=091147283060abe624057cdabf9d21e8. Dermatology (Basel) 1993;186(1):23–31. doi: 10.1159/000247298. [Severity scoring of atopic dermatitis: the SCORAD index. Consensus report of the european task force on atopic dermatitis[J]. Dermatology (Basel), 1993, 186(1): 23-31.] [DOI] [PubMed] [Google Scholar]
- 22.陈超. TRPA1在DNCB诱导的小鼠特应性皮炎模型中的作用及机制研究[D].重庆医科大学, 2019.
- 23.董 妍君, 李 卫东, 屠 呦呦, et al. 双氢青蒿素对BXSB狼疮小鼠自身抗体产生、TNFα分泌及狼疮性肾炎病理改变的影响. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zxyjh200309010. 中国中西医结合杂志. 2003;9:676–9. [董妍君, 李卫东, 屠呦呦, 等.双氢青蒿素对BXSB狼疮小鼠自身抗体产生、TNFα分泌及狼疮性肾炎病理改变的影响[J].中国中西医结合杂志, 2003, 9: 676-9.] [Google Scholar]
- 24.魏 强, 金 权鑫, 金 琳博, et al. 双氢青蒿素通过抑制角质形成细胞的增殖和促炎因子的产生改善小鼠银屑病样皮肤炎症. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgmyxzz202005006. 中国免疫学杂志. 2020;36(5):543–8. [魏强, 金权鑫, 金琳博, 等.双氢青蒿素通过抑制角质形成细胞的增殖和促炎因子的产生改善小鼠银屑病样皮肤炎症[J].中国免疫学杂志, 2020, 36(5): 543-8.] [Google Scholar]
- 25.顾 恒. 他克莫司软膏治疗特应性皮炎的共识. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=gwyx-pfxbx200606027. 国际皮肤性病学杂志. 2006;32(6):403–4. [顾恒.他克莫司软膏治疗特应性皮炎的共识[J].国际皮肤性病学杂志, 2006, 32(6): 403-4.] [Google Scholar]
- 26.Tomasek JJ, Haaksma CJ, Eddy RJ, et al. Fibroblast contraction occurs on release of tension in attached collagen lattices: dependency on an organized actin cytoskeleton and serum. Anat Rec. 1992;232(3):359–68. doi: 10.1002/ar.1092320305. [Tomasek JJ, Haaksma CJ, Eddy RJ, et al. Fibroblast contraction occurs on release of tension in attached collagen lattices: dependency on an organized actin cytoskeleton and serum[J]. Anat Rec, 1992, 232(3): 359-68.] [DOI] [PubMed] [Google Scholar]
- 27.高 强, 李 辉, 刘 勇庆, et al. 免疫细胞在特应性皮炎中作用研究进展. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=wjyxyxb201410026. 武警后勤学院学报:医学版. 2014;23(10):871–4. [高强, 李辉, 刘勇庆, 等.免疫细胞在特应性皮炎中作用研究进展[J].武警后勤学院学报:医学版, 2014, 23(10): 871-4.] [Google Scholar]
- 28.薛 明, 夏 文江, 霍 继曾, et al. 青蒿琥酯活性代谢产物双氢青蒿素的牛体代谢动力学. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhonggsyzz200407001. 中国兽药杂志. 2004;38(7):1–3. [薛明, 夏文江, 霍继曾, 等.青蒿琥酯活性代谢产物双氢青蒿素的牛体代谢动力学[J].中国兽药杂志, 2004, 38(7): 1-3.] [Google Scholar]
- 29.Cheng C, Ng DS, Chan TK, et al. Anti-allergic action of anti-malarial drug artesunate in experimental mast cell-mediated anaphylactic models. Allergy. 2013;68(2):195–203. doi: 10.1111/all.12077. [Cheng C, Ng DS, Chan TK, et al. Anti-allergic action of anti-malarial drug artesunate in experimental mast cell-mediated anaphylactic models[J]. Allergy, 2013, 68(2): 195-203.] [DOI] [PubMed] [Google Scholar]


