Abstract
Hintergrund
Die COVID-19-Erkrankung (Coronavirus Disease 2019) ist in ihrer klinischen Manifestation unspezifisch und sehr variabel, wodurch die Diskriminationsfähigkeit zu anderen (Virus‑)Infekten erschwert ist. Weder Einzelbefunde noch Befundkombinationen sind spezifisch genug, um eine COVID-19-Erkrankung mit hoher Sicherheit diagnostizieren zu können. Ziel war es, in der Notaufnahme durch Anwendung eines Scores frühzeitig Patienten identifizieren zu können, die ein Risiko für eine COVID-19-Erkrankung haben und somit präemptiv isoliert werden müssen.
Methode
Entwicklung und Implementierung eines symptombasierten COVID-19-Scores anhand einer multizentrischen retrospektiven Diagnostikstudie in 3 deutschen Notaufnahmen vom 09.03. bis 30.04.2020 an Patienten mit Verdacht auf COVID-19 und anschließender SARS-CoV-2-PCR-Diagnostik.
Ergebnisse
Das Studienkollektiv umfasste 697 Patienten, bei 9,4 % dieser Patienten wurde eine COVID-19-Infektion diagnostiziert. Ein COVID-19-Score ≥5 Punkte ging mit einer deutlich erhöhten Erkrankungswahrscheinlichkeit einher. Die Sensitivität des Scores lag bei 98,4 % bei einer allerdings mäßigen Spezifität von 48,3 %.
Schlussfolgerung
Der während der Ersteinschätzung einfach zu erhebende Score unterstützt im Rahmen der Risikostratifizierung die Beurteilung der Vortestwahrscheinlichkeit für eine COVID-19-Infektion und kann frühzeitig den Behandlungspfad bezüglich präemptiver Isolation, PCR-Testung und weiterer Behandlungsoptionen beeinflussen. Aufgrund der unspezifischen Symptomatik der Erkrankung muss allerdings in Kauf genommen werden, dass für das Ziel einer hohen Sensitivität eine relativ geringe Spezifität des Scores resultiert.
Schlüsselwörter: COVID-19, Score, SARS-CoV‑2, Notfallmedizin, Notaufnahme
Abstract
Background
The clinical manifestation of COVID-19 is nonspecific and varies greatly, which makes it more difficult to discriminate from other (virus) infections. Neither individual findings nor combinations of findings are specific enough to be able to diagnose COVID-19 with a high degree of certainty. The goal was to identify patients in the emergency department, who are at risk for COVID-19 disease, early by using a score, so that they could be isolated pre-emptively.
Method
Development and implementation of a symptom-based COVID-19 score based on a multicentric retrospective evaluation in three German emergency departments from 9 March until 30 April 2020 of patients suspected of having COVID-19 and subsequent SARS-CoV‑2 PCR testing.
Results
The study population included 697 patients and 9.4% of these patients were diagnosed with COVID-19 infection. A COVID-19 score of ≥5 points was associated with a significantly increased likelihood of illness. The sensitivity of the score was 98.4% with a moderate specificity of 48.3%.
Discussion
The score, which is easy to obtain during the initial assessment, supports the assessment of the pretest probability for a COVID-19 infection as part of the risk stratification and can influence the treatment pathway in terms of pre-emptive isolation, PCR testing and other treatment options at an early stage.
Due to the nonspecific symptoms of the disease; however, it must be accepted that the goal of high sensitivity results in a relatively low specificity of the score.
Keywords: COVID-19, Score, SARS-CoV‑2, Emergency medicine, Emergency department
Die akute infektiöse Lungenerkrankung COVID-19 (Coronavirus Disease 2019) war im Dezember 2019 erstmalig in Wuhan/China, ausgelöst durch den Coronavirussubtyp SARS-CoV‑2 (Severe Acute Respiratory Syndrome Corona-Virus-2), nachgewiesen worden. Die dadurch verursachte Pandemie stellt eine globale Herausforderung für die Gesundheitssysteme der betroffenen Länder dar.
Insbesondere Patienten mit relevanten Vorerkrankungen, die ein erhöhtes Risiko für einen schweren Verlauf haben, stellen sich in den deutschen Notaufnahmen vor. Aufgrund des oft unspezifischen Krankheitsbilds ist es nicht immer einfach zu entscheiden, welche Patienten primär schon isoliert und im Weiteren auch einer SARS-CoV-2-Testung zugeführt werden sollten – insbesondere, da während des Studienzeitraums Testkapazitäten nicht uneingeschränkt zur Verfügung standen. In diesem Beitrag wird ein neu entwickelter Score vorgestellt, der die Risikostratifizierung erleichtern soll.
Einleitung
Die COVID-19-Erkrankung kann asymptomatisch bis letal verlaufen. Ein klinischer Verdacht auf eine COVID-19-Erkrankung besteht aufgrund von Anamnese, Symptomen oder Befunden, wenn gleichzeitig eine Diagnose für eine andere Erkrankung fehlt, die das Krankheitsbild ausreichend erklärt [10]. Ab dem 50. bis 60. Lebensjahr steigt das Risiko für eine schwere Erkrankung stetig an, verschiedene chronische Erkrankungen begünstigen aber auch bei jüngeren Patienten einen schweren Verlauf [12]. Zum Zeitpunkt des Studienabschlusses (Ende April) gab es in Deutschland schon über 160.000 Infizierte (von denen über 120.000 schon wieder genesen waren) und mehr als 6500 Todesfälle [11].
Bisher schon veröffentlichte Flussschemata können die Entscheidungsfindung unterstützen, erfordern aber meist eine zeitaufwändige apparative Diagnostik [6, 13]. Die Entscheidung für oder gegen eine Isolation muss aber frühzeitiger erfolgen, denn es besteht die Forderung, dass die Behandlungsprozesse für (potenziell) Infizierte getrennt von den anderen Patienten erfolgen müssen.
Hilfreich wäre deshalb ein einfach anwendbarer Risikoscore, der mit hoher Zuverlässigkeit alle Patienten, die eine COVID-19-Erkrankung haben, ohne apparativen Aufwand erkennt.
Ziele der vorliegenden Studie waren:
die Entwicklung eines Scores zum strukturierten Screening von Notaufnahmepatienten im Rahmen der Ersteinschätzung bezüglich des Risikos für eine COVID-19-Erkrankung;
die digitale Umsetzung des Risikoscores in der Notaufnahmesoftware.
Methoden
Die vorliegende retrospektive Diagnostikstudie nutzte die Intention des vom Innovationsfonds geförderten Projekts Erkennung und Steuerung epidemischer Gefahrenlagen (ESEG), durch Zusammenführung von Routinedaten aus Notaufnahmen eine infektiologische Surveillance zu implementieren und damit ein vermehrtes Auftreten von Infektionserkrankungen frühzeitig zu erkennen [2].
Während des Studienzeitraums vom 09.03. bis 30.04.2020 erfolgte die Datenerfassung an 3 Klinikstandorten:
Caritas-Krankenhaus St. Josef Regensburg (300 Betten, ca. 33.000 Notaufnahmekontakte/Jahr);
Krankenhaus der Barmherzigen Brüder Trier (684 Betten, ca. 33.000 Notaufnahmekontakte/Jahr);
Sana Klinikum Offenbach (926 Betten, ca. 60.000 Notaufnahmekontakte/Jahr).
Gemäß den publizierten Symptomhäufigkeiten von an COVID-19 erkrankten Patienten wurde im Expertenkonsens ein Score mit unterschiedlicher Gewichtung entwickelt, der sich auf die vorbeschriebene Häufigkeit von Erkrankungssymptomen stützt (Tab. 1).
| COVID-19-Symptome | WHO [7] 20.02.2020 55.924 Fälle (%) |
ECDC [1] 21.04.2020 100.233 Fälle (%) |
RKI [8] 08.05.2020 134.728 Fälle (%) |
|---|---|---|---|
| Atembeschwerden/Atemnot/Kurzatmigkeit | 18,6 | 47 | – |
| Fieber >37,3 °C | 87,9 | 48,7 | 41 |
| Schüttelfrost | 11,4 | – | |
| (Reiz‑)Husten mit/ohne Auswurf | 67,7 | 24 | 50 |
| Halsschmerzen | 13,9 | 11,8 | – |
| Beeinträchtigung des Geruchs- oder Geschmackssinns | – | – | 16 |
| Abgeschlagenheit (Unwohlsein, Ermüdung) | 38,1 | 8,4 | – |
| Kopfschmerzen | 13,6 | – | – |
| (Glieder‑)Schmerzen | 14,8 | 6,9 | – |
| Schnupfen | 4,8 | 3,6 | 21 |
| Übelkeit/Erbrechen | 5,0 | – | – |
| Durchfall | 3,7 | 1,7 | – |
COVID-19 Coronavirus Disease 2019, WHO World Health Organization, RKI Robert Koch-Institut, ECDC European Centre for Disease Prevention and Control
Als Kriterium für Fieber wurde ein Schwellenwert von 37,3 °C festgelegt, wie in einer großen Studie aus China empfohlen wurde [14]. Die Geruchs- oder Geschmacksstörung wurde erstmals als Symptom in einer italienischen Studie erwähnt [3]. Einige Symptome wurden aus Praktikabilitätsgründen zu einem gemeinsamen Kriterium zusammengefasst. Aus epidemiologischen Erwägungen und einhergehend mit den Empfehlungen des Robert Koch-Instituts wurde das Kriterium „Kontakt mit bestätigtem COVID-19-Fall in den letzten 14 Tagen“ ergänzt [9].
Aus dem beschriebenen Vorgehen resultierte der 11 Kriterien (Punktsumme: 0–24) umfassende COVID-19-Score (Abb. 1).
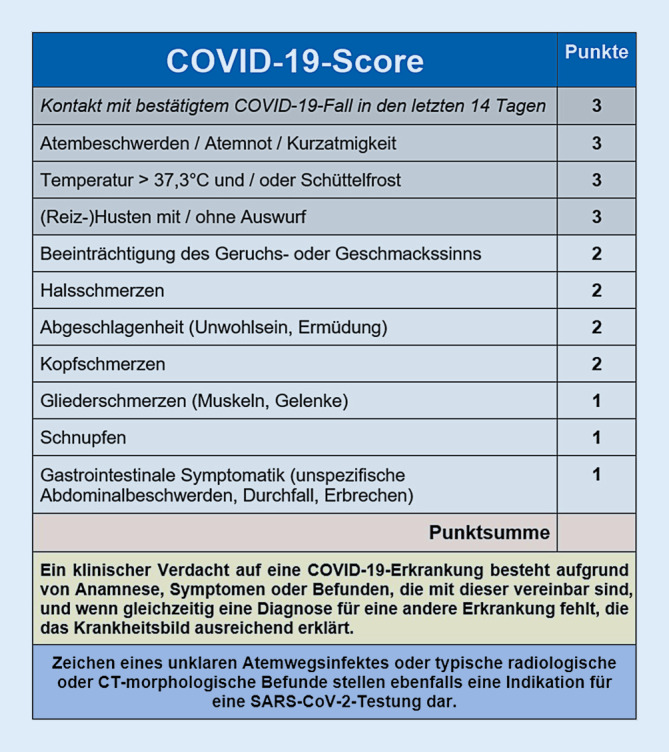
Bewertet wurden nur innerhalb der letzten 2 Wochen neu aufgetretene Symptome, die nicht durch ein anderes Krankheitsbild erklärbar waren (z. B. Atemnot bei kardialer Dekompensation, Fieber bei Infektfokus anderer Lokalisation, Abgeschlagenheit/Geschmacksstörung unter Chemotherapie). Es wurde der Zusatz hinzugefügt, dass jeder unklare Atemwegsinfekt und jeder typische radiologische oder CT-morphologische Befund auch bei einem COVID-19-Score <5 während der Diagnostikphase in der Notaufnahme eine frühzeitige Isolation und SARS-CoV-2-Testung auslösen sollten.
Der Score wurde als Zusatzmodul in die Notaufnahmesoftware (epias ED®, epias GmbH, Idstein/Ts., Deutschland) implementiert. Zur Überprüfung der praktischen Anwendbarkeit des Scores wurde eine multizentrische retrospektive Diagnostikstudie in den 3 Notaufnahmen der o. g. Kliniken der Schwerpunkt- bzw. Maximalversorgung durchgeführt.
Die Datenerhebung erfolgte mit einem Screeningfragebogen. Die Dokumentation wurde im „SARS-CoV-2-Modul“ einer Notaufnahmesoftware (epias ED®) durchgeführt, wodurch auch eine einfache Nachverfolgbarkeit der Testergebnisse sichergestellt werden konnte. Bei einem Teil der Patienten war aufgrund von Verständigungsschwierigkeiten (z. B. Sprachbarriere, demenzielle Erkrankung) eine vollständige Symptombefragung nicht durchführbar. Hierbei wurde – soweit möglich – auf fremdanamnestische Informationen zurückgegriffen.
Eingeschlossen wurden alle Patienten, die im Screening mindestens einen Scorepunkt erzielten und bei denen während des Studienzeitraums eine SARS-CoV-2-Testung durchgeführt wurde (Abb. 2). Als Proben für die Virusdiagnostik dienten tiefe Nasen-Rachen-Abstriche bzw. Rachenspülwasser und die Testung auf das SARS-CoV-2 erfolgte mit den aktuell auf dem Markt verfügbaren Verfahren der „real-time reverse transcriptase polymerase chain reaction“ (RT-PCR).
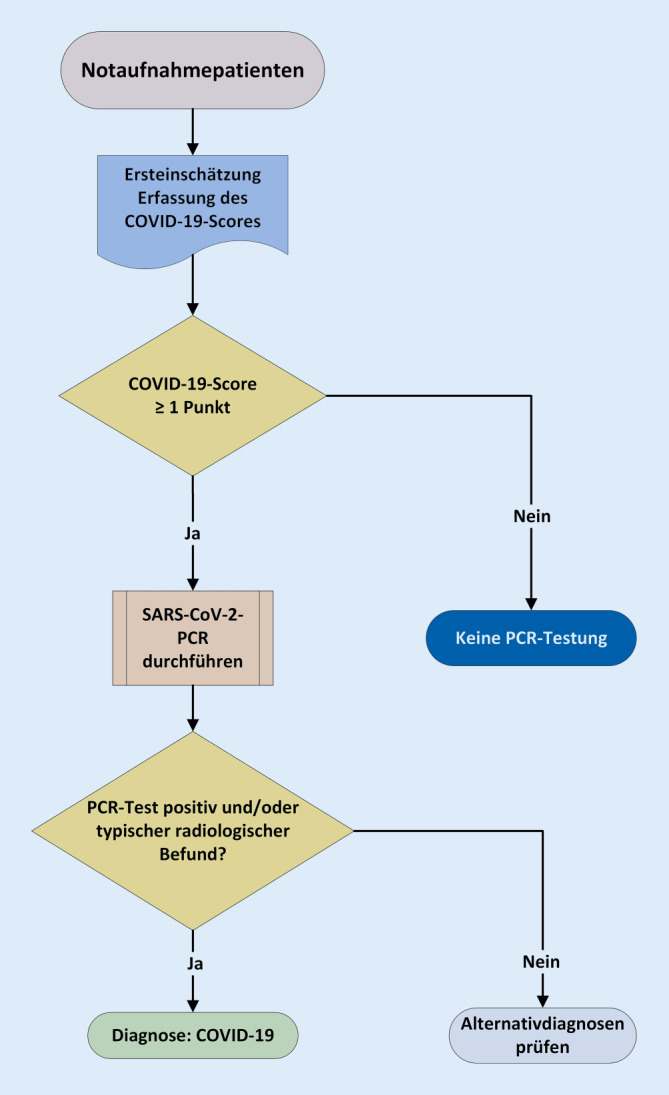
Die initiale radiologische Diagnostik wurde für die Studie ebenfalls ausgewertet, da Patienten mit typischen Befunden in der Röntgen-Thorax-Aufnahme oder im CT-Thorax (bilaterale Verschattungen bzw. Milchglasinfiltrate) auch bei negativem PCR-Test entsprechend internationalen Empfehlungen als positiv gewertet wurden [4, 5].
Sensitivität und Spezifität wurden sowohl für die einzelnen Symptome als auch für die Gesamtperformance des COVID-19-Scores berechnet.
Ergebnisse
Die Studienpopulation umfasste insgesamt 697 symptomatische Patienten aus 3 Notaufnahmen, bei denen eine SARS-CoV-2-PCR durchgeführt wurde. Es konnten alle Testergebnisse mit einem Score ≥1 ausgewertet werden. Im Untersuchungszeitraum wurden in den beteiligten Notaufnahmen 12.822 Patienten behandelt, sodass die COVID-19-Verdachtsfälle 5,4 % aller Patientenkontakte darstellten.
Die wesentlichen Patientencharakteristika sind in Tab. 2 zusammengefasst. Bei 9,2 % (n = 64) der Patienten konnte eine COVID-19-Erkrankung diagnostiziert werden. Davon wurden 12,5 % (n = 8) Patienten trotz negativer PCR aufgrund eines typischen radiologischen Befundes als COVID-19-positiv gewertet.
| Patientencharakteristik | COVID-19 negativ | COVID-19 positiv |
|---|---|---|
| Studienpopulation |
N (%) 697 (100 %) |
|
| 633 (90,8) | 64 (9,2) | |
| Davon weiblich (♀) | ♀: 356 (51,1) | |
| ♀: 336 (53,1) | ♀: 20 (31,2) | |
| Durchschnittsalter | 55,2 Jahre (Median: 56 Jahre; Min: 3/Max: 97) | |
| 54,7 (56,0; 3/97) | 60,3 (60,5; 20/96) | |
| Altersgruppen | ||
| 0–9 Jahre | n = 1 | |
| 1 | 0 | |
| 10–19 Jahre | n = 6 | |
| 6 | 0 | |
| 20–29 Jahre | n = 91 | |
| 88 | 3 | |
| 30–39 Jahre | n = 104 | |
| 100 | 4 | |
| 40–49 Jahre | n = 79 | |
| 67 | 12 | |
| 50–59 Jahre | n = 112 | |
| 101 | 11 | |
| 60–69 Jahre | n = 106 | |
| 92 | 14 | |
| 70–79 Jahre | n = 92 | |
| 80 | 12 | |
| 80–89 Jahre | n = 79 | |
| 73 | 6 | |
| 90–99 Jahre | n = 27 | |
| 25 | 2 | |
| Ambulante Behandlung | 297 (46,9) | 13 (20,3) |
| Stationäre Behandlung | 336 (53,1) | 51 (79,7) |
| Durchschnittliche Anzahl positiver Scorekriterien | 2,2 (Median: 2; Min: 1/Max: 10) | |
| 2,0 (2; 1/9) | 3,6 (3; 1/10) | |
| Durchschnittliche Punktzahl (COVID-19-Score) | 5,7 (Median: 6; Min: 1/Max: 21) | |
| 5,3 (5; 1/20) | 8,9 (8; 3/21) | |
| COVID-19-Score ≥5 | 327 (51,7) | 63 (98,4) |
| ♀: 197 (50,5) | ||
| COVID-19-Score <5 | 306 (48,3) | 1 (1,6) |
| ♀: 159 (51,8) | ||
COVID-19 Coronavirus Disease 2019
Im Gesamtkollektiv lag das Durchschnittsalter der Patienten bei 55,2 Jahren – bei den COVID-19-positiven Patienten bei 60,3 Jahren. Die größte Altersgruppe bildeten die Patienten von 50–59 Jahren (Tab. 2). In der Studienpopulation waren 51,1 % weiblich, während es von den COVID-19-positiv getesteten nur 31,2 % waren. Von dem hier untersuchten Patientenkollektiv wurden 55,5 % stationär aufgenommen und 44,5 % ambulant weiterbehandelt.
Sensitivität und Spezifität
Die erhobenen Daten wurden in Hinblick auf Symptomhäufigkeit, Sensitivität und Spezifität in Bezug auf die COVID-19-Erkrankung ausgewertet (Tab. 3).
| COVID-19-Symptome | Studienkollektiv N (%) 697 (100 %) |
Spezifität bez. COVID-19-Erkrankung (%) |
|
|---|---|---|---|
| COVID-19 negativ 633 (90,8) |
COVID-19 positiv 64 (9,2) |
||
| Kontakt mit bestätigtem COVID-19-Fall in den letzten 14 Tagen | 216 (34,1) | 12 (18,8) | 65,9 |
| Atembeschwerden/Atemnot/Kurzatmigkeit | 236 (37,3) | 35 (54,7) | 62,7 |
| Fieber >37,3 °C und/oder Schüttelfrost | 230 (36,3) | 47 (73,4) | 63,7 |
| (Reiz‑)Husten mit/ohne Auswurf | 199 (31,4) | 42 (65,6) | 68,6 |
| Beeinträchtigung des Geruchs- oder Geschmackssinns | 23 (3,6) | 8 (12,5) | 96,4 |
| Halsschmerzen | 60 (9,5) | 9 (14,1) | 90,5 |
| Abgeschlagenheit (Unwohlsein, Ermüdung) | 106 (16,7) | 36 (56,3) | 83,3 |
| Kopfschmerzen | 69 (10,9) | 12 (18,8) | 89,1 |
| Gliederschmerzen (Muskeln, Gelenke) | 34 (5,4) | 14 (21,9) | 94,6 |
| Schnupfen | 58 (9,2) | 3 (4,7) | 90,8 |
| Gastrointestinale Symptomatik (unspezifische Abdominalbeschwerden, Durchfall, Erbrechen) | 59 (9,3) | 9 (14,1) | 90,7 |
COVID-19 Coronavirus Disease 2019
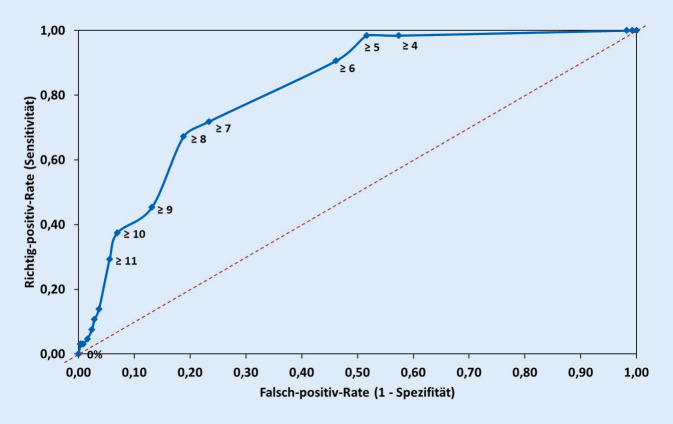
In der Analyse der ROC-Kurve zeigte sich, dass ein Cut-off-Wert von ≥5 Punkten unter der Prämisse einer hohen Sensitivität zur besten Gesamtperformance des Scores führt, sodass dieser Wert als Entscheidungskriterium für eine präemptive Isolation und PCR-Testung festgelegt wurde (Abb. 3).
Die Sensitivität dieses Scores lag bei 98,4 % während die Spezifität 48,3 % erreichte.
Die positive Vorhersagewahrscheinlichkeit lag für einen Score ≥5 Punkte bei 16,2 % und für einen Score <5 Punkte lag die negative Vorhersagewahrscheinlichkeit bei 99,7 %.
Die durchschnittliche Anzahl der positiven Scorekriterien betrug im gesamten Studienkollektiv 2,2 (COVID-19-Patienten: 3,6; SARS-CoV‑2 negativ: 2,0). 56,0 % aller Patienten erreichten einen Score von ≥5 Punkten, während die COVID-19-Erkrankten in 98,4 % einen Score von ≥5 Punkten erzielten. Die durchschnittliche Scorepunktzahl der COVID-19-Patienten lag bei 8,9 und in der COVID-19-negativen Gruppe bei 5,3 Punkten.
Von den COVID-19-positiven Patienten zeigten 93,8 % (n = 58) mindestens 2 der folgenden „Kardinalsymptome“ (3-Punkte-Wertung) und 21,9 % (n = 14) zeigten alle 3 Symptome:
Atembeschwerden/Atemnot/Kurzatmigkeit (n = 35);
Fieber >37,3 °C und oder Schüttelfrost (n = 47);
(Reiz‑)Husten mit/ohne Auswurf (n = 42).
Die großen Unterschiede in Art und Anzahl der dokumentierten Symptome reflektieren sowohl die häufig unspezifische Symptomatik der Erkrankung als auch die alltägliche Heterogenität der Patienten, die eine Notaufnahme aufsuchen.
Diskussion
Die vorliegende Studie stellt den Versuch zur strukturierten Einschätzung aller Notaufnahmepatienten bezüglich ihres Risikos für eine COVID-19-Erkrankung mit Unterstützung durch einen einfach anwendbaren Score dar. Das Patientenkollektiv besteht aus einer sehr heterogene Gruppe, spiegelt aber die Realität in den Notaufnahmen wider.
Die Ergebnisse dieser Diagnostikstudie zeigen bei Patienten mit einem COVID-19-Score von <5 Punkten ein deutlich geringeres Risiko für das Vorliegen einer SARS-CoV-2-Infektion als bei Patienten mit einem Score von ≥5 Punkten. Die Spezifität liegt für einzelne Kriterien zwar bei über 90 %, aber in Kombination aller Kriterien nur bei 48,3 %. Dafür weist der Score eine hohe Sensitivität von 98,4 % auf. Zusätzlich sollten ja auch alle Patienten mit klinischen Zeichen eines Atemwegsinfekts oder typischen radiologischen Befunden einer PCR-Testung unterzogen werden. Dadurch ist das Risiko, einen COVID-19-Erkrankten nicht zu erkennen, sehr gering und die systematische Anwendung des COVID-19-Scores kann dazu beitragen, infektiologische Ausbrüche im Krankenhaus durch eine nosokomiale Ausbreitung zu verhindern.
Als echtes Diagnosetool eignet sich der Score nicht, da nur 16,2 % der Patienten, die einen Score ≥5 Punkte erzielten, COVID-positiv waren, aber er kann zur Verbesserung der Vortestwahrscheinlichkeit hilfreich sein.
Die Geschlechtsverteilung wies einen deutlichen Unterschied zu den RKI-Zahlen auf. So waren 69 % der COVID-19-Erkrankten männlich (RKI: 48 %). Ob dies an einer höheren Rate an Vorerkrankungen bei den Männern lag, wurde in dieser Studie nicht untersucht. Und auch der Altersmedian der COVID-19-Fälle lag mit 60,5 Jahren signifikant höher als der bundesweite Wert von 50 Jahren bei allen positiv getesteten Personen [8]. Dies kann dadurch erklärt werden, dass in den Kliniken vorwiegend ältere Patienten behandelt werden, die häufiger einen so schweren Krankheitsverlauf zeigen, dass eine stationäre Aufnahme begründet ist. Während in den RKI-Zahlen der Husten das häufigste Symptom war (50 %), lag in unserem Kollektiv das Fieber mit 73 % an erster Stelle. Die RKI-Zahlen [8] zeigten auch eine im internationalen Vergleich deutliche Häufung von Schnupfensymptomatik (21 %), die sich aber in unserem Studienkollektiv nicht bestätigen ließ (9 %).
Die Anwendung des COVID-19-Scores im Rahmen der pflegebasierten Ersteinschätzung ermöglicht eine effektive Patientensteuerung durch frühzeitige präemptive Isolation und dient sowohl dem Mitarbeiter- als auch dem (Mit‑)Patientenschutz.
Der im Rahmen der vorliegenden Arbeit entwickelte COVID-19-Score soll den Arzt dabei unterstützen, das Risiko für eine COVID-19-Erkrankung noch vor Einleitung einer apparativen Diagnostik korrekt einzuschätzen und die Entscheidung für den weiteren klinischen Behandlungspfad und eine erforderliche SARS-CoV-2-Testung zu bahnen.
Die digitale Umsetzung des Befragungsinstruments „COVID-19-Score“ im elektronischen Notaufnahmedokumentationssystem (Emergency Department Information System – EDIS) ermöglicht durch die strukturierte Befunderhebung eine schnelle und effektive Dokumentation für jeden Patienten. Der Score wird automatisch berechnet und eine Risikoeinschätzung ausgegeben, sodass diese nachvollziehbar bleibt. Dieser Score kann in Verbindung mit Triage-Routinedaten dazu beitragen, dass lokale Ausbruchsszenarien zeitnah detektiert werden können. Hierfür wären weitere Studien notwendig.
Auch in der kalten Jahreszeit, in der sich die COVID-19-Pandemie mit der Influenzasaison überlappen wird, kann der Score eine Hilfe sein. Aus infektionsepidemiologischer Sicht wird auch dann der Ausschluss einer COVID-19-Erkrankung im Vordergrund stehen, aber auch eine Influenzainfektion darf nicht übersehen werden. Scorewerte >5 Punkte können als Entscheidungsgrundlage dafür dienen, dass schon frühzeitig sowohl der Ausschluss einer SARS-CoV-2-Infektion als auch einer Influenza A/B erfolgen sollte. Anbieter von PCR-Tests haben hierfür auch schon Kombi-Testkits für den europäischen Markt angekündigt. Hierdurch könnten der Behandlungsprozess in der Notaufnahme optimiert und die Zeitdauer einer präemptiven Isolation auf ein Minimum beschränkt werden.
Die Ergebnisse der vorliegenden Studie lassen den Schluss zu, dass die Anwendung des Covid-19-Scores als Screeningtool bei der Risikostratifizierung von Patienten mit COVID-19-Symptomen hilfreich sein kann. Dieser kann den Behandlungspfad bezüglich erforderlicher präemptiver Isolation, PCR-Testung und weiterer Behandlungsoptionen beeinflussen.
Der entwickelte COVID-19-Score kann Patienten, die keine oder eine atypische Symptomatik zeigen, nicht detektieren – dieser Anteil wird aktuell mit 20 % beziffert [8]. Um auch diese Patienten zu erfassen, müsste bei allen stationär aufgenommenen Patienten ein SARS-CoV-2-Test durchgeführt werden. Auch dann bleibt es wichtig, durch die Erhebung des COVID-19-Scores Verdachtsfälle rasch zu erkennen, um die entsprechenden Maßnahmen (präemptive Isolation und Behandlung im COVID-Bereich) in der Notaufnahme frühzeitig einzuleiten.
Limitationen
Die Studie weist einige Limitationen auf. Es handelt sich um eine begrenzte Fallzahl von Patienten mit Verdacht auf eine SARS-CoV-2-Infektion, von denen nur 64 auch positiv getestet wurden; die Repräsentativität ist dadurch eingeschränkt. Für eine bessere Validierung wäre eine groß angelegte multizentrische Datenerhebung in den Notaufnahmen sinnvoll. Hierzu projektiert das Autorenteam eine weitere Untersuchung in der kommenden Influenzasaison.
Die Studie wurde in 3 Kliniken durchgeführt, weshalb die Ergebnisse nicht uneingeschränkt auf ambulante Versorgungssysteme (z. B. Hausarzt, KV-Bereitschaftspraxis) übertragen werden können, da dort vorwiegend Patienten mit leichteren Symptomen vorstellig werden.
Die Einschätzung der Symptome erfolgte primär anhand eines Patientenfragebogens, der durch die Triage-Pflegekraft geprüft wurde. Wichtig ist hier die anschließende reflektierte und risikoorientierte ärztliche Evaluation des Ergebnisses, bevor die Entscheidung für oder gegen eine SARS-CoV-2-Testung erfolgt.
Fazit für die Praxis
Die SARS-CoV-2-Infektion (Severe Acute Respiratory Syndrome Corona-Virus-2) ist in ihrer klinischen Manifestation unspezifisch und sehr variabel, wodurch die Unterscheidung zu anderen (Virus‑)Infekten erschwert ist.
Der neu entwickelte COVID-19-Score (Coronavirus Disease 2019) ist ein während der Ersteinschätzung einfach anwendbares Screeningtool für die Notaufnahme zur Beurteilung des Risikos für eine COVID-19-Erkrankung, um frühzeitig die Entscheidung für oder gegen eine präemptive Isolation und PCR-Testung treffen zu können.
Durch digitale Dokumentation des Scores in einem elektronischen Notaufnahmedokumentationssystem bleibt die darauf gestützte Risikoeinschätzung von Notaufnahmepatienten nachvollziehbar.
Den Arzt in der Notaufnahme kann der Score dabei unterstützen, die Vortestwahrscheinlichkeit für eine COVID-19-Erkrankung bereits vor Einleitung einer weiteren apparativen Diagnostik einzuschätzen.
Der Score zeigt eine hohe Sensitivität (98,4 %). Aufgrund der unspezifischen Symptomatik der Erkrankung geht dies jedoch mit einer geringen Spezifität (48,3 %) einher.
Einhaltung ethischer Richtlinien
Interessenkonflikt
A. Hüfner, D. Kiefl, M. Baacke, R. Zöllner, O. Schellein, N. Avan und S. Pemmerl geben an, dass kein Interessenkonflikt besteht. E. Loza Mencía erhielt Fördergelder und nichtfinanzielle Unterstützung vom Innovationsausschuss des Gemeinsamen Bundesausschusses (G-BA).
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.European Centre for Disease Prevention and Control (2020) Rapid risk assessment: coronavirus disease 2019 (COVID-19) in the EU/EEA and the UK—ninth update. http://www.ecdc.europa.eu/sites/default/files/documents/covid-19-rapid-risk-assessment-coronavirus-disease-2019-ninth-update-23-april-2020.pdf. Zugegriffen: 5. Mai 2020
- 2.Gemeinsamer Bundesausschuss (2020) ESEG – Erkennung und Steuerung epidemischer Gefahrenlagen. https://innovationsfonds.g-ba.de/projekte/versorgungsforschung/eseg-erkennung-und-steuerung-epidemischer-gefahrenlagen.151. Zugegriffen: 5. Mai 2020 (https://www.rki.de/DE/Content/Infekt/Ausbrueche/ESEG/ESEG_node.html)
- 3.Giacomelli A, Pezzati L, Conti F, et al. Self-reported olfactory and taste disorders in SARS-CoV-2 patients: a cross-sectional study. Clin Infect Dis. 2020;71(15):889–890. doi: 10.1093/cid/ciaa330. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Guan W, Ni Z, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. doi: 10.1016/s0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lenzen-Schulte M. Bei COVID-19-Verdacht: Rasche Triage symptomatischer Patienten in der Notaufnahme. Dtsch Arztebl. 2020;117(14):A-715–A-716. [Google Scholar]
- 7.World Health Organisation (2020) Report of the WHO-China joint mission on coronavirus disease 2019 (COVID-19). https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf. Zugegriffen: 30. Apr. 2020
- 8.Robert Koch-Institut (2020) SARS-CoV‑2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19). http://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Steckbrief.html. Zugegriffen: 8. Mai 2020
- 9.Robert Koch-Institut (2020) COVID-19 Verdacht: Maßnahmen und Testkriterien. http://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Massnahmen_Verdachtsfall_Infografik_DINA3.pdf?__blob=publicationFile. Zugegriffen: 15. Apr. 2020
- 10.Robert Koch-Institut (2020) Coronavirus SARS-CoV‑2 – Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV. www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Vorl_Testung_nCoV.html. Zugegriffen: 24. Apr. 2020
- 11.Robert Koch-Institut (2020) COVID-19-Dashboard. https://experience.arcgis.com/experience/478220a4c454480e823b17327b2bf1d4. Zugegriffen: 30. Apr. 2020
- 12.Ständiger Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger am Robert Koch-Institut (2020) Hinweise zu Erkennung, Diagnostik und Therapie von Patienten mit COVID-19. http://www.rki.de/DE/Content/Kommissionen/Stakob/Stellungnahmen/Stellungnahme-Covid-19_Therapie_Diagnose.pdf. Zugegriffen: 17. Apr. 2020
- 13.Wennmann DO, Dlugos CP, Hofschröer A, et al. Umgang mit COVID-19 in der Notaufnahme. Med Klin Intensivmed Notfmed. 2020;115:380–387. doi: 10.1007/s00063-020-00693-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhang J, Zhou L, Yang Y, et al. Therapeutic and triage strategies for 2019 novel coronavirus disease in fever clinics. Lancet Respir Med. 2020;8(3):e11–e12. doi: 10.1016/S2213-2600(20)30071-0. [DOI] [PMC free article] [PubMed] [Google Scholar]