Abstract
Hintergrund
Das familiäre Mittelmeerfieber (FMF) ist eine in Deutschland eher seltene genetisch bedingte Erkrankung des Kindes- und Erwachsenenalters, die durch rezidivierende Fieberschübe sowie Peritonitis, Pleuritis und Arthritis charakterisiert ist. Die etablierte Therapie mit Kolchizin ist für die meisten Patienten wirksam und verträglich. Einige Patienten sprechen aber auf diese Therapie nicht ausreichend an bzw. vertragen diese nicht. Für diese Patienten kommen Biologika in Betracht. Die Gesellschaft für Kinder- und Jugendrheumatologie (GKJR) und die Deutsche Gesellschaft für Rheumatologie (DGRh) sind übereingekommen, gemeinsame Empfehlungen für diese spezielle klinische Situation zu entwickeln.
Ziel
Durchführung einer systematischen Literaturrecherche (SLR) auf Basis der 2016 publizierten EULAR(European League Against Rheumatism)-Empfehlungen als Grundlage für die Entwicklung von evidenzbasierten Therapieempfehlungen für FMF-Patienten mit unzureichendem Ansprechen bzw. Unverträglichkeit auf Kolchizin.
Methoden
Die SLR wurde mit Referenzen aus verschiedenen Datenbanken und als Aktualisierung der bis zum Jahr 2014 durchgeführten SLR der EULAR durchgeführt, wobei die Artikel zwischen dem 01.01.2015 und dem 31.12.2017 publiziert worden sein mussten. Für die Vorselektion wurde das Abstractwerkzeug Rayyan und für die Erstellung der Evidenztabellen die Klassifikation des Oxford Centre for Evidence Based Medicine 2009 benutzt.
Ergebnisse
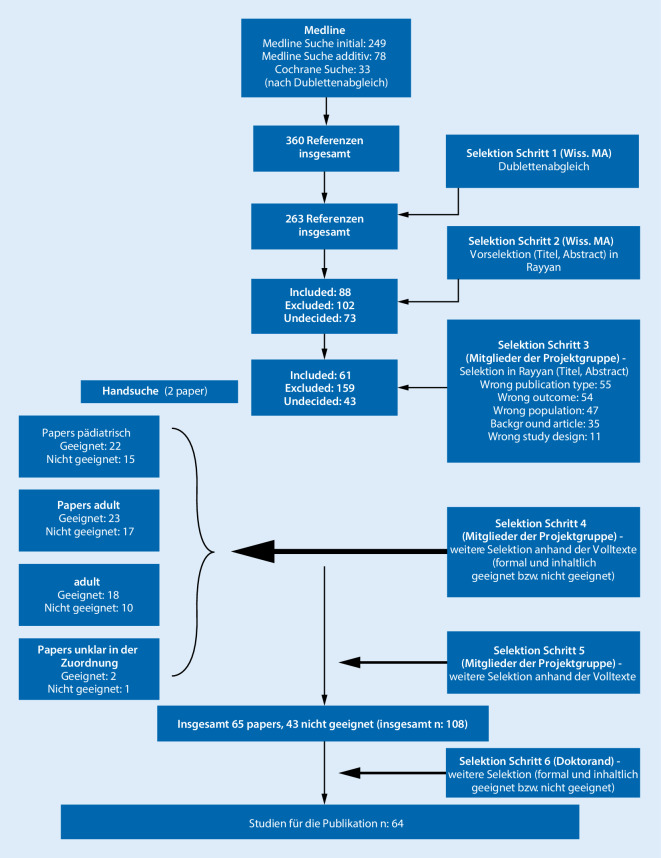
Die Suche ergab 360, nach Dublettenabgleich noch 263 Treffer. Insgesamt 88 Publikationen wurden ein- (34%) und 102 ausgeschlossen (39%), bei weiteren 73 war eine Sichtung der Vollpublikation notwendig (28%), und 43 wurden intensiver diskutiert. Schlussendlich blieben 64 Publikationen (24%) übrig. Insgesamt wurden 4 Fall-Kontroll-Studien, 31 Kohortenstudien, 8 Fallserien, 7 kontrollierte Studien (davon 5 Abstracts), 10 Übersichtsarbeiten sowie 4 Metaanalysen und systematische Reviews akzeptiert.
Diskussion
Die SLR wurde wissenschaftlich exakt, transparent und nach internationalen Standards durchgeführt. Die SLR erwies sich als gute Grundlage für die Konsentierung der 5 übergeordneten Prinzipien und der 10 Empfehlungen, sodass die gemeinsame Aktivität von GKJR und DGRh erfolgreich und sogar zeitnah abgeschlossen werden konnte. Die Empfehlungen sind eine solide Basis, Patienten jeden Alters mit FMF gut zu behandeln. Dabei spielen die Erklärungen zum Problem der Kolchizinresistenz eine wichtige Rolle.
Zusatzmaterial online
Die Online-Version dieses Beitrags (10.1007/s00393-020-00886-0) enthält die Evidenztabellen, Tabellen zum Verzerrungsrisiko (RoB) sowie die Übersicht der Suchstrategien. Folgende Inhalte finden Sie online: Tab. 2a: Evidenztabelle für alle zitierten Fall-Kontroll-Studien, Studiencharakteristika; Tab. 2b: Evidenztabelle für alle zitierten Kohortenstudien, Studiencharakteristika; Tab. 2c: Evidenztabelle für alle zitierten Fallserien, Studiencharakteristika; Tab. 2d: Evidenztabelle für sämtliche zitierte kontrollierte Studien (inklusive Abstracts), Studiencharakteristika; Tab. 2e: Evidenztabelle für alle zitierten Übersichtsarbeiten, Studiencharakteristika; Tab. 2f: Evidenztabelle für alle zitierten Metaanalysen und systematischen Reviews, Studiencharakteristika; Tab. 3a: Verzerrungsrisiko für sämtliche zitierte Kohortenstudien nach der Newcastle-Ottawa-Skala (Risiko für Bias); Tab. 3b: Verzerrungsrisiko für sämtliche zitierte Fall-Kontroll-Studien nach der Newcastle-Ottawa-Skala (Risiko für Bias); Suchstrategien (Supplement). Beitrag und Zusatzmaterial stehen Ihnen auf www.springermedizin.de zur Verfügung. Bitte geben Sie dort den Beitragstitel in die Suche ein, das Zusatzmaterial finden Sie beim Beitrag unter „Ergänzende Inhalte“.

Schlüsselwörter: Familiäres Mittelmeerfieber , Biologika , Kolchizin-Resistenz , Europäische Liga gegen den Rheumatismus , Interleukin-1
Abstract
Background
Familial Mediterranean fever (FMF) is a genetic disease of childhood and adulthood which is relatively rare in Germany. It is characterized by recurrent febrile attacks, peritonitis, pleuritis and arthritis. The established treatment with colchicine is effective and well-tolerated by most patients; however, some patients do not adequately respond or do not tolerate this treatment. Biologics can be considered for some of these patients. The Society for Pediatric and Adolescent Rheumatology (GKJR) and the German Society for Rheumatology (DGRh) have agreed to develop joint recommendations for this specific clinical situation.
Aim
Implementation of a systematic literature search (SLR) on the basis of the EULAR recommendations published in 2016 as the foundation for the development of evidence-based treatment recommendations for FMF patients with insufficient response or intolerance to colchicine.
Methods
The SLR was performed using references from various databases as an update of the SLR carried out by EULAR up to 2014, whereby all articles must have been published between 1 January 2015 and 31 December 2017. The Rayyan abstract tool for the preselection and the classification of the Oxford Centre for Evidence Based Medicine 2009 were used for the preparation of the evidence tables.
Results
The search yielded 360 hits and after duplicate matching 263. A total of 88 publications were included (34%) and 102 excluded (39%), a review of the full publication was necessary for a further 73 (28%) and 43 were discussed more intensively. Finally, 64 publications (24%) remained. A total of 4 case-control studies, 31 cohort studies, 8 case series, 7 controlled studies (including 5 abstracts), 10 reviews, 4 meta-analyses and systematic reviews were accepted.
Discussion
The SLR was carried out in a scientifically accurate and transparent manner according to international standards. The SLR proved to be a good basis for a consensus on the 5 overarching principles and the 10 recommendations, so that the joint activity of the GKJR and DGRh was successfully and even promptly concluded. The recommendations are a solid basis for treating patients of all ages with FMF. The explanations on the problem of colchicine resistance play an important role here.
Keywords: Familial Mediterranean fever, Biologics, Colchicine resistance, European League Against Rheumatism, Interleukin 1
Das familiäre Mittelmeerfieber (FMF) ist eine autoinflammatorische Erkrankung, die durch rezidivierende Fieberschübe, häufig in Kombination mit klinischen Zeichen einer Peritonitis, Pleuritis und/oder Arthritis, charakterisiert ist [1]. Bei unbehandelten oder unzureichend behandelten Patienten erhöht die häufig zum Teil subklinische Entzündungsreaktion das Risiko für das Auftreten von Komplikationen, wie z. B. Amyloidose, erheblich [2]. Klassifikationskriterien für das FMF sind 1997 vorgeschlagen worden [3].
Ätiopathogenetisch ist die Erkrankung mit Mutationen im MEditerranean-FEver-Gen (MEFV) assoziiert, wobei aber kein klassischer Erbgang vorliegt, denn es handelt sich um eine Gendosis-Wirkungs-Beziehung [4–10]. Vorschläge für eine rationale Durchführung genetischer Diagnostik sind 2012 gemacht worden [11].
Ziel des FMF-Managements ist es, FMF-Attacken und mögliche Organkomplikationen zu verhindern [2]. Die pharmakologische Therapie basiert im Wesentlichen auf Kolchizin. Die prophylaktische und therapeutische Wirksamkeit des Mitosehemmstoffs Kolchizin, welches aus der ziemlich giftigen Herbstzeitlosen (Colchicum autumnale) gewonnen wird, ist seit fast 50 Jahren etabliert [12–17].
Die klinische Wirksamkeit dieser Therapie wurde schon vor vielen Jahren nachgewiesen, als gezeigt wurde, dass klinisch apparente Attacken von FMF meist komplett und bei vielen Patienten partiell verhindert werden konnten [12–17]. Die kontinuierliche Therapie mit Kolchizin stellte auch einen wirksamen Schutz vor Amyloidose dar [12]. Evidenzbasierte Empfehlungen für den Einsatz von Kolchizin bei Patienten mit FMF mit detaillierter Angabe von zugelassenen Dosierungen wurden früh publiziert [16, 17] und sind auch Teil der European League against rheumatism (EULAR)-Empfehlungen von 2016 [18]. Da in der wissenschaftlichen Literatur der Begriff „Kolchizin-Resistenz“ nicht genau definiert ist bzw. unterschiedliche Definitionen publiziert wurden und bisher keine internationale Übereinstimmung erzielt werden konnte, ist davon auszugehen, dass das Management bei Patienten mit „Kolchizin-resistentem familiärem Mittelmeerfieber“ uneinheitlich erfolgt ist. Eine Übersicht über die bisher gemachten Vorschläge gibt Tab. 1.
| Referenz | Jahr | Definition der Kolchizin-Resistenz |
|---|---|---|
| Barut, K. et al. [33] | 2017 | ≥1 Attacke/Monat über 3 Monate |
| Basaran, Ö. et al. [34] | 2015 | Schwere, häufige Attacken und/oder erhöhte Entzündungsparameter |
| Ben-Zvi, I. et al. [25] | 2017 | ≥1 Attacke/Monat |
| Cetin, P. et al. [35] | 2015 | Nicht eindeutig (schwere, gehäufte Attacken oder erhöhte Entzündungsparameter trotz Maximaldosis) |
| De Benedetti, F. et al. [36] | 2017 | ≥1 Attacke/Monat |
| Eroglu, F.K. et al. [37] | 2015 | ≥1 Attacke in den letzten 3 Monaten und Erhöhung von Entzündungsparametern zwischen den Attacken |
| Knieper, M. et al. [38] | 2017 |
<6 Attacken/Jahr oder >3 Attacken in den letzten 4 bis 6 Monaten (3,7 % der Gesamtkohorte) |
| Kucuksahin, O. et al. [39] | 2016 | ≥2 Attacken/Monat und Erhöhung von CRP und BSG zwischen den Attacken |
| Laskari, K. et al. [40] | 2017 | Aktive Erkrankung trotz mindestens 3 Monate langer Kolchizin-Therapie |
| Lofty, H.M. et al. [41] | 2016 | ≥1 Attacke/Monat |
| Melikoglu, M.A. et al. [42] | 2017 | ≥1 Attacke alle 3 Monate |
| Omma, A. et al. [43] | 2017 | >3 Attacken in den letzten 6 Monaten |
| Ozen, S. et al. [44] | 2017 | ≥1 Attacke/Monat über 3 Monate |
| Ozer, I. et al. [45] | 2015 | ≥3 Attacken in 6 Monaten |
| Ozkan, S. et al. [46] | 2017 | Schwere, häufige Attacken und/oder erhöhte Entzündungsparameter |
| Pecher, A.C. et al. [47] | 2017 | >1 Attacke/Monat und/oder >1,5-facher Anstieg der Attackenfrequenz im Vergleich zum Zeitpunkt des besten Ansprechens auf eine Kolchizin-Therapie |
| Yalcintepe, S. et al. [48] | 2016 | ≥2 Attacken/Monat und Erhöhung der Entzündungsparameter |
Reicht die Therapie mit Kolchizin nicht aus bzw. wird diese nicht vertragen, können danach Biologika wie die IL-1-Inhibitoren eingesetzt werden [23]. Interleukin 1 (IL-1) ist ein wichtiger Vermittler von Entzündungsreaktionen, der bei den natürlichen Reaktionen des Körpers und der Entwicklung pathologischer Zustände, die zu chronischen Entzündungen führen, eine wichtige Rolle spielt [19]. Durch eine unangemessen hohe Produktion und Freisetzung von IL-1β kann eine Vielzahl unterschiedlicher Symptome wie Arthritis, Exantheme, Konjunktivitis, Serositis, Fieber oder Hörverlust ausgelöst werden [20]. Die Verwendung von IL-1-Antagonisten hat sich bei Patienten mit autoinflammatorischen Zuständen, die mit einer übermäßigen IL-1-Produktion einhergehen, als wirksam erwiesen, die erste Publikation dazu gab es 2007 [21]. Die Implikation von IL‑1 in den durch pathogene Kristalle ausgelösten Entzündungsprozess lieferte die Begründung für die Verwendung von IL-1-Inhibitoren z. B. bei kristallinduzierter Arthritis [22, 23].
Nachdem erst nur Fallberichte und kleine Kohortenstudien veröffentlicht worden waren, die den erfolgreichen Einsatz einer IL-1-Blockade bei Patienten mit unzureichendem Ansprechen auf Kolchizin beschrieben, gab es dann zunehmend auch randomisierte kontrollierte Studien zum Einsatz der IL-1-Antagonisten Rilonacept [24], Anakinra [25] und zuletzt Canakinumab [26] bei Patienten mit hoher Krankheitsaktivität eines FMF trotz adäquat dosierter Kolchizin-Therapie.
Seit 2017 ist Canakinumab für die Therapie des FMF in Deutschland zugelassen. Weil auf der einen Seite nur relativ wenige Patienten für eine solche Therapie infrage kommen und auf der anderen Seite insbesondere die Behandlung mit Canakinumab mit relativ hohen Kosten verbunden ist sowie keine Daten zur Langzeittherapie bei großen Kohorten vorliegen, waren möglichst eindeutige Empfehlungen für den Einsatz von Biologika bei therapierefraktärem FMF wünschenswert. Im April 2020 hat die European Medical Association (EMA) im Rahmen einer Indikationserweiterung auch Anakinra für die Behandlung des FMF zugelassen.
Da im Jahr 2016 EULAR-Empfehlungen zum Management von FMF publiziert worden waren, wurden diese als Ausgangspunkt für die Erstellung nationaler Therapieempfehlungen gewählt. Ziel der vorliegenden Arbeit war es, unter Berücksichtigung der neuesten Studienergebnisse und der aktuellen Zulassungssituation in Deutschland die Evidenzbasis zu schaffen, um erweiterte Empfehlungen zur Therapie des FMF für betroffene Patienten und Ärzte, die mit dem Management von FMF-Patienten betraut sind, entwickeln und konsentieren zu können [27]. Dies betrifft vorwiegend Rheumatologen und Pädiater mit Erfahrung in der Behandlung solcher Patienten.
Methoden
Wegen dieses Problems und angesichts der neuen Therapiemöglichkeiten haben die Gesellschaft für Kinder- und Jugendrheumatologie (GKJR) und die Deutsche Gesellschaft für Rheumatologie e. V. (DGRh) beschlossen, auf Basis einer systematischen Literaturrecherche (SLR) eine gemeinsame Empfehlung zur „Therapie des Kolchizin-resistenten familiären Mittelmeerfiebers“ zu erarbeiten.
Teilnehmer der Konsensusgruppe waren: Norbert Blank (DGRh), Jürgen Braun (DGRh, Koordinator), Eugen Feist (DGRh), Tilmann Kallinich (GKJR), Uta Kiltz (DGRH), Ulrich Neudorf (GKJR), Prasad Oommen (GKJR), Helmut Wittkowski (GKJR) und Christiane Weseloh (Wissenschaftliche Mitarbeiterin der DGRh). Der medizinische Doktorand Tom Sahr (geb. Braun) half bei der Erstellung der SLR, unterstützte die Volltextselektion und erstellte die Evidenztabellen. Um den Anforderungen einer evidenzbasierten Publikation gerecht zu werden, wurden die Interessenkonflikte der stimmberechtigten Mitglieder vor Projektbeginn von jedem Teilnehmer erhoben. Die finale Bewertung wurde von U. Kiltz, T. Kallinich und J. Braun vorgenommen.
Methodik der Erstellung der Therapieempfehlungen
a) Durchführung der systematischen Literaturrecherche mit Suchstrategien (MEDLINE, Cochrane)
Für die Durchführung der SLR wurden vorab der Suchzeitraum, die Datenbanken, Publikationsart und das Suchschema mittels PICO-Fragen von der Gruppe konsentiert. PICO steht als Akronym für:
Population oder Patient, Problem: Beschreibung der Gruppe von Patienten bzw. des Problems.
Intervention = Technologien, diagnostisches/therapeutisches Verfahren: Welche Intervention ist Gegenstand der gegenwärtigen Untersuchung?
Comparison oder Control = Vergleichsintervention: Was ist die Hauptalternative, mit der die Intervention verglichen werden kann?
Outcome = Zielgröße: Was soll erreicht werden?
Die SLR sollte unter Verwendung von Referenzen aus MEDLINE-, EMBASE- und Cochrane CENTRAL-Datenbanken und als Aktualisierung der bis zum Jahr 2014 durchgeführten SLR der EULAR durchgeführt werden [18, 28, 29]. Die in der vorliegenden SLR enthaltenen Artikel mussten zwischen dem 01.01.2015 und dem 31.12.2017 publiziert worden sein.
Die gefundenen Artikel wurden zunächst nach Titel und Abstract gemäß den Ein- und Ausschlusskriterien gesichtet. Duplikate wurden manuell aussortiert. Die Referenzen wurden in ein Abstractverwaltungstool (Rayyan) hochgeladen und vorselektiert. Die vorselektierten Abstracts standen den Arbeitsgruppen zur weiteren Selektion zur Verfügung.
Die Volltextorganisation der relevanten Arbeiten wurde in der Universitätsmedizin Charité Berlin arbeitsteilig durchgeführt. In einem weiteren Schritt selektierten die Mitglieder der Konsensusgruppe teamweise diejenigen Arbeiten, die für die Publikation von Interesse waren und formal und inhaltlich den Vorgaben entsprachen.
Die Gruppe wurde bei der Selektion vom Doktoranden unterstützt, der am Ende des Auswahlprozesses zudem eine umfassende Evidenzbewertung vornahm. Dabei wurde eine weitere Selektion der Studien anhand der formalen und inhaltlichen Eignung vorgenommen (s. Abb. 1).
b) Formulierung der Therapieempfehlung
Die Formulierung der Therapieempfehlungen basierte auf der identifizierten Evidenz und wurde von der Gruppe auf Basis eines offenen Austausches formuliert. Für die Verabschiedung der Empfehlungen vereinbarte die Gruppe, dass eine Mehrheit von 75 % zur Annahme eines Formulierungsvorschlages notwendig sein sollte.
Ergebnisse
A) Literatursuche
Durchführung:
Die SLR wurde am 28.01.2018 in den Datenbanken MEDLINE (PubMed) und Cochrane Library auf Basis der PICO-Fragen für den Zeitraum 01.01.2015 bis 31.12.2017 durchgeführt (s. Zusatzmaterial online):
P (Population): alle Patienten mit familiärem Mittelmeerfieber (FMF),
I (Intervention): alle Medikamente, die eingesetzt wurden, wenn Kolchizin nicht ausreichte,
C (Comparator): Glukokortikoide und konventionelle disease modifying anti-rheumatic drugs (DMARDs),
O (Outcome): Krankheitsaktivität inklusive C-reaktivem Protein (CRP), S‑100 und Serum-Amyloid‑A, Amyloidose.
Als Selektionskriterien wurden im Vorfeld die Publikationsarten wie folgt definiert:
Reviews,
Editorials,
randomisierte kontrollierte Studien (RCT), (10 Patienten und mehr, Laufzeit ≥12 Wochen),
Kohorte (25 Patienten und mehr, Laufzeit 6 Monate und mehr, wenn Längsschnittarm),
Fall-Kontroll-Studie (20 Patienten und mehr, Laufzeit 6 Monate und mehr, wenn Längsschnittarm),
Metaanalyse,
- Case Reports (mindestens 3 Patienten):
- Arbeit in Englisch oder Deutsch,
- Volltextpublikation + Kongressabstracts.
Ausschlusskriterien:
Zweitpublikation
Gruppen nicht sauber getrennt (z. B. FMF und andere periodische Fiebersyndrome vermischt)
Eine Intervention war nicht zwingend vorgeschrieben.
Datenextraktion und Bewertung des Verzerrungspotenzials.
Jeder identifizierte Artikel oder Abstract wurde unabhängig von je 2 Reviewern auf Eignung gemäß den vordefinierten Einschlusskriterien bewertet, gefolgt von einer Volltextüberprüfung. Für jede eingeschlossene Studie wurden relevante Daten extrahiert und in Evidenztabellen zusammengefasst (Tab. 2a–f). Die Bewertung der Evidenz erfolgte mithilfe der Oxford Center of Evidence-based Medicine-Levels of Evidence von 2009 (www.cebm.net). (s. Zusatzmaterial online). Darüber hinaus bewerteten die Gutachter das Verzerrungspotenzial (risk of bias, RoB) jeder Studie anhand des „Cochrane-Tools“ für RCTs, des „Hayden-Tools“ für Kohortenstudien und der Newcastle-Ottawa-Skala für den Einzelfall [28–30]. Meinungsverschiedenheiten hinsichtlich der Eignung der Studien, der Datenextraktion und der RoB-Bewertung wurden durch Diskussion und Konsens gelöst. Bei anhaltenden Meinungsverschiedenheiten wurde ein dritter Gutachter hinzugezogen.
Die Suche ergab insgesamt 360 Treffer (nach Dublettenabgleich: 263 Treffer). Die Referenzen wurden in ein Abstractverwaltungstool (Rayyan) hochgeladen und vorselektiert (eingeschlossen: 88, ausgeschlossen: 102, keine sichere Zuordnung: 73). Die vorselektierten Abstracts standen den Arbeitsgruppen zur weiteren „Selektion“ zur Verfügung.
Die Abstractselektion durch die Mitglieder der Arbeitsgruppen ergab zum Stichtag 01.03.2018 folgendes Ergebnis: eingeschlossen: 61, ausgeschlossen: 159, keine sichere Zuordnung: 43. In einem weiteren Schritt selektierten die Mitglieder der Konsensusgruppe teamweise diejenigen Arbeiten, die für die Publikation von Interesse waren und formal und inhaltlich den Vorgaben entsprachen.
Am Ende des Auswahlprozesses wurde eine umfassende Evidenzbewertung vorgenommen mit weiterer Selektion der Studien anhand der formalen und inhaltlichen Eignung. Schlussendlich blieben 64 Publikationen übrig, die für die Empfehlungen zu berücksichtigen waren. Insgesamt wurden 4 Fall-Kontroll-Studien, 31 Kohortenstudien, 8 Fallserien, 7 kontrollierte Studien (davon 5 Abstracts), 10 Übersichtsarbeiten und 4 Metaanalysen und systematische Reviews als Grundlage für die Formulierung der Therapieempfehlung identifiziert (Abb. 1).
Die Evidenztabellen und die RoB-Bewertungsliste finden Sie als Zusatzmaterial online.
B) Konsentierung der übergeordneten Prinzipien und Empfehlungen
Auf einem Projekttreffen im Rheumazentrum Ruhrgebiet in Herne am 19.04.2018 wurde auf Basis der gefundenen Evidenz die Sachlage in der Gruppe diskutiert, und übergeordnete Prinzipien und Empfehlungen wurden konsentiert. Es waren 7 stimmberechtigte Teilnehmer der Gruppe anwesend, keiner fehlte. Das Ergebnis dieser Konsentierung wurde den Vorständen von DGRh und GKJR zur Prüfung und Freigabe vorgelegt. Änderungswünsche wurden diskutiert und partiell berücksichtigt. Diese Änderungen wurden erneut mittels einer elektronischen Abfrage zwischen den Autoren konsentiert. Die Kommission Pharmakotherapie der DGRh (Sprecher: Klaus Krüger) war in den Freigabeprozess der Publikation ebenso eingebunden. Sowohl die übergeordneten Prinzipien als auch die Empfehlungen basieren auf den EULAR-Empfehlungen und einer aktualisierten SLR. Es wurden 5 übergeordnete Prinzipien und 10 Empfehlungen formuliert. Alle Empfehlungen wurden nach intensiver inhaltlicher Diskussion in der Expertengruppe in voller Übereinstimmung (100 %) konsentiert [27].
Diskussion
Die SLR war insgesamt trotz des relativ engen Zeitraums (im Anschluss an die EULAR-Empfehlungen [23] von 2016) formal, quantitativ (Referenzen [28, 31–89]), inhaltlich und auch qualitativ erfolgreich (Abb. 1; Tab. 1–2a–f). Die gemeinsame Arbeitsgruppe von DGRh und GKJR hat dann auch auf dieser Basis sehr gut funktioniert, sodass die gemeinsamen Empfehlungen schon im Jahr 2019 publiziert werden konnten [27]. Neben den hier ausführlich vorgestellten Publikationen wurden für die Empfehlungen noch einige ältere Publikationen für die Themen Kolchizin inklusive Dosierung und Resistenz sowie Sicherheit [92–102], Lebensqualität [103–107] und Schwere der Erkrankung [108–112], Akutphaseparameter [113–115], Arthritis [116–119] febrile Myalgien [120–122] und Nebenwirkungen bzw. Applikationsform von Biologika [123–125] hinzugezogen.
Interessanterweise haben sich die möglichen Indikationen für Kolchizin in Richtung Perikarditis [126, 127] und Canakinumab in Richtung Arteriosklerose [128, 129] und sogar Myokardinfarkt [130] inzwischen ausgeweitet.
Ein Ende 2017 für die Behandlung von Gicht und FMF von der EMA neu zugelassenes Kolchizin-haltiges Arzneimittel wird in Deutschland inzwischen flächendeckend vertrieben.
Nachdem der erfolgreiche Einsatz von IL-1-Antagonisten bei FMF-Patienten mit unzureichendem Ansprechen auf Kolchizin zunächst nur in Fallberichten und kleinen Kohortenstudien beschrieben worden war, gibt es inzwischen eine ziemlich solide Datenlage für die Wirksamkeit der 3 IL-1-Antagonisten, wobei nur Anakinra und Canakinumab in Deutschland erhältlich sind. So liegen für den Einsatz von Rilonacept, Anakinra und Canakinumab bei Patienten mit hoher Krankheitsaktivität eines FMF trotz adäquat dosierter Kolchizin-Therapie mittlerweile publizierte Ergebnisse randomisierter kontrollierter Studien vor. Für Canakinumab gibt es auch bereits recht positive 72-Wochen-Daten [131].
Inwieweit auch andere Biologika wirksam sind, kann noch nicht abschließend beurteilt werden, für anti-IL-6R und anti-TNF‑α gibt es aber bislang immer noch lediglich positive Fallberichte [132].
Interessant geblieben ist auch das Thema Assoziationen und Komorbidität, hierzu wurde kürzlich eine große Studie vorgelegt, in der auch Zusammenhänge zwischen FMF und Spondyloarthritiden bzw. Morbus Behçet wieder thematisiert bzw. mit Daten gestützt wurden [133].
Caption Electronic Supplementary Material
Funding
Open Access funding provided by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
T. Sahr, U. Kiltz, C. Weseloh, T. Kallinich und J. Braun geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Sohar E, Gafni J, Pras M, Heller H. Familial Mediterranean fever. A survey of 470 cases and review of the literature. Am J Med. 1967;43(2):227–253. doi: 10.1016/0002-9343(67)90167-2. [DOI] [PubMed] [Google Scholar]
- 2.Özen S. Update on the epidemiology and disease outcome of Familial Mediterranean fever. Best Pract Res Clin Rheumatol. 2018;32(2):254–260. doi: 10.1016/j.berh.2018.09.003. [DOI] [PubMed] [Google Scholar]
- 3.Livneh A, Langevitz P, Zemer D, et al. Criteria for the diagnosis of familial Mediterranean fever. Arthritis Rheum. 1997;40:1879–1885. doi: 10.1002/art.1780401023. [DOI] [PubMed] [Google Scholar]
- 4.French FMF Consortium A candidate gene for familial Mediterranean fever. Nat Genet. 1997;17(1):25–31. doi: 10.1038/ng0997-25. [DOI] [PubMed] [Google Scholar]
- 5.The International FMF Consortium Ancient missense mutations in a new member of the RoRet gene family are likely to cause familial Mediterranean fever. The International FMF Consortium. Cell. 1997;90(4):797–807. doi: 10.1016/s0092-8674(00)80539-5. [DOI] [PubMed] [Google Scholar]
- 6.Livneh A, Langevitz P, Shinar Y, et al. MEFV mutation analysis in patients suffering from amyloidosis of familial Mediterranean fever. Amyloid. 1999;6(1):1–6. doi: 10.3109/13506129908993281. [DOI] [PubMed] [Google Scholar]
- 7.Shohat M, Magal N, Shohat T, et al. Phenotype-genotype correlation in familial Mediterranean fever: evidence for an association between Met694Val and amyloidosis. Eur J Hum Genet. 1999;7(3):287–292. doi: 10.1038/sj.ejhg.5200303. [DOI] [PubMed] [Google Scholar]
- 8.Kogan A, Shinar Y, Lidar M, et al. Common MEFV mutations among Jewish ethnic groups in Israel: high frequency of carrier and phenotype III states and absence of a perceptible biological advantage for the carrier state. Am J Med Genet. 2001;102(3):272–276. doi: 10.1002/ajmg.1438. [DOI] [PubMed] [Google Scholar]
- 9.Ben-Zvi I, Herskovizh C, Kukuy O, et al. Familial Mediterranean fever without MEFV mutations: a case-control study. Orphanet J Rare Dis. 2015;10:34. doi: 10.1186/s13023-015-0252-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kallinich T, Orak B, Wittkowski H. Role of genetics in familial Mediterranean fever. Z Rheumatol. 2017;76:303–312. doi: 10.1007/s00393-017-0265-9. [DOI] [PubMed] [Google Scholar]
- 11.Shinar Y, Obici L, Aksentijevich I, et al. Guidelines for the genetic diagnosis of hereditary recurrent fevers. Ann Rheum Dis. 2012;71(10):1599–1605. doi: 10.1136/annrheumdis-2011-201271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Zemer D, Revach M, Pras M, et al. A controlled trial of colchicine in preventing attacks of familial Mediterranean fever. N Engl J Med. 1974;291(18):932–934. doi: 10.1056/NEJM197410312911803. [DOI] [PubMed] [Google Scholar]
- 13.Zemer D, Pras M, Sohar E, et al. Colchicine in the prevention and treatment of the amyloidosis of familial Mediterranean fever. N Engl J Med. 1986;314(16):1001–1005. doi: 10.1056/NEJM198604173141601. [DOI] [PubMed] [Google Scholar]
- 14.Goldstein RC, Schwabe AD. Prophylactic colchicine therapy in familial Mediterranean fever. A controlled, double-blind study. Ann. Intern. Med. 1974;81:792–794. doi: 10.7326/0003-4819-81-6-792. [DOI] [PubMed] [Google Scholar]
- 15.Kallinich T, Haffner D, Niehues T, et al. Colchicine use in children and adolescents with familial Mediterranean fever: literature review and consensus statement. Pediatrics. 2007;119(2):e474–e483. doi: 10.1542/peds.2006-1434. [DOI] [PubMed] [Google Scholar]
- 16.Hentgen V, Grateau G, Kone-Paut I, et al. Evidence-based recommendations for the practical management of Familial Mediterranean Fever. Semin. Arthritis Rheum. 2013;43(3):387–391. doi: 10.1016/j.semarthrit.2013.04.011. [DOI] [PubMed] [Google Scholar]
- 17.Slobodnick A, Shah B, Krasnokutsky S, Pillinger MH. Update on colchicine, 2017. Baillieres Clin Rheumatol. 2018;57(suppl_1):i4–i11. doi: 10.1093/rheumatology/kex453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ozen S, Demirkaya E, Erer B, et al. EULAR recommendations for the management of familial Mediterranean fever. Ann Rheum Dis. 2016;75(4):644–651. doi: 10.1136/annrheumdis-2015-208690. [DOI] [PubMed] [Google Scholar]
- 19.Dinarello CA. Overview of the IL-1 family in innate inflammation and acquired immunity. Immunol Rev. 2018;281(1):8–27. doi: 10.1111/imr.12621. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Goldbach-Mansky R, Dailey NJ, Canna SW, et al. Neonatal-onset multisystem inflammatory disease responsive to interleukin-1beta inhibition. N Engl J Med. 2006;355(6):581–592. doi: 10.1056/NEJMoa055137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Kuijk LM, Govers AM, Frenkel J, Hofhuis WJ. Effective treatment of a colchicine-resistant familial Mediterranean fever patient with anakinra. Ann Rheum Dis. 2007;66(11):1545–1546. doi: 10.1136/ard.2007.071498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.McGonagle D, Tan AL, Shankaranarayana S, et al. Management of treatment resistant inflammation of acute on chronic tophaceous gout with anakinra. Ann Rheum Dis. 2007;66(12):1683–1684. doi: 10.1136/ard.2007.073759. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Schlesinger N, Mysler E, Lin HY, et al. Canakinumab reduces the risk of acute gouty arthritis flares during initiation of allopurinol treatment: results of a double-blind, randomised study. Ann Rheum Dis. 2011;70(7):1264–1271. doi: 10.1136/ard.2010.144063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Hashkes PJ, Spalding SJ, Giannini EH, et al. Rilonacept for colchicine-resistant or -intolerant familial Mediterranean fever: a randomized trial [published correction appears in Ann Intern Med Feb 2014; 18; 160(4):291–2. Ann Intern Med. 2012;157(8):533–541. doi: 10.7326/0003-4819-157-8-201210160-00003. [DOI] [PubMed] [Google Scholar]
- 25.Ben-Zvi I, Kukuy O, Giat E, et al. Anakinra for colchicine-resistant familial Mediterranean fever: a randomized, double-blind, placebo-controlled trial. Arthritis Rheumatol. 2017;69(4):854–862. doi: 10.1002/art.39995. [DOI] [PubMed] [Google Scholar]
- 26.De Benedetti F, Gattorno M, Anton J, et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. N Engl J Med. 2018;378(20):1908–1919. doi: 10.1056/NEJMoa1706314. [DOI] [PubMed] [Google Scholar]
- 27.Kallinich T, Blank N, Braun T, et al. Evidenzbasierte Therapieempfehlungen für das familiäre Mittelmeerfieber : Eine gemeinsame Stellungnahme der Gesellschaft für Kinder- und Jugendrheumatologie und der Deutschen Gesellschaft für Rheumatologie. Z Rheumatol. 2019;78(1):91–101. doi: 10.1007/s00393-018-0588-1. [DOI] [PubMed] [Google Scholar]
- 28.Demirkaya E, Erer B, Ozen S, Ben-Chetrit E. Efficacy and safety of treatments in Familial Mediterranean fever: a systematic review. Rheumatol Int. 2016;36:325–331. doi: 10.1007/s00296-015-3408-9. [DOI] [PubMed] [Google Scholar]
- 29.Erer B, Demirkaya E, Ozen S, Kallinich T. What is the best acute phase reactant for familial Mediterranean fever follow-up and its role in the prediction of complications? A systematic review. Rheumatol Int. 2016;36:483–487. doi: 10.1007/s00296-015-3413-z. [DOI] [PubMed] [Google Scholar]
- 30.The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials (2011) BMJ ;343:d5928 [DOI] [PMC free article] [PubMed]
- 31.Hayden JA, Côté P, Bombardier C. Evaluation of the quality of prognosis studies in systematic reviews. Ann Intern Med. 2006;144(6):427–437. doi: 10.7326/0003-4819-144-6-200603210-00010. [DOI] [PubMed] [Google Scholar]
- 32.Bae JM. A suggestion for quality assessment in systematic reviews of observational studies in nutritional epidemiology. Epidemiol Health. 2016;38:e2016014. doi: 10.4178/epih.e2016014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Barut K, Sahin S, Adrovic A, et al. Familial Mediterranean fever in childhood: a single-center experience. Rheumatol Int. 2018;38(1):67–74. doi: 10.1007/s00296-017-3796-0. [DOI] [PubMed] [Google Scholar]
- 34.Başaran Ö, Uncu N, Çelikel BA, et al. Interleukin-1 targeting treatment in familial Mediterranean fever: an experience of pediatric patients. Mod Rheumatol. 2015;25(4):621–624. doi: 10.3109/14397595.2014.987437. [DOI] [PubMed] [Google Scholar]
- 35.Cetin P, Sari I, Sozeri B, et al. Efficacy of interleukin-1 targeting treatments in patients with familial mediterranean Fever. Inflammation. 2015;38(1):27–31. doi: 10.1007/s10753-014-0004-1. [DOI] [PubMed] [Google Scholar]
- 36.De Benedetti F, Miettunen P, Kallinich T, et al. Genetic phenotypes impacting efficacy and safety of canakinumab in patients with colchicine-resistant FMF, TRAPS and Hids/Mkd: results from cluster study [abstract. Arthritis Rheumatol. 2017 doi: 10.1002/art.40321. [DOI] [Google Scholar]
- 37.Eroglu FK, Beşbaş N, Topaloglu R, Ozen S. Treatment of colchicine-resistant Familial Mediterranean fever in children and adolescents. Rheumatol Int. 2015;35(10):1733–1737. doi: 10.1007/s00296-015-3293-2. [DOI] [PubMed] [Google Scholar]
- 38.Knieper AM, Klotsche J, Lainka E, et al. Familial Mediterranean fever in children and adolescents: factors for colchicine dosage and predicting parameters for dose increase. Rheumatology. 2017;56(9):1597–1606. doi: 10.1093/rheumatology/kex222. [DOI] [PubMed] [Google Scholar]
- 39.Kucuksahin O, Yildizgoren MT, Ilgen U, et al. Anti-interleukin-1 treatment in 26 patients with refractory familial mediterranean fever. Mod Rheumatol. 2017;27(2):350–355. doi: 10.1080/14397595.2016.1194510. [DOI] [PubMed] [Google Scholar]
- 40.Laskari K, Boura P, Dalekos GN, et al. Longterm beneficial effect of canakinumab in colchicine-resistant familial Mediterranean fever. J Rheumatol. 2017;44(1):102–109. doi: 10.3899/jrheum.160518. [DOI] [PubMed] [Google Scholar]
- 41.Lofty HM, Marzouk H, Farag Y, et al. Serum amyloid a level in Egyptian children with familial Mediterranean fever. Int J Rheumatol. 2016 doi: 10.1155/2016/7354018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Melikoglu MA, Senel K. Non-response to colchicine in familial Mediterranean fever should be identified accurately. Int J Rheum Dis. 2017;20(12):2118–2121. doi: 10.1111/1756-185X.12374. [DOI] [PubMed] [Google Scholar]
- 43.Omma A, Sandikci SC, Kücüksahin O, et al. Can the Thiol/Disulfide imbalance be a predictor of colchicine resistance in familial Mediterranean fever? J Korean Med Sci. 2017;32(10):1588–1594. doi: 10.3346/jkms.2017.32.10.1588. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Ozen S, Kuemmerle-Deschner JB, Cimaz R, et al. International retrospective chart review of treatment patterns in severe familial Mediterranean fever, tumor necrosis factor receptor-associated periodic syndrome, and Mevalonate Kinase deficiency/Hyperimmunoglobulinemia D syndrome. Arthritis Care Res. 2017;69(4):578–586. doi: 10.1002/acr.23120. [DOI] [PubMed] [Google Scholar]
- 45.Ozer I, Mete T, Turkeli Sezer O, et al. Association between colchicine resistance and vitamin D in familial Mediterranean fever. Ren Fail. 2015;37(7):1122–1125. doi: 10.3109/0886022X.2015.1056064. [DOI] [PubMed] [Google Scholar]
- 46.Ozkan S, Atas B. Canakinumab treatment in four children with colchicine resistant familial mediterranean fever. J Pak Med Assoc. 2017;67(6):945–947. [PubMed] [Google Scholar]
- 47.Pecher AC, Igney-Oertel A, Kanz L, Henes J. Treatment of familial Mediterranean fever with anakinra in patients unresponsive to colchicine. Scand J Rheumatol. 2017;46(5):407–409. doi: 10.1080/03009742.2016.1245780. [DOI] [PubMed] [Google Scholar]
- 48.Yalcıntepe S, Ozdemır O, Sılan C, et al. The CYP4502D6 *4 and *6 alleles are the molecular genetic markers for drug response: implications in colchicine non-responder FMF patients. Eur J Drug Metab Pharmacokinet. 2016;41(3):281–286. doi: 10.1007/s13318-015-0255-8. [DOI] [PubMed] [Google Scholar]
- 49.Brenner R, Ben-Zvi I, Shinar Y, et al. Familial Mediterranean fever and incidence of cancer: an analysis of 8,534 Israeli patients with 258,803 person-years. Arthritis Rheumatol. 2018;70(1):127–133. doi: 10.1002/art.40344. [DOI] [PubMed] [Google Scholar]
- 50.Migita K, Izumi Y, Fujikawa K, et al. Dysregulated mature IL-1β production in familial Mediterranean fever. Rheumatology. 2015;54(4):660–665. doi: 10.1093/rheumatology/keu359. [DOI] [PubMed] [Google Scholar]
- 51.Akar S, Cetin P, Kalyoncu U, et al. Nationwide experience with off-label use of Interleukin-1 targeting treatment in familial Mediterranean fever patients. Arthritis Care Res. 2018;70(7):1090–1094. doi: 10.1002/acr.23446. [DOI] [PubMed] [Google Scholar]
- 52.Bayram MT, Çankaya T, Bora E, et al. Risk factors for subclinical inflammation in children with Familial Mediterranean fever. Rheumatol Int. 2015;35(8):1393–1398. doi: 10.1007/s00296-015-3227-z. [DOI] [PubMed] [Google Scholar]
- 53.Bonfrate L, Scaccianoce G, Palasciano G, et al. A novel cluster of patients with Familial Mediterranean Fever (FMF) in southern Italy. Eur J Clin Invest. 2017;47(9):622–629. doi: 10.1111/eci.12783. [DOI] [PubMed] [Google Scholar]
- 54.Bonyadi MJ, Somi MH, Khoshknab MM, et al. FMF Genotype-phenotype correlation in Iranian Azeri Turks: association between M694V/R761H mutation and amyloidosis. Iran J Basic Med Sci. 2015;18(7):659–663. [PMC free article] [PubMed] [Google Scholar]
- 55.Corsia A, Georgin-Lavialle S, Hentgen V, et al. A survey of resistance to colchicine treatment for French patients with familial Mediterranean fever. Orphanet J Rare Dis. 2017;12(1):54. doi: 10.1186/s13023-017-0609-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Demirkaya E, Acikel C, Hashkes P, et al. Development and initial validation of international severity scoring system for familial Mediterranean fever (ISSF) Ann Rheum Dis. 2016;75(6):1051–1056. doi: 10.1136/annrheumdis-2015-208671. [DOI] [PubMed] [Google Scholar]
- 57.Dogan H, Bayrak FO, Emet M, et al. Familial Mediterranean fever gene mutations in north-eastern part of Anatolia with special respect to rare mutations. Gene. 2015;568(2):170–175. doi: 10.1016/j.gene.2015.05.045. [DOI] [PubMed] [Google Scholar]
- 58.Erden A, Batu ED, Sarı A, et al. Which definition should be used to determine colchicine resistance among patients with familial Mediterranean fever? Clin Exp Rheumatol. 2018;36(6 Suppl 115):97–102. [PubMed] [Google Scholar]
- 59.Herscovici T, Merlob P, Stahl B, et al. Colchicine use during breastfeeding. Breastfeed Med. 2015;10(2):92–95. doi: 10.1089/bfm.2014.0086. [DOI] [PubMed] [Google Scholar]
- 60.Konukbay D, Gattorno M, Yildiz D. A novel assessment tool for clinical care of patients with autoinflammatory disease: juvenile autoinflammatory disease multidimensional assessment report. Clin Exp Rheumatol. 2016;34(6 Suppl 102):129–135. [PubMed] [Google Scholar]
- 61.Özçakar ZB, Özdel S, Yılmaz S, et al. Anti-IL-1 treatment in familial Mediterranean fever and related amyloidosis. Clin Rheumatol. 2016;35(2):441–446. doi: 10.1007/s10067-014-2772-2. [DOI] [PubMed] [Google Scholar]
- 62.Özdel S, Özçakar ZB, Kunt SŞ, et al. Late-onset disease is associated with a mild phenotype in children with familial Mediterranean fever. Clin Rheumatol. 2016;35(7):1837–1840. doi: 10.1007/s10067-016-3196-y. [DOI] [PubMed] [Google Scholar]
- 63.Proft F, Fleck M, Fiehn C, et al. Efficacy and safety analysis of off-label treatment with biologics in autoinflammatory diseases: Experiences from a German registry (GRAID2) Z Rheumatol. 2018;77(1):46–54. doi: 10.1007/s00393-017-0329-x. [DOI] [PubMed] [Google Scholar]
- 64.Rossi-Semerano L, Fautrel B, Wendling D, et al. Tolerance and efficacy of off-label anti-interleukin-1 treatments in France: a nationwide survey. Orphanet J Rare Dis. 2015;10:19. doi: 10.1186/s13023-015-0228-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Stankovic Stojanovic K, Hentgen V, Fellahi S, et al. Concordance between CRP and SAA in familial Mediterranean fever during attack-free period: a study of 218 patients. Clin Biochem. 2017;50(4–5):206–209. doi: 10.1016/j.clinbiochem.2016.11.008. [DOI] [PubMed] [Google Scholar]
- 66.Topaloglu R, Batu ED, Yıldız Ç, et al. Familial Mediterranean fever patients homozygous for E148Q variant may have milder disease. Int J Rheum Dis. 2018;21(10):1857–1862. doi: 10.1111/1756-185X.12929. [DOI] [PubMed] [Google Scholar]
- 67.Vitale A, Insalaco A, Sfriso P, et al. A snapshot on the on-label and off-label use of the interleukin-1 inhibitors in Italy among rheumatologists and pediatric rheumatologists: a nationwide multi-center retrospective observational study. Front Pharmacol. 2016;7:380. doi: 10.3389/fphar.2016.00380. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Yesilkaya S, Acikel C, Fidanci BE, et al. Development of a medication adherence scale for familial Mediterranean fever (MASIF) in a cohort of Turkish children. Clin Exp Rheumatol. 2015;33(6 Suppl 94):S156–S162. [PubMed] [Google Scholar]
- 69.Yoldaş TÇ, Çakar N, Başaran Ö, et al. The effect of colchicine and disease severity on physical growth in children with familial Mediterranean fever. Clin Rheumatol. 2016;35(6):1603–1607. doi: 10.1007/s10067-015-3077-9. [DOI] [PubMed] [Google Scholar]
- 70.Alaygut D, Kilic SC, Kaya A, et al. Assessment of 17 pediatric cases with colchicine poisoning in a 2-year period. Pediatr Emerg Care. 2016;32(3):168–172. doi: 10.1097/PEC.0000000000000728. [DOI] [PubMed] [Google Scholar]
- 71.Rom E, Amarilyo G, Levinski Y, et al. Protracted febrile myalgia syndrome treated with pulse of corticosteroids. Semin Arthritis Rheum. 2018;47(6):897–899. doi: 10.1016/j.semarthrit.2017.10.008. [DOI] [PubMed] [Google Scholar]
- 72.Venhoff N, Voll RE, Glaser C, Thiel J. IL-1-blockade with Anakinra during pregnancy : retrospective analysis of efficacy and safety in female patients with familial Mediterranean fever. Z Rheumatol. 2018;77(2):127–134. doi: 10.1007/s00393-017-0354-9. [DOI] [PubMed] [Google Scholar]
- 73.Haj Yahia S, Ben Zvi I, Livneh A. Colchicine intoxication in familial Mediterranean fever patients using clarithromycin for the treatment of Helicobacter pylori: a series of six patients. Rheumatol Int. 2018;38(1):141–147. doi: 10.1007/s00296-017-3823-1. [DOI] [PubMed] [Google Scholar]
- 74.Yilmaz S, Cinar M, Simsek I, et al. Tocilizumab in the treatment of patients with AA amyloidosis secondary to familial Mediterranean fever. Rheumatology. 2015;54(3):564–565. doi: 10.1093/rheumatology/keu474. [DOI] [PubMed] [Google Scholar]
- 75.Youngstein T, Hoffmann P, Gül A, et al. International multi-centre study of pregnancy outcomes with interleukin-1 inhibitors. Rheumatology. 2017;56(12):2102–2108. doi: 10.1093/rheumatology/kex305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.De Benedetti F, A J, Ben-Chetrit E, Calvo I et al (2016) Efficacy and safety of canakinumab in patients with colchicine-resistant familial mediterranean fever, hyper-immunoglobulin d syndrome/mevalonate kinase deficiency and tnf receptor-associated periodic syndrome: 40 week results from the pivotal phase 3 umbrella cluster trial. 2016 ACR/ARHP Annual Meeting, abstract nr. 3205
- 77.Koné-Paut I, Hofer M, Benseler S et al (2017) Improvement of disease activity in patients with Colchicine-resistant FMF, Hids/Mkd and TRAPS assessed by autoinflammatory disease activity index (AIDAI): results from a randomized phase III trial [abstract]. Arthritis Rheumatol 69(suppl 10):376
- 78.Ozen S, Kone-Paut I, Hofer M, et al. Efficacy, safety, pharmacokinetics and pharmacodynamics of canakinumab in patients with colchicine-resistant fmf: results from the phase 3 cluster trial. In: Proceedings of the 24th Paediatric Rheumatology European Society Congress: Part two: Athens, Greece. 14–17 September 2017. Pediatr. Rheumatol. Online J. 2017;15(Suppl 2):65 (P182). [Google Scholar]
- 79.Polat A, Acikel C, Sozeri B, et al. Comparison of the efficacy of once- and twice-daily colchicine dosage in pediatric patients with familial Mediterranean fever—a randomized controlled noninferiority trial. Arthritis Res Ther. 2016;18:85. doi: 10.1186/s13075-016-0980-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Erken E, Erken E. Cardiac disease in familial Mediterranean fever. Rheumatol Int. 2018;38(1):51–58. doi: 10.1007/s00296-017-3853-8. [DOI] [PubMed] [Google Scholar]
- 81.Gül A. Approach to the patients with inadequate response to colchicine in familial Mediterranean fever. Best Pract Res Clin Rheumatol. 2016;30(2):296–303. doi: 10.1016/j.berh.2016.09.001. [DOI] [PubMed] [Google Scholar]
- 82.Haviv R, Hashkes PJ. Canakinumab investigated for treating familial Mediterranean fever. Expert Opin Biol Ther. 2016;16(11):1425–1434. doi: 10.1080/14712598.2016.1233963. [DOI] [PubMed] [Google Scholar]
- 83.Koga T, Migita K, Kawakami A. Biologic therapy in familial Mediterranean fever. Mod Rheumatol. 2016;26(5):637–641. doi: 10.3109/14397595.2016.1162261. [DOI] [PubMed] [Google Scholar]
- 84.Lachmann HJ, Brogan PA. Autoinflammation: when is familial Mediterranean fever ‘severe’? Nat Rev Rheumatol. 2016;12(5):256–258. doi: 10.1038/nrrheum.2016.55. [DOI] [PubMed] [Google Scholar]
- 85.Ozdogan H, Ugurlu S. Canakinumab for the treatment of familial Mediterranean fever. Expert Rev Clin Immunol. 2017;13(5):393–404. doi: 10.1080/1744666X.2017.1313116. [DOI] [PubMed] [Google Scholar]
- 86.Özen S, Batu ED, Demir S. Familial Mediterranean fever: recent developments in pathogenesis and new recommendations for management. Front Immunol. 2017;8:253. doi: 10.3389/fimmu.2017.00253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Ozen S, Kone-Paut I, Gül A. Colchicine resistance and intolerance in familial mediterranean fever: definition, causes, and alternative treatments. Semin Arthritis Rheum. 2017;47(1):115–120. doi: 10.1016/j.semarthrit.2017.03.006. [DOI] [PubMed] [Google Scholar]
- 88.Sozeri B, Kasapcopur O. Biological agents in familial Mediterranean fever focusing on colchicine resistance and amyloidosis. Curr Med Chem. 2015;22(16):1986–1991. doi: 10.2174/0929867322666150311152300. [DOI] [PubMed] [Google Scholar]
- 89.Terreri MT, Bernardo WM, Len CA, et al. Guidelines for the management and treatment of periodic fever syndromes familial Mediterranean fever. Rev Bras Reumatol. 2016;56(1):37–43. doi: 10.1016/j.rbre.2015.08.019. [DOI] [PubMed] [Google Scholar]
- 90.van der Hilst JCH, Moutschen M, Messiaen PE, et al. Efficacy of anti-IL-1 treatment in familial Mediterranean fever: a systematic review of the literature. Biologics. 2016;10:75–80. doi: 10.2147/BTT.S102954. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Wu B, Xu T, Li Y, Yin X. Interventions for reducing inflammation in familial Mediterranean fever. Cochrane Database Syst Rev. 2015 doi: 10.1002/14651858.CD010893.pub3. [DOI] [PubMed] [Google Scholar]
- 92.Dinarello CA, Wolff SM, Goldfinger SE, et al. Colchicine therapy for familial Mediterranean fever. A double-blind trial. N Engl J Med. 1974;291(18):934–937. doi: 10.1056/NEJM197410312911804. [DOI] [PubMed] [Google Scholar]
- 93.Levy M, Eliakim M. Long-term colchicine prophylaxis in familial Mediterranean fever. Brit Med J. 1977;2(6090):808. doi: 10.1136/bmj.2.6090.808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Lehman TJ, Peters RS, Hanson V, Schwabe A. Long-term colchicine therapy of familial Mediterranean fever. J Pediatr. 1978;93(5):876–878. doi: 10.1016/s0022-3476(78)81107-x. [DOI] [PubMed] [Google Scholar]
- 95.Majeed HA, Carroll JE, Khuffash FA, Hijazi Z. Long-term colchicine prophylaxis in children with familial Mediterranean fever (recurrent hereditary polyserositis) J Pediatr. 1990;116(6):997–999. doi: 10.1016/s0022-3476(05)80667-5. [DOI] [PubMed] [Google Scholar]
- 96.Majeed HA, Barakat M. Familial Mediterranean fever (recurrent hereditary polyserositis) in children: analysis of 88 cases. Eur J Pediatr. 1989;148(7):636–641. doi: 10.1007/BF00441519. [DOI] [PubMed] [Google Scholar]
- 97.Zemer D, Livneh A, Danon YL, et al. Long-term colchicine treatment in children with familial Mediterranean fever. Arthritis Rheum. 1991;34(8):973–977. doi: 10.1002/art.1780340806. [DOI] [PubMed] [Google Scholar]
- 98.Wallace SL, Ertel NH. Occupancy approach to colchicine dosage. Lancet. 1970;2(7685):1250–1251. doi: 10.1016/s0140-6736(70)92206-3. [DOI] [PubMed] [Google Scholar]
- 99.Chappey ON, Niel E, Wautier JL, et al. Colchicine disposition in human leukocytes after single and multiple oral administration. Clin Pharmacol Ther. 1993;54(4):360–367. doi: 10.1038/clpt.1993.161. [DOI] [PubMed] [Google Scholar]
- 100.Fradkin A, Yahav J, Zemer D, Jonas A. Colchicine-induced lactose malabsorption in patients with familial Mediterranean fever. Isr J Med Sci. 1995;31(10):616–620. [PubMed] [Google Scholar]
- 101.Lidar M, Livneh A. Familial Mediterranean fever: clinical, molecular and management advancements. Neth J Med. 2007;65(9):318–324. [PubMed] [Google Scholar]
- 102.Terkeltaub RA, Furst DE, Digiacinto JL, et al. Novel evidence-based colchicine dose-reduction algorithm to predict and prevent colchicine toxicity in the presence of cytochrome P450 3A4/P-glycoprotein inhibitors. Arthritis Rheum. 2011;63(11):3521. doi: 10.1002/art.30389. [DOI] [PubMed] [Google Scholar]
- 103.Buskila D, Zaks N, Neumann L, et al. Quality of life of patients with familial Mediterranean fever. Clin Exp Rheumatol. 1997;15(4):355–360. [PubMed] [Google Scholar]
- 104.Makay B, Unsal E, Arslan N, Varni JW. Health-related quality of life of school-age children with familial Mediterranean fever. Clin Exp Rheumatol. 2009;27(2 Suppl 53):S96–S101. [PubMed] [Google Scholar]
- 105.Deger SM, Ozturk MA, Demirag MD, et al. Health-related quality of life and its associations with mood condition in familial Mediterranean fever patients. Rheumatol Int. 2011;31(5):623–628. doi: 10.1007/s00296-009-1334-4. [DOI] [PubMed] [Google Scholar]
- 106.Giese A, Kurucay M, Kilic L, et al. Quality of life in adult patients with Familial Mediterranean fever living in Germany or Turkey compared to healthy subjects: a study evaluating the effect of disease severity and country of residence. Rheumatol Int. 2013;33(7):1713–1719. doi: 10.1007/s00296-012-2622-y. [DOI] [PubMed] [Google Scholar]
- 107.Sahin S, Yalcin I, Senel S, et al. Assessment life quality of familial Mediterranean fever patients by short form-36 and its relationship with disease parameters. Eur Rev Med Pharmacol Sci. 2013;17(7):958–963. [PubMed] [Google Scholar]
- 108.Pras E, Livneh A, Balow JE, Jr, et al. Clinical differences between North African and Iraqi Jews with familial Mediterranean fever. Am J Med Genet. 1998;75(2):216–219. doi: 10.1002/(sici)1096-8628(19980113)75:2<216::aid-ajmg20>3.0.co;2-r. [DOI] [PubMed] [Google Scholar]
- 109.Mor A, Shinar Y, Zaks N, et al. Evaluation of disease severity in familial Mediterranean fever. Semin Arthritis Rheum. 2005;35(1):57–64. doi: 10.1016/j.semarthrit.2005.02.002. [DOI] [PubMed] [Google Scholar]
- 110.Kalkan G, Demirkaya E, Ozen S. Severity scoring system for paediatric FMF. Nat Rev Rheumatol. 2012;8(10):621. doi: 10.1038/nrrheum.2012.54-c1. [DOI] [PubMed] [Google Scholar]
- 111.Piram M, Frenkel J, Gattorno M, et al. A preliminary score for the assessment of disease activity in hereditary recurrent fevers: results from the AIDAI (Auto-Inflammatory Diseases Activity Index) Consensus Conference. Ann Rheum Dis. 2011;70(2):309–314. doi: 10.1136/ard.2010.132613. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 112.Ozen S, Demirkaya E, Duzova A, et al. FMF50: a score for assessing outcome in familial Mediterranean fever. Ann Rheum Dis. 2014;73(5):897–901. doi: 10.1136/annrheumdis-2013-204719. [DOI] [PubMed] [Google Scholar]
- 113.Lachmann HJ, Sengül B, Yavuzşen TU, et al. Clinical and subclinical inflammation in patients with familial Mediterranean fever and in heterozygous carriers of MEFV mutations. Rheumatology. 2006;45(6):746–750. doi: 10.1093/rheumatology/kei279. [DOI] [PubMed] [Google Scholar]
- 114.Korkmaz C, Ozdogan H, Kasapçopur O, Yazici H. Acute phase response in familial Mediterranean fever. Ann Rheum Dis. 2002;61(1):79–81. doi: 10.1136/ard.61.1.79. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 115.Duzova A, Bakkaloglu A, Besbas N, et al. Role of A-SAA in monitoring subclinical inflammation and in colchicine dosage in familial Mediterranean fever. Clin Exp Rheumatol. 2003;21(4):509–514. [PubMed] [Google Scholar]
- 116.Sneh E, Pras M, Michaeli D, et al. Protracted arthritis in familial Mediterranean fever. Rheumatol Rehabil. 1977;16(2):102–106. doi: 10.1093/rheumatology/16.2.102. [DOI] [PubMed] [Google Scholar]
- 117.Kaushansky K, Finerman GA, Schwabe AD. Chronic destructive arthritis in familial Mediterranean fever: the predominance of hip involvement and its management. Clin Orthop Relat Res. 1981;155:156–161. [PubMed] [Google Scholar]
- 118.Kaşifoğlu T, Calişir C, Cansu DU, Korkmaz C. The frequency of sacroiliitis in familial Mediterranean fever and the role of HLA-B27 and MEFV mutations in the development of sacroiliitis. Clin Rheumatol. 2009;28(1):41–46. doi: 10.1007/s10067-008-0980-3. [DOI] [PubMed] [Google Scholar]
- 119.Langevitz P, Livneh A, Zemer D, et al. Seronegative spondyloarthropathy in familial Mediterranean fever. Semin Arthritis Rheum. 1997;27(2):67–72. doi: 10.1016/s0049-0172(97)80007-8. [DOI] [PubMed] [Google Scholar]
- 120.Kaplan E, Mukamel M, Barash J, et al. Protracted febrile myalgia in children and young adults with familial Mediterranean fever: analysis of 15 patients and suggested criteria for working diagnosis. Clin Exp Rheumatol. 2007;25(4 Suppl 45):S114–S117. [PubMed] [Google Scholar]
- 121.Majeed HA, Al-Qudah AK, Qubain H, Shahin HM. The clinical patterns of myalgia in children with familial Mediterranean fever. Semin Arthritis Rheum. 2000;30(2):138–143. doi: 10.1053/sarh.2000.16646. [DOI] [PubMed] [Google Scholar]
- 122.Langevitz P, Zemer D, Livneh A, et al. Protracted febrile myalgia in patients with familial Mediterranean fever. J Rheumatol. 1994;21(9):1708–1709. [PubMed] [Google Scholar]
- 123.Kaiser C, Knight A, Nordström D, et al. Injection-site reactions upon Kineret (anakinra) administration: experiences and explanations. Rheumatol Int. 2012;32(2):295–299. doi: 10.1007/s00296-011-2096-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 124.Bodar EJ, Kuijk LM, Drenth JP, et al. On-demand anakinra treatment is effective in mevalonate kinase deficiency. Ann Rheum Dis. 2011;70(12):2155–2158. doi: 10.1136/ard.2011.149922. [DOI] [PubMed] [Google Scholar]
- 125.Grimwood C, Despert V, Jeru I, Hentgen V. On-demand treatment with anakinra: a treatment option for selected TRAPS patients. Rheumatology. 2015;54(9):1749–1751. doi: 10.1093/rheumatology/kev111. [DOI] [PubMed] [Google Scholar]
- 126.Imazio M, Brucato A, Cemin R, et al. Colchicine for recurrent pericarditis (CORP): a randomized trial. Ann Intern Med. 2011;155(7):409–414. doi: 10.7326/0003-4819-155-7-201110040-00359. [DOI] [PubMed] [Google Scholar]
- 127.Imazio M, Brucato A, Cemin R, et al. A randomized trial of colchicine for acute pericarditis. N Engl J Med. 2013;369(16):1522–1528. doi: 10.1056/NEJMoa1208536. [DOI] [PubMed] [Google Scholar]
- 128.Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med. 2017;377(12):1119–1131. doi: 10.1056/NEJMoa1707914. [DOI] [PubMed] [Google Scholar]
- 129.Ridker PM, MacFadyen JG, Everett BM, et al. Relationship of C-reactive protein reduction to cardiovascular event reduction following treatment with canakinumab: a secondary analysis from the CANTOS randomised controlled trial. Lancet. 2018;391(10118):319–328. doi: 10.1016/S0140-6736(17)32814-3. [DOI] [PubMed] [Google Scholar]
- 130.Tardif JC, Kouz S, Waters DD, et al. Efficacy and safety of low-dose Colchicine after myocardial infarction. N Engl J Med. 2019;381(26):2497–2505. doi: 10.1056/NEJMoa1912388. [DOI] [PubMed] [Google Scholar]
- 131.Ozen S, Ben-Chetrit E, Foeldvari I, et al. Long-term efficacy and safety of canakinumab in patients with colchicine-resistant familial Mediterranean fever: results from the randomised phase III CLUSTER trial. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-217419. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Kuemmerle-Deschner JB, Gautam R, George AT, et al. A systematic literature review of efficacy, effectiveness and safety of biologic therapies for treatment of familial Mediterranean fever. Rheumatology. 2020 doi: 10.1093/rheumatology/keaa205. [DOI] [PubMed] [Google Scholar]
- 133.Balcı-Peynircioğlu B, Kaya-Akça Ü, Serap Arıcı Z, et al. Comorbidities in familial Mediterranean fever: analysis of 2000 genetically confirmed patients. Rheumatology. 2020;59(6):1372–1380. doi: 10.1093/rheumatology/kez410. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.