Abstract
目的
制备并通过体外实验评价一种新型猪小肠黏膜下层(small intestinal submucosa, SIS)海绵的基本性能,建立动物模型评价其体内促成骨能力。
方法
采用冷冻干燥法制备SIS海绵,通过环境扫描电镜观察微观结构和孔径大小,比重法检测孔隙率和吸水率,万能力学试验机测试其机械性能,细胞增殖-毒性检测评估其生物相容性。通过建立比格犬动物模型评价其体内促成骨作用,将3只比格犬前磨牙拔牙窝共计18个位点随机分为3组,放置SIS海绵作为SIS海绵组、放置Bio-Oss骨粉并覆盖Bio-Gide膜作为阳性对照组,不做处理作为空白对照组,术后分别于4周和12周取材行微计算机断层扫描技术(micro computed tomography, Micro-CT)检测,采用单因素方差分析法对数据进行统计学分析,以评估SIS海绵的促成骨效果。
结果
SIS海绵的平均孔径为(194.90±30.39) μm,孔隙率为92.31%±0.24%,吸水率为771.50%±40.90%,压缩弹性模量为(2.20±0.19) kPa。细胞增殖-毒性检测结果显示SIS海绵不会影响人骨髓间充质干细胞的早期增殖,Micro-CT结果显示术后4周时SIS海绵组骨体积分数(bone volume fraction, BV/TV, 52.81%±3.21%)和阳性对照组(58.30%±9.36%)显著高于空白对照组(38.65%±4.80%,P < 0.05),SIS海绵组骨密度[bone mineralized density, BMD, (887.09±61.02) mg/cm3]、阳性对照组[(952.05±132.78) mg/cm3]和空白对照组[(879.29±74.27) mg/cm3]差异无统计学意义(P >0.05);术后12周时SIS海绵组BV/TV(47.89%±3.59%)显著低于阳性对照组(60.57%±6.56%, P < 0.05),与空白对照组(42.99%±2.54%)差异无统计学(P >0.05),SIS海绵组BMD[(1047±89.95) mg/cm3]和阳性对照组[(1101.37±98.85) mg/cm3]显著高于空白对照组[(890.36±79.79) mg/cm3, P < 0.05]。
结论
SIS海绵具有良好的理化性能和生物相容性,在犬拔牙窝成骨早期(4周)能提高新生BV/TV,在犬拔牙窝成骨后期(12周)可提高新生BMD,具有潜在促成骨应用前景。
Keywords: 猪小肠黏膜下层海绵, 骨组织工程, 促成骨
Abstract
Objective
To prepare and evaluate the basic properties in vitro of a novel small intestinal submucosa (SIS) sponge, and to describe the bone formation ability of the SIS sponge in vivo.
Methods
The SIS sponge was prepared by freeze-drying method. To evaluate the physicochemical properties of the sponge, electron microscope observation, porosity test, water absorption ability and mechanical property were conducted in vitro. The cytotoxicity of the SIS sponge was performed by cell counting kit-8 method. In vivo experiments, eighteen extraction sockets of premolar of three Beagle dogs were randomly divided into three groups: SIS sponge group (SIS sponge), positive control group (Bio-Oss granules and Bio-Gide membrane) and control group(no treatment). The animals were sacrificed 4 weeks and 12 weeks after operation, and micro computed tomography (Micro-CT) was applied to measure the bone volume fraction (BV/TV) and bone mineralized density (BMD). The data were analyzed with one-way ANOVA.
Results
The average pore diameter of the SIS sponge was (194.90±30.39) μm, the porosity was 92.31%±0.24%, the water absorption rate was 771.50%±40.90%, and the compressive elastic modulus was (2.20±0.19) kPa. There was no significant difference in cell proliferation ability between SIS sponge and control group (P>0.05). Micro-CT quantitative results showed that BV/TV of SIS sponge group (52.81%±3.21%) and positive control group (58.30%±9.36%) were significantly higher than that of control group (38.65%±4.80%) 4 weeks after operation (P < 0.05). The BMD of SIS sponge group [(887.09±61.02) mg/cm3], positive control group [(952.05±132.78) mg/cm3] and control group [(879.29±74.27) mg/cm3] showed no statistical difference 4 weeks after operation (P>0.05). The BV/TV of positive control group (60.57%± 6.56%) was significantly higher than that of SIS sponge group (47.89%±3.59%) and control group (42.99%±2.54%) 12 weeks after operation (P < 0.05). BMD of SIS sponge group [(1047±89.95) mg/cm3] and positive control group [(1101.37±98.85) mg/cm3] were significantly higher than that of control group [(890.36±79.79) mg/cm3] 12 weeks after operation (P < 0.05).
Conclusion
The SIS sponge has satisfying physicochemical properties and biocompatibility. The SIS sponge significantly increased bone volume fraction in the early stage of bone formation (4 weeks) and bone mineralized density in the late stage of bone formation (12 weeks).
Keywords: Small intestinal submucosa sponge, Bone tissue engineering, Osteogenesis
牙周病、牙髓病和创伤等原因常导致牙齿无法保留,牙齿拔除后可能出现出血、感染、成骨效果不佳等问题,剩余牙槽骨的吸收为种植和美学修复带来了困难和挑战[1-2]。拔牙窝内填充骨替代材料等方法可一定程度减少拔牙后牙槽骨吸收,临床常用骨粉填充并覆盖可吸收生物膜引导骨组织再生,但骨粉等材料存在降解周期长,成骨过程中骨粉残余等缺点[3]。如何简便且有效地减少牙槽骨吸收并促进拔牙窝愈合,仍是亟待解决的问题。骨组织工程为骨缺损修复提供了新的治疗策略,支架在其中发挥为细胞提供微环境和场所、调控新骨生成等重要作用,寻找理想的支架材料成为近年来研究的热点[4-5]。细胞外基质(extracellular matrix, ECM)能够提供最接近于体内细胞生长的微环境,其中脱细胞猪小肠黏膜下层(small intestinal submucosa, SIS)作为一种来源广泛的天然ECM,其生物相容性良好,且具有生物活性,已被广泛应用于皮肤、心血管等软组织的修复[6-7]。近年来已有学者证实了SIS的内源性促成骨作用,并探索了将SIS重塑为海绵的成骨潜力,为其应用于骨缺损修复提供可能性[8-10],但将SIS海绵应用于拔牙窝骨缺损修复效果仍需进一步研究证实。
本研究拟通过制备SIS海绵,经体外实验检测其微观结构、孔径大小、孔隙率、吸水率、机械性能及细胞毒性, 并建立比格犬前磨牙拔牙窝骨缺损模型,微计算机断层扫描技术(micro computed tomography, Micro-CT)分析评估SIS海绵的促成骨效果,为SIS海绵在骨缺损修复中的应用提供实验依据。
1. 资料与方法
1.1. 主要材料与试剂
实验中主要的材料与试剂包括新鲜脱细胞猪小肠黏膜下层(北京大清生物技术股份有限公司,中国)、Bio-Oss可吸收生物膜(Geistlich公司,瑞士)、Bio-Gide可吸收生物膜(Geistlich公司,瑞士)、培养基(Gibco公司,美国)、胎牛血清(Gibco公司,美国)、青霉素(Sigma公司,美国)、链霉素(Sigma公司,美国)、胰蛋白酶(Gibco公司,美国)、细胞增殖-毒性检测试剂盒(cell counting kit-8, CCK-8, 同仁化学研究所,日本)、生理盐水、乙酸等。
1.2. 主要仪器与设备
实验中主要使用的仪器与设备包括冷冻研磨仪(SPEX公司,美国)、磁力搅拌机(北京金北德工贸有限公司,中国)、精密电子天平(Mettler Toledo公司,瑞士)、万能力学试验机(Instron公司,美国)、环境扫描电镜(FEI公司,荷兰)、冻干机(Labconco公司,美国)、细胞培养箱(Thermo公司,美国)、光学显微镜(Olympus公司,日本)、Micro-CT(Siemens公司,美国)。
1.3. SIS海绵的制备
将采用机械-化学联合法制备的新鲜脱细胞湿态SIS置于冷冻研磨仪中研磨成粉末,再将SIS粉末溶于含有0.1%(质量分数)胃蛋白酶和3%(体积分数)乙酸的水溶液中,配制成浓度为40 g /L的SIS溶液,并于磁力搅拌器下搅拌48 h,将此溶液倒入硅胶模具(1 cm×1 cm×1 cm)中,于冻干机中冻干24 h(-80 ℃、1.62 MPa),完成SIS海绵制备,消毒备用。
1.4. SIS海绵基本性能检测
1.4.1. 环境扫描电镜观察
采用环境扫描电镜观察SIS海绵的微观结构,工作电压为15 kV。通过微观形貌图像分析孔隙分布,运用Image J软件对图像进行处理,并统计分析SIS海绵的孔径。
1.4.2. 孔隙率测试
将SIS海绵(n=3)称重(ms),精确至0.000 1 g,在10 mL比重瓶倒满蒸馏水后称重(m1),将SIS海绵浸入蒸馏水中,超声波震荡一段时间,向瓶中加蒸馏水直至充满,称重(m2)。取出吸满蒸馏水的SIS海绵,称剩余的蒸馏水与比重瓶的质量(m3),每个SIS海绵测量5次取平均值。孔隙率计算公式:P=(m2-m3-ms)/(m1-m3)×100%。
1.4.3. 吸水率测试
将SIS海绵(n=3)称重(n1),精确至0.000 1 g,浸入室温下的蒸馏水中,待SIS海绵充分吸水后,将其夹出水面,待液滴自然滴落后称重(n2),计算吸收水分的质量与SIS海绵质量之比,每个SIS海绵测量5次取平均值,吸水率计算公式W=(n2-n1)/n1×100%。
1.4.4. 机械强度测试
将SIS海绵(n=5)置于万能力学试验机上固定,进行压缩试验,加载速率为0.05 mm/s,加载量和压缩位移传入计算机并对数据进行处理,根据应力-应变曲线的斜率计算压缩弹性模量。
1.5. SIS海绵细胞毒性检测
将SIS海绵于37 ℃环境中在培养基中浸泡72 h制备浸提液,收集浸提液并用0.22 μm的滤器进行过滤除菌。分离、培养人骨髓间充质干细胞(human bone marrow mesenchymal stem cells, hBMSCs),传代至第4代,以3×103个/孔的密度接种于96孔板,SIS海绵组的培养液为含10%(体积分数)胎牛血清、100 U / mL青霉素和100 mg / mL链霉素的浸提液,空白对照组为含10%胎牛血清、100 U/mL青霉素和100 g / L链霉素的正常培养基。分别于1、3、5、7 d加入10 μL CCK-8液,37 ℃孵育2 h后于酶标仪的450 nm波长处测定各孔的光密度值(D),并进行统计学分析,实验重复3次。
1.6. 犬拔牙窝动物实验
1.6.1. 实验动物
3只健康成年比格犬,体质量10~12 kg(北京市昌扬西山养殖场提供,军事科学院实验动物室饲养)。实验动物入住至少7 d后开始实验操作,正常饮食。本实验经北京大学生物医学伦理委员会批准(批准号: LA2018293)。
1.6.2. 实验分组
实验选用3只比格犬,拔除下颌第一前磨牙(单根牙)和上、下颌第二前磨牙(双根牙)的远中根,共计18个拔牙窝位点,随机平均分为3组,每个拔牙窝行以下处理:放置SIS海绵作为SIS海绵组,放置Bio-Oss骨粉并覆盖Bio-Gide膜作为阳性对照组,不做处理作为空白对照组。手术观察时间点为4周和12周,每个时间点每组样本量为3个。
1.6.3. 手术方法
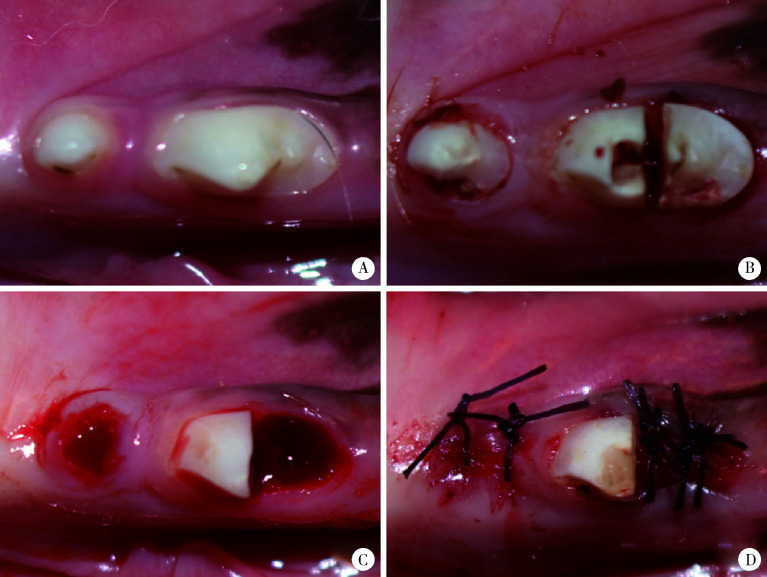
将实验犬称重,采用3%(质量分数)戊巴比妥钠按体质量1 mL/kg经犬后肢静脉注射行全身麻醉。手术过程如图 1所示,常规备皮、消毒,图 1A示术前犬前磨牙形态,将第一前磨牙直接拔除,采用分根法拔除第二前磨牙远中根,具体方法如下:持续生理盐水冷却降温下,采用牙科涡轮机将第二前磨牙分根,近中根开髓(图 1B),根管治疗后行树脂充填,将远中根拔除(图 1C)。按分组处理后缝合关闭创口(图 1D)。术后肌肉注射青霉素预防感染,80万U/d,肌肉注射3 d,口腔冲洗护理2周。
图1.
动物实验手术过程
Operation process
A, preoperation; B, pulp opening; C, extraction; D, suture.
1.6.4. 大体标本观察
术后观察实验犬的饮食、活动以及手术区的愈合情况,植入材料后1周术区软组织反应,有无出血、肿胀、伤口撕裂等现象。分别于4及12周时将犬处死,截取下颌骨前磨牙区及其周围2 cm范围的全层骨组织,并肉眼观察各拔牙窝愈合情况。
1.6.5. Micro-CT检测
将截取的犬下颌骨前磨牙区域标本行Micro-CT检测,检查系统为SIEMENS INVEON软件,检测参数为:电压为80 kV,电流为500 μA,曝光时间1 500 ms,有效体素8.89 μm,每0.6°扫描一张,360°旋转扫描,得到相应的图像,并对图像进行分析得到骨体积分数(bone volume fraction, BV/TV)、骨密度(bone mineralized density, BMD)两种骨形态定量指标。
1.7. 统计学分析
采用统计软件SPSS 23.0对实验数据进行统计学分析,计量资料以均数±标准差表示,采用单因素方差分析LSD统计数据,P < 0.05为差异有统计学意义。
2. 结果
2.1. SIS海绵大体观
SIS海绵整体呈白色,结构均匀一致,未见明显空腔和气泡等缺陷,受轻压力后可恢复原状(图 2)。
图2.
SIS海绵表面形貌
Physical appearance of SIS sponge
2.2. SIS海绵基本性能检测
用环境扫描电镜分别于300倍(图 3A)和500倍(图 3B)观察SIS海绵的微观形貌,结果显示内部呈现互相交织的网络结构,形成大量较均匀的相互连通的三维孔隙,孔径较为一致。
图3.
SIS海绵环境扫描电镜观察
Scanning electron microscope results of SIS sponge
A, ×300; B, ×500.
用Image J软件分析测量SIS海绵平均孔径为(194.90±30.39) μm,比重法测定其孔隙率为92.31%±0.24%,吸水率为771.50%±40.90%,万能力学试验机测试压缩弹性模量为(2.20±0.19) kPa。
2.3. SIS海绵细胞毒性检测
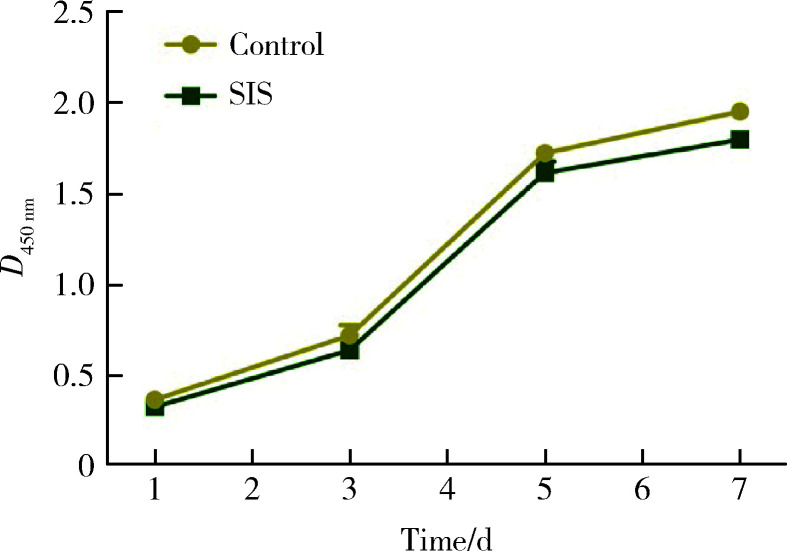
在细胞培养的第1、3、5、7天时,获取不同时间点细胞增殖情况并绘制增殖曲线,结果如图 4所示,SIS海绵组和空白对照组之间光密度值差异无统计学意义(P>0.05)。
图4.
SIS海绵对hBMSCs增殖的影响
Effect of SIS sponge on proliferation of hBMSCs
SIS, small intestinal submucoma.
2.4. 犬拔牙窝动物实验结果
术后1周拔牙窝愈合中,未见明显出血及炎症反应;术后4周及12周拔牙窝愈合情况良好,未见明显炎症反应。
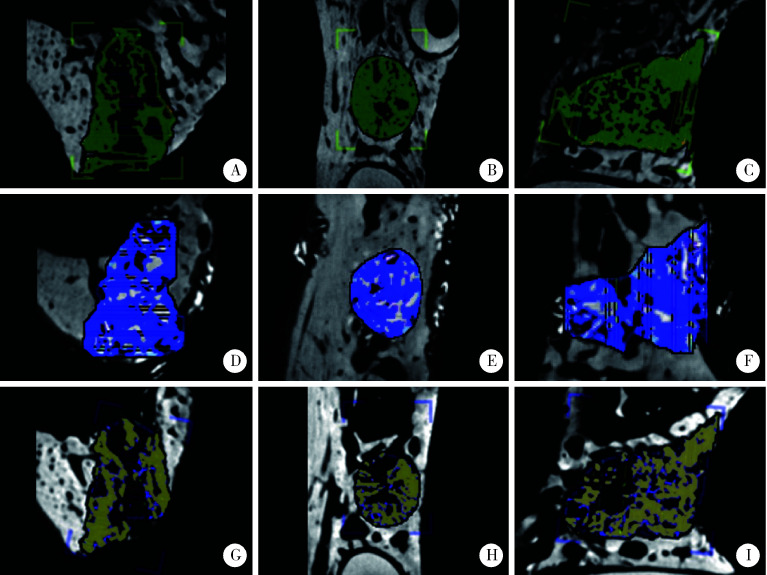
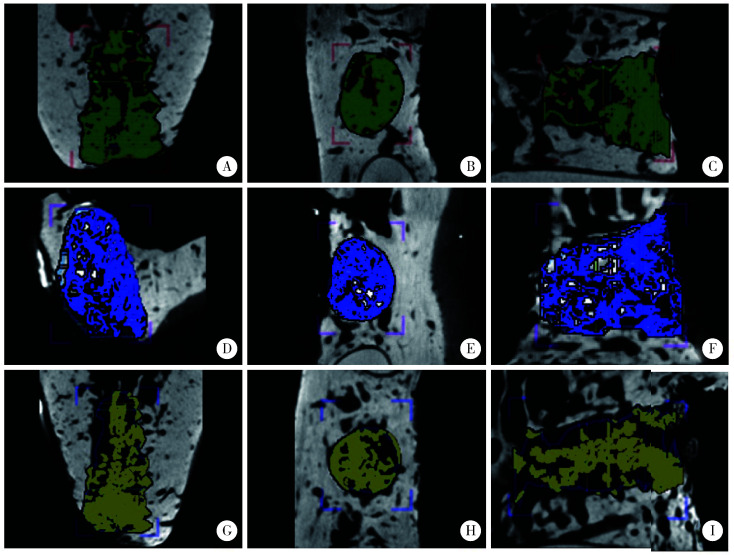
Micro-CT检测结果示术后4周各组拔牙窝内可见新生骨小梁,可识别与周围正常骨质分界,术后12周各组拔牙窝新生骨充满整个拔牙窝骨缺损区,与周围正常骨质界限不清,阳性对照组仍可见高密度骨粉残余。图 5示术后4周拔牙窝新生骨CT截图,分别于从冠状面、水平面、矢状面观察SIS海绵组(图 5A、5B、5C)、阳性对照组(图 5D、5E、5F)和空白对照组(图 5G、5H、5I)新生骨的形态与体积分布。图 6示术后12周拔牙窝新生骨CT截图,分别于从冠状面、水平面、矢状面观察SIS海绵组(图 6A、6B、6C)、阳性对照组(图 6D、6E、6F)和空白对照组(图 6G、6H、6I)新生骨的形态与体积分布。
图5.
术后4周拔牙窝新生骨冠状面、水平面、矢状面的Micro-CT扫描形态
Micro-CT images at 4 weeks after operation
A, B, C, SIS sponge group; D, E, F, positive control group; G, H, I, control group.
图6.
术后12周拔牙窝新生骨冠状面、水平面、矢状面的Micro-CT扫描形态
Micro-CT images at 12 weeks after operation
A, B, C, SIS sponge group; D, E, F, positive control group; G, H, I, control group.
根据CT值确定新生骨组织范围,定量分析骨形态指标,主要包括缺损区BV/TV及BMD。术后4周,SIS海绵组、阳性对照组、空白对照组BV/TV分别为52.81%±3.21%、58.30%±9.36%、38.65%±4.80%、BMD分别为(887.09±61.02) mg/cm3、(952.05±132.78) mg/cm3、(879.29±74.27) mg/cm3,分析表明SIS海绵组和阳性对照组BV/TV显著高于空白对照组(P < 0.05),各组BMD差异无统计学(P>0.05)。术后12周,SIS海绵组、阳性对照组、空白对照组BV/TV分别为47.89%±3.59%、60.57%±6.56%、42.99%±2.54%,BMD分别为(1047±89.95) mg/cm3、(1101.37±98.85) mg/cm3、(890.36±79.79) mg/cm3,结果显示阳性对照组BV/TV显著高于SIS海绵组和空白对照组(P < 0.05),SIS海绵组和阳性对照组BMD显著高于空白对照组(P < 0.05)。
3. 讨论
ECM具有低抗原性、生物相容性好、可降解性等理想支架应具备的性质,多项研究报道ECM支架在不同骨缺损模型中未见明显炎症反应,并可加速成骨、血管再生和矿化进程[11-12]。SIS是一种来源广泛的ECM材料,主要成分为Ⅰ型和Ⅲ型胶原,还含有纤维粘连蛋白、糖胺聚糖和多种生长因子等成分[13-14]。有学者尝试将这种在促成骨方面具有一定成分优势的ECM材料制成三维海绵,并探究其促成骨作用[15-16]。本实验选用新鲜脱细胞SIS,通过冷冻干燥法制备成SIS海绵,经CCK-8法检测显示其无细胞毒性,具有良好的生物相容性,为进一步将其应用于体内提供实验依据。
孔隙率和孔径是支架材料的重要指标,理想的孔隙率和孔径可允许血管长入和新骨形成,发挥骨引导的作用[17]。骨再生效果随孔径大小而有所差异,研究表明孔径高于100 μm时才能允许新生血管和新生骨组织长入,理想孔隙率应达到80%以上,才适合新生血管的生成,以促进骨再生[18-19]。本实验制备的SIS制备海绵平均孔径为(194.90±30.39) μm,孔隙率为92.31%±0.24%,与以往文献中理想孔径和孔隙率较为一致,在结构上具有促成骨的潜力[15, 20],但实验中为方便研磨,选用了湿态脱细胞SIS,且研磨为粉末后易吸水潮湿,如何精确筛选最佳浓度的SIS海绵仍需深入研究。
本研究建立了犬拔牙窝骨缺损模型,通过与临床常用骨填充材料和空白对照组相比较,进一步证实该SIS海绵促进骨缺损修复的能力。本研究表明在成骨早期(4周)SIS海绵可达到阳性对照组的效果,与空白对照组相比能够提高新生BV/TV,其原因可能为SIS海绵在成骨早期可为成骨细胞提供生长空间并允许营养分子扩散,这与文献报道中SIS具有显著促成骨效果相一致[16, 21]。而在成骨晚期(12周)SIS海绵新生BV/TV低于阳性对照组,可能与材料缺乏无机成骨成分、降解时间为6~8周、在成骨后期可能降解未能与成骨时间相匹配有关[22-23]。BMD是反映新生骨矿化程度的一个指标,本实验结果显示在成骨晚期(12周)SIS海绵BMD高于空白对照,这可能是由于SIS海绵能够释放生长因子,改善骨缺损区微环境,优化成骨效果[16]。本实验结果数值与Kim等[24]研究相似,比Wang等[25]研究结果略高,这可能是由于受分析方法影响,组织学的方法将会提供更直接的证据。本研究的结论也提示我们,需进一步寻找更有效的方法来提升SIS海绵的性能以提高促成骨能力。
综上所述,本研究中制备的SIS海绵具有良好的理化性能和生物相容性,在犬拔牙窝动物模型中,SIS海绵能提高成骨早期(4周)新生BV/TV,提高成骨后期(12周)新生BMD, 因此,SIS海绵有望成为一种兼具活性成分和适宜结构的新型支架材料。
References
- 1.Avilaortiz G, Elangovan S, Kramer KWO, et al. Effect of alveolar ridge preservation after tooth extraction: A systematic review and meta-analysis. J Dent Res. 2014;93(10):950–958. doi: 10.1177/0022034514541127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.López M, Fanny, Gómez M, et al. Implants failures related to endodontic treatment. An observational retrospective study. Clin Oral Implant Res. 2015;26(9):992–995. doi: 10.1111/clr.12415. [DOI] [PubMed] [Google Scholar]
- 3.Horváth A, Mardas N, Mezzomo LA, et al. Alveolar ridge preservation. A systematic review. Clin Oral Investig. 2013;17(2):341–363. doi: 10.1007/s00784-012-0758-5. [DOI] [PubMed] [Google Scholar]
- 4.Bose S, Roy M, Bandyopadhyay A. Recent advances in bone tissue engineering scaffolds. Trends Biotechnol. 2012;30(10):546–554. doi: 10.1016/j.tibtech.2012.07.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.蒋 欣泉. 骨缺损修复生物材料与骨再生. 中华口腔医学杂志. 2017;52(10):600–604. doi: 10.3760/cma.j.issn.1002-0098.2017.10.004. [DOI] [PubMed] [Google Scholar]
- 6.Andrée B, Bär A, Haverich A, et al. Small intestinal submucosa segments as matrix for tissue engineering: review. Tissue Eng Part B. 2013;19(4):279–291. doi: 10.1089/ten.teb.2012.0583. [DOI] [PubMed] [Google Scholar]
- 7.Nezhad ZM, Poncelet A, Kerchove LD, et al. Small intestinal submucosa extracellular matrix (CorMatrix ®) in cardiovascular surgery: A systematic review. Interact Cardiovasc Thorac Surg. 2016;22(6):839–850. doi: 10.1093/icvts/ivw020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Li M, Zhang C, Mao Y, et al. A cell-engineered small intestinal submucosa-based bone mimetic construct for bone regeneration. Tissue Eng Part A. 2018;24(13):1099–1111. doi: 10.1089/ten.TEA.2017.0407. [DOI] [PubMed] [Google Scholar]
- 9.房 艳, 倪 伟民, 单 伟, et al. 海绵状的小肠粘膜下层促进成骨样细胞增殖分化. 中国生物工程杂志. 2013;33(6):18–23. [Google Scholar]
- 10.Kim KS, Lee J Y, Kang YM, et al. Small intestine submucosa sponge for in vivo support of tissue-engineered bone formation in the presence of rat bone marrow stem cells. Biomaterials. 2010;31(6):1104–1113. doi: 10.1016/j.biomaterials.2009.10.020. [DOI] [PubMed] [Google Scholar]
- 11.Lin X, Chen J, Qiu P, et al. Biphasic hierarchical extracellular matrix scaffold for osteochondral defect regeneration. Osteoarthritis Cartilage. 2018;26(3):433–444. doi: 10.1016/j.joca.2017.12.001. [DOI] [PubMed] [Google Scholar]
- 12.Cunniffe GM, Díazpayno PJ, Ramey JS, et al. Growth plate extracellular matrix-derived scaffolds for large bone defect healing. Eur Cells Mater. 2017;33(1):130–142. doi: 10.22203/eCM.v033a10. [DOI] [PubMed] [Google Scholar]
- 13.Wang W, Zhang X, Chao NN, et al. Preparation and charac-terization of proangiogenic gel derived from small intestinal submucosa. Acta Biomaterialia. 2016;29(1):135–148. doi: 10.1016/j.actbio.2015.10.013. [DOI] [PubMed] [Google Scholar]
- 14.Lin X, Robinson M, Petrie T, et al. Small intestinal submucosa-derived extracellular matrix bioscaffold significantly enhances angiogenic factor secretion from human mesenchymal stromal cells. Stem Cell Res Ther. 2015;6(1):164–176. doi: 10.1186/s13287-015-0165-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kim MS, Hong KD, Shin HW, et al. Preparation of porcine small intestinal submucosa sponge and their application as a wound dressing in full-thickness skin defect of rat. Int J Biol Macromol. 2005;36(1/2):54–60. doi: 10.1016/j.ijbiomac.2005.03.013. [DOI] [PubMed] [Google Scholar]
- 16.Li M, Zhang C, Cheng M, et al. Small intestinal submucosa: A potential osteoconductive and osteoinductive biomaterial for bone tissue engineering. Mater Sci Eng C Biomim Supramol Syst. 2017;75(6):149–156. doi: 10.1016/j.msec.2017.02.042. [DOI] [PubMed] [Google Scholar]
- 17.Dimitriou R, Mataliotakis GI, Calori GM, et al. The role of barrier membranes for guided bone regeneration and restoration of large bone defects: current experimental and clinical evidence. BMC Med. 2012;10(1):81–105. doi: 10.1186/1741-7015-10-81. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Rouwkema J, Rivron NC, Blitterswijk CAV. Vascularization in tissue engineering. Trends Biotechnol. 2008;26(8):434–441. doi: 10.1016/j.tibtech.2008.04.009. [DOI] [PubMed] [Google Scholar]
- 19.Bolaños MAC, Buttigieg J, Triana JCB. Development and characterization of a novel porous small intestine submucosa-hydroxyapatite scaffold for bone regeneration. Mater Sci Eng C Biomim Supramol Syst. 2017;72(3):519–525. doi: 10.1016/j.msec.2016.11.113. [DOI] [PubMed] [Google Scholar]
- 20.孙 慧哲, 田 伟, 曾 亮, et al. 猪小肠黏膜下基质海绵的制备. 中国组织工程研究. 2016;20(21):3110–3116. doi: 10.3969/j.issn.2095-4344.2016.21.010. [DOI] [Google Scholar]
- 21.Sarkar AD, Singhvi N, Shetty JN, et al. The local effect of alendronate with intra-alveolar collagen sponges on post extraction alveolar ridge resorption: A clinical trial. J Oral Maxillofac Surg. 2015;14(2):344–356. doi: 10.1007/s12663-014-0633-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Gilbert TW, Stewartakers AM, Simmonsbyrd A, et al. Degradation and remodeling of small intestinal submucosa in canine achilles tendon repair. J Bone Joint Surg Am. 2007;89(3):621–630. doi: 10.2106/00004623-200703000-00020. [DOI] [PubMed] [Google Scholar]
- 23.Wu W, Li B, Liu Y, et al. Effect of multilaminate small intestinal submucosa as a barrier membrane on bone formation in a rabbit mandible defect model. Biomed Res Int. 2018;(2):1–11. doi: 10.1155/2018/3270293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kim JJ, Schwarz F, Song HY, et al. Ridge preservation of extraction sockets with chronic pathology using Bio-Oss Collagen with or without collagen membrane: An experimental study in dogs. Clin Oral Implant Res. 2017;(28):727–733. doi: 10.1111/clr.12870. [DOI] [PubMed] [Google Scholar]
- 25.Wang F, Li Q, Wang Z. A comparative study of the effect of Bio-Oss® in combination with concentrated growth factors or bone marrow-derived mesenchymal stem cells in canine sinus grafting. J Oral Pathol Med. 2017;46(7):528–536. doi: 10.1111/jop.12507. [DOI] [PubMed] [Google Scholar]