Abstract
Die medizinische Versorgung von Patienten, die im Zusammenhang mit der pandemischen Coronaviruserkrankung 2019 („coronavirus disease 2019“, COVID-19) erkrankt sind, stellt für die staatlichen Gesundheitssysteme weltweit eine große Herausforderung dar. Das Virus mit dem Namen „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2) zeigt eine hohe Organspezifität zu den unteren Atemwegen. Da bislang weder eine wirksame Therapie noch Impfung gegen das Virus existieren, kommt der diagnostischen Früherkennung eine große Bedeutung zu. Durch den spezifischen Aspekt der überwiegend im peripheren Lungenparenchym beginnenden Infektion ist die Lungensonographie als bildgebende Diagnostikmethode geeignet, Verdachtsfälle bereits im Frühstadium der Erkrankung als solche zu identifizieren. Serielle Ultraschalluntersuchungen an Patienten mit bestätigter Infektion können bettseitig und zeitnah Veränderungen im betroffenen Lungengewebe nachweisen. Dieser Artikel fasst das diagnostische Potenzial der Lungensonographie im Hinblick auf Screening und therapeutische Entscheidungsfindung bei Patienten mit vermuteter oder bestätigter SARS-CoV-2-Pneumonie zusammen.
Schlüsselwörter: Coronavirus, SARS-CoV-2, Airbronchogramm, B‑Linien, Lungenkonsolidierungen
Abstract
Providing medical care to patients suffering from the coronavirus disease 2019 (COVID-19) pandemic is a major challenge for government healthcare systems around the world. The new coronavirus called severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), shows a high organ specificity for the lower respiratory tract. Since there is so far no effective treatment or vaccination against the virus, early diagnostic recognition is of great importance. Due to the specific aspects of the infection, which mainly begins in the peripheral lung parenchyma, lung ultrasonography is suitable as a diagnostic imaging method to identify suspected cases as such in the early stages of the disease. Serial ultrasound examinations on patients with confirmed COVID-19 can promptly detect changes in the affected lung tissue at the bedside. This article summarizes the diagnostic potential of lung ultrasound with respect to screening and therapeutic decision-making in patients with suspected or confirmed SARS-CoV‑2 pneumonia.
Keywords: Coronavirus, SARS-CoV-2, Air bronchogramm, B‑lines, Lung consolidations
Einleitung
Nach dem Ausbruch im Dezember 2019 breitete sich die SARS-CoV-2-Infektion pandemisch über den gesamten Globus aus, sodass die Weltgesundheitsorganisation (World Health Organization, WHO) bereits am 30.01.2020 diese Entwicklung zu einem international besorgniserregenden Notfall im Bereich der öffentlichen Gesundheit erklärte. Am 19.10.2020 veröffentlichte die WHO die Anzahl von 39.944.882 bestätigten COVID-19-Fällen weltweit, von denen 1.111.998 Menschen starben (https://who.sprinklr.com).
Da bislang weder spezifische Medikamente zur Behandlung von COVID-19 noch ein nachweislich wirksamer Impfstoff gegen das Virus existieren, kommt einer frühzeitigen Diagnose der Krankheit und Isolation der infizierten Personen eine große Bedeutung zu. Diesbezüglich spielen die radiologische wie auch sonographische Bildgebung neben Blutuntersuchungen und Fluoreszenz-Echtzeit-Polymerase-Kettenreaktionstests eine wichtige Rolle, was auch an der sehr dynamisch ansteigenden Zahl von Publikationen zu dieser Thematik abzulesen ist [8, 9, 13, 17, 19, 46, 47, 49, 52, 53]. Während international mittlerweile eine Vielzahl von Fallberichten, Übersichtsartikeln und Studienergebnissen über Lungensonographie bei COVID-19 publiziert wurde, ist dieses Thema in der deutschsprachigen Fachliteratur kaum vertreten und in den maßgeblichen Empfehlungen des Robert Koch-Instituts (RKI) bislang unerwähnt [9].
Dabei ist die Lungensonographie international in der Akutmedizin etabliert und für pulmonale Erkrankungen wie das Lungenödem, das akute Lungenversagen („acute respiratory distress syndrome“, ARDS), die Pneumonie oder den Pneumothorax als bettseitige Bildgebung empfohlen [25, 43].
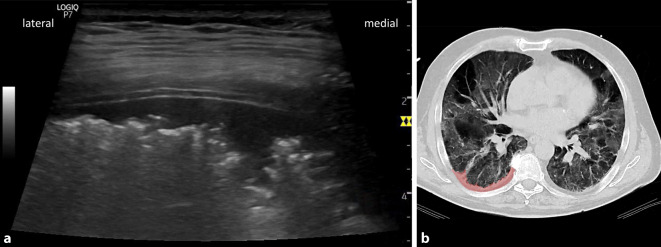
Die bei COVID-19 in CT-Untersuchungen nachweisbaren Veränderungen der Lunge werden als multifokale, häufig bilateral auftretende Milchglastrübungen („ground-glass opacity“) mit z. T. verdickten Interlobärsepten („crazy paving“) beschrieben. Abhängig vom Schweregrad der Erkrankung kommt es im Verlauf, von dorsobasal beginnend nach ventral zunehmend, zu massiven Konsolidierungen [17, 19, 28, 32, 41, 42]. In mehreren Publikationen findet sich der Hinweis, dass die radiologisch nachweisbaren pathologischen Veränderungen überwiegend in der Lungenperipherie lokalisiert sind und der dorsobasale Nachweis bereits früh nach Symptombeginn erfolgen kann [19, 29, 32]. Vergleichende Untersuchungen zu CT- und Ultraschallbefunden zeigen eine gute Übereinstimmung beider Bildgebungsverfahren in der Darstellung von infektbedingten pathologischen Lungenveränderungen bei COVID-19-Pneumonien [3, 14, 19, 28, 41, 44, 49].
Lungensonographische Befunde bei Patienten mit COVID-19
Die Anwendung der Lungensonographie bei Patienten mit nachgewiesener SARS-CoV-2-Infektion zeigt, dass nicht nur typische Befunde als Ausdruck infektbedingter subpleuraler Belüftungsstörungen zur Darstellung kommen. Vielmehr differenziert die Sonographie auch zwischen den verschiedenen Stadien der regionalen Lungenveränderungen, denen das Organ im Verlauf der Erkrankung unterliegt [8, 10, 35, 48]. Pathophysiologische Grundlage dieser Veränderungen sind subpleural beginnende alveoläre Belüftungsstörungen [34]. Diese sind nicht spezifisch für COVID-19, ebenso wenig sind es auch die lungensonographischen Befunde, die prinzipiell unabhängig von der Ursache auch bei anderen pleuralen oder subpleuralen Pathologien nachweisbar sind [25, 43]. Dagegen zeichnen sich die im Folgenden vorgestellten Sonobefunde durch eine hohe Sensitivität für COVID-19 aus. Finden sie sich im Rahmen einer umfassenden Lungensonographie nicht, kann eine SARS-CoV-2-Pneumonie mit einem negativen Vorhersagewert von 98 % nahezu sicher ausgeschlossen werden [4, 17, 41].
Lungensonographie im Kontext der Pathophysiologie von COVID-19
Das Coronavirus interagiert mit dem Renin-Angiotensin-Aldosteron-System (RAAS), indem es das Angiotensin-Converting-Enzym 2 (ACE 2) als funktionellen Rezeptor nutzt, um mit der Zellwand der Wirtszelle zu fusionieren [51]. Durch die Fusion gelangt die Virus-RNA ins Zellinnere. Das ACE 2 wird durch die Fusion, die Wirtszelle selbst später durch die ausufernde intrazelluläre Virusreproduktion zerstört. Diese ACE-2-vermittelte Virusinvasion schädigt in der Lunge sowohl Alveolarepithelien wie auch Kapillarendothelzellen, was einerseits in den infizierten Bereichen zu direkten Belüftungsstörungen aufgrund des diffusen Alveolarschadens, andererseits zu einem Kapillarleck in Verbindung mit Mikrozirkulationsstörungen aufgrund regional aktivierter Gerinnung führt [1, 23].
Das Fortschreiten der Infektion im Lungenparenchym führt konsequenterweise auch zu einem stetigen Anwachsen der subpleuralen Belüftungsstörungen und somit zu einer Reduktion der zur Verfügung stehenden alveolären Gasaustauschfläche. Die Folgen sind eine Hypoxämie und die Ausbildung von intrapulmonalen Rechts-links-Shunts.
Die zeitliche Dynamik der subpleuralen Parenchymveränderungen kann mithilfe der sonographischen Bildgebung verfolgt werden, wodurch zeitnah hilfreiche Informationen zur Optimierung der Therapie gewonnen werden können [8, 10, 17, 34, 35, 45]. Die verschiedenen lungensonographisch nachweisbaren Befunde sind in Tab. 1 zusammengefasst und werden im Folgenden näher beschrieben; mögliche aus der Sonographie ableitbare Therapieoptionen werden im Abschnitt „Ausblick“ erläutert.
| B‑Linien |
| Multiple Anzahl (>2/ICR) |
| Inhomogen verteilt |
| Bilateral |
| Bandförmige „Light-beam“-B-Linien |
| Pleuralinie |
| Verdickt, kontrastreduziert |
| Unregelmäßige Oberfläche mit Einziehungen |
| Fragmentiert durch kleine Konsolidierungen |
| Konsolidierungen |
| Subpleural unregelmäßig nach zentral begrenzt |
| Gering ausgeprägtes Airbronchogramm |
| Reduzierte Perfusion |
| Kein oder minimaler Begleiterguss |
Multiple inhomogene B-Linien-Musterung
Als primär unspezifische Immunreaktion auf ein Infektionsgeschehen im Lungenparenchym entwickelt sich ein proteinreiches interstitielles Ödem mit nachfolgender Störung der alveolär-kapillären Diffusionsstrecke. Auch in histopathologischen Befunde von Patienten mit SARS-CoV-2-Infektion wurden entsprechende diffuse Alveolarschäden nachgewiesen, die in der CT-Diagnostik als multifokale Milchglastrübung mit einem unregelmäßigen Pflastersteinmuster („crazy paving pattern“) beschrieben und als typische Befunde für eine frühe Phase der Erkrankung bezeichnet werden [1, 13, 39, 53]. Das sonographische Korrelat zu diesen CT-Befunden bilden bilateral inhomogen verteilte multiple B‑Linien mit scharf zu normalen Bereichen abgegrenzter Fokussierung (Abb. 1; [28, 35]). Das unregelmäßige fleckförmige Verteilungsmuster der B‑Linien unterscheidet sich deutlich von dem typischen Bild der homogenen bilateralen Verteilung bei einem generalisierten Lungenödem [17, 35]. Vielmehr präsentieren sich die B‑Linien bei COVID-19-Patienten in Form und regionaler Verteilung auf eine Weise, wie sie auch bei einem klassischen ARDS oder bei Lungenkontusionen zu finden sind [7]. Weitere Unterscheidungsmerkmale zwischen den verschiedenen B‑Linien generierenden Erkrankungen sind bei Betrachtung der Pleuralinie selbst zu finden, die sich bei einem generalisierten Lungenödem in der Regel glatt und mit regelmäßig ausgeprägter respiratorischer Gleitbewegung präsentiert, während sie bei einem ARDS mit oder ohne Nachweis einer SARS-CoV-2-Infektion in dem Bereich, dem die multiplen B‑Linien entspringen, eine unregelmäßige Verlaufslinie und reduziertes Lungengleiten zeigt [7, 20].
Bei einigen Patienten mit bestätigter SARS-CoV‑2 Infektion fällt besonders in den ersten Tagen nach Symptombeginn zusätzlich eine besonders breitbasige, von einer glatten Pleuralinie ausgehende Form der B‑Linien auf (Abb. 2). Diese bandförmigen Sonderformen des Artefakts werden in aktuellen Publikationen als „waterfall sign“ oder „light beam“ benannt [14, 44, 45]. Im Gegensatz zu der flackernden respiratorischen Echodynamik „normaler“ konfluierender B‑Linien bei ausgeprägtem Lungenödem verändern die „Light-beam“-Artefakte ihre Intensität im Rahmen der Respiration nur en bloc. Die spezielle Pathogenese dieses Artefakts ist zum gegenwärtigen Zeitpunkt noch unbekannt. Bemerkenswert ist jedoch, dass „Light-beam“-Artefakte bislang nur im Zusammenhang mit SARS-CoV-2-Infektionen beschrieben wurden. Ob auch noch andere pulmonale Erkrankungen diese spezifischen Artefakte auslösen können, ist aktuell Gegenstand einer Multizenterstudie [45].

Optische Veränderungen der Pleuralinie
Die Pleurablätter sind mit einer Stärke von nur 0,2–0,4 mm auch mit modernen hochauflösenden Schallköpfen nur schwer darstellbar [31]. Beim Eintritt in die Lunge erfahren die Schallwellen durch die luftgefüllten Alveolarräume unmittelbar unter der Pleura jedoch einen so hohen Impedanzsprung, dass sie nahezu total reflektiert werden. Dadurch kommt die Pleura visceralis im Sonogramm als starke echogene Struktur überproportional deutlich zur Darstellung. Diese physikalische Bildverstärkung reduziert sich, wenn der subpleurale alveoläre Luftanteil abnimmt.
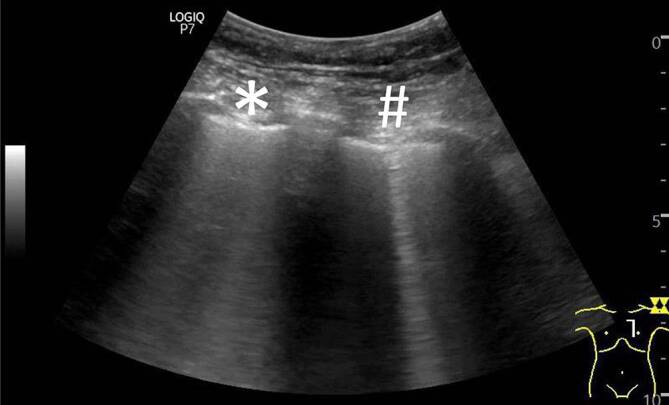
Bei COVID-19-Patienten führt dieser Mechanismus ebenfalls zu optischen Veränderungen der Pleuralinie, die jedoch in Abhängigkeit vom zeitlichen Verlauf des lokalen Infektionsgeschehens einer deutlichen Heterogenität unterliegen (verdickte Pleuralinie (Abb. 3, 4 und 5), unregelmäßige Verlaufslinie mit Einziehungen (Abb. 6), Fragmentierung der Pleuralinie (Abb. 5 und 7), Konsolidierungen unterschiedlicher Größe (Abb. 4, 5, 7, 8 und 9) [3, 14, 20, 36, 48]). Histopathologische Studien, die diese Heterogenität der Pleuradarstellung im Detail erklären könnten, fehlen derzeit noch. Aus Sicht der Autoren sind diese Befunde im Kontext der zeitlichen Entwicklung in der Frühphase der Erkrankung (eine bis 2 Wochen nach Virusexposition) zu sehen (Tab. 1). Die Abb. 3, 4 und 5 stammen von einer SARS-CoV-2-positiv getesteten Patientin ca. 10 Tage nach Symptombeginn. Alle Bilder wurden in einer Untersuchung aufgezeichnet, was die Heterogenität der möglichen Befunde auch bei nur einem Patienten unterstreicht. Die optisch verdickte, gleichzeitig aber auch kontrastreduzierte Pleuralinie resultiert dementsprechend aus beginnender subpleuraler alveolärer Belüftungsstörung im infizierten Areal (Abb. 3). Mit Vergrößerung des lokalen Alveolarschadens durch die Virusinvasion können im Ultraschallbild multiple, unregelmäßig verteilte kleine Konsolidierungen nachgewiesen werden. Die Impedanz des konsolidierten Lungenparenchyms nähert sich mit Zunahme der Belüftungsstörung immer mehr der der Pleura an, was im Sonogramm zu punktuellen optischen Lücken in der Pleuralinie führt (Abb. 4 und 5). Die Pleuralinie erscheint dadurch fragmentiert [11, 20, 45].
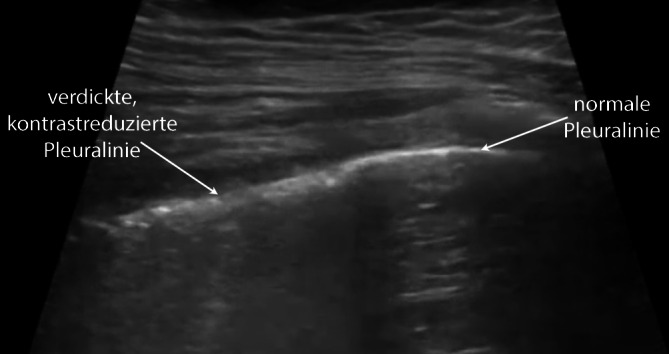
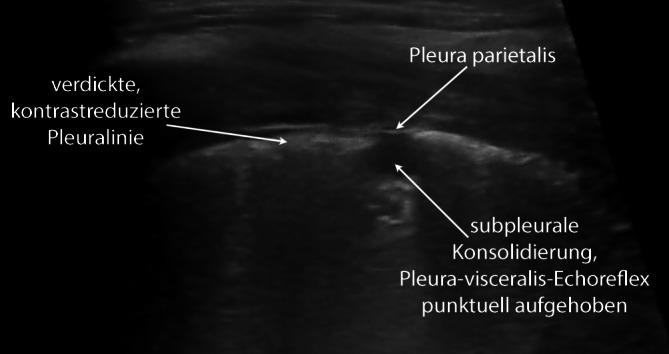
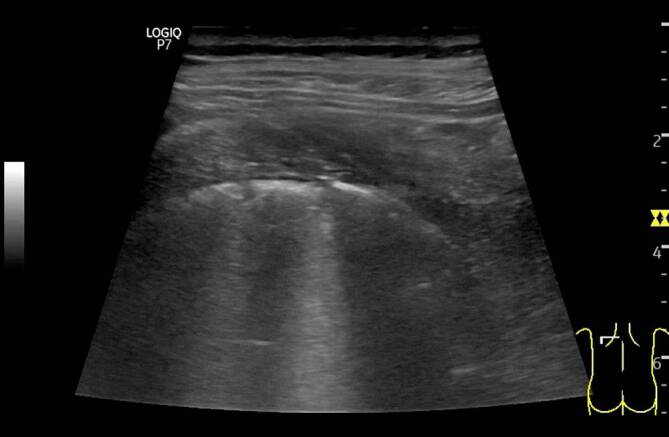
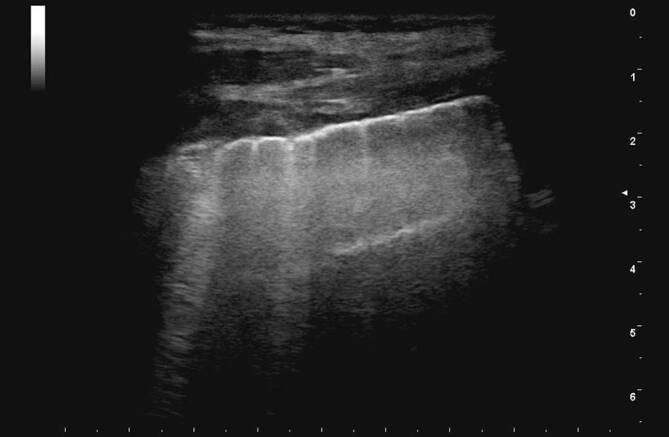
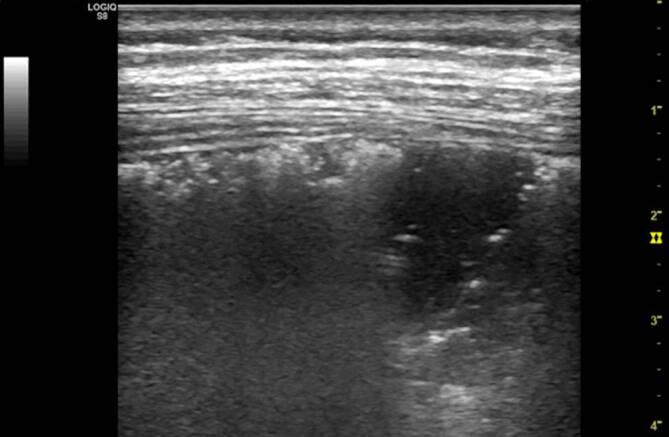
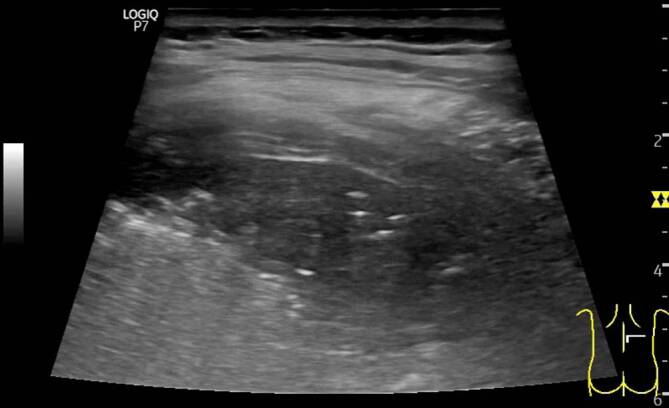
Diese für kleine subpleurale Belüftungsstörungen typischen optischen Veränderungen der Pleuralinie können analog zu den B‑Linien ebenfalls durch eine Vielzahl von pulmonalen Störungen erzeugt werden. Pathognomonisch für COVID-19 könnten jedoch die fulminante Befundentwicklung und die unregelmäßige bilaterale Verteilung der scharf gegen normale Bereiche abgegrenzten Areale sein [45], da diese Befundkonstellation bislang weder bei chronischen noch akuten Lungenerkrankungen beschrieben wurde.
Besonderheiten der Parenchymkonsolidierungen bei COVID‑19
Im weiteren Krankheitsverlauf können die zunächst kleinen subpleuralen Konsolidierungsareale v. a. in den schwerkraftabhängigen dorsobasalen Lungenbezirken zu großflächigen Konsolidierungen verschmelzen [13, 34, 35, 37]. Diese Konsolidierungen enthalten kaum noch Restluftanteile und sind daher mit dem Ultraschall sehr gut darstellbar (Abb. 8a und 9). In dieser Phase der Erkrankung verstärkten sich in der Regel auch die typischen Symptome Fieber, Kraftlosigkeit und Dyspnoe bis hin zur respiratorischen Insuffizienz [34, 35].
In der sonographischen Darstellung dieser z. T. massiven und langstreckigen subpleuralen Konsolidierungen sind einige Besonderheiten bemerkenswert, die als Unterscheidungskriterien zu pneumonischen Infiltraten bakterieller Genese dienen können:
Infiltrate bakteriellen Ursprungs weisen regelhaft alveoläre Restluftanteile auf, die im Ultraschall als kleine hyperechogene, atemverschiebliche Reflexe innerhalb des Infiltrats zu erkennen sind und als dynamisches Airbronchogramm bezeichnet werden [16, 30, 43]. Für Konsolidierungen, die im Verlauf einer Viruspneumonie entstehen, wurden diese Airbronchogramme jedoch nur als sehr gering ausgeprägt beschrieben [21, 40], ein sonomorphologischer Aspekt, der auch bei eigenen Untersuchungen an schwer kranken, beatmeten Patienten mit nachgewiesener SARS-CoV‑2 Infektion darstellbar war (Abb. 7, 8a und 9). Für die Behandlung von COVID-19-Patienten könnte dieser Aspekt nach Ansicht der Autoren von Bedeutung sein, da sowohl der initiale Nachweis wie auch die Entwicklung von Konsolidierungsarealen mit dynamischem Airbronchogramm im späteren Verlauf als Hinweis auf eine bakterielle Superinfektion eine supportive antibiotische Therapie indizieren würde.
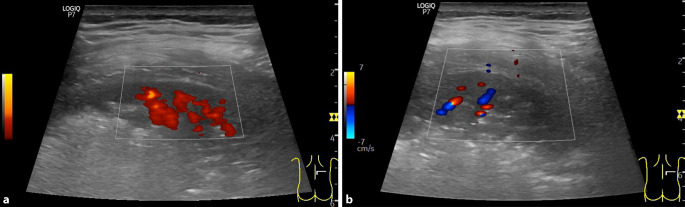
Auch in der Perfusion der konsolidierten Parenchymbezirke lassen sich Unterschiede feststellen, wenngleich diese nicht so auffällig sind. Bakteriell induzierte pneumonische Infiltrate präsentieren in der Farbdopplersonographie verstärkt astförmige Gefäße, die Segmentarterien der A. pulmonalis, den sog. Vasa publica der Lunge, entsprechen [12]. Für Konsolidierungen, die im Rahmen schwerer Verläufe einer SARS-CoV-2-Pneumonie entstanden sind, wurde jedoch beschrieben, dass in diesen Arealen kaum noch Perfusionssignale nachweisbar waren [14, 20]. Histopathologische Post-mortem-Befunde konnten in den Konsolidierungen u. a. Kapillarstauung und eine Vielzahl von Mikrothrombosierungen in Verbindung mit intraalveolärer Fibrinexsudation als vorherrschende Schädigung nachweisen [1, 23]. Eine post mortem durchgeführte Vergleichsuntersuchung zeigte eine hohe Übereinstimmung von sonographisch darstellbaren Lungenkonsolidierungen und histologisch nachweisbaren Alveolarschäden [2]. Zu diesen Schädigungen passende sonographische Befunde konnte auch in der eigenen Patientenklientel bei seriellen Untersuchungen eines beatmungspflichtigen SARS-CoV-2-positiv getesteten Patienten mit großflächigen Lungenkonsolidierungen nachgewiesen werden. Während am Tag 1 nach Intubation in den Konsolidierungen noch Perfusionssignale bis an die Lungenoberfläche darstellbar waren, reduzierten sich diese in der Folge stark (Abb. 10a,b). Unter Berücksichtigung der histopathologischen Befunde könnte die sonographisch verfolgbare Perfusionsminderung im konsolidierten Parenchym somit ein zusätzlicher wichtiger prognostischer und therapieoptimierender Hinweis bei schweren Verlaufsformen von SARS-CoV-2-Infektionen sein, dessen Relevanz durch umfassende klinische Studien überprüft werden sollte.
Bakterielle Pneumonien werden häufig von mäßig ausgeprägten Pleuraergüssen begleitet. Im Gegensatz dazu werden für COVID-19-Erkrankten ohne bakterielle Superinfektion nur minimale, klinisch irrelevante Pleuraergüsse beschrieben [3, 17].
Untersuchungsgang und Hygiene
Für die sonographische Untersuchung empfiehlt es sich, zunächst mit einer Konvexsonde einen orientierenden Untersuchungsgang sowohl ventral wie auch dorsal durchzuführen, bei dem der gesamte Thorax, in 12 Abschnitte unterteilt, abgescannt wird (2 ventral, 2 lateral, 2 dorsal/Hemithorax) [11, 17, 18, 22, 38]. Da die meisten pathologischen Lungenveränderungen in den dorsobasalen Lungenabschnitten zu finden sind, dürfen diese Areale nicht unbeachtet bleiben [29, 41, 49]. Bereits intubierte Patienten können für die Untersuchung durch eine Assistenzperson in eine stabile überdrehte Seitenlage verbracht werden, sodass alle dorsalen Lungenabschnitte erreichbar sind (Abb. 11; [11, 22]).
Die im Vergleich zur Linearsonde größere Abtastfläche und geringere Schallfrequenz bietet eine erste Übersicht und erlaubt eine sichere Identifikation der typischen unregelmäßigen Verteilungsmuster von B‑Linien. Wird die Untersuchung nur mit einer Linearsonde durchgeführt, sollte ein für die Lungensonographie optimiertes Preset mit möglichst niedriger Frequenz und ohne Verwendung von softwareassoziierter Artefaktunterdrückung verwendet werden [24–26].
Die Nahfelduntersuchung auffälliger Pleurabereiche mit einer Linearsonde ermöglicht die Darstellung von Unregelmäßigkeiten oder Fragmentierungen der Pleuralinie und minimale subpleurale Konsolidierungen wie auch die Perfusionsprüfung größerer Konsolidierungsbereiche [20].
Grundsätzlich ist die Technik der Lungensonographie leicht zu erlernen [35], sodass die Anwendung bereits im Rahmen von Screeninguntersuchungen in der Notaufnahme auch durch noch wenig erfahrene Kollegen erfolgen sollte [15]. In der intensivmedizinischen Betreuung verlangt das Zusammenspiel von Untersuchung, Bilddokumentation und Befundinterpretation im Kontext der klinischen Symptomatik jedoch die Expertise eines in der Lungensonographie erfahrenen Intensivmediziners, da bei diesem für eine aussagefähige Untersuchung eine kürzere Untersuchungszeit bei gleichzeitig höherer Diagnosesicherheit erwartet werden kann [11, 15, 22, 34].
Wie bereits angesprochen, verändern sich die lungensonographischen Befunde in Form und Ausdehnung im Verlauf der virusinduzierten Lungenschädigung. Diese Veränderungen können durch konsequente Integration der Lungensonographie in die arbeitstägliche Behandlungsroutine zeitnah erfasst und nach vollständiger Dokumentation jedes Untersuchungspunktes durch Anwendung etablierter Scoring-Konzepte objektiviert werden [8, 11, 17, 18, 25, 34]. Zudem kann auf diese Weise die Anzahl an Untersuchungen mit ionisierender Strahlung ohne Qualitätsverlust in der Patientenversorgung reduziert werden [6, 22], was in der aktuellen Pandemiesituation u. a. zu Verringerung der Virusexposition für medizinisches Personal und Einsparungen von Schutzkleidung aufgrund reduzierter Patiententransporte führt [26, 34].
Um die Kontamination des Ultraschallgeräts und des Untersuchers möglichst gering zu halten, müssen hygienisch wirksame Maßnahmen und Strategien Berücksichtigung finden [5, 20]. Von einigen Autoren wird empfohlen, für die Sonographie der COVID-19-Patienten kleine portable Geräte mit reduzierter Funktionalität zu verwenden, da diese Geräte deutlich einfacher zu desinfizieren sind [11, 15, 22, 34]. Diese Empfehlungen berücksichtigen allerdings nicht die Notwendigkeit einer Multiorgansonographie mit einem technisch hochwertigeren Gerät zur Evaluation infektionsassoziierter Begleitschäden an Herz, Darm oder Nieren [20, 45]. Hier müssen die Vorteile der besseren Bildqualität und Möglichkeiten quantitativer Messungen gegen die Nachteile des aufwendigeren Desinfektionsprozesses für Monitor, Funktionsregler und Tastatur abgewogen werden. In Abhängigkeit von den zur Verfügung stehenden Ressourcen und der zu versorgenden Patientenzahl ist es empfehlenswert, ein geeignetes Ultraschallgerät eigens für den stationären Isolationsbereich abzustellen [5, 15, 33]. Vor allem bei Verwendung größerer Ultraschallgeräte sollte sich der Untersucher dahingehend disziplinieren, die Schallhand nicht zu wechseln und die Einstellungen zu Bildoptimierung und Dokumentation konsequent nur mit der anderen Hand vorzunehmen, um das Risiko der Kontamination gerade dieser schwierig zu desinfizierenden Bauteile so weit, wie möglich, zu reduzieren. Messungen, Nachbearbeitung und Interpretation der Befunde müssen nicht während der Untersuchung am Patientenbett erfolgen, sondern können nach Abschluss der Untersuchung und Speicherung des Bildmaterials vor dem Patientenzimmer durchgeführt werden. Auf diese Weise reduziert sich die direkte Kontaktzeit mit dem Patienten auf das geringste notwendige Maß. Es ist in diesem Fall jedoch entscheidend für die Effektivität der Untersuchung, nach einem klar definierten Untersuchungsprotokoll und mit konkreten Fragestellungen hinsichtlich Diagnosestellung und Therapieoptimierung vorzugehen [17, 33, 38]. Des Weiteren wird empfohlen, die Sonden mit einer langen, das Kabel inkludierenden Schutzhülle zu versehen [5, 20, 33]. Nach jeder Untersuchung müssen das Gerät und die verwendeten Sonden, inklusive der Sondenkabel, mit geeigneten viruziden Desinfektionsmitteln gründlich wischdesinfiziert werden.
Ausblick
Die Lungensonographie hat das Potenzial, intensivmedizinische Behandlungspfade von der differenzialdiagnostischen Abklärung der akuten Dyspnoe über die zielorientiere Steuerung der Beatmungstherapie bis zu Planung und Durchführung des Weaning-Prozesses positiv zu beeinflussen [11, 25, 34]. Seit Ausbruch der Pandemie wurden diese bildgebende Methode weltweit mit dem besonderen Fokus auf den Nachweis und die Entwicklungsverfolgung COVID-19-typischer Lungenveränderungen erfolgreich eingesetzt und die Erkenntnisse und Erfahrungen in einer immer noch stetig wachsenden Zahl von Publikationen beschrieben. Die herausragenden Vorteile sind zum einen die Möglichkeiten des bettseitigen Screenings von Verdachtsfällen ohne Transport durch die Klinik wie auch die mögliche Steigerung der Diagnosesicherheit [4, 17, 22, 33]. Die Verbindung der lungensonographischen Befunde mit der Anamnese und klinischen Präsentation des Patienten und der Laborparameter erlauben dem behandelnden Arzt bereits bei der Erstuntersuchung eine orientierende Bewertung der klinischen Situation. Sowohl die Anzahl und Ausprägung der am weitesten fortgeschrittenen Konsolidierungen wie auch die Zusammenfassung der Befunde in einem Scoring-System können wertvolle Hinweise im Hinblick auf Schwere und Prognose der Erkrankung liefern [8, 17, 20, 34, 35]. Eine solche Bewertung kann jedoch nur dann vorgenommen werden, wenn alle Lungenanteile systematisch untersucht wurden.
Vor allem bei Schwangeren, Kindern und Jugendlichen kann die Lungensonographie als Bildgebung der ersten Wahl hilfreich sein, um die hohen Strahlenexposition der CT zu vermeiden [27].
Wie bereits erwähnt, ist die Lungensonographie auch bei der Therapiekontrolle hilfreich. Die Zunahme von Arealen mit multiplen B‑Linien-Artefakten wie auch neu aufgetretene subpleurale Konsolidierungen sind hilfreiche Informationen, die in der Zusammenschau von klinischer Symptomatik und Laborwerten frühzeitig die Entscheidung zur intensivierten nichtinvasiven Beatmung, zu programmierter kinetischer Lagerungstherapie auch bei (noch) nicht intubierten Patienten oder zur Intubation unterstützen können [17, 25, 35]. Auch ein rasches Anwachsen von Konsolidierungsarealen identifiziert einen Krankheitsprogress, was in die kontinuierliche Anpassung der Therapiestrategie einbezogen werden sollte [9, 17, 26, 45, 50]. Zeigen sich im Verlauf dagegen verstärkt Pleuraergüsse oder Infiltrate mit dynamischem Airbronchogramm, müssen diese Befunde als zusätzliche Hinweise auf eine bakterielle Superinfektion interpretiert werden.
Fazit für die Praxis
Lungensonographie ist sowohl als Screeningbildgebung bei COVID-19-Verdachtsfällen wie auch als Therapiemonitoring geeignet.
Eine aussagefähige Untersuchung sollte auch bei beatmeten Intensivpatienten immer die dorsalen Lungenquadranten inkludieren.
Serielle arbeitstägliche Untersuchungen sind geeignet, frühzeitig Bildinformationen über die Zustandsveränderung der peripheren Lunge zur Optimierung der supportiven Therapie zu generieren.
Strukturierte Befunddokumentation nach einem standardisierten Protokoll und die Erfassung eines Lungenultraschall-Scores nach etablierten Konzepten erlauben eine untersucherunabhängige Vergleichbarkeit und Quantifizierbarkeit der täglichen Befunde.
Abkürzungen
- ACE 2
Angiotensin-Converting-Enzym 2
- ARDS
„Acute respiratory distress syndrome“
- COVID-19
„Coronavirus disease 2019“
- CT
Computertomographie
- NIV
Nicht Invasive Beatmung
- PEEP
„Positive end-expiratory pressure“
- RAAS
Renin-Angiotensin‐Aldosteron‐System
- RKI
Robert Koch-Institut
- RNA
„Ribonucleic acid“
- SARS-CoV‑2
„Severe acute respiratory syndrome coronavirus 2“
- WHO
World Health Organization
Einhaltung ethischer Richtlinien
Interessenkonflikt
A. Seibel, W. Heinz, C.-A. Greim und S. Weber geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383:120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Almeida Monteiro RA, de Oliveira EP, Nascimento Saldiva PH, et al. Histological-ultrasonographical correlation of pulmonary involvement in severe COVID-19. Intensive Care Med. 2020 doi: 10.1007/s00134-020-06125-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Chinese Critical Care Ultrasound Study Group (CCUSG) Peng Q-Y, Wang X-T, Zhang L-N. Findings of lung ultrasonography of novel corona virus pneumonia during the 2019–2020 epidemic. Int Care Med. 2020 doi: 10.1007/s00134-020-05996-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bar S, Lecourtois A, Diouf M, et al. The association of lung ultrasound images with COVID-19 infection in an emergency room cohort. Anaesthesia. 2020 doi: 10.1111/anae.15175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Basseal JM, Westerway SC, McAuley T. COVID-19: Infection prevention and control guidance for all ultrasound practitioners. Australas J Ultrasound Med. 2020;23:90–95. doi: 10.1002/ajum.12210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Brogi E, Bignami E, Sidoti A, et al. Could the use of bedside lung ultrasound reduce the number of chest x-rays in the intensive care unit? Cardiovasc Ultrasound. 2017;15:23. doi: 10.1186/s12947-017-0113-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Copetti R, Soldati G, Copetti P. Chest sonography: a useful tool to differentiate acute cardiogenic pulmonary edema from acute respiratory distress syndrome. Cardiovasc Ultrasound. 2008;6:16. doi: 10.1186/1476-7120-6-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Dell’Aquila P, Raimondo P, De Matteis S, et al. Lung ultrasound score and management strategies in the critically COVID-19 patients. Ital J Emerg Med. 2020;9:126–130. doi: 10.23736/S2532-1285.20.00040-3. [DOI] [Google Scholar]
- 9.Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger am Robert Koch-Instittut, Feldt T, Guggemos W, Heim K et al (2020) Hinweise zu Erkennung, Diagnostik und Therapie von Patienten mit COVID-19. 10.25646/6539.13. Zugegriffen am: 06.08.2020
- 10.Fiala MJ. Ultrasound in COVID-19: a timeline of ultrasound findings in relation to CT. Clin Radiol. 2020;75(7):552–558. doi: 10.1016/j.crad.2020.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Gargani L, Soliman-Aboumarie H, Volpicelli G, et al. Why, when, and how to use lung ultrasound during the COVID-19 pandemic: enthusiasm and caution. Eur Heart J Cardiovasc Imaging. 2020 doi: 10.1093/ehjci/jeaa163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Görg C. Vaskularisation und Kontrastmittelsonographie. In: Mathis G, editor. Bildatlas der Lungensonographie. Berlin Heidelberg: Springer; 2015. pp. S157–160. [Google Scholar]
- 13.Hamer OW, Salzberger B, Gebauer J, et al. CT morphology of COVID-19: Case report and literature. RoFo. 2020;192(05):386–392. doi: 10.1055/a-1142-4094. [DOI] [PubMed] [Google Scholar]
- 14.Huang Y, Wang S, Liu Y et al (2020) A preliminary study on the ultrasonic manifestations of peripulmonary lesions of non-critical novel coronavirus pneumonia (COVID-19). 10.2139/ssrn.3544750. https://ssrn.com/abstract=3544750
- 15.Johri AM, Galen B, Kirkpatrick JN et al (2020) ASE statement on point-of-care ultrasound during the 2019 novel Coronavirus pandemic. JASE 33(6):670–673. 10.1016/j.echo.2020.04.017 [DOI] [PMC free article] [PubMed]
- 16.Lichtenstein D, Mezière G, Seitz J. The dynamic air Bronchogram. Chest. 2009;135(6):1421–1425. doi: 10.1378/chest.08-2281. [DOI] [PubMed] [Google Scholar]
- 17.Lichter Y, Topilsky Y, Taieb P, et al. Lung ultrasound predicts clinical course and outcomes in COVID-19 patients. Intensive Care Med. 2020;46:1873–1883. doi: 10.1007/s00134-020-06212-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lokuge A, Alexander J, Land B, et al. Lung ultrasound in a respiratory pandemic. EMA. 2020 doi: 10.1111/1742-6723.13575. [DOI] [PubMed] [Google Scholar]
- 19.Lomoro P, Verde F, Zerboni F, et al. COVID-19 pneumonia manifestations at the admission on chest ultrasound, radiographs, and CT: single-center study and comprehensive radiologic literature review. Eur J Radiol. 2020 doi: 10.1016/j.ejro.2020.100231. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Lv F, Wang J, Xing Y, et al. Chinese expert consensus on critical care ultrasound applications at COVID-19 pandemic. Adv Ultrasound Diagnosis Ther. 2020;4(2):27–42. doi: 10.37015/AUDT.2020.200029. [DOI] [Google Scholar]
- 21.Mathis G. Entzündliche Lungenkonsolidierungen. In: Mathis G, editor. Bildatlas der Lungensonographie. Berlin, Heidelberg: Springer; 2015. pp. 62–72. [Google Scholar]
- 22.Mayo PH, Copetti R, Feller-Kopman D, et al. Thoracic ultrasonography: a narrative review. Intensive Care Med. 2019;45:1200–1211. doi: 10.1007/s00134-019-05725-8. [DOI] [PubMed] [Google Scholar]
- 23.Menter T, Haslbauer D, Nienhold R, et al. Post-mortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings of lungs and other organs suggesting vascular dysfunction. Histopathology. 2020 doi: 10.1111/his.14134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Mento F, Demi L. On the influence of imaging parameters on lung ultrasound B-line artifacts, in vitro study. JASA. 2020;148:975–983. doi: 10.1121/10.0001797. [DOI] [PubMed] [Google Scholar]
- 25.Mojoli F, Bouhemad B, Mongodi S, et al. Lung ultrasound for critically ill patients. Am J Respir Crit Care Med. 2018;199(6):701–714. doi: 10.1164/rccm.201802-0236CI. [DOI] [PubMed] [Google Scholar]
- 26.Mongodi S, Orlando A, Arisi E, et al. Acute respiratory failure reduces conventional imaging and health care provider exposure to COVID-19. Ultrasound Med Biol. 2020;46(8):2090–2093. doi: 10.1016/j.ultrasmedbio.2020.04.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Moro F, Buonsenso D, Moruzzi C, et al. How to perform lung ultrasound in pregnant women with suspected COVID-19. Ultrasound Obstet Gynecol. 2020;55:593–598. doi: 10.1002/uog.22028. [DOI] [PubMed] [Google Scholar]
- 28.Nouvenne A, Zani MD, Milanese G, et al. Lung Ultrasound in COVID-19 Pneumonia: Correlations with Chest CT on Hospital admission. Respiration. 2020 doi: 10.1159/000509223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Pan F, Ye T, Sun P, et al. Time course of lung changes at chest CT during recovery from Coronavirus disease 2019 (COVID-19) Radiology. 2020;295:715–721. doi: 10.1148/radiol.2020200370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Reissig A, Copetti R, Mathis G, et al. Lung ultrasound in the diagnosis and follow-up of community-acquired pneumonia: a prospective, multicenter, diagnostic accuracy study. Chest. 2012;142:965–972. doi: 10.1378/chest.12-0364. [DOI] [PubMed] [Google Scholar]
- 31.Reuss J. Pleura. In: Mathis G, editor. Bildatlas der Lungensonographie. Berlin, Heidelberg: Springer; 2015. pp. S23–52. [Google Scholar]
- 32.Shi H, Han X, Jiang N, et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020;20:425–434. doi: 10.1016/S1473-3099(20)30086-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Skulstad H, Cosyns B, Popescu BA, et al. COVID-19 pandemic and cardiac imaging: EACVI recommendations on precautions, indications, prioritization, and protection for patients and healthcare personnel. Eur Heart J Cardiovasc Imaging. 2020;21(6):592–598. doi: 10.1093/ehjci/jeaa072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Smith MJ, Hayward SA, Innes AM, et al. Point-of-care lung ultrasound in patients with COVID-19—a narrative review. Anaesthesia. 2020;75(8):1096–1104. doi: 10.1111/anae.15082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Sofia S, Boccatonda A, Montanari M, et al. Thoracic ultrasound and SARS-COVID-19: a pictorial essay. J Ultrasound. 2020;23(2):217–221. doi: 10.1007/s40477-020-00458-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Soldati G, Smargiassi A, Inchingolo R, et al. Proposal for international standardization of the use of lung ultrasound for patients with COVID-19. J Ultrasound Med. 2020;39:1413–1419. doi: 10.1002/jum.15285. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Song F, Shi N, Shan F, et al. Emerging 2019 novel Coronavirus (2019-ncoV) pneumonia. Radiology. 2020;295:210–217. doi: 10.1148/radiol.2020200274. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Stock KF, Horn R, Mathis G et al (2020) Vorschlag eines standardisierten Lungen-Ultraschallprotokolls in den Zeiten von COVID-19. https://www.degum.de/nc/aktuelles/degum-ultraschall/im-detail/news/anleitung-zum-lungenultraschall-bei-verdacht-auf-covid-19.html. Zugegriffen am: 06.10.2020
- 39.Tian S, Hu W, Niu L, et al. Pulmonary pathology of early-phase 2019 novel Coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol. 2020;15(5):700–704. doi: 10.1016/j.jtho.2020.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Tsung JW, Kessler DO, Saha VP. Prospective application of clinician-performed lung ultrasonography during the 2009 H1N1 influenza A pandemic: distinguishing viral from bacterial pneumonia. Crit Ultrasound J. 2012;4:16. doi: 10.1186/2036-7902-4-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Tung-Chen Y, de Gracia MM, Díez-Tascón A, et al. Correlation between chest computed tomography and lung ultrasonography in patients with coronavirus disease 2019 (COVID-19) Ultrasound Med Biol. 2020;46(11):2918–2926. doi: 10.1016/j.ultrasmedbio.2020.07.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Vogel-Claussen J, Ley-Zaporozhan J, Agarwal P, et al. Recommendations of the Thoracic Imaging Section of the German Radiological Society for clinical application of chest imaging and structured CT reporting in the COVID-19 pandemic. Fortschr Röntgenstr. 2020;192:633–640. doi: 10.1055/a-1174-8378. [DOI] [PubMed] [Google Scholar]
- 43.Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 2012;38:577–591. doi: 10.1007/s00134-012-2513-4. [DOI] [PubMed] [Google Scholar]
- 44.Volpicelli G, Gargani L. Sonographic signs and patterns of COVID-19 pneumonia. Ultrasound J. 2020;12:22. doi: 10.1186/s13089-020-00171-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Volpicelli G, Lamorte A, Villén T. What’s new in lung ultrasound during the COVID-19 pandemic. Intensive Care Med. 2020;46:1445–1448. doi: 10.1007/s00134-020-06048-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.World Health Organization Infection prevention and control during health care when novel coronavirus (nCoV) infection is suspected, interim guidance. https://www.who.int/internal-publications-detail/surveillance-case-definitions-for-human-infection-withnovel-coronavirus-(ncov). Zugegriffen am: 15.01.2020
- 47.Wu J, Wu X, Zeng W, et al. Chest CT findings in patients with corona virus disease 2019 and its relationship with clinical features. Invest Radiol. 2020;55(5):257–261. doi: 10.1097/RLI.0000000000000670. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Xing C, Li Q, Du H, et al. Lung ultrasound findings in patients with COVID-19 pneumonia. Crit Care. 2020;24:174. doi: 10.1186/s13054-020-02876-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Yang Y, Huang Y, Gao F, et al. Lung ultrasonography versus chest CT in COVID-19 pneumonia: a two-centered retrospective comparison study from China. Intensive Care Med. 2020 doi: 10.1007/s00134-020-06096-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Zang X, Qang Q, Zhou H, et al. Efficacy of early prone position for COVID-19 patients with severe hypoxia: a single-center prospective cohort study. Intensive Care Med. 2020 doi: 10.1007/s00134-020-06182-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Zhang H, Penninger JM, Li Y, et al. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020;46(4):586–590. doi: 10.1007/s00134-020-05985-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Zhao W, Zhong Z, Xie X, et al. Relation between chest CT findings and clinical conditions of coronavirus disease (COVID-19) pneumonia: a multicenter study. Am J Roentgenol. 2020;3:1–6. doi: 10.2214/AJR.20.22976. [DOI] [PubMed] [Google Scholar]
- 53.Zhou S, Wang Y, Zhu T, et al. CT features of coronavirus disease 2019 (COVID-19) pneumonia in 62 patients in Wuhan, China. Am J Roentgenol. 2020;5:1–8. doi: 10.2214/AJR.20.22975. [DOI] [PubMed] [Google Scholar]