Abstract
Antecedentes y objetivo
El objetivo de este estudio fue conocer la prevalencia de la infección por SARS-CoV-2 en pacientes y profesionales de un hospital de media y larga estancia en el periodo del pico de la pandemia en España en la primavera de 2020.
Material y métodos
A finales de febrero del 2020, se diseñó en el hospital una estrategia para el diagnóstico de la infección por SARS-CoV-2 consistente en complementar la realización de PCR a tiempo real con una técnica rápida de inmunocromatografía de flujo lateral para la detección de anticuerpos IgG e IgM frente al virus. Se protocolizó la realización de dichas pruebas diagnósticas y se consideró como infección (actual o pasada) un resultado positivo de alguna de ellas.
Se incluyeron en el estudio a 524 participantes (230 pacientes y 294 profesionales). Los pacientes se agruparon en ingresados y en ambulatorios para terapia de hemodiálisis. Los trabajadores se agruparon en asistenciales y no asistenciales. El periodo que se documenta es el comprendido entre el 20 de marzo y el 21 de abril del 2020.
Resultados
En 26 de los 230 pacientes el resultado fue positivo en alguna de las técnicas, con una prevalencia del 11,30%. Por grupos, en ingresados fue del 14,38% frente al 5,95% de los ambulatorios (p = 0,055), siendo significativamente superior el riesgo en pacientes ingresados tras ajustar por sexo y edad (OR = 3,309; IC del 95%: 1,154-9,495).
En 24 de los 294 profesionales el resultado fue positivo en alguna de las técnicas, con una prevalencia del 8,16%. Por grupos, en asistenciales fue del 8,91% frente al 4,26% de los no asistenciales (p = 0,391), OR ajustada = 2,502 (IC del 95%: 0,559-11,202).
Conclusiones
Se ha encontrado una tasa de prevalencia baja frente a SARS-CoV-2 tanto en pacientes como en profesionales. La prevalencia en pacientes hospitalizados es mayor que en ambulatorios, también es superior la prevalencia de sanitarios asistenciales respecto a los no asistenciales.
Palabras clave: Hospital media y larga estancia, Prevalencia, SARS-CoV-2, PCR, Anticuerpos
Abstract
Background and goals
The aim of the study is to know the prevalence of SARS-CoV-2 infection in patients and professional staff of a medium or long-stay hospital during the peak period of the pandemic in Spain, spring 2020.
Material and methods
At the end of February 2020, we developed at the hospital a strategy to diagnose the SARS-CoV-2 infection consisting of complementing the realization of PCR tests at real time with a quick technique of lateral flow immunochromatography to detect IgG and IgM antibodies against the virus. We also developed a protocol to realize those diagnostic tests and considered an infection (current or past) a positive result in any of the above tests.
We included 524 participants in the study (230 patients and 294 hospital staff), and divided them into hospital patients and Hemodialysis outpatients. Furthermore, we divided the hospital staff into healthcare and non-healthcare staff. The documented period was from March, 20th to April, 21st, 2020.
Results
26 out of 230 patients tested positive in any of the diagnostic techniques (PCR, antibodies IgG, IgM) with a 11.30% prevalence. According to patients groups, we got a 14.38% prevalence in hospital patients vs. 5.95% in outpatients, with a significantly higher risk in admitted patients after adjustment for age and gender (OR=3,309, 95%CI: 1,154-9,495).
24 out of 294 hospital staff tested positive in any of the diagnostic techniques, with a 8.16% prevalence. According to the groups, we got a 8.91% prevalence in healthcare staff vs. 4.26% in non-healthcare staff. Thus, we do not see any statistically significant differences between hospital staff and patients as far as prevalence is concerned (P=0,391), (OR=2,200, 95%CI: 0,500-9,689).
Conclusions
The result of the study was a quite low prevalence rate of SARS-CoV-2 infection, in both patients and hospital staff, being the hospital patients’ prevalence rate higher than the outpatients’, and the healthcare staff higher than the non-healthcare's. Combining PCR tests (gold standard) with antibodies tests proved useful as a diagnostic strategy.
Keywords: Medium or long-stay hospital, Prevalence, SARS-CoV-2, PCR, Antibodies
Introducción
El 31 de diciembre del 2019, las autoridades chinas informaron sobre un grupo de casos de neumonía de etiología desconocida en la ciudad de Wuhan. El inicio de los síntomas del primer caso fue el 8 de diciembre del 20191. El causante del brote era una nueva especie de coronavirus denominado SARS-CoV-2, cuya secuencia genética fue compartida el 12 de enero2. Junto a los mecanismos de transmisión se describió la enfermedad infecciosa producida por este virus, a la que se denominó COVID-19. El 30 de enero la Organización Mundial de la Salud (OMS) declaró el brote como una urgencia de salud pública de importancia internacional y el 11 de marzo se declaró el estado de pandemia3. El primer caso en España se notificó el 31 de enero en la Gomera, posteriormente en Palma, y el 24 de febrero se detectaron los primeros casos en la península. Dos semanas después se constató la transmisión comunitaria no controlada, decretándose el 14 de marzo del 2020 el estado de alarma, confirmándose más tarde un gran número de afectados y defunciones.
Actualmente, se desconocen la prevalencia y el impacto de la infección en hospitales de media y larga estancia en España. El Hospital San Juan de Dios de Zaragoza es un hospital de media y larga estancia integrado en la red pública sanitaria de Aragón, cuenta con unidad de agudos, convalecencia, cuidados paliativos, neurorrehabilitacion, consultas externas y unidad de hemodiálisis, y atiende principalmente a pacientes de edad avanzada con numerosas comorbilidades y altamente vulnerables a SARS-CoV-2. Los profesionales asistenciales, a su vez, se consideran de riesgo, teniendo España un alto índice de contagios entre el personal sanitario.
Este estudio reporta la prevalencia de la infección en pacientes y profesionales del hospital durante el pico de la pandemia en nuestro país en la primavera de 2020.
Material y método
Población a estudio
Se consideró a los pacientes y profesionales disponibles en el Centro en el periodo del estudio, comprendido entre el 20 de marzo y el 21 de abril del 2020.
Los pacientes se agruparon en ingresados y en ambulatorios para terapia de hemodiálisis. No se incluyeron en el estudio los resultados de pacientes que ingresaron de residencias u otros hospitales con diagnóstico confirmado por PCR de COVID-19, ni pacientes de consultas externas por haber cesado esta actividad asistencial durante la pandemia.
Los profesionales se agruparon en asistenciales, cuya actividad sanitaria requiere contacto directo y frecuente con el paciente, y a los que se les consideró de alto riesgo (médicos, enfermeras, personal auxiliar sanitario, celadores, personal de limpieza, fisioterapeuta, técnico de radiología), y no asistenciales, sin contacto habitual con el paciente y a los que se consideró de bajo riesgo (dirección, admisión, administración, mantenimiento, cocina, ropería, farmacia, comunicación, atención al usuario, trabajo social).
Infección por SARS-CoV-2
En la última semana de febrero se formó en el hospital el comité COVID-19 y en las siguientes semanas se diseñó una estrategia para el diagnóstico de la infección por SARS-CoV-2.
De acuerdo con el procedimiento emitido el 24 de enero del 2020 por la Dirección General de Salud Pública del Ministerio de Sanidad de España para solicitar una PCR confirmatoria, se consideró caso en investigación por COVID-19 a los pacientes que hubieran viajado a Wuham o hubieran tenido un contacto estrecho con un caso confirmado en los 14 días previos al comienzo de los síntomas sumado al criterio clínico (neumonía o fiebre con infección respiratoria aguda). Por otra parte, se considero, «caso confirmado por laboratorio» a aquel paciente con PCR de cribado positiva y PCR de confirmación en un gen alternativo al de cribado, también positiva4.
Ante las limitaciones de solicitud de la PCR, se consideró la posibilidad de ampliar el espectro diagnóstico con algún tipo de prueba rápida que fuera complementaria. Se descartaron los test rápidos de detección de antígeno nasofaríngeo por baja sensibilidad y se decidió incorporar una técnica serológica rápida para la detección de anticuerpos (AC) IgG e IgM frente al virus (la OMS se refirió a la utilidad del uso de pruebas de AC para el diagnóstico de COVID-19 en directrices provisionales publicadas el 19 de marzo)5.
Habiéndose descrito que a los 3-6 días tras la infección pueden comenzar a detectarse AC IgM, y tras 8 días AC IgG6, 7, el uso conjunto de ambas técnicas podía ofrecer información de todas las fases de la infección (PCR en la fase inicial, aparición de AC IgM entre la primera y segunda semana y aparición de AC IgG entre la segunda y tercera semana con la adquisición de inmunidad), si bien los AC mostraban como mayor hándicap la baja sensibilidad diagnóstica en estadios tempranos de la infección y la posibilidad de producir falsos positivos por detección de inmunidad cruzada con otros virus.
Se adquirió el Kit Master-Labor. 2019-nCoV IgG/IgM Rapid Test (Master Labor S.L., Madrid, España). Se trata de un ensayo inmunocromatográfico de flujo lateral sobre membrana para la detección cualitativa en 10 min de AC IgG e igM de manera individualizada frente al SARS-CoV-2, con alta sensibilidad y especificidad según el fabricante:
-
-
IgG sensibilidad relativa 100% (intervalo de confianza del 95% [IC del 95%], 86%-10%), especificidad relativa 98% (IC del 95%, 89,4-99,9%), precisión 98,6% (IC del 95%, 92,3-99,96%) en comparación con PCR (70 muestras).
-
-
IgM sensibilidad relativa 85% (IC del 95%, 62,1-96,8%), especificidad relativa 96% (IC del 95%,86,3-99,5%), precisión 92,9% (IC del 95%, 84,1-97,6%) en comparación con PCR (70 muestras).
El kit se ensayó con muestras positivas para otros virus, no mostrándose sensibilidad cruzada alguna.
Se protocolizó la realización de las pruebas diagnósticas según el siguiente esquema:
-
-
Realizar AC a todos los pacientes y profesionales sanitarios, pudiendo repetir la prueba durante el período del estudio si aparecían en algún momento criterios clínicos o epidemiológicos que lo justificasen.
-
-
Realizar PCR a pacientes y profesionales con criterio clínico o epidemiológico y a todos los casos con resultado de AC positivos.
-
-
De cara a la realización del estudio, se consideró como infección (actual o pasada) un resultado positivo en alguna de las pruebas (PCR/IgG/IgM).
Aspectos éticos
El estudio de la prevalencia de infección por SARS-COV-2 se efectuó como una iniciativa de la Dirección del Hospital San Juan de Dios, con objeto de gestionar adecuadamente y prevenir la posibilidad de difusión de la infección al ser este un centro que alberga pacientes con alto riesgo de desarrollar una enfermedad grave. La evaluación se llevó a cabo de manera sistemática en un periodo corto tanto en pacientes como en los profesionales del centro. Los datos para la publicación se han recogido de manera retrospectiva y el protocolo ha sido aprobado por el Comité Regional de Ensayos y Ética de Aragón (CEICA). Se realizó solicitud de consentimiento informado verbal a los pacientes, y verbal y firmado a los trabajadores.
Para la realización de este estudio no se ha contado con ninguna financiación externa ni pública ni privada, siendo asumidos los costes de la realización del mismo por el propio Hospital.
Análisis estadístico
Se realizó, en primer lugar, un análisis descriptivo de los datos para conocer las pruebas realizadas, la prevalencia de COVID-19 y las características de los participantes por grupo de estudio; para las variables cualitativas se aportan las frecuencias relativas y absolutas y para las variables cuantitativas la media ± desviación estándar (DE). Además de estos resultados, se recogieron las variables edad y sexo, así como síntomas, necesidad de ingreso y fallecimiento de los participantes infectados. Para analizar la influencia de las variables de interés sobre la prevalencia de COVID-19, se emplearon el test de Fisher para comparación de proporciones y el test de U de Mann-Whitney para la comparación de medias. Se aplicó el test de Kolmogorov-Smirnov para comprobar la normalidad de las variables en estudio. Para valorar el riesgo de infección ajustado por sexo y edad, se realizaron distintos análisis de regresión logística, la fuerza de asociación entre las variables se midió en términos de odds ratio (OR) junto con los IC del 95%.
Todas las pruebas fueron consideradas significativas cuando p < 0,05. El análisis estadístico se llevó a cabo mediante el software IBM SPSS® Statistics versión 26.0 para Windows con licencia de la Universidad de Zaragoza (SPSS Ibérica, Madrid, España).
Resultados
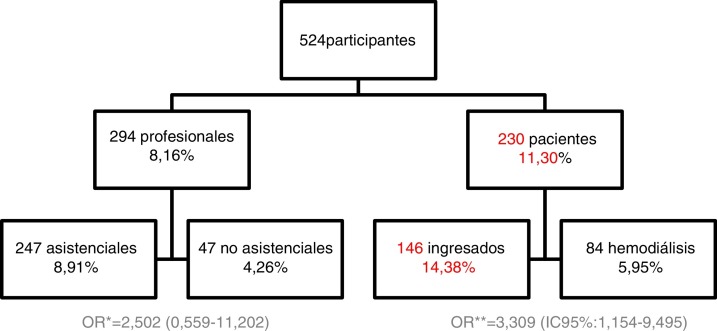
Se incluyó en el estudio a 524 participantes (230 pacientes y 294 profesionales sanitarios) a los que se realizaron pruebas de PCR y/o AC IgG e IgM frente a SARS-CoV-2 (AC) siguiendo los criterios anteriormente citados, lo que se tradujo en 787 pruebas (141 pruebas de PCR y 646 pruebas de AC).
Pacientes
Se recogieron datos de 230 pacientes, 99 mujeres (43,04%) y 131 hombres (56,96%), con una edad media ± DE de 74,43 ± 13,95 años (rango de 36 a 97 años), siendo un 53,47% (123/230) mayores de 74 años.
Se realizaron PCR y AC frente a SARS-CoV-2 a 68 pacientes (29,57%) solo PCR a un paciente (0,43%) y solo AC a 161 pacientes (70%). Un total de 26 pacientes (30,77% mujeres y 69,23% hombres) dieron resultado positivo en al menos una de las pruebas, lo que se traduce en una prevalencia de 11,30% (fig. 1 ).
Figura 1.
Prevalencia de SARS-CoV-2 según grupo de estudio.
* Odds ratio ajustada por sexo y edad (profesionales asistenciales vs. profesionales no asistenciales).
** Odds ratio ajustada por sexo y edad (pacientes ingresados vs. pacientes hemodiálisis).
Un 42,31% de los pacientes positivos no mostró fiebre ni tos, un 26,92% solo fiebre, un 3,85% solo tos y un 26,92% presentó ambos síntomas.
La PCR se realizó a 69 pacientes (30,00%), siendo positiva en 15 casos (21,74%). A 59 pacientes se les realizó la prueba una única vez (25,65%), a 9, 2 veces (3,91%) y a uno, 3 veces (0,43%).
Los AC se realizaron a 229 pacientes (99,57%), siendo positivos 16 (6,99%). A un paciente no se realizaron AC porque falleció antes de recogerle la muestra (0,43%), a 210 pacientes se les realizó una única vez (91,30%), a 17 pacientes, 2 veces (7,39%) y a 2 pacientes, 3 veces (0,87%).
En cuanto a las combinaciones, sobre los 26 pacientes positivos, la PCR junto a los AC fue positiva en 5 casos (19,23%); solo la PCR en 10 (38,46%) y solo los AC en 11 casos (42,31%).
En la tabla 1 se muestra la relación de cada una de estas combinaciones con síntomas clínicos recogidos en el momento de la positividad de la prueba (T.ª > 37,3 °C y tos).
Tabla 1.
Síntomas en pacientes y profesionales sanitarios positivos
| Pacientes (n=26) 23 ingresados (88,46%) 6 fallecidos (23,08%) |
Profesionales sanitarios (n=24) 1 ingresado (4,17%) 0 fallecidos (0,00%) |
|||||
|---|---|---|---|---|---|---|
| PCR+, AC + n = 5 |
PCR+ n = 10 |
AC+ n = 11 |
PCR+, AC+ n = 11 |
PCR+ n = 7 |
AC+ n = 6 |
|
| T.ª > 37,3 °C+ tos | 4 (80,00%) | 3 (30,00%) | 6 (54,55%) | 5 (71,43%) | ||
| T.ª > 37,3 °C | 6 (60,00%) | 1 (9,09%) | 1 (9,09%) | |||
| Tos | 1 (10,00%) | 2 (18,18%) | 2 (28,57%) | |||
| No fiebre, no tos | 1 (20,00%) | 10 (90,91%) | 2 (18,18%) | 6 (100,00%) | ||
AC: anticuerpos.
En pacientes con PCR positiva (n = 15), la fiebre o la febrícula fue el síntoma más frecuente, detectándose en 13 de 15 pacientes (86,67%), mientras que la tos apareció en 8 de 15 pacientes (53,55%). Solamente un paciente no presentó ninguno de los 2 síntomas (6,67%).
No se determinaron ni edad ni sexo como factores de riesgo de infección por SARS-CoV-2 en los pacientes; la edad media de los pacientes positivos fue de 72,35 ± 11,66 años frente a 74,70 ± 14,22 años en pacientes negativos (p = 0,185). La proporción de hombres fue similar en ambos grupos; el 69,23% de los pacientes positivos y el 55,39% de los pacientes negativos fueron hombres (p=0,211).
En este grupo, el número de fallecidos durante el periodo de realización de estudio fue de 6 sobre 26 positivos (23,08%). Un 88,46% de los pacientes positivos requirió ingreso (23/26).
En 5 casos con resultado de PCR positiva se dispuso de resultado de AC realizados al menos una semana después, detectándose positividad en los 5 casos, lo que supone una concordancia del 100%.
Pacientes segregados (ingresados y ambulatorios de hemodiálisis)
Los 230 pacientes se distribuyeron en 146 ingresados (63,48%) y 84 de hemodiálisis (36,52%).
De los 146 pacientes ingresados (47,95% mujeres y 52,05% hombres), con una edad media de 77,40 ± 12,92 años (rango 43-97), un total de 21 dieron resultado positivo (28,57% mujeres y 71,43% hombres), lo que se traduce en una prevalencia del 14,38% (fig. 1).
De los 84 pacientes ambulatorios (34,52% mujeres y 65,48% hombres), con una edad media de 69,26 ± 14,24 años (rango 36-90), un total de 5 (40,0% mujeres y 60,0% hombres) dieron resultado positivo en al menos una de las pruebas, lo que se traduce en una prevalencia de 5,95% (fig. 1).
No se observaron diferencias estadísticamente significativas entre pacientes ingresados o ambulatorios en cuanto a prevalencia (14,38% vs. 5,95%, p = 0,055), si bien el riesgo de infección fue significativamente 3 veces mayor en los pacientes ingresados tras ajustar por sexo y edad, OR = 3,309 (IC del 95%, 1,154-9,495).
Profesionales sanitarios
Se recogieron datos de 294 profesionales sanitarios, 223 mujeres (75,85%) y 71 hombres (24,15%), con una edad media de 41,85 ± 12,68 años (rango de 19 a 64 años).
Se realizó PCR y AC frente a SARS-CoV-2 a 42 profesionales (14,29%), solo PCR a 5 profesionales (1,70%) y solo AC a 247 profesionales (84,01%), un total de 24 profesionales (75,00% mujeres y 25,00% hombres) dieron resultado positivo en al menos una de las pruebas, lo que se tradujo en una prevalencia de 8,16% (fig. 1).
Un 33,33% de los profesionales positivos no mostró ni fiebre ni tos, un 4,17% solo fiebre, un 16,67% solo tos y un 45,83% presentó ambos síntomas.
La PCR se realizó a 47 profesionales (15,99%), a 35 profesionales se les realizó una única vez (11,90%), a 10 profesionales 2 veces (3,40%) y a 2, 3 veces (0,68%), siendo positiva en 18 casos (38,30%).
Los AC se realizaron a 289 profesionales (98,30%), siendo positivos en 17 casos (5,88%). A 5 profesionales no se les realizaron porque pasaron a aislamiento domiciliario antes de recoger la muestra (1,70%), a 195 profesionales, una vez (66,33%); a 81 casos, 2 veces (27,55%) y a 13 profesionales, 3 veces (4,42%).
En cuanto a las combinaciones, en los 24 profesionales positivos, la PCR junto a los AC fue positiva en 11 casos (45,83%), solo la PCR en 7 (29,17%) y solo los AC en 6 (25,00%).
En la tabla 1 se muestra la relación de cada una de estas combinaciones con síntomas clínicos recogidos en el momento de la positividad de la prueba (T.ª > 37,3 °C y tos).
En profesionales con PCR positiva (n = 18) se detectó fiebre o febrícula en 12 de 18 (66,66%) y tos en 15 de 18 casos (83,33%). En 2 pacientes no se detectaron ninguno de los 2 síntomas (11,11%). En 13 casos con resultado de PCR positiva se dispuso de resultado de AC realizados al menos una semana después, detectándose positividad en los 10 casos, lo que supone una concordancia del 76,92%.
No se determinaron ni la edad ni el sexo como factores de riesgo de infección por SARS-CoV-2 en los profesionales; la edad media de los pacientes positivos fue de 44,75 ± 13,60 años frente a 41,59 ± 12,59 años en pacientes negativos (p = 0,242). La proporción de mujeres fue similar en ambos grupos, el 75,00% de los profesionales positivos y el 75,93% de los profesionales negativos fueron mujeres (p = 1,000).
En este grupo, no hubo ningún fallecido durante el periodo de realización del estudio. Solo un profesional de los 24 positivos requirió ingreso (4,17%).
Profesionales sanitarios segregados (asistenciales y no asistenciales)
Los 294 profesionales sanitarios se distribuyeron en 247 asistenciales (84,01%) y 47 no asistenciales (15,99%).
De los 247 asistenciales (77,73% mujeres y 22,27% hombres), con una media de edad de 41,05 ± 12,82 años (rango 19-64 años), un total de 22 (77,27% mujeres y 22,73% hombres) dio resultado positivo en al menos una de las pruebas, lo que se traduce en una prevalencia del 8,91% (fig. 1).
De los 47 no asistenciales (65,96% mujeres y 34,04% hombres), con una media de edad de 46,04 ± 11,09 años (rango 24-64 años), un total de 2 (una mujer y un hombre) dio resultado positivo en al menos una de las pruebas, lo que se traduce en una prevalencia del 4,26% (fig. 1).
No se observaron diferencias estadísticamente significativas entre ser profesional asistencial o no en cuanto a la prevalencia (p = 0,391), si bien el riesgo de infección se muestra superior en los asistenciales OR = 2,502 (IC del 95%, 0,559-11,202) tras ajustar por sexo y edad.
El porcentaje de casos positivos por categoría profesional fue el siguiente: el 12,16% de las enfermeras, el 10,34% de los médicos, el 9,72% de los auxiliares clínicos, el 8,70% del personal de limpieza, el 4,26% de los profesionales no asistenciales y el 3,33% de los celadores (tabla 2 ). No se encontró relación estadísticamente significativa entre pertenecer a una categoría profesional determinada y presentar infección por SARS-CoV-2.
Tabla 2.
Casos positivos de infección por SARS-CoV-2 según categorías profesionales
| Profesionales | N = 294 | Número positivos | Prevalencia | p valora |
|---|---|---|---|---|
| Enfermera/os | 74 | 9 | 12,16% | 0,149 |
| Médico/as | 29 | 3 | 10,34% | 0,717 |
| Auxiliares clínicos | 72 | 7 | 9,72% | 1,000 |
| Limpieza | 23 | 2 | 8,70% | 1,000 |
| No asistenciales | 47 | 2 | 4,26% | 0,391 |
| Celadores | 30 | 1 | 3,33% | 1,000 |
| Otros asistenciales | 19 | 0 | 0,00% | 0,382 |
Test de Fisher (se contrasta la prevalencia de SARS-CoV-2 en los profesionales de la categoría de estudio vs. los profesionales de otras categorías). Los casos positivos hacen referencia al resultado positivo en alguna de las pruebas (PCR/IgG/IgM).
Discusión
El objetivo principal del estudio fue conocer la prevalencia de infección por SARS-CoV-2 en pacientes y profesionales de un hospital de media y larga estancia de Zaragoza en el pico de la pandemia en España, entre el 20 de marzo y el 21 de abril del 2020.
Los pacientes ingresados en este tipo de instituciones y los profesionales que los atienden presentan factores de riesgo que los hacen especialmente vulnerables a esta infección, por lo que hemos considerado de especial relevancia aportar datos epidemiológicos de estos colectivos.
Siendo la PCR el «gold standard» mundialmente aceptado, hubo varios motivos que nos llevaron a considerar la necesidad de contar en el hospital con una herramienta diagnóstica complementaria para optimizar la detección del virus y minimizar el riesgo de un brote que pudiera poner el riesgo la propia actividad asistencial. Por una parte, los criterios clínicos y epidemiológicos que había que cumplir para solicitar la prueba eran muy estrictos y restrictivos, lo cual nos creaba incertidumbre de un posible infradiagnóstico de casos positivos. También consideramos la posibilidad de que se dieran falsos negativos de la técnica PCR relacionados principalmente con periodos de baja carga viral o con errores en la toma o trasporte de la muestra. Por último, entendimos que no era desdeñable la posibilidad de que se produjeran infecciones asintomáticas o con síntomas atípicos (frecuentes en ancianos) que pudieran producir un brote de diseminación incontrolada.
Inicialmente, se consideró la posibilidad de adquirir kits rápidos de detección de antígeno, ya que en esos primeros momentos la PCR además de restringida su petición, tenía un periodo de varios días de demora hasta obtener el resultado. Sin embargo, debido a la baja sensibilidad de la técnica de antígeno documentada por los primeros países que los testaron, se decidió implementar una técnica individual rápida de detección de AC IgG e IgM que pudiera complementarse con la PCR para ofrecer información en los distintos momentos evolutivos del proceso de la infección y estimar el estado inmunitario del paciente frente al virus. Respecto a la fiabilidad de la técnica de AC empleada en el centro, en 18 casos con resultado de PCR positiva (5 pacientes y 13 profesionales) se dispuso del resultado de AC realizados al menos una semana después, detectándose una concordancia del 83,33%. Es probable que los resultados discordantes pudieran deberse a falsos negativos de la técnica, sobre todo en estadios tempranos de la infección, aunque no puede descartarse que en al menos algún caso el paciente no hubiera producido el número suficiente de AC para ser detectados.
Estos datos dan verosimilitud a la sensibilidad especificada por el fabricante del kit de AC (IgM 85%, IgG 100%) y concuerdan a posteriori con los publicados en el informe preliminar de julio del estudio ENE-COVID19 del Instituto de Salud Carlos III, donde se muestra que el 74 y el 87% de los participantes que refieren haber tenido una PCR+ presentan AC IgG8.
Respecto a la especificidad de estas técnicas, no se puede obviar la posibilidad de falsos positivos (sobre todo en IgM) por reactividad cruzada con otros virus, lo que podría tener influencia nuestro estudio, sobre todo en los casos diagnosticados solo por AC.
Del análisis de los resultados de las pruebas (PCR/IgG/IgM) se pudo determinar la prevalencia de infección por SARS-CoV-2 en distintos grupos de nuestro hospital, constatando una notable variación entre ellos, sin mostrar significación estadística.
En pacientes, nuestra prevalencia global fue de 11,30%. Como era de prever en función de los factores de riesgo, la mayor tasa correspondió al grupo de pacientes ingresados, que triplicó a la de los pacientes ambulatorios de hemodiálisis tras ajustar por sexo y edad. El hospital de parapléjicos de Toledo publicó un estudio realizado en las mismas fechas, donde refiere una prevalencia en pacientes del 12,2%9, lo que reportaría resultados similares al presente estudio.
En el grupo de profesionales la prevalencia global en este estudió fue algo menor (8,16%), siendo la tasa de los asistenciales más del doble que la de los no asistenciales, debido probablemente al riesgo de contagio que supone el contacto directo y frecuente con los pacientes. Enfermeras, médicos, auxiliares clínicos y personal de limpieza fueron los más afectados por este orden, aunque con poca diferencia entre ellos.
Otros hospitales españoles de agudos han publicado estudios de prevalencia de profesionales sanitarios en las fechas del estudio, como el Hospital Clínic de Barcelona con cifras del 11,2%10 y del 11,6% en el Hospital 12 de Octubre de Madrid11. Esta comparativa favorable podría estar relacionada con unas buenas prácticas de control de la infección por parte de nuestros profesionales.
Aunque la muestra es muy específica, parece razonable pensar que la prevalencia de la infección de los trabajadores sanitarios no asistenciales (4,26%), al no tener contacto directo con los pacientes podría ser semejante a la de la población general en las fechas del estudio, lo que indicaría una cifra de contagios mucho mayor que la que reflejaban las cifras oficiales en ese momento, pero muy alejada todavía de la necesaria para lograr la ansiada inmunización de grupo. El informe preliminar del estudio ENE-COVID19 del Instituto de Salud Carlos III mostró a posteriori una prevalencia estimada en julio del 5% en la población general, lo que avala dicha presunción8.
Sin ser el objetivo principal de este estudio, se recogieron algunas variables clínicas relacionadas con la infección, determinándose la presencia o no de fiebre o febrícula ≥ 37,3 °C y de tos. En el grupo de pacientes, la mayoría presentaron fiebre o febrícula, mientras que poco más de la mitad refirieron tos, proporciones que difirieron entre los profesionales, donde la tos fue el síntoma más frecuente seguido de la fiebre.
La mayoría de casos con PCR positiva presentaron síntomas (lo que sugiere que eran los casos de infección aguda) y la mayoría con solo AC positivos fueron asintomáticos (probablemente los casos subagudos o pasados).
Un 23,08% de los pacientes con resultado positivo en alguna de las técnicas falleció durante el estudio. Estos resultados están en consonancia con el informe número 57 de la enfermedad por el COVID-19, publicado por el Centro de coordinación de Alertas y Emergencias Sanitarias en fecha 26 de marzo del 2020, donde se documentaba que la mortalidad en pacientes con COVID-19 mayores de 80 años alcanza cifras superiores al 14,2% en España.
Las limitaciones de nuestro trabajo están relacionadas con la tipología del hospital, ya que alberga a pacientes de edad avanzada con procesos crónicos y complejos lo que dificulta la comparativa de sus resultados con otros hospitales de agudos. Por otra parte, se han recogido pocas variables clínicas, ya que no era el objetivo fundamental del estudio. Por último, puede ser cuestionable la fiabilidad de los resultados de los test rápidos de AC por posibles falsos negativos en etapas tempranas de la infección o pacientes con niveles bajos de AC, y falsos positivos por reactividad cruzada.
Conclusiones
Presentamos un estudio de prevalencia de la infección por SARS-CoV-2 en pacientes y profesionales de un hospital de media y larga estancia, realizado en los meses del pico de la pandemia en España.
Los resultados mostraron tasas de prevalencia bajas en ambos colectivos, muy alejadas de la inmunidad de rebaño. Los grupos con mayores factores de riesgo de contraer la infección (pacientes ingresados y profesionales asistenciales) son los que presentaron una mayor tasa.
Conflicto de intereses
Los autores declaran no existir ningún conflicto de intereses.
Agradecimientos
Al Dr. Ángel Lanas Arbeloa, como director del IIS Aragón, por su inestimable apoyo.
Bibliografía
- 1.Zhao W.M., Song S.H., Chen M.L., Zou D., Ma L.N., Ma Y.K. The 2019 novel coronavirus resource. Yi Chuan. 2020;42:212–221. doi: 10.16288/j.yczz.20-030. [consultado 7 Jun 2020]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32102777/ [DOI] [PubMed] [Google Scholar]
- 2.Wuhan seafood market pneumonia virus isolate Wuhan-Hu-1, complete genome. 23 de enero de 2020 [consultado 4 Jun 2020]. Disponible en: http://www.ncbi.nlm.nih.gov/nuccore/MN908947.3
- 3.WHO Coronavirus disease (COVID-2019) situation reports [consultado 7 Jun 2020]. Disponible en: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports
- 4.Procedimiento de actuación frente a casos de infección por el nuevo coronavirus (2019-nCoV), 24 de enero del 2020. Dirección General de Salud Pública, Calidad e Innovación. Centro de Coordinación de Alertas y Emergencias Sanitarias [consultado 31 Mar 2020]. Disponible en: https://fundacionio.com/wp-content/uploads/2020/01/Procedimiento_2019-nCoV.pdf
- 5.WHO: Laboratory testing for coronavirus disease (COVID-19) in suspected human cases (Interim guidance, 19 Mar 2020) [consultado 1 Abril 2020]. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/331329/WHO-COVID-19-laboratory-2020.4-eng.pdf?sequence=1&isAllowed=y
- 6.Lee H.K., Lee B.H., Seok S.H., Baek M.W., Lee H.Y., Kim D.J. ET-AL>. Production of specific antibodies against SARS-coronavirus nucleocapsid protein without cross reactivity with human coronaviruses 229E and OC43. J Vet Sci. 2010;11:165–167. doi: 10.4142/jvs.2010.11.2.165. [consultado 4 Jun 2020]. Disponible: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2873818/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Wan Z.Y., Zhang X., Yan X.G. IFA in testing specific antibody of SARS coronavirus. South China J Prev Med. 2003;29:36–37. [consultado 7 Jun 2020]. Disponible en: https://europepmc.org/article/cba/562591. [Google Scholar]
- 8.Estudio ENE-COVID: informe final estudio nacional de sero-epidemiología de la infección por SARS-COV-2 en España, 6 de julio de 2020. Instituto de Salud Carlos III [consultado 10 Jul 2020]. Disponible en: https://www.mscbs.gob.es/ciudadanos/ene-covid/docs/ESTUDIO_ENE-COVID19_INFORME_FINAL.pdf
- 9.Ruiz Moruno AJ, Rodríguez Cola M, Jiménez Velasco I, Ruíz Delgado RM, González Rubio A. Efectividad de la implantación de una gestión clínico-epidemiológica durante la Covid-19 en un hospital de media-larga estancia. Rev Esp Salud Pública. 2020;94:1-10. [consultado 10 Oct 2020]. Disponible en: http://www.mscbs.es/biblioPublic/publicaciones/recursos_propios/resp/revista_cdrom/VOL94/ORIGINALES/RS94C_202007084.pdf [PMC free article] [PubMed]
- 10.Garcia-Basteiro A., Moncunill G., Tortajada M., Vidal M., Guinovart C., Jiménez A. Seroprevalence of antibodies against SARS-CoV-2 among health care workers in a large Spanish reference hospital. Nat Commun. 2020;11:3500. doi: 10.1101/2020.04.27.20082289. [Consultado 20 Jul 2020]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Folgueira M.D., Munoz-Ruiperez C., Alonso-Lopez M.A., Delgado R. SARS-CoV-2 infection in health care workers in a large public hospital in Madrid, Spain, during March 2020. 2020:20055723. medRxiv 2020.04.07 [consultado 10 de Jul 2020]. Disponible en: https://www.medrxiv.org/content/10.1101/2020.04.07.20055723v2.full.pdf. [Google Scholar]