Abstract
La Société de Pneumologie de Langue Française (SPLF) propose un guide pour la prise en charge thérapeutique des patients ayant d’éventuelles séquelles respiratoires après avoir présenté une pneumonie à SARS-CoV-2 (COVID-19). Les propositions s’appuient sur les données connues des précédentes épidémies, les données préliminaires publiées sur le suivi après COVID-19 et les avis d’experts. Les propositions ont été élaborées par un groupe d’experts puis soumises selon la méthode Delphi à un panel composé de 22 pneumologues. Dix-sept propositions ont été validées, qui vont des examens complémentaires à réaliser après le bilan minimal proposé dans le guide de suivi de la SPLF à la place de la corticothérapie inhalée ou systémique et des médicaments antifibrosants. Ces propositions pourront évoluer dans le temps au fil des connaissances sur le sujet. Ce guide insiste sur l’importance de la discussion multidisciplinaire.
Mots clés: SARS-CoV-2, Pneumonie, Séquelles, Fibrose, COVID-19, Pneumopathie interstitielle diffuse
Abstract
The French-speaking Respiratory Medicine Society (SPLF) proposes a guide for the management of possible respiratory sequelae in patients who have presented with SARS-CoV-2 pneumonia (COVID-19). The proposals are based on known data from previous epidemics, preliminary published data on post COVID-19 follow-up and on expert opinion. The proposals were developed by a group of experts and then submitted, using the Delphi method, to a panel of 22 pulmonologists. Seventeen proposals were validated ranging from additional examinations after the minimum assessment proposed in the SPLF monitoring guide, to inhaled or systemic corticosteroid therapy and antifibrotic agents. These proposals may evolve over time as knowledge accumulates. This guide emphasizes the importance of multidisciplinary discussion.
Keywords: SARS-CoV-2, Pneumonia, Sequelae, Fibrosis, COVID-19, Interstitial lung disease
Préambule
Nous ne disposons actuellement d’aucune donnée concernant la prise en charge à proposer aux patients ayant des séquelles pulmonaires au décours d’une pneumonie à SARS-CoV-2 (COVID-19). En effet, compte tenu de l’atteinte pulmonaire initiale désormais bien documentée [1], certains de ces patients pourraient garder des séquelles respiratoires ou développer une « fibrose » pulmonaire à distance de l’infection aiguë, tout comme cela a été rapporté lors des épidémies de SARS-CoV de 2003 et de middle east respiratory syndrome (MERS) [2], [3], [4], [5], [6]. Un guide pour le suivi respiratoire des patients ayant présenté une pneumonie à SARS-CoV-2 a été élaboré par la Société de Pneumologie de Langue Française (SPLF) et publié en mai 2020 [7]. La SPLF propose ici un guide pour la prise en charge des éventuelles séquelles des patients ayant présenté une pneumonie à SARS-CoV-2, sur la base des données connues des précédentes épidémies, les données préliminaires publiées sur le suivi après COVID-19 et les avis d’experts. Ces propositions pourront évoluer dans le temps au fil des connaissances sur le sujet. Elles seront à adapter aux possibilités locales compte tenu de l’ampleur de l’épidémie.
Méthodologie
Les propositions ont été élaborées par un groupe d’experts puis soumises selon la méthode Delphi à un panel composé de 10 pneumologues hospitaliers de centres hospitaliers universitaires, de 6 pneumologues hospitaliers de centres hospitaliers généraux et de 6 pneumologues libéraux, avec un pourcentage important (51 %) de pneumologues originaires de régions fortement touchées par la première vague d’infections à SARS-CoV-2. Au sein de ce panel étaient présents des représentants de plusieurs groupes de travail de la SPLF (GREPI (Groupe de Recherche et d’Enseignement en Pneumo-Infectiologie), OrphaLung, BPCO, Fonction, GAVO2 (groupe Assistance Ventilatoire et Oxygène), Alvéole, G2A (Groupe Asthme et Allergie).
Les votes des experts ont été réalisés via un outil de vote en ligne permettant une récupération des données de manière anonyme. Un délai de 10 jours était donné au panel pour répondre. Une échelle de Likert basée sur 4 réponses était proposée : pas du tout d’accord, plutôt pas d’accord, plutôt d’accord, tout à fait d’accord. Il a été considéré qu’il y avait consensus lorsqu’une proposition était validée (plutôt d’accord ou tout à fait d’accord) par au moins 75 % des membres votants du panel.
Un premier tour a été réalisé, obtenant 18 réponses. Après ce premier tour, seules 5 des 18 questions n’ayant pas trouvé consensus ont été modifiées en vue du second tour, avec finalement fusion de deux questions. À l’issue du second tour, les 17 propositions ont été validées entre 75 % et 100 % par 19 votants.
Propositions thérapeutiques
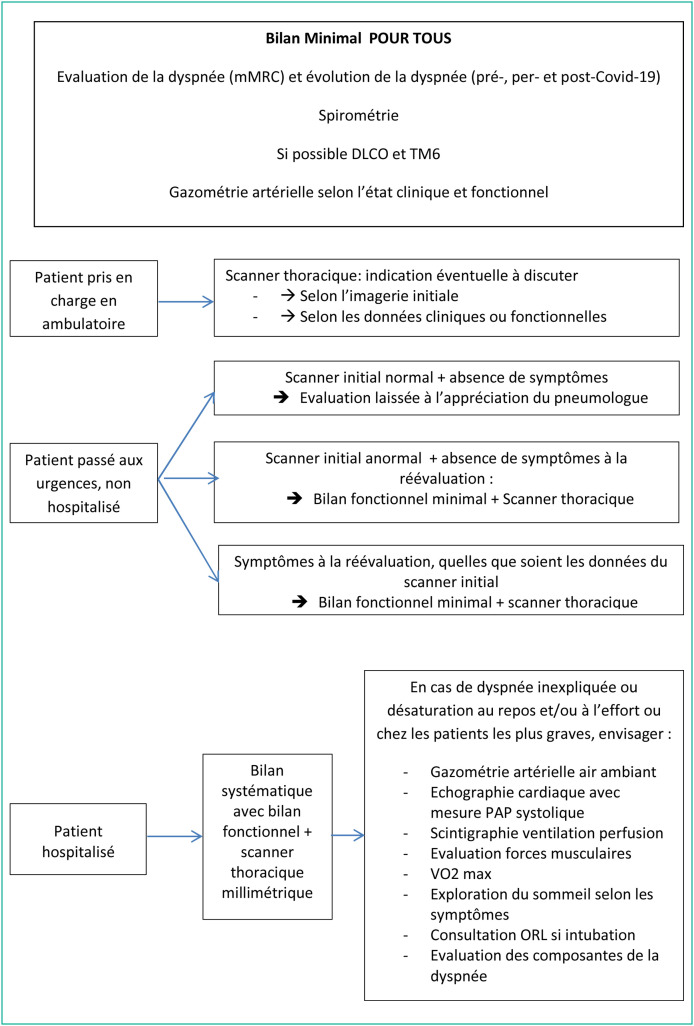
Le bilan initial proposé est celui du guide pratique de la SPLF [7]. La Fig. 1 résume la prise en charge proposée en termes de suivi [1]. Les propositions suivantes s’entendent une fois le bilan initial réalisé. Le J0 de l’infection est défini par la date d’admission des patients à l’hôpital et par le premier jour des symptômes pour les patients non hospitalisés.
Figure 1.
Propositions de suivi selon le guide de la SPLF [7].
Proposition 1
Chez un patient ayant fait une infection à SARS-CoV-2, avec une dyspnée persistante 12 semaines après le J0 de l’infection, sans étiologie évidente au terme du bilan fonctionnel respiratoire proposé par la SPLF, il est proposé de rechercher une anémie, une maladie thrombo-embolique, une cause cardiaque, un déconditionnement, un syndrome d’hyperventilation et une pathologie diaphragmatique.
91,7 % d’accord ou plutôt d’accord
Le guide pratique de la SPLF [7] recommande une tomodensitométrie thoracique et des explorations fonctionnelles respiratoires, notamment pour rechercher des séquelles parenchymateuses d’une COVID-19. Toutefois, en post COVID-19, d’autres causes de dyspnée sont possibles : anémie inflammatoire, embolie pulmonaire, myocardite virale et syndrome d’hyperventilation. La fonte musculaire rapide a été retrouvée chez quasiment tous les malades, allant jusqu’à la neuromyopathie en cas de passage en réanimation et une atteinte diaphragmatique chez certains malades.
Proposition 2
Chez un patient ayant fait une infection à SARS-CoV-2, avec une dyspnée persistante au-delà de 12 semaines après l’infection, sans diagnostic pulmonaire et extra-pulmonaire clair (guide pratique de la SPLF) et après avoir éliminé une anémie, une maladie thrombo-embolique, une cause cardiaque, un déconditionnement, un syndrome d’hyperventilation et une pathologie diaphragmatique, il est proposé de réaliser une épreuve d’effort avec réalisation de la VO2max.
79,1 % de tout à fait d’accord, plutôt d’accord
Comme dans l’exploration d’une dyspnée inexpliquée, la VO2 max permet un diagnostic multifactoriel et permet de donner des pistes, surtout chez les sujets auparavant en bonne condition physique, sur une cause unique ou multifactorielle de l’essoufflement.
Proposition 3
Chez un patient ayant fait une infection à SARS-CoV-2, il est proposé d’envisager la réhabilitation respiratoire si le patient reste symptomatique après évaluation respiratoire spécialisée, quelles que soient les données spirométriques et tomodensitométriques.
90 % plutôt d’accord et tout à fait d’accord
Peu de données sont disponibles sur SARS-CoV-2 et réhabilitation respiratoire. Une étude s’est intéressée à la réhabilitation respiratoire précoce dans le post-COVID-19 sur la fonction respiratoire physique et psychologique, avec en particulier la prise en charge des sujets âgés [8]. Soixante-douze patients ont été inclus : 36 patients ont reçu une réhabilitation respiratoire et 36 une prise en charge classique. Après 6 semaines de réhabilitation respiratoire, la différence était significative pour le VEMS, la capacité vitale fonctionnelle, le coefficient de Tiffeneau, la DLCO et le test de marche de 6 minutes entre le groupe réhabilitation respiratoire et le groupe sans réhabilitation respiratoire. Le score SF-36 était significativement amélioré dans le groupe réhabilitation respiratoire. Il n’a pas été trouvé d’impact sur le score de dépression mais un impact significatif sur le score d’anxiété. Il faut d’autre part garder en tête que la plupart de ces patients sont déconditionnés, y compris les moins sévères, et qu’ils pourront donc tirer un bénéfice d’une réhabilitation respiratoire.
Proposition 4
Chez un patient ayant fait une infection à SARS-CoV-2 et ayant des anomalies tomodensitométriques s’aggravant ou ne s’améliorant pas (à type de verre dépoli étendu ou multifocal), ou d’anomalies « nouvelles » (à type de nodules, de condensations, de réticulations, de bronchectasies) au-delà de 12 semaines du J0 de l’infection COVID-19, il est proposé de réaliser une endoscopie bronchique avec lavage broncho-alvéolaire (LBA) à visée cytologique et microbiologique et des analyses de sang incluant une recherche d’auto-immunité avec anticorps anti-nucléaires, anticorps anti-antigène soluble de noyau, facteur rhumatoïde, dot-myosites, anti-peptide cyclique citrulliné et anticorps anti-cytoplasme des polynucléaires neutrophiles, notamment en cas de doute étiologique, avant l’éventuelle introduction d’une corticothérapie ou d’un traitement anti-fibrosant.
100 % plutôt d’accord et tout à fait d’accord
Les données cliniques dans la littérature et l’expérience des centres concernant l’évolution de l’infection à SARSCoV-2 suggèrent qu’un certain nombre de patients restent symptomatiques avec, sur l’imagerie, la persistance ou l’aggravation de lésions. Sans avoir à l’heure actuelle de données publiées sur les explorations à effectuer, il parait logique de proposer des investigations étiologiques devant une pathologie interstitielle. Dans ce cadre, le LBA pourra documenter une éventuelle complication infectieuse et rechercher une alvéolite inflammatoire qui pourra être intégrée à la réflexion au cours d’une discussion multidisciplinaire. La recherche d’auto-immunité permettra de ne pas méconnaitre une pathologie auto immune sous-jacente.
Proposition 5
Chez un patient ayant fait une infection à SARS-CoV-2 et ayant des anomalies tomodensitométriques s’aggravant ou ne s’améliorant pas (à type de verre dépoli étendu ou multifocal) ou d’anomalies « nouvelles » (à type de nodules, de condensations, de réticulations, de bronchectasies) au-delà de 12 semaines du J0 de l’infection à SARS-CoV-2, il est proposé d’évaluer le retentissement fonctionnel respiratoire avec pléthysmographie, DLCO, gaz du sang artériels et test de marche de 6 minutes.
95 % plutôt d’accord et d’accord
Les données existantes au cours des pathologies pulmonaires sévères de type syndrome de détresse respiratoire aiguë (SDRA) ont montré que l’amélioration des images pulmonaires peut être très progressive sur plusieurs mois voire années [9]. Sans données dans la littérature concernant l’infection à SARS-CoV-2 autres que préliminaires [10], [11], [12] mais au vu des expériences des différents centres, il apparait important, chez les patients dont l’imagerie ne s’est pas améliorée, de proposer d’évaluer le degré de restriction pulmonaire et l’altération des échanges gazeux au repos et à l’effort par des tests simples réalisables dans la plupart des structures médicales.
Proposition 6
Chez un patient ayant fait une infection à SARS-CoV-2 et ayant des anomalies tomodensitométriques s’aggravant ou ne s’améliorant pas (à type de verre dépoli, de condensations, de réticulations ou de bronchectasies), au-delà de 12 semaines du J0 de l’infection à SARS-CoV-2 avec un retentissement fonctionnel et après avoir réalisé les investigations complémentaires recommandées, il est proposé de discuter du dossier en réunion multidisciplinaire.
100 % plutôt d’accord et tout à fait d’accord
Au terme d’une démarche diagnostique systématique, la discussion multidisciplinaire comportant des experts en pathologie interstitielle pulmonaire telle qu’elle est recommandée chez un patient ayant une pneumopathie interstitielle diffuse (PID) [13], [14] permet de discuter d’un éventuel diagnostic différentiel, l’infection venant révéler une maladie préexistante méconnue, ou venant déclencher une maladie auto-immune par exemple. Cette discussion entre les collègues ayant l’expérience et l’expertise de l’infection à SARS-CoV-2 et ceux ayant l’expertise des PID permettra de mieux définir le profil lésionnel et de proposer au patient une attitude et une prise en charge adaptée à chaque situation en prenant en compte l’existence d’une pathologie préexistante ou associée nécessitant une prise en charge spécifique.
Proposition 7
Chez un patient ayant fait une infection à SARS-CoV-2, une prise en charge globale, y compris psychologique, doit être proposée en plus de la prise en charge spécifique.
95 % plutôt d’accord et d’accord
Plusieurs travaux ont montré la survenue d’un véritable syndrome post traumatique après une infection à SARS-CoV-2 [15]. La prise en charge globale de ces patients est fondamentale compte tenu des atteintes et des symptômes multiples que peuvent présenter ces patients.
Proposition 8
Chez un patient ayant fait une infection à SARS-CoV-2, les indications d’une oxygénothérapie ne sont pas différentes de la pratique habituelle en pneumologie.
95 % plutôt d’accord et d’accord
Il n’y a pas d’argument scientifique actuellement pour penser que les indications de l’oxygénothérapie de longue durée soient différentes dans les suites de l’infection à SARS-CoV-2 par rapport aux autres pathologies respiratoires chroniques et notamment les pathologies interstitielles. Le recours à l’oxygénothérapie doit suivre les recommandations validées [16].
Proposition 9
Chez un patient ayant fait une infection à SARS-CoV-2 et connu pour une maladie respiratoire obstructive chronique (asthme ou BPCO), il est proposé de poursuivre le traitement de fond inhalé habituel, y compris le cas échéant la corticothérapie inhalée.
100 % plutôt d’accord et d’accord
Les données actuelles montrent qu’il est important, à la phase aiguë comme à la phase chronique, de maintenir un traitement de fond efficace permettant un contrôle de la maladie obstructive chronique. La corticothérapie inhalée, lorsqu’elle est indiquée par la maladie obstructive sous-jacente, permet de limiter les exacerbations dans cette période à haut risque.
Proposition 10
Chez un patient ayant fait une infection à SARS-CoV-2 et présentant une toux persistante au-delà de 12 semaines du J0 de l’infection, il est proposé d’éliminer les causes classiques de toux chronique (causes ORL, reflux gastro-œsophagien, cause iatrogène, etc) et de rechercher une hyperréactivité bronchique par un test à la métacholine.
83 % plutôt d’accord et d’accord
L’infection à SARS-CoV-2 peut démasquer une pathologie préexistante responsable d’une toux chronique, notamment une cause ORL, un reflux gastro-œsophagien ou une hyperréactivité bronchique, comme observée après d’autres pathologies infectieuses. Au-delà, de 12 semaines post COVID-19, il ne semble pas y avoir de toux spécifiquement liée à la COVID-19. Il est difficile notamment de retenir le diagnostic de toux post-virale, aussi le bilan diagnostique est le même qu’en dehors de la période COVID-19 et la réalisation d’un test de provocation bronchique est utile.
Proposition 11
Chez un patient ayant fait une infection à SARS-CoV-2 qui a conduit à la découverte d’une hyperréactivité bronchique, il est proposé d’introduire un traitement de fond par corticothérapie inhalée (seule ou en association avec des bronchodilatateurs de longue durée d’action) et de réévaluer la réponse thérapeutique à 1 mois.
95 % plutôt d’accord et d’accord
Il n’y a pas d’argument pour que la prise en charge d’une hyperréactivité bronchique découverte après une infection à SARS-CoV-2 soit différente de la prise en charge habituelle d’une hyperréactivité bronchique. La corticothérapie inhalée peut donc être prescrite devant la découverte d’une hyperréactivité bronchique non connue antérieurement selon les recommandations pour la prise en charge de l’asthme et de la BPCO (exacerbateurs fréquents) après confirmation diagnostique. Il reste important, comme habituellement, de réévaluer les patients sous traitement.
Proposition 12
Chez un patient ayant fait une infection à SARS-CoV-2 sans aucune maladie respiratoire bronchique chronique sous-jacente documentée, il est proposé de ne pas introduire de traitement par corticothérapie inhalée sous forme nébulisée.
100 % plutôt d’accord et d’accord
Des données expérimentales suggèrent que le budésonide avec glycopyrronium, en association avec le formotérol, aurait un effet inhibiteur sur la réplication virale du coronavirus [17]. Le ciclesonide aurait également un effet inhibiteur sur la réplication virale [18]. Pour l’instant il n’y a pas de résultats d’études cliniques. En dehors de toute pathologie respiratoire bronchique diagnostiquée, il n’y a pas d’arguments pour la prescription systématique de corticoïdes inhalés sous forme nébulisée.
Proposition 13
Chez un patient en phase aiguë d’infection à SARS-CoV-2, n’ayant pas de maladie respiratoire chronique sous-jacente, il est proposé de ne pas introduire de traitement par corticothérapie inhalée (que ce soit à visée préventive ou anti-tussive) en dehors d’essais thérapeutiques.
100 % plutôt d’accord et d’accord
En dehors de toute pathologie respiratoire bronchique diagnostiquée, et en dehors d’un diagnostic d’hyperréactivité bronchique il n’y a pas d’arguments pour la prescription systématique de corticoïdes inhalés chez des patients présentant des symptômes persistants de toux et/ou de dyspnée.
Proposition 14
Chez un patient ayant fait une infection à SARS-CoV-2 et ayant des anomalies tomodensitométriques « persistantes » (à type de verre dépoli étendu ou multifocal), ou « nouvelles » (à type de nodules, de condensations, de réticulations, avec ou sans bronchectasies par traction), et présentant une dyspnée et/ou une toux et/ou des anomalies fonctionnelles persistantes à moins d’un an du début d’une infection à SARS-CoV-2, il est proposé de prescrire, après discussion multidisciplinaire, une corticothérapie orale en l’absence de contre-indication et après s’être assuré de l’absence de toute infection active.
84 % plutôt d’accord et d’accord
Les opacités persistantes dans les suites de COVID-19 correspondraient assez souvent à une pneumopathie organisée ou à des lésions inflammatoires cellulaires, même si les données objectives manquent pour l’affirmer. La pneumopathie organisée est très sensible aux corticoïdes [19]. Le développement d’un tableau radio-clinique évocateur de pneumopathie organisée peut constituer une indication à la corticothérapie dans les formes retardées de COVID-19, après la phase aiguë, en cas de persistance des opacités parenchymateuses. Ces lésions pourraient expliquer le bénéfice associé à la corticothérapie chez certains patients atteints de COVID-19 [20]. Dans d’autres contextes, des formes fibrosantes de pneumopathie organisée ont été décrites [21] ainsi que des formes de chevauchement avec une pneumopathie interstitielle non spécifique [22].
Proposition 15
Chez un patient ayant présenté une infection à SARS-CoV-2, si une corticothérapie est décidée dans le cadre d’anomalies tomodensitométriques associées à une dyspnée et/ou une toux et/ou des anomalies fonctionnelles persistantes, il est proposé de la prescrire à la dose de 0,5 mg/kg/j de prednisone en arrondissant à la dizaine inférieure pendant un mois, puis diminuée par paliers de 10 mg/j tous les mois. La prescription de la corticothérapie sera assortie de mesures d’information et de prévention afin de réduire autant que possible les effets secondaires de cette corticothérapie. Une première évaluation clinique peut avoir lieu à 1 mois.
84 % plutôt d’accord et d’accord
Compte tenu du peu d’arguments sur lesquels repose la prescription de corticoïdes dans le cadre de la persistance d’anomalies post infection à SARS-CoV-2, cette prescription doit être encadrée et assortie d’une surveillance rapprochée de l’efficacité et de la tolérance et de la mise en place de toutes les mesures associées pour limiter les effets secondaires de cette corticothérapie.
Proposition 16
Chez un patient chez lequel une corticothérapie orale a été prescrite pour une dyspnée et/ou une toux et des anomalies tomodensitométriques « persistantes » après une infection à SARS-CoV-2, il est proposé d’évaluer cliniquement le patient à 1 mois du début de la corticothérapie et de réaliser à 3 mois l’exploration fonctionnelle respiratoire (spirométrie, DLCO) et le scanner thoracique.
100 % plutôt d’accord et d’accord
Compte tenu du peu d’arguments sur lesquels repose la prescription de corticoïdes dans le cadre d’anomalies persistantes suivant une infection à SARS-CoV-2, cette prescription doit être réévaluée précocement, cliniquement dès un mois si possible, et au minimum par exploration fonctionnelle respiratoire et scanner thoracique pour vérifier de l’efficacité du traitement afin de ne pas poursuivre un traitement inefficace.
Proposition 17
Chez un patient ayant des anomalies tomodensitométriques « persistantes » avec des signes évocateurs de ‘fibrose’ (réticulations, avec ou sans bronchectasies par traction) et présentant une diminution de la DLCO à plus de 12 semaines et moins d’un an du début d’une infection à SARS-CoV-2, il est proposé de tester l’efficacité d’un médicament anti-fibrosant (nintédanib ou pirfénidone) après discussion multidisciplinaire. L’inclusion dans un essai thérapeutique sera recherchée en priorité.
89 % plutôt d’accord et d’accord
Le nintédanib ralentit l’évolution de la fibrose pulmonaire idiopathique [23] et des PID avec phénotype de fibrose progressive (« fibroses pulmonaires progressives ») de causes diverses qui s’aggravent malgré une prise en charge optimale incluant, dans la majorité des cas, une corticothérapie et/ou un traitement immunosuppresseur [24]. La pirfenidone réduit l’évolution des fibroses pulmonaires inclassables progressives [25]. Dans la majorité des cas et sauf contre-indication absolue, une corticothérapie orale est justifiée en première intention en cas d’anomalies interstitielles persistantes dans les suites de COVID-19. L’efficacité des anti-fibrosants dans le contexte des anomalies persistantes après COVID-19 n’est pas connue à ce jour; il semble que la survenue d’une fibrose pulmonaire à distance de l’infection et continuant de s’aggraver malgré une corticothérapie soit une complication rare voire très rare. L’indication éventuelle d’un traitement anti-fibrosant en seconde intention après la corticothérapie doit donc faire l’objet d’une discussion multidisciplinaire spécialisée. En l’absence de données sur l’efficacité de ce traitement dans cette indication, l’inclusion dans un essai thérapeutique évaluant un anti-fibrosant devra être privilégiée.
Déclaration de liens d’intérêts
Au cours des 5 dernières années, B. Crestani a perçu des honoraires ou financements pour participation à des congrès, communications, actions de formation, conseil, participation à des groupes d’experts et des travaux de recherche, de la part des laboratoires et entreprises AstraZeneca, BMS, Boehringer Ingelheim, Chiesi, LVL, Novartis, Roche, Sanofi.
Au cours des 5 dernières années, B. Crestani a été investigateur principal, coordonnateur ou responsable scientifique d’études cliniques promues par les laboratoires Boehringer Ingelheim, Novartis, Roche.
Les autres auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Wiersinga W.J., Rhodes A., Cheng A.C. Pathophysiology, transmission, diagnosis, and treatment of Coronavirus Disease 2019 (COVID-19): a review. JAMA. 2020;324:782–793. doi: 10.1001/jama.2020.12839. [DOI] [PubMed] [Google Scholar]
- 2.Wong K.T., Antonio G.E., Hui D.S. Thin-section CT of severe acute respiratory syndrome: evaluation of 73 patients exposed to or with the disease. Radiology. 2003;228:395–400. doi: 10.1148/radiol.2283030541. [DOI] [PubMed] [Google Scholar]
- 3.Hsu H.H., Tzao C., Wu C.P. Correlation of high-resolution CT, symptoms, and pulmonary function in patients during recovery from severe acute respiratory syndrome. Chest. 2004;126:149–158. doi: 10.1378/chest.126.1.149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Müller N.L., Ooi G.C., Khong P.L. High resolution CT findings of severe acute respiratory syndrome at presentation and after admission. Am J Roentgenol. 2004;182:39–44. doi: 10.2214/ajr.182.1.1820039. [DOI] [PubMed] [Google Scholar]
- 5.Ooi G.C., Khong P.L., Müller N.L. Severe acute respiratory syndrome: temporal lung changes at thin-section CT in 30 patients. Radiology. 2004;230:836–844. doi: 10.1148/radiol.2303030853. [DOI] [PubMed] [Google Scholar]
- 6.Chang Y.C., Yu C.J., Chang S.C. Pulmonary sequelae in convalescent patients after severe acute respiratory syndrome: evaluation with thin-section CT. Radiology. 2005;236:1067–1075. doi: 10.1148/radiol.2363040958. [DOI] [PubMed] [Google Scholar]
- 7.Andréjak C., Blanc F.X., Costes F. Guide for follow-up of patients with SARS-CoV-2 pneumonia. Management proposals developed by the French-language Respiratory Medicine Society. Version of 10 may 2020. Rev Mal Respir. 2020;37:505–510. doi: 10.1016/j.rmr.2020.05.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Liu K., Zhang W., Yang Y. Respiratory rehabilitation in elderly patients with COVID-19: A randomized controlled study. Complementary therapies in clinical practice. 2020;39:101166. doi: 10.1016/j.ctcp.2020.101166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chang Y.C., Yu C.J., Chang S.C. Pulmonary sequelae in convalescent patients after severe acute respiratory syndrome: evaluation with thin-section CT. Radiology. 2005;236:1067–1075. doi: 10.1148/radiol.2363040958. [DOI] [PubMed] [Google Scholar]
- 10.Mo X., Jian W., Su Z. Abnormal pulmonary function in COVID-19 patients at time of hospital discharge. Eur Respir J. 2020;55:2001217. doi: 10.1183/13993003.01217-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Frija-Masson J., Debray M.P., Gilbert M. Functional characteristics of patients with SARS-CoV-2 pneumonia at 30 days post-infection. Eur Respir J. 2020;56:2001754. doi: 10.1183/13993003.01754-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Rogliani P., Calzetta L., Coppola A. Are there pulmonary sequelae in patients recovering from COVID-19? Respir Res. 2020;21:286. doi: 10.1186/s12931-020-01550-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Walsh S.L.F., Wells A.U., Desai S.R. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a case-cohort study. Lancet Respir Med. 2016;4:557–565. doi: 10.1016/S2213-2600(16)30033-9. [DOI] [PubMed] [Google Scholar]
- 14.Cottin V., Crestani B., Cadranel J. French practical guidelines for the diagnosis and management of idiopathic pulmonary fibrosis - 2017 update. Full-length version. Rev Mal Respir. 2017;34:900–968. doi: 10.1016/j.rmr.2017.07.017. [DOI] [PubMed] [Google Scholar]
- 15.Rogers J.P., Chesney E., Oliver D. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. Lancet Psychiatry. 2020;7:611–627. doi: 10.1016/S2215-0366(20)30203-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.http://www.has-sante.fr/portail/upload/docs/application/pdf/2012-07/oxygenotherapie_-_fiche_buts.pdf.
- 17.Gut-Gobert C., L’Her E. Indications and practical issues concerning oxygen therapy. Rev Mal Respir. 2006;23:3S13–23S. [PubMed] [Google Scholar]
- 18.Yamaya, Yamaya M., Nishimura H. Inhibitory effects of glycopyrronium, formoterol, and budesonide on coronavirus HCoV-229E replication and cytokine production by primary cultures of human nasal and tracheal epithelial cells. Respir Investig. 2020;58:155–168. doi: 10.1016/j.resinv.2019.12.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Cottin V., Cordier J.F. Cryptogenic organizing pneumonia. Semin Respir Crit Care Med. 2012;33:462–475. doi: 10.1055/s-0032-1325157. [DOI] [PubMed] [Google Scholar]
- 20.Shang L., Zhao J., Hu Y. On the use of corticosteroids for 2019-nCoV pneumonia. Lancet. 2020 29;395:683–684. doi: 10.1016/S0140-6736(20)30361-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Beardsley B., Rassl D. Fibrosing organising pneumonia. J Clin Pathol. 2013;66:875–881. doi: 10.1136/jclinpath-2012-201342. [DOI] [PubMed] [Google Scholar]
- 22.Todd N.W., Marciniak E.T., Sachdeva A. Organizing pneumonia/non-specific interstitial pneumonia overlap is associated with unfavorable lung disease progression. Respir Med. 2015;109:1460–1468. doi: 10.1016/j.rmed.2015.09.015. [DOI] [PubMed] [Google Scholar]
- 23.Richeldi L., du Bois R.M., Raghu G. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370:2071–2082. doi: 10.1056/NEJMoa1402584. [DOI] [PubMed] [Google Scholar]
- 24.Flaherty K.R., Wells A.U., Cottin V. Nintedanib in progressive fibrosing interstitial lung diseases. N Engl J Med. 2019;381:1718–1727. doi: 10.1056/NEJMoa1908681. [DOI] [PubMed] [Google Scholar]
- 25.Maher T.M., Corte T.J., Fischer A. Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet Respir. 2020;8:147–157. doi: 10.1016/S2213-2600(19)30341-8. [DOI] [PubMed] [Google Scholar]