Die Prävalenz der Colitis ulcerosa ist in den letzten Jahrzehnten weltweit deutlich angestiegen. In Europa sind es vor allem die jungen und die alten Patienten, bei denen eine Zunahme der Erkrankung beobachtet wird. Die Therapiealgorithmen wurden sowohl in der 2020 aktualisierten DGVS-S3-Leitlinie als auch im Rahmen der 2017 überarbeiteten Leitlinie der European Crohn's and Colitis Organisation (ECCO) neu publiziert. Der folgende Artikel gibt ein Update der aktuellen Behandlungsprinzipien.
Bei dem heute verfügbaren großen Spektrum an Therapieoptionen der Colitis ulcerosa (CU) wird die individuelle Strategie für den einzelnen Patienten immer komplexer und muss neben dem Schweregrad der Entzündung auch ihre Ausdehnung, aber ebenso die Verlaufsform der Erkrankung (akut-intermittierend, chronisch-rezidivierend, chronisch-persistierend) sowie individuelle Faktoren, wie Alter, Vorerkrankungen und Komorbiditäten, berücksichtigen.
Konventionelle Therapie der CU
Das wichtigste Standardtherapeutikum der unkompliziert verlaufenden CU stellt nach wie vor Mesalazin dar [1]. Mesalazin wird bei der leicht- bis mittelgradig aktiven CU eingesetzt und steht in unterschiedlichen Applikationsformen zur Verfügung. In Abhängigkeit von der Krankheitsausdehnung, die üblicherweise in eine Proktitis, eine Linksseitenkolitis und eine ausgedehnte Kolitis unterteilt wird, wird bei der Proktitis initial Mesalazin rektal und bei der Linksseitenkolitis oder ausgedehnten Kolitis Mesalazin oral in Kombination mit einer rektalen Gabe verabreicht (▶Abb. 1). Kann mit Mesalazin eine Remission induziert werden, erfolgt eine Erhaltungstherapie mit Mesalazin über mindestens zwei Jahre [2, 3]. Alternativ kann auch das Probiotikum E. coli Nissle zur Remissionserhaltung eingenommen werden, das in mehreren Studien bei dieser Indikation keine Unterlegenheit gegenüber Mesalazin zeigte [4]. Sollte durch eine Monotherapie mit Mesalazin keine Remission erreicht werden, können ergänzend zu Mesalazin bei der Proktitis rektal Steroide zum Beispiel in Form von Suppositorien eingesetzt werden. Bei der über das Rektum hinausgehenden Kolitis ergibt sich die Therapieoption mit Budesonid MMX, das aufgrund seiner Galenik mit verzögerter Freisetzung im distalen Kolon bei der leicht- bis mittelgradig aktiven Kolitis angewendet werden kann [5]. Ist auch unter diesem Therapieregime keine Remission zu erzielen, sollten systemische Glukokorticoide eingesetzt werden. Die üblicherweise verwendete Dosis beträgt in der Initialtherapie 1 mg/kg Körpergewicht [KG] pro Tag mit einem Reduktionsschema, das zum Ziel haben sollte, nach spätestens drei Monaten unter 7,5 mg Prednisolonäquivalent pro Tag zu liegen. Beispielsweise kann eine Therapie mit 60 mg Prednisolon über eine Woche durchgeführt werden, gefolgt von einer wöchentlichen Dosisreduktion um 10 mg und bei einer Dosis von 20 mg dann um 5 mg/Woche. Treten unter der Dosisreduktion erneut stärkere Beschwerden auf, kann das einen steroidabhängigen Verlauf anzeigen (s. u.). Bei allen genannten Therapieoptionen der konventionellen Therapiesäulen wird Mesalazin oder alternativ das Probiotikum E. coli Nissle in der Erhaltungstherapie über mindestens zwei Jahre eingesetzt. Mesalazin hat über den antientzündlichen Effekt hinaus auch einen karzinompräventiven Effekt [6].
Die schwer verlaufende CU, die in erster Linie klinisch definiert ist, wird üblicherweise unabhängig von der Lokalisation mit Prednisolon (1 mg/kg Körpergewicht Initialdosis pro Tag) behandelt. Auch hier gilt, dass eine Erhaltungstherapie nach erfolgreicher Induktionstherapie notwendig ist.
Etwa 50 % der Patienten, die an einer CU leiden, können mit den genannten Möglichkeiten der konventionellen Therapie gut geführt werden.
Etwa 50 % der Colitis-ulcerosa-Patienten, können mit der konventionellen Therapie gut geführt werden.
Komplizierte Verlaufsformen
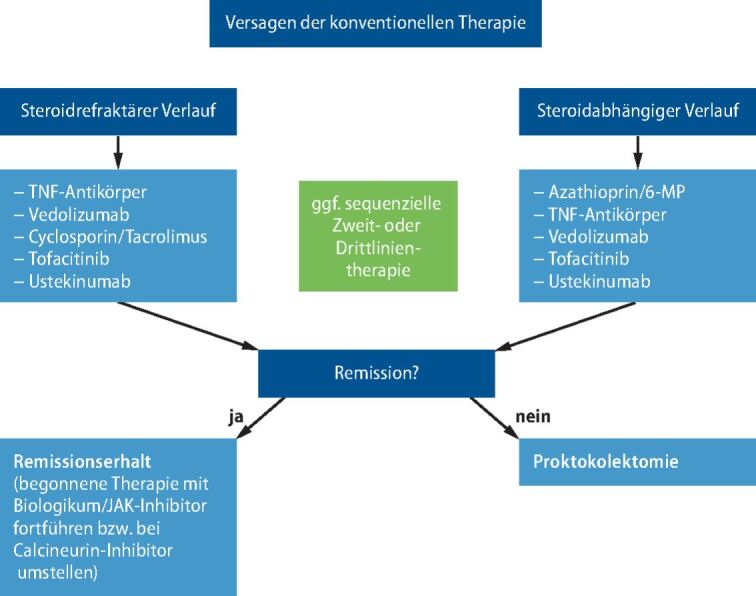
Die andere Hälfte der Patienten mit CU leidet an einer komplizierten Verlaufsform der CU, die dann entweder chronisch rezidivierend oder chronisch persistierend verläuft. Verschiedene Einteilungen bezüglich des klinischen Verlaufs helfen in diesen Fällen, die richtige Therapieform zu finden. Üblicherweise unterscheiden wir eine steroidabhängige und eine steroidrefraktäre Verlaufsform der Erkrankung. Wenngleich es keine allgemeingültige Definition dieser Krankheitsverläufe gibt, verstehen wir unter einer Steroidabhängigkeit üblicherweise das Wiederaufflammen der Krankheitsaktivität im Rahmen der Reduktion der Glukokortikoide innerhalb von drei Monaten unter 10 mg/kg KG. Auch ein Frührezidiv, das innerhalb der ersten drei Monate nach Absetzen einer Steroidtherapie auftritt, wird üblicherweise einer Steroidabhängigkeit zugeschrieben.
Die Differenzialtherapie der komplizierten Verlaufsform der CU wird individualisiert durchgeführt.
Der Begriff der Steroidrefraktärität ist nicht eindeutig definiert. Das Nichtansprechen auf Steroide kann je nach Krankheitsaktivität zu unterschiedlichen Zeitpunkten definiert werden und zum Beispiel beim fulminanten Verlauf der Erkrankung bereits nach vier Tagen vorliegen und zu einer Therapieentscheidung zwingen. Bei weniger dramatischen Krankheitsverläufen kann der steroidrefraktäre Verlauf durchaus auch nach längerer, zum Teil bis nach vierwöchiger Therapie definiert werden. Auch die Steroidabhängigkeit wird von einigen Autoren als steroidrefraktäre Unterform der Erkrankung interpretiert. Die Einschätzung der Krankheitsaktivität erfolgt dabei im Kontext der klinischen Symptomatik, bei der die Stuhlfrequenz und Hämatochezie zweifelsfrei im Vordergrund stehen, aber unbedingt auch objektive Parameter, wie Biomarkern (CRP, fäkales Calprotectin), Darmsonografie und endoskopischer Befunde.
Für die steroidabhängige und steroidrefraktäre Verlaufsform der Erkrankung stehen neben dem Immunsuppressivum Azathioprin, das nach wie vor eine Bedeutung bei der steroidabhängigen CU besitzt, verschiedene TNF-Antikörper (Infliximab, Adalimumab und Golimumab), der Integrin-Antikörper Vedolizumab, IL12/IL-23-Antikörper (z. B. Ustekinumab) sowie der Januskinase (JAK)-Inhibitor Tofacitinib zur Verfügung (▶Abb. 2, ▶Tab. 1). Alle genannten Medikamente können grundsätzlich bei Steroidabhängigkeit eingesetzt werden. Bei steroidrefraktärem Verlauf werden aufgrund der Notwendigkeit, eine rasche Remission zu erzielen, in erster Linie die Medikamente eingesetzt, die eine rasche Wirksamkeit zeigen. Auch hier gibt es in Abhängigkeit vom Wirkmechanismus ein unterschiedlich schnelles Ansprechen der Medikamente, was bei der Wahl der Medikation individuell berücksichtigt werden sollte. Neben den TNF-Antikörpern, Ustekinumab, Vedolizumab und Tofacitinib stehen beim steroidrefraktären Krankheitsverlauf auch die Calcineurininhibitoren Ciclosporin und Tacrolimus zur Verfügung.
| Wirksubstanz | Applikation | Induktion* | Erhaltungstherapie* |
|---|---|---|---|
| Infliximab | i. v. (i. v. oder s. c. in der Erhaltungstherapie) | 5 mg/kg KG, Woche 0, 2, 6 | 5 mg/kg KG alle acht Wochen i. v. (oder 120 mg s. c. alle zwei Wochen für IFX-Biosimilar) |
| Adalimumab | s. c. | 80/40 mg (160/80 mg) | 40 mg alle zwei Wochen |
| Golimumab | s. c. |
200/100 mg Woche 0, 2 |
50 oder 100 mg/100 mg (< 80/> 80 kg) alle vier Wochen |
| Vedolizumab | i. v. (i. v. oder s. c. in der Erhaltungs-therapie) |
300 mg Woche 0, 2, 6 |
300 mg alle acht Wochen oder 100 mg s. c. alle zwei Wochen |
| Ustekinumab | i. v. initial, dann s. c. | 6 mg/kg KG | 90 mg alle acht/zwölf Wochen |
| Tofacitinib | oral | 2 x 10 mg für acht Wochen | 2 x 5 mg/Tag |
(*Angaben laut Fachinformation, individuelle Dosisanpassungen zum Teil notwendig)
IFX = Infliximab; i. v. = Intravenös; s. c. = subkutan)
Individualisierte Differenzialtherapie
Die Erweiterung der Therapieoptionen ist einerseits als außerordentlich positiv zu werten, insbesondere wenn man bedenkt, wie eingeschränkt die Therapieoptionen noch vor wenigen Jahren waren. Anderseits stellt sich uns im klinischen Alltag häufig die Frage, in welcher Reihenfolge die Medikamente im Einzelfall eingesetzt werden können. Da bisher keine beziehungsweise wenig randomisierte Vergleichsstudien zur Verfügung stehen, kann eine generelle Priorisierung der genannten Biologika/JAK-Inhibitor nicht vorgegeben werden. Die Differenzialtherapie der komplizierten Verlaufsform der CU wird daher individualisiert durchgeführt und berücksichtigt Kriterien wie die persönliche Erfahrungen mit der Medikation, das Alter des Patienten, die Dauer der Erkrankung, den bisherigen Verlauf, die Aktivität der Kolitis, das Nebenwirkungsspektrum und auch die persönliche Präferenzen der Patienten [1]. Bei der steroidabhängigen Verlaufsform wird in der Regel ein Behandlungsversuch mit Azathioprin durchgeführt. Hierbei sollte der EBV-Status beachtet werden, da Thiopurine bei EBV-negativen Patienten aufgrund des erhöhten Risikos für eine lymphoproliferative Erkrankung in der Regel vermieden werden sollten. Bei Azathioprinversagen oder -unverträglichkeit wird aufgrund der langjährigen Erfahrung in den meisten Fällen als erstes Biologikum ein TNF-Antikörper eingesetzt.
TNF-Antikörper
TNF-Antikörper spielen schon seit vielen Jahren eine bedeutende Rolle in der Therapie der CU. Hier haben sich neben Infliximab, Adalimumab und Golimumab als wirksam erwiesen [7, 8, 9]. Neben den Originatorpräparaten stehen für Infliximab und Adalimumab mittlerweile auch Biosimilars zur Verfügung, die in der Primäreinstellung aber auch beim einmaligen Wechsel äquivalent eingesetzt werden können. Hierbei kann sich beispielsweise für den Infliximab-Biosimilar auch die Option einer weiteren Applikationsform mit der subkutanen Verabreichung ergeben (s. u.). Ein Multiswitch zwischen den verschiedenen Präparaten wird zum gegenwärtigen Zeitpunkt wegen gefürchteter beziehungsweise ungeklärter Immunigenitätsprobleme nicht empfohlen. In Netzwerkanalysen kontrollierter Studien hat sich Infliximab als der wirksamste TNF-Antikörper und Adalimumab als am wenigsten wirksam erwiesen. Dies sollte bei der Wahl der Therapeutika berücksichtigt werden.
Anti-Integrin-Antikörper
Als Anti-Integrin-Antikörper steht seit einigen Jahren Vedolizumab zur Verfügung, das aufgrund des etwas verzögerten Wirkeintritts in erster Linie bei der steroidabhängigen Form der CU, aber bei mäßiggradiger Aktivität der Kolitis auch bei steroidrefraktären Formen zum Einsatz kommt [10].
Zu Vedolizumab sowie zu dem Infliximab-Biosimilar CT-P13, die bisher primär intravenös appliziert wurden, zeigen jüngere Studiendaten auch in der Langzeitwirkung eine gleich gute Wirkung bei Wechsel der intravenösen Induktion auf eine subkutane Applikationsform. Beide Therapien sind seit kurzem für die Subkutantherapie nach i. v. Induktion zugelassen, was die Praktikabilität der Anwendung noch einmal deutlich verbessert. Die Entscheidung zwischen infusionaler und subkutaner Therapie sollte dabei mit Blick auf den Patientenwunsch und die Compliance getroffen werden.
Antikörper gegen Interleukin-12/23
Ustekinumab, ein humaner monoklonaler Antikörper gegen Interleukin-12/23, der seit einigen Jahren schon erfolgreich in der Therapie des Morbus Crohn eingesetzt wird, steht nun seit einiger Zeit auch für die Therapie der mittelschweren bis schweren CU zur Verfügung [11]. Nach dem bewährten Schema der i. v. Induktion, gefolgt von einer subkutanen Applikation zeigt die Medikation nicht nur eine gute Wirksamkeit, sondern nach bisherigen Studiendaten und Erfahrungen auch eine gute Verträglichkeit. Die Entscheidung zwischen infusionaler und subkutaner Therapie sollte dabei mit Blick auf den Patientenwunsch und die Compliance getroffen werden.
Bei steroidrefraktärem Verlauf werden wegen der Notwendigkeit, eine schnelle Remission zu erzielen, in erster Linie die Medikamente eingesetzt, die eine rasche Wirksamkeit zeigen.
Januskinase(JAK)-Inhibitoren
Der orale JAK-Inhibitor Tofacitinib, der bereits seit einigen Jahren bei der rheumatoiden Arthritis eingesetzt wird, ist nach Belegung der Wirksamkeit in drei randomisierten Studien auch für die Therapie der mittelschweren bis schweren CU zugelassen [12]. Nach gegenwärtigen Erkenntnissen ist Vorsicht bei bestimmten Risikokonstellationen geboten, da es unter einer Therapie mit Tofacitinib insbesondere zu thromboembolischen Komplikationen, aber auch zu vermehrten Virusinfektionen beziehungsweise Herpes zoster-Reaktivierungen kommen kann. Für den Fall einer schweren SARS-CoV-2-Infektion sollte die Therapie mit Tofacitinib pausiert werden. Gleiches gilt gemäß der zum Zeitpunkt der Veröffentlichung gültigen Empfehlungen der DGVS für eine Therapie mit systemisch wirksamen Glukokortikoiden, Azathioprin und MTX [13].
Remissionsinduktion und -erhaltung
Jüngere Netzwerkanalysen zeigen, dass es bezüglich der Wirksamkeit verschiedener Biologika und JAK-Inhibitoren durchaus Unterschiede hinsichtlich der Remissionsinduktion und -erhaltung, aber auch in Bezug auf Nebenwirkungen gibt [14, 15]. Eine erste Head-to-Head-Studie zwischen Adalimumab und Vedolizumab bezüglich der Wirksamkeit bei mittel- bis schwergradig aktiver CU zeigte beim primären Endpunkt eine höhere klinische Remissionsrate bei Vedolizumab [16]. Der Unterschied zwischen beiden Substanzen zeigte sich bereits sechs bis 14 Wochen nach Therapiebeginn. Weitere Head-to-Head-Studien, die uns bezüglich der Priorisierung der Medikation bei komplizierter Verlaufsform der CU therapeutisch vermutlich leiten werden, folgen in den kommenden Jahren.
Bezüglich der Wirksamkeit verschiedener Biologika und JAK-Inhibitoren gibt es Unterschiede in der Remissionsinduktion und -erhaltung, aber auch in Bezug auf Nebenwirkungen.
Zur Sicherstellung einer langfristigen Remission ist grundsätzlich eine Mukosa heilung nach Schubtherapie zu fordern, die etwa drei bis sechs Monate nach Therapiebeginn endoskopisch überprüft werden sollte.
Eine besonders refraktäre Form der Entzündung stellt die therapierefraktäre Proktitis dar, die mit Kortison-Suppositorien (z. B. mit Beclometason-Suppositorien) oder bei steroidrefraktären Fällen auch mit Tacrolimus-Suppositorien behandelt werden kann [17].
Fulminante Formen
Eine weitere Sonderform der steroidrefraktären Kolitis stellt die fulminante Form der CU dar, die einer besonderen Therapie und Aufmerksamkeit bedarf (▶Abb. 3). Grundsätzlich sollten Patienten mit einer fulminanten Form der CU stationär behandelt werden und eine Thromboseprophylaxe erhalten. Neben einer initialen Stuhldiagnostik zum Ausschluss pathogener Keime und Clostridioides difficile sollte immer auch an eine CMV-Reaktivierung gedacht werden und diese mittels quantitativer PCR im Blut oder im Gewebe ausgeschlossen werden. Nach einer üblicherweise durchgeführten i. v. Steroidtherapie sollte am dritten bis vierten Tag evaluiert werden, ob hier ein relevantes Therapieansprechen vorliegt oder nicht. Falls dies nicht der Fall ist, stehen als medikamentöse Therapieoptionen entweder Ciclosporin i. v. (2 mg/kg KG pro Tag) oder Infliximab (5 mg/kg KG +/- Azathioprin) zur Verfügung [18, 19]. In Abhängigkeit von der Schwere der Entzündung sollte in der interdisziplinären Evaluation gemeinsam zwischen Gastroenterologen und Viszeralchirurgen auch über die Kolektomie diskutiert werden. Kommt es unter einer der genannten Therapien, die in zwei randomisierten Studien eine vergleichbare Wirkung aufwiesen, nicht zu einer relevanten Besserung innerhalb etwa einer Woche, sollten die Patienten proktokolektomiert werden. Der Wechsel der medikamentösen Therapie auf eine Drittlinientherapie stellt in dieser Situation keinen Standard dar. Nach Remissionsinduktion einer fulminanten CU mit Infliximab (mit oder ohne Thiopurine) sollte die remissionsinduzierende Therapie in der Erhaltungstherapie weiter fortgesetzt werden. Nach einer Remissionsinduktion mit Calcineurin-Inhibitoren wie Ciclosporin oder Tacrolimus sollte hier eine remissionsserhaltende Therapie mit Azathioprin oder bei Azathioprin-Versagen in der Vergangenheit mit einem anderen Biologikum wie Vedolizumab oder einem TNF-Antikörper durchgeführt werden.
Grundsätzlich gilt, dass nach Remissionsinduktion mit einem Biologikum oder einem JAK-Inhibitor die remissionsinduzierende Medikation weiter fortgeführt werden sollte. Über die Dauer der remissionserhaltenden Therapie mit einem Thiopurin, einem Biologikum oder einem JAK-Inhibitor gibt es keine verlässlichen Daten, sodass dies individuell entschieden werden muss.
Mukosaheilung
Da sich seit längerem gezeigt hat, dass die klinische Remission als Therapieziel allein nicht ausreichend ist und die intestinale Entzündung bei CU zur Sicherstellung einer langfristigen Remission und zur Vermeidung von Strukturschäden nach erfolgreicher Schubtherapie reduziert werden sollte, ist grundsätzlich eine Mukosaheilung nach Schubtherapie zu fordern [19]. Dies sollte etwa drei bis sechs Monate nach Therapiebeginn endoskopisch überprüft werden. Alternativ kann als Surrogatparameter auch eine Bestimmung von Calprotectin im Stuhl drei bis sechs Monate nach Therapiebeginn erfolgen, da der Calprotectinwert gut mit der endoskopischen Entzündungsaktivität korreliert [20, 21]. Die in letzter Zeit häufiger diskutierte histologische Heilung stellt aktuell noch kein etabliertes Therapieziel dar.
Kürzlich konnte des Weiteren gezeigt werden, dass auch der Darmultraschall eine verlässliche Methode darstellt, um das Therapieansprechen nach Remissionsinduktion zu evaluieren [22]. Ein erfolgreiches Ansprechen auf die Therapie zeigt sich im Darmultraschall bereits zwei Wochen nach Remissionsinduktion durch eine Verminderung der Darmwanddicke und der Vaskularisierung.
Chirurgische Therapie
Das chirurgische Standardverfahren bei CU stellt die restaurative Proktokolektomie dar. Neben der therapierefraktären CU ergibt sich hier die kolitisassoziierte Neoplasie als wichtigste chirurgische Therapieindikation. Grundsätzlich sollte die Indikation zur Proktokolektomie innerhalb eines erfahrenen viszeralmedizinischen Teams gestellt werden. Bei den therapierefraktären komplizierten Verlaufsformen der CU gilt grundsätzlich, dass bei jeder Therapieeskalation die Möglichkeit einer Proktokolektomie mit berücksichtigt und dies mit dem Patienten diskutiert werden sollte. Bei einer fulminanten CU sollte diese Entscheidung immer grundsätzlich im interdisziplinären Austausch im viszeralmedizinischen Team erfolgen.
Kolitiskarzinom und endoskopisch nicht resezierbare Epitheldysplasie
Neben den therapierefraktären Verläufen stellt das Kolitiskarzinom oder die endoskopisch nicht resezierbare Epitheldysplasie eine absolute Indikation zur Proktokolektomie dar. Bei dem Nachweis hochgradiger Epitheldysplasien in endoskopisch unauffälliger Schleimhaut ist die Rate synchroner Karzinome im Restkolon mit etwa 45 % so hoch, dass hier ebenfalls die Indikation zur Proktokolektomie besteht. Ein erhöhtes Karzinomrisiko beobachten wir auch bei niedriggradigen Epitheldysplasien, das in jüngeren Metaanalysen etwa um das Neunfache erhöht ist [23]. Kolonstenosen, deren Dignität unklar bleiben, stellen ebenfalls eine relative Indikation zur Operation dar. Hier kann bei präoperativ nicht eindeutiger Klärung der Dignität grundsätzlich zunächst auch eine partielle Resektion erfolgen. Bei Nachweis eines Karzinoms ist in der Regel jedoch auch eine Proktokolektomie notwendig. Im Zweifel sollte bei Kolonstenosen die Indikation zur Operation großzügig gestellt werden, da auch bei bildgebend und bioptisch fehlenden Hinweisen auf Malignität bereits in etwa 8 % der Fälle ein Karzinom oder höhergradige Dysplasien vorliegen [24]. Da sich der vorliegende Artikel auf die aktuellen Therapieoptionen der Colitis ulcerosa beschränkt, wird an dieser Stelle auf die Ausführungen zu den diagnostischen Algorithmen inklusive der Überwachungskoloskopien verzichtet.
Limitierte Kolonresektionen stellen Ausnahmen dar, über die in Einzelfällen und von einem erfahrenen interdisziplinären Team entschieden werden sollte.
Dreizeitige Operation
Bei der Notwendigkeit der Proktokolektomie in therapierefraktären Konstellationen sollte bei erhöhtem perioperativen Risiko bedingt durch die Immunsuppression dreizeitig operiert werden. Die dreizeitige Operation besteht in der primären Durchführung einer subtotalen Kolektomie mit endständigem Ileostoma mit anschließender Restmukosektomie mit Ileo-analer Pouch-Anlage und doppelläufigem Ileostoma in der zweiten Operation und zuletzt dem dritten Schritt der Ileostoma-Rückverlagerung. Zahlreiche Studien und die Erfahrung der letzten Jahrzehnte zeigen, dass die restaurative Proktokolektomie mit Ileumpouch-analer Anastomose für den Patienten eine sinnvolle Therapieoption mit guter Lebensqualität darstellt.
Fazit für die Praxis
Die konventionelle Therapie der CU basiert nach wie vor auf den therapeutischen Säulen Mesalazin und Glukokortikoiden, die in unterschiedlichen Applikationsformen eingesetzt werden können. Systemisch wirkende Glukokortikoide sollten aufgrund der Nebenwirkungen nur kurzfristig verwendet werden. Alternativ steht seit einigen Jahren das topisch wirkende Budesonid MMX-Präparat zur Verfügung, das aufgrund seines hohen first-pass Effektes weniger systemische Nebenwirkungen aufweist.
Bei steroidabhängigen Verläufen einer CU wird abhängig von der EBV-Serologie immer noch häufig Azathioprin eingesetzt.
Bei der Therapie der komplizierten CU hat sich das Spektrum der therapeutischen Möglichkeiten deutlich erweitert. Neben den TNF-Antikörpern Infliximab, Adalimumab und Golimumab stehen der Anti-Integrin-Antikörper Vedolizumab, der IL12/IL23-Antikörper Ustekinumab sowie der JAK-Inhibitor Tofacitinib zur Verfügung. Die steroidrefraktäre fulminante CU wird unter stationären Bedingungen entweder mit Ciclosporin/Tacrolimus oder Infliximab therapiert.
Bei therapierefraktären komplizierten Verlaufsformen der CU sollte bei jeder Therapieeskalation die Möglichkeit einer Proktokolektomie mit berücksichtigt und mit dem Patienten diskutiert werden.
Bei der Proktokolektomie in therapierefraktären Konstellationen sollte bei erhöhtem perioperativen Risiko durch die Immunsuppression dreizeitig operiert werden.
Individualisierte Therapiekonzepte finden zunehmend Anwendung bei den komplizierten Verlaufsformen der CU.
Bei jeder Therapieeskalation einer kompliziert verlaufenden CU sollte die Möglichkeit einer Proktokolektomie mit Ileumpouch-analer Anastomose in Erwägung gezogen und mit den Patienten diskutiert werden. Absolute Indikationen für eine Proktokolektomie stellen der Nachweis eines kolitisassoziierten Karzinoms, endoskopisch nicht resezierbare Epitheldysplasien sowie die fulminante, medikamentös therapierefraktäre CU dar.
Nützliche Internet-Adressen DGVS-Leitlinie: https://www.dgvs.de/wissen-kompakt/leitlinien/leitlinien-dgvs/ ECCO-Guidelines: https://www.ecco-ibd.eu/publications/ecco-guidelines-science.html
Dr. med. Klaus Kannengiesser.
Leitender Oberarzt
Klinik für Allgemeine Innere Medizin und Gastroenterologie
Klinikum Lüneburg
Bögelstraße 1, 21339 Lüneburg
E-Mail: Klaus.Kannengiesser@klinikum-lueneburg.de
Prof. Dr. med. Torsten Kucharzik.
Chefarzt der Klinik für Allgemeine Innere Medizin und Gastroenterologie
Ärztlicher Direktor, Klinikum Lüneburg,
Bögelstraße 1, 21339 Lüneburg
E-Mail: Torsten.Kucharzik@klinikum-lueneburg.de
CME-Fragebogen.
Leitliniengerechte Therapie der Colitis ulcerosa - Update
Welche Aussage trifft für die Therapie der fulminanten Colitis ulcerosa zu?
Das Ergebnis der CMV(Cytomegalovirus) -PCR muss abgewartet werden, bevor eine immunsuppressive Therapie gestartet werden kann.
Alle TNF-Antikörper haben in dieser Situation in Studien ein gleich gutes Ansprechen gezeigt.
Ciclosporin i. v. hat sich als effektive Therapieoption in dieser klinischen Situation erwiesen.
Eine remissionserhaltende Therapie mit Thiopurinen sollte in jedem Fall fortgeführt werden.
Ustekinumab oder Tofacitinib haben sich in dieser Situation als gleichwertig wirksam ergeben.
Was gilt für die Therapie der unkomplizierten Colitis ulcerosa?:
Bei der leicht- bis mittelgradig aktiven Proktitis ulcerosa, die auf Mesalazin nicht anspricht, sollten ergänzend rektale Steroide appliziert werden.
Die remissionserhaltende Therapie mit E. coli Nissle hat sich gegenüber der Therapie mit Mesalazin als unterlegen herausgestellt.
Budesonid MMX kann in der Primärtherapie bei Mesalazin-naiven Patienten mit leicht- bis mittelgradig aktiver Colitis ulcerosa eingesetzt werden.
Die Kombinationstherapie aus Mesalazin oral plus rektal hat sich als nicht überlegen gegenüber einer oralen Mesalazin-Monotherapie erwiesen.
Die Erhaltungstherapie mit Mesalazin nach erfolgreicher Remissionsinduktion sollte nach einem Jahr beendet werden.
Was trifft für den Einsatz von Vedolizumab bei der komplizierten Colitis ulcerosa zu?
Bei steroidabhängiger Verlaufsform ist eine Therapie mit Vedolizumab der Therapie mit Adalimumab in der Regel unterlegen.
Vedolizumab kann nach zweimaliger i. v. Induktionstherapie in der Erhaltungstherapie auch subkutan appliziert werden.
Vedolizumab darf erst nach Versagen von TNF-Alpha-Antikörpern wie bei der Therapie der schweren bis mittelschweren Colitis ulcerosa angesetzt werden.
Vedolizumab hat einen wichtigen Stellenwert in der remissionsinduzierenden Therapie der fulminanten Colitis ulcerosa.
Eine subkutane Induktionstherapie mit Vedolizumab kann bei Thiopurin-Versagen eingesetzt werden.
Welche Aussage zur Therapie mit Tofacitinib bei mittelschwerer bis schwerer Colitis ulcerosa trifft zu?
Tofacitinib ist nur für die Therapie der mittelschweren bis schweren Colitis ulcerosa zugelassen, die refraktär auf TNF-Antikörper ist.
Tofacitinib stellt aufgrund seines günstigen Nebenwirkungsprofils das Medikament der Wahl bei Patienten mit Colitis ulcerosa dar, die älter als 60 Jahre sind.
Tofacitinib und Infliximab haben sich als gleich gut wirksam bei der Therapie der fulminanten Colitis ulcerosa erwiesen.
Aufgrund der thromboembolischen Risiken sollte Tofacitinib bei Patienten mit kardiovaskulären Risikofaktoren nicht eingesetzt werden.
Eine Kombinationstherapie mit Tofacitinib und Vedolizumab stellt eine etablierte Standardtherapie der komplizierten Colitis ulcerosa dar.
Was gilt für den Einsatz der Glukokortikoide bei Colitis ulcerosa?
Der Einsatz von Glukokortikoiden in einer Dosierung von < 7,5 mg Prednisolon-Äquivalenz pro Tag ist langfristig bedenkenlos.
Die Applikationsform von Glukokortikoiden spielt bei der Therapie der unkomplizierten Colitis ulcerosa keine Rolle, da die Wirkstoffkonzentrationen am Ort der Entzündung sich nicht wesentlich unterscheiden.
Glukokortikoide sollten grundsätzlich nicht in der remissionserhaltenden Therapie der Colitis ulcerosa eingesetzt werden.
Eine Therapie mit Vedolizumab sollte grundsätzlich mit einem Steroidstoß eingeleitet werden.
Glukokortikoide haben sich bei der leicht- bis mittelgradigen aktiven Colitis ulcerosa effektiver als eine Therapie mit Mesalazin erwiesen.
Welche Aussage zu chirurgischen Therapieoptionen bei Colitis ulcerosa trifft zu?
Bei Nachweis eines Colitiskarzinoms ist es ausreichend nach onkologischen Kriterien kolonerhaltend zu operieren.
Bei einer neu aufgetretenen Stenose bei langjähriger Colitis ulcerosa sollte auch bei fehlendem Malignitätsnachweis eine großzügige Indikation zur Operation gestellt werden.
Bei niedriggradigen Epitheldysplasien ist das Karzinomrisiko nur gering erhöht.
Limitierte Kolonresektionen sind bei Colitis ulcerosa grundsätzlich obsolet.
Bei komplizierter Verlaufsform einer Colitis ulcerosa sollte frühestens nach Versagen des dritten Biologikums/Januskinase-Inhibitors die Indikation zur Durchführung einer Proktokolektomie gestellt werden.
Welche Aussage zur Kontrolle des Therapieerfolges ist richtig?
Die klinische Evaluation ist ausreichend.
Die Bestimmung von Calprotectin im Stuhl ersetzt die endoskopische Diagnostik nicht, da die erhobenen Werte schlecht mit dem endoskopischen Befund korrelieren.
Eine endoskopische Verlaufskontrolle zur Abklärung der Mukosaheilung sollte drei bis sechs Monate nach Initiierung der Therapie durchgeführt werden.
Die Darmsonografie liefert keine validen Befunde zur Kontrolle der Therapie.
CRP-Werte korrelieren gut mit der endoskopischen Entzündungsaktivität.
Welche Aussage zum Einsatz von Infliximab bei Colitis ulcerosa ist richtig?
Die Kombinationstherapie Infliximab plus Azathioprin spielt bei der Colitis ulcerosa keine Rolle.
Infliximab kann seit kurzem in der Induktionstherapie auch subkutan eingesetzt werden.
Bei der fulminanten Colitis ulcerosa ist die Gabe von Infliximab der Gabe von Ciclosporin unterlegen.
Die Subkutantherapie mit Infliximab hat sich in der Erhaltungstherapie als gleichwertig zur i. v. Therapie erwiesen.
Infliximab-Biosimilars können beliebig und auch mehrfach untereinander ausgetauscht werden.
Was gilt bei steroidrefraktärer Colitis ulcerosa?
Die CMV(Cytomegalovirus)-Reaktivierung sollte durch Bestimmung der CMV-Antikörper abgeklärt werden.
Ein Therapiebeginn sollte erst nach Ausschluss einer Clostridien-Infektion erfolgen.
Eine Mesalazin-Hochdosistherapie stellt eine sinnvolle Therapieoption dar.
Thiopurine stellen eine geeignete Therapieoption dar.
Eine orale Therapie mit Tofacitinib stellt eine sinnvolle Therapieoption dar.
Welche der folgenden Therapien sollte bei einem steroidabhängigen Verlauf einer Colitis ulcerosa erfolgen?
Kombination von TNF-Antikörper plus Vedolizumab
Dauertherapie mit Budesonid MMX
Immunsuppressivum, Biologikum oder Januskinase-Inhibitor
Kombination Azathioprin plus Tofacitinib
Kombination Azathioprin plus Ustekinumab
Interessenkonflikt
Die Autoren erklären, dass sie sich bei der Erstellung des Beitrags von keinen wirtschaftlichen Interessen leiten ließen. K. Kannengiesser erklärt Autoren- und Referententätigkeiten für Abbvie, Janssen-Cilag, MSD und Dr. Falk Pharma. T. Kucharzik erklärt den Erhalt von Honoraren für Vortrags- und/oder Beratungstätigkeit von AbbVie, Biogen, Boehringer Ingelheim, Centocor, Gilead, Falk Pharma, Hospira, Mundipharma, MSD, Ferring, Janssen, Roche, Pfizer und Takeda.
Der Verlag erklärt, dass die inhaltliche Qualität des Beitrags von zwei unabhängigen Gutachtern geprüft wurde. Werbung in dieser Zeitschriftenausgabe hat keinen Bezug zur CME-Fortbildung.
Der Verlag garantiert, dass die CME-Fortbildung sowie die CMEFragen frei sind von werblichen Aussagen und keinerlei Produktempfehlungen enthalten. Dies gilt insbesondere für Präparate, die zur Therapie des dargestellten Krankheitsbildes geeignet sind.
Contributor Information
Klaus Kannengiesser, Email: Klaus.Kannengiesser@klinikum-lueneburg.de.
Torsten Kucharzik, Email: torsten.kucharzik@klinikum-lueneburg.de.
Literatur
- 1.Kucharzik T, Dignass AU, Atreya R et al. [August 2019 - AWMF-Registriernummer: 021-009]. Z Gastroenterol 2019;57:1321-405. [DOI] [PubMed]
- 2.Wang Y, Parker CE, Bhanji T et al. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev 2016;4:CD000543. [DOI] [PMC free article] [PubMed]
- 3.Wang Y, Parker CE, Feagan BG, et al. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2016:CD000544. [DOI] [PMC free article] [PubMed]
- 4.Losurdo G, Iannone A, Contaldo A et al. Escherichia coli Nissle 1917 in Ulcerative Colitis Treatment: Systematic Review and Meta-analysis. J Gastrointestin Liver Dis 2015;24:499-505 [DOI] [PubMed]
- 5.Travis SP, Danese S, Kupcinskas L et al. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: results from the randomised CORE II study. Gut 2014;63:433-41 [DOI] [PMC free article] [PubMed]
- 6.Velayos FS, Terdiman JP, Walsh JM. Effect of 5-aminosalicylate use on colorectal cancer and dysplasia risk: a systematic review and metaanalysis of observational studies. Am J Gastroenterol 2005;100:1345-53 [DOI] [PubMed]
- 7.Rutgeerts P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005;353:2462-76 [DOI] [PubMed]
- 8.Sandborn WJ, van Assche G, Reinisch W et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012;142:257-65 e1-3 [DOI] [PubMed]
- 9.Sandborn WJ, Feagan BG, Marano C et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014;146:85-95; quiz e14-5 [DOI] [PubMed]
- 10.Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013;369:699-710 [DOI] [PubMed]
- 11.Sands BE, Sandborn WJ, Panaccione R et al. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med 2019;381:1201-14 [DOI] [PubMed]
- 12.Sandborn WJ, Su C, Sands BE, et al. Tofacitinib as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med 2017;376:1723-36 [DOI] [PubMed]
- 13.Stallmach A, Sturm A, Blumenstein I, Helwig U, Koletzko S, Lynen P, Schmidt C, Dignass A, Kucharzik T. Addendum to S3-Guidelines Crohn's disease and ulcerative colitis: Management of Patients with Inflammatory Bowel Disease in the COVID-19 Pandemic - open questions and answers Z Gastroenterol 2020 Oct;58(10):982-1002 doi: 10.1055/a-1234-8079. Epub 2020 Oct 9. [DOI] [PubMed]
- 14.Bonovas S, Lytras T, Nikolopoulos G et al. Systematic review with network meta-analysis: comparative assessment of tofacitinib and biological therapies for moderate-to-severe ulcerative colitis. Aliment Pharmacol Ther 2018;47:454-65 [DOI] [PubMed]
- 15.Singh S, Fumery M, Sandborn WJ et al. Systematic review with network meta-analysis: first- and second-line pharmacotherapy for moderate-severe ulcerative colitis. Aliment Pharmacol Ther 2018;47:162-75 [DOI] [PubMed]
- 16.Sands BE, Peyrin-Biroulet L, Loftus EV Jr. et al. Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis. N Engl J Med 2019;381:1215-26 [DOI] [PubMed]
- 17.Lawrance IC, Baird A, Lightower D et al. Efficacy of Rectal Tacrolimus for Induction Therapy in Patients With Resistant Ulcerative Proctitis. Clin Gastroenterol Hepatol 2017;15:1248-55 [DOI] [PubMed]
- 18.Laharie D, Bourreille A, Branche J et al. Ciclosporin versus infliximab in patients with severe ulcerative colitis refractory to intravenous steroids: a parallel, open-label randomised controlled trial. Lancet 2012;380:1909-15 [DOI] [PubMed]
- 19.Laharie D, Bourreille A, Branche J et al. Long-term outcome of patients with steroid-refractory acute severe UC treated with ciclosporin or infliximab. Gut 2018;67:237-43 [DOI] [PubMed]
- 20.Maaser C, Sturm A, Vavricka SR et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis 2019;13:144-64 [DOI] [PubMed]
- 21.D'Amico F, Bonovas S, Danese S et al. Review article: faecal calprotectin and histologic remission in ulcerative colitis. Aliment Pharmacol Ther 2020;51:689-98 [DOI] [PubMed]
- 22.Maaser C, Petersen F, Helwig U et al. Intestinal ultrasound for monitoring therapeutic response in patients with ulcerative colitis: results from the TRUST&UC study. Gut 2020;69:1629-36 [DOI] [PMC free article] [PubMed]
- 23.Thomas T, Abrams KA, Robinson RJ et al. Metaanalysis: cancer risk of low-grade dysplasia in chronic ulcerative colitis. Aliment Pharmacol Ther 2007;25:657-68 [DOI] [PubMed]
- 24.Fumery M, Pineton de Chambrun G, Stefanescu C et al. Detection of Dysplasia or Cancer in 3.5% of Patients With Inflammatory Bowel Disease and Colonic Strictures. Clin Gastroenterol Hepatol 2015;13:1770-5 [DOI] [PubMed]





