Abstract
La prevalencia en fase epidémica de la COVID-19 hace que prácticamente cualquier opacidad pulmonar en la radiografía de tórax pueda ser una neumonía por SARS-CoV-2. Sin embargo, hallazgos radiológicos atípicos aumentarán la credibilidad de un resultado microbiológico o serológico negativo. Asimismo, fuera de la ola epidémica y con el retorno de otras entidades respiratorias, el radiólogo puede tener gran relevancia en la toma de decisiones diagnósticas, terapéuticas o preventivas (aislamiento) si conoce las claves diagnósticas de las entidades simuladoras de neumonía COVID-19. La distribución unifocal o en campos pulmonares superiores de las opacidades y la afectación predominante de vía aérea, entre otras claves radiológicas y clínicas detalladas en este capítulo, implican necesariamente ampliar el abanico de posibilidades diagnósticas.
Palabras clave: COVID-19, Computed tomography, X ray, Radiography, Diagnostic imaging
Abstract
During the COVID-19 epidemic, the prevalence of the disease means that practically any lung opacity on an X-ray could represent pneumonia due to infection with SARS-CoV-2. Nevertheless, atypical radiologic findings add weight to negative microbiological or serological tests. Likewise, outside the epidemic wave and with the return of other respiratory diseases, radiologists can play an important role in decision making about diagnoses, treatment, or preventive measures (isolation), provided they know the key findings for entities that can simulate COVID-19 pneumonia. Unifocal opacities or opacities located in upper lung fields and predominant airway involvement, in addition to other key radiologic and clinical findings detailed in this paper, make it necessary to widen the spectrum of possible diagnoses.
Keywords: COVID-19, Computed tomography, X-rays, Radiography, Diagnostic imaging
Introducción
Como se ha discutido en esta revista1, 2, durante la fase epidémica de la COVID-19 numerosos estudios han otorgado un papel clave a las técnicas de imagen en el manejo inicial diagnóstico de la enfermedad, bien en primera línea con la radiografía de tórax como técnica para confirmar de entrada un diagnóstico de neumonía, o en un segundo escalón con la tomografía computarizada (TC), considerada como prueba diagnóstica “definitiva” por su alta sensibilidad y especificidad. No obstante, las características de la enfermedad hacen que, en algunos hospitales, la COVID-19 haya borrado por completo a la mayor parte de las enfermedades respiratorias y otras urgencias médicas2, 3. Esta situación, junto con la variable gravedad de los cuadros clínicos y el tiempo de evolución, supone un sesgo importante a la hora de valorar la rentabilidad de una prueba diagnóstica. Sin restar importancia a la TC para detectar enfermedad pulmonar, graduar su gravedad o sugerir su etiología viral en fase epidémica o de escasez de pruebas diagnósticas microbiológicas, algunas revisiones4 hablan de una ventaja menor en valores de sensibilidad y especificidad de la otorgada inicialmente5 respecto a detectar el virus mediante la técnica de la reacción en cadena de la polimerasa (PCR).
En esta actualización haremos un repaso de las situaciones en las que el radiólogo debe sugerir alternativas diagnósticas diferentes a la COVID-19 en pacientes en los que existe sospecha de esta enfermedad, bien desde el punto de vista clínico, por la analítica, por la radiología o por una combinación de ellas, centrándonos en la fase aguda de la enfermedad. Hay que recordar que, en radiología torácica, los patrones de enfermedad pulmonar raramente son patognomónicos, por lo que a menudo es esencial la correlación clínica y analítica (fig. 1 ). Algunos datos en la presentación de las diferentes entidades tanto infecciosas como no infecciosas pueden ser claves para diferenciarlas de la COVID-19, mientras que otros son inespecíficos. Entre otros destacan:
-
•
Cronología. A diferencia del cuadro de horas o días de evolución de la COVID-19, el inicio súbito (p.ej., una hemorragia alveolar) o el progresivo durante semanas (p.ej., la enfermedad intersticial) sugieren otros procesos no infecciosos u otras infecciones como la tuberculosis o la neumonía por Pneumocystis jirovecii.
-
•
La fiebre caracteriza a las infecciones pulmonares, pero está presente en procesos agudos como la hemorragia alveolar6, e incluso en algunas enfermedades intersticiales7. Por tanto, no permite excluir otras entidades, aunque su ausencia será infrecuente en la COVID-198.
-
•
Muchas de las alteraciones analíticas (elevación de la proteína C reactiva, lactato deshidogrenasa, dímero D, etc.) presentes en casos graves de COVID-198 son consecuencia del proceso inflamatorio agudo común también a cuadros infecciosos y de otro origen.
-
•
Conocer los antecedentes personales y el cuadro clínico del paciente nos permitirá identificar factores precipitantes de determinadas complicaciones que constituyen alternativas clínico-radiológicas a la infección por SARS-CoV-2, aunque no podamos descartarla (fig. 2 ).
Figura 1.
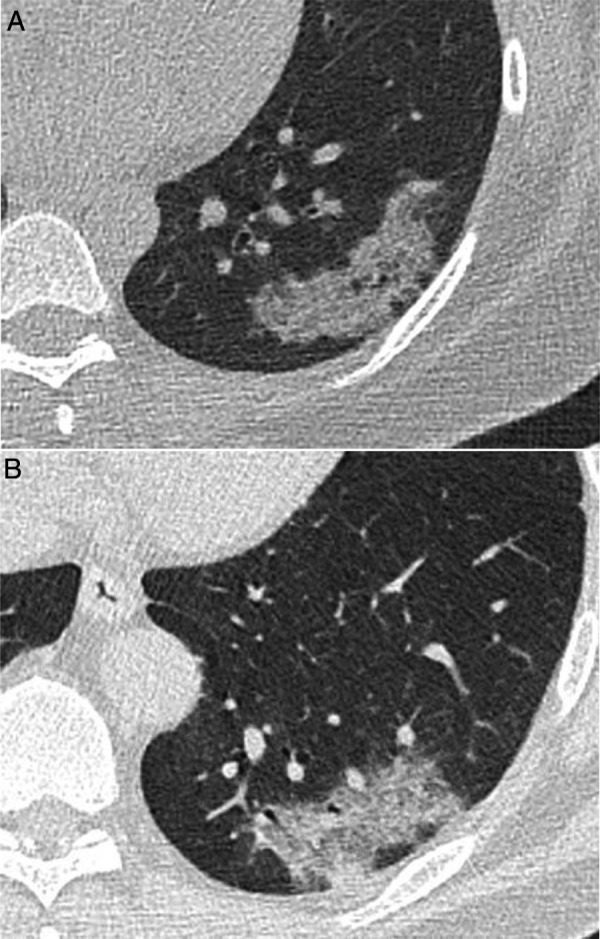
Imágenes de tomografía computarizada (TC) correspondientes a 2 pacientes con lesiones de apariencia radiológica similar: A) Mujer de 40 años con esclerosis sistémica limitada y tos, con consolidación pulmonar persistente en lóbulo inferior izquierdo durante más de 9 meses y diagnóstico anatomopatológico concordante con seudotumor inflamatorio. B) Varón de 52 años que acude durante las fechas de la pandemia de COVID-19 con fiebre elevada persistente y disnea de 4 días de evolución. Debido a la persistencia de los síntomas tras una PCR negativa, se realiza una TC que mostró una consolidación de apariencia similar a imagen A, finalmente diagnosticada de neumonía por SARS-CoV-2 tras confirmación por una nueva PCR.
Figura 2.
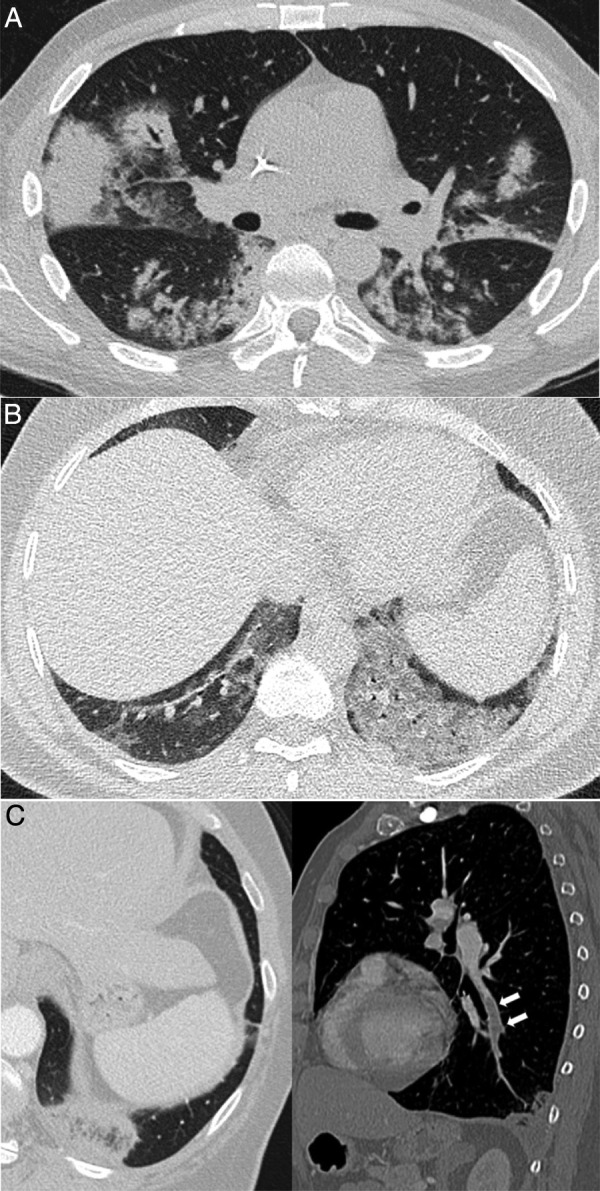
Procesos pulmonares con confirmación clínica y patológica que ocurren en contextos clínicos característicos, pero de apariencia similar a la neumonía COVID-19. A) Síndrome de diferenciación secundario al tratamiento con ácido transretinoico en un paciente con leucemia promielocítica aguda que muestra consolidaciones bilaterales asociadas a algunas zonas de atenuación “en vidrio deslustrado” y opacidades nodulares. B) Neumonía lipoidea exógena que se manifiesta como áreas de atenuación “en vidrio deslustrado” denso en ambas bases pulmonares. C) Paciente con sospecha de COVID-19, pero finalmente diagnosticado de tromboembolismo pulmonar con infarto pulmonar, que mostraba un halo invertido y un defecto de repleción en rama del lóbulo inferior izquierdo, mostrado en la reconstrucción sagital (flechas).
Para abordar las posibles situaciones sistemáticamente plantearemos dos escenarios:
-
1.
Enfermos con sospecha de infección respiratoria, pero con patrón radiológico alternativo diferente a la COVID-19.
-
2.
Enfermos con disnea y opacidades pulmonares con diagnóstico diferente a una infección.
Enfermos con sospecha de infección respiratoria con patrón radiológico alternativo diferente a la COVID-19
La presentación clínica típica de la COVID-19, con tos, disnea y fiebre es un cuadro inespecífico, común a la mayoría de los procesos infecciosos de las vías respiratorias. Para establecer un diagnóstico de neumonía de cualquier etiología, además de esos síntomas, se requiere la presencia de alteraciones radiológicas9. A excepción de los patrones más característicos de la enfermedad, descritos en esta misma revista por Martínez et al.1, fuera de la fase epidémica, la presentación radiológica de la COVID-19 puede ser completamente inespecífica e indistinguible de procesos no infecciosos e infecciosos de otra etiología. La negatividad de las pruebas de PCR en un porcentaje significativo de pacientes con COVID-191, 10 hace que, junto con los datos epidemiológicos, clínicos y analíticos, las pruebas de imagen puedan tener un papel importante para tomar decisiones de aislamiento o terapéuticas. Para ayudar al manejo de la enfermedad, los radiólogos debemos alertar ante manifestaciones que, aun sugiriendo una naturaleza infecciosa, obligan a considerar un diagnóstico alternativo a la COVID-19 así como una coinfección o sobreinfección bacteriana1, 11. Para ello, al valorar la imagen ante la sospecha de neumonía por SARS-CoV-2 debemos considerar dos aspectos: los hallazgos propiamente dichos y su distribución, cuya frecuencia relativa en TC aparece reflejada en la tabla 1 .
Tabla 1.
Frecuencia relativa de las diferentes características de imagen en tomografía computarizada de la infección aguda por SARS-CoV-2
| Característica radiológica | Frecuencia |
|---|---|
| Distribución predominante | |
| Unilateral | + |
| Bilateral | +++ |
| Superior | + |
| Basal | +++ |
| Periférica | +++ |
| Central | + |
| Difusa | + |
| Lobar | + |
| Posterior | +++ |
| Hallazgos | |
| Consolidación | ++ |
| “En vidrio deslustrado” | +++ |
| Reticulación | + |
| Patrón “en empedrado” | ++ |
| Opacidades nodulares | ++ |
| Línea subpleural | ++ |
| Engrosamiento de septos interlobulillares | ++ |
| Nódulos acinares | + |
| Engrosamiento de paredes bronquiales | + |
| Árbol en brote | + |
| Halo invertido | + |
| Cavitación | + |
| Derrame pleural | + |
| Adenopatías | + |
+: raramente (<10%); ++: con frecuencia (10-50%); +++: característico (>50%).
Basada en la frecuencia en la descripción y presencia de los hallazgos obtenida de la bibliografía que aparece en material suplementario.
Presentación en la radiografía de tórax
Las manifestaciones en la radiografía de tórax de la COVID-19 siguen fielmente los patrones vistos en la TC1, 12, 13, siendo la distribución bilateral y periférica, con tendencia al predominio basal, la más característica, en forma de franca consolidación, de opacidades más tenues (que podemos etiquetar como “en vidrio deslustrado” en similitud a la semiología en la TC) o de lesiones más lineales o reticulares1, 12, 14, 15, 16. No obstante, debemos tener siempre presente que en fase epidémica casi cualquier opacidad pulmonar podría corresponder a una neumonía por SARS-CoV-2.
La presencia de lesiones pulmonares solitarias (nódulos, masas, lesiones cavitadas, etc.), derrame pleural, lesiones hiliares o mediastínicas como hallazgos dominantes es excepcional en la COVID-191, y exceden el objetivo de esta revisión.
En enfermos con infección respiratoria, la presencia de una o varias opacidades pulmonares sugiere el diagnóstico de neumonía y, como se ha dicho, su distribución y características serán claves para sugerir un diagnóstico alternativo a la COVID-19. La distribución bilateral característica de la COVID-19 puede verse influenciada por el tiempo de evolución. En una serie, solo el 25% se presentaron como lesiones bilaterales o múltiples14, por lo que la unilateralidad o la presencia de una lesión única no descartan la enfermedad. Además, en muchas de estas lesiones aparentemente únicas, la TC desvela otras lesiones no identificadas en la radiografía.
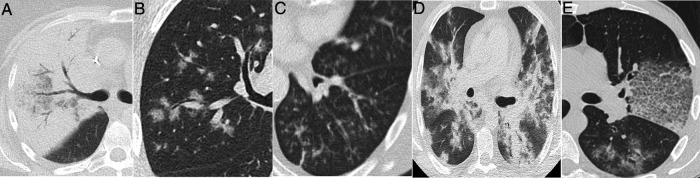
En fase epidémica, la presentación clínico-radiológica de un paciente con disnea y lesiones difusas bilaterales obliga a descartar una neumonía grave por SARS-CoV-2. No obstante, si la distribución de las alteraciones predomina en los lóbulos superiores o las áreas centrales del pulmón (Figura 3, Figura 4 ), no características de la COVID-19, puede sugerirnos alternativas. En pacientes con enfermedad grave y hallazgos radiológicos dudosos, una TC realizada precozmente ayudará a caracterizar la distribución como se muestra en esas figuras.
Figura 3.
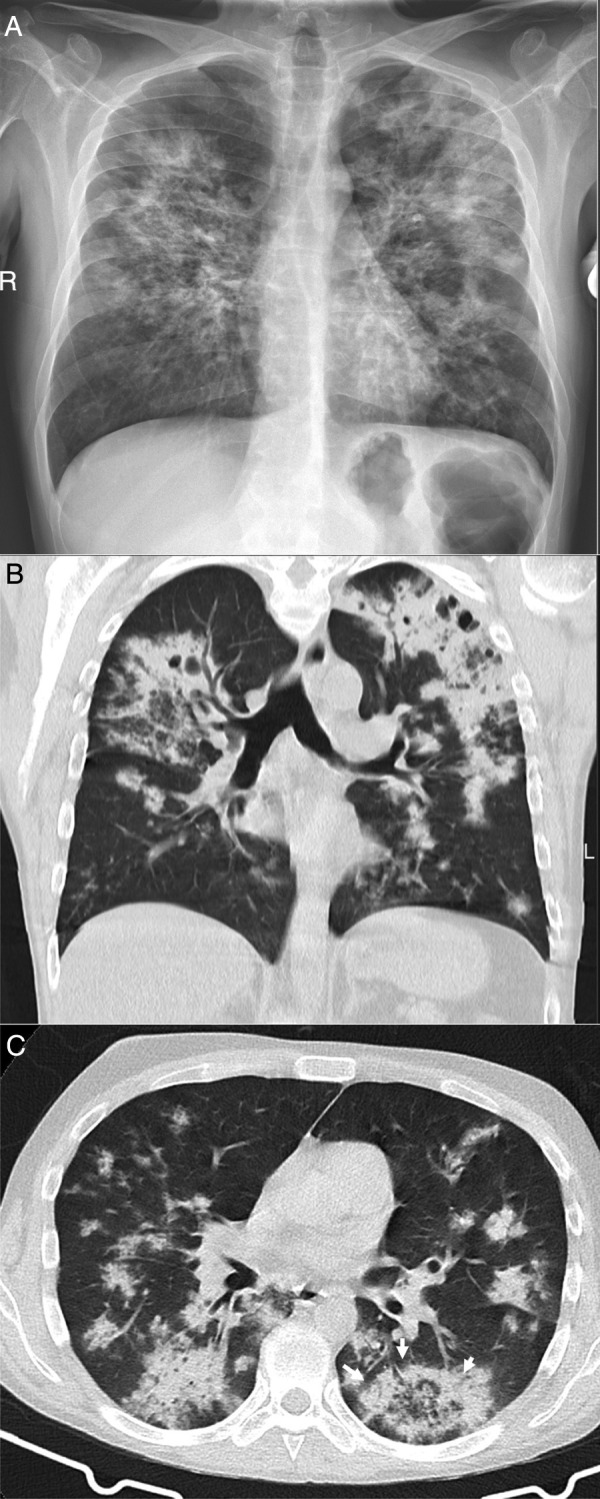
Varón de 39 años que acude durante la pandemia por astenia, mialgias y odinofagia, con diagnóstico final de tuberculosis pulmonar. La radiografía de tórax (A) muestra consolidaciones bilaterales extensas de predominio superior y central en el lado derecho y en campos superior y medio en el lado izquierdo, con posibles cavitaciones que se confirman en la reconstrucción coronal de la TC (B). Son visibles también opacidades con morfología de árbol en brote y alguna lesión con apariencia de halo invertido, cuyos bordes micronodulares son una característica distintiva de la enfermedad (flechas en C).
Figura 4.
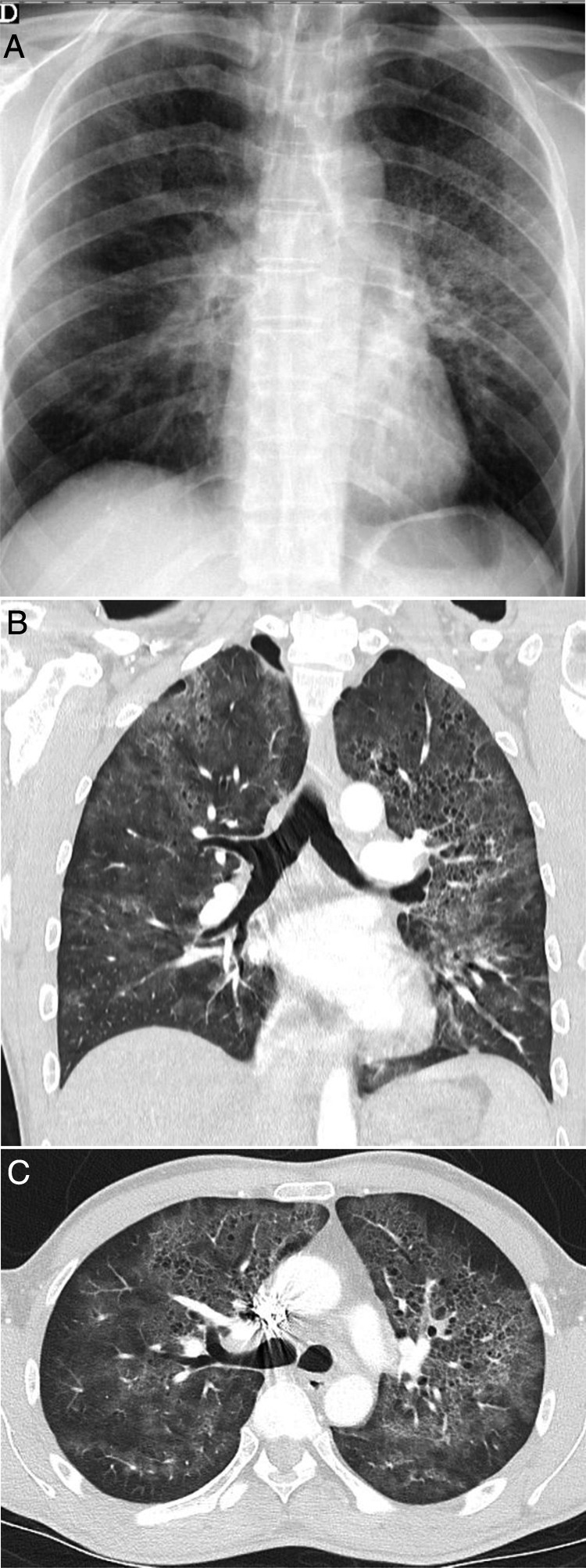
Varón de 42 años, sin antecedentes de interés, que acude durante la pandemia por fiebre y disnea de 3 semanas de evolución acompañadas de hipoxemia, linfopenia y elevación de dímero D y LDH. La radiografía de tórax (A) muestra opacidades pulmonares de predominio perihiliar y en los dos tercios superiores de los pulmones, con pequeñas imágenes quísticas en el lado izquierdo. Una angio-TC para descartar tromboembolismo pulmonar (B y C) mostró la presencia de opacidades de atenuación “en vidrio deslustrado” con discreto predominio superior y tendencia a respetar la periferia pulmonar, acompañadas de lesiones quísticas aéreas de paredes finas. Se sospechó que se trataba de una neumonía por Pneumocystis jirovecii, que fue confirmada por lavado broncoalveolar y posteriormente se confirmó positividad para el virus de la inmunodeficiencia humana.
La afectación lobar en forma de consolidación densa, de extensión segmentaria o lobar, en ocasiones afectando a varios lóbulos, es característica de la neumonía bacteriana adquirida en la comunidad (fig. 5 A). Aunque ocurra en fase epidémica, estos hallazgos, junto a algunas características como la presencia de esputos purulentos o diferentes cuadros analíticos, permitirán orientar el diagnóstico desde el inicio9, 17. En nuestra experiencia, la presencia de broncograma aéreo en la radiografía no es frecuente en la COVID-19; es más frecuente por TC12, 13, 18, aunque menor del 20% en alguna serie17, 18. En cuanto a la presentación de la COVID-19 en forma de afectación intersticial o como patrón reticular, el diagnóstico diferencial debe establecerse con neumonías atípicas6, 15 y causas no infecciosas (edema intersticial, fibrosis, etc.).
Figura 5.
Hallazgos radiológicos en neumonías con etiología diferente a la COVID-19. A) Consolidación lobar en neumonía por Streptococcus pneumoniae. B) Opacidades “arracimadas” peribroncovasculares por el virus sincitial respiratorio. C) Opacidades ramificadas y con morfología de árbol “en brote” en una infección por el virus de la influenza A. D) Consolidación peribroncovascular en una neumonía bilateral por el virus de la influenza A. E) Patrón en empedrado en una neumonía por Streptococcus pneumoniae.
Presentación en la tomografía computarizada
La TC permite definir y caracterizar mejor las alteraciones y su distribución, y en ese sentido su especificidad para sugerir diagnósticos alternativos es mayor19, 20. Los estudios que valoran la rentabilidad diagnóstica de la TC en series que incluyen un número similar de neumonías de otra etiología y por SARS-CoV-221, 22 muestran algunas limitaciones de la TC para definir el germen dado el solapamiento de hallazgos. Estos estudios obtienen resultados muy dispares, y presentan limitaciones en cuanto a la población analizada e importante variabilidad entre radiólogos4, 21, 22. La presentación epidemiológica tan intensa de esta pandemia impide tener datos reales acerca de cuál sería la eficacia de la TC en la práctica clínica habitual, cuando el SARS-CoV-2 solo causara parte de las neumonías adquiridas en la comunidad, conviviendo con otros microrganismos al mismo tiempo. En esas circunstancias, quizá solo sea realmente útil una presentación muy típica por TC1 o una combinación de un cuadro clínico característico con determinados hallazgos de la TC.
La COVID-19 produce principalmente daño alveolar, tanto en las fases iniciales23 como en la evolución, en la que predomina el patrón de daño alveolar difuso24, 25 y alteraciones vasculares26. Esta afectación puramente alveolar explicaría la manifestación en forma de opacidades “en vidrio deslustrado” y áreas de consolidación periféricas como hallazgos predominantes. Ambos tipos de lesiones por sí solas tienen poca especificidad, ya que traducen una ocupación de los espacios aéreos que es común a muchos procesos patológicos pulmonares27. Sin embargo, a diferencia de otras neumonías bacterianas y víricas, en las que los cambios patológicos se centran en la vía aérea17, 28, 29, 30, los hallazgos radiológicos que traducen patología en la vía aérea o peribronquiolar (el engrosamiento de las paredes bronquiales o el patrón en árbol en brote) (fig. 5) no son esperables como manifestaciones radiológicas dominantes de la COVID-19, y de hecho no aparecen en las descripciones de los hallazgos por TC de la enfermedad (tabla 1), o lo hacen en un pequeño porcentaje13, por lo que deberían sugerir un diagnóstico alternativo11.
Hay otros hallazgos secundarios que aparecen con menos frecuencia en la COVID-19, pero que han despertado interés en la literatura científica, como el engrosamiento del intersticio intralobulillar e interlobulillar, el patrón en empedrado o la presencia de halo invertido13. Estos signos carecen de especificidad. Así, por ejemplo, el patrón “en empedrado” aparece en muchos procesos infecciosos pulmonares de etiología variada, habiéndose descrito por Pneumocystis jirovecii 31, 32, 33, pero también en otras neumonías víricas y bacterianas33, 34 (fig. 5E). Del mismo modo, el halo invertido inicialmente se consideró característico de la neumonía organizada, la cual puede tener etiología infecciosa; sin embargo, también fue considerado típico de la mucormicosis en pacientes inmunodeprimidos, se ha asociado a infecciones por otros hongos y bacterianas en ese tipo de pacientes35, embolias sépticas36 y tuberculosis37, entre otros diagnósticos.
Un importante elemento diferenciador es evaluar la distribución de las alteraciones, tanto a lo largo del eje longitudinal del pulmón como, sobre todo, en el plano axial.
Como se ha comentado, la distribución predominante en los lóbulos superiores debe sugerir otros diagnósticos (Figura 3, Figura 4)12, 13.
Una consolidación lobar o segmentaria desde la periferia a la vertiente hiliar, y con broncograma aéreo, sugiere un origen bacteriano17, 30. Las lesiones agrupadas arracimadas sugieren enfermedad de extensión por la vía aérea, bien aspirativas38, 39, de origen tuberculoso40, o por virus diferentes al SARS-CoV-2 como los de la gripe41 (fig. 5C y D), si bien en fases iniciales de la COVID-19 pueden presentarse lesiones con esta distribución, como corresponde a una diseminación aérea de la enfermedad42. Igualmente, el predominio central de las lesiones también debe alertar sobre otros diagnósticos (fig. 5D)12, aunque las lesiones neumónicas de distribución peribroncovascular que no alcanzan la periferia tampoco son excepcionales en la COVID-1943.
Salvo en casos graves de COVID-19, la consolidación o atenuación en vidrio deslustrado de forma difusa debe sugerir un diagnóstico alternativo. Por ejemplo, en pacientes con linfopenia, la neumonía por Pneumocystis jirovecii puede tener una presentación clínica y analítica idéntica (fig. 4), aunque variarán el contexto clínico y los hallazgos radiológicos con vidrio deslustrado puro difuso y extenso, ocasionalmente de predominio superior y con quistes aéreos31, 32.
Por último, se abordarán algunos procesos infecciosos específicos que pueden plantear el diagnóstico diferencial con la COVID-19 en nuestro medio, como son la aspiración y la tuberculosis. Los cuadros aspirativos y la neumonía aspirativa son una causa relativamente frecuente de neumonía adquirida en la comunidad e intrahospitalaria44, y debe considerarse en el diagnóstico diferencial de lesiones pulmonares bilaterales, fiebre y disnea en pacientes con factores de riesgo, especialmente ancianos44, 45. Radiológicamente se caracterizan por lesiones del espacio aéreo y consolidaciones predominantes en regiones posteriores de ambos pulmones38, 39, 43, 44. La distribución de las alteraciones, junto con la presencia de factores de riesgo o una aspiración presenciada permiten el diagnóstico (fig. 6 ). La tuberculosis pulmonar posprimaria es otra causa frecuente de infección pulmonar con afectación bilateral que podría plantear dudas con la COVID-19. Sin embargo, tanto por la radiografía de tórax como por la TC, la distribución característica, predominante en regiones posteriores de los lóbulos superiores y segmentos apicales de los inferiores, y manifestaciones radiológicas, como la cavitación, dilataciones de bronquios de mediano calibre y opacidades centrolobulillares densas con morfología de árbol en brote40, y ocasionalmente el derrame pleural o lesiones extrapulmonares, permitirán diferenciarla de la infección por SARS-CoV-2 (fig. 3). La tuberculosis miliar, caracterizada por nódulos densos milimétricos difusos distribuidos de forma aleatoria, también puede diferenciarse de la COVID-19.
Figura 6.
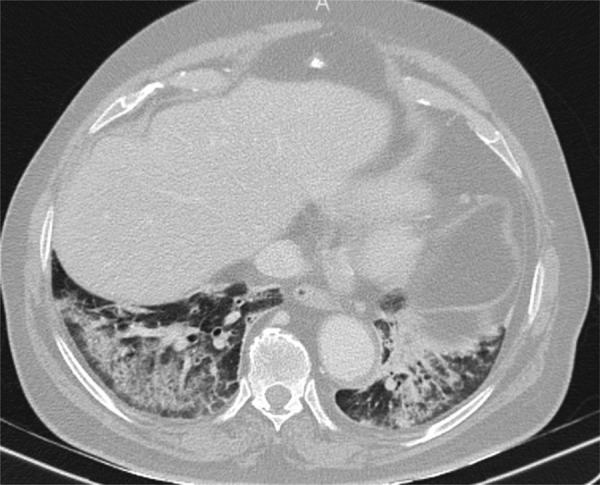
Tomografía computarizada, realizada durante la pandemia a un anciano con fiebre y nivel de conciencia fluctuante, que muestra consolidaciones posterobasales bilaterales con respeto subpleural. Se sospechó aspiración. El cuadro clínico y radiológico se resolvió con antibióticos y se descartó COVID-19 durante el ingreso.
Enfermos con disnea y opacidades pulmonares con diagnósticos diferentes a una infección
Desde el punto de vista clínico y radiológico, numerosas entidades no infecciosas pueden manifestarse como procesos respiratorios agudos46 y solaparse tanto con la COVID-19 como con otros cuadros infecciosos.
Por limitaciones de espacio, nos centraremos en el diagnóstico diferencial con las entidades con afectación pulmonar bilateral y curso subagudo, o agudo, más frecuentes o con más similitud con la presentación radiológica típica de la COVID-19. En la tabla 2 se muestran algunas de ellas y sus claves diagnósticas.
Tabla 2.
Algunas entidades que pueden plantear diagnóstico diferencial de opacidades pulmonares múltiples en pacientes con disnea aguda/subaguda diferentes a la COVID-19
| Entidad | Claves diagnósticas clínicas | Claves diagnósticas radiológicas |
|---|---|---|
| Infecciones | ||
| Neumonía bacteriana | Leucocitosis marcada, elevación de la procalcitonina, esputos purulentos | Consolidación segmentaria, lobar o multilobar con broncograma aéreo |
| Aspiración | Enfermedades predisponentes o aspiración presenciada | Consolidación multifocal en regiones posteriores, nódulos acinares, secreciones endobronquiales |
| Tuberculosis pulmonar | Evolución subaguda o crónica | Nódulos, cavitaciones, bronquiectasias, árbol en brote, patrón miliar, derrame |
| Neumonía por Pneumocystis Jirovecii | Inmunodepresión, evolución subaguda, pero analítica muy similar a COVID-19 (fig. 4) | Vidrio deslustrado difuso, discreto predominio superior, quistes |
| Infección fúngica | Inmunodepresión y otras enfermedades predisponentes | Nódulo o consolidación con halo, halo invertido, oclusión vascular en angio-TC |
| Embolismos sépticos | ADVP, catéter central, prótesis valvular | Nódulos, nódulos con halo, halo invertido, cavitación, derrame pleural |
| Otras infecciones víricas y bacterianas | Variable dependiendo del germen, solapamiento importante | Opacidades nodulares agrupadas, nódulos acinares, árbol en brote, engrosamiento de paredes bronquiales, engrosamiento septal |
| Enfermedades intersticiales | ||
| Neumonía organizada | Infecciones, enfermedades del colágeno, fármacos | Consolidación predominante, patrón perilobulillar, halo invertido. Vidrio deslustrado puro infrecuente |
| Neumonía intersticial no específica | Enfermedades del colágeno, fármacos, curso crónico (meses) | Vidrio deslustrado y reticulación basal, bronquiectasias por tracción, pérdida de volumen |
| Exacerbación de neumonía intersticial usual | Habitualmente NIU conocida, raramente inicio | Reticulación, bronquiectasias por tracción y panal junto al vidrio deslustrado |
| Neumonitis por hipersensibilidad (forma “subaguda”) | Exposición, habitualmente curso subagudo o crónico | Difusa, nódulos centrolobulillares de atenuación en vidrio deslustrado, atrapamiento aéreo, patrón “en cabeza de jabalí” |
| Neumonía intersticial descamativa | Tabaquismo, no fiebre | Vidrio deslustrado puro basal, enfisema y datos de bronquiolitis respiratoria |
| Sarcoidosis | Antecedente de la enfermedad, manifestaciones extrapulmonares | Adenopatías hiliares y mediastínicas, micronódulos perilinfáticos, patrón “en cabeza de jabalí” |
| Neumonía intersticial linfocítica | Sjögren y otras enfermedades autoinmunes y del colágeno, SIDA | Variable, puede presentar vidrio deslustrado, nódulos y engrosamiento broncovascular, quistes |
| Neumonía eosinófila crónica | Eosinofilia con frecuencia, curso crónico (meses) | Consolidación periférica, respeta subpleural, predominio lóbulos superiores |
| Neumonía eosinófila aguda | Eosinofilia rara pero marcada en lavado broncoalveolar | Vidrio deslustrado y engrosamiento de septos |
| Toxicidad farmacológica | Tratamientos más frecuentes: oncológicos, amiodarona, nitrofurantoína Presentación variable aguda/subaguda |
Patrón radiológico variable: NINE, NO, DAD, NHS |
| Miscelánea | ||
| Edema pulmonar por insuficiencia cardiaca | Antecedentes de cardiopatía, ortopnea, aumento pro-BNP | Cardiomegalia, engrosamiento septal prominente, patrón alveolar central, derrame pleural |
| Edema pulmonar no hidrostático/daño alveolar difuso | Procesos clínicos asociados (cirugía, pancreatitis, traumatismo, exposición a drogas, transfusión, tratamiento oncológico, etc.) | Vidrio deslustrado, patrón “en empedrado” y consolidación difusa, gradiente anterior-posterior, no cardiomegalia ni derrame pleural |
| Hemorragia alveolar difusa | Enfermedades predisponentes, hemoptisis y anemia. Afectación renal | Patrón alveolar parcheado bilateral, tamaño cardiaco normal y no derrame pleural |
| Infarto pulmonar | Factores predisponentes de TEP, dolor pleurítico | Trombos en arterias que se dirigen a la lesión, consolidación subpleural, halo invertido, basal, derrame pleural |
| Neumonitis por radioterapia | Antecedente de radioterapia semanas o meses antes | Vidrio deslustrado, consolidación y bronquiectasias de tracción en portal de radiación o su margen |
| Neumonía lipoidea | Antecedente de exposición, curso subagudo/crónico | Vidrio deslustrado y consolidación basal, a veces atenuación grasa |
| Neumonía por “vapeo” | Uso de cigarrillo electrónico | Más frecuente afectación pulmonar difusa de predominio basal que respeta subpleural. Patrones variables (DAD, HAD, NHS, NO, neumonía lipoidea, NEA) |
| Daño agudo por inhalación de tóxicos | Exposición laboral, doméstica o accidental a tóxicos | Variable, manifestaciones laringotraqueales, edema pulmonar, nódulos centrolobulillares |
| Proteinosis alveolar | Curso subagudo/crónico. Pocos síntomas (disociación clínico-radiológica) | Vidrio deslustrado y patrón “en empedrado” geográfico |
ADVP: adicción a drogas por vía parenteral; DAD: daño alveolar difuso; HAD: hemorragia alveolar difusa; NEA: neumonía esoinófila aguda; NIU: neumonía intersticial usual; NHS: neumonitis por hipersensibilidad; NINE: neumonía intersticial no específica; NO: neumonía organizada; SIDA: síndrome de inmunodeficiencia adquirida.
Las referencias bibliográficas de esta tabla aparecen en el material suplementario.
Entre las causas frecuentes de afectación radiológica bilateral con disnea está el edema pulmonar hidrostático de origen cardíaco 47. El diagnóstico se puede establecer por el predominio central de las opacidades, su carácter algodonoso, la asociación con líneas B de Kerley, cardiomegalia, derrame pleural y aumento y borrosidad de los hilios, hallazgos más evidentes en la TC. Apoyarán el diagnóstico datos clínicos característicos como la instauración aguda, ortopnea o la elevación del péptido natriurético tipo B48. No obstante, ambas entidades pueden ser radiológicamente indistinguibles al asociarse edema pulmonar con atelectasia pasiva y consolidación en las regiones pulmonares posteriores adyacentes al derrame pleural acompañante. Por otra parte, la neumonía aparece como comorbilidad en alrededor del 15% de los pacientes que ingresan por fallo cardiaco en fase no epidémica49. La coexistencia de la afectación infecciosa pulmonar COVID-19 con el fallo cardíaco es frecuente, combinación que es altamente letal, especialmente en ancianos con factores de riesgo cardiovascular50, 51.
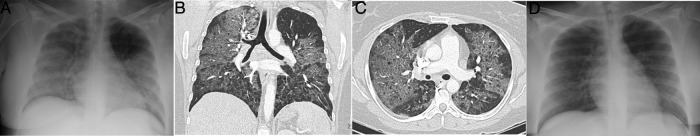
El edema pulmonar no cardiogénico es un tipo de edema pulmonar no hidrostático menos frecuente, con vínculos etiopatogénicos con los procesos neumónicos y con la COVID-19, a la que se puede asociar24, 25. La forma más característica de edema pulmonar no cardiogénico es el síndrome de distrés respiratorio del adulto (SDRA), que es, de hecho, la evolución más frecuente en los casos más graves de la neumonía COVID-19. Se caracteriza por daño pulmonar inflamatorio agudo difuso, con aumento de la permeabilidad capilar y pérdida del espacio aéreo52. Sin embargo, el SDRA es un síndrome heterogéneo con mecanismos variados y complejos, cuya definición ha variado en el tiempo53. Subyace un patrón histológico de daño alveolar difuso, común a muchos procesos patológicos. Numerosos desencadenantes pulmonares y extrapulmonares (como la sepsis, pancreatitis, transfusión, drogas o traumatismos) pueden causar cuadros de edema pulmonar que cumplen de forma variable los criterios de SDRA (fig. 7 ). Su presentación característica en la radiografía de tórax, con opacidades pulmonares bilaterales, constituye un criterio diagnóstico de SDRA53, aunque la concordancia interobservador para detectarla es solo moderada54. En la TC, la fase aguda se manifiesta como opacidades con atenuación en vidrio deslustrado, consolidación o patrón en empedrado de distribución bilateral y difusa55. En los SDRA de origen extrapulmonar, estas manifestaciones tienen tendencia a presentar un gradiente anteroposterior, con preservación o menor afectación de la región anterior del pulmón y mayor atenuación progresiva, con consolidación en regiones posteriores56. Esta distribución puede ser muy similar a algunos casos de neumonía por SARS-CoV2.
Figura 7.
Mujer de 34 años, politoxicómana, que acude durante la pandemia por fiebre, disnea e hipoxemia, con elevación de dímero D. La radiografía de tórax portátil (A) mostró consolidación extensa bilateral. Se realizó angio-TC pulmonar (reconstrucción coronal en B, e imagen axial en C) que mostró un patrón en empedrado difuso, de predominio central sin derrame pleural. Ante la sospecha de edema pulmonar no cardiogénico por drogas, la paciente fue tratada con corticoides, con rápida resolución completa del cuadro clínico y radiológico a las 24 horas (D), lo que es característico de la enfermedad. La paciente había presentado un cuadro clínico similar 1 mes antes con idéntica evolución.
La hemorragia alveolar difusa (HAD) es otra causa de afectación pulmonar bilateral y difusa en pacientes con disnea. El signo cardinal que permitiría diferenciarla de la COVID-19 sería la hemoptisis. Sin embargo, puede estar ausente en un porcentaje significativo de pacientes6, 57, y signos como la fiebre y marcadores séricos de inflamación pueden estar presentes, lo que dificulta su diferenciación. La anemia de instauración reciente u otros datos clínicos de enfermedades asociadas con la HAD pueden ayudar, ya que raramente es idiopática44. Desde el punto de vista radiológico, suelen asociarse opacidades “en vidrio deslustrado”, consolidación o patrón “en empedrado”, con distribución predominantemente central o difusa, siendo rara, a diferencia de la COVID-19, la afectación únicamente periférica. Los nódulos centrolobulillares mal definidos también pueden estar presentes en la HAD57.
Los infartos pulmonares en la enfermedad tromboembólica venosa se manifiestan como lesiones periféricas subpleurales con atenuación “en vidrio deslustrado”, consolidación o, característicamente, con un área central de menor atenuación o signo del halo invertido. Con frecuencia están en los lóbulos inferiores y se asocian a derrame pleural58, 59. Estos hallazgos, junto con la fiebre a menudo asociada, pueden plantear la sospecha de neumonía por SARS-CoV-2 (fig. 2C). Ayudan al diagnóstico la presencia de trombos en las arterias que se dirigen a la lesión, el dolor pleurítico frecuente y la hemoptisis. Los fenómenos trombóticos complican frecuentemente otros procesos médicos, entre ellos la COVID-1960.
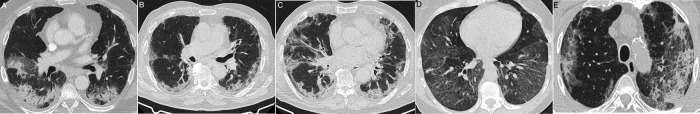
Algunas enfermedades intersticiales difusas idiopáticas o secundarias (enfermedad del colágeno, toxicidad farmacológica, etc.) pueden tener una presentación clínica aguda o subaguda o sufrir exacerbaciones, lo que puede plantear el diagnóstico diferencial con la COVID-19. Describirlas detalladamente sobrepasa los objetivos de esta revisión. Las entidades con más similitud clínica y radiológica con la COVID-19 por su apariencia y distribución son la neumonía organizada (NO), la neumonía intersticial no específica (NINE), la neumonía intersticial descamativa (NID) y la exacerbación de la neumonía intersticial usual (NIU)61. La NO puede ocurrir de forma idiopática o ser secundaria a múltiples procesos, como las infecciones61. Diferenciar la forma idiopática de la asociada a una neumonía vírica puede ser imposible en algunos casos13, 62, especialmente cuando predomina la distribución subpleural (fig. 8 A), que ocurre en alrededor del 40%63. No debe extrañar que algunos signos radiológicos descritos en la NO, como el signo del halo invertido o el patrón perilobulillar, aparezcan también en la neumonía COVID-1913. El predominio de las consolidaciones de distribución peribroncovascular podría ser un rasgo distintivo de una NO. La NINE tiene muchas similitudes radiológicas con la afectación pulmonar por SARS-CoV-264; sin embargo, su presentación clínica, generalmente asociada a enfermedades del colágeno o por toxicidad permitirá su diagnóstico. La banda subpleural respetada puede aparecer en ambas entidades, si bien suele estar peor delimitada en el caso de la NINE (fig. 8B y C). La pérdida de volumen de los lóbulos inferiores y las bronquiectasias en el seno de las opacidades “en vidrio deslustrado” son hallazgos radiológicos clave para diagnosticar la NINE, aunque en la evolución de la neumonía COVID-19 también pueden aparecer, por lo que es muy difícil su diferenciación. La NID se caracteriza por la presencia de opacidades “en vidrio deslustrado” puro extensas y de predominio basal (fig. 8D); en estos casos, la presencia de datos de bronquiolitis respiratoria y enfisema en lóbulos superiores en un paciente fumador ayudan a establecer la sospecha. La exacerbación aguda de la NIU, aunque también de otras enfermedades intersticiales, puede tener una presentación similar a la COVID-19. En estos casos, el conocimiento de los antecedentes o la identificación de reticulación, bronquiectasias por tracción y panalización asociadas a las opacidades de atenuación “en vidrio deslustrado” y consolidaciones centrales, características de la exacerbación aguda, puede ayudar al diagnóstico65. Aunque en el momento de escribir estas líneas no hay datos de la asociación del SARS-CoV-2 con mayor incidencia de exacerbación aguda, se acepta que las infecciones víricas pueden desencadenarla, y por tanto sería esperable su asociación con la COVID-1965.
Figura 8.
Enfermedades intersticiales con apariencia similar a la COVID-19 que pueden manifestarse con disnea y ocasionalmente fiebre. A) Neumonía organizada criptogenética con consolidación periférica y broncograma aéreo. B y C) Neumonía intersticial no específica que muestra áreas de atenuación “en vidrio deslustrado” y consolidación periféricas con banda respetada subpleural. D) Neumonía intersticial descamativa en paciente fumador, que muestra extensas áreas de atenuación en vidrio deslustrado y pequeños quistes aéreos. E) Neumonía eosinófila crónica que muestra consolidación periférica que respeta parcialmente la región subpleural y afecta característicamente a los lóbulos superiores.
La neumonitis por hipersensibilidad muestra manifestaciones clínicas y radiológicas variables66. En su presentación aguda/subaguda, los nódulos centrolobulillares de atenuación “en vidrio deslustrado” y los patrones en mosaico y “en cabeza de jabalí” son los hallazgos que caracterizan la enfermedad67. De ellos, este último, con lobulillos pulmonares normales alternando con otros de menor atenuación por atrapamiento aéreo y con áreas de mayor atenuación “en vidrio deslustrado”, es el que con mayor frecuencia podría simular una neumonía por SARS-CoV-268. No obstante, en la neumonitis por hipersensibilidad y otras enfermedades asociadas a este patrón, como la sarcoidosis o, en nuestra experiencia, algunas enfermedades del colágeno o toxicidad por drogas, la afectación suele ser difusa, sin predominio por la periferia pulmonar como en la COVID-19.
Las enfermedades eosinófilas del pulmón constituyen un grupo variado de enfermedades que pueden simular la COVID-19, especialmente la neumonía eosinófila aguda (NEA) desde el punto de vista clínico y la crónica, desde el radiológico69. La eosinofilia periférica presente en todas ellas salvo en la NEA, ayudará a sospecharlas. La NEA es una entidad rara, su presentación característicamente aguda con fiebre e hipoxemia, opacidades en vidrio deslustrado difusas y engrosamiento de septos extenso como hallazgos fundamentales dificulta diferenciarla de muchas entidades comentadas anteriormente. La consolidación periférica de la forma crónica puede ser similar a la COVID-19, excepto por su predominio superior (fig. 8E).
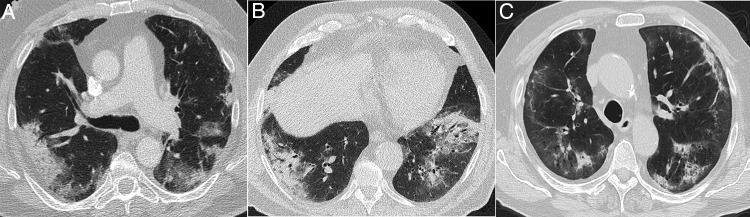
En los pacientes oncológicos se debe tener presente siempre la posibilidad de una toxicidad farmacológica como causa de un cuadro clínico-radiológico con opacidades pulmonares bilaterales, fiebre y disnea. Los patrones de afectación pulmonar como NO, NINE, “cabeza de jabalí” o un daño alveolar difuso70 pueden obligar a considerar a la COVID-19 en el diagnóstico diferencial en fases epidémicas (fig. 9 ).
Figura 9.
Neumonitis secundaria a toxicidad farmacológica, cuya presentación clínica y alteraciones parenquimatosas pueden simular la neumonía COVID-19. A) Paciente con carcinoma de colon en tratamiento con el esquema FOLFOX (ácido folínico, fluorouracilo y oxaliplatino). B) Carcinoma de células renales en tratamiento con everolimus. C) Paciente con neoplasia pulmonar con mutación ALK tratada con alectinib, que acudió durante la pandemia por disnea, descartándose COVID-19 y otras causas para las lesiones.
Por último, las manifestaciones o complicaciones pulmonares de algunas enfermedades (como por ejemplo algunas enfermedades y terapias hematológicas) podrían plantear dudas con la COVID-19 en una fase epidémica, por lo que es imprescindible conocer los antecedentes51 para incluir esas entidades raras en el diagnóstico diferencial (fig. 2A), aunque su discusión excede los objetivos de esta revisión.
Conclusión
En este capítulo hemos recopilado las claves diferenciadoras de las entidades que pueden simular neumonía por SARS-CoV-2, bien porque su presentación clínica sea similar o porque sus características radiológicas se parezcan.
Autoría
-
1.
Responsable de la integridad del estudio: JJAJ.
-
2.
Concepción del estudio: JJAJ, JMPM, EGG.
-
3.
Diseño del estudio: JJAJ, JMPM, EGG.
-
4.
Obtención de los datos: JJAJ, JMPM, EGG.
-
5.
Análisis e interpretación de los datos: JJAJ, JMPM, EGG.
-
6.
Tratamiento estadístico: N/A.
-
7.
Búsqueda bibliográfica: JJAJ, JMPM, EGG.
-
8.
Redacción del trabajo: JJAJ, JMPM, EGG.
-
9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JJAJ, JMPM, EGG.
-
10.
Aprobación de la versión final: JJAJ, JMPM, EGG.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Footnotes
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.rx.2020.11.003.
Anexo A. Material suplementario
Bibliografía
- 1.Martínez-Chamorro E., Díez Tascón A., Ibáñez-Sanz L., Ossaba-Vélez S., Borruel-Nacenta S. Manejo diagnóstico inicial del paciente con COVID-19. Radiología. 2020 doi: 10.1016/j.rx.2020.11.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Valdés P., Rovira A., Guerrero A., Morales A., Martínez C. Gestión de la pandemia. Visión del radiólogo. Radiología. 2020;62(6.) doi: 10.1016/j.rx.2020.10.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Boeken T., Le Berre A., Mebazaa A., Boulay-Coletta I., Hodel J., Zins M. Non-COVID-19 emergencies: where have all the patients gone? Eur Radiol. 2020;30:5220–5221. doi: 10.1007/s00330-020-06961-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Waller J.V., Kaur P., Tucker A., Lin K.K., Diaz M., Henry T.S. Diagnostic Tools for Coronavirus Disease (COVID-19): Comparing CT and RT-PCR Viral Nucleic Acid Testing. AJR Am J Roentgenol. 2020;15:834–838. doi: 10.2214/AJR.20.23418. [DOI] [PubMed] [Google Scholar]
- 5.Ai T., Yang Z., Hou H., Zhan C., Chen C., Lu W. Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiology. 2020;296:E32–E40. doi: 10.1148/radiol.2020200642. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lara A.R., Schwarz M.I. Diffuse alveolar hemorrhage. Chest. 2010;137:1164–1171. doi: 10.1378/chest.08-2084. [DOI] [PubMed] [Google Scholar]
- 7.Martinez F.J. Idiopathic interstitial pneumonias: usual interstitial pneumonia versus nonspecific interstitial pneumonia. Proc Am Thorac Soc. 2006;3:81–95. doi: 10.1513/pats.200511-123JH. [DOI] [PubMed] [Google Scholar]
- 8.Guan W.J., Ni Z.Y., Hu Y., Liang W.H., Ou C.Q., He J.X. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382:1708–1720. doi: 10.1056/NEJMoa200203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Franquet T. Imaging of Community-acquired Pneumonia. J Thorac Imaging. 2018;33:282–294. doi: 10.1097/RTI.0000000000000347. [DOI] [PubMed] [Google Scholar]
- 10.Arevalo-Rodriguez I, Buitrago-Garcia D, Simancas-Racines D, Zambrano P, Del Campo R, Ciaponi A, et al. False-negative results of initial RT-PCR assays for COVID-19: a systematic review. medRxiv 2020.04.16.20066787. doi: 10.1101/2020.04.16.20066787. [DOI] [PMC free article] [PubMed]
- 11.Luo L., Luo Z., Jia Y., Zhou C., He J., Lyu J. CT differential diagnosis of COVID-19 and non-COVID-19 in symptomatic suspects: a practical scoring method. BMC Pulm Med. 2020;20:129. doi: 10.1186/s12890-020-1170-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Wong H.Y.F., Lam H.Y.S., Fong A.H., Leung S.T., Chin T.W., Lo C.S.Y. Frequency and Distribution of Chest Radiographic Findings in COVID-19 Positive Patients. Radiology. 2020;296:E72–E78. doi: 10.1148/radiol.2020201160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ojha V., Mani A., Pandey N.N., Sharma S., Kumar S. CT in coronavirus disease 2019 (COVID-19): a systematic review of chest CT findings in 4410 adult patients. Eur Radiol. 2020;30:6129–6138. doi: 10.1007/s00330-020-06975-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Weinstock M.B., Echenique A., Russell J.W., Miller J.A., Cohen D.J., Waite S. Chest x-ray findings in 636 ambulatory patients with COVID-19 presenting to an urgent care center: a normal chest x-ray is no guarantee. J Urgent Care Med. 2020;14:13–18. [Google Scholar]
- 15.Litmanovich D.E., Chung M., Kirkbride R.R., Kicska G., Kanne J.P. Review of Chest Radiograph Findings of COVID-19 Pneumonia and Suggested Reporting Language. J Thorac Imaging. 2020 Jun 9 doi: 10.1097/RTI.0000000000000541. [DOI] [PubMed] [Google Scholar]
- 16.Vancheri S.G., Savietto G., Ballati F., Maggi A., Canino C., Bortolotto C. Radiographic findings in 240 patients with COVID-19 pneumonia: time-dependence after the onset of symptoms. Eur Radiol. 2020;30:6161–6169. doi: 10.1007/s00330-020-06967-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Nambu A., Ozawa K., Kobayashi N., Tago M. Imaging of community-acquired pneumonia: Roles of imaging examinations, imaging diagnosis of specific pathogens and discrimination from noninfectious diseases. World J Radiol. 2014;6:779–793. doi: 10.4329/wjr.v6.i10.779. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan. China: a descriptive study. Lancet. 2020;395:507–513. doi: 10.1016/S0140-6736(20)30211-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Salehi S., Abedi A., Balakrishnan S., Gholamrezanezhad A. Coronavirus Disease 2019 (COVID-19): A Systematic Review of Imaging Findings in 919 Patients. AJR Am J Roentgenol. 2020;215:87–93. doi: 10.2214/AJR.20.23034. [DOI] [PubMed] [Google Scholar]
- 20.Zhang R., Ouyang H., Fu L., Wang S., Han J., Huang K. CT features of SARS-CoV-2 pneumonia according to clinical presentation: a retrospective analysis of 120 consecutive patients from Wuhan city. Eur Radiol. 2020;30:4417–4426. doi: 10.1007/s00330-020-06854-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Bai H.X., Hsieh B., Xiong Z., Halsey K., Choi J.W., Tran T.M.L. Performance of Radiologists in Differentiating COVID-19 from Non-COVID-19 Viral Pneumonia at Chest CT. Radiology. 2020;296:E46–E54. doi: 10.1148/radiol.2020200823. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Pu J., Leader J., Bandos A., Shi J., Du P., Yu J. Any unique image biomarkers associated with COVID-19? Eur Radiol. 2020;30:6221–6227. doi: 10.1007/s00330-020-06956-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Tian S., Hu W., Niu L., Liu H., Xu H., Xiao S.Y. Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer. J Thorac Oncol. 2020;15:700–704. doi: 10.1016/j.jtho.2020.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Carsana L., Sonzogni A., Nasr A., Rossi R.S., Pellegrinelli A., Zerbi P. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infect Dis. 2020;20:1135–1140. doi: 10.1016/S1473-3099(20)30434-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Schaller T., Hirschbühl K., Burkhardt K., Braun G., Trepel M., Märkl B. Postmortem Examination of Patients With COVID-19. JAMA. 2020;323:2518–2520. doi: 10.1001/jama.2020.8907. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Ackermann M., Verleden S.E., Kuehnel M., Haverich A., Welte T., Laenger F. Pulmonary Vascular Endothelialitis. Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383:120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Parekh M., Donuru A., Balasubramanya R., Kapur S. Review of the Chest CT Differential Diagnosis of Ground-Glass Opacities in the COVID Era. Radiology. 2020;297:E28229–E28302. doi: 10.1148/radiol.2020202504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Franquet T. Imaging of pulmonary viral pneumonia. Radiology. 2011;260:18–39. doi: 10.1148/radiol.11092149. [DOI] [PubMed] [Google Scholar]
- 29.Koo H.J., Lim S., Choe J., Choi S.H., Sung H., Do K.H. Radiographic and CT Features of Viral Pneumonia. Radiographics. 2018;38:719–739. doi: 10.1148/rg.2018170048. [DOI] [PubMed] [Google Scholar]
- 30.Beigelman-Aubry C., Godet C., Caumes E. Lung infections: the radiologist's perspective. Diagn Interv Imaging. 2012;93:431–440. doi: 10.1016/j.diii.2012.04.021. [DOI] [PubMed] [Google Scholar]
- 31.Cereser L., Dallorto A., Candoni A., Volpetti S., Righi E., zuiani C. Pneumocystis jirovecii pneumonia at chest High-resolution Computed Tomography (HRCT) in non-HIV immunocompromised patients: Spectrum of findings and mimickers. Eur J Radiol. 2019;116:116–127. doi: 10.1016/j.ejrad.2019.04.025. [DOI] [PubMed] [Google Scholar]
- 32.Kanne J.P., Yandow D.R., Meyer C.A. Pneumocystis jirovecii pneumonia: high-resolution CT findings in patients with and without HIV infection. AJR Am J Roentgenol. 2012;198:W555–W561. doi: 10.2214/AJR.11.7329. [DOI] [PubMed] [Google Scholar]
- 33.Rossi S.E., Erasmus J.J., Volpacchio M., Franquet T., Castiglioni T., McAdams H.P. Crazy-paving” pattern at thin-section CT of the lungs: radiologic-pathologic overview. Radiographics. 2003;23:1509–1519. doi: 10.1148/rg.236035101. [DOI] [PubMed] [Google Scholar]
- 34.De Wever W., Meersschaert J., Coolen J., Verbeken E., Verschakelen J.A. The crazy-paving pattern: a radiological-pathological correlation. Insights Imaging. 2011;2:117–132. doi: 10.1007/s13244-010-0060-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Thomas R., Madan R., Gooptu M., Hatabu H., Hammer M.M. Significance of the Reverse Halo Sign in Immunocompromised Patients. AJR Am J Roentgenol. 2019;213:549–554. doi: 10.2214/AJR.19.21273. [DOI] [PubMed] [Google Scholar]
- 36.Almeida R.R., Marchiori E., Flores E.J. Frequency and Reliability of the Reversed Halo Sign in Patients With Septic Pulmonary Embolism Due to IV Substance Use Disorder. AJR Am J Roentgenol. 2020;214:59–67. doi: 10.2214/AJR.19.21659. [DOI] [PubMed] [Google Scholar]
- 37.Marchiori E., Zanetti G., Irion K.L., Nobre L.F., Hochhegger B., Mançano A.D. Reversed halo sign in active pulmonary tuberculosis: criteria for differentiation from cryptogenic organizing pneumonia. AJR Am J Roentgenol. 2011;197:1324–1327. doi: 10.2214/AJR.11.6543. [DOI] [PubMed] [Google Scholar]
- 38.Ryu A.J., Navin P.J., Hu X., Yi E.S., Hartman T.E., Ryu J.H. Clinico-radiologic Features of Lung Disease Associated With Aspiration Identified on Lung Biopsy. Chest. 2019;156:1160–1166. doi: 10.1016/j.chest.2019.07.018. [DOI] [PubMed] [Google Scholar]
- 39.Franquet T., Giménez A., Rosón N., Torrubia S., Sabaté J.M., Pérez C. Aspiration diseases: findings, pitfalls, and differential diagnosis. Radiographics. 2000;20:673–685. doi: 10.1148/radiographics.20.3.g00ma01673. [DOI] [PubMed] [Google Scholar]
- 40.Nachiappan A.C., Rahbar K., Shi X., Guy E.S., Mortani Barbosa E.J., Jr., Shroff G.S. Pulmonary Tuberculosis: Role of Radiology in Diagnosis and Management. Radiographics. 2017;37:52–72. doi: 10.1148/rg.2017160032. [DOI] [PubMed] [Google Scholar]
- 41.Wang H., Wei R., Rao G., Zhu J., Song B., Characteristic C.T. findings distinguishing 2019 novel coronavirus disease (COVID-19) from influenza pneumonia. Eur Radiol. 2020;30:4910–4917. doi: 10.1007/s00330-020-06880-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Han R., Huang L., Jiang H., Dong J., Peng H., Zhang D. Early Clinical and CT Manifestations of Coronavirus Disease 2019 (COVID-19) Pneumonia. AJR Am J Roentgenol. 2020;215:338–343. doi: 10.2214/AJR.20.22961. [DOI] [PubMed] [Google Scholar]
- 43.Ng M.Y., Lee E.Y.P., Yang J., Yang F., Li X., Wang H. Imaging Profile of the COVID-19 Infection: Radiologic Findings and Literature Review. Radiology: Cardiothoracic Imaging. 2020 Feb 13 doi: 10.1148/ryct.2020200034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Mandell L.A., Niederman M.S. Aspiration Pneumonia. N Engl J Med. 2019;380:651–663. doi: 10.1056/NEJMra1714562. [DOI] [PubMed] [Google Scholar]
- 45.Hu X., Lee J.S., Pianosi P.T., Ryu J.H. Aspiration-related pulmonary syndromes. Chest. 2015;147:815–823. doi: 10.1378/chest.14-1049. [DOI] [PubMed] [Google Scholar]
- 46.Arenas-Jiménez J., García Garrigós E., Sirera M., García-Pastor I. Checklist approach to the interpretation of chest CT examinations showing diffuse abnormalities in acute disease. Educational Exhibit presented at 105th scientific assembly and annual meeting. RSNA. 2019 Chicago, Dec 1-6 2019. [Google Scholar]
- 47.Wang C.S., FitzGerald J.M., Schulzer M., Mak E., Ayas N.T. Does this dyspneic patient in the emergency department have congestive heart failure? JAMA. 2005;294:1944–1956. doi: 10.1001/jama.294.15.1944. [DOI] [PubMed] [Google Scholar]
- 48.Ponikowski P., Voors A.A., Anker S.D., Bueno H., Cleland J.G., Coats A.J. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37:2129–2200. doi: 10.1093/eurheartj/ehw128. [DOI] [PubMed] [Google Scholar]
- 49.Blecker S., Paul M., Taksler G., Ogedegbe G., Katz S. Heart failure–associated hospitalizations in the United States. J Am Coll Cardiol. 2013;61:1259–1267. doi: 10.1016/j.jacc.2012.12.038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Chen T., Wu D., Chen H., Yan W., Yang D., Chen G. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ. 2020;368:m1091. doi: 10.1136/bmj.m1091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Xie C., Tsakok M., Channon-Wells S., MacLeod F., Peschl H., Wing L. COVID-19 pneumonia and the masquerades. BJR Case Rep. 2020;6:20200067. doi: 10.1259/bjrcr.20200067. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Fan E., Brodie D., Slutsky A.S. Acute Respiratory Distress Syndrome: Advances in Diagnosis and Treatment. JAMA. 2018;319:698–710. doi: 10.1001/jama.2017.21907. [DOI] [PubMed] [Google Scholar]
- 53.Definition Task Force A.R.D.S., Ranieri V.M., Rubenfeld G.D., Thompson B.T., Ferguson N.D., Caldwell E. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307:2526–2533. doi: 10.1001/jama.2012.5669. [DOI] [PubMed] [Google Scholar]
- 54.Rubenfeld G.D., Caldwell E., Granton J., Hudson L.D., Matthay M.A. Interobserver variability in applying a radiographic definition for ARDS. Chest. 1999;116:1347–1353. doi: 10.1378/chest.116.5.1347. [DOI] [PubMed] [Google Scholar]
- 55.Obadina E.T., Torrealba J.M., Kanne J.P. Acute pulmonary injury: high-resolution CT and histopathological spectrum. Br J Radiol. 2013;86:20120614. doi: 10.1259/bjr.20120614. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Elicker B.M., Jones K.T., Naeger D.M., Frank J.A. Imaging of Acute Lung Injury. Radiol Clin North Am. 2016;54:1119–1132. doi: 10.1016/j.rcl.2016.05.006. [DOI] [PubMed] [Google Scholar]
- 57.Levesque M.H., Montesi S.B., Sharma A. Diffuse Parenchymal Abnormalities in Acutely Dyspneic Patients: A Pattern-based Approach. J Thorac Imaging. 2015;30:220–232. doi: 10.1097/RTI.0000000000000133. [DOI] [PubMed] [Google Scholar]
- 58.Marchiori E., Menna Barreto M., Pereira Freitas H.M., Hochhegger B., Soares Souza A., Jr., Zanetti G. Morphological characteristics of the reversed halo sign that may strongly suggest pulmonary infarction. Clin Radiol. 2018;73:503. doi: 10.1016/j.crad.2017.11.022. e7-503.e13. [DOI] [PubMed] [Google Scholar]
- 59.Revel M.P., Triki R., Chatellier G., Couchon S., Haddad N., Hernigou A. Is It possible to recognize pulmonary infarction on multisection CT images? Radiology. 2007;244:875–882. doi: 10.1148/radiol.2443060846. [DOI] [PubMed] [Google Scholar]
- 60.Gervaise A., Bouzad C., Peroux E., Helissey C. Acute pulmonary embolism in non-hospitalized COVID-19 patients referred to CTPA by emergency department. Eur Radiol. 2020;30:6170–6177. doi: 10.1007/s00330-020-06977-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Travis W.D., Costabel U., Hansell D.M., King T.E., Jr., Lynch D.A., Nicholson A.G. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013;188:733–748. doi: 10.1164/rccm.201308-1483ST. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Goyal N., Chung M., Bernheim A., Keir G., Mei X., Huang M. Computed Tomography Features of Coronavirus Disease 2019 (COVID-19): A Review for Radiologists. J Thorac Imaging. 2020;35:211–218. doi: 10.1097/RTI.0000000000000527. [DOI] [PubMed] [Google Scholar]
- 63.Lee J.W., Lee K.S., Lee H.Y., Chung M.P., Yi C.A., Kim T.S. Cryptogenic organizing pneumonia: serial high-resolution CT findings in 22 patients. AJR Am J Roentgenol. 2010;195:916–922. doi: 10.2214/AJR.09.3940. [DOI] [PubMed] [Google Scholar]
- 64.Kligerman S.J., Groshong S., Brown K.K., Lynch D.A. Nonspecific interstitial pneumonia: radiologic, clinical, and pathologic considerations. Radiographics. 2009;29:73–87. doi: 10.1148/rg.291085096. [DOI] [PubMed] [Google Scholar]
- 65.Collard H.R., Ryerson C.J., Corte T.J., Jenkins G., Kondoh Y., Lederer D.J., Acute Exacerbation of Idiopathic Pulmonary Fibrosis. An International Working Group Report Am J Respir Crit Care Med. 2016;194:265–275. doi: 10.1164/rccm.201604-0801CI. [DOI] [PubMed] [Google Scholar]
- 66.Magee A.L., Montner S.M., Husain A., Adegunsoye A., Vij R., Chung J.H. Imaging of Hypersensitivity Pneumonitis. Radiol Clin North Am. 2016;54:1033–1046. doi: 10.1016/j.rcl.2016.05.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Barnett J., Molyneaux P.L., Rawal B., Abdullah R., Hare S.S., Vancheeswaran R. Variable utility of mosaic attenuation to distinguish fibrotic hypersensitivity pneumonitis from idiopathic pulmonary fibrosis. Eur Respir J. 2019;54:1900531. doi: 10.1183/13993003.00531-2019. [DOI] [PubMed] [Google Scholar]
- 68.Chong B.J., Kanne J.P., Chung J.H. Headcheese sign. J Thorac Imaging. 2014;29:W13. doi: 10.1097/RTI.0000000000000067. [DOI] [PubMed] [Google Scholar]
- 69.Jeong Y.J., Kim K.I., Seo I.J., Lee C.H., Lee K.N., Kim K.N. Eosinophilic lung diseases: a clinical, radiologic, and pathologic overview. Radiographics. 2007;27:617–639. doi: 10.1148/rg.273065051. [DOI] [PubMed] [Google Scholar]
- 70.Rossi S.E., Erasmus J.J., McAdams H.P., Sporn T.A., Goodman P.C. Pulmonary drug toxicity: radiologic and pathologic manifestations. Radiographics. 2000;20:1245–1259. doi: 10.1148/radiographics.20.5.g00se081245. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.