RESUMEN
Objetivos
Analizar la administración de antibióticos, la evolución temporal de sensibilidades y el tratamiento dirigido de las infecciones asociadas a enterobacterias productoras de carbapenemasas (EPC) OXA-48 en un servicio de Cirugía General y Digestivo.
Material y métodos
Estudio observacional retrospectivo, incluyendo pacientes con cultivo positivo de OXA-48 y datos clínicos de infección activa, hospitalizados en un servicio de Cirugía General y Digestivo entre enero 2013 y diciembre 2018.
Resultados
Se incluyeron 65 pacientes, con 66 aislamientos de OXA-48: Klebsiella pneumoniae, 57 (86,5%); Enterobacter cloacae, 5 (7,6%); Escherichia coli, 3 (4,5%); Morganella morganii, 1 (1,5%). La infección intraabdominal fue la más común (n=39, 60%), y el consumo previo de antibióticos fue: piperacilina-tazobactam (48%), meropenem (45%), ciprofloxacino (25,5%), ertapenem (16,5%), imipenem (12%), amikacina (12%), tigeciclina (12%). La evolución temporal (2013/14, 2015/16 y 2017/18) de las sensibilidades (porcentajes) según antibiograma fue: ceftazidima-avibactam X-X-100; amikacina 100-96-84 (p=0,518); tigeciclina 100-92-80 (p=0,437); colistina 100-67-66 (p<0,001); meropenem 37-64-72 (p=0,214); imipenem 51-41-77 (p=0,109); gentamicina 13-19-18 (p=0,879); ertapenem 35-0-0 (p<0,001). El tratamiento dirigido tuvo una mediana de duración de 14 [RIQ 9-20] días, destacando en frecuencia: tigeciclina (57%); meropenem (40,5%); amikacina (37,5%); ceftazidima-avibactam (9%); imipenem (7,5%); colistina (7,5%). La mortalidad global a 30 días fue del 12% (8 individuos). El tratamiento dirigido fue adecuado según antibiograma en el 87,7%, utilizando un régimen de terapia combinada en el 76,9%, régimen que incluyó algún carbapenémico en el 49,2%.
Conclusiones
En Cirugía General y Digestivo destaca la infección intraabdominal asociada a OXA-48, con elevado consumo previo de antibióticos de amplio espectro. El tratamiento dirigido con mayor sensibilidad de cepas productoras de OXA-48 incluye ceftazidima-avibactam, amikacina, tigeciclina, meropenem e imipenem.
PALABRAS CLAVE: Carbapenemasa, Enterobacterias, Resistencia
ABSTRACT
Objective
To assess antibiotic consumption, susceptibility patterns and targeted treatment for OXA-48 carbapenemase-producing Enterobacteriaceae (CPE) related infections in surgical patients in a General Surgery Department.
Material and methods
Retrospective review of patients with a positive culture for OXA-48 and associated clinical data of infection, while hospitalized in a General Surgery Department from January 2013 to December 2018.
Results
Sixty-five patients with 66 isolations (OXA-48) were included: Klebsiella pneumoniae, 57 (86.5%); Enterobacter cloacae, 5 (7.6%); Escherichia coli, 3 (4.5%); Morganella morganii, 1 (1.5%). The most frequent source was intra-abdominal infection (n=39, 60%), and previous antibiotic consumption was: piperacillin-tazobactam (48%), meropenem (45%), ciprofloxacin (25.5%), ertapenem (16.5%), imipenem (12%), amikacin (12%), tigecycline (12%). Temporal trends (2013/14, 2015/16 and 2017/18) in susceptibility patterns were (percentages): ceftazidime-avibactam X-X-100; amikacin 100-96-84 (p=0.518); tigecycline 100-92-80 (p=0.437); colistin 100-67-66 (p<0.001); meropenem 37-64-72 (p=0.214); imipenem 51-41-77 (p=0.109); gentamicin 13-19-18 (p=0.879); ertapenem 35-0-0 (p<0.001). Median duration of the targeted antibiotic therapy was 14 [IQR 9-20] days; antibiotics used were: tigecycline (57%); meropenem (40.5%); amikacin (37.5%); ceftazidime-avibactam (9%); imipenem (7.5%); colistin (7.5%). Global mortality rate at 30 days was 12% (8 patients). Targeted treatment was appropriate (antibiogram) in 87.7%, and targeted combination scheme was administered in 76.9%, which included a carbapenem in 49.2%.
Conclusions
OXA-48-related-intra-abdominal infection is significant in surgical patients, with substantial broad-spectrum antibiotic consumption. Useful targeted therapy includes ceftazidime-avibactam, amikacin, tigecycline, meropenem, and imipenem.
Keywords: Carbapenemase, Enterobacteriaceae, Resistance
INTRODUCCIÓN
Las infecciones asociadas a enterobacterias productoras de carbapenemasas (EPC) suponen un grave problema sanitario a nivel mundial, existiendo una prioridad de primer nivel actualmente para el desarrollo de nuevos antibióticos [1,2]. Los factores de riesgo de adquisición de estas infecciones han sido ampliamente detallados en la literatura, siendo la administración de antibióticos el factor clave, sobre todo antibióticos de amplio espectro destacando los carbapenémicos [3].
Las infecciones nosocomiales asociadas a EPC traen consigo elevados porcentajes de morbimortalidad; teniendo lugar habitualmente en pacientes con múltiples comorbilidades, sometidos a procedimientos diagnóstico-terapéuticos y con estancia hospitalaria prolongada [4,5]. Existen unas recomendaciones acerca del tratamiento frente a EPC, si bien son opciones limitadas debido al reducido abanico de antibióticos disponibles frente a cepas sensibles [6].
Los estudios publicados acerca de la incidencia y el perfil de las infecciones por EPC en pacientes quirúrgicos son escasos hasta la fecha [7,8], incluyendo la mayoría pacientes quirúrgicos en unidad de cuidados intensivos o algunos casos de infección intraabdominal (IIA). Al añadir una intervención quirúrgica, se incrementa el riesgo de morbimortalidad, y potencialmente la probabilidad de requerir nuevos tratamientos, reintervenciones, antibióticos de amplio espectro; y con todo ello, un incremento en estancia y costes sanitarios [8,9].
El objetivo de este estudio fue analizar el perfil de la administración previa de antibióticos, la evolución temporal de sensibilidades y el tratamiento dirigido en pacientes con infecciones asociadas a EPC de clase OXA-48 de un departamento de Cirugía General y Digestivo (CGD).
MATERIAL Y MÉTODOS
Estudio observacional retrospectivo, incluyendo pacientes con infecciones asociadas a EPC OXA-48 en un departamento de CGD entre enero 2013 y diciembre 2018. Los criterios de inclusión fueron: adultos mayores de 18 años de edad, presencia de al menos un cultivo positivo a partir de 48 horas tras el ingreso, asociado a datos clínicos de infección activa. Para realizar una revisión completa de la evolución de cada paciente, se excluyeron aquellos pacientes con aislamientos de EPC no ingresados en CGD o trasladados a otros servicios, pacientes con información incompleta de datos microbiológicos y pacientes colonizados por EPC sin expresión clínica. Los datos quedaron recogidos en una base de datos informatizada y anónima, incluyendo a los pacientes exclusivamente una vez, revisando la evolución hasta el alta hospitalaria o el fallecimiento.
Las variables analizadas se recogieron mediante la revisión del historial médico de los pacientes. Se registraron factores intrínsecos (comorbilidades, datos demográficos) y extrínsecos del paciente, incluyendo en este caso factores de riesgo de infección por EPC presentes en los 30 días previos al diagnóstico. Se recogieron los antibióticos administrados previamente al aislamiento de EPC (durante al menos 48 horas, administrados en los 30 días previos a EPC). Se evaluó la presencia de infecciones nosocomiales según la fuente principal de infección (la infección nosocomial se definió como una infección que tiene lugar al menos 48 horas tras el ingreso hospitalario actual, o una infección que ya existía dentro de las dos semanas anteriores en relación con un ingreso previo [10]). El foco infeccioso más probable se registró según datos microbiológicos y según la evaluación clínica reflejada por al menos dos facultativos, teniendo en cuenta criterios de las definiciones de CDC estadounidenses (Centers for Disease Control and Prevention) [10]. Las variables microbiológicas analizadas incluyeron especie, presencia y clase de carbapenemasa [11], antibiograma con patrón de sensibilidades y presencia en la cepa de beta-lactamasas de espectro extendido (BLEE). Se registró la terapia dirigida para EPC según antibiograma, y la relación con la mortalidad (tasa de mortalidad global a 30 días). El tratamiento dirigido apropiado se definió así al mostrar actividad in vitro, incluyendo una duración mínima de 48 horas [12]. El régimen de monoterapia o terapia combinada se definió según el número de antibióticos activos incluidos.
El protocolo para la realización de este trabajo obtuvo la aprobación correspondiente por el Comité Ético de Investigación Clínica del centro (referencia nº registro 3454).
El cribado de EPC y la determinación del antibiograma se realizó utilizando el sistema MicroScan “Walk away”® (Beckman Coulter). Se estudiaron todas las cepas con concentración mínima inhibitoria (CMI) >0,125 mg/L para ertapenem y meropenem, y CMI >1 mg/L para imipenem, según las recomendaciones EUCAST (European Committee on Antimicrobial Susceptibility Testing). La caracterización de las cepas de EPC identificadas en los años 2013 y 2014 tuvieron estudio de fenotipo empleando métodos colorimétricos CARBA NP, realizando el estudio genotípico en el Centro Nacional de Micro-biología (Instituto de Salud Carlos III). A partir del año 2015, el estudio fenotípico se realizó utilizando inmunocromatografía (OXA-48 Card Letitest, Coris BioConcept Belgium), y en caso de resultado negativo tras inmunocromatografía, empleando la técnica de la reacción en cadena de polimerasa (PCR) en tiempo real Xpert Carba-R (Cepheid Sunnyvale, CA).
En el caso de las variables categóricas, los resultados se expresaron como porcentajes, y como media y desviación estándar para variables continuas, utilizando mediana y rango intercuartílico (RIQ) para variables con distribución asimétrica. La comparación de variables continuas se realizó utilizando la prueba de Mann-Whitney. Se consideraron diferencias estadísticamente significativas de forma bilateral con valores de p < 0,05. El análisis estadístico se realizó mediante el programa SPSS® v. 25.0 para Windows (SPSS Inc., Chicago, Illinois, USA).
RESULTADOS
En los seis años de estudio se incluyeron 65 pacientes con infecciones asociadas a OXA-48. La edad media fue de 68,7 ± 13 años y la mediana del índice de comorbilidad de Charlson de 4 [RIC 1-6], incluyendo 37 pacientes de sexo masculino (57%).
Se registraron 66 aislamientos: Klebsiella pneumoniae, 57 (86,5%); Enterobacter cloacae, 5 (7,6%); Escherichia coli, 3 (4,5%); Morganella morganii, 1 (1,5%) (aislamiento simultáneo en un individuo de K. pneumoniae y E. coli). El aislamiento previo de bacterias productoras de BLEE (beta-lactamasas de espectro extendido) tuvo lugar en el 18% de individuos, existiendo 5 cepas coproductoras de OXA-48 y BLEE en un mismo individuo (7,6%). Las infecciones asociadas a OXA-48 se clasificaron según la fuente principal: IIA 39 (60%), infección de herida quirúrgica 16 (24,5%), infección de tracto urinario 7 (11%), neumonía 2 (3%), bacteriemia primaria/bacteriemia asociada a catéter 1 (1,5%).
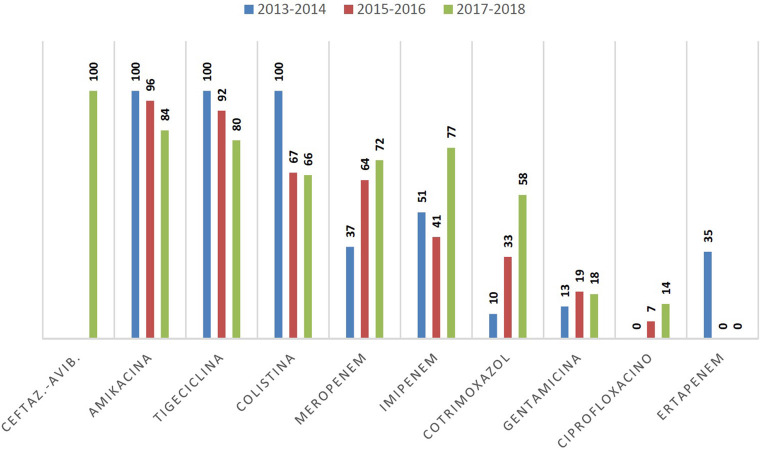
Todos los pacientes recibieron tratamiento antibiótico en los 30 días previos a la infección por OXA-48, destacando en orden (Tabla 1): piperacilina-tazobactam (48%), meropenem (45%), ciprofloxacino (25,5%), ertapenem (16,5%), imipenem (12%), amikacina (12%), tigeciclina (12%). La evolución de las sensibilidades (porcentajes) según antibiograma a lo largo del periodo estudiado se presenta en la figura 1.
Tabla 1.
Antibioterapia recibida según el momento respecto a la infección por EPC.
| Antibiótico | Previa (n, %) |
Dirigida (n, %) |
|---|---|---|
| Amikacina | 8 (12) | 24 (37,5) |
| Amoxicilina-ácido clavulánico | 6 (9) | 0 |
| Aztreonam | 1 (1,5) | 0 |
| Cefotaxima | 0 | 0 |
| Ceftazidima | 1 (1,5) | 0 |
| Ceftazidima-avibactam | 0 | 6 (9) |
| Ceftolozano-tazobactam | 1 (1,5) | 0 |
| Ceftriaxona | 2 (3) | 0 |
| Cefuroxima | 1 (1,5) | 0 |
| Ciprofloxacino | 17 (25,5) | 2 (3) |
| Colistina | 1 (1,5) | 5 (7,5) |
| Cotrimoxazol | 2 (3) | 3 (4,5) |
| Ertapenem | 11 (16,5) | 1 (1,5) |
| Fosfomicina | 0 | 3 (4,5) |
| Gentamicina | 3 (4,5) | 2 (3) |
| Imipenem | 8 (12) | 5 (7,5) |
| Levofloxacino | 5 (7,5) | 1 (1,5) |
| Meropenem | 30 (45) | 26 (40,5) |
| Metronidazol | 4 (6) | 0 |
| Piperacilina-tazobactam | 31 (48) | 1 (1,5) |
| Rifaximina | 0 | 0 |
| Tigeciclina | 8 (12) | 37 (57) |
| Tobramicina | 1 (1,5) | 0 |
Figura 1.
Evolución temporal de las sensibilidades según antibiograma (porcentajes).
Analizando el tratamiento dirigido a infecciones por OXA-48, la mediana de duración fue de 14 [RIQ 9-20] días, y los antibióticos empleados con mayor frecuencia fueron (Tabla 1): tigeciclina (57%); meropenem (40,5%); amikacina (37,5%); ceftazidima-avibactam (9%); imipenem (7,5%); colistina (7,5%). La mortalidad a 30 días de las infecciones por OXA-48 fue del 12% (8 pacientes). El tratamiento dirigido (Tabla 2) fue adecuado según antibiograma en el 87,7%, utilizando un régimen de terapia combinada en el 76,9%, régimen que incluyó algún carbapenémico en el 49,2%.
Tabla 2.
Antibioterapia dirigida a EPC.
| Variable | Total = 65n (%) |
|---|---|
| Antibioterapia dirigida adecuada | 57 (87,7) |
| Antibioterapia dirigida en monoterapia | 15 (23,1) |
| Tigeciclina | 9 (13,8) |
| Colistina | 1 (1,5) |
| Amikacina/gentamicina | 1 (1,5) |
| Carbapenémico | 4 (6,2) |
| Antibioterapia dirigida combinada | 50 (76,9) |
| Combinación de dos antibióticos | 45 (69,2) |
| Combinación de tres antibióticos | 5 (7,7) |
| Incluye carbapenémico | 32 (49,2) |
| Incluye meropenem | 26 (40) |
DISCUSIÓN
El presente trabajo incluye una descripción detallada del consumo de antibióticos previo al desarrollo de infecciones por EPC en CGD, destacando elevados porcentajes de antibioterapia de amplio espectro, incluyendo algún carbapenémico en más del 60% de individuos. El empleo de antibióticos es el factor de riesgo de adquisición de EPC más mencionado en la literatura, entre los que destacan sobre el resto los carbapenémicos [13]. K. pneumoniae fue la especie identificada más común (86%), en la misma línea con los datos internacionales [2,4], y también en España, donde OXA-48 es la clase más común en los aislamientos de EPC [14].
De forma similar a los resultados publicados en estudios multicéntricos sobre los antibióticos con mayor sensibilidad de cepas productoras de OXA-48 en España [4,14], nuestros resultados fueron: amikacina (84%-100%), tigeciclina (80%-100%) y colistina (66%-100%). En el caso de los carbapenémicos los porcentajes se encuadraron en el siguiente rango de sensibilidad: meropenem 37%-72%, imipenem 41%-77%. Respecto a la evolución temporal, podemos realizar algunas afirmaciones. Ceftazidima-avibactam es un antibiótico de introducción reciente, sin identificación de resistencia en nuestras cepas, aunque ya se han comunicado mecanismos de resistencia en OXA-48 [15]. Amikacina y tigeciclina notan un descenso, rondando el 80%, y sobre todo colistina (66%). Imipenem y meropenem mantienen una sensibilidad estable en el periodo de estudio.
Los antibióticos más utilizados en el tratamiento dirigido a OXA-48 fueron tigeciclina, meropenem y amikacina, además de ceftazidima-avibactam (sobre todo en los últimos años), coincidiendo con los antibióticos habitualmente más sensibles y eficaces [16]. En nuestra serie el tratamiento dirigido se administró mayormente siguiendo una terapia combinada, si bien no se realizaron comparaciones según aparición o no de mortalidad debido al bajo número de pacientes fallecidos (8 sobre 65 pacientes). En relación a ello diferentes trabajos han objetivado diferencias significativas en la mortalidad [3,12], recomendándose su uso en guías clínicas [3,6,17]. Por otro lado, algún estudio ha detallado la posibilidad del tratamiento dirigido con monoterapia en pacientes con bajo riesgo según modelos de mortalidad [5], sin olvidar tampoco la utilidad de los nuevos fármacos en investigación [18]. La IIA incluyó la mayoría de pacientes con infección por OXA-48 en este trabajo, siendo infecciones con potencial gravedad y morbimortalidad, debiendo adaptarse el tratamiento antibiótico con un control adecuado del foco [16,17].
Entre las principales limitaciones de este trabajo cabe mencionar el carácter retrospectivo con las limitaciones que ello conlleva. Sin embargo, la revisión de las historias clínicas fue exhaustiva y rigurosa. Por otra parte, es un estudio unicéntrico y con un número limitado de casos, lo que podría afectar a la detección de pequeñas diferencias estadísticamente significativas. Los pacientes incluidos proceden de un área concreta de una comunidad autónoma, con población quirúrgica y unas características microbiológicas concretas (patrón de sensibilidades de OXA-48). Los resultados obtenidos deben extrapolarse cautelosamente a otras poblaciones, si bien los datos finales son concordantes con la literatura.
En resumen, debemos conocer que las infecciones asociadas a OXA-48 también están presentes en pacientes quirúrgicos, destacando la IIA y una probable selección de resistencias por antibióticos de amplio espectro. Entre los antibióticos más útiles en nuestro medio como tratamiento dirigido cabe mencionar ceftazidima-avibactam, amikacina, tigeciclina, meropenem e imipenem; y a tener en cuenta un descenso en el tiempo de algunas sensibilidades.
FINANCIACIÓN
Los autores declaran que no han recibido financiación para la realización de este estudio.
CONFLICTO DE INTERESES
Los autores declaran la no existencia de conflictos de intereses en el presente estudio.
References
- 1.Tacconelli E, Carrara E, Savoldi A, Harbarth S, Mendelson M, Monnet DL, et al. . Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis. 2018;18(3):318-27. doi: 10.1016/S1473-3099(17)30753-3. [DOI] [PubMed] [Google Scholar]
- 2.Brolund A, Lagerqvist N, Byfors S, Struelens MJ, Monnet DL, Albiger B, et al. . Worsening epidemiological situation of carbapenemase-producing Enterobacteriaceae in Europe, assessment by national experts from 37 countries, July 2018. Euro Surveill. 2019;24(9). doi: 10.2807/1560-7917.ES.2019.24.9.1900123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Martin A, Fahrbach K, Zhao Q, Lodise T. Association Between Carbapenem Resistance and Mortality Among Adult, Hospitalized Patients With Serious Infections Due to Enterobacteriaceae: Results of a Systematic Literature Review and Meta-analysis. Open Forum Infect Dis. 2018;5(7):ofy150. doi: 10.1093/ofid/ofy150. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Grundmann H, Glasner C, Albiger B, Aanensen DM, Tomlinson CT, Andrasevic AT, et al. . Occurrence of carbapenemase-producing Klebsiella pneumoniae and Escherichia coli in the European survey of carbapenemase-producing Enterobacteriaceae (EuSCAPE): a prospective, multinational study. Lancet Infect Dis. 2017;17(2):153-63. doi: 10.1016/S1473-3099(16)30257-2. [DOI] [PubMed] [Google Scholar]
- 5.Cano A, Gutierrez-Gutierrez B, Machuca I, Gracia-Ahufinger I, Perez-Nadales E, Causse M, et al. . Risks of Infection and Mortality Among Patients Colonized With Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae: Validation of Scores and Proposal for Management. Clin Infect Dis. 2018;66(8):1204-10. doi: 10.1093/cid/cix991. [DOI] [PubMed] [Google Scholar]
- 6.Sheu CC, Chang YT, Lin SY, Chen YH, Hsueh PR. Infections Caused by Carbapenem-Resistant Enterobacteriaceae: An Update on Therapeutic Options. Front Microbiol. 2019;10:80. doi: 10.3389/fmicb.2019.00080. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Di Carlo P, Gulotta G, Casuccio A, Pantuso G, Raineri M, Farulla CA, et al. . KPC-3 Klebsiella pneumoniae ST258 clone infection in postoperative abdominal surgery patients in an intensive care setting: analysis of a case series of 30 patients. BMC Anesthesiol. 2013;13(1):13. doi: 10.1186/1471-2253-13-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mora-Guzmán I, Rubio-Perez I, Domingo-Garcia D, Martin-Perez E. Intra-Abdominal Infections by Carbapenemase-producing Enterobacteriaceae in a Surgical Unit: Counting Mortality, Stay and Costs. Surg Infect (Larchmt). 2020. doi: 10.1089/sur.2020.137. [DOI] [PubMed] [Google Scholar]
- 9.Bartsch SM, McKinnell JA, Mueller LE, Miller LG, Gohil SK, Huang SS, et al. . Potential economic burden of carbapenem-resistant En-terobacteriaceae (CRE) in the United States. Clin Microbiol Infect. 2017;23(1):48.e9-48.e16. doi: 10.1016/j.cmi.2016.09.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections, 1988. Am J Infect Control. 1988;16(3):128-40. doi: 10.1016/0196-6553(88)90053-3. [DOI] [PubMed] [Google Scholar]
- 11.Queenan AM, Bush K. Carbapenemases: the versatile beta-lactamases. Clin Microbiol Rev. 2007;20(3):440-58, table of contents. doi: 10.1128/CMR.00001-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Zarkotou O, Pournaras S, Tselioti P, et al. . Predictors of mortality in patients with bloodstream infections caused by KPC-producing Klebsiella pneumoniae and impact of appropriate antimicrobial treatment. Clin Microbiol Infect 2011;17:1798–1803. doi: 10.1111/j.1469-0691.2011.03514.x. [DOI] [PubMed] [Google Scholar]
- 13.van Loon K, Voor In ‘t Holt AF, Vos MC. A Systematic Review and Meta-analyses of the Clinical Epidemiology of Carbapenem-Resistant Enterobacteriaceae. Antimicrob Agents Chemother. 2017;62(1):e01730-17. doi: 10.1128/AAC.01730-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Oteo J, Ortega A, Bartolome R, Bou G, Conejo C, Fernandez-Martinez M, et al. . Prospective multicenter study of carbapenemase-producing Enterobacteriaceae from 83 hospitals in Spain reveals high in vitro susceptibility to colistin and meropenem. Antimicrob Agents Chemother. 2015;59(6):3406-12. doi: 10.1128/AAC.00086-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Fröhlich C, Sørum V, Thomassen AM, Johnsen PJ, Leiros H-KS, Samuelsen Ø. OXA-48-mediated ceftazidime-avibactam resistance is associated with evolutionary trade-offs. mSphere. 2019;4(2):e00024-19. doi: 10.1128/mSphere.00024-19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Stewart A, Harris P, Henderson A, Paterson D. Treatment of infections by OXA-48-producing Enterobacteriaceae. Antimicrob Agents Chemother. 2018;62(11):e01195-18. doi: 10.1128/AAC.01195-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Mazuski JE, Tessier JM, May AK, et al. . The Surgical Infection Society Revised Guidelines on the Management of Intra-Abdominal Infection. Surg Infect (Larchmt). 2017;18(1):1-76. doi: 10.1089/sur.2016.261. [DOI] [PubMed] [Google Scholar]
- 18.Karaiskos I, Lagou S, Pontikis K, et al. . The ‘‘old’’ and the ‘‘new’’ antibiotics for MDR gram-negative pathogens: For whom, when, and how. Front Public Health. 2019;7:151. doi: 10.3389/fpubh.2019.00151. [DOI] [PMC free article] [PubMed] [Google Scholar]