RESUMEN
Introducción
La endocarditis infecciosa tiene una alta morbimortalidad y precisa un manejo médico-quirúrgico coordinado. El objetivo fue analizar la mortalidad en un hospital sin cirugía cardiaca.
Material y métodos
Evaluación de una cohorte pros-pectiva de pacientes con endocarditis infecciosa diagnosticada entre agosto de 2011 y enero de 2016 según los criterios de Duke modificados.
Resultados
. Se incluyeron 64 pacientes, de los cuales fueron intervenido diecisiete (26,6%). La mortalidad fue 32,8% y se asoció con el antecedente de enfermedad pulmonar obstructiva crónica y la presencia de complicaciones, como la insuficiencia valvular y los embolismos en el sistema nervioso central; la cirugía cardiaca no fue un factor relacionado con la mortalidad. Cuatro pacientes (6,6%) no fueron intervenidos a pesar de tener indicación de cirugía cardiaca. El principal motivo para no ser intervenido fue el mal pronóstico prequirúrgico (44,7%).
Conclusiones
La mortalidad por endocarditis infecciosa en un hospital sin cirugía cardíaca es elevada. La complejidad de la patología fortalece la necesidad de equipos multidisciplinarios e interhospitalarios.
Palabras clave: Endocarditis, endocarditis infecciosa, cirugía cardiaca, valvulopatía
ABSTRACT
Background
Infective endocarditis has a high morbidity and mortality and requires a coordinated medical-surgical management. The objective was to analyse the impact of surgery on mortality in a hospital without cardiac surgery.
Material and methods
Evaluation of a prospective cohort of patients with infective endocarditis diagnosed between August 2011 and January 2016 according to modified Duke’s criteria.
Results
Sixty-four patients were included, of whom seventeen patients were operated (26.6%). Mortality was 32.8% and it was associated with chronic obstructive pulmonary disease history, staphylococci coagulase-negative and the appearance of complications, as valvular insufficiency and embolisms in the central nervous system; cardiac surgery was not associated with mortality. Four patients (6,6%) were not operated despite indication of cardiac surgery. The main reason for not been intervened was the poor presurgical prognosis (44.7%).
Conclusions
Mortality due to infective endocarditis in a hospital without cardiac surgery is high. The need for interhospital teams is strengthened.
Keywords: endocarditis, infective endocarditis, cardiac surgery, valvulopathy
INTRODUCCIÓN
La endocarditis infecciosa (EI) es una enfermedad con una alta morbimortalidad, estimada en algunos estudios en torno al 25% en los 6 meses tras la cirugía [1–3]. En los últimos años se han realizado avances en el diagnóstico y manejo de esta patología [4], y se han establecido escalas de predicción de mortalidad [1]. A pesar de ello, la evolución clínica de los pacientes es muy variable y su pronóstico depende, en muchas ocasiones, de la posibilidad de cirugía cardiaca realizada precozmente [5]. Por el contrario, la disponibilidad de cirugía cardiaca se encuentra limitada a hospitales terciarios, lo que podría retrasar el tratamiento adecuado en pacientes subsidiarios de cirugía cardiaca o incluso disminuir la probabilidad de aplicarse. Aunque existen datos de grandes registros de endocarditis, no se ha evaluado con profundidad la evolución de los pacientes en centros donde los pacientes deben ser derivados para ser intervenidos quirúrgicamente.
La evaluación del impacto de la cirugía en centros donde no se dispone de este servicio es muy pertinente, ya que son muchos los hospitales en España que se encuentran en este supuesto. Debido a que la mayoría de información se deriva de cohortes y registros multicéntricos, la evolución de los pacientes en centros sin cirugía queda oscurecida. El objetivo prima-rio del estudio fue analizar el impacto de la cirugía cardíaca sobre la mortalidad de los pacientes con EI en un hospital sin servicio de cirugía cardiaca.
MATERIAL Y MÉTODOS
Realizamos un estudio de cohorte observacional pros-pectivo de todos los pacientes ingresados por EI de agosto de 2011 a enero de 2016, de forma consecutiva, en un hospital con un área de 170.000 pacientes [6]. El centro dispone de un protocolo específico y de un comité multidisciplinar de manejo de endocarditis; el hospital de referencia para la cirugía fue el mismo durante todo el estudio.
Los criterios de inclusión fueron los pacientes con diagnóstico o sospecha de EI que aportaron su consentimiento para la recogida de datos. La definición de EI se basó en los criterios de Duke modificados [7]. La curación fue definida como ausencia de sintomatología y hemocultivos estériles tras finalizar el tratamiento. La indicación de cirugía se consideró según guías actuales [4,8]. La comorbilidad se cuantificó según el índice de Charlson [9].
Las tasas se calcularon por casos incidentes entre la población del área sanitaria. Las variables cualitativas se describieron a través de frecuencia absoluta y relativa, mientras que las variables cuantitativas se describieron a través de media y desviación estándar (DS) para aquellas variables con desviación normal, y mediana y rango intercuartil (RIQ) para aquellas que no lo eran. Para la identificación de los factores de riesgo asociados a la mortalidad se utilizó la prueba Chi cuadrado para las variables cuantitativas, y la prueba t-Student y ANOVA para el análisis de una variable cualitativa frente a una variable cuantitativa según el número de categorías. Se evaluó la mortalidad intrahospitalaria. La probabilidad de muerte debido a la cirugía fue realizado por la escala RISK-E [10]. Las variables clínicamente relevantes y significativas en el análisis univariante fueron incluidas en el modelo multivariante con la mortalidad como variable dependiente. Se definió la significación estadística como p<0,05. El análisis de supervivencia se realizó mediante el método de Kaplan Meier. El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital y la información se recogió disociada de la identidad del paciente.
RESULTADOS
En el periodo observado se incluyeron un total de 64 pacientes con diagnóstico o sospecha de EI, de los cuales 40 eran hombres (62,5%). La edad media fue de 73,0±11,9 años. Cumplían criterios de EI definida 51 pacientes (79,7%). La tasa anual se mantuvo entre 6,5-11,2 casos/100,000 habitantes/ año durante el periodo observado, y hubo dos casos de recidiva de EI (3,1%).
La localización más frecuente fue sobre la válvula mitral en 25 pacientes (39,1%) y sobre válvula nativa en 31 pacientes (48,4%). Los microorganismos más frecuentes fueron los cocos grampositivos en 57 pacientes (89,1%), siendo Staphylococcus aureus el microorganismo más habitual, seguido de Streptococcus spp. y estafilococos coagulasa negativos (SCN). La mediana del índice de Charlson fue 3 puntos (RIQ 1-5). Las variables relacionadas con los microorganismos, comorbilidad, clínica y complicaciones se muestran en la tabla 1. Presentaron complicaciones 43 pacientes (67,2%), siendo los fenómenos embólicos lo más frecuente (34,4%), seguido de la insuficiencia cardiaca (23,4%), anomalías en la conducción (10,9%) e infarto de miocardio (6,3%).
Tabla 1.
Características de los pacientes con endocarditis infecciosa.
| Variable | Total n (%) |
Cirugía cardíaca | No cirugía cardíaca | Análisis univariante | |||
|---|---|---|---|---|---|---|---|
| N | 64 | 17 | 47 | p | |||
| Hombre | 40 (62,5) | 11 (64,7) | 29 (61,7) | 1 | |||
| Edad (años; media, DS) | 73,0±11,9 | 67,1±13,4 | 75,1±10,7 | 0,66 | |||
| Tipo de válvula | |||||||
| Natural | 31 (48,4) | 7 (41,2,4) | 24 (51,1) | 0,58 | |||
| Prótesis | 24 (37,5) | 8 (47,1) | 16 (34,9) | 0,39 | |||
| Localización de la endocarditis | |||||||
| Mitral | 25 (39,1) | 8 (47,1) | 17 (36,2) | 0,56 | |||
| Aórtica | 20 (31,3) | 8 (47,1) | 12 (25,5) | 0,13 | |||
| Tricúspide | 2 (3,1) | 0 (0) | 2 (4,3) | 1 | |||
| Dispositivo intravascular | 7 (10,9) | 1 (5,9) | 6 (12,8) | 1 | |||
| Antecedentes personales | |||||||
| Índice Charlson (mediana, RIQ) | 3 (1-5) | 2 (1-3) | 3 (1-5) | 0,73 | |||
| Criterios Duke definida | 51 (79,7) | 16 (94,1) | 35 (74,5) | 0.16 | |||
| EPOC | 6 (9,4) | 1 (5,9) | 5 (10,6) | 1 | |||
| Enfermedad coronaria | 10 (15,6) | 3 (17,6) | 7 (14,9) | 1 | |||
| Fibrilación/flutter auricular | 27 (42,2) | 6 (35,3) | 21 (44,7) | 0,58 | |||
| Insuficiencia cardiaca-NYHA | 14 (21,9) | 3 (17,6) | 11 (23,4) | 0,74 | |||
| Diabetes | 23 (35,9) | 8 (47,1) | 15 (31,9) | 0,38 | |||
| Accidente cerebrovascular | 11 (17,2) | 1 (5,9) | 10 (21,3) | 0,26 | |||
| Leucemia/ linfoma | 3 (4,7) | 0 (0) | 3 (6,4) | 0,56 | |||
| Neoplasiaa | 19 (29,7) | 5(47,1) | 14 (29,8) | 0,98 | |||
| Insuficiencia renal | 27 (42,2) | 8 (47,1) | 19 (40,4) | 0,78 | |||
| Endocarditis previa | 5 (7,8) | 1 (5,9) | 4 (8,5) | 1 | |||
| Cirugía cardiaca previa | 14 (21,9) | 4 (23,5) | 10 (21,3) | 1 | |||
| Valvulopatía natural | 28 (43,8) | 7 (41,2) | 21 (44,7) | 1 | |||
| Microorganismo | |||||||
| Staphylococcus aureus | 17 (26,6) | 2 (11,8) | 15 (31,9) | 0,20 | |||
| SARM | 4 (6,3) | 0 (0) | 4 (8,5) | 0,57 | |||
| Streptococcusspp.b | 16 (25) | 2 (11,8) | 14 (29,8) | 0,20 | |||
| Estafilococo coagulasa negativosc | 14 (21,9) | 7 (41,2) | 7 (14,9) | 0,04 | |||
| Enterococcusspp.d | 9 (14,1) | 3 (17,6) | 6 (12,8) | 0,69 | |||
| Levaduras | 2 (3,1) | 2 (11,8) | 0 (0) | 0,07 | |||
| Cultivo negativo | 4 (6,3) | 0 (0) | 4 (8,5) | ||||
| Clínica | |||||||
| Fiebre | 49 (76,6) | 13 (76,5) | 36 (76,6) | 1 | |||
| Fenómenos vascularese | 22 (34,4) | 14 (29,8) | 8 (47,1) | 0,2 | |||
| Fenómenos inmunológicosf | 13 (20,3) | 5 (29,4) | 8 (17,0) | 0,31 | |||
| Esplenomegalia | 2 (3,1) | 0 (0) | 2 (4,3) | 1 | |||
| Nuevo soplo o empeoramiento | 11 (17,2) | 7 (41,2) | 4 (8,5) | 0,005 | |||
| Mortalidad | 21 (32,8) | 7 (41,2) | 14 (29,8) | 0,54 | |||
| Tiempo supervivenciag(días; mediana, DS) | 26,5 (16-58) | 35 (19-66) | 25 (13-58) | 0,46 | |||
SARM: S. aureus resistente meticilina; EPOC: enfermedad pulmonar obstructiva crónica; DS: desviación estándar; RIQ: rango inter-quartil. aNeoplasia de órgano sólido y neoplasia hematológica; bLos aislados de Streptococcus fueron: 11 pacientes con S. viridans y 5 pacientes con S. bovis. cLos estafilococos coagulasa negativas aislados fueron S. epidermidis, S. capitis, S. hominis y S. lugdunensis. dLos aislados de Enterococcus aislados fueron: 8 pacientes con E. faecalis y un paciente con E. raffinosus. eFenómenos vasculares: embolismo, aneurisma micótico, hemorragia intracraneal, hemorragia conjuntival, lesiones Janeway, hemorragias en astilla, petequias. fFenómenos inmunológicos: glomerulonefritis, nódulos Osler, manchas Roth, factor reumatoide elevado. gPacientes fallecidos.
Tenían indicación de cirugía cardiaca 21 pacientes, aunque únicamente fueron intervenidos diecisiete (26,6%). Las razones por las que no fueron intervenido los cuatro pacientes, a pesar de tener indicación, fueron la complejidad de la técnica, el mal pronóstico independiente de la EI, la negativa del paciente a ser intervenido y un paciente que falleció antes de operarse. Los motivos más habituales (no exclusivos) por los que sí fueron intervenidos los 17 pacientes fueron: 10/17 pacientes presencia de prótesis (58,9% respecto a los pacientes operados), 8/17 pacientes insuficiencia valvular por insuficiencia cardiaca y/o perforación válvula (47,1%), 7/17 pacientes invasión del miocardio por abscesos y/o bloqueo en la conducción (41,2%), 7/17 pacientes embolización a pesar de antibioterapia adecuada (41,2%) y 3/17 pacientes por sepsis persistente (17,6%). Las características de estos pacientes con indicación de cirugía cardíaca según fueron o no intervenidos quirúrgicamente, y según mortalidad se muestra en la tabla 2.
Tabla 2.
Características de los pacientes con indicación de cirugía cardiaca
| Total | Según cirugía realizada | Mortalidad | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Variable | n (%) | Cirugía cardíaca | No cirugía cardíaca | Exitus | Vivo | |||||
| N | 21 | 17 | 4 | p | 8 | 13 | p | |||
| Hombre | 16 (76,2) | 12 (70,6) | 4 (100) | 0,21 | 5 (62,5) | 11 (84,6) | 0,25 | |||
| Edad (años; media, DS) | 68,8±13,2 | 67,1±13,4 | 76,0±10,8 | 0,34 | 71,7±11,2 | 66,9±14,4 | 0,55 | |||
| Tipo de válvula | ||||||||||
| Natural | 6 (28,6) | 5 (29,4) | 1 (25,0) | 0,86 | 1 (12,5) | 5 (38,5) | 0,20 | |||
| Prótesis | 13 (61,9) | 10 (58,8) | 3 (75,0) | 0,55 | 7 (87,5) | 6 (46,2) | 0,06 | |||
| Localización de la endocarditis | ||||||||||
| Mitral | 9 (42,9) | 7 (41,2) | 2 (50,0) | 0,75 | 4 (50,0) | 5 (38,5) | 0,60 | |||
| Aórtica | 11 (52,4) | 9 (52,9) | 2 (50,0) | 0,92 | 5 (62,5) | 6 (46,2) | 0,47 | |||
| Antecedentes personales | ||||||||||
| Índice Charlson (mediana, RIQ) | 2 (1-3) | 2 (1-3) | 1,5 (0,5-3,5) | 0,89 | 3 (2-4,5) | 1 (0-3) | 0,39 | |||
| Charlson ≥3 puntos | 9 (42,9) | 8 (47,1) | 1 (25,0) | 0,42 | 5 (62,5) | 4 (30,8) | 0,15 | |||
| Criterios Duke definida | 19 (90,5) | 16 (94,1) | 3 (75,0) | 0,24 | 7 (87,5) | 12 (92,3) | 0,72 | |||
| EPOC | 1 (4,8) | 1 (5,9) | 0 | 0,62 | 1 (12,5) | 0 | 0,19 | |||
| Enfermedad coronaria | 4 (19,1) | 3 (17,7) | 1 (25,0) | 0,74 | 2 (25,0) | 2 (15,4) | 0,59 | |||
| Fibrilación/flutter auricular | 9 (42,9) | 7 (41,2) | 2 (50,0) | 0,75 | 5 (62,5) | 4 (30,8) | 0,15 | |||
| Insuficiencia cardiaca | 3 (14,3) | 2 (11,8) | 1 (25,0) | 0,50 | 1 (12,5) | 2 (15,4) | 0,85 | |||
| Diabetes | 7 (33,3) | 7 (41,2) | 0 | 0,12 | 3 (37,5) | 4 (30,8) | 0,75 | |||
| Accidente cerebrovascular | 1 (4,8) | 1 (5,9) | 0 | 0,62 | 1 (12,5) | 0 | 0,19 | |||
| Neoplasiaa | 6 (28,6) | 5 (29,4) | 1 (25,0) | 0,86 | 3 (37,5) | 3 (23,1) | 0,48 | |||
| Insuficiencia renal | 9 (42,9) | 8 (47,1) | 1 (25,0) | 0,42 | 6 (75,0) | 3 (23,1) | 0,02 | |||
| Endocarditis previa | 3 (14,3) | 2 (11,8) | 1 (25,0) | 0,50 | 1 (12,5) | 2 (15,4) | 0,85 | |||
| Cirugía cardiaca previa | 7 (33,3) | 5 (29,4) | 2 (50,0) | 0,43 | 4 (40,0) | 3 (23,2) | 0,20 | |||
| Valvulopatía natural | 9 (42,9) | 8 (47,1) | 1 (25,0) | 0,42 | 6 (75,0) | 3 (23,1) | 0,02 | |||
| Microorganismo | ||||||||||
| Staphylococcus aureus | 2 (9,5) | 2 (11,8) | 0 | 0,47 | 1 (12,5) | 1 (7,7) | 0,72 | |||
| SARM | 0 | 0 | 0 | 0 | 0 | |||||
| Streptococcusspp. | 3 (14,3) | 2 (11,8) | 1 (25,0) | 0,50 | 0 | 3 (23,1) | 0,14 | |||
| SCN | 7 (33,3) | 7 (41,2) | 0 | 0,12 | 2 (25,0) | 5 (38,5) | 0,53 | |||
| Enterococcusspp. | 5 (23,8) | 3 (17,7) | 2 (50,0) | 0,17 | 3 (37,5) | 2 (15,4) | 0,25 | |||
| Levaduras | 2 (9,5) | 2 (11,8) | 0 | 0,47 | 1 (12,5) | 1 (12,5) | 0,72 | |||
| Clínica | ||||||||||
| Fiebre | 15 (71,4) | 14 (82,4) | 1 (25,0) | 0,02 | 6 (75,0) | 9 (69,2) | 0,78 | |||
| Fenómenos vascularesb | 10 (47,6) | 9 (52,9) | 1 (25,0) | 0,31 | 2 (25,0) | 8 (61,5) | 0,10 | |||
| Fenómenos inmunológicosc | 5 (23,8) | 5 (29,4) | 0 | 0,21 | 2 (25,0) | 3 (23,2) | 0,92 | |||
| Nuevo soplo o empeoramiento | 7 (33,3) | 6 (35,3) | 1 (25,0) | 0,69 | 3 (37,5) | 4 (30,8) | 0,75 | |||
| Mortalidad | 8 (38,1) | 7 (41,2) | 1 (25,0) | 0,55 | ||||||
| Tiempo supervivenciad(días; mediana, DS) | 28 (19,5-53,5) | 35 (19-66) | 20 (20-20) | 0,33 | ||||||
SARM: S. aureus resistente meticilina; SCN: Estafilococo coagulasa negativos; EPOC: enfermedad pulmonar obstructiva crónica; DS: desviación estándar; RIQ: rango interquartil. aNeoplasia de órgano sólido y neoplasia hematológica; bFenómenos vasculares: embolismo, aneurisma micótico, hemorragia intracraneal, hemorragia conjuntival, lesiones Janeway, hemorragias en astilla, petequias. cFenómenos inmunológicos: glomerulonefritis, nódulos Osler, manchas Roth, factor reumatoide elevado; dPacientes fallecidos.
Se consideró que no cumplían criterios quirúrgicos y no fueron intervenidos 43 pacientes (67,2%). Entre ellos, los motivos fueron en 14 pacientes la situación basal deteriorada (32,6%), en 10 pacientes la posibilidad de curación sólo con antibiótico y el mal pronóstico quirúrgico (23,3%), en 5 pacientes la complejidad de la técnica quirúrgica (11,6%), en 2 pacientes la inestabilidad hemodinámica (4,7 %), en 2 pacientes el exitus temprano antes de solicitar la valoración de cirugía cardiaca (4,6%), y en 17 pacientes otros motivos no especificados (39,5%); algunos pacientes tenían varios motivos para no ser intervenidos. El tiempo hasta la cirugía fue de 17 días de mediana (RIQ 9-62) desde la fecha de ingreso.
Diecisiete pacientes fallecieron durante el ingreso (26,6%) y cuatro tras el alta hospitalaria (6,3%). Las características de los pacientes fallecidos se muestran en la tabla 3 (global y por subgrupos según la realización de cirugía cardiaca). Las complicaciones postquirúrgicas ocurrieron en 11 pacientes (64,7% respecto a los 17 pacientes intervenidos), siendo el fracaso hemodinámico, la aparición o empeoramiento de un ictus o las infecciones postquirúrgicas las más frecuentes.
Tabla 3.
Características de los pacientes fallecidos.
| Variable | Total n (%) |
Cirugía cardíaca | No cirugía cardíaca | Análisis univariante |
|---|---|---|---|---|
| N | 21 | 7 | 14 | P |
| Hombre | 14 (66,7) | 4 (57,1) | 10 (71,4) | 0,51 |
| Edad (años; media, DS) | 76,0±10,3 | 70,0±10,8 | 79,1±8,9 | 0,07 |
| Tipo de válvula | ||||
| Natural | 10 (47,6) | 1 (14,3) | 9 (64,3) | 0,03 |
| Prótesis | 11 (52,4) | 6 (85,7) | 5 (35,7) | 0,03 |
| Localización de la endocarditis | ||||
| Mitral | 9 (42,9) | 4 (57,1) | 5 (35,7) | 0,35 |
| Aórtica | 8 (38,1) | 4 (57,1) | 4 (28,6) | 0,20 |
| Antecedentes personales | ||||
| Índice Charlson (mediana, RIQ) | 3 (2-4) | 3 (2-4) | 3 (1-5) | 0,66 |
| Criterios Duke definida | 17 (81,0) | 6 (85,7) | 11 (78,6) | 0,69 |
| EPOC | 5 (23,8) | 1 (4,3) | 3 (21,4) | 0,69 |
| Enfermedad coronaria | 4 (19,1) | 1 (4,3) | 3 (21,4) | 0,69 |
| Fibrilación/flutter auricular | 10 (47,6) | 5 (71,4) | 5 (35,7) | 0,12 |
| Insuficiencia cardiaca | 5 (23,8) | 1 (14,3) | 4 (28,6) | 0,47 |
| Diabetes | 7 (33,3) | 3 (42,9) | 4 (28,6) | 0,51 |
| Accidente cerebrovascular | 11 (52,4) | 1 (14,3) | 0 (0) | 0,15 |
| Neoplasiaa | 6 (28,6) | 3 (42,9) | 3 (21,4) | 0,31 |
| Insuficiencia renal | 12 (57,1) | 5 (71,4) | 7 (50,0) | 0,35 |
| Endocarditis previa | 1 (4,8) | 1 (14,3) | 0 (0) | 0,15 |
| Cirugía cardiaca previa | 6 (28,6) | 3 (42,9) | 3 (21,4) | 0,31 |
| Valvulopatía natural | 13 (61,9) | 5 (71,4) | 8 (57,1) | 0,53 |
| Microorganismo | ||||
| Staphylococcus aureus | 4 (19,1) | 1 (14,3) | 3 (21,4) | 0,69 |
| SARM | 1 (4,8) | 0 (0) | 1 (7,1) | 0,47 |
| Streptococcusspp. | 3 (14,3) | 0 (0) | 3 (21,4) | 0,19 |
| Estafilococo coagulasa negativos | 8 (38,1) | 2 (28,6) | 6 (42,9) | 0,53 |
| Enterococcusspp. | 3 (14,3) | 2 (28,6) | 1 (7,1) | 0,19 |
| Levaduras | 1 (4,8) | 1 (14,3) | 0 (0) | 0,15 |
| Clínica | ||||
| Fiebre | 18 (85,7) | 6 (85,7) | 12 (85,7) | 1 |
| Fenómenos vascularesb | 9 (42,9) | 2 (28,6) | 7 (50,0) | 0,35 |
| Fenómenos inmunológicosc | 4 (19,1) | 2 (28,6) | 2 (14,3) | 0,43 |
| Nuevo soplo o empeoramiento | 5 (23,8) | 2 (40,0) | 3 (60,0) | 0,72 |
SARM: S. aureus resistente meticilina; EPOC: enfermedad pulmonar obstructiva crónica; ACV; accidente cerebrovascular. DS: desviación estándar; RIQ: rango interquartil; aNeoplasia de órgano sólido y neoplasia hematológica; bFenómenos vasculares: embolismo, aneurisma micótico, hemorragia intracraneal, hemorragia conjuntival, lesiones Janeway, hemorragias en astilla, petequias. cFenómenos inmunológicos: glomerulonefritis, nódulos Osler, manchas Roth, factor reumatoide elevado.
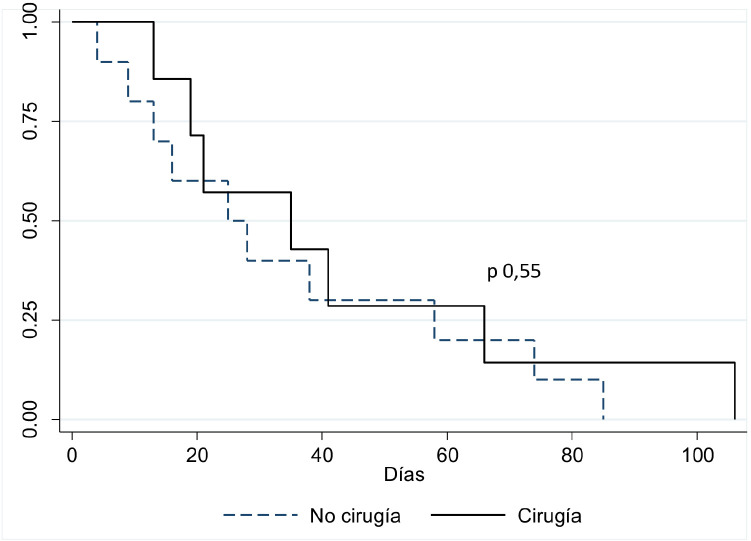
En el análisis univariable, las variables relacionadas con la mortalidad global de la cohorte fueron el antecedente de enfermedad pulmonar obstructiva crónica (EPOC) (OR 13,1; IC95% [1,4-121,2], p=0,02) y la presencia de complicaciones (OR 4,3; IC95% [1,1-16,9], p=0,03) concretamente secundarias a insuficiencia valvular (OR 4,9; IC95% [1,2-19,2], p=0,04) y embolismo en el sistema nervioso central (SNC) (OR 3,8; IC95% [1,0-14,0], p=0,05). Manteniéndose significativas en el análisis multivariable el desarrollo de complicaciones (OR 4,2; 95% [1,0-17,5], p=0,05) y la EPOC (OR 12,5; 95% [1,3-124,4], p=0,03). El análisis de supervivencia se muestra en la figura 1. El tiempo hasta la cirugía no fue un factor relacionado con la mortalidad (OR 0,01, IC95% [1-1,02], p=0,51). Tampoco hubo diferencias en la mortalidad en los pacientes que tenían indicación de cirugía cardiaca y fueron intervenidos frente aquellos que no se operaron teniendo indicación quirúrgica (7/17 [41,2%] versus 1/4 [25,0%]; p =0,55). De forma global, la mortalidad en los pacientes con indicación de cirugía cardiaca frente a los que no tenían indicación no mostró diferencias estadísticamente significativas (8/21 [38,1%] versus 13/43 [30,2%]; p=0,53). Este valor es superior al estimado según la escala Risk-E, para evaluar el riesgo de la mortalidad postquirúrgica, concretamente 22,3±10,3 puntos, lo que predice un probabilidad de fallecer en torno el 25% tras el procedimiento. Por otro lado, el bajo número de eventos (exitus) limitó el análisis de los factores asociados a la mortalidad.
Figura 1.
Curva supervivencia en el análisis de Kaplan Meier.
DISCUSIÓN
Nuestro trabajo muestra una cohorte de pacientes con EI con una baja tasa de intervención quirúrgica. Esta tasa se encuentra muy por debajo de lo que se describe en una encuesta europea realizada en 2005, donde el 50% de los pacientes eran intervenidos [11]. Sin embargo, se asemeja a las cifras publicadas por algunos centros españoles sin cirugía cardiaca [12]. Es por ello que se han desarrollado varias escalas que pretenden establecer el riesgo quirúrgico en los pacientes con EI [10,13].
La mortalidad en nuestra serie es elevada, aunque muestra resultados similares a los datos publicados por otros hospitales, con tasas en torno 30-35% [3,11,12]. La demora en la cirugía cardiaca podría suponer un aumento en la mortalidad debido a la ausencia del control del foco y un incremento en la probabilidad de complicaciones propias de la EI o relacionadas con el ingreso hospitalario. En nuestra serie, la realización de cirugía cardiaca y el tiempo hasta la cirugía no se relacionaron con la mortalidad. En cambió el antecedente de EPOC y la presencia de complicaciones, concretamente la presencia de insuficiencia valvular y/o embolismo en el SNC, fueron factores de riesgo independiente de la mortalidad. Estos datos reflejan cómo el pronóstico de los pacientes está influido por la propia EI, y quizás en menos grado por la disponibilidad de cirugía en el centro.
Un metaanálisis en 2011 mostró una disminución de la mortalidad de la cirugía frente al tratamiento antibiótico (OR 0,47, IC 95% [0,38-0,58]), aunque los estudios incluidos era muy heterogéneos entre sí [14]. Otro metaanálisis más reciente, demostraba que la cirugía temprana tenía menos mortalidad que la tardía, sin observarse diferencias en aquellos pacientes intervenidos en los primeros 7 días (OR 0,61; 95% IC[0,16–0,54] p=0,001) [15].
Recientemente se han comercializado nuevas alternativas terapéuticas que podrían ser útiles en aquellos pacientes con EI sin opción quirúrgica, como la administración ambulatoria de antibióticos [16], la administración con reservorio o en infusor [17,18] o nuevos fármacos de duración prolongada, como la dalbavancina o la rezafungina [19,20]. Además , la implicación de un equipo multidisciplinar e interhospitalario resulta imprescindible para un adecuado manejo de la endocarditis infecciosa en hospitales sin cirugía cardíaca.
Las limitaciones del estudio son fundamentalmente aquellas referidas al pequeño tamaño muestral y al carácter unicéntrico del estudio. Finalmente, la modificación de la técnica quirúrgica y pautas de antibiótico podrían también haber influido en los resultados.
En conclusión, la comorbilidad del paciente es un factor pronóstico fundamental en la EI. La intervención quirúrgica no se relacionó con mayor mortalidad en aquellos pacientes que tenían indicación de cirugía cardiaca. El desarrollo de nuevos antibióticos de administración prolongada podría utilizarse como alternativa terapéutica en aquellos pacientes no subsidiarios a cirugía cardiaca.
AGRADECIMIENTOS
Este estudio ha sido realizado junto con la colaboración de los miembros del Comité de Endocarditis del HUFA, P. Robles, O. Martín, C. Fuente y G. Navarro, además de L. Moreno, R. Hervas, E. España y JF. Valverde.
FINANCIACIÓN
Los autores declaran que no han recibido financiación para la realización de este estudio.
CONFLICTO DE INTERESES
Los autores declaran no tener conflictos de intereses.
References
- 1.Park LP, Chu VH, Peterson G, Skoutelis A, Lejko-Zupa T, Bouza E, et al. Validated risk score for predicting 6-month mortality in infective endocarditis. J Am Heart Assoc. 2016;5(4):1–13. DOI: 10.1161/JAHA.115.003016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Cresti A, Chiavarelli M, Scalese M, Nencioni C, Valentini S, Guerrini F, et al. Epidemiological and mortality trends in infective endocarditis, a 17-year population-based prospective study. Cardiovasc Diagn Ther. 2017;7(1):27–35. DOI: 10.21037/cdt.2016.08.09 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Varela Barca L, López-Menéndez J, Navas-Elorza E, Moya Sur JL, Centella Hernéndez T, Redondo Palacios A, et al. Long-term prognosis after surgery for infective endocarditis: Distinction between predictors of early and late survival. Enferm Infecc Microbiol Clin. 2019;37(7):435–40. DOI: 10.1016/j.emc.2018.10.017 [DOI] [PubMed] [Google Scholar]
- 4.Baddour LM, Wilson WR, Bayer AS, Fowler VG, Tleyjeh IM, Rybak MJ, et al. Infective endocarditis in adults: Diagnosis, antimicrobial therapy, and management of complications: A scientific statement for healthcare professionals from the American Heart Association. Circulation. 2015;132:1435-86. DOI: 10.1161/CIR.0000000000000296 [DOI] [PubMed] [Google Scholar]
- 5.Kang D-H, Kim Y-J, Kim S-H, Sun BJ, Kim D-H, Yun S-C, et al. Early Surgery versus Conventional Treatment for Infective Endocarditis. N Engl J Med. 2012;366:2466–73. DOI: 10.1056/nejmoa1112843 [DOI] [PubMed] [Google Scholar]
- 6.Ministerio de sanidad. Memoria del Hospital Universitario Fundación Alcorcón. 2017;
- 7.Bayer AS, Ward JI, Ginzton LE, Shapiro SM. Evaluation of New Clinical Criteria for the ‘Diagnosis of Infective Endocarditis. Am J Med. 1994;96:211–19. DOI: 10.1056/nejmoa1112843 [DOI] [PubMed] [Google Scholar]
- 8.Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. Guía ESC 2015 sobre el tratameinto de la endocarditis infecciosa. Rev Esp Cardiol. 2016;69(1):69.e1-e49. DOI: 10.1093/eurheartj/ehv319 [DOI] [Google Scholar]
- 9.Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373–83. DOI: 10.1016/0021-9681(87)90171-8 [DOI] [PubMed] [Google Scholar]
- 10.Olmos C, Vilacosta I, Habib G, Maroto L, Fernández C, López J, et al. Risk score for cardiac surgery in active left-sided infective endocarditis. Heart. 2017;103:1435–42. DOI: 10.1136/hear-tjnl-2016-311093 [DOI] [PubMed] [Google Scholar]
- 11.Tornos P. Infective endocarditis in Europe: lessons from the Euro heart survey. Heart. 2005;91(5):571–5. DOI: 10.1136/hrt.2003.032128 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Rodríguez-Esteban M, Anguita M, Miranda-Montero S, Castillo JC, Álvarez-Acosta L, Castillo F, et al. Endocarditis infecciosa en 2 hospitales universitarios españoles que difieren en su localización y en la presencia de servicio quirúrgico. Enferm Infecc Microbiol Clin. 2014;32(5):297–301. DOI: 10.1016/j.eimc.2013.04.019 [DOI] [PubMed] [Google Scholar]
- 13.Rasmussen R V., Bruun LE, Lund J, Larsen CT, Hassager C, Bruun NE. The impact of cardiac surgery in native valve infective endocarditis: Can euroSCORE guide patient selection? Int J Cardiol. 2011;149(3):304–9. DOI: 10.1016/j.ijcard.2010.02.007 [DOI] [PubMed] [Google Scholar]
- 14.Head SJ, Mostafa Mokhles M, Osnabrugge RLJ, Bogers AJJC, Pieter Kappetein A. Surgery in current therapy for infective endocarditis. Vasc Health Risk Manag. 2011;7(1):255–63. DOI: 10.2147/VHRM.S19377 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Narayanan MA, Haddad TM, Kalil AC, Kanmanthareddy A, Suri RM, Mansour G, et al. Early versus late surgical intervention or medical management for infective endocarditis: A systematic review and meta-analysis. Heart. 2016;102:950–7. DOI: 10.1136/hear-tjnl-2015-308589 [DOI] [PubMed] [Google Scholar]
- 16.Norris AH, Shrestha NK, Allison GM, Keller SC, Bhavan KP, Zurlo JJ, et al. 2018 IDSA Clinical Practice Guideline for the Management of Outpatient Parenteral Antimicrobial Therapy. Clin Infect Dis. 2019;68:1–4. DOI: 10.1093/cid/ciy745 [DOI] [PubMed] [Google Scholar]
- 17.Nakamura T, Enoki Y, Uno S, Uwamino Y, Iketani O, Hasegawa N, et al. Stability of benzylpenicillin potassium and ampicillin in an elastomeric infusion pump. J Infect Chemother. 2018;24(10):856–9. DOI: 10.1016/j.jiac.2018.04.003 [DOI] [PubMed] [Google Scholar]
- 18.Hase R, Hosokawa N, Uno S, Mikawa T, Uwamino, Yoshifumi Muranaka K. The first trial of OPAT (outpatient parenteral antimicrobial therapy) with continuous infusions in Japan. J Japanese Assoc Infect Dis. 2014;88(3):269–74. DOI: 10.11150/kansenshogakuzasshi.88.269 [DOI] [PubMed] [Google Scholar]
- 19.Bouza E, Valerio M, Soriano A, Morata L, Carus EG, RodríguezGonzález C, et al. Dalbavancin in the treatment of different gram-positive infections: a real-life experience. Int J Antimicrob Agents. 2018;51(4):571–7. DOI: 10.1016/j.ijantimicag.2017.11.008 [DOI] [PubMed] [Google Scholar]
- 20.Sofjan AK, Mitchell A, Shah DN, Nguyen T, Sim M, Trojcak A, et al. Rezafungin (CD101), a next generation echinocandin: A systematic literature review and assessment of possible place in therapy. J Glob Antimicrob Resist. 2018;14:58–64. DOI: 10.1016/j.jgar.2018.02.013 [DOI] [PubMed] [Google Scholar]