Abstract
Hintergrund
Klinikmitarbeiter (healthcare workers, HCW) stellen eine Risikopopulation für eine SARS-CoV-2-Infektion dar. Um die Kapazität von Gesundheitseinrichtungen und den Schutz von medizinischem Personal optimieren zu können, ist es wichtig, das Infektionsrisiko und den potenziellen Immunitätsstatus der Behandler von COVID-19-Patienten einzuschätzen.
Methode
Wir untersuchten die Seroprävalenz von IgM-/IgG-Antikörpern (AK) gegen SARS-CoV‑2 bei Klinikmitarbeitern der Region mit der höchsten SARS-CoV-2-Durchseuchung (1570/100.000) deutschlandweit, 4 Monate nach Ausbruch der Pandemie. Als Kontrollgruppe wurden Mitarbeiter eines nichtmedizinischen Unternehmens (MU) derselben Region untersucht und demographische Daten, medizinische Anamnese und Arbeitssituation der Teilnehmer erhoben.
Ergebnisse
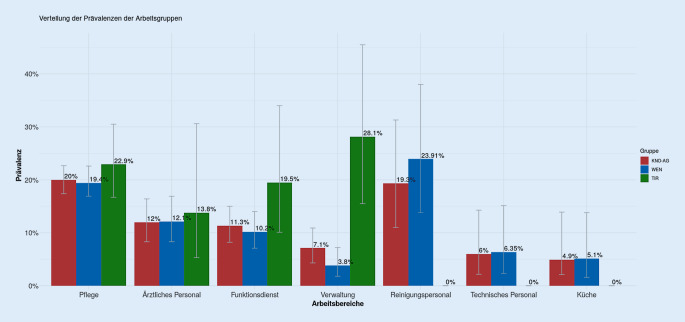
Es wurden 1838 HCW und 986 MU eingeschlossen. Die Prävalenz von SARS-CoV-2-AK bei HCW war 15,1 % und im Vergleichskollektiv des Unternehmens 3,7 %. Bei den HCW waren die Pflegekräfte zu 20,0 %, das Intensivpersonal zu 20,3 %, Reinigungskräfte zu 19,3 %, das ärztliche Personal zu 12,0 %, die Funktionsdienste zu 11,3 %, die Verwaltung zu 7,1 % und der technische Dienst zu 6 % seropositiv. Bei 10,1 % der positiven HCW waren keine COVID-19 typischen Symptome aufgetreten.
Schlussfolgerung
Die Seroprävalenz von AK gegen SARS-CoV‑2 ist bei Klinikmitarbeitern einer schwer von COVID-19 betroffenen Region signifikant höher als bei einer nichtmedizinischen Kontrollgruppe. Das Infektionsrisiko der HCW ist umso höher je mehr patientennahen Tätigkeiten sie ausüben. Das Infektionsrisiko des Intensivpersonals ist im Vergleich zu anderen Tätigkeiten in einer Klinik erhöht. Das Risiko des Reinigungspersonals wird in Kliniken vermutlich unterschätzt.
Schlüsselwörter: Krankenhausmitarbeiter, COVID-19, Seroprävalenz, Risikofaktoren, Antikörper
Abstract
Background
Healthcare workers are a high-risk population for SARS-CoV‑2 infection. For capacity planning of healthcare providers and to optimize protection of healthcare workers (HCW) in SARS-CoV‑2 pandemics, it is essential to know the risk of infection and potential immunity status of staff dealing with COVID-19 patients.
Materials and methods
We examined seropravalence of SARS-CoV‑2 IgM/IgG antibodies (AB) in HCW of a region with the highest rate of infection (1570/100,000) during COVID-19 pandemic in Germany, 4 months after its start. Employees of a nonmedical company (MU) served as control group. Demographic data, medical history and working situation were recorded.
Results
A total of 1838 HCW and 986 MU volunteered to participate. Seroprevalence for SARS-CoV‑2 in HCW was 15.1% and 3.7% in MU. Among HCWs, nurses had a seropositivity of 20.0%, ICU personnel 20.3%, housekeepers 19.3%, physicians 12.0%, medical services (e.g., radiology, physiotherapy) 11.3%, administration 7.1% and technical services 6%. Symptoms typical for COVID-19 were not experienced by 10% of seropositive HCWs.
Conclusion
Seroprevalence of SARS-CoV‑2 antibodies in HCW of a region heavily affected by COVID-19 is with 15.1% significantly higher than in a control group of nonmedical staff with 3.7%. Infection rate in HCW was higher in staff with close contact to infected patients. Seropositivity in ICU personnel is higher than in other clinical professions. The occupational risk for housekeepers seems to be underestimated.
Keywords: Healthcare workers, COVID-19, Seroprevalence, Risk factors, Antibodies
Hintergrund und Fragestellung
Seit Ende 2019 hat die durch das SARS-Coronavirus 2 (SARS-CoV-2) verursachte „coronavirus disease 2019“ (COVID-19) weltweit mit Millionen von Infizierten und tausenden Toten zu einer Überlastung der Gesundheitssysteme vieler Staaten geführt. Obwohl bei etwa 80 % der Infizierten keine oder nur geringe Symptome auftreten, bedingen Risikofaktoren wie Alter, Adipositas und chronische Erkrankungen eine erhöhte Morbidität und Mortalität durch COVID-19 [12, 17] Die Behandlung von COVID-19-Erkrankten ist ein anerkannter Risikofaktor für eine eigene Infektion mit SARS-CoV‑2 [25, 27].
Eine zentrale Frage bei der Bewältigung der Pandemie ist, in welchem Ausmaß Mitarbeiter im Gesundheitswesen („healthcare workers“ [HCW]) durch berufsassoziierte COVID-19-Infektionen gefährdet sind. Dazu ist es wichtig, die Zahl der Infektionen in dieser Berufsgruppe mit der nichtmedizinischen, arbeitstätigen Bevölkerung derselben Region im Sinne einer Risikoevaluation zu vergleichen. Die Seroprävalenz von Antikörpern gegen SARS-CoV‑2 erlaubt Rückschlüsse auf eine überstandene COVID-19-Infektion und eine mögliche Immunität bzw. das Risiko einer Neuerkrankung [7]. Für die Verantwortlichen auf allen Ebenen der medizinischen Versorgung sind Erkenntnisse hierüber entscheidend zur Vorbereitung auf zukünftige Infektionswellen sowie zur Reduktion physischer und psychischer Belastungen des Personals [5] in der Zukunft.
Die vorliegende Arbeit untersucht, ob die Prävalenz von SARS-CoV-2-Antikörpern bei Mitarbeitern zweier Krankenhäuser der von COVID-19 deutschlandweit am stärksten betroffenen Region der nördlichen Oberpfalz/Bayern höher ist als in der regionalen werktätigen Bevölkerung. Hierzu wurden 4 Monate nach dem Höhepunkt der Pandemie im März 2020 bei Klinikpersonal (HCW) und Mitarbeitern eines großen, nichtmedizinischen Unternehmens (NMU) als Kontrollgruppe IgM- und IgG-Antikörper gegen SARS-CoV‑2 bestimmt und die Teilnehmer zu klinisch-epidemiologischen Daten evaluiert.
Studiendesign und Untersuchungsmethoden
Studienpopulation
Die Kliniken Nordoberpfalz AG (KNO-AG) ist der größte Gesundheitsversorger für etwa 282.000 Einwohner im ländlichen Nordostbayern [21]. Im Versorgungsgebiet liegt mit Tirschenreuth der deutschlandweit am schwersten betroffene Landkreis (1570 COVID-19-Fälle/100.000 Einwohner), knapp dahinter folgen Wunsiedel (909) und Neustadt a. d. Waldnaab (860) und die Stadt Weiden (796; [19]), wodurch die KNO-AG von der COVID-19-Pandemie in Deutschland ab März 2020 besonders stark betroffen war.
Von März bis Ende Juni 2020 wurden am Klinikum Weiden (WEN) mit 629 Betten und am Krankenhaus Tirschenreuth (TIR) mit 145 Betten mehr als 1100 Patienten mit Verdacht auf COVID-19 stationär behandelt, 595 davon mit PCR-gesicherter SARS-CoV-2-Infektion.
Hygienemaßnahmen
Zu Beginn der Pandemie in Deutschland existierten keine klaren Leitlinien und Vorgaben zum Umgang mit SARS-CoV-2-Patienten. Ab Anfang März wurden alle Mitarbeiter der KNO-AG mit Patientenkontakt zum Tragen von persönlicher Schutzkleidung (PPE) angewiesen. Für HCW mit engem Patientenkontakt war ab dem 09.03.2020 das Tragen einer (mindestens) FFP2-Maske, Einmalkittel sowie von Einmalhandschuhen verpflichtend Zusätzlich sollten Schutzbrillen und „face shields“ auf Interventionen an COVID-Patienten für einen vermehrten Schutz sorgen. Teile der PPE waren von Ende März bis Anfang Juni 2020 aufgrund des hohen Patientenaufkommens teils nicht in ausreichender Menge vorhanden und mussten oft mehrfach benutz werden.
Studiendesign
Die monozentrische prospektive Beobachtungsstudie wurde vom Studienzentrum der KNO-AG nach Prüfung durch die Ethikkommission der bayerischen Landesärztekammer (BLÄK), vom 29.06. bis zum 29.07.2020 in WEN und TIR und bei einem großen mittelständischen Unternehmen der Region nach den Richtlinien der Good Clinical Practice (GCP) gemäß der Deklaration von Helsinki [2] durchgeführt. Die Studie ist im deutschen Register für klinische Studien (DRKS-Nummer 00021813) registriert. Die Teilnahme war freiwillig, die Datenerhebung erfolgte pseudonymisiert. Den Teilnehmern wurde standardisiert Blut entnommen [25], das tagesgleich analysiert wurde. Ein begleitender Fragebogen mit Angaben zur Demographie, beruflicher Tätigkeit, COVID-19-typischen Symptomen, vorangegangenen PCR-Tests und gesundheitlichen Risikofaktoren für COVID-19 wurde bei Blutabnahme erhoben. Die Erstellung der Fragebögen und die Datenextraktion erfolgte mit SDAPS Version 1.9.9 (SDAPS 1.9.9; Benjamin Berg, open source[GPLv3, LPPL], Haar, Deutschland) [3].
Testverfahren
Die Serumproben wurden mittels des Immunassays Elecsys® Anti-SARS-CoV‑2 (Roche Diagnostics, Deutschland) auf das Vorhandensein von SARS-CoV-2-Antikörper (IgM/IgG) untersucht und das qualitative Ergebnis entsprechend der Herstellervorgabe (Sensitivität 99,5 %, Spezifität 99,8 % für die Identifikation einer SARS-CoV-2-Infektion ≥14 Tage nach positiver PCR) ausgewertet [10].
Statistische Auswertung
Die statistische Auswertung der Fragebögen und der SARS-CoV-2-Antikörpertests erfolgte durch das Helmholtz-Zentrum für Infektionsforschung (HZI) in Braunschweig und die Ostfalia Hochschule in Wolfenbüttel. Die Konfidenzintervalle für Prävalenzen wurden nach der Methode von Wilson berechnet [1]. Odds Ratios (OR) und p-Werte wurden, sofern nicht 2 × 2-Kontingenztafeln vorlagen, bei denen die OR direkt und die p-Werte mit dem Fisher-Test bestimmt wurden, mittels logistischer Regression berechnet. Konfidenzintervalle (KI) sind immer zum Konfidenzniveau 95 % angegeben.
Ergebnisse
1838 von 2387 Krankenhausmitarbeitern (77,0 %, HCW) und 986 der 1850 Mitarbeiter des Vergleichskollektivs im Unternehmen (53,3 %, NMU) wurden in die Studie eingeschlossen. Geschlechter- und Altersverteilung sind Tab. 1 zu entnehmen. 313 Teilnehmer (11,1 %) waren im Test seropositiv auf SARS-CoV‑2, davon 277 HCW und 36 NMU in der Vergleichsgruppe. 11,5 % der Seropositiven im Gesamtkollektiv hatten seit Beginn 2020 keine COVID-19 typischen Symptome angegeben (10,1 % HCW; 22,2 % MU). Die jeweiligen Odds Ratios, 95 %-Konfidenzintervalle und p-Werte sind in den Tab. 1 und 2 den Ergebnissen zugeordnet.
| Klinikpersonal n (%) |
Unternehmen n (%) |
Gesamt n (%) |
||
|---|---|---|---|---|
| Gesamtzahl, n | 2387 | 1850 | – | |
| Studienteilnehmer, n | 1879 (78,7) | 988 (52,9) | – | |
| Valide erfasst | 1838 (77,0) | 986 (53,3) | 2824 | |
| Geschlecht | Männlich | 371 (20,2) | 728 (73,8) | 1099 (38,9) |
| Weiblich | 1442 (78,5) | 225 (22,8) | 1667 (59,0) | |
| k. A. | 25 (1,4) | 33 (3,5) | 58 (2,1) | |
| Altersgruppe | 18–29 | 322 (17,5) | 329 (33,4) | 651 (23,1) |
| 30–39 | 321 (17,5) | 227 (23,0) | 548 (19,4) | |
| 40–49 | 396 (21,5) | 151 (15,3) | 547 (19,4) | |
| 50–59 | 536 (29,2) | 163 (16,5) | 699 (24,8) | |
| 60–69 | 176 (9,6) | 34 (3,4) | 210 (7,4) | |
| >69 | 2 (0,1) | 1 (0,1) | 3 (0,1) | |
| k. A. | 85 (4,6) | 81 (8,2) | 166 (5,9) | |
| AK positiv | 277 (15,1) | 36 (3,7) | 313 (11,1) | |
| AK negativ | 1561 (84,9) | 950 (96,3) | 2511 (88,9) | |
| PCR positiv (Anamnese) | 149 (8,1) | 8 (0,8) | – | |
| PCR negativ oder keine PCR | 1687 (91,8) | 978 (99,2) | – | |
| Univariable A | Mutlivariable Analyse | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Gesamt n (%) |
AK negativ n (%) |
AK positiv n (%) |
p-Wert | OR | 95 % CI | p-Wert | OR | (95 % KI) | ||
| Geschlecht | Männlich | 371 | 324 | 47 | 0,144 | 1,29 | 0,92 | 0,360 | 1,29 | 0,75 |
| Weiblich | 1442 | 1214 | 228 | – | – | 1,86 | – | – | 2,22 | |
| k. A. | 25 | 23 | 2 | – | – | – | – | – | – | |
| Gesamt | 1838 | 1561 | 277 | – | – | – | – | – | – | |
| Berufsgruppe | Ärztliches Personal |
251 (13,7) |
221 (88,0) |
30 (12,0) |
0,187 | 0,76 |
0,49 1,14 |
0,233 | 0,54 |
0,19 1,49 |
| Funktionsdienste |
336 (18,3) |
298 (88,7) |
38 (11,3) |
0,043 | 0,69 |
0,47 1,00 |
0,364 | 0,69 |
0,31 1,54 |
|
| Pflegepersonal |
887 (48,3) |
710 (80,0) |
177 (20,0) |
<0,001 | 2,20 |
1,67 2,91 |
0,850 | 1,08 |
0,48 2,46 |
|
| Reinigungspersonal |
57 (3,1) |
46 (80,7) |
11 (19,3) |
0,349 | 1,36 |
0,63 2,71 |
0,179 | 2,17 |
0,70 6,73 |
|
| Technikpersonal |
67 (3,6) |
63 (94,0) |
4 (6,0) |
0,035 | 0,35 |
0,09 0,95 |
0,804 | 1,18 |
0,32 4,34 |
|
| Verwaltung |
240 (13,1) |
223 (92,9) |
17 (7,1) |
<0,001 | 0,39 |
0,22 0,65 |
0,122 | 0,45 |
0,16 1,24 |
|
| Gesamt | 1838 | 1561 | 277 | – | – | – | – | – | – | |
| Non-COVID-Station |
397 (21,6) |
340 (85,6) |
57 (14,4) |
0,692 | 0,93 |
0,67 1,28 |
0,452 | 0,83 |
0,51 1,35 |
|
| COVID-Station |
324 (17,6) |
239 (73,8) |
85 (26,2) |
<0,001 | 2,44 |
1,80 3,29 |
<0,001 | 2,31 |
1,53 3,48 |
|
| Intensivstation |
291 (15,8) |
232 (79,7) |
59 (20,3) |
0,009 | 1,55 |
1,10 2,15 |
0,049 | 1,58 |
1,00 2,48 |
|
| Positiver PCR-Test | Ja | 149 | 6 |
143 (51,6) |
<0,001 | 274 |
120 766 |
<0,001 | 226 |
95 533 |
| Nein | 1687 | 1553 | 134 | – | – | – | – | – | – | |
| COVID-19-Symptome | Ja | 1215 | 966 |
249 (89,9) |
<0,001 | 5,61 |
3,73 8,72 |
<0,001 | 2,45 |
1,56 3,86 |
| Nein | 631 | 603 |
28 (10,1) |
– | – | – | – | – | – | |
Die Antikörperprävalenz beim gesamten Klinikpersonal betrug 15,1 % und war in TIR mit 20,7 % signifikant höher als im Haupthaus des Klinikverbunds in WEN, was u. a. durch einen deutlich höheren Anteil an „patientenfern Beschäftigten“ in Technik und Verwaltung in WEN erklärbar ist. Die höchste Prävalenz in der Gesamtheit der HCW (Abb. 1; Tab. 2) zeigten die Pflegekräfte mit 20,0 %, gefolgt vom Reinigungspersonal mit 19,3 % und ärztlichen Personal mit 12,0 %. Bei den Funktionsdiensten – wie z. B. Radiologie und Physiotherapie – waren 11,3 % seropositiv, in der Verwaltung 7 % und beim technischen Personal (Haustechnik, EDV usw.) 6 % seropositiv.
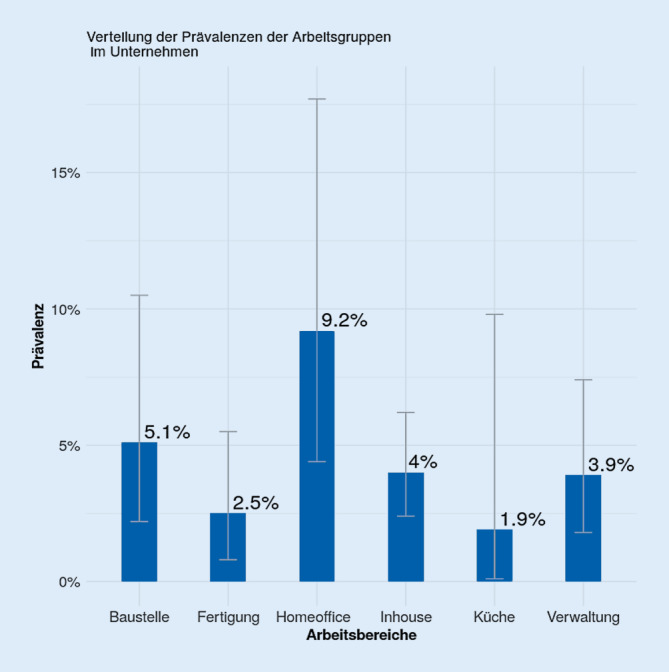
In der Vergleichsgruppe der NMU derselben Region (Abb. 2) waren 3,7 % antikörperpositiv. Betroffen waren 9,2 % der NMU im Homeoffice, 5,1 % der überwiegend auf Baustellen tätigen Kollegen, 4,0 % der technischen Mitarbeiter (inhouse) und 3,9 % der Verwaltung. Am geringsten durchseucht waren Mitarbeiter in der Fertigung (2,5 %) und der Gastronomie/Küche (1,9 %).
Ein signifikanter demographischer Unterschied zwischen HCW und NMU bestand nicht. Wie zu erwarten lag der Anteil der Frauen bei den HCW mit 78,5 % höher. Die Seroprävalenz von Antikörpern gegen SARS-CoV‑2 war beim Klinikpersonal hochsignifikant (p > 0,0001) höher als bei den Mitarbeitern des nichtmedizinischen Unternehmens.
In beiden Krankenhäusern zeigten die Pflegekräfte signifikant häufiger SARS-CoV-2-Antikörper als ärztliches Personal (p = 0,016) bzw. Verwaltungspersonal, Funktionsdienste, technisches Personal und Küchenpersonal (p = 0,0001). Das ärztliche Personal zeigte keinen signifikanten Unterschied zu den Funktionsdiensten, war aber signifikant häufiger betroffen als die Verwaltung und technische Dienste (p = 0,05). Auffällig war, dass beim Reinigungspersonal in WEN 23,9 % seropositiv waren.
Auf den 4 mit COVID-19-Patienten belegten Intensivstationen (ICU) waren 20,3 % des Personals seropositiv (TIR: 10 %, WEN: 23,2 %). Es bestanden teils deutliche Unterschiede der Seropositivität auf den einzelnen Stationen zwischen 9,6–36,9 %. Sie differieren jedoch auch in der Anzahl der dort behandelten Patienten bzw. deren Behandlungsdauer.
Auf Normalstationen, die mit COVID-19-Patienten belegt waren, hatten 26,2 % der HCW Antikörper (TIR: 24,2 %, WEN: 27,1 %), wohingegen auf Non-COVID-Stationen nur 14,4 % (TIR: 7,7 %, WEN: 14,8 %) serologische Hinweise für eine abgelaufene Infektion zeigten.
47,9 % aller antikörperpositiven Teilnehmer hatten im Vorfeld einen positiven PCR-Test, der im Mittel 93,8 Tage vor dem Antikörpertest durchgeführt wurde. Von den vor Studienbeginn mittels PCR positiv Getesteten hatten nach im Mittel 89,4 Tagen 4,6 % (n = 7) keinen Antikörpernachweis im Serum. Bezüglich eines Aufenthalts in Risikogebieten seit Jahresbeginn 2020 ergaben sich hierbei keine signifikanten Korrelationen mit einem Antikörpernachweis.
Diskussion
Wir berichten über die Seroprävalenz von SARS-CoV-2-Antikörpern im Gesamtspektrum von Klinikmitarbeitern aus einer von der COVID-19-Pandemie schwer betroffenen Region in Deutschland und vergleichen diese mit einer Kontrollgruppe aus der nichtmedizinischen Arbeitsbevölkerung der gleichen Region (Abb. 1 und 2). In der Region um den Landkreis Tirschenreuth/Bayern betrug die Seroprävalenz von IgM-/IgG-Antikörpern bei Krankenhausmitarbeitern im Gesamtkollektiv 15,1 % und entspricht damit in etwa den publizierten Zahlen aus hochdurchseuchten Regionen in den USA, Italien oder Spanien [7, 16]. Die Seropositivität war bei Berufsgruppen im Krankenhaus, die nahen Kontakt mit COVID-19-Erkrankten hatten, mit bis zu 26,2 % (auf peripheren COVID-Stationen) deutlich höher als bei Mitarbeitern ohne bzw. mit nur geringem Patientenkontakt wie z. B. bei technischem Personal (6,0 %). Hohe Infektionsraten der HCW – vor allem mit patientennahen Tätigkeiten – führen bei einer erneuten Infektionswelle potenziell zu einem Verlust der regionalen Kontrolle in der medizinischen Bewältigung der Pandemie [4] und erfordern einen niederschwelligen Zugang des Personals zu Testmöglichkeiten.
In der Kontrollgruppe der Unternehmensmitarbeiter war die Seropositivität mit 3,7 % deutlich niedriger und dürfte dem durchschnittlichen Wert an durchlaufenen Infektionen in der arbeitstätigen Bevölkerung der Region entsprechen. Die Werte lagen bei den Berufsgruppen des Unternehmens (Abb. 2) im Bereich der publizierten Testergebnisse (1,3–9,2 %) der Bevölkerung in Deutschland zwischen Kalenderwoche 10 und 26 im Jahr 2020 [20].
Infektionsrisiken im Krankenhaus
Aufgrund der erhöhten Exposition müssen HCW als Hochrisikogruppe für eine Infektion mit SARS-CoV‑2 eingeschätzt werden [26]. Problematisch ist, dass ein Teil der Infektionen asymptomatisch verläuft. Auch bei den HCW in dieser Studie hatten 10,1 % aller Seropositiven keine COVID-19-typischen Symptome angegeben. Betroffene Krankenhäuser können somit sowohl für die Patienten als auch für das eigene Personal ein Ort der Übertragung bzw. Weiterverbreitung des Virus sein, selbst wenn alle Hygienevorschriften beachtet werden [26]. Beim rapiden Anstieg der Infektionsraten in Deutschland im März 2020 war die Knappheit an persönlicher Schutzkleidung und teils auch Desinfektionsmaterial ein immenser Risikofaktor für HCW und Patienten. Der Ausfall von Kollegen durch Erkrankung und die generelle Überforderung der Gesundheitseinrichtungen dürften zu erhöhten Infektionsraten bei HCW beigetragen haben. Körperliche Untersuchungen und Manipulationen, Kontakt mit Körperflüssigkeiten und Ausscheidungen, direkter Patientenkontakt bei Absaugungen und vor allem Reanimation sind anerkannte Risikofaktoren [14, 27]. Gleichzeitig sind sie vor allem auf Intensivstationen und speziellen COVID-Stationen Alltag und unvermeidbar [27]. Dies erklärt den signifikant höheren Anteil an seropositiven HCW mit Tätigkeiten unmittelbar am Patienten auch in dieser Studie (Tab. 2; Abb. 1).
Stationen
Die Behandler von COVID-19-Patienten auf Intensivstationen waren mit einem Anteil von 20,3 % häufiger seropositiv als das Personal auf Stationen, die keine infizierten Patienten behandelten (Non-COVID) mit 14,4 %. Jedoch zeigten sich deutliche Unterschied zwischen den 4 mit COVID-19-Patienten belegten ICU (9,6–36,9 %), was multifaktorielle Gründe hat wie z. B. Belegungszahl und -dauer, Verfügbarkeit von persönlicher Schutzkleidung, Belüftungssystemen, Therapiemanagement. Diese Aspekte werden aktuell durch Subgruppenanalysen untersucht und sollen in Folgepublikationen detailliert dargestellt werden. Zudem waren Mitarbeiter auf den „peripheren“ COVID-Stationen mit 26,2 % sogar häufiger betroffen als das Intensivpersonal. Gründe hierfür sind ebenfalls vielschichtig, unter anderem könnte das Personal auf ICU sensibilisierter im Umgang mit infektiösen Patienten sein. Auch dürfte, zumindest am Beginn der Pandemie, persönliche Schutzkleidung auf peripheren Stationen ohne Belegung mit COVID-Patienten in Hotspots nicht in ausreichendem Maß verfügbar gewesen sein [27].
Reinigungspersonal
Auffällig bei Auswertung der Daten war, dass mit 23,9 % das Reinigungspersonal WEN eine höhere Durchseuchung aufwies als die Gesamtheit der Pflegekräfte (19,6 % WEN). Beim Reinigungspersonal der ICU lag der Wert mit 44,4 % (4/9) nochmals deutlich höher, bei insgesamt aber sehr kleiner Fallzahl. In einer aktuellen Arbeit aus Birmingham [23] waren sogar 34,5 % aller getesteten Reinigungskräfte seropositiv. Wie auch in unserer Studie werden die Gründe hierfür als multifaktoriell angesehen. Die Knappheit an Schutzkleidung und der weniger vertraute Umgang damit sind mögliche Faktoren. Wichtig ist es, zukünftig der immens wichtigen Funktion des Reinigungspersonals innerhalb des Klinikbetriebs und insbesondere auf ICU und COVID-Stationen Rechnung zu tragen [23, 27]. Durch den Kontakt mit kontaminiertem Material haben sie ein deutliches persönliches Infektionsrisiko und das Potenzial der nosokomialen Übertragung ist hoch.
Nicht unterschätzt werden darf das Vorhandensein potenzieller, auch asymptomatischer, „Spreader“ in einzelnen Bereichen. Dies würde auch die Rate der teils unterschiedlichen Seroprävalenz in der Verwaltung beider Krankenhäuser erklären (WEN 3,8 % vs. TIR 28,1 %). Sowohl in Verwaltung TIR als auch beim Reinigungspersonal WEN gab es Mitarbeiter, die COVID-19-typische Symptome hatten, in der PCR (mehrfach) negativ waren, nun aber Antikörper gegen SARS-CoV‑2 aufwiesen. Folgen solcher Spreader sind bereits aus den SARS-/MERS-Epidemien bekannt [14] und auch in der aktuellen Pandemie dokumentiert [24].
Deutliche Auswirkungen auf die Gesundheit der HCW hat, abgesehen vom Infektionsrisiko am Arbeitsplatz, der teils immense physische und psychische Stress, dem diese bei der Behandlung von COVID-19 Patienten ausgesetzt sind [8, 13], auch weil eine durchlaufene Infektion keinen dauerhaften Schutz vor einer erneuten Ansteckung bedeutet [9, 18]. Dies und das erhöhte Risiko, eine am Arbeitsplatz Krankenhaus akquirierte SARS-CoV-2-Infektion mit potenziellen Folgen zu erleiden, führt folgerichtig zur möglichen Anerkennung als Berufserkrankung für Mitarbeiter im Gesundheitswesen [6, 15] und zur Erarbeitung von Leitlinien für eine Testung der HCW [11] mit zeitnaher Abklärung des Infektionsstatus [22].
Limitationen der Studie
Die Datenerhebung erfolgte über einen Zeitraum von 4 Wochen, sodass bei einer sich relativ rasch verbreitenden Infektion kein exaktes Datum für die Punktprävalenz angegeben werden kann, sondern der Zeitraum von Ende Juni bis Ende Juli 2020 betrachtet wird. Weiterhin wurde keine gleichzeitige PCR-Testung der Teilnehmer durchgeführt, sodass akute Infektionen noch ohne Antikörperreaktion nicht detektiert wurden. Die Studie sollte jedoch aufgrund des zeitlichen Abstands das Maximum der Pandemie in der Region im März/April 2020 gut abbilden. Eine weitere Limitation ist die freiwillige Studienteilnahme mit einer Rate von 77 % bei den HCW und nur etwas mehr als der Hälfte der NMU. Dies könnte zu einem gewissen Bias geführt haben. Jedoch unterzogen sich bei den unterschiedlichen Berufsgruppen der HCW und NMU adäquate Anteile einer Testung, sodass ein ausgewogenes Bild der Seroprävalenz vorliegen dürfte.
Weitere Subgruppenanalysen der Studie bezüglich Berufsgruppen sowie epidemiologische Begleitaspekte werden aktuell durchgeführt. Ein Follow-up mit erneuter freiwilliger Testung vor allem der seropositiven Teilnehmer ist nach 3 Monaten geplant.
Schlussfolgerung
In der von der COVID-19-Pandemie schwer betroffenen Region um Tirschenreuth ist die Seroprävalenz von SARS-CoV-2-Antikörpern bei Mitarbeitern der versorgenden Kliniken mit 15,1 % signifikant höher als in einer Kontrollgruppe eines nichtmedizinischen Unternehmens mit 3,7 %. Etwa 10 % der seropositiven Klinikmitarbeiter hatten keine Symptome einer Infektion bemerkt. Je näher dabei der Kontakt der Berufsgruppe zu COVID-19-Patienten war, desto höher war die Infektionsrate. Mit am höchsten war die Durchseuchung bei Personal auf Intensivstationen und beim Reinigungspersonal, dessen Infektionsrisiko vermutlich oft unterschätzt wird. Zur genaueren Einschätzung dieser Daten sind Langzeitstudien zur Entwicklung der Seroprävalenz und ihrer Relevanz notwendig.
Fazit für die Praxis
Die Seroprävalenz von Antikörpern gegen SARS-CoV‑2 ist bei Krankenhausmitarbeitern (HCW) einer „Hotspotregion“ höher als bei Berufstätigen im nichtmedizinischen Sektor.
Über 10 % der seropositiven HCW haben keine Symptome für eine Infektion bemerkt.
Das berufsbedingte Infektionsrisiko für HCW ist höher, je enger sie mit COVID-19-Patienten in Kontakt kommen.
Das Risiko des Reinigungspersonals im Krankenhaus für eine Infektion mit SARS-CoV‑2 wird vermutlich unterschätzt
Longitudinale Untersuchungen zum Verlauf der Seropositivität auf SARS-CoV‑2 sind notwendig.
Acknowledgments
Danksagung
Die Autoren möchten sich sehr herzlich bedanken bei allen, die bei der Organisation der Studie, der Blutabnahme und Datenerfassung sowie der statistischen Auswertung geholfen haben.
Förderung
Die Studie wurde durch Roche Diagnostics International durch die Bereitstellung der Anti-SARS-CoV-2-Testkits und durch eine Subvention von 10.000 € unterstützt.
Einhaltung ethischer Richtlinien
Interessenkonflikt
T. Finkenzeller, A. Faltlhauser, K.-H. Dietl, C. Paetzel, N. Szczypien, F. Klawonn, K.-F. Bodmann und A. von Meyer geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Agresti A, Coull BA. Approximate is better than “exact” for interval estimation of binomial proportions. Am Stat. 1998;52:119–126. [Google Scholar]
- 2.Ashcroft R, et al. The declaration of Helsinki. In: Emanuel E, Grady C, Crouch RA, et al., editors. The oxford textbook of clinical research ethics. Oxford New York: Oxford University Press; 2008. pp. 141–148. [Google Scholar]
- 3.Berg B (2020) SDAPS: scripts for data acquisition with paper-based surveys. https://sdaps.org/. Zugegriffen: 23.06.2020
- 4.Bielicki J, Duval X, Gobat N, et al. Monitoring approaches for health-care workers during the COVID-19 pandemic. Lancet Infect Dis. 2020 doi: 10.1016/S1472-3099(20)30458-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Cai H, Tu B, Ma J, et al. Psychological impact and coping strategies of frontline medical staff in Huan between january and march 2020 during the outbreak of COVID-19 in Hubei, China. Med Sci Monit. 2020;26:e924171. doi: 10.12659/MSM.924171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.COVID-19 knapp 6.000 Mal als Berufskrankheit anerkannt. Deutsches Ärzteblatt: Politik 09.Juli.2020
- 7.Garcia-Basteiro AL, Moncunill G, Tortajada M, et al. Seroprevalence of antibodies against SARS-CoV-2 among healthcare workers in a large Spanish reference hospital. Nat Commun. 2020;11:3500. doi: 10.1038/s4147-020-17318-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Gilan D, Röthke N, Blessin M, et al. Psychische Belastungen, Resilienz, Risiko- und protektive Faktoren während der SARS-CoV-2-Pandemie. Systematische Literaturanalyse und Studienergebnisseaus dem deutschen COSMO-Panel. Dtsch Arztebl Int. 2020;117:625–632. doi: 10.3238/arztebl.2020.0625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.https://www.aerzteblatt.de/nachrichten/116059/Nach-4-Berichten-zu-Re-Infektionen-Wie-lange-haelt-eine-Immunitaet-gegen-SARS-CoV-2-an. Zugegriffen: 12.09.2020
- 10.https://www.roche.de/diagnostics/tests-parameter/elecsys-anti-sars-cov-2.html#Allgemeine-Informationen-zu-SARS-CoV-2. Zugegriffen: 18.08.2020
- 11.Janssens U, Schlitt A, Hein A et al (2020) SARS-CoV‑2 Infektion bei Mitarbeiterinnen und Mitarbeitern im Gesundheitswesen – Bedeutung der RT-PCR Testung. S1-Leitlinien AWMF online Registernummer 040-015 Versions-Nummer 1.2 9/2020
- 12.Jordan RE, Adab P, Cheng KK. COVID-19: risk factors for severe disease and death. BMJ. 2020;368:m1198. doi: 10.1136/bmj.m1198. [DOI] [PubMed] [Google Scholar]
- 13.Lai J, Ma S, Wang Y, et al. Factors associated with mental health outcomes among health care workers exposed to coronavirus disease 2019. JAMA Netw Open. 2020;3:e203976. doi: 10.1001/jamanetworkopen.2020.3976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lu W, Liu XF, Jia ZF. 2019-nCoV transmission through the ocular surface must not be ignored. Lancet. 2020;395:e39. doi: 10.1016/S0140-6736(20)30313-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Möhner M, Wolik A. Berufs- und branchenbezogene Unterschiede im COVID-19-Risiko in Deutschland. Dtsch Arztebl Int. 2020;117:641–642. doi: 10.3238/arztebl.2020.0641. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Moscaola J, Sembajwe G, Jarrett M, et al. Prevalence of SARS-coV-2 antibodies in health care personnel in the new York City area. JAMA. 2020;324(9):893–895. doi: 10.1001/jama.2020.14765. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Onder G, Rezza G, Brusaferro S. Case fatality rate an characteristics of patients dying in relation to COVID-19 in Italy. JAMA. 2020;323(18):1775–1776. doi: 10.1001/jama.2020.4683. [DOI] [PubMed] [Google Scholar]
- 18.Parry J. Covid-19: Hong Kong scientists report first confirmed case of reinfection. BMJ. 2020 doi: 10.1136/bmj.m3340. [DOI] [PubMed] [Google Scholar]
- 19.RKI Dashboard vom 23. Juli 2020
- 20.RKI Erfassung der SARS-CoV-2-Testzahlen in Deutschland. Epidemiol. Bull. 2020;29:15. [Google Scholar]
- 21.Statistisches Bundesamt DESTATIS 2020. Zugegriffen: 17.07.2020
- 22.Schwierzeck V, Correa-Martinez CL, Schneider KN, et al. SARS-CoV-2 in the employees of a large university hospital. Dtsch Arztebl Int. 2020;117:34–35. doi: 10.3238/arztebl.2020.0344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Shields A, Faustini SE, Perez-Toledo M, et al. SARS-CoV-2 seroprevalence and asymptomatic viral carriage in healthcare workers: a cross sectional study. Thorax. 2020 doi: 10.1136/thoraxjnl-2020-215414. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Streeck H, Schulte B, Kümmerer B, et al. Infection fatality rate of SARS-CoV-2 infection in a German community with a super spreading event. 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.von Meyer A, Cadamuro J, Streichert T, et al. Standard-Arbeitsanleitung zur peripher venösen Blutentnahme für die labormedizinische Diagnostik. J Lab Med. 2017;41(6):333–340. [Google Scholar]
- 26.Xiao J, Fang M, Chen Q, He B. SARS, MERS and COVID-19 among healthcare workers: a narrative review. J Infect Pub Health. 2020;13:843–848. doi: 10.1016/j.jiph.2020.05.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Zhang S, Diao MY, Duan L, et al. The novel coronavirus (SARS-CoV-2) infections in China: prevention, control and challenges. Intensive Care Med. 2020;46:591–593. doi: 10.1007/s00134-020-05977-9. [DOI] [PMC free article] [PubMed] [Google Scholar]